На правах рукописи
ЦАРЕГОРОДЦЕВА МАРИНА ВЛАДИМИРОВНА
ЭТИОПАТОГЕНЕТИЧЕСКИЕ, КЛИНИЧЕСКИЕ И РЕАБИЛИТАЦИОННЫЕ АСПЕКТЫ АУТОИММУННОГО ООФОРИТА ВОСПАЛИТЕЛЬНОГО ГЕНЕЗА
14.0I.01 – акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2010
Работа выполнена в ФГУ «Научный Центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова Росмедтехнологий»
Научный консультант
Академик РАМН, профессор Серов Владимир Николаевич
Официальные оппоненты
доктор медицинских наук, Макацария Александр Давидович
профессор
доктор медицинских наук, Тихомиров Александр Леонидович
профессор
доктор медицинских наук Тотчиев Георгий Феликсович
профессор
Ведущая организация:
Московский областной научно-исследовательский институт акушерства и гинекологии (МОНИИАГ) МЗ РФ
Защита диссертации состоится «____»________2010 года в ____ часов на заседании диссертационного совета Д 208.041.06 при ГОУ ВПО «Московский государственном медико-стоматологический университет Росздрава» (127473, Москва, ул. Делегатская, 20/1).
С диссертацией можно ознакомиться в библиотеке Московского государственного медико-стоматологического университета (127206, Москва, ул. Вучетича, д.10а).
Автореферат разослан «___»________2010 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Умаханова М.М.
Общая характеристика работы
Актуальность проблемы. Аутоиммунный оофорит (АО), как сложная многофакторная нозологическая форма овариальной недостаточности, по современным представлениям, около 20% клинических наблюдений обусловлен высоким инфекционным индексом. АО как одна из причин возникновения первичной яичниковой недостаточности, составляет при гипергонадотропной гипофункции 43-69%, при нормогонадотропной 19,2-31,5% (Э.К.Айламазян, В.В. Потин, 2002). По данным Sontag W.S., Sikorski K., Kapes E. (2003) в 22,3% у женщин с хроническими сальпингоофоритами формируется овариальная недостаточность с наличием циркулирующих и фиксированных антиовариальных антител. Появление циркулирующих антиовариальных антител как маркеров аутоиммунной гипофункции яичников обосновывается гипотезой, согласно которой основными патогенетическими механизмами, направленными на растущий фолликул являются снижение толерантности к аутоантигенам в результате молекулярной мимикрии, перекрестной реакции собственных и чужеродных белков при тканевой деструкции и увеличение активности цитотоксических клонов. В настоящее время нет единой теории патогенеза АО. Длительное время формирование АО связывали с развитием полигландулярного аутоиммунного синдрома. Отмечено частое сочетание (до 50%) аутоиммунного процесса в яичниках с аутоиммунным тиреоидитом, недостаточностью коры надпочечников и др. (Lou Y.H., Garza K.M., Tung K.S., 2003.,Tomer Y., Davies T.F., 2004). Эта особенность, по мнению указанных авторов, указывает на общность механизмов аутоиммунных процессов. Считается предпосылкой для развития данного иммунопатологического процесса относительность иммунологической толерантности, а не нарушение или утрату ее механизмов (Ailamazyan E.K., Potin V.V., 2002, Isubata Т., Murakami M., 2003). Известно, что баланс активности Т-клеток определяет состояние толерантности к аутоантигенам. Концепция развития аутоиммунной патологии вследствии увеличения активности цитотоксических аутореактивных клонов и снижения осуществляющих протективную функцию Т-супрессоров (Bottazzo G.F., Pujol-Borrell R. Hanafusa Т., 1999, Cao Z., 2002, Giglio Т., Filaci G., Scudeletti M., 2004). Причину развития аутоиммунного процесса авторы видят в снижении толерантности к своим тканевым антигенам за счет истощения регуляторных Т-клеток и в активации аутореактивных Т-клеток в результате молекулярной мимикрии (Tomer Y., Davies T.F., 2001). Она обусловлена общностью некоторых аминокислотных остатков в структуре овариальных или эндогенных неоовариальных, или чужеродных белков, возможно, микробных или вирусных. Перекрестная реакция собственных и чужеродных белков, приводящая к активации патогенных Т-клеток по отношению к антигенам яичника; индукция персистирующего Т-клеточного ответа против собственных антигенов, в результате которого происходит деструкция тканей и многократная стимуляция В-клеточного ответа (Manganaro T.F., Donahoe P.K., 1999, Zoller M., 2001).
Иммунологическими исследованиями последних лет представлена информация о роли цитокинов в развитии АО. Введение провоспалительных цитокинов (IL-1,2 и IFN-) ускоряет развитие аутоиммунных заболеваний у экспериментальных животных (Harlow C.R., Maile L.A., Hull M.G.,1995,Hughes C., Wolos J.A.,2000, Mori T.,2002), тогда как специфическая блокада лимфокинов обладает протективным действием. Протективным ингибирующим эффектом обладают, например, трансформирующий фактор роста- и IL-4 (Best C.L, Hill J.A., 1999, Coulam C.B.,Tung K.S.,1999, Hughes C, Wolos J.A., Hirsch R.,2003).
Несмотря на многочисленные публикации по данной проблеме в клинической практике нет единой концепции о патогенезе АО при хронических воспалительных заболеваниях органов малого таза (ХВЗОТ), как возможной причины его формирования. В связи с этим вопросы своевременной клинической диагностики, этиопатогенетической терапии и реабилитации у женщин репродуктивного возраста нуждаются в дальнейших исследованиях.
Целью исследования является оптимизация методов диагностики, терапии овариальной недостаточности при хронических воспалительных заболеваниях органов малого таза на основании изучения этиопатогенетических механизмов формирования аутоиммунного оофорита.
Задачи исследования
1.Изучить особенности клинического течения ХВЗОТ и гормонального статуса у женщин с циркулирующими антиовариальными антителами.
2.Определить значимые ассоциации микроорганизмов при ХВЗОТ для развития аутоиммунного оофорита воспалительного генеза.
3.Исследовать клеточный и гуморальный иммунитет у женщин с ХВЗОТ и определить роль иммунных механизмов в формировании аутоиммунной овариальной недостаточности.
4.Предложить этиопатогенетическую схему формирования аутоиммунного оофорита воспалительного генеза.
5.Определить, используя, информативные клинико-иммунологические диагностические критерии, схему комплексной дифференцированной терапии пациенток с аутоиммунным оофоритом.
6.Разработать схему прогнозирования и реабилитации женщин с сочетанием ХВЗОТ и аутоиммунной овариальной недостаточностью.
Научная новизна
Впервые в клинике, используя современные методы идентификации инфектов при ХВЗОТ, иммунологические и аутоиммунные маркеры воспалительного поражения яичников, изучена их патогенетическая роль, проведена клиническая оценка значимости показателей для прогнозирования, диагностики, комплексной терапии и реабилитации аутоиммунной овариальной недостаточности воспалительного генеза.
На основании комплексного обследования пациенток с хроническими воспалительными заболеваниями органов малого таза определены этиологически значимые ассоциации инфектов, вызывающие при ХВЗОТ формирование АО.
Предложена этипатогенетическая схема формирования и классификация аутоиммунного оофорита воспалительного генеза.
Выявлены прогностически значимые клинические, иммунологические параметры для выявления групп риска в обследуемой нозологической форме, применимые для прогнозирования и ранней диагностики АО (патент на изобретение № 2312359). Наиболее значимыми факторами системного воспалительного ответа в формировании аутоиммунного оофорита при ХВЗОТ являются повышенные сывороточные концентрации провоспалительных цитокинов IL-1 и TNF-.
Оптимизированы схемы коррекции иммунного, гормонального статуса женщин с ХВЗОТ в комплексной терапии микробного фактора и реабилитации пациенток за счет снижения числа осложнений, связанных с развитием аутоиммунной гипофункции яичников воспалительного генеза (патент на изобретение № 2301655).
Мониторинг уровня IL-1,TNF-, предовуляторного уровня эстрадиола и соотвествующего коэффициента воспалительного повреждения овариальной ткани позволил оценить адекватность противовоспалительной терапии, определить показания к расширению спектра лечебно-диагностичеких мероприятий (определение циркулирующих антиовариальных антител, показателей овариального резерва, применение плазмофереза, микродоз стероидных противовоспалительных препаратов, цитокинмодулирующей терапии).
Впервые использован у пациенток с АО и гиперпродукцией IL-1, TNF- иммуномодулирующий препарат галавит (регистрационный номер Р №000088/02). На основании анализа эффективности данной терапии установлено: на фоне стабильного снижения уровня циркулирующих антиовариальных антител снижение IL-1, TNF-, IL-6, IFN-, CD8 на фоне тенденции к повышению количества CD3, CD4 - клеток, что является определяющим преимуществом коррегирующего избирательного влияния данной терапии. У обследуемых пациенток четко определялись тенденции нормализации гормонопродуцирующей функции яичников: повышение уровня эстрадиола, прогестерона, ингибина В. Проведенное исследование внесло вклад в изучение этиопатогенетических механизмов формирования аутоиммунного оофорита при ХВЗОТ.
Практическая значимость
Детальный анализ анамнестических и клинико-лабораторных данных позволил выявить не только важные для развития данной патологии факторы (длительность заболевания, вид патогена, патологическая секреция цитокинов), но и определить стадии развития поражения ткани яичника. На основании изучения этиопатогенеза АО при ХВЗОТ, при анализе динамики клинических симптомов заболевания выявлено прогрессирование патологического процесса от нормогонадотропной ановуляции к гипергонадотропной ановуляции, что демонстрирует постепенное нарастание потери овариального резерва и ухудшение прогноза на восстановление фертильности по мере прогрессирования заболевания.
Важным результатом работы является выделение из всей группы возможных патогенов тех микроорганизмов, которые обладают максимальным повреждающим воздействием на яичник, индуцируя аутоиммунные реакции, преимущественно внутриклеточные патогены, обладающие максимальной способностью интеграции с геномом и стимуляции процесса апоптоза клеток.
Предложена собственная классификация аутоиммунного оофорита, охватывающая все возможные варианты заболевания, изученные в настоящий момент. В диссертации представлена схема патогенеза аутоиммунного оофорита, в основе которой лежат процессы цитотоксического повреждения ооцитов, апоптоз и склероз ткани яичника, индуцированные воспалением. Представленная систематизация данных по анализируемой патологии имеет важное научное значение, и послужило основой для решения важных терапевтических вопросов.
Разработаны диагностические критерии заболевания, необходимые для дифференцированной терапии в зависимости от стадии развития аутоиммунных процессов и степени поражения овариальной ткани. В комплексной терапии применены современные методы иммунокоррекции, в частности плазмоферез и цитокинкоррегирующая терапия галавитом.
Разработана программа прогнозирования развития аутоиммунных поражений яичников при ХВЗОТ, что отражает современный диагностический подход, базирующийся на раннем выявлении функциональных дефектов и предупреждении развития повреждения ткани.
Предложена дифференцированная терапия и реабилитации овариальной недостаточности при АО воспалительного генеза в зависимости от степени воспалительного повреждения яичников, которая позволила снизить число пациенток с овариальной гипофункцией аутоиммунного генеза при ХВЗОТ.
Основные положения, выносимые на защиту:
1.Хронические воспалительные заболевания органов малого таза у женщин репродуктивного возраста вызывают образование антиовариальных антител в период обострения у 42,7% обследуемых, на стадии клинико-лабораторного излечения у 22,8% пациенток с формированием овариальной недостаточности. Этиопатогенетическими факторами аутоиммунного оофорита воспалительного генеза являются длительность заболевания более 5 лет, микстформы с преобладаем хламидийно-гонорейного инфицирования в сочетании с Corynebacterium, Neisseria, Enterоbacteriacea.
2. В основе патогенеза аутоиммунного оофорита лежит активация Th-1 звена иммунитета, дисбаланс иммунорегуляторного индекса CD4/CD8 с превалированием цитотоксических эффектов, что вызывает каскад патологических реакций формирования аутоиммунной овариальной недостаточности. Мониторинг уровня аутоантител, провоспалительных цитокинов позволяет оценить риск развития, адекватность терапии, аутоиммунного оофорита, показания к расширению спектра лечебно-диагностических мероприятий
3. Применение в комплексном противовоспалительном лечении ХВЗОТ у серопозитивных к овариальным антигенам пациенток иммуномодулятора галавит позволило на фоне стабильной нормализации уровня циркулирующих антиовариальных антител снизить уровень IL-1, TNF-, IL-6, IFN-, CD8-клеток, при некотором повышении CD3, CD4-лейкоцитов. У данных женщин определялись тенденции к нормализации гормонопродуцирующей функции яичников: повышение уровня эстрадиола, прогестерона, ингибина В, снижение ФСГ, ЛГ.
Апробация диссертации
Основные положения по материалам диссертации доложены и обсуждены на IV и VIII Российском форуме «Мать и дитя» (Москва, 2002, 2006 гг.), на XIX Международном Конгрессе «Современные технологии в диагностике и лечении гинекологических заболеваний» (Москва, 5-8 июня 2006г), III Международном Конгрессе «Репродуктивная медицина» (Москва,19-22 января 2009).
Диссертационная работа апробирована межклинической конференцией и апробационной комиссией ФГУ «Научный Центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова Росмедтехнологий».
Личный вклад
В исследование включено 537 пациенток с хроническими воспалительными заболеваниями органов малого таза. Во всех случаях было проведено комплексное обследование и дифференцированная противовоспалительная терапия, в большей части автором лично. Выбор методов и дизайна исследования, планирование и проведение различных обследований, статистическая обработка клинико-лабораторных данных, обсуждение результатов, оформление диссертации и автореферата выполнены автором самостоятельно.
Критерием включения в исследование пациенток явился верифицированный диагноз ХВЗОТ на основании диагностических критериев, предложенных CDC (2006) и международной классификации PID (США). Разделение на клинические группы проводилась по признаку наличия (отсутствия) циркулирующих антиовариальных (OV) антител в сыворотке крови обследуемых. Критерием исключения являлись резекция яичников и ятрогенная овариальная гипофункция.
Внедрение в практику
Результаты исследования внедрены в работу гинекологического отделения восстановительного лечения Научного Центра акушерства, гинекологии и перинатологии имени академика В.И.Кулакова Росмедтехнологий, а так же используются для обучения врачей–интернов, ординаторов, аспирантов и слушателей кафедры акушерства, гинекологии, перинатологии и репродуктологии ФППО В ММА им. И.М. Сеченова
Публикации
По теме диссертации опубликованы 30 научных работ, в том числе 10 в изданиях, рекомендованных ВАК Минобрнауки, отражающие её основное содержание. Результаты исследований изложены в главах монографии «Гинекология» (М.,2009): «Аутоиммунный оофорит: патогенез, диагностика, терапия», «Немедикаментозная терапия нарушений функции яичников у женщин и использование овариального резерва в оценке ее эффективности ».
Объем и структура диссертации.
Диссертация включает введение; обзор литературы, описание материалов и методов исследования, результатов, полученных в ходе выполнения работы и их обсуждения; а так же из заключение; выводы; практические рекомендации и список литературы. Работа изложена на 200 листах машинописного текста, она содержит 33 таблиц и 19 рисунков. Библиографический указатель включает 358 источников, из них 142- отечественных и 216 иностранных авторов.
Cодержание работы. Общая характеристика пациенток,
объем и методы и методы исследования
В рамках проводимого исследования было обследовано 537 женщин репродуктивного возраста, с клинико-анамнестическими данными о хронических воспалительных заболеваний органов малого таза (ХВЗОТ) и длительностью заболевания более 1 года. Диссертационная работа выполнена в ФГУ «Научный Центр акушерства, гинекологии и перинатологии имени академика В.И.Кулакова Росмедтехнологий» в гинекологическом отделении восстановительного лечения в период с 2006-2010гг.
У обследуемых определялась нозологическая форма ХВЗОТ по международной классификации PID (США). При определении длительности заболевания были использованы диагностические критерии: минимальные (бимануальное обследование), дополнительные (лабораторная идентификация инфекта, признаки воспаления), достоверные (трансвагинальная сонография, лапароскопия), предложенные CDC (2006).
Для данного исследования 537 обследуемых пациенток с ХВЗОТ были разделены на клинические группы по признаку наличия (отсутствия) циркулирующих антиовариальных (OV) антител в сыворотке крови.
1-ая группа: 259 пациенток с циркулирующими антиовариальными антителами. 2-ая группа: 278 обследуемых (без циркулирующих антиовариальных антител).
Предварительное обследование пациенток проводилось с использованием программы, включающей формализованные анамнестические данные, соматический, гинекологический и репродуктивный анамнез. Особое внимание уделяли периодам становления и изменения менструальной функции, инфекционному фону, перенесенным ИППП в анамнезе, репродуктивным потерям.
Гинекологический анамнез дополнялся данными о наличии и объеме оперативных вмешательств, проводившихся дополнительных обследованиях (метросальпингография, гистероскопия, лапароскопия, тесты функциональной диагностики овариальной недостаточности, данные гормональных обследований и проводимых в анамнезе курсов антибактериальной, гормональной, иммуно-коррегирующей терапии и др.).
Возраст женщин, включенных в исследование, в обеих группах колебался от 18 до 37 лет. Средний возраст женщин 1-ой группы составил 29,73 ± 0,31, 2-ой группы – 26,95 ± 0,41, (р<0,05).
Анализ структуры сочетанной гинекологической патологии показал, что в группе OV-серопозитивных пациенток достоверно выше заболеваемость генитальным эндометриозом 41(15,8%) относительно OV- серонегативной группы 13 (4,7%), (р<0,005), миомой матки – 1-ая группа – 29 (11,2%), 2-ая группа – 7 (2,5%), (р<0,005), синдромом Ашермана у 11 OV-серопозитивных пациенток (4,3%), у 2 (0,7%) OV-серонегативных обследуемых, (p<0,005). Патология шейки матки диагностирована в 1-ой группе у 31 (11,9%) пациентки, во 2-ой группе – у 59 (21,2%)), полипоз эндометрия (в 1-ой группе – 18 (6,9%), 2-ой группе – 33 (11,8%)), (p<0,05). Функциональные кисты яичника установлены у 11 (4,25%) женщин 1-ой группы и у 38 (13,67%) пациенток 2-ой клинической группы, (p<0,005). Вероятно, превалирование гиперпластических процессов эндометрия и функциональных кист яичников связаны с недостаточностью лютеиновой фазы у OV-серонегативных пациенток с ХВЗОТ, а достоверно повышенная частота внутриматочных синехий у OV-серопозитивных женщин подтверждает активацию склерофиброзирующих процессов.
Структура соматических патологии обследуемых пациентов отражает, превалирование у данной категории пациентов заболеваний мочевыделительной системы в OV-серопозитивной группе. В 1-ой группе у 107 (41,3%) женщин диагностирован хронический пиелонефрит, хронический цистит у 86 (33,0%) обследуемых, мочекаменная болезнь у 21 (8,1%) пациенток, во 2-ой группе хронический пиелонефрит установлен у 43 (15,5%) обследуемых, хронический цистит у 35(12,6%) женщин, мочекаменная болезнь у 5 (1,8%) пациенток (р<0,05). У пациенток OV-серопозитивной группы чаще наблюдались заболевания с аутоиммунными механизмами формирования; язвенная болезнь – 12 (4,6%), хронический бронхит – 28(10,9%), хронический колит – 19 (7,3%), бронхиальная астма – 2 (0,8%), (р<0,05 относительно OV-негативных обследуемых). По остальным нозологическим формам статистически достоверных различий выявлено не было, группы были сходны между собой и однородны.
Методы клинического обследования пациенток. Обследование всех женщин, помимо общего клинического, включало следующие методики: определение ассоциантов микробиоциноза половых путей, исследование иммунологических маркеров воспаления и активности аутоиммунных процессов и гормонопродуцирующей овариальной функции, обследование на наличие циркулирующих антиовариальных антител.
Ультразвуковое исследование пациенток. Ультразвуковое исследование пациенток проводили с помощью УЗ-сканера Concept/MC (England) с использованием трансвагинального датчика с частотой 7 МГц. Для изучения исходных размеров матки и яичников первое исследование проводилось в 1-2-3 дни менструального цикла. В процессе проводимого исследования уточнялись исходные размеры и положения матки, состояние миометрия, толщина эндометрия (21 день менструального цикла), размеры и локализация яичников по отношению к матке, наличие или отсутствие ретенционных образований, оценивался овариальный резерв. УЗИ-мониторинг состояния фолликулярного аппарата и толщины эндометрия осуществлялся на 5-6; 9-10 дни менструального цикла и затем ежедневно до момента предполагаемой овуляции (при сохраненном менструальном цикле).
Методы идентификации инфектов. Обследование инфекционного статуса пациенток включало бактериоскопическое исследование цервикальной слизи, влагалищного содержимого, уретрального отделяемого, бактериологическое исследование ассоциантов шейки матки, влагалища. ДНК-диагностика ИППП проводилась исследованием цервикальной слизи и влагалищной жидкости. Микробиологическое исследование отделяемого цервикального канала включало культуральное исследование видового и количественного состава всех ассоциантов микробиоциноза цервикального канала женщин. Посев проводили на набор стандартных питательных сред для выделения облигатных и факультативных анаэробов, микроаэрофилов, включая генитальные микоплазмы, G.vaginalis, грибы и трихоманады. Забор и транспортировку исследуемого материала проводили с использованием набора для транспортировки аэробных и анаэробных бактерий Portagem Amies Agar+Swab фирмы bioMerieux, содержащим стерильный апликатор с ватным тампоном и пробирку с транспортной средой Portagem Amies Agar. Для создания анаэробных и микроаэрофильных условий использовали анаэростаты GENbox фирмы bioMerieux и GasPak Anaerobic System фирмы Becton Dickinson и газо-генерирующие пакеты с палладиевыми катализаторами, создающими соответсвующие микро- или анаэроусловия культивирования. Контроль за созданием оптимальных условий культивирования проводился с помощью индикаторов анаэробиоза и СО2 индикаторов этих фирм. Посев в анаэробные и микроаэрофильные условия производился на предварительно прередуцированный (не менее суток выдержанный в анаэростате) агар Шэдлера. После культивирования посевов в термостате производили макро- и микроскопическое изучение выросших колоний, а также определяли количество микроорганизмов, выделенных с тампона. Из колоний, выросших в анаэробных условиях, производили рассевы на две чашки: с агаром Шэдлера и 5% кровяным агаром. Одну чашку помещали в микроаэрофильные условия для контроля аэротолерантности. Другую – в анаэробные условия для выделения чистых культур. Культуры, не выросшие в микроаэрофильных условиях относили к облигатным анаэробам. Все остальные – к факультативным анаэробам или микроаэрофилам. Микробную колонизацию оценивали по частоте выделения симбионтов и по интенсивности – десятичному логарифму от среднего числа микроорганизмов (lg КОЕ), выделенных из исследуемого материала. Видовую идентификацию выделенных возбудителей проводили с помощью компьютерной программы и идентификационных наборов фирмы Becton Dickinson BBL Crystal Systems (идентификация энтеро- и неферментирующих микроорганизмов, Грамположительных, анаэробов, Нейсерий и Гемафилюс, всего 400 видов). Определение чувствительности выделенных микроорганизмов выполняли дискодиффузионным методом на среде Mueller-Hinton II с использованием международных стандартов NCCLS в терминах: чувствительный, промежуточно-устойчивый или устойчивый. Селективные исследования на урогенитальные микоплазмы с определением титра и чувствительности к антибиотикам, трихоманады, листерии и гарднереллу проводились с использованием специальных сред фирм bioMerieux (Франция), Orion Diagnostica (Финляндия), Sanofi diagnostics Pasteur (Франция).
ПЦР-диагностика влагалищной жидкости проводилась методом амплификации нуклеиновых кислот использован для выявления:Trichomonas vaginalis, Chlamidia trachomatis, Ureaplasma urealiticum, Mycoplasma hominis, Mycoplasma genitalium, Neisseria gonorrhoaea, Gerpes simplex virus type I, Gerpes simplex virus type II, Gardnerella vaginalis. Детекция ампликонов методом электропореза в полиакриламидном геле и методом ИФА. ДНК-диагностика документирована: ДНК-гели с помощью видеогельсканирующей системы фирмы «Ультра-Люм».
Применялся иммуноферментный метод определения иммуноглобулинов IgA, IgM и IgG к Chlamydia trachomatis, IgG к Trichomonas vaginalis в сыворотке крови обследуемых пациенток, «Вектор-Бест». Учет результатов проводили на спектрофотометре «Виктор» фирмы DELFIA, длина волны 492 нм, путем сравнения оптических плотностей «MEDAC Diagnoctica».
Методы определения иммунологических маркеров воспаления и активности аутоиммунных процессов. Количественное определение Т-лимфоцитов (CD3), субпопуляций (CD4,CD8,CD16) и В-лимфоцитов (CD19). Забор крови у пациенток осуществлялся из локтевой вены с 8 до 10 часов утра натощак. В качестве антикоагулянта использовали раствор гепарина (5 МЕ/мл). Лимфоциты периферической крови выделяли по методы Recalde H.R. (1984) на градиенте плотности фиколл-верографина. Определение фенотипа лимфоцита проводили по методу Филатова А.В. с соавторами (1990) с помощью реакции непрямой иммунофлюоресценции с использованием мышиных моноклональных антител (МКАТ) LT3, LT4, LT8, LT16, LT19 и козьих антител к иммуноглобулинам мыши, меченных ФИТЦ (АО «Сорбент», Москва). Результаты учитывали на проточном цитофлюориметре EPICS-XT, фирмы COULTER, США, методом мультипара-метрической двуцветной цитофлюориметрии.
Количественное определение иммуноглобулина IgA, IgМ, IgG, IgE проводили иммуноферментным методом определения иммуноглобулинов в сыворотке крови, разработанный ЗАО «Вектор-Бест».
При количественном определение интерлейкинов IL1, IL4, IL6, IL8 IL10, IL12,-() интерферона (IFN) использовался твёрдофазный иммуноферментный метод, (ООО «Протеиновый контур»).
Количественное определение TNF– метод для определения в сыворотке крови в интервале концентраций 20-2000 пкг/мл (ProCon TNF- (ИФА).
Количественное определение Ig G к ДНК (тест-система «Вектор ДНК-IgG-стрип» представляет собой набор реагентов для выявления IgG к двухцепочечной неденатурированной ДНК в сыворотке крови (ИФА).
Количественное определение антиспермальных антител (Spermatozoa Antibody ELISA).
количественное определение циркулирующих антител к ткани яичника (OV) («Biosor» Германия) (нормальные значения 0-10 Ед/мл, повышенные 11 и более Ед/мл). Иммуноферментный метод определения циркулирующих IgA, IgG, Ig) к zona pellucida (ВСМ Diagnostics).
Значение уровня антител к ZP определяется следующи образом: IgG: Значения ОП сывороток пациентов сравниваются с значениями контролей. Образец считается положительным, если его значение ОП равно или больше ОП слабоположительного контроля (коррелирует с концентрацией IgA/IgG в образце). IgM: Вычитание значение ОП контролей в непокрытых антигеном ячейках из соответствующих значений ОП контролей в покрытых антигеном ячейках. Сравнение полученных значений со значениями ОП сывороток пациентов. Образец считается положительным, если его значение ОП равно или больше ОП слабоположительного контроля (коррелирует с концентрацией IgM ).
Гормональные исследования: количественное определение фолликулостимули-рующего (ФСГ), лютеинизирующего (ЛГ), тиреотропного (ТТГ) гормонов, эстрадиола (Э2) – методом ИФА (Adaltis Italia Sp.A), пролактина, прогестерона, тестостерона (кортизола). ЗАО «Алкор Био-ИФА», тироксина Т4, трийодтиронина Т3 «Тироид ИФА-тироксин, трийодтиронин» г. Санкт-Петербург.
Количественное определение ингибина В (Oxford Bio–Innovation), секссвязывающего глобулина SHBG (Sex-Hormon-Bind Globulin, ИФА).
Методы восстановительной терапии
аутоиммунного оофорита воспалительного генеза.
Фармакотерапия. Лечение ХВЗОТ начиналось с антибактериальной терапии с учетом структуры микробного пейзажа репродуктивного тракта пациентки, идентифицированных ИППП, результатов бактериологических и дефицитных исследований условной микрофлоры и ее чувствительности к препаратам. В схемы лечения были включены: антибактериальные препараты (фторхинолоны, азалиды, нитроимидазолы, солкотриховак, цефалоспорины IV поколения. Контроль излеченности инфекта проводился через 5-6 недель после этиотропной терапии. После установления эрадикации возбудителя проводилось обследование иммунологического статуса повторно (в рамках указанных методик) и определение маркеров активности аутоиммунных реакций. Параллельно исследовали гормональный фон на 2-3,13-14 и 21 день менструального цикла.При повышенной активности провоспалительных цитокинов, неспецифических аутоиммунных маркеров (антитела к ДНК, антифосфолипидные антитела и др.) и определении циркулирующих антиовариальных антител, пациенты получали курсы нестероидных (найз, месулид и др.) и стероидных препаратов (метипред 4 мг/сутки), при клинической необходимости проводились сеансы плазмофереза (№5 с интервалом 3-4 дня) с внутривенным введением иммуновенина 25 мл после проведения процедуры. По показателям проводилась коррекция интерференового статуса применением виферона - III ректально № 10.
После завершения курса реабилитационной противовоспалительной терапии информативные маркеры в комплексной в конкретной клинической ситуации оценивали повторно.
Содержание IL-1 более 500 пкг/мл при OV – антителах более 10 ЕД/мл в сыворотке крови у обследуемых пациенток в период ремиссии ХВЗОТ и после эрадикации инфекта являлось показанием к проведению цитокинмодулирующей терапии аутоиммунного оофорита воспалительного генеза. Иммуномодулятор галавит (аминодигидрофталазиндион, регистрационный номер Р №000088/02) вводился внутримышечно по 100 мг в течение 5 дней ежедневно, затем 100 мг каждые 72 часа (всего 20 инъекций). Контрольные обследования проводились по окончании терапии и через 1, 2, 3, 6 месяцев.
Физиотерапия. В рамках физиотерапевтического лечения был использован комплекс "Андро-Гин". В частности, проводились внутривлагалищные воздействия электрическими импульсами в диапазоне 10-120Гц.
Электроимпульсная стимуляция (комплекс «Андро-Гин»).Позиция больной - лежа на спине, ноги согнуты в коленях и разведены. Полостной электрод плавно вводят во влагалище до соприкосновения с шейкой матки. Пластинчатый (пассивный) электрод располагают горизонтально в надлобковой области. Последовательность выбора параметров и их величины воздействия –электростимуляция; стимуляция- внутриполостная; полярность-прямая (положительная) и обратная (отрицательная) по 10 мин; амплитуда 5% с последующим увеличением (Показатели индивидуально желаемой амплитуды определяют по безболезненным ощущениям вибрации, распространяющейся вглубь, и/или сокращениям мышц передней брюшной стенки. При исчезновении или значительном ослаблении этих ощущений их усиления добиваются плавным повышением амплитуды); режим 3; частота 10 Гц; девиация 20%: возбуждение 6 с; пауза 2 с. Общая продолжительность воздействия 20 мин. Ежедневно. Курс лечения 10 процедур.
Лазерное надвенное облучение крови. Комплекс «Андро-Гин». Локализация воздействия: наружный лазерный излучатель расположить контактно (расстояние до источника лазерного излучения – 1 см, d=890нм в конструкции излучателя) на зону проекции крупной вены (локтевой, бедренной или подколенной). Продолжительность воздействия 5 мин. Ежедневно. Курс 7 процедур. Для лазерного облучения крови примененяли низкоинтенсивные лазеры, работающие в красном (= 632нм или инфракрасном диапазонах, = 890нм).
Методы статистической обработки полученных результатов.
Анализ результатов выполняли с помощью статистической компьютерной программы SPSS for Windows (Версия 11.5.1). Достоверность различий полученных результатов определялась с использованием парного либо непарного t-теста Стьюдента и критерия Вилкоксона. Результаты исследования представлены как средние ± стандартная ошибка\стандартное отклонение (M±SE/SD). Различия между группами считались достоверными при значении p<0,05. Наличие и характер связи между признаками устанавливали с помощью корреляционного анализа. Использовали стандартный пакет программ «Statistika 6,0» и MS Office Excel.
Результаты исследования и их обсуждение
Для решения поставленных задач 537 пациенток репродуктивного возраста с хроническими воспалительными заболеваниями органов малого таза длительностью более 1-го года были разделены по признаку наличия циркулирующих антиовариальных антител. 1-ая группа (n = 259) – содержание OV-антител 26,3±4,7 Ед/мл, антител к блестящей оболочке ооцита (ZP) у 37 (15,1%) обследуемых пациенток, 2-ая группа (n = 278) – содержание OV-антител 5,6±2,9 ед/мл, антител к ZP не выявлено.
Оценивая динамику серопозитивности в зависимости от стадии воспалительного процесса по результатам нашего исследования на стадии обострения 44,8% установлено повышенное содержание циркулирующих антиовариальных антител, на стадии ремиссии у 22,8% пациенток.
Исходя из приведенных данных, установлена зависимость между образованием циркулирующих антиовариальных антител и длительностью ХВЗОТ (r = 0,68). Продолжительность заболевания в 1- ой группе – 8,8 года, во 2-ой – 5,1лет, (р<0,05).
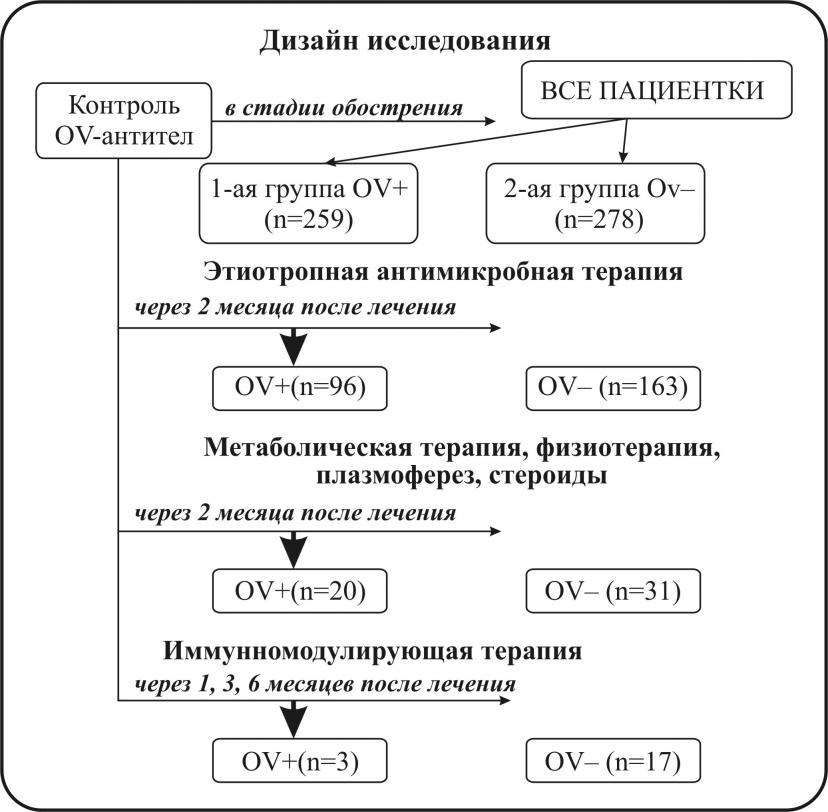
Формирование антиовариальных антител, как специфического фактора активации аутоиммунных механизмов, вероятно, связано с длительностью воздействия антигена (инфекта), приводя к нарушению ауторезистентности к антигенам яичника. В клинических группах был проведен антибактериальный курс терапии, в результате которой при мониторинге антиовариальных антител через 6-8 недель была определена группа пациенток, нуждающихся в коррекции аутоиммунитета (96 женщин). При дальнейшем обследовании после проведения плазмофереза, иммуноглобулинотерапии, стероидотерапии, комплексного физиолечения выделена группа с сохраняющимися антиовариальными антителами и повышенным уровнем IL-1, которой была проведена иммуномодулирующая терапия (рис.1).
Рисунок 1.
Анализ клинических жалоб показал превалирование в OV-серопозитивной группе пациенток синдрома тазовых и суставных болей, дизурических расстройств и нарушений менструальной функции. В первой клинической группе основными симптомами ХВЗОТ являлись: тазовые боли (85,33%), дизурические расстройства (76,06%), в 54,44% пациентки отмечали суставные боли и в 92,28% различные нарушения менструальной функции, во второй клинической группе достоверно чаще жалобы пациенток на патологические бели (75,18%.). Длительность ХВЗОТ, видимо, определяла характер жалоб, характерных для распространения и хронизации воспалительного процесса и определяет развитие дисфункции яичников воспалительного генеза
В структуре нарушений репродуктивная функция в группе пациенток с выделенными циркулирующими антиовариальными антителами достоверно выше были показатели длительности бесплодия (в 1-ой клинической группе – 7,37±0,39 лет, во 2-ой – 4,73±0,81 года, р<0,05) и ранних репродуктивных потерь (непрогрессирующие беременности и самопроизвольные выкидыши на ранних сроках 1-ая группа – 27 (14,75%), 2-ая группа – 10 (6,06%), р<0,005).
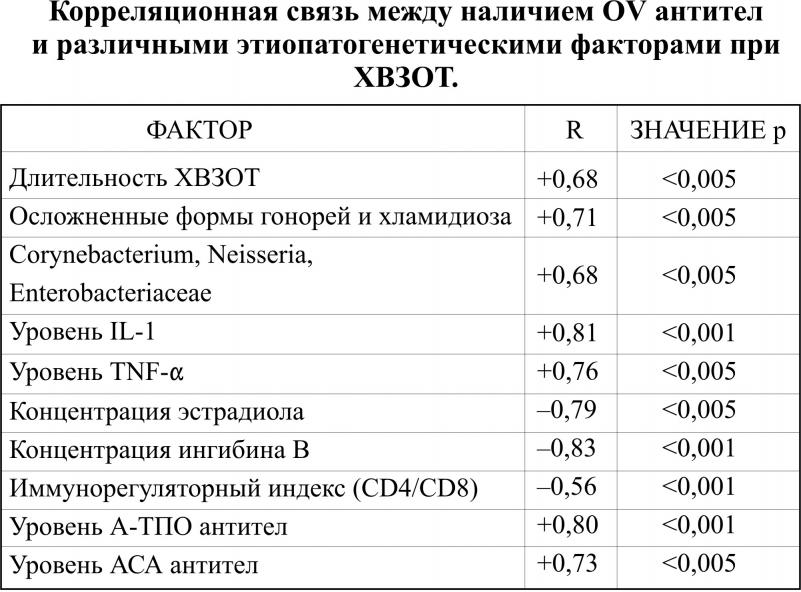
В первой клинической группе НМФ диагностированы у 134 женщин, что составило 92%, во второй соответственно 22 (56,41%), p<0,05. Доминировали у OV- серопозитивных пациенток такие нозологические формы, как опсоменорея 63 (43,45%), спаниоменорея 35 (24,13%), гипоменструальный синдром 30 (20,69%). Во второй клинической группе выявлены следующие формы НМФ: спаниоменорея 7 (17,96%), опсоменорея 3 (7,69%), гипоменструальный синдром 1 (2,56%). Вторичная аменорея в группе OV-негативных пациенток не выявлена. У 2 пациенток (5,13%) наблюдались явления гиперполименореи. В группе серопозитивных к овариальным антигенам пациенток нами установлено снижение уровня эстрадиола в периферической крови по сравнению с 2-ой исследуемой группой (65,73±2,4 пкг/мл и 123,7±3,7 пкг/мл соответственно, p<0,05). У OV–серопозитивных пациенток пониженный уровень эстрадиола, вероятно обусловил превалирование гипоменструальных форм нарушений цикла. Четко определена обратно пропорциональная зависимость между сроком заболевания сывороточной концентрацией эстрадиола, прогестерона и уровнем кортизола, прямая корреляция с концентрацией ФСГ (таблица 1).
При анализе инфекционного фактора наиболее значимые различия между обследуемыми группами в частоте осложненных форм хламидиоза и гонореи и корреляция между формированием у обследуемых пациентов клинической триады синдрома Рейтера и образованием циркулирующих антиовариальных антител.(1-я группа - 83(32%)), 2-ая – 36(13%) (рисунок 2).
Рисунок 2.
Этиологическая структура ИППП при ХВЗОТ
в обследуемых клинических группах
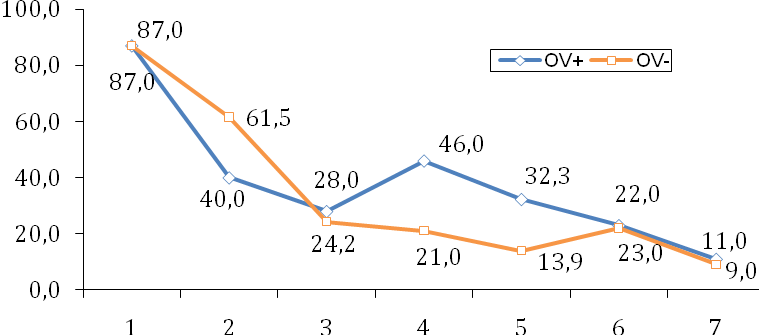
1-трихомониаз, 2-уреамикоплазмоз (>104), 3-неосложненная форма хламидиоза, 4- осложненная форма хламидиоза (p<0,05), 5-сочетение хламидиоза и гонореи (p<0,005), 6-HPV, 7- генитальный герпес.
При анализе условнопатогенного микробного пейзажа обследованных пациенток, серопозитивных с антигеном яичника выявлено достоверное превалирование: Corynebacterium различных типов (1-ая группа – 199 (76, 8%), 2-ая группа 67 (24%), Neisseria spp (1-ая группа – 49 (18,9%), 2-ая группа – 3 (1,1%), Enterоbacteriaceae (1-ая группа – 49 (18,9%), 2-ая группа – 7 (2,5%).
С точки зрения антигенной активности коринебактерии выделяют экзотоксин, катализатор химических реакций, вызывая отек и некротические изменения в тканях, также продуцируют гемолизин, некротизирующий фактор и гиалуронидазу. Энтробактерии – источники эндо-экзотоксических факторов, влияющих на межклеточные контакты. Антигенная структура микроорганизмов представлена липополисахаридами (ЛПС), О-антигенами кокковых инфекций и кишечной группы, у анаэробов являясь механизмом активации провоспали-тельного каскада (рисунок 3).
Рисунок 3.
Структура условнопатогенной микрофлоры
в обследуемых группах (%)
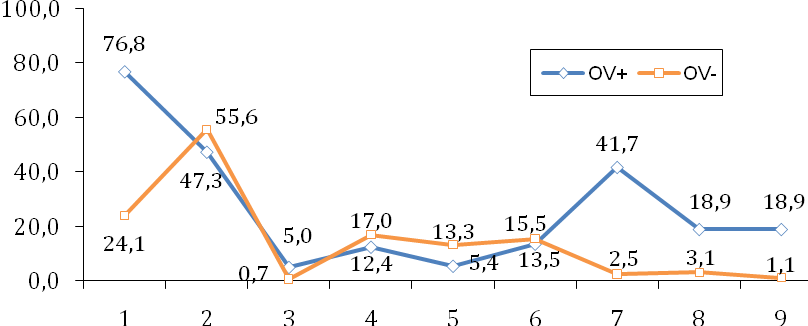
1-corynebakterium, 2-staphyloccoccus, 3-streptococcus, 4-candida albicans, 5-lactobacilum, 6-gardnerella, 7-enterobacteriacae, 8-облигатные анаэробы, 9-neisseria spp
При сравнении провоспалительных цитокинов в указанных группах выявлено достоверное различие содержания IL-1 (1-ая группа – 1053,41±1,1 пкг/мл, 2-ая – З68,8±0,10 пкг/мл, p<0,05), ТNF- (1-ая – 1250,0±4,70 пкг/мл, 2-ая – 196,88±4,3 пкг/мл, р < 0,05), IFN- (1-ая – 122,37±0,9 пкг/мл, 2-ая – 59,9±1,1 пкг/мл, p< 0,05).
Настоящими исследованиями было показано, что у обследуемых женщин имели место значительные «перестройки» показателей клеточного иммунитета. Так, было обнаружено снижение общего числа Т-лимфоцитов (CD3). Процентное содержание Т-хелперов/индукторов (CD4) было также снижено в OV-серопозитивной группе. В то же время количество Т-супрессоров (CD8) имело тенденцию к повышению. Отмечалась снижение иммунорегуляторного индекса CD4/CD8. Было установлено, что в отличие от Т-лимфоцитов, количество В-клеток (CD19) отличалось незначительно, но имела место тенденция к снижению, особенно у пациенток с большей длительностью заболевания. Незначительно снижался уровень натуральных киллеров (CD16).
Таким образом, определены факторы прогностически значимые для образования циркулирующих антиовариальных антител. Таковыми являются сывороточное содержание IL-1,TNF-, предовуляторного эстрадиола, ингибина В, осложненные формы хламидийной и гонорейной инфекций, корине - и энтеро-бактерии (таблицы 1,2).
В результате данных исследований был определен ряд анамнестических и клинико-лабораторных данных, позволяющих оценить степень риска формирования овариальной недостаточности при ХВЗОТ.
Таблица 2.
Факторы риска формирования аутоиммунного ооофрита
воспалительного генеза.
| Факторы риска | Клинико-анамнестические данные | Оценка в баллах | |
| Социально-биологические | |||
| 1 | Возраст женщины: | До 30 лет более 30 лет | 0 2 |
| 2 | Экстрагенитальные заболевания | да нет | 3 0 |
| Гинекологический анамнез | |||
| 3 | Нарушения менструального цикла в период менархе | да нет | 1 0 |
| 4 | Нарушения менструального цикла по типу гипоменструального синдрома | да нет | 3 0 |
| 5 | Хронические воспалительные заболевания органов малого таза в анамнезе | Длительность: до 5-х лет 5-10лет более 10 лет | 2 3 5 |
| 6 | Беременность в анамнезе | да нет замершая беременность привычное невынашивание | 0 3 4 5 |
| 7 | Искусственные аборты | да нет | 1 0 |
| 8 | Перенесенные ИППП, однократно | да нет | 2 0 |
| 9 | Перенесенные ИППП, неоднократно | да нет | 5 0 |
| 10 | Бесплодие, длительность 1-3 года | да нет | 1 0 |
| 11 | Бесплодие, длительность более 3-х лет | да нет | 5 0 |
| Данные лабораторного обследования | |||
| 12 | Наличие повышенного уровня циркулирующих поликлональных антиовариальных антител | да нет | 4 0 |
| 13 | Наличие повышенного уровня циркулирующих моноклональных антител к блестящей оболочке фолликулов | да нет | 5 0 |
| 14 | Наличие повышенного уровня маркеров активности аутоиммунитета (АФС-антител, антиспермальных антител, А-ДНК, А-ТПО) | да нет | 3 0 |
| 15 | Хламидиоз неосложненный в сочетании с гонореей синдром Рейтера | 2 4 5 | |
| 16 | Идентификация различных типов Enterоbacteriaceae,Corynebacterium | да нет | 5 0 |
| 17 | Наличие повышенного уровня провоспалительных цитокинов IL1,TNF | да нет | 5 1 |
| 18 | Индекс TNF- / Э2 более 20 усл. ед. 10-20 менее 10 | да нет | 5 3 1 |
| 19 | Уровень эстрадиола в норме | да нет | 0 3 |
| 20 | Индекс СD4/СD8 снижен | да нет | 3 1 |
| 21 | УЗИ: адекватные циклу данные фолликулометрии | да нет | 0 2 |
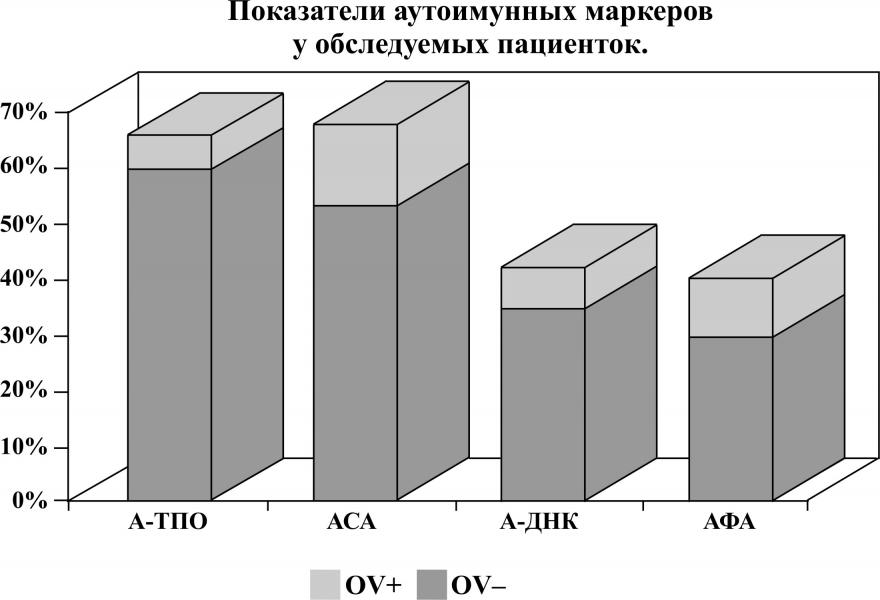
В обследуемых клинических группах анализ маркеров аутоиммунных процессов показал, что содержание в сыворотке обследуемых А-ТПО антиспермальных антител (АСА), антифосфолипидных антител (АФА). В группе серопозитивных женщин были достоверно выше, однако наиболее значимо это различие в частоте аутоиммунного тиреоидита, в 50%, сочетая с повышенным уровнем антиспермальных антител, что объясняет снижение репродуктивного потенциала (рисунок 4).
Рисунок 4.
По результатам исследования при развитии хронического воспалительного процесса с формированием антиовариальных антител определяющую роль имеют провоспалительные цитокины, секретируемые Th1-клетками. Сдвиг Th1 звена, приводит к активации провоспалительного каскада,преимущественно IL-1,TNF-, IFN-, модифицирующих архитектонику межклеточных контактов эндотелиаль-ных клеток. Активированные лимфоциты приводят к повышению экспрессии этих цитокинов, которые в свою очередь стимулируют HLA-экспрессию молекул главного комплекса гистосовместимости.
Поскольку яичники не обособлены от иммунной системы в яичниках идентифицированы макрофаги, лимфоциты и др. Эти клетки способны секретировать цитокины, модулирующие регуляцию гонадотропинами яичников (при физиологическом менструальном цикле). Так TNF-, выделяемый яичниковыми макрофагами, работает, как ингибитор фолликулов. В фолликулярной фазе цитокины – ингибиторы, контролирующие действие стероидогенеза в клетках теки и гранулозы незрелых ФСГ на клетки теки и гранулозы доминантного фолликула. Логично предположить, что активация цитокинового каскада, вызванная хроническими воспалительными процессами нарушает овариальную функцию, приводя к усиленной атрезии фолликулов.
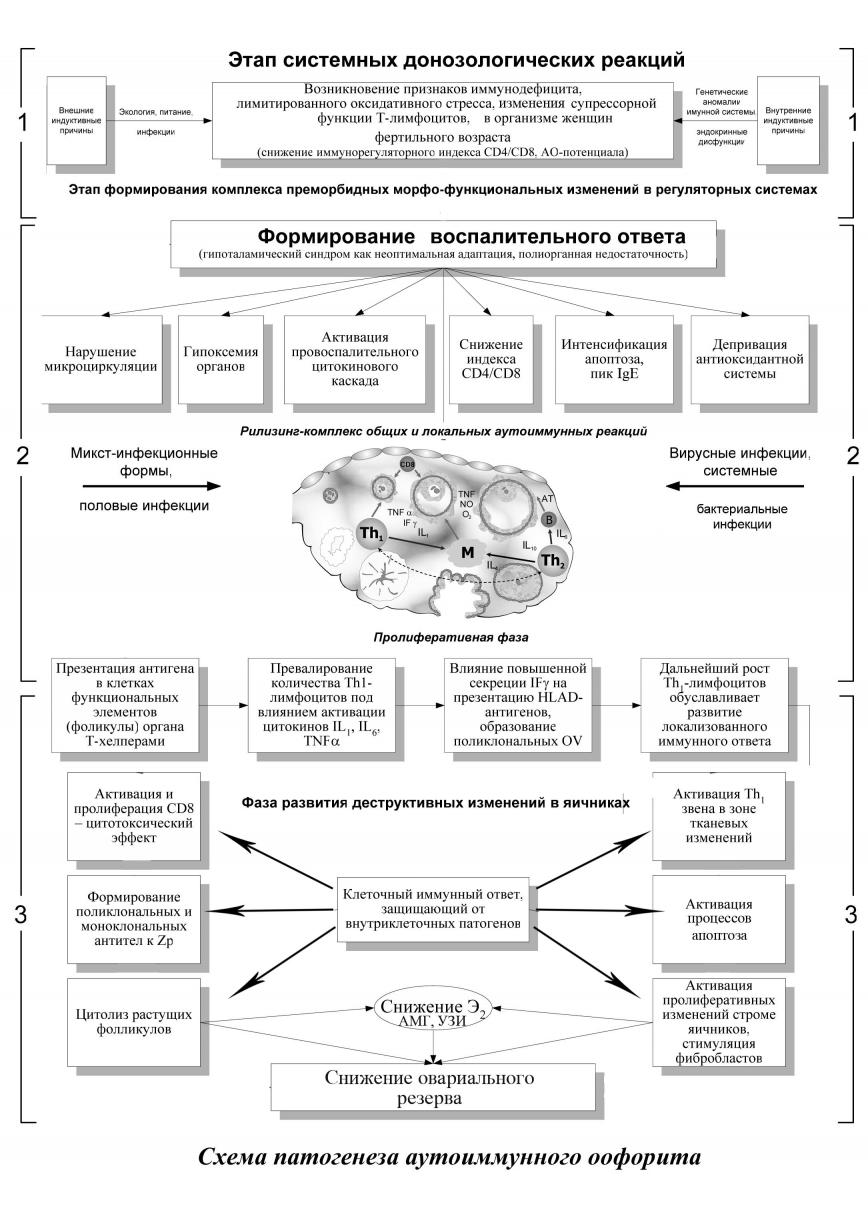
На завершающей стадии воздействие цитотоксических CD8 клеток приводит не только к атретическим процессам, но и воздействию на строму яичников. Пролиферативные изменения в строме, стимуляция фибробластов приводит к уменьшению функциональной активности овариальной ткани, за счёт гиперплазии стромальных элементов. Если поликлональные антиовариальные антитела воздействуют преимущественно на микроокружение ооцитов, то на фоне деструкции ооцита, формируются моноклональные антитела к блестящей оболочке (Zp). Снижение эстрадиола в сыворотке крови у женщин репродуктивного возраста определяет активацию гипоталамо-гипофизарной системы. Однако, на фоне системных воспалительных изменений, данные адаптивные механизмы неадекватны. Комплекс общих и локальных аутоиммунных реакций поддерживается определенными антигенными инфекционными стимулами. Однако, даже при эрадикации патогенов, вероятно, благодаря механизмам молекулярных мимикрии между собственными белками и микробными суперагентами, порочный круг поражения овариальной ткани замыкается (рисунок 5).
Рисунок 5.
Классификация аутоиммунного оофорита воспалительного генеза.
| Этиология | Патогенез | Характер нарушения мен. цикла: функции и структуры яичника | Ведущие диагностические признаки | Степень тяжести процесса в аспекте перспектив лечения | Клиническая стадия АО инфекционного генеза |
| Бактериальная инфекция (моно-ИППП, Staphylococcus, Streptococcus условно-пато-генные микро-организмы вне группы риска) | 1. ХВЗОТ длительностью до 5 лет. 2. Активация провоспалительно-го цитокинового каскада, обра-зование циркулирующих поликлональных ОV-антител в период обострения ХВЗОТ. 3.Функциональные сдвиги в корреляциях гипоталамо-гонадотропной интеграции, снижение эстрадиола, прогестерона,ингибина В,повышение кортизола. | 1. Недостаточность лютеиновой фазы менструального цикла. 2. Гиперполименорея дисменорея. 3. Пролиферативные изменения в оболочках фолликулов яичника (возможно формирование ретенционных овариальных кист), гиперпластических процессов эндометрия, начальные признаки фиброзных изменений. | 1. Отсутствие четких биоритмологических изменений в гормонопродукции яичников. 2. Возрастание уровня IL-1,TNF-.Увеличение индекса TNF- /Е2, снижение индекса СD4/СD8. IgЕ- значительно выше нормы 3. Циркулирующие поликлональные ОV имеют тенденцию к нарастанию в период обострения воспалительного процесса 4. Остается без изменений или может быть снижено число антральных фолликулов | Начальная | I серонегативная (транзиторная) в период ремиссии |
| Бактериальная микст ИППП (хламидии+ гонорея и др. сочетания Enterо-bacteriaceae Corynebacterium Neisseria spp.) | 1. ХВЗОТ длительностью от 5-10 лет с частыми обострениями. 2. Активация цитокинового каскада, цитотоксических лимфоцитов, образование циркулирующих поликлональных ОV в период ремиссии. 3.Снижение овариального резерва. 4. Развитие дезадаптации гипоталамогонадотропной интеграции ( нормогонадо-тропная гипофункция яичников). | 1. Гипоменструальный синдром, опсоменорея, спаниоменорея 2.Гиперплазия эндометрия 3. Формирование синдрома истощения яичников с наличием деструктивно-фиброзных изменений в овариальной ткани. | 1. Резкое снижение уровня овариальных гормонов 2. Высокий уровень IL-1, TNF. индекс TNF- /Е2 >20 усл. ед. индекс СD4/СD8 менее 1,5,Ig Е незначительно выше нормы. 3.Уровень поликлональных циркулирующих OV антител не снижается после проведения противовоспалительной терапии (при сочетанной форме моноклональные антитела к Zp). 4.Снижение уровня кортизола. 5.На УЗИ объем яичника увеличен, мало антральных фолликулов, нет доминантного. | Средняя | II серопозитивная IIа- «чистая» IIб –сочетанная ( с антителами Zp) |
| Вирусно-бактериальная микстинфекция | 1.В анамнезе наличие длительного системного воспалительного процесса (в анамнзе ХВЗОТ более 10 лет). 2.Некорректируемые высокие уровни провоспалительных цитокинов IL-1,TNF-. 3. Цитоксический тип иммунного ответа (СD8), развитие вторичного иммунодефицита. 4.Тенденция к снижению уровня циркулирующих поликлональных OV антител и увеличение моноклональных антител к Zp. 5.Гипергонадотропная гипофункция яичников. | 1.Вторичная аменорея. 2. Cиндром истощения яичников. 3. Дегенеративные изменения в яичниках и эндометрии | 1.Резкое снижение уровня кортизола и овариальных гормонов 2.Cниженны уровени СD4/СD8, IgЕ. 3.Уровени циркулирующих антиовариальных антител OV и моноклональных Zp стабильно незначительно повышены. 4.Объем яичника на УЗИ уменьшен,<5 антральных, отсутствие растущих фолликулов | Тяжелая | III иммуно-дефицитная III а – «чистая» IIIб –сочетанная (с антителами Zp) |
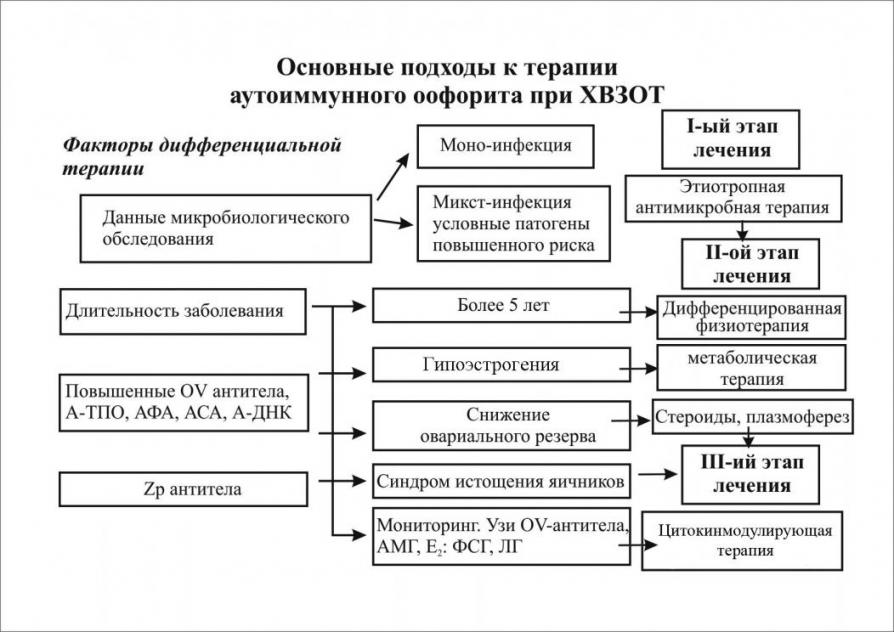
В соответствии с сформулированными представлениями мы разработали схему дифференцированной терапии. Первый этап лечения обследуемых пациенток - адекватная антибактериальная терапия, направленная на эрадикацию инфекта, исходя из данных обследования по идентификации микроорганизмов.
Поэтапно мониторируя уровень антиовариальных антител, провоспалительных цитокинов и показателей овариального резерва лечение дополняли плазмоферезом, иммуноглобулинотерапией, интерферонотерапией, физиотерапевтическими методами. Необходимо отметить, что, несмотря на высокую эффективность комплесной противовоспалительной терапии установлено при динамическом исследовании через 6-8 недель после эрадиксиции инфектов антиовариальные антитела обнаружены у 65(22,7%) пациенток (рисунок 6).
Рисунок 6.
Показатели А-ТПО, антиспермальные антитела у пациенток с циркулирующими антиовариальными антителами были наиболее резистентны к проводимой терапии и достоверно отличались от соотвествующих во 2-ой группе. В группе ОV-серопозитивных женщин значительно выше диагностически значимое содержание в сыворотке крови АМФ более чем у 60 % пациенток, достоверно выше были также А-ДНК, (p<0,005). В период лечения ХВЗОТ и реабилитационной терапии в 1-ой клинической группе наступила беременность у 33 пациенток (12,74%), во 2-ой у 102 (36,04%), (p< 0,05) (рисунок 7).
Рисунок 7.
Динамика маркеров активности аутоиммунных процессов после комплексной противовоспалительной терапии у обследуемых женщин
Влияние восстановительной терапии на критерии овариальной недостаточности при аутоиммунном оофорита: ФСГ, эстрадиола, ингибина В в сочетании с определением антиовариальных антител, определялись в обследуемых группах. В 1-ой группе содержание ИВ до лечения составило 76,8±2,3пкг/мл, во 2-ой группе 102,1±1,7 пкг/мл, причем при сопоставимой достоверности различий между OV-серопозитивными и OV- серонегативными пациентками: 1-ая группа – Э2 (65,73± 2,4пкг/мл) и 2-ая – (123,7±3,7 пкг/млp<0,05), 1-ая – ФСГ-12,41±0,4МЕ/мл, 2-ая – 5,84±0,4МЕ/мл, p<0,05,достоверность различий по показателю ИВ была выше. При нормализации OV-антител повышался ИВ до 128,11±1,8 пкг/мл.
Анализ мониторинга исследуемых провоспалительных цитокинов показал, что, несмотря на статически достоверные показатели коррекции на фоне проводимой этиотропной терапии неравнозначны. Наиболее резистентны к проводимой терапии, по результатам наших исследований, были повышением концентрации TNF-, IL-1. Уровень исследуемых провоспалительных цитокинов до и после терапии в группах с повышенным уровнем антиовариальных антител составило: IL-l (до терапии – 1053,4±3,1 пкг/мл, после – 807,8±4,1 пкг/мл, р<0,05), TNF-, (до – 1960,8±84,7 пкг/мл, после – 1250,0±4,3 пкг/мл, р<0,05), IFN- (до – 122,37±4,9 пкг/мл, после – 195,18±3,1 пкг/мл, р<0,05). Во 2-ой группе пациенток данные показатели составили: IL-l (до терапии – 368,82±3,1 пкг/ мл, после 311,8±4,1 пкг/мл, р<0,05), TNF (до – 196,88±4,7 пкг/мл, после – 125,0±4,3 пкг/мл, р<0,05), IFN- (до – 59,99±4,9 пкг/мл, после – 91,54±3,1 пкг/мл, р<0,05).
Наиболее стабильных показателей интенсивности аутоиммунного процесса были значения провоспалительные цитокины ТNF-, IL-1. Их уровень возрастал пропорционально уровню циркулирующих антиовариальных антител и значительно превышал таковой, характерный для OV-негативной группы. Учитывая, что высокий уровень IL-1, TNF- отражал интенсивность аутоиммунной реакции, которая сопровождалась значительным снижением овариальной функции мы решили предложить оценивать степень воспалительного поражения яичников по соотношению IL-1, TNF-/Э2 (сывороточное содержание эстрадиола в середине менструального цикла.)
Рисунок 8.
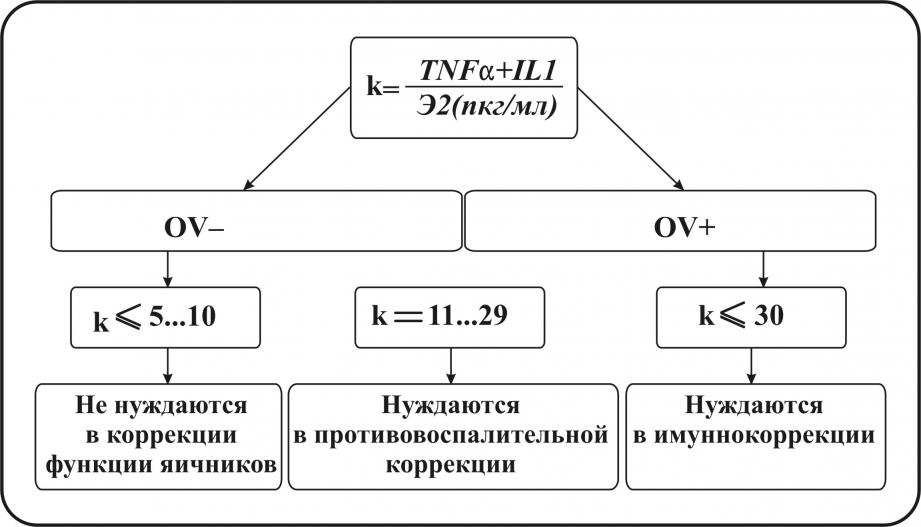
Путем эмпирических наблюдений, проведенных у женщин с разной длительностью заболевания, было выявлено, что тяжесть процесса коррелирует с возрастанием указанного соотношения (коэффициента). Для женщин низкого риска развития аутоиммунного оофорита его величины варьировали до 10 усл. ед. У женщин с длительностью заболевания от 1го года до 5 лет заболевания, с уровнем антиовариальных антител в пределах 10-15 усл.ед.,коэффициент IL-1, TNF-/Э2 возрастал более 15-20 усл. ед.(рисунок 8). Повышенные, резистентные к комплексной противо-воспалительной терапии уровни IL-1 у OV-серопозитивных обследуемых пациенток дают патогенетическое обоснование для применения цитокинмодулирующей терапии у женщин с овариальной аутоиммунной недостаточностью. В настоящее время существует точка зрения, что гиперпродукция IL-1, TNF- в острую фазу воспаления является важнейшим медиатором защиты против патогенов, играет решающую роль в иммунопатогенезе аутоиммунных состояний. Использование антицитокиновой терапии при хронических иммунопатологических процессах на фоне постоянной гиперпродукции цитокинов клинически оправдано и уже нашло применение в практике. В наших исследованиях в группе пациенток OV-серопозитивных после комплексной противовоспалительной терапии использован иммуномодулятор галавит (аминодигидрофталазиндион, регистрационный номер Р №000088/02), данный препарат вводился внутримышечно по 100 мг в течение 5 дней ежедневно, затем 100 мг каждые 72 часа (всего 20 инъекций). Контрольные обследования проводились по окончании терапии и через 1, 2, 3, 6 месяцев. У 17 пациенток (85%) на фоне стабильного снижения уровня циркулирующих антиовариальных антител установлено снижение IL-1, TNF-, IL-6, IFN-, (р<0,05). Изменения клеточного иммунитета были достоверны в субпопуляции CD8, установлено снижение (р<0,05), на фоне некоторого повышения CD3, CD4 (р>0,05), что является определяющим преимуществом, корректирующего избирательного влияния по сравнению с глюкортикоидной терапией.
При снижение уровня OV-антител четко определялись тенденции к повышение уровня эстрадиола, прогестерона, ИВ (р<0,05), при тенденции к снижению ФСГ, ЛГ.
У 5-ти пациенток с вторичным бесплодием, аменореей, были восстановлены менструальный цикл, овуляция. В двух случаях наступила беременность (1-стимуляция кломифеном на фоне эстроген-гестагенной схемы, 1-ЭКО).
Результататы нашего исследования позволяют расширить спектр этиопатогенетических, диагностических, прогностических аспектов формирования аутоиммунного оофорита воспалительного генеза. Анализ анамнестических, клинических и лабораторных данных указывают на высокую вероятность развития этого осложнения при ХВЗОТ и позволяют в гинекологической практике прогнозировать развитие аутоиммунной гипофункции яичников воспалительного генеза для своевременной диагностики, дифференцированной терапии и реабилитации данной категории пациенток. Таким образом, проведенное комплексное обследование женщин с аутоиммунным оофоритом, анализ основных звеньев патогенеза заболевания позволил определить роль инфекционного фактора в развитии нарушений овариальной функции и разработать современные подходы к диагностике и лечению данного осложнения при ХВЗОТ.
Выводы:
- В период обострения длительные хронические воспалительные заболевания органов малого таза у женщин репродуктивного возраста вызывают образование циркулирующих антиовариальных антител у 42,7% обследуемых пациенток.
- В период клинико-лабораторного излечения (через 1,5-2 месяца после эрадикации инфекционного фактора) у 22,8% обследумых диагностирован аутоиммунный оофорит с формированием синдрома овариальной недостаточности. В OV-серопозитивной клинической группе пациенток в 10,81% выявлены циркулирующие антитела к блестящей оболочке ооцита.
- Этиологически значимыми инфектами, вызывающими при ХВЗОТ образование антиовариальных антител являются микстформы с преобладаем хламидийно-гонорейного инфицирования в сочетании с различными типами Corynebacterium, Neisseria, Enterоbacteriaceae.
- Среди этипатогенетических факторов формирования аутоиммунного оофорита установлены: длительность ХВЗОТ более 5 лет, активация Th-1 звена иммунитета (повышение уровня провоспалительных цитокинов IL-1, TNF-, IFN-), дисбанс иммурегуляторного индекса и превалирование цитотоксических эффектов (снижение CD3, CD4, повышение содержания CD8-лейкоцитов).
- В структуре гестационных потерь у OV–серопозитивных пациенток превалировали неразвивающиеся беременности (14,8%) по сравнению с OV-негативной группой - 6,1%, (р<0,05), на фоне активации в 1-ой группе аутоиммунных маркеров: А-ТПО (61%), антиспермальных антител (54%), анти ДНК-антител (41%), антифосфолипидных антител (35%), (p<0,005 относительно 2-ой группы).
- Прогностически значимыми факторами системного воспалительного ответа для формирования аутоиммунного оофорита, наиболее резистентными к противовоспалительной терапии ХВЗОТ являются повышенные сывороточные концентрации провоспалительных цитокинов IL-1 и TNF-. Мониторинг уровня IL-1,TNF-, предовуляторного уровня эстрадиола и соотвествующего коэффициента позволяет оценить адекватность противовоспалительной терапии, является показанием к расширению спектра лечебно-диагностичеких мероприятий (определение циркулирующих антиовариальных антител, показателей овариального резерва, применение плазмофереза, интерфероногенов, цитокинмодулирующей терапии).
- Результататы применения иммуномодулятора галавит у OV-серопозитивных пациенток, на фоне стабильной нормализации уровня циркулирующих антиовариальных антител установлено снижение IL-1, TNF-, IFN-, IL-6 (р<0,05). Изменения клеточного иммунитета были достоверны лишь в субпопуляции CD8-клеток, установлено снижение (р<0,05), на фоне некоторого повышения CD3, CD4-клеток (р>0,05), что является определяющим преимуществом, избирательного влияния по сравнению с глюкортикоидной иммунотерапией. После применения цитокинмодулирующей терапии четко определялись тенденции нормализации гормонопродуцирующей функции яичников: повышение уровня эстрадиола, прогестерона, ингибина В, (р<0,05), при некотором снижении ФСГ, ЛГ.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Пациенки репродуктивного возраста с ХВЗОТ составляют группу высокого риска по развитию аутоиммунного оофорита воспалительного генеза, прогностически значимыми клиническими признаками являются нарушение менструальной функции по типу гипоменструального синдрома, суставные и тазовые боли, бесплодие и ранние репродуктивные потери. Этиологически значимыми инфектами, вызывающими образование антиовариальных антител являются микстформы с преобладаем хламидийно-гонорейного инфицирования в сочетании с Corynebacterium, Neisseria, Enterоbacteriaceae и длительность заболевания более 5 лет.
- Обследование пациенток из группы риска рекомендовано проводить в период обострения ХВЗОТ и через 1,5 месяца после проведения комплексной противовоспалительной терапии и эрадикации инфектов.Показаниями к этапному расширению лечебно-диагностичеких мероприятий (применение плазмофереза, иммуноглобулинотерапии, стероидных противовоспалительных препаратов, цитокинмодулирующей терапии) являются снижение овариального резерва, повышение сывороточной концентрации антиовариальных антител, IL-1, TNF-.
- У пациенток с аутоиммунным оофоритом (повышенный уровень антиовариальных антител), гиперпродукцией IL-1 после комплесной противовоспалительной терапии ХВЗОТ показано применение иммуно-модулятора галавит:введение проводится внутримышечно по 100мг/ сутки в течение 5 дней, затем по 100 мг через 72 часа, курс 20 инъекций. Контрольные обследования проводятся по окончании терапии и через 1,2,3,6 месяцев. Эффективность терапии определяется стабильным снижением уровня циркулирующих антиовариальных антител, IL-1, TNF-, IL-6, IFN-, тенденцией нормализации гормонопродуцирующей функции яичников (повышение уровня эстрадиола, прогестерона, ингибина В).
- Восстановление функциональной активности яичников на фоне терапии ХВЗОТ и нормализация уровня циркулирующих антиовариальных антител является необходимым этапом предгравидарной реабилитации пациенток.
СПИСОК РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ СПИСОК НАУЧНЫХ ТРУДОВ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Орлов В.И., Царегородцева М.В., Ефанова Е.А., Поляков В.А. Комплексная лабораторная диагностика и мониторинг терапии хламидийной инфекции //Материалы II съезда акушеров – гинекологов Северного Кавказа.- Ростов-на-Дону, 1998.- С. 33.
- Орлов В.И., Царегородцева М.В., Зайцева Е.В. Aутоиммунные аспекты хронического оофорита // Материалы IV Российского форума «Мать и дитя» – Москва, 2002. - Часть 2, С. 450-451.
- Царегородцева М.В. Клинико-иммунологические аспекты формирования гипофункции яичников при урогенитальном хламидиозе.//«Пренатальная диагностика и беременность высокого риска» материалы Пленумов Российской ассоциации акушеров-гинекологов, проблемной комиссии межведомственного научного совета по акушерству и гинекологии РАМН МЗ РФ, научно-практической конференции акушеров-гинекологов Южного федерального округа Ростов-на-Дону, 2003.- С.135 –139.
- Царегородцева М.В., Зайцева Е.В Некоторые патогенетические аспекты хронического эндометрита //«Пренатальная диагностика и беременность высокого риска» материалы Пленумов Российской ассоциации акушеров-гинекологов, проблемной комиссии межведомственного научного совета по акушерству и гинекологии РАМН МЗ РФ, научно-практической конференции акушеров-гинекологов Южного федерального округа. Ростов-на-Дону, 2003. - С.140–142.
- Царегородцева М.В.,Зайцева Е.В. Синдром Рейтера (особенности диагностики, лечения и реабилитации. // Материалы IX Международного конгресса «Проблемы иммунореабилитации: физиология и патология иммунной системы» – Анталия, 2003. - том 5, N 1,С. 108.
- Царегородцева М.В., Туркаева Т.Н.Клинические факторы риска формирования поликлональных антител и моноклональных к Zona pelucida при хроническом оофорите // Материалы II съезда акушеров – гинекологов Северного Кавказа.- Ростов-на-Дону, 2005.- С. 59-62.
- Царегородцева М.В. Урогенитальный хламидиоз как возможный этиологический фактор аутоиммунной гипофункции яичников // Известия высших учебных заведений, Cеверокавказский регион, 2005.- С.65-69.
- Царегородцева М.В., Туркаева Т.Н. Роль провоспалительных цитокинов в формировании аутоиммунного оофорита при персистирующей хламидийной инфекции // Материалы VII Российского форума «Мать и дитя» – М., 2005.-С. 540-541.
- Царегородцева М.В. Провоспалительные цитокины как прогностические критерии формирования аутоиммунного оофорита при синдроме Рейтера // АГ-инфо, 2006, № 1- С.38-40 ( Бюллютень № 4, 2005г.).
- Царегородцева М.В. Циркулирующие антиовариальные антитела на различных клинических этапах хронических воспалительных заболеваний органов малого таза // Материалы международного конгресса РАМН «Практическая гинекология:от новых возможностей к новой стратегии»– М., 2006.- С.208-209.
- Царегородцева М.В. Особенности микробного пейзажа репродуктивной системы при аутоиммунной овариальной недостаточности воспалительного генеза // Материалы 1-го международного конгресса конгресс «Репродуктивная медицина» – М., 2006.- С.179.
- Серов В.Н., Царегородцева М.В., Кожин А.А., Жаров Е.В. Механизмы формирования аутоиммунного оофорита у женщин с хроническим воспалением придатков матки // Журнал Российского общества акушеров-гинекологов, 2006, N-4 - С.32-34.
- Царегородцева М.В., Волошина Е.И. Восстановительная терапия нарушений функции яичников у женщин с аутоиммунным оофоритом воспалительного генеза // Журнал Российского общества акушеров-гинекологов, 2006, N1- С.41- 43.
- Царегородцева М.В Иммуногормональный статус женщин с воспалительными заболеваниями репродуктивных органов и диагностические критерии аутоиммунного оофорита // Журнал Российского общества акушеров-гинекологов, 2006, N2.- С.23-25.
- Силантьева Е.С., Кожин А.А., Царегородцева М.В., Волошина Е.И., Белоусов Д.М.Современная медицинская техника – возможность комплексного подхода в физиотерапии женского бесплодия // Здравоохранение и новая медицинская техника, 2006, N5.- С.23-25.
- Серов В.Н., Царегородцева М.В.Эффективность плазмофереза в комплесной аутоиммунного оофорита воспалительного генеза // Материалы VIII Российского форума «Мать и дитя» – М., 2006. С.- 516-517.
- Серов В.Н., Царегородцева М.В.Клиническое значение ингибина В при оценке гормопродуцирующей функции при аутоиммунном оофорите воспалительного генеза / /Материалы VIII Российского форума «Мать и дитя» – М.,2006.С.- 517.
- Царегородцева М.В. Этапность образования антиовариальных антител при хроническом оофорите // Материалы VIII Российского форума «Мать и дитя» – М., 2006. С.- 558.
- Царегородцева М.В. Циркулирующие антиовариальные антитела и репродуктивные потери // Материалы VIII Российского форума «Мать и дитя» – М., 2006. С.-557.
- Серов В.Н., Царегородцева М.В., Кожин А.А. Аутоиммунная овариальная недостаточность воспалительного генеза //Материалы VIII Российского форума «Мать и дитя» – М., 2006. С.-557.
- Серов В.Н., Царегородцева М.В. Клинико-иммунологичекие факторы в формировании аутоиммунной овариальной недостаточности воспалительного генеза // Акушерство и гинекология, 2007, № 6, с. 28-33.
- Царегородцева М.В., Туркаева Т.Н. Способ прогнозирования аутоиммунного оофорита воспалительного генеза у женщин репродуктивного возраста // Бюллютень № 34, 10.12.2007, Патент на изобретение № 2312359.
- Царегородцева М.В.,Волошина Е.И., Кожин А.А. Способ лечения нарушений менструального цикла у женщин // Бюллютень№ 18, 27.06.2007, патент на изобретение № 2301655.
- Серов В.Н., Царегородцева М.В., Кожин А.А., Жаров Е.В. Овариальная резервометрия у женщин, перенесших аутоиммунный оофорит, в оценке эффективности восстановительной терапии // Журнал Российского общества акушеров-гинекологов, 2007, N-1 С.23-25.
- Серов В.Н., Царегородцева М.В. Хронические воспалительные заболевания органов малого таза: оценка риска развития аутоиммунной овариальной недостаточности // Российский вестник акушера-гинеколога, 2008, № 5- С.4-9.
- Царегородцева М.В. Аутоиммунная овариальная недоста-точность воспалительного генеза // Журнал акушерства и женских болезней, 2008, том LVII, выпуск 2- С.37-42.
- Серов В.Н., Царегородцева М.В. Аутоиммунная овариальная недостаточность на различных этапах терапии хронических воспалительных заболеваний органов малого таза // Вопросы гинекологии, акушерства и перинатологии, 2008, том 7, N 6 - С.5-9.
- Серов В.Н., Царегородцева М.В. Характеристика инфекционного фактора при аутоиммунной овариальной недостаточности // Вестник Волгоградского государственного медицинского университета, 2008, N 4- С. 65-68.
- Серов В.Н., Царегородцева М.В., Кожин А.А., Волошина Е.И., главы в монографии «Гинекология» « Аутоиммунный оофорит: патогенез, диагностика, терапия», «Немедикаментозная терапия нарушений функции яичников у женщин и использование показателей овариального резерва в оценке ее эффективности». // М.,издательство «Литтера», 2008, главы 36, 54; С.505-527, С.793-809.
- Серов В.Н., Царегородцева М.В. Аутоиммунный оофорит воспалительного генеза и репродуктивная функция // Акушерство и гинекология, 2009, № 1, с.32-35.

