Министерство сельского хозяйства Российской Федерации
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Московская государственная академия ветеринарной медицины и биотехнологии имени К. И. Скрябина» (ФГОУ ВПО МГАВМиБ)
| УДК 544.7 № госрегистрации 01200961265 Инв. № 59-11-11 | «УТВЕРЖДАЮ» Ректор ФГОУ ВПО МГАВМиБ, академик РАСХН, профессор ______________Ф.И. Василевич «___» ноября 2010 г. |
ОТЧЕТ о научно-исследовательской работе
Проведение научных исследований коллективами научно-образовательных центров в области коллоидной химии и поверхностных явлений.
по теме:
РАЗРАБОТКА МЕТОДИК И СОЗДАНИЕ БИОХИМИЧЕСКИХ КОЛЛОИДНЫХ СИСТЕМ ДЛЯ ВЕТЕРИНАРНО-БИОЛОГИЧЕСКИХ И ЗООТЕХНИЧЕСКИХ
НАПРАВЛЕНИЙ
(промежуточный этап №4)
«Теоретические и экспериментальные исследования
биохимических свойств БКС»
Государственный контракт от «07» июля 2009 г. № 02.740.11.0270 в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы
Мероприятие 1.1 Проведение научных исследований коллективами научно-образовательных центров.
Руководитель проекта,
академик РАСХН, д.с/х.н., проф. ___________ Н.А. Балакирев
«__» ноября 2010 г.
Москва 2010
Список основных исполнителей
| Проректор по НР, академик РАСХН, д.с./х.н., проф. | ____________ подпись, дата | Н.А. Балакирев Раздел 4.4, 4.5, 4.6 |
| Зав. кафедрой, д.х.н., д.б.н., проф. | ____________ подпись, дата | С. Ю. Зайцев Раздел 4.1, 4.5,4.6, 4.7 |
| Проф., д.х.н | ____________ подпись, дата | М. С. Царькова Раздел 4.1, 4.5,4.6, 4.7 |
| Доцент, к.х.н. | ____________ подпись, дата | Л.А. Фролова Раздел 4.7 |
| Доцент, к.х.н. | ____________ подпись, дата | О.С. Белоновская Раздел 4.1 |
| Доцент, к.б.н. | ____________ подпись, дата | А.А. Лисицына Раздел 4.7 |
| Доцент, к.х.н. | ____________ подпись, дата | И.Н. Староверова Раздел 4.5 |
| Доцент, к.б.н. | ____________ подпись, дата | Т.О. Азарнова Раздел 4.3 |
| к.б.н. | ____________ подпись, дата | А.А. Дельцов Раздел 4.3 |
| к.б.н. | ____________ подпись, дата | Т.А. Садовская Раздел 4.1 |
| Доцент, к.х.н. | ____________ подпись, дата | Г.К. Жирнова Раздел 4.2 |
| Доцент, к.х.н. | ____________ подпись, дата | М. Мухамедкулова Раздел 4.3 |
| Доцент, к.х.н. | ____________ подпись, дата | М.Х. Джафаров Раздел 4.5 |
| Зав. уч. лабораторией, к.б.н. | ____________ подпись, дата | И.В. Милаёва Раздел 4.1, 4.2, 4.3, 4.4 |
| Аспирант | ____________ подпись, дата | Е. Н. Зарудная Раздел 4.1, 4.2, 4.3, 4.4 |
| Аспирант | ____________ подпись, дата | А. Н. Тимонин Раздел 4.7 |
| Аспирант | ____________ подпись, дата | М.Н. Шапошников Раздел 4.2 |
| Аспирант | ____________ подпись, дата | Н.А. Довженко Раздел 4.1, 4.2, 4.3, 4.4 |
| Аспирант | ____________ подпись, дата | В.В. Бондаренко Раздел 4.2 |
| Аспирант | ____________ подпись, дата | Е.Ю. Миронова Раздел 4.4 |
| Ассистент | ____________ подпись, дата | О.А Коршунова Раздел 4.1 |
| Студентка | ____________ подпись, дата | Д.О. Соловьева Раздел 4.1, 4.2, 4.3, 4.4 |
| Лаборант | ____________ подпись, дата | Е.Н. Демина Раздел 4.3 |
| Лаборант (Уволена приказом № 478 от 25.08.2010г.) | ____________ подпись, дата | С.Г. Дикова Раздел 4.2 |
| Инженер | ____________ подпись, дата | Е.В. Баннова Раздел 4.4 |
| Инженер | ____________ подпись, дата | А.Н. Балакирев Раздел 4.5 |
| Нормоконтролер | ____________ подпись, дата | Е.Ю. Любинская Раздел 4.5 |
| Старший лаборант | ____________ подпись, дата | Н.С. Епихина Раздел 4.3 |
Реферат
Отчет 126 с., 7 ч., 45 рис., 44 табл., 2 приложения.
Ключевые слова: биохимические коллоидные системы, ферментные коллоидные системы, мембранные коллоидные системы, полимеры, иммобилизованные ОМС, иммобилизованные ферменты, супрамолекулярные ферментные комплексы, коллоидно-химические свойства, белки, полиэлектролиты, физико-механические свойства, динамическое поверхностное натяжение, модельные системы, сыворотка крови, спектральные методы.
Объекты исследования и разработки. Экспериментальное оборудование для изучения ФКС. Результаты по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов. Модели на основе полученных корреляций между изученными параметрами. Состав и свойства биологических жидкостей коров под воздействием внешних факторов. Изменения элементного состава поверхностных слоев волоса и кожного покрова у ценных видов пушных зверей * песцов, лисиц и норок) для применения в зоотехнии. Использование результатов НИР в учебном процессе.
Цели работы по четвертому этапу
- Инжиниринговое обеспечение экспериментального оборудования для изучения ФКС.
- Анализ результатов по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов.
- Построение моделей на основе полученных корреляций между изученными параметрами.
- Изучение состава и свойств биологических жидкостей коров под воздействием внешних факторов.
- Сравнительное исследование изменений элементного состава поверхностных слоев волоса и кожного покрова у ценных видов пушных зверей для применения в зоотехнии.
- Анализ и обобщение полученных на 4 этапе результатов НИР
- Анализ апробации результатов по мембранным коллоидным системам в части МКС для определения катионов тяжелых металлов спектральными методами в учебном процессе.
Метод и методология проведения работы включали: Инжиниринговое обеспечение экспериментального оборудования для изучения ФКС, включающее приборы для измерения динамического поверхностного натяжения биологических жидкостей, измерения активности ферментов, изучения гидролиза триглицеридов и получения липосом; анализ результатов по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов; построение моделей на основе полученных корреляций между изученными параметрами; изучение состава и свойств биологических жидкостей коров под воздействием внешних факторов методами межфазной тензиометрии и биохимического анализа; исследование изменений элементного состава поверхностных слоев волоса и кожного покрова у ценных видов пушных зверей для применения в зоотехнии; анализ и обобщение полученных на 4 этапе результатов НИР; разработка методик, создание образцов, методических рекомендаций и указаний для внедрения в учебный процесс ФГОУ ВПО МГАВМиБ.
В работе использованы следующие физико-химические методы исследования:
измерение ДПН методом максимального давления в пузырьке; биохимический анализ; корреляционный анализ; измерение спектров поглощения; измерение спектров флуоресценции, проведение элементного анализа волосяного и кожного покрова ценных пушных зверей и биохимических показателей крови.
Результаты работы
Показано, что изучение ФКС обеспечено экспериментальным оборудованием. Установлено, что величина изменения динамического поверхностного натяжения 4 для систем панкреатической липазы с полимерами с увеличением относительного содержания фермента от 1:100 до 100:1 уменьшается в ряду ПАМАПЛ>ПССПГ>БСА. Выявлено, что концентрация соли оказывает влияние на ПН смесей при коротких временах существования поверхности. При разных соотношениях компонентов в смеси увеличение концентрации соли приводит к повышению ДПН при коротких и средних временах, снижению ДПН при больших временах и равновесному значению ДПН. Наибольшие различия при разных концентрациях отмечаются при коротких временах, равновесные значения отличаются незначительно. Установлено, что динамика белков сыворотки крови коров закономерно отражает физиологические процессы, происходящие в их организме в период полового и физиологического созревания и в период функциональной зрелости. Выявлены межвидовые и межвозрастные отличия в минеральном составе (по 25 элементам) кожного и волосяного покрова у пушных зверей, показаны корреляционные связи между этими параметрами, позволяющие предсказывать дефицит необходимых элементов. Результаты по мембранным коллоидным системам для определения катионов тяжелых металлов спектральными методами внедрены в учебный процесс.
7. Проанализированы и обобщены полученные на четвертом этапе результаты НИР.
Рекомендации по внедрению результатов НИР
Разработка методик и создание биохимических коллоидных систем с использованием современных методических и инструментальных достижений позволит решить ряд актуальных фундаментальных проблем в области коллоидной химии и поверхностных явлений, а также прикладных задач биомедицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии. Биохимические коллоидные системы на основе мембран и тонких пленок позволят создать нанокомпозитные материалы для хемосенсорных устройств биологического контроля катионов биогенных металлов и малых органических молекул в воде и биологических жидкостях.
Все вышеизложенное является неотъемлемой частью научно-технического прогресса в развитии животноводства на современном этапе и будет реализовано в данной НИР на базе достижений коллоидной химии.
Выполнение НИР обеспечит достижение научных результатов мирового уровня в решении многих актуальных фундаментальных и прикладных проблем химии и биологии, медицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии; позволит завершить создание комплексной системы подготовки высококвалифицированных специалистов (от бакалавров и магистров до кандидатов и докторов наук), обладающих особыми компетенциями по профилю данной НИР, что приведет к формированию эффективного и жизнеспособного научного коллектива.
Область применения полученных результатов.
Результаты проекта должны быть включены в образовательную программу ФГОУ ВПО МГАВМиБ и использоваться в образовательном процессе на базе научного кадрового потенциала, лабораторного и испытательного оборудования научно-образовательного центра ФГОУ ВПО МГАВМиБ, в том числе в процессе проведения настоящих научно-технических работ.
Новые БКС, разработанные на основе полимеров разного типа, могут найти применение в медицине человека и животных, экологии, нано- и биотехнологии и т.д. Полученные на данном этапе результаты являются ключевыми для успешного выполнения всего проекта.
Прогнозные предположения о развитии объекта исследования.
В процессе проведения НИР должны быть разработаны технологические параметры БКС и методические рекомендации по их использованию для различных областей применения, в том числе: экспериментальные образцы; методики испытаний экспериментальных образцов; технологии получения биохимических коллоидных систем.
В ходе выполнения НИР будут получены результаты интеллектуальной деятельности (статьи, патенты и т.д.); учебно-методические комплексы, включающие учебно-методические пособия, указания и рекомендации; примерные и рабочие учебные программы, практикумы по дисциплинам «Биохимия мембран», «Физическая и коллоидная химия», «Кинетика и термодинамика ферментативных реакций», «Энзимология», «Биоэнергетика», «Бионанотехнология» и другие.
СОДЕРЖАНИЕ
| Реферат ………………………………………………………………………………….…………. | 4 |
| 4.1. Инжиниринговое обеспечение экспериментального оборудования для изучения ФКС…………………………………………………………………………………………………. | 11 |
| 4.1.1 Методы измерения динамического поверхностного натяжения биологических жидкостей…………………………………………………………………………………………… | 11 |
| 4.1.2 Метод измерения активности ферментов………………………………………………….. | 16 |
| 4.1.3 Метод изучения гидролиза триглицеридов и новых липидоподобных субстратов в монослоях под действием липаз………………………………………………………………….. | 18 |
| 4.1.4 Использование роторного испарителя для получения липосом…………………………. | 30 |
| 4.2. Анализ результатов по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов…………………………………..…………………………………………….. | 33 |
| 4.2.1 Влияние полиэлектролитного окружения на активность липаз из поджелудочной железы свиньи и гриба Mucor javanicus…………………………………………………………... | 33 |
| 4.2.2 Изучение динамического поверхностного натяжения систем липазы из поджелудочной железы свиньи с природными и синтетическими полиэлектролитами…….... 4.2.3 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в смеси с полистиролсульфонатом натрия…………………… 4.2.4 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в смеси с полидиаллилдиметиламмоний хлоридом…………. 4.2.5 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в трехкомпонентном комплексе с полистиролсульфонатом натрия и полидиаллидиметиламмоний хлоридом……………………………………………….. | 35 35 40 45 |
| 4.3. Построение моделей на основе полученных корреляций между изученными параметрами……………………………………………………………………………………….. | 48 |
| 4.3.1 Модельные системы на основе белков, липидов и солей………………………………… | 48 |
| 4.3.2 Модельные системы на основе куриных эмбрионов……………………………………… | 58 |
| 4.4. Изучение состава и свойств биологических жидкостей коров под воздействием внешних факторов…..…………………………………………………………………………… | 63 |
| 4.5. Сравнительное исследование изменений элементного состава поверхностных слоев волоса и кожного покрова у ценных видов пушных зверей для применения в зоотехнии…………………………………………………………………..……………………….. | 72 |
| 4.5.1 Закономерности изменения минерального состава волосяного покрова у стандартных норок ……………………………………………………………………………………………….. | 74 |
| 4.5.2 Закономерности изменения минерального состава волосяного покрова у серебристых песцов ………………………………………………………………………………………………. 4.5.3 Закономерности изменения минерального состава волосяного покрова у серебристо-черных лисиц ………………………………………………………………………………………. 4.5.4 Закономерности изменения поверхностной концентрации макро- и микроэлементов в кожно-волосяном покрове у разных видов пушных зверей…………………………………….. | 77 82 85 |
| 4.6. Анализ и обобщение полученных на 4 этапе результатов НИР…...…………………………………………………………………………………………….. | 101 |
| 4.7. Анализ апробации результатов по мембранным коллоидным системам в части МКС для определения катионов тяжелых металлов спектральными методами в учебном процессе………………………………………………………………………………… 4.7.1 Апробация результатов по мембранным коллоидным системам в реализации рабочих программ учебных дисциплин, практик, выпускных квалификационных работ……………… 4.7.2 Апробация результатов по мембранным коллоидным системам в профиле работы научных студенческих кружков кафедры органической и биологической химии…………… 4.7.3 Методические рекомендации по апробации результатов по мембранным коллоидным системам, содержащие фрагменты разрабатываемой проблемы по МСК и внедренные в учебный процесс…………………………………………………………………………………... ПРИЛОЖЕНИЯ Приложение 1 | 102 103 108 109 |
| 4.8. Проведение экспериментальных исследований биологических жидкостей с использованием лабораторных установок для формирования мономолекулярных пленок органических и биологических веществ, для исследования биологических мембран, клеток, синтетических и природных полимеров и другого специального оборудования………………………………………………………………………………………. | 112 |
| Приложение 2 ……………………………………………………………………………………... | 116 |
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
МКС - мембранные коллоидные системы
ФКС – ферментные коллоидные системы
БКС – биохимические коллоидные системы
НКМ - нанокомпозитные материалы
ОМС - оптические молекулярные сенсоры
ММВ - малые моноламеллярные везикулы
БМВ - большие моноламеллярные везикулы
ПСС - Na-полистиролсульфонат
ПАМА - полидиаллилдиметиламмоний хлорид
ПЛ - полилизин
ПГ - полиглутамин
БСА – бычий сывороточный альбумин
УФ-область – ультрафиолетовая область
КРС – крупный рогатый скот
СОЭ – скорость оседания эритроцитов
ЛС - лекарственные средства
АГ - антигены
АТ - антитела
ПН - поверхностное натяжение
ДПН - динамическое поверхностное натяжения
УЗ - ультразвук
ПАВ - поверхностно-активные вещества
ССА - свиной сывороточный альбумин
4.1 Инжиниринговое обеспечение экспериментального оборудования для изучения ФКС
4.1.1 Методы измерения динамического поверхностного натяжения биологических жидкостей
Для исследования биологических жидкостей в большей степени подходят два метода: максимального давления в пузырьке и метод висящей капли. Метод максимального давления в пузырьке позволяет получать кривую динамического поверхностного натяжения в диапазоне времени от 0,01 до 100 секунд с воспроизводимостью не менее 0,2%. В настоящее время выпускается несколько типов приборов, работающих по этому методу PBS (Electronetics Comp., США), Sensadyn (Chem Dyne Research Corp., США), BPA-1P (Sinterface Technologies, ФРГ), MPT2 (Lauda, ФРГ).
Адаптированные для измерения биологических жидкостей приборы проводят измерения объёма жидкости от 1 мл.
Преимуществом метода висящей капли является малый объём анализируемой жидкости (менее 0,5 мл), простое и удобное термостатирование пробы, широкий диапазон измерений времени существования капли (от 10 до 10000 с и более), что дополняет возможности метода максимального давления в пузырьке. Приборы, работающие по этому методу: "ADSA-Toronto" (Канада), PAT-1 (Sinterface Technologies, ФРГ). Комбинация двух методов, позволяет проводить измерения ДПН во временном интервале от 10-3 до 104 секунд.
Метод висящей капли. Метод висящей капли используется при измерении поверхностного натяжения на приборе РАТ-1 (Topfen-Blasen-Profiltensiometer) (ФРГ, Sinterface Technologies). Его преимуществами являются малый объём анализируемой жидкости, широкий диапазон измерений времени жизни капли (от 10 до 10000с и более). Прибор РАТ-1 состоит из микродозирующего устройства, включающего шприц для жидкостной хроматографии на 0,5 мл и микрометрического регулятора (1), микродозирующей системы (7), которая через процессор управляется компьютером (6), источника света (3), объектива и специальной видеокамеры (4), обеспечивающей неискажённое изображение капли, термостатируемой ячейки (8) с каплей исследуемой жидкости (2), формируемой на кончике стального или тефлонового капилляра (Рис.1).

Рисунок 1 - Схема строения тензиометра РАТ-1.
1-макродозирующая система, 2-капля биологической жидкости, 3-источник света, 4-объектив и видеокамера, 5-аналогово-цифровой преобразователь, 6-компьютер, 7-микродозирующая система, 8-термостатируемая ячейка.
От видеокамеры (4) сигнал поступает в видеопроцессор (5), где происходит его преобразование из аналогового в цифровой. Затем он передаётся на компьютер (6). Для определения геометрической границы капли используется метод локального порога яркости. Граница капли определяется по максимальному градиенту яркости, как функции от координаты строки изображения, а также используется полиномиальное сглаживание каждой группы из 5 последовательных точек на границе капли. Для калибровки видеоустановки используется эталонная оптическая сетка. Экспериментальная погрешность измерений поверхностного натяжения по методу висящей капли составляет около 0,1 мН/м.
Форма капли, висящей на кончике капилляра, при прочих равных условиях определяется ее размерами. Чем больше объем капли, тем в большей степени ее форма отличается от сферической. Уравнение Лапласа описывает механическое равновесие капли, как баланс действующих на каплю сил. Избыточное давление в капле жидкости, помещенной в другую жидкость или газ, определяется главными радиусами кривизны (R1 и R2) и поверхностным (межфазным) натяжением жидкости:
 (1)
(1)
где – поверхностное натяжение, P – разность давлений между фазами. В отсутствие других внешних сил, кроме гравитации, величина разности давлений может быть выражена как линейная функция высоты капли:
![]() (2)
(2)
где P0 – разность гидростатических давлений в плоскости z=0, z – вертикальная координата, – разность плотностей двух объемных фаз, g – гравитационное ускорение. Капиллярные силы стремятся сделать каплю более сферической, тогда как гравитационные, наоборот, стремятся вытянуть каплю вдоль вертикальной оси.
Таким образом, если известно поверхностное натяжение, то форма капли (главные радиусы кривизны R1 и R2) может быть определена по уравнению Лапласа (1). Определение поверхностного натяжения по форме капли также может быть осуществлено. Rottenberg с сотрудниками предложили метод, названный методом анализа формы осесимметричных капель (ADSA), в котором форма капли автоматически анализируется, оптимизируется и сравнивается с теоретическим лапласовским профилем.
Анализ тензиограмм. Зависимость ПН от «времени жизни» поверхности обусловлена неравновесным характером процессов адсорбции-десорбции поверхностно-активных веществ (липидов, белков и т.п.) на жидкой границе раздела фаз. В начальный момент времени (t=0) поверхностный слой не содержит избытка поверхностно-активных компонентов, т.е. адсорбция равна нулю, а ПН раствора и растворителя 0 одинаковы. Для большинства биологических жидкостей величина 0 близка к ПН воды и солевых растворов - 70-74 мН/м. Скорости адсорбции и понижения ПН определяются в общем случае диффузией сурфактантов к поверхности, скоростью преодоления так называемого адсорбционного барьера (электростатической, энтропийной или иной природы) и процессами перестройки адсорбированных молекул в поверхностном слое.
Многочисленные теоретические работы дополнены в последнее время теорией кинетики адсорбции без учета перестройки в поверхности, которая была разработана Уордом и Тордеем. Применение данной теории в полном виде встречает значительные затруднения вследствие интегрально-дифференциальной формы итогового уравнения (так называемое уравнение Вольтера) и необходимостью привлечения дополнительных термодинамических и кинетических соотношений. В частности, должны быть использованы уравнения изотермы адсорбции, кинетическое адсорбционное (типа уравнения Ленгмюра) и состояния поверхностного слоя. Эти уравнения были получены для случаев, когда в растворе присутствуют одно или два вещества известной природы. В случае же многокомпонентных биологических жидкостей строгий подход к решению диффузионно-кинетических проблем вряд ли возможен в настоящее время. Использование асимптотических уравнений теории кинетики адсорбции является более простым, но в то же время достаточно информативным методом анализа динамических тензиограмм.
При предельно малых временах (t0) из общего уравнения Уорда и Тордея вытекает относительно простое соотношение, которое для многокомпонентного раствора имеет вид:
 (3)
(3)
где R - газовая постоянная, T - температура, сi - концентрация поверхностно-активного компонента, Di - коэффициент диффузии, i - номер компонента, n - общее число ПАВ. Производная в левой части уравнения (3) представляет собой тангенс угла наклона прямой в координатах - t1/2. Поскольку значения коэффициентов диффузии различных ПАВ имеют одинаковый порядок величины, то соотношение (3) показывает, что тангенс угла наклона прямой от t1/2 примерно пропорционален суммарной концентрации ПАВ смеси. Начальный участок кривой хорошо аппроксимируется линейной зависимостью. Точка пересечения линейного участка с осью ординат близка к поверхностному натяжению воды (в наших опытах равна 72,7±0,3 мН/м). Как следует из теории, величина 0 определяется солевым составом биологической жидкости. Таким образом, сравнивая углы наклона динамических тензиограмм в координатах - t1/2 можно получить информацию о суммарной концентрации поверхностно-активных компонентов в исследуемом образце биологической жидкости.
Второе важное соотношение, вытекающее из теории Уорда - Тордея (так называемое уравнение Йооса - Хансена), относится к случаям предельно больших времен жизни поверхности. Расширенное для многокомпонентной системы, оно может быть записано в виде:
 (4)
(4)
где Г - величина гиббсовской (избыточной) адсорбции данного поверхностно-активного соединения.
Производная в левой части этого уравнения берется в координатах - t1/2 и рассчитывается в пределе t (т.е. t1/20). Поскольку отношение Гi/ci для многих сурфактантов является константой (так называемая константа Генри Кi = Гi/ci), то сумма в правой части уравнения (4) приближенно выражает адсорбцию всех компонентов смеси с учетом их адсорбционной активности (Ki). Таким образом, сравнивая значения производных (d/dt1/2)t для различных образцов биологических жидкостей, мы получаем информацию об изменении их состава по изменению величины адсорбции.

Рисунок 2 - Динамическая тензиограмма сыворотки крови человека в зависимости от teff1/2. Характеристика линейного участка 0=72,8 мН/м,
0=2,8 мН.м-1.с1/2
Экспериментальная зависимость имеет «квазилинейный» участок при t1/20. Точка пересечения прямой с осью ординат дает величину равновесного (т.е. приведенного к t) ДПН (). Последняя характеристика является чрезвычайно важной и может быть получена только путем экстраполяций динамической тензиограммы в координатах - t1/2.
Анализ общего решения и асимптотических уравнений для «не диффузионной» кинетики адсорбции свидетельствует, что существование адсорбционного барьера оказывает слабое влияние на выражаемую уравнением (1) зависимость от t1/2 при t, поскольку в этих условиях диффузионный поток из раствора к поверхности является наиболее медленной стадией, определяющей скорость адсорбции. В области очень коротких времен, для которых используется уравнение (3), адсорбционный барьер существует только в концентрированных растворах и поэтому им можно пренебречь в случае для биологических жидкостей человека и животных. В то же время процессы перестройки в поверхности, например, адсорбция-десорбция сегментов белковых молекул, могут замедлять кинетику адсорбции в области средних и больших времен по сравнению с диффузионным механизмом.

Рисунок 3 - Динамическая тензиограмма сыворотки крови человека
в зависимости от teff-1/2. Характеристика линейного участка: =62,9 мН/м,
=11,2 мН.м-1.с1/2.
Однако в области небольших (до 3 мН/м) понижений ДПН (малых t) процесс адсорбции макромолекул контролируется диффузией. Таким образом, уравнения (3) и (4) для биологических жидкостей могут использоваться почти без ограничений.
Результаты исследований представляются в виде тензиограмм (кривых зависимости от t), на которых определяются точки, соответствующие t=0,01 с (0) и t=1 с (1), а также равновесному ДПН (3). Кроме того, подсчитывается угол наклона кривой () в координатах (t-1/2). Значения 1, (как и 0), характеризуют как свойства растворителя, так и адсорбцию в области коротких времен, а 2 - в области средних времен жизни поверхности. Эти процессы обусловлены в основном наличием в биологических жидкостях низко и средне молекулярных поверхностно-активных веществ, тогда как для высокомолекулярных фракций (белков и других соединений) определяющими являются значения 3. При этом угол наклона прямой характеризует величину адсорбции и концентрацию основного компонента сыворотки.
4.1.2 Метод измерения активности ферментов
Для определения активности ферментов, в частности липаз, использован pH-стат - автоматический титратор фирмы “Radiometer”(Копенгаген).

Рисунок 4 - Устройство автоматического титратора фирмы “Radiometer”(Копенгаген).
Титратор состоит из 4 частей:
- Анализирующая часть pH-stat Controller
- Титрующая часть (Autoburette ABU 901), соcтоящая из бюретки со щелочью, системы шлангов и поршня для подачи щелочи в кювету с рабочим раствором.
- Воспринимающая часть (комплексный электрод).
- Персональный компьютер.
В кювету помещают 10 мл рабочего раствора субстрата и ставят на магнитную мешалку. Запускают программу титрования и после звукового сигнала добавляют 100 мкл раствора липазы или комплекса липазы с полиэлектролитами. Время титрования 10 минут, в течение которых программа Stat Talk (версия 1.2) строит график зависимости объема добавленной щелочи от времени. Активность рассчитывается по тангенсу угла наклона касательной к графику. Одна единица активности липазы соответствует 1 мкмоль уксусной кислоты, выделяющейся при ферментативном гидролизе субстрата в одну минуту. Каждую пробу измеряют по 5 раз и рассчитывают среднее значение абсолютной активности липазы. Относительная активность в % рассчитывается как отношение активности опытной пробы к активности контрольной пробы. Результаты представляют в виде таблиц и графиков.
4.1.3 Метод изучения гидролиза триглицеридов и новых липидоподобных субстратов в монослоях под действием липаз
Изучение кинетики ферментативного гидролиза липофильных субстратов, организованных в монослои на границе раздела фаз вода-воздух (как простейшей супрамолекулярной системы), постоянно привлекает внимание исследователей. Причина этому - уникальная возможность регистрировать скорость превращения субстрата, находящегося в ориентированном состоянии, характерном для липидов клеточных мембран, мицелл в биологических жидкостях и т.п.
Для изучения реакций подобного типа удобно воспользоваться установкой “пленочные весы” (называемой также “весы Ленгмюра”), широко используемой для получения и исследования монослоев ПАВ. Для проведения реакции фермент растворяют в водной фазе, находящейся в ванне “пленочных весов”, а субстрат наносят на ее поверхность в количестве, соответствующем образованию монослоя. Определение скорости ферментативного гидролиза проводят путем регистрации изменения площади, занятой субстратом на поверхности раздела фаз при заданном поверхностном давлении, с течением времени. В общем случае, гидролиз ПАВ, липидов и других липоподобных субстратов сопровождается отщеплением жирных кислот, частично растворимых в воде (по крайней мере, в области низких концентраций, достигаемых при гидролизе монослоя). Вследствие растворения продуктов гидролиза в водной фазе площадь монослоя ПАВ уменьшается. Характерно, что вместе с этим уменьшается и количество фермента, контактирующего с монослоем. Наложение двух указанных процессов приводит к получению интегральной кинетической кривой, математическая обработка которой довольно сложна. Для упрощения расчетов было предложено использовать “пленочные весы”, состоящие из двух отсеков, соединенных неглубоким каналом, так что монослой в обоих отсеках представляет собой единое целое, а водные фазы существенно разъединены. Указанная конструкция позволяет регистрировать скорость ферментативной реакции, протекающей при постоянном количестве контактирующих фермента и субстрата, что облегчает обработку данных.
В рамках проекта предложен альтернативный подход к изучению кинетики ферментативного гидролиза в однокюветных «пленочных весах», основанный на регистрации его начальных скоростей, подобно тому как это принято для реакций, протекающих в гомогенной среде.
Основным направлением работы явилось сравнительное изучение кинетики ферментативного гидролиза новых поверхностно-активных производных глицерина и некоторых аминокислот, которые являются удобными липофильными субстратами для выяснения особенностей механизма действия липаз. В ряду гидролитических ферментов липазы (ЕС 3.1.1.3) занимают особое место ввиду того, что липиды, их природные субстраты, сильно ассоциированы в водной среде и активация фермента происходит именно в контакте с границей раздела фаз. Известно, что адсорбция липаз на гидрофобных носителях часто увеличивает каталитическую активность фермента. В связи с этим представляет интерес изучение взаимодействия липазы Pseudomonas fluorescens с монослоями ориентированных субстратов, а также влияния строения их молекул на каталитическую активность фермента.
Методическая часть.
Синтез липофильных субстратов – производных глицерина и следующих аминокислот: валина (Val-PG), лейцина (Leu-PG) и фенилаланина (Phe-PG) был проведен на кафедре органической химии Университета г. Вупперталь (ФРГ) под руководством проф. М. Шнайдера, субстраты были исследованы под руководством автора и описаны в совместной работе. В общем виде схема синтеза приведена ниже:

Схема 1 - Общая схема синтеза липофильных субстратов на основе глицерина и аминокислот.
На первом этапе синтеза проводилась ферментативная этерификация глицерина двухкратным молярным избытком винилового эфира лауриновой кислоты в присутствии 1,3-sn-специфической липазы. На втором этапе свободная гидроксильная группа в положении 2 у полученного 1,3-sn-дилаурина реагировала с N-BOC-защищенной аминокислотой в присутствии дициклогексилкарбодиимида (DCC) и каталитических количеств N,N-диметил-4-аминопиридина (DMAP). Реакция проводилась в дихлорметане. После окончания реакции N-BOC-защитную группу снимали обработкой продукта сначала трифторуксусной кислотой, а затем - соляной кислотой, с образованием гидрохлорида соответствующей аминокислоты. Таким образом были получены три новых псевдоглицерида – гидрофобных производных аминокислот: валина (Val-PG), лейцина (Leu-PG) и фенилаланина (Phe-PG).
 |
| Рисунок 5 - Схематическое изображение супрамолекулярных систем молекул субстрата и липазы из бактерий Pseudomonas fluorescens. |
В работе использовали препарат липазы из бактерий Pseudomonas fluorescens молекулярной массы 33000 Да (фирма «RHM Pharma», ФРГ), который очищали следующим образом: 40 мг фермента растворяли в 2 мл 10 мМ КН2РО4 (рН 7,0) при перемешивании и охлаждении льдом на магнитной мешалке в течение 1 ч, после чего отделяли раствор от нерастворимых примесей фильтрованием. Активность фермента определяли в реакции гидролиза 2 %-го раствора триацетина в 0,05М CaCl2, 0,05M NaCl (pH 7,0) путем титрования выделяющейся уксусной кислоты 0,01М раствором NaOH на автоматическом титраторе ТТТ 80 (Radiometer Copenhagen, Дания). Содержание белка в полученном растворе определяли по методу Бредфорда и использовали при расчете каталитических констант. Перед экспериментами в монослоях 10 мкл раствора липазы переносили в водную субфазу весов Ленгмюра и тщательно перемешивали.
Монослои указанных липофильных субстратов и трилаурина были получены и исследованы на установках "Lauda FW2" (ФРГ) и NIMA (Англия), работающих по принципу Ленгмюра и Вильгельми, соответственно. 10-50 мкл 10 мМ раствора трилаурина в хлороформе наносили на поверхность раздела водная субфаза/воздух. Водная субфаза представляла собой 10 мМ фосфатный буфер с рН 7,0, содержащий свежеприготовленный раствор липазы. Изотермы поверхностное давление () - площадь на молекулу (А) записывали при сжатии монослоя с постоянной скоростью 10 см2/мин.
Из серии последовательных нанесений и удалений монослоя трилаурина на одной и той же водной субфазе был определен коэффициент распределения фермента между монослоем и субфазой. Более подробно указанные эксперименты описаны при обсуждении результатов.
Кинетику ферментативного гидролиза трилаурина и липофильных субстратов, организованных в монослои на границе раздела фаз вода-воздух, проводили при постоянном поверхностном давлении 10 мН/м. Реакцию проводили на “пленочных весах” обычного типа, состоящих из одного отсека (“ванны”). Как показано на рис.7, при конверсии субстрата в пределах 10-15 % площадь монослоя линейно уменьшается с течением времени, что дает возможность надежно измерять начальную скорость реакции в широком диапазоне ее значений (правая “ветвь” кривой на рис.7а). Начальный участок представленной зависимости площади монослоя от времени гидролиза (левая “ветвь” кривой на рис.7б) отвечает уравновешиванию монослоя в течение нескольких минут после приложения к нему постоянного поверхностного давления.
 |
| Рисунок 6 - Зависимости длины монослоя от времени, полученные в процессе ферментативного гидролиза трилаурина при концентрации липазы 1.7*10-10 М (а) и зависимость начальной скорости гидролиза (Vi) от количества последовательных нанесений трилаурина (i) в монослой над раствором фермента (б). |
Величину I (объем монослоя) вычисляли, умножая площадь монослоя на его толщину, принятую за 1,5 нм. Площадь монослоя рассчитывали, умножая его начальную длину на ширину ванны. Начальную длину монослоя определяли путем экстраполяции линейного участка зависимости длины монослоя к оси ординат (см. рис.6а). Далее, зная объем ванны V (для установок Landa и NIMA, 0,7 дм3 и 1 дм3, соответственно), рассчитывали отношение I/V, которое важно для решения кинетических задач, представленных ниже.
Параметры монослоев липофильных субстратов.
Обнаружено, что все синтезированные липофильные субстраты (Val-PG, Leu-PG и Phe-PG), а также трилаурин способны образовывать стабильные монослои на границе раздела вода/воздух (рис. 7).
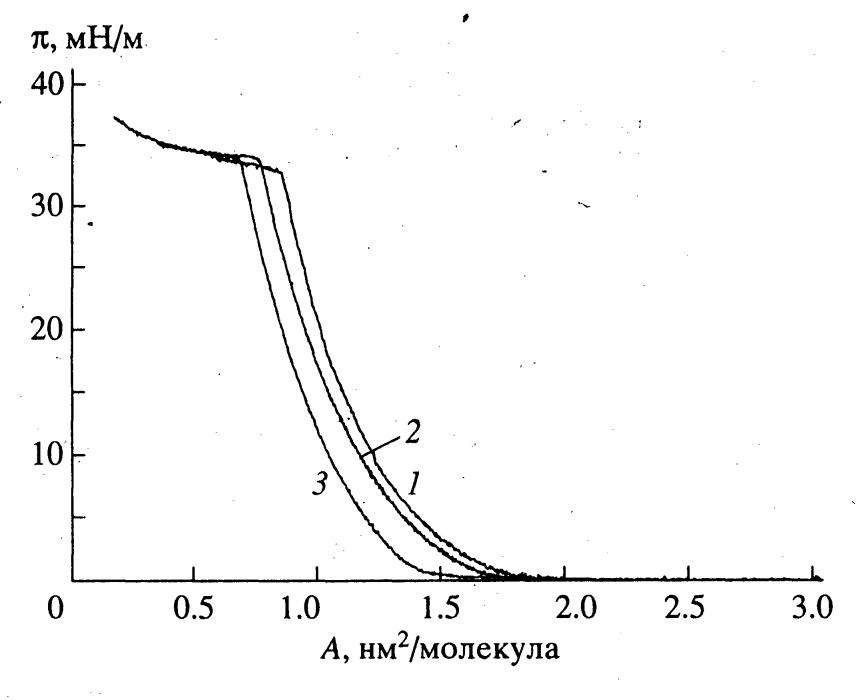 |
| Рисунок 7 - Изотермы поверхностное давление – площадь, приходящаяся на молекулу, для монослоёв псевдоглицеридов: Val-PG (1), Leu-PG (2), Phe-PG (3) на границе раздела вода-воздух (температура 18С). |
Как видно из рис.7, изотермы зависимости поверхностного давления от площади на молекулу для всех синтезированных липофильных субстратов в монослое качественно подобны: имеют практически одинаковый наклон и протяженный "квазилинейный участок", что свидетельствует о наличии только одного жидко-конденсированного состояние монослоя. Средние значения давлений коллапса монослоя (33-34 мН/м) для всех указанных соединений позволяют говорить об их относительной устойчивости на границе раздела вода/воздух. При давлении коллапса монослоя минимальные площади на молекулу для производных псевдогицеридов (Val-PG, Leu-PG и Phe-PG) составляют 0,85 нм2, 0,76 нм2 и 0,68 нм2. При этом величина площади на молекулу для Phe-псевдоглицерида, имеющего два лауриновых и объемистый гидрофобный фенилаланиновый заместители, практически равна утроенной площади сечения на молекулу жирных кислот в монослое (0,22 нм2), что указывает на плотную упаковку молекул в слое. Увеличение площади на молекулу для Leu- и Val-псевдогицеридов, что свидетельствует о соответствующем уменьшении степени упорядоченности молекул в монослое, коррелирует с уменьшением длины третьего гидрофобного заместителя. Аналогичная последовательность значений площади на молекулу в монослое: 1,23 нм2, 1,17 нм2 и 1,05 нм2 (рис.7) наблюдается для указанных псевдоглицеридов (Val-PG, Leu-PG и Phe-PG) и в случае поверхностного давления 10 мН/м (выбор этого давления был обусловлен тем, что именно при этом поверхностном давлении начинается протяженный квазилинейный участок на изотерме, и осуществляли изучение кинетики гидролиза монослоя указанных субстратов липазой из водной субфазы).
 |
| Рисунок 8 - Модель ферментативного гидролиза триглицеридов и псевдоглицеридов в монослое. I – объем субстрата в монослое, V – объем водной фазы. |
Для описания кинетики ферментативного гидролиза нами использована простейшая модель, представленная на рис.8. Ориентированный в монослой субстрат находится на поверхности водной фазы и занимает объем I. Фермент распределен между водной фазой объемом V и монослоем субстрата. В нашей кинетической модели, молекула фермента, контактирующая с монослоем, немедленно образует фермент-субстратный комплекс. Отметим, что большинство известных из литературы моделей взаимодействия молекулы фермента с монослоем субстрата учитывает стадию перехода фермента в сорбированное состояние и лишь затем - образование фермент-субстратного комплекса. Это необходимо учитывать только при медленной сорбции фермента, когда ее скорость определяет скорость ферментативной реакции в целом, что приводит к появлению предстационарных эффектов: вначале реакция идет медленно, постепенно увеличивая скорость (lag period). В нашем случае, как следует из рис.6, такие эффекты отсутствуют.
Еще одно отличие нашей модели от цитированных выше заключается в том, что концентрация субстрата в монослое выражается в объемных величинах, а не в количестве молекул на единицу поверхности. Для изученных 1,3-дилаурил-псевдоглицеридов и трилаурина толщина монослоя была принята равной 1,5 нм, на основании ряда литературных данных. В этом случае начальная скорость химической реакции, регистрируемая в пределах 10%-ной конверсии субстрата, вычисляется по формуле:
Такой расчет скорости реакции дает возможность получить эффективные значения kкат и Км(каж) в привычных размерностях (с-1 и М, соответственно). В соответствии со схемой, представленной на рис. 8, запишем уравнения материального баланса для фермента и субстрата, условие стационарности ([ES]=const) и уравнение скорости реакции:

При [P] 0 получим следующее выражение для начальной скорости:
(6)
В выбранных нами условиях концентрация фермента [E]o варьируется от 0,75. 10-11 до 3,40. 10-10 М, а отношение ![]() составляет 1,4-1,8. 10-7. Поскольку объемная концентрация субстрата [S]o для всех изученных веществ близка к 1,0 М, вкладом слагаемого [E]o в знаменателе правой части уравнения (6) следует пренебречь. Легко заметить, что в таком виде из экспериментально полученной зависимости vo от [E]o невозможно раздельно получить константы kкат и
составляет 1,4-1,8. 10-7. Поскольку объемная концентрация субстрата [S]o для всех изученных веществ близка к 1,0 М, вкладом слагаемого [E]o в знаменателе правой части уравнения (6) следует пренебречь. Легко заметить, что в таком виде из экспериментально полученной зависимости vo от [E]o невозможно раздельно получить константы kкат и ![]() . Для определения kкат воспользуемся следующим методическим подходом. При заданной концентрации фермента определим начальную скорость гидролиза, подобно тому, как представлено на рисунке 6. Затем при постоянном поверхностном давлении удалим монослой с поверхности водной фазы при помощи шприца. Конечно, при этом удаляется и часть водной фазы, но она невелика (не более 0,5 % от общего объема) и ей можно пренебречь. Нанесем на поверхность новый монослой и вновь определим начальную скорость гидролиза (v1). Повторим эту операцию несколько раз. Очевидно, что в каждом цикле количество фермента, равное [ES].I, удаляется с поверхности водной фазы. После первого цикла общая концентрация фермента в системе [E]1 составит:
. Для определения kкат воспользуемся следующим методическим подходом. При заданной концентрации фермента определим начальную скорость гидролиза, подобно тому, как представлено на рисунке 6. Затем при постоянном поверхностном давлении удалим монослой с поверхности водной фазы при помощи шприца. Конечно, при этом удаляется и часть водной фазы, но она невелика (не более 0,5 % от общего объема) и ей можно пренебречь. Нанесем на поверхность новый монослой и вновь определим начальную скорость гидролиза (v1). Повторим эту операцию несколько раз. Очевидно, что в каждом цикле количество фермента, равное [ES].I, удаляется с поверхности водной фазы. После первого цикла общая концентрация фермента в системе [E]1 составит: ![]() , а после i-го цикла
, а после i-го цикла ![]() . Логарифмируя последнее уравнение, получим
. Логарифмируя последнее уравнение, получим ![]() . Поскольку vo прямо пропорционально [E]o, можно записать:
. Поскольку vo прямо пропорционально [E]o, можно записать: ![]() .
.
Из зависимости lnvi от i были определены значения k, равные 0,92 для Phe-псевдоглицерида и 0,93 для трилаурина. Таким образом, 7-8% от внесенного в водную фазу фермента концентрируется в монослое, объем которого в миллионы раз меньше объема водной фазы!
 | |
| Рисунок 9а - Зависимость начальной скорости ферментативного гидролиза липофильных субстратов в монослое при поверхностном давлении 10 мН/м от концентрации липазы. Субстраты: Phe-PG (1), трилаурин (2). | |
 | |
| Рисунок 9б - Зависимость начальной скорости ферментативного гидролиза липофильных субстратов в монослое при поверхностном давлении 10 мН/м от концентрации липазы. Субстраты: Val-PG (1), Leu-PG (2). | |
Учитывая, что ![]() , получим
, получим
Перепишем уравнение (6) в виде:
Экспериментально полученные зависимости vo от [E]o представлены на рис. 9(а и б), из которых следует, что предложенная нами кинетическая схема описывает процесс ферментативного гидролиза в монослоях лишь приблизительно. В пределах ошибки эксперимента скорость химической реакции монотонно возрастает с увеличением концентрации фермента, но не является ей строго прямо пропорциональной. При больших концентрациях [E]0 v0, по-видимому, стремится к предельному значению, по крайней мере, в реакции гидролиза трилаурина. Указанное явление не может быть описано уравнением (6), поскольку, повторим, ![]() . Одним из возможных объяснений является присутствие в препарате фермента большого количества примесей, способных влиять на связывание фермента с монослоем.
. Одним из возможных объяснений является присутствие в препарате фермента большого количества примесей, способных влиять на связывание фермента с монослоем.
В области малых концентраций фермента (и примесей) указанное влияние слабее, в связи с чем значение kкат определяли согласно уравнению (8) из начальных участков кривых (см. табл.1). Приравнивая правые части уравнений 6 и 8, получим выражение для определения KM(каж):
Таблица 1 - Концентрации трилаурина и псевдоглицеридов в монослоях и кинетические параметры их ферментативного гидролиза.
| Субстрат | [S]o, М | kкат, с-1 * | Км(каж) 10-6, М |
| Трилаурин | 0,97 | 4 | 1,9 |
| Phe-псевдоглицерид | 0,81 | 11 | 1,7 |
| Leu-псевдоглицерид | 0,94 | 7 | 1,9 |
| Val-псевдоглицерид | 0,97 | 13 | 2,0 |
* - ошибка измерений ±2.
Поскольку концентрации субстратов [S]0 в монослоях нам известны, а соответствующие значения кажущихся констант Михаэлиса определены нами впервые и приведены в таблице 1, то из уравнения (7) можно непосредственно определить концентрацию фермент-субстратного комплекса в монослое трилаурина, равную 9.10-6 М при исходной концентрации фермента в растворе 1,7.10-7 М (см. подпись к рис.7). Зная объем монослоя, можно вычислить поверхностную концентрацию [ES]*, равную приблизительно 8 молекул/мкм2. Другими словами, площадь монослоя, приходящаяся на 1 молекулу фермента в условиях эксперимента в несколько сотен раз превышает площадь сечения самой молекулы фермента.
Из данных таблицы 1 следует, что величина каталитической константы ферментативного гидролиза (kкат) приблизительно соответствует константе, найденной ранее для некоторых эмульгированных субстратов. Например, при гидролизе трибутирина, под действием липазы Rhizopus oryzae, в эмульсии, стабилизированной поливиниловым спиртом, kкат = 5 с-1 и KM(каж) = 2.610–3 М, при этом на величины кинетических констант сильно влияют процессы эмульгирования субстрата. В отсутствии эмульгатора kкат становится ниже, а Км(каж) выше приведенных значений. Отметим, что сравнение вышеприведенных констант с найденными в данной работе носит приблизительный характер и показывает лишь примерное соответствие величин, полученных двумя различными способами.
Значения каталитических констант kкат, полученных нами впервые, свидетельствуют о более высоких скоростях превращения синтетических 1,3-дилаурилпсевдоглицеридов по сравнению с трилаурином. Этот, абсолютно новый и неожиданный результат можно объяснить особенностями строения псевдоглицеридов. содержащих в положении 2 остаток аминокислоты и, следовательно, алифатическую аминогруппу, протонированную в условиях проведения реакции (рН 7,0). Электростатическое взаимодействие положительно заряженного субстрата с молекулой липазы Pseudomonas fluorescens, содержащей большое количество карбоксильных групп аспарагиновой (33 остатка) и глутаминовой (24 остатка) кислот, может приводить к снижению свободной энергии переходного состояния реакции образования ацилированного фермента, что является ключевым условием эффективности ферментативного катализа.
Особенно важно то, что вопрос о соответствии параметров ферментативных реакций, протекающих в монослоях водонерастворимых субстратов и в их эмульсиях, который до наших работ оставался «открытым» впервые нашел свое принципиальное решение в данной работе. В ходе исследований нами предложен оригинальный подход к определению параметров ферментативного гидролиза липидоподобных субстратов, организованных в мономолекулярные слои на границе раздела фаз. Это дает возможность дальнейшего изучения химических превращений субстратов подобного типа под действием липаз в монослоях и в объеме и сопоставления количественных характеристик этих реакций.
Таким образом, предложен простой метод определения параметров ферментативного гидролиза липидоподобных субстратов и трилаурина, организованных в монослои на поверхности раздела фаз. Метод основан на определении начальной скорости реакции по уменьшению площади монослоя субстрата, происходящем при его гидролизе под действием фермента, растворенного в водной субфазе однокюветных весов Ленгмюра, при поверхностном давлении 10 мН/м. Указанным методом определены каталитические константы kкат и кажущиеся константы Михаэлиса Км(каж) ферментативного гидролиза трилаурина и трех 1,3-дилаурил-псевдоглицеридов, ацилированных в положение 2 аминокислотами (фенилаланином, лейцином и валином) под действием липазы из Pseudomonas fluorescens. В отличие от моделей ферментативного гидролиза, пренебрегающих толщиной монослоя субстрата, предложенный метод позволяет получить кинетические константы в привычных размерностях. Установлено, что при близких значениях Км(каж) около 2.10 –6 M, значения kкат заметно выше для синтетических псевдоглицеридов (7 – 13 с–1), чем для трилаурина (4 с–1), что может быть связано с наличием в их молекулах положительно заряженных первичных аминогрупп.
4.1.4 Использование роторного испарителя для получения липосом

Рисунок 10 - Роторный испаритель IKA®RV 10 basic.
Основное назначение роторного испарителя - дистилляция (процесс термического разделения жидких соединений на основе разности их температур кипения с последующей конденсацией отогнанного растворителя). Однако он с успехом может использоваться и для других целей, например – для последующего создания липосом.
Получение, свойства и возможности применения липосом описаны в ряде монографий и обзоров, поэтому здесь эти вопросы будут рассмотрены кратко с использованием конкретных примеров.
В самом общем случае, к липосомам можно отнести любые типы липидных дисперсий, состоящих из «сферически замкнутых» липидных частиц с внутренним водным содержимым. В зависимости от числа сферических липидных оболочек (каждая оболочка представляет собой один бислой) в такой частице выделяют 1) моноламеллярные липидные дисперсии или липосомы, содержащие один липидный бислой (иногда их называют везикулы или моноламеллярные везикулы) и 2) мультиламеллярные липидные дисперсии или мультиламеллярные везикулы, содержащие набор липосом с различным числом липидных бислоев в оболочках (но более одного). Последний тип липосом получается самопроизвольно при «механическом диспергировании» (встряхивании рукой или на механическом «шейкере») фосфолипидов в воде и собственно был впервые предложен в качестве модели биомембран в 1965 году английским биохимиком и биофизиком Бэнгхемом. В настоящее время с этой целью мультиламеллярные везикулы используется редко (из-за сложности их внутренней организации, что затрудняет анализ результатов) и по этим же причинам, широко используются моноламеллярные везикулы.
В последнее время различают малые моноламеллярные везикулы (ММВ) с диаметром от 20 до 50 нм и большие моноламеллярные везикулы (БМВ) с диаметром от 50 до 500 нм.
Малые моноламеллярные везикулы
Для получения малых моноламеллярных везикул (ММВ) чаще всего используют ультразвуковую обработку водных дисперсий фосфолипидов при постоянной температуре в течение определенного времени (чем дольше проводится так называемое «озвучивание», тем меньше средние размеры ММВ и разброс по диаметру частиц). После этого ММВ фракционируют по размерам методом гельпроникающей хроматографии или центрифугированием в градиенте глицерола с получением практически монодисперсных частиц. Например, из фосфатидилхолина куриного яйца можно получить таким образом ММВ с гидродинамической молекулярной массой 1,88106, диаметр наружного монослоя 19,8 нм, диаметр внутреннего монослоя 12,2 нм, толщина наружного монослоя 2,1 нм, толщина внутреннего монослоя 1,6 нм, площадь поверхности на «полярную голову» в наружном монослое 0,74 нм2 (во внутреннем монослое 0,61 нм2): поперечное сечение ацильных цепей в центре бислоя в наружном монослое 0,46 нм2 (во внутреннем монослое 0,97 нм2), толщина гидрофобной области бислоя 3,7 нм, число липидных молекул в наружном монослое 1658 (во внутреннем монослое 790).
Большие моноламеллярные везикулы
Для получения больших моноламеллярных везикул (БМВ) чаще всего используются следующие методы.
Диализ от детергента или разбавление растворов липида и детергента. Вначале избытком детергента диспергируют липиды (или липид-белковую смесь), а затем концентрацию детергента уменьшают (диализом, удалением или просто разбавлением) до уровня, при котором липиды начинают самопроизвольно формировать везикулы с достаточно большим внутренним водным объемом (от 5 до 20 л/моль). Причем средние размеры БМВ зависят как от типа детергента, так и от скорости его удаления. Например, с помощью октилглюкозида получают БМВ достаточно крупного размера (диаметром от 100 до 200 нм), тогда как при использовании холатов получают БМВ относительно небольшого размера (диаметром от 50 до 80 нм).
Методы слияния объединяют несколько подходов, основанных на слиянии ММВ до образования БМВ. Например, повторные операции замораживания-оттаивания, особенно удобные для реконструкции ряда мембранных белков, а также использование ионов кальция для слияния ММВ, содержащих фосфатидилсерин.
Обращенно-фазовое упаривание и инфузия, т.е. методы, связанные с использованием неполярных растворителей. Например, введение эфирного раствора липида в теплую воду вызывает мгновенное испарение органического растворителя и образование БМВ. Однако эти методы непригодны для получения смешанных липид-белковых липосом из-за возможной денатурации белков в неполярных растворителях и при повышенной температуре.
Добавление фосфатидилхолинов с короткими цепями в количестве до 20% от общего содержания липидов приводит к переходу мультиламеллярных липидных дисперсий в стабильные БМВ.
Добавление жирных кислот или детергентов при определенных условиях вызывает слияние ММВ с образованием БМВ.
Быстрая экструзия мультиламеллярных липидных дисперсий через поликарбонатные фильтры приводит к образованию БМВ с диаметром 60-100 нм в зависимости от условий процесса.
Для отдельных классов липидов можно использовать свои методы, например, кратковременное повышение рН мультиламеллярных липидных дисперсий фосфатидной кислоты может приводить к образованию как ММВ, так и БМВ.
4.2 Анализ результатов по динамическому поверхностному натяжению и по каталитическим свойствам липаз в присутствии полиэлектролитов.
4.2.1 Влияние полиэлектролитного окружения на активность липаз из поджелудочной железы свиньи и гриба Mucor javanicus
Для изучения влияния полимеров на активность липаз были взяты разнозаряженные полиэлектролиты. Na-полистиролсульфонат (ПСС) – как полианион, полидиаллилдиметиламмоний хлорид (ПАМА) – как поликатион. Полиэлектролиты таких типов находят широкое применение в химических технологиях (как флокулянты для очистки воды), в медицине и бионанотехнологиях (формирование полиэлектролитных оболочек на коллоидных частицах различной природы для получения микрокапсул, получение нанотрубок, лечение гиперкалиемии и т.д.). Белковые молекулы ферментов являются полиамфолитами, так как входящие в их состав аминокислоты могут быть заряжены как положительно (лизин, аргинин, гистидин), так и отрицательно (аспарагиновая и глутаминовая кислоты). Поэтому на поверхности белков в нейтральных средах присутствуют как положительные, так и отрицательные заряды. В связи с такой особенностью строения белковых молекул, с их полипептидной цепью могут взаимодействовать соединения, содержащие ионогенные группы, в том числе и полиэлектролиты. Результатом такого взаимодействия является образование нековалентных белок-полиэлектролитных комплексов.
Активность липазы из поджелудочной железы свиньи и липазы из гриба Mucor javanicus была измерена в присутствии ПАМА и ПСС в соотношениях липаза : полимер 1:1, 1:10, 1:100 при рН 7,0 и t 25 С. Активность липаз без полиэлектролитов была принята за 100 %.
Было установлено, что такие комплексы образуются спонтанно при смешении компонентов и существуют, главным образом, за счет электростатических взаимодействий между противоположно заряженными группами белка и полииона. Главными условиями проявления активационного и стабилизационного эффектов являются наличие электростатических контактов между компонентами комплекса и растворимость фермент-полиэлектролитных комплексов в воде (при их приготовлении). Такой растворимостью обладают комплексы нестехиометрического состава, в которых большая часть заряженных групп полиэлектролита не вовлечена во взаимодействие с противоположно заряженными группами белка. Увеличение числа контактов при образовании фермент-полиэлектролитного комплекса приводит к его упрочнению, и тем самым, обеспечивает повышение устойчивости фермента к инактивации различными факторами. Стабильность белок-полиэлектролитных комплексов может быть обусловлена гидрофобными взаимодействиями или водородными связями, возникающими вследствие неионных взаимодействий между молекулами белка и неполярными участками полиэлектролита. Благодаря этим взаимодействиям образование белок-полиэлектролитных комплексов может происходить даже при таких значениях pH, при которых знаки заряда белковых глобул и цепей полиэлектролитов совпадают.
Активность липазы из поджелудочной железы свиньи в присутствии ПСС при соотношениях 1:10 и 1:100 различалась незначительно (117 и 115 %, соответственно) и была максимальной, что может быть связано с увеличением микрогетерогенности системы в результате взаимодействия липазы с полиэлектролитом. В то же время использование эквимолярной смеси липаза:ПСС (1:1) приводит к значительному уменьшению активности липазы (до 23%), поскольку недостаточно ПСС для образования микрогетерогенной границы раздела фаз.
В присутствии ПАМА наивысшая активность панкреатической липазы наблюдалась при соотношении липаза : полимер равное 1:10 (94%). Присутствие ПАМА в соотношении 1:10 незначительно уменьшает активность липазы по сравнению с контролем (на 6%). Это может быть связано с тем, что отрицательно заряженная при нейтральных значениях рН липаза в процессе комплексообразования оказывается расположенной внутри глобулы положительно заряженного полимера и становится менее доступной для субстрата.
Это подтверждается тем, что при увеличении концентрации ПАМА в смеси с липазой до 1:100 происходит значительное уменьшение активности до 44% по сравнению с эквимолярной системой (при 1:1 активность составила 73%). Это свидетельствует о значительном экранировании активных центров липазы при связывании с избытком положительно заряженного ПАМА.
Максимальная активность липазы из гриба Mucor javanicus наблюдалась в присутствии ПАМА при соотношении 1:100 (116%), а в присутствии ПСС при соотношении 1:1 (152%). Увеличение активности липазы из Mucor javanicus с увеличением концентрации положительно заряженного ПАМА относительно фермента (от 96 % при соотношении 1:1 до 116 % при соотношении 1:100) связано прежде всего с удалением отрицательно заряженных жирных кислот из реакционной смеси путем электростатического взаимодействия с полиэлектролитом и сдвигом равновесия в сторону образования продуктов реакции. Увеличение активности липазы на 52 % в случае эквимолярного соотношения фермента с ПСС можно объяснить закреплением каталитически выгодной конформации фермента в комплексе с ПСС.
Таким образом, активность липазы существенно зависит от заряда полиэлектролита и от концентрации его относительно фермента. Наилучшими для липазы из поджелудочной железы свиньи являются системы с ПСС 1:10 и 1:100, для липазы из Mucor javanicus – системы с ПАМА 1:100 или ПСС 1:1.
4.2.2 Изучение динамического поверхностного натяжения систем липазы из поджелудочной железы свиньи с природными и синтетическими полиэлектролитами
Для оценки взаимодействия липазы с полиэлектролитами в растворе и на границе раздела фаз вода/воздух было исследовано динамическое поверхностное натяжение (ДПН) подобных комплексов при различных соотношениях липаза : полиэлектролит. Изучение динамического поверхностного натяжения может дать ценную информацию для понимания механизмов адсорбции молекул на границе раздела фаз, что особенно важно для данных исследований, поскольку известно свойство липаз активироваться на границе раздела фаз масло/вода и гидрофобных поверхностях. Известно, что слишком низкое поверхностное давление, то есть, слишком высокое поверхностное натяжение, может привести к необратимой денатурации липазы, а очень высокое поверхностное давление (низкое поверхностное натяжение) уменьшает активность липазы в результате недоступности субстрата к активному центру липазы.
Впервые исследовано динамическое поверхностное натяжение раствора липазы в присутствии природного полимера – бычьего сывороточного альбумина, а также в присутствии синтетических полиэлектролитов – положительно заряженных полилизина и полидиаллилдиметиламмоний хлорида, и отрицательно заряженных – полиглутаминовой кислоты и полистиролсульфоната натрия.
4.2.3 Измерение динамического поверхностного натяжения растворов липазы из поджелудочной железы свиньи в смеси с полистиролсульфонатом натрия
Поверхностное натяжение раствора липазы из поджелудочной железы свиньи было измерено в присутствии отрицательно заряженного синтетического полимера полистиролсульфоната натрия (ПСС) при молярных соотношениях липаза : ПСС 1:100, 1:10, 1:1, 10:1, 100:1 (рис. 11-16).
 |
| Рисунок 11 - Зависимость поверхностного натяжения раствора ПСС от времени существования поверхности. |
 |
| Рисунок 12 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:1 от времени существования поверхности. |
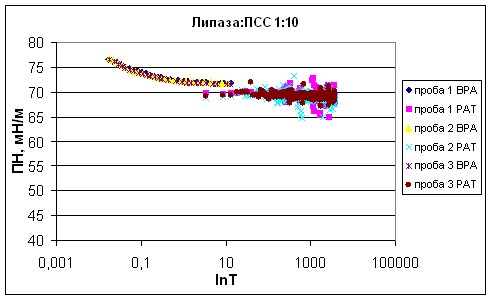 |
| Рисунок 13 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:10 от времени существования поверхности. |
 |
| Рисунок 14 - Зависимость поверхностного натяжения смеси липаза : ПСС 1:100 от времени существования поверхности. |
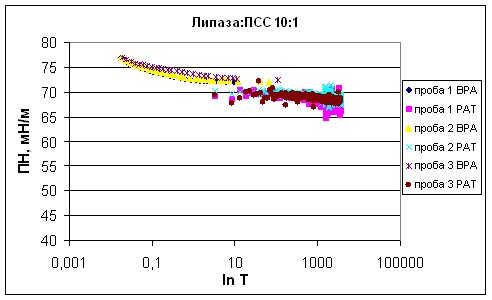 |
| Рисунок 15 - Зависимость поверхностного натяжения смеси липаза : ПСС 10:1 от времени существования поверхности. |
 |
| Рисунок 16 - Зависимость поверхностного натяжения смеси липаза : ПСС 100:1 от времени существования поверхности. |
Из полученных тензиограмм были рассчитаны показатели поверхностного натяжения в динамике (табл. 2). При коротких временах существования поверхности 0,01 и 0,1 с ПН растворов ПСС и смесей липаза : ПСС в различных соотношениях близко к ПН воды и незначительно изменяется от 75,73±0,11 до 78,21±0,15 мН/м (эти значения соответствуют ПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм увеличивается на 3-5 мНм-1с1/2 при добавлении ПСС к раствору липазы.
Полистиролсульфонат натрия является поверхностно неактивным соединением, как и все остальные полиэлектролиты. Его ПН соответствует динамическому поверхностному натяжению воды, и лишь незначительно ниже при длинных временах существования поверхности. При длинных временах существования поверхности 4 раствора липазы меньше, чем ПН раствора ПСС на 26 мН/м.
При временах жизни 1 и 100 с различия в 2 и 3 смесей липаза : ПСС еще не видны. ПН изменяется от 70,61±0,33 до 73,00±0,17 мН/м.
Таблица 2 - Показатели поверхностного натяжения смеси липаза:ПСС при различных временах существования поверхности 0,01 с (0), 0,1 с (1), 1 с (2), 100с (3) и 3500 c (4), а также углы наклона тензиограмм (0, 1).
| Соотношение липаза:ПСС | 0 | 1 | 2 | 3 | 4 | 0 | 1 |
| 0:1 | 77,71 ±0,17 | 77,95 ±0,21 | 72,30 ±0,04 | 71,68 ±0,08 | 69,18 ±0,11 | 10,27 ±0,27 | 0,95 ±0,14 |
| 1:100 | 77,53 ±0,50 | 77,59 ±0,47 | 72,34 ±0,14 | 71,84 ±0,23 | 68,76 ±0,66 | 10,38 ±0,46 | 0,68 ±0,11 |
| 1:10 | 77,32 ±0,07 | 77,46 ±0,11 | 71,95 ±0,16 | 71,52 ±0,15 | 68,71 ±0,06 | 10,24 ±0,39 | 0,39 ±0,07 |
| 1:1 | 77,10 ±0,57 | 77,30 ±0,63 | 72,01 ±0,17 | 71,18 ±0,10 | 66,61 ±0,74 | 9,27 ±1,01 | 0,63 ±0,13 |
| 10:1 | 77,42 ±0,19 | 77,55 ±0,06 | 72,81 ±0,63 | 71,92 ±0,31 | 67,28 ±0,58 | 8,62 ±0,17 | 0,89 ±0,08 |
| 100:1 | 77,97 ±0,14 | 78,21 ±0,15 | 73,00 ±0,17 | 72,03 ±0,27 | 54,98 ±3,16 | 9,67 ±0,32 | 1,72 ±0,21 |
| 1:0 | 75,73 ±0,11 | 76,73 ±0,16 | 71,68 ±0,06 | 70,61 ±0,33 | 42,86 ±1,18 | 5,32 ±0,46 | 1,19 ±0,60 |

