Биохимические механизмы повреждения мужской репродуктивной системы при действии полихлорированных бифенилов и фармакологическая коррекция выявленных нарушений (экспериментальное исследование)
На правах рукописи
Аглетдинов Эдуард Феликсович
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ
МУЖСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ ПРИ ДЕЙСТВИИ ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ И ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ ВЫЯВЛЕННЫХ НАРУШЕНИЙ
(экспериментальное исследование)
03.01.04 – биохимия
14.03.06 – фармакология, клиническая фармакология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Уфа - 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научные консультанты: Заслуженный деятель науки РФ
доктор медицинских наук, профессор
Камилов Феликс Хусаинович
Заслуженный деятель науки РФ
доктор медицинских наук, профессор
Алехин Евгений Константинович
Официальные оппоненты:
член-корреспондент РАМН,
доктор медицинских наук, профессор,
Терентьев Александр Александрович
Заслуженный деятель науки РФ,
доктор медицинских наук, профессор
Гильмиярова Фрида Насыровна
доктор медицинских наук, профессор
Юшков Владимир Викторович
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Российский университет дружбы народов»
Защита состоится « »______________________ года в ___ час. на заседании диссертационного совета Д 208.006.03 при Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан « » _______________________ г.
Ученый секретарь
диссертационного совета Мирсаева Г.Х.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Демографическая ситуация в России, несмотря на некоторую стабилизацию, наметившуюся в последние годы, продолжает оставаться неблагоприятной. Сохраняющиеся негативные тенденции представляют угрозу интеллектуальному, трудовому, культурному и оборонному потенциалу страны.
Доля семей на территории РФ, неспособных иметь детей составляет 15-19%, тогда как критическим уровнем считается 15%, при котором бесплодие следует рассматривать в качестве фактора, значительно влияющего на демографические показатели в стране (ВОЗ, 1999; Артифексов С.Б. и др., 2003). Основой государственной стратегии преодоления демографического кризиса является Концепция демографической политики Российской Федерации до 2025 года, в которой вопросам сохранения и восстановления репродуктивного здоровья мужчин впервые отведено особое внимание [Указ Президента РФ № 1351 от 9 октября 2007]. Удельный вес «мужского фактора» в семейном бесплодии за последние годы изменился с 30% до 50% и продолжает расти [Пшеничникова Т.Я., 1991; Селезнева И.Ю., 1999; Леонов Б.В., 2000; Тер-Аванесов Г.В., 2004; Кулаков В.И., 2005; Sigman M., 2009]. По данным научного Центра акушерства, гинекологии и перинатологии им. В.И. Кулакова РАМН, частота нарушений репродуктивной функции мужчин в структуре бесплодного брака составляет 47,2% [Тер-Аванесов Г.В., 2005].
Зарубежные исследования также выявили увеличение частоты рака яичек, простаты, молочной железы, врожденных пороков развития мужской половой системы и снижение фертильности мужчин за последние десятилетия. Скорость падения концентрации сперматозоидов в сперме здоровых мужчин составляет около 2% в год - со 113 млн/мл в 1940г. до 66 млн/мл в 1990г. [Carlsen E. et al., 1992; Auger J. et al., 1995]. Похожие результаты получены при обследовании мужчин Великобритании, Греции, Италии, Германии, Бельгии, Канады и др. [Waeleghem K. et. al., 1996; Pajarinen J. et. al., 1997; Никитин А.И., 2005]. За этот же период произошли беспрецедентные в медицинской теории и практике изменения общепринятых минимальных стандартов фертильной концентрации сперматозоидов - с 60 млн/мл до 40, а затем и до 20 млн/мл.
Причины, которые ведут к ухудшению качества спермы, недостаточно ясны, однако, ряд исследователей подчеркивает, что описанные тенденции характерны для промышленно развитых стран Европы и Америки и, в меньшей степени, для стран Азии и Африки [Menkveld R. et al., 1997; Swan Sh. et al. 2003]. Все это послужило основанием для выдвижения гипотезы о поражении мужской репродуктивной системы химическими факторами окружающей среды [Swan S. et al., 1997, 2000, 2003; Hauser R. et al., 2002; Comhaire F. et al., 2007]. В пользу этого предположения свидетельствует и тот факт, что абсолютное большинство экотоксикантов появилось именно в середине прошлого века и имеет искусственное происхождение [Майстренко В.Н., 2004]. В настоящее время в литературе имеются сведения о влиянии различных промышленных химических соединений на функцию гонад. Наибольшую опасность среди прочих ксенобиотиков представляют полихлорированные бифенилы (ПХБ), обладающие чрезвычайно высокой физико-химической стабильностью и устойчивостью к биологической деградации [Юфит С.С., 2002; Norstrom R., 2003]. Всего в мировых масштабах было произведено от 1 до 2 млн. тонн этих соединений [Майстренко, 2004]. По данным ВОЗ, в организм человека, не имеющего профессионального контакта с этими соединениями, поступает от 5 до 100 мкг ПХБ в сутки [Толстопятова Г.В., Коркач В.И., 1982].
ПХБ в низких концентрациях вызывают серьезные нарушения нервной, иммунной, гормональной и др. систем, обладают канцерогенным и мутагенным эффектами [Bessmann A., 1981; Cooke P.S. et al., 1996; Hauser R, Altshul L., 2002; Lee Y.W., Park H.J., 2003; Sripada S. et al., 2007]. Полихлорбифенилы способны индуцировать в организме процессы свободнорадикального окисления [Safe S., 1995; McLean M.R. et al., 2000; Twarovski T.P. et al., 2001; Supriyo De et al., 2004; Murugesan P. et al., 2007]. Известно, что окислительный стресс, развивающийся в тканях репродуктивной системы, является одним из важных патогенетических факторов снижения мужской фертильности [Agarwal A., 2006; Aitken 2007; Артифексов С.Б. и др., 2008; Божедомов В.А. и др., 2009; Громенко и др., 2009].
Некоторые исследования показали, что отравление ПХБ приводит к угнетению продукции половых гормонов, ухудшению количественных и качественных параметров спермы [Faqi A.S. et al., 1998; Safe S., 2000; Камилов Ф.Х. и др., 2000, 2003, 2005, 2009; Murugesan P. et al., 2005; Хабиров Р.Э., 2003, 2004; Галимов Ш.Н. и др., 2005, 2006; Галимова Э.Ф., 2005, 2006; Громенко Д.С. и др., 2007; Макашева Л.О., 2008; Булыгин К.В. и др., 2008, 2009].
В то же время, имеющиеся в литературе сведения о влиянии ПХБ на мужскую половую систему крайне неоднозначны, весьма противоречивы и требуют дальнейшего изучения [Barone M.A. t al., 1991; De Guise S. et al., 1995; Rozati R. et al., 2002; Colborn T., 2004; Acharya U.R. et al., 2006, Arunakaran J. et al., 2010]. Между тем, без углубленного исследования механизмов повреждения бифенилами мужской репродуктивной системы невозможна разработка эффективных патогенетически обоснованных принципов фармакологической коррекции нарушений фертильности, обусловленных экополлютантами.
Целью настоящей работы являлось выявление биохимических механизмов влияния полихлорированных бифенилов на мужскую репродуктивную систему и способов фармакологической коррекции установленных сдвигов в условиях эксперимента.
Задачи исследования:
1. Изучить действие различных доз промышленной смеси полихлорированных бифенилов «Совол» на сывороточные концентрации основных гормонов, регулирующих репродуктивную функцию.
2. Охарактеризовать действие поллютанта в различных дозах и длительности перорального введения на метаболический и морфофункциональный статус семенников.
3. Определить уровни биохимических маркеров функционального состояния акцессорных половых органов экспериментальных животных, подвергшихся субхроническому отравлению ксенобиотиком.
4. Выполнить исследование оплодотворяющей способности крыс-самцов in vivo, подвергшихся отравлению токсикантом в различных дозах, биохимических параметров и морфо-функциональных свойств нативного физиологического эякулята in vitro при интоксикации бифенилами.
5. Охарактеризовать интенсивность прооксидативных процессов и состояние неферментного и энзиматического звеньев физиологической антиоксидантной защиты тканей репродуктивных органов и печени самцов крыс, подвергшихся длительному воздействию полихлорбифенилов.
6. Дать сравнительную оценку эффективности использования фармакологических препаратов с антиоксидантным действием с целью коррекции ПХБ-индуцированных сдвигов оксидантного баланса в семенниках, эякуляте и печени самцов крыс.
7. Исследовать влияние комбинированного применения фармакологических препаратов на состояние основных показателей метаболического и морфофункционального статуса репродуктивной системы самцов крыс на фоне длительного воздействия полихлорированных бифенилов.
Научная новизна.
Впервые показано, что экспозиция крыс ПХБ в низких концентрациях приводит в тестикулах к дозозависимому усилению липопероксидации, уменьшению общей антиокислительной активности, истощению пула неферментных водо- и жирорастворимых антиоксидантов, подавлению активностей ферментов физиологической антиокислительной защиты, угнетению биосинтеза белков, снижению уровня НАДФН, интенсивности апотомического окисления глюкозы и активности глюкозо-6-фосфат дегидрогеназы, развитию гипоэнергетического состояния, падению концентрации АТФ и скорости окисления НАД- и ФАД-зависимых энергетических субстратов.
Впервые охарактеризовано динамическое состояние системы глутатиона в тканях репродуктивных органов под действием совола: показано дозо- и хронозависимое снижение под действием ПХБ уровня глутатиона восстановленного, свободных сульфгидрильных групп, фазовые изменения активностей глутатионзависимых ферментов детоксикации (глутатионпероксидазы и глутатионтрансферазы), обмена и рециклирования глутатиона (глутатионредуктазы и -глутамилтрансферазы) и особенности взаимосвязи системы глутатиона с другими ферментативными (супероксиддисмутаза, каталаза) и неферментными (-токоферол, аскорбат) антиоксидантами при интоксикации бифенилами.
Впервые установлено, что продолжительное воздействие совола вызывает нарушения метаболического статуса сперматозоидов, выделенных из эякулята: в лизате сперматозоидов обнаружено увеличение содержания мочевой кислоты, уменьшение концентрации общего белка, альбумина, фруктозы, глюкозы, снижение активностей аланинаминотрансферазы, аспартатаминотрансферазы, лактатдегидрогеназы, щелочной фосфатазы.
Впервые выявлено существенное снижение метаболической активности акцессорных половых желез, участвующих в формировании эякулята: в тканях семенных пузырьков, эпидидимиса и вентральной простаты отравленных животных зафиксировано снижение уровня фруктозы, активностей нейтральной гликозидазы и кислой фосфатазы.
Показана относительная сохранность и функциональная способность к адаптационным сдвигам неферментативного и энзиматического звеньев антиоксидантной системы печени крыс. Обнаружены динамические сдвиги оксидантного статуса тканей репродуктивных органов и печени животных на фоне поступления поллютанта: выявлено снижение общей антиоксидантной активности и возрастание концентрации продуктов пероксидации в зависимости от дозы и длительности воздействия ксенобиотика.
Продемонстрировано негативное влияние полихлорированных бифенилов на репродуктивный потенциал экспериментальных животных – снижение оплодотворяющей способности самцов крыс и численности их потомства, полученного при спаривании с интактными самками.
Впервые показано, что длительная интоксикация промышленной смесью ПХБ «Совол» в низких концентрациях приводит к поражению тестикулярной ткани самцов экспериментальных животных. Об этом свидетельствует дозозависимое уменьшение при действии бифенилов содержания сперматогоний, сперматоцитов, ранних и поздних сперматид, сперматозоидов в тестикулах экспонированных самцов.
Впервые выявлено снижение количества клеток Сертоли и интерстициальных клеток Лейдига в яичках, сопровождающееся падением сывороточных и тестикулярных концентраций ингибина и активина, уровней тестостерона и эстрадиола в крови отравленных крыс. Установлено, что длительное воздействие полихлорбифенилов (1,5-2,0 мес.) приводит к заметному уменьшению общей концентрации сперматозоидов в эякуляте крыс. Кратковременное поступление токсиканта вызывает ухудшение способности половых гамет к активному поступательному движению, существенное увеличение долей половых клеток с колебательными движениями и неподвижных спермиев в эякуляте.
Показано, что при интоксикации низкими концентрациями ПХБ у самцов крыс наблюдается падение сывороточных концентраций трийодтиронина и тироксина на фоне одновременного уменьшения плазменного содержания тиреотропного гормона. Уровни лютеинизирующего и фолликулостимулирующего гонадотропинов в крови самцов, подвергшихся длительному воздействию больших доз бифенилов, снижаются.
Впервые экспериментально апробированы новые подходы к коррекции выявленных нарушений. Установлено, что использование препаратов антиоксидантного действия оказывает существенное влияние на соотношение прооксидантных процессов и антиоксидантной активности в тканях печени, семенников и эякуляте крыс, подвергшихся отравлению соволом. Полученные данные также указывают на центральную роль развития окислительного стресса в патохимических механизмах репротоксического действия полихлорбифенилов.
Впервые показано, что применение оксиметилурацила, а также витаминно-минерального комплекса «Селмевит», оказывает защитное действие на метаболический статус тканей животных при субхронической интоксикации соволом. Под влиянием иммурега и селмевита в органах мужской репродуктивной системы и в печени крыс, подвергнутых воздействию полихлорированными бифенилами, снижается интенсивность свободнорадикального окисления и стимулируется антиокислительная защита, восстанавливается функциональная активность ферментативного звена антиоксидантной системы, нормализуется уровень основных водо- и жирорастворимых антиоксидантов.
Впервые продемонстрировано, что комбинированное применение селмевита и иммурега на фоне длительной интоксикации полихлорбифенилами способствует восстановлению большинства параметров энергетического, углеводного, белкового видов обмена веществ, оксидантного баланса в тканях репродуктивных органов крыс-самцов и их фертильности при спаривании с интактными самками.
Полученные данные определяют возможные способы рациональной патогенетически обоснованной фармакологической коррекции экологически обусловленных субфертильных состояний.
Научная и практическая значимость.
Полученные данные существенно расширяют и уточняют имеющиеся представления о биохимических механизмах репротоксического действия стойких органических загрязнителей класса хлорбифенилов. Разработка механизмов развития окислительного стресса при интоксикации диоксино-подобными экотоксикантами позволяет наметить пути фармакологической коррекции метаболических и структурно-функциональных нарушений мужской репродуктивной системы, вызванных отравлением стойкими органическими загрязнителями.
Установлен ведущий патогенетический механизм действия полихлорированных бифенилов, заключающийся в развитии окислительного стресса в тканях семенников, акцессорных половых органов, эякуляте и печени экспериментальных животных.
Выявленные особенности эндокринного статуса, результаты биохимического и морфометрического исследования тестикулярной ткани и спермы экспериментальных животных указывают на многоуровневый характер токсического действия бифенилов и предопределяют направления дальнейших исследований.
Показано корригирующее влияние экзогенного введения препаратов с антиоксидантным механизмом действия на основные показатели оксидантного статуса тканей на фоне отравления бифенилами. Уточнены некоторые биохимические механизмы репропротекторного действия селмевита и иммурега при субхронической интоксикации соволом. Результаты экспериментального исследования позволяют рекомендовать применение при интоксикации ксенобиотиками препаратов с антиоксидантной активностью в качестве средств, улучшающих тканевой метаболизм и функциональное состояние органов репродуктивной системы и печени.
Экспериментально обоснована необходимость периодического контроля функционального состояния половой системы и печени у мужчин, имеющих профессиональный контакт с полихлорбифенилами, а также проживающих на экологически дестабилизированных территориях, с целью ранней диагностики интоксикации, определения степени ее тяжести и своевременного предупреждения развития субфертильного состояния.
Основные положения, выносимые на защиту.
1. Репротоксическое действие полихлорированных бифенилов на мужской организм реализуется на различных уровнях организации половой системы. Снижение сывороточных концентраций гонадотропных гормонов, тиреотропина и отсутствие адекватной реакции гипофиза на снижение уровней в крови тестостерона, ингибина В, активина А, трийодтиронина, тироксина при отравлении соволом указывает на претестикулярный уровень нарушения функции самовоспроизведения и ее регуляции.
2. Пероральное поступление поллютанта приводит к поражению тестикулярной ткани – нарушению белкового, энергетического, углеводного видов обмена веществ, уменьшению количества сперматогоний, сперматоцитов, сперматид, сперматозоидов, клеток Лейдига, клеток Сертоли и угасанию сперматогенной и стероидогенной функций яичек.
3. Проявлением посттестикулярной токсичности полихлорбифенилов является ухудшение биохимического статуса и функциональной активности акцессорных органов мужской половой системы, а также сперматозоидов, полученных из эякулята крыс, подвергшихся кратковременному воздействию соволом в низких дозах.
4. Интоксикация полихлорбифенилами вызывает в тканях репродуктивных органов, эякуляте и печени самцов крыс накопление продуктов перекисного окисления липидов и окислительной модификации белков, изменения уровней глутатиона, свободных сульфгидрильных групп, аскорбиновой кислоты, токоферола и активностей ферментов физиологической антиоксидантной защиты. Их направленность и выраженность определяются интенсивностью и продолжительностью перорального введения токсиканта.
5. Использование препаратов антиоксидантного действия в целях патогенетической коррекции при отравлении самцов животных полихлорированными бифенилами способствует нормализации метаболического статуса семенников, спермы и печени.
6. Одновременное применение витаминно-минерального комплекса «Селмевит» и препарата «Иммурег» на фоне продолжающегося воздействия ксенобиотика более эффективно препятствует развитию эндокринотоксических и репротоксических эффектов ПХБ и способствует нормализации функции мужской репродуктивной системы экспериментальных животных
Внедрение результатов исследования в практику. Результаты исследования используются в учебном процессе на кафедрах биологической и биоорганической химии, фармакологии №1 с курсом клинической фармакологии, фармакологии №2, мобилизационной подготовки здравоохранения и медицины катастроф, урологии с курсом ИПО ГОУ ВПО Башкирский государственный медицинский университет Росздрава, кафедре биохимии ГОУ ВПО Ижевская государственная медицинская академия Росздрава, кафедре биохимии и лабораторной медицины с курсом клинической и лабораторной диагностики последипломного образования ГОУ ВПО Омская государственная медицинская академия Росздрава, кафедре биохимии с курсом физколлоидной и токсикологической химии ГОУ ВПО Оренбургская государственная медицинская академия Росздрава, кафедре биохимии ГОУ ВПО Тюменская государственная медицинская академия, кафедре биохимии ГОУ ВПО Челябинская государственная медицинская академия Росздрава.
Апробация результатов работы. Результаты исследований были представлены и обсуждены на VII конференции Российской ассоциации репродукции человека «Лечение бесплодия: нерешенные проблемы» (Саратов, 2001); III Съезде Биохимического Общества (Санкт-Петербург, 2002); Российской конференции «Национальный план действий по экологически обоснованному управлению диоксинами/фуранами и диоксиноподобными веществами» (Санкт-Петербург, 2002); Всероссийской конференции «Актуальные вопросы охраны репродуктивного здоровья в медицине труда» (Самара, 2002); 1-й Всероссийской научной конференции с международным участием «Влияние загрязнения окружающей среды на здоровье человека» (Новосибирск, 2002); Российском научном форуме «Мужское здоровье и долголетие» (Москва, 2003, 2004, 2008); International Ecologic Forum "Environment and Human Health» (St.Petersburg, 2003); межрегиональной конференции биохимиков Урала, Западной Сибири и Поволжья «Биохимия: от исследования молекулярных механизмов - до внедрения в клиническую практику и производство» (Оренбург, 2003); Международном конгрессе «Профилактика нарушений репродуктивного здоровья от профессиональных и экологических факторов риска» (Волгоград, 2004); Всероссийской конференции с международным участием «Биологические аспекты экологии человека» (Архангельск, 2004); ІV съезде Российского общества биохимиков и молекулярных биологов (Новосибирск, 2008); Всероссийской конференции, посвященной 80-летию со дня рождения профессора Р.И. Лифшица «Актуальные проблемы теоретической и прикладной биохимии» (Челябинск, 2009); 7-й международной научно-практической конференции «Достижения фундаментальных наук в решении актуальных проблем медицины» (Астрахань, 2010); совместном заседании кафедр биологической и биоорганической химии, фармакологии №1 с курсом клинической фармакологии с участием сотрудников кафедр фармакологии №2, общей гигиены с экологией с курсом гигиенических дисциплин медико-профилактического факультета, патологической физиологии, мобилизационной подготовки здравоохранения и медицины катастроф, клинической лабораторной диагностики ИПО ГОУ ВПО Башкирский государственный медицинский университет Росздрава (Уфа, 2010).
Публикации. По материалам диссертации опубликовано 60 печатных работ, из них 13 - в рецензируемых периодических изданиях, рекомендованных ВАК для публикации материалов диссертаций.
Структура и объем диссертации. Работа изложена на 304 страницах печатного текста, содержит 27 рисунков, 34 таблицы и состоит из введения, обзора литературы, описания материалов и методов исследования, глав результатов исследований, заключения, выводов и списка литературы, который включает 354 иностранных и 127 отечественных источников.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Эксперименты выполнены на 1250 белых беспородных крысах-самцах половозрелого возраста (3 мес.) массой 180-220 г. Животные содержались в виварии при 12-часовом цикле день/ночь в условиях постоянной температуры и влажности на стандартной диете. Эксперименты выполнены в соответствии с требованиями приказов №1179 МЗ СССР от 10.10.1983 г., №267 МЗ РФ от 19.06.2003 г., регламента Европейской Конвенции (Страсбург, 1986) по содержанию, кормлению, уходу за подопытными животными, выводу их из эксперимента и последующей утилизации.
Интоксикацию вызывали воздействием отечественной смеси ПХБ «Совол», включающей 26% тетра-, 64,6% пента-, 9% гексахлорбифенилов и следовые количества гептахлорбифенилов. Учитывая, что ведущим путем поступления полихлорбифенилов в организм человека и животных считается пероральный, экспериментальную интоксикацию вызывали внутрижелудочным введением совола в составе оливкового масла один раз в сутки с помощью специального металлического зонда.
Все животные были разделены на 6 групп. Самцы 2-й и 5-й групп подвергались воздействию совола в ежесуточной дозе 5 мг·кг-1 веса тела в течение 30-и и 60-и дней соответственно. Крысы 3-й и 6-й групп получали поллютант в количестве 10 мг·сут·кг-1 на протяжении 30-и и 60-и дней соответственно. Таким образом, суммарная токсическая экспозиция крыс 5-й и 6-й групп составляла 0,05 ЛД50 (300 мг·кг-1) и 0,1 ЛД50 (600 мг·кг-1), установленных для совола. Крысам контрольных групп (группы 1 и 4) вводили оливковое масло в тех же объемах - по 1,0 мл в течение 30 и 60 дней соответственно. В отдельных сериях экспериментов моделировали подострое отравление крыс (28 суток), при котором суммарная токсическая экспозиция крыс групп составляла 0,05 ЛД50 и 0,1 ЛД50.
Животных умерщвляли под легким эфирным наркозом путем декапитации – группы 2 и 5 на 30-й день, группы 3 и 6 на 60-й день эксперимента. Собирали кровь, извлекали для исследования семенники, эпидидимис, семенные пузырьки, вентральную простату, печень.
Эксперименты по изучению эффективности применения фармакологических препаратов с целью патогенетической коррекции токсических эффектов полихлорбифенилов выполнялись в два этапа. На первом осуществлялась предварительная оценка влияния препаратов «Триовит», «Селмевит», «Иммурег» на антиоксидантный статус печени, семенников и эякулята крыс на фоне подострой интоксикации полихлорированными бифенилами (28 дней в дозе 10 мг·сут·кг-1). Препараты вводили перорально с помощью специального зонда, начиная с 14-го дня подострой интоксикации. При выборе лечебных доз руководствовались подходами, описанными в литературе [Мышкин С.А., 2000; Бышевский А.Ш., 2006;] и общепринятой схемой использования фармакологических препаратов в пересчете на крыс [Гуськова Т.А., 1990]. Забой животных всех групп осуществляли на 28-й день.
На втором этапе была использована модель субхронической интоксикации соволом (60 дней по 10 мг·сут·кг-1). В этой серии экспериментов применяли «Селмевит», «Иммурег» и их комбинацию. Препараты вводили в тех же дозах, начиная с 30 дня экспериментального отравления. Группа 1 (контроль) получала оливковое масло, группа 2 - совол, группы 3, 4, 5, помимо токсиканта - селмевит, иммурег, комбинацию селмевит+иммурег, соответственно. Эвтаназию животных осуществляли на 60-й день экспериментального отравления.
В сыворотке крови определяли методом иммуноферментного анализа (ИФА) содержание тестостерона, эстрадиола, лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ) трийодтиронина (Т3), тироксина (Т4), тиреотропного гормона (ТТГ) с использованием стандартных тест-систем производства «DRG Diagnostics» (Германия). Тестикулярные и сывороточные концентрации ингибина В и активина А определяли с применением тест-систем производства фирмы DSL (США).
В тканях акцессорных органов исследовали содержание фруктозы [Mann Т., 1954], активности кислой фосфатазы (ЕС 3.1.3.2) [Paquin R., 1984] и нейтральной гликозидазы (ЕС 3.2.1.20) с помощью набора производства FertiPro N.V., (Belgium).
В эякуляте и гомогенатах тканей определяли содержание глутатиона восстановленного (ГВ) [Гаврилова А.Н., 1986; Карпищенко А.И., 1997], свободных сульфгидрильных групп (ССГ) [Bellomo G., 1990], аскорбата [Omaye S.T. et al., 1979], токоферола [Desai I.D., 1984], активности глутатионпероксидазы (ГПО) (EC 1.11.1.9, GPx) [Rotruck J.T., 1973; Гаврилова А.Н., 1986], глутатионредуктазы (ГР) (EC 1.6.4.2, GR) [Carlberg I. & Mannervik B. 1985], глутатион-S-трансферазы (ГТ) (EC 2.5.1.1.8, GST) [Habig W.H., 1974], -глутамилтрансферазы (ГГТ) (EC 2.3.2.2, -GT) [Orlowski M. & Meister A., 1965], каталазы (EC 1.11.1.6, CAT) [Королюк М.А., 1988], супероксиддисмутазы (СОД) (EC 1.15.1.1, SOD) [Murklund S. & Marklund G., 1974].
Концентрацию соединений, реагирующих с тиобарбитуровой кислотой (ТБК-РП), и общую антиокислительную активность (ОАА) изучали с использованием диагностических наборов производства ООО «Агат-Мед» (Россия) и по Клебанову Г.И. (1988), соответственно. Содержание окисленных белковых производных определяли спектрофотометрическим методом, предложенным Дубининой Е.Е. (1995).
В лизате сперматозоидов определяли содержание общего белка биуретовым методом, альбумина с использованием бромкрезолового зеленого, мочевой кислоты энзиматическим кoлориметрическим методом с уриказой и пероксидазой, фруктозы по Mann Т. (1954), глюкозы глюкозооксидантным методом, активности щелочной фосфатазы (ЕС 3.1.3.1) (ЩФ) с помощью п-нитрофенилфосфата, аспартатаминотрансферазы (ЕС 2.6.1.1) (АсТ), аланинаминотрансферазы (ЕС 3.6.1.2) (АлТ), лактатдегидрогеназы (ЕС 1.1.1.27) (ЛДГ) кинетическими УФ-методами.
В тканях исследовали содержание АТФ [Lamprecht W., Trautschold I., 1965], окислительный метаболизм 1,4-14С-сукцината, 1,2-14С--кетоглутарата и 2-14С-пирувата - по выделению 14СО2, содержание НАДФН, интенсивность биосинтеза белка по скорости включения [2-14С]-гистидина и [2-14С]-аланина в состав суммарных белков гомогенатов тканей, активность глюкозо-6-фосфат дегидрогеназы (ЕС 1.1.1.49) (Г-6-Ф ДГ) [Прохорова М.И., 1982], общего белка [Lowry O., 1951].
При морфометрическом исследовании тестикулярной ткани проводили подсчет сперматогоний, сперматоцитов, сперматид и сперматозоидов [Рыжаков Д. И. и др., 1980; Косюга Ю.И. и др., 1994; Шевантаева О.Н. и др., 1995].
Эякулят у самцов крыс получали путем трансректальной электростимуляции семенного бугорка через слизистую прямой кишки [Рыжаков Д.И., Молодюк А.В., Артифексов С.Б, 1980].
Оценку оплодотворяющей способности проводили по стандартной методике in vivo. Для этого самцов, подвергшихся интоксикации, помещали в одну клетку с интактными самками в (1 самец : 2 самки). Через неделю самок отсаживали. После родоразрешения производили подсчет потомства.
Статистическую обработку данных выполняли с помощью пакета Statistica 6.0 фирмы StatSoft. В группах выборки оценивали следующие параметры: значения медианы, нижний и верхний квартили. Для оценки достоверности различий использовали непараметрический критерий (U) Манна–Уитни с поправкой Бонферонни. Корреляционный анализ полученных в эксперименте данных проводили по Спирмену.
Результаты исследования и их обсуждение
1. Влияние полихлорированных бифенилов на мужскую репродуктивную систему экспериментальных животных.
При оценке гормонального статуса экспериментальных животных обнаружено достоверное снижение сывороточной концентрации тестостерона уже при непродолжительном действии малых доз полихлорбифенилов (5 мг·сут·кг-1) до 54,3% от показателей интактных самцов, усиливающееся с увеличением дозы и длительности интоксикации (рис. 1).
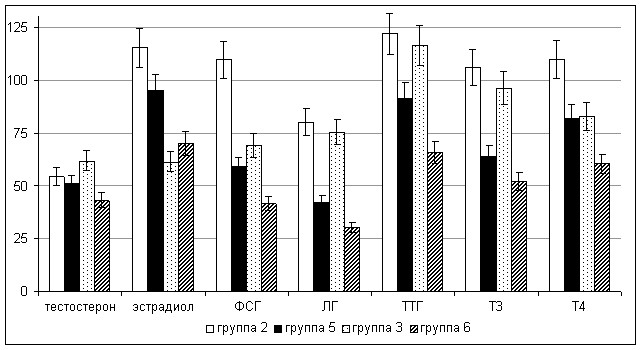 Рисунок 1. Концентрации гормонов в сыворотке крови самцов крыс на 30-й и 60-й дни отравления соволом в различных дозах (% от контроля)
Рисунок 1. Концентрации гормонов в сыворотке крови самцов крыс на 30-й и 60-й дни отравления соволом в различных дозах (% от контроля)
Плазменное содержание стимулирующего андрогенопоэз лютеинизирующего гормона при этом отнюдь не увеличивалось, а, либо не отличалось от уровня контроля при экспозиции меньшими дозами ксенобиотика, либо заметно уменьшалось в условиях большей интенсивности и длительности интоксикации. Аналогичные результаты были получены при определении сывороточной концентрации другого гипофизарного гонадотропина - ФСГ, контролирующего сперматогенез. Об эндокринотоксичности ПХБ на гипофизарном уровне также свидетельствуют результаты определения ТТГ в крови крыс, содержание которого также снижалось на фоне резкого падения уровня тиреоидных гормонов. Концентрация в крови крыс эстрадиола, образующегося в мужском организме преимущественно в результате внетестикулярного метаболизма тестостерона, также значительно уменьшалась, однако лишь к окончанию экспериментальной интоксикации полихлорбифенилами - до 61,4-70%.
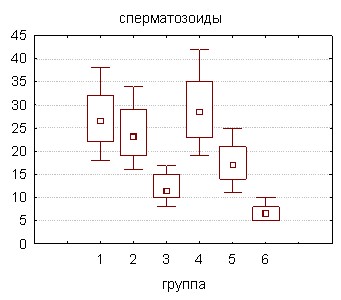
В отдельной серии экспериментов нами было выполнено динамическое изучение количественных и качественных параметров спермы крыс на фоне отравления полихлорбифенилами в различных дозах. Для этого у интактных половозрелых самцов методом трансректальной электростимуляции был получен эякулят и выполнено исследование исходного уровня показателей спермограммы (0 день). Затем животные были разделены на две равные группы, которым ежедневно вводили совол в дозе 5 мг·кг-1 (группа 1) и 10 мг·кг-1 (группа 2). На 15-е, 30-е, 45-е, 60-е сутки наблюдения на фоне продолжающейся интоксикации у животных указанным способом получали и исследовали эякулят. Согласно полученным данным у животных обеих групп зафиксировано последовательное ухудшение основных параметров спермограммы (таблица 1). Зарегистрированное уменьшение общего содержания половых клеток в сперме крыс обеих групп достигало уровня статистически значимых отличий на 45-е и 60-е сутки воздействия ксенобиотика. Общая концентрация сперматозоидов в эякуляте крыс группы 1 к 45-му дню составила 77,3%, а у самцов группы 2 – 65,5% от исходного уровня. На 60-й день экспериментальной интоксикации ПХБ падение общего содержания гамет в сперме этих животных продолжилось и составило 67,1% и 54,0% от исходного уровня, соответственно.
Более ранние нарушения в структуре спермограммы выявлены при оценке функциональных свойств сперматозоидов. Уже на 15-й день отравления поллютантом в меньшей дозе (5 мг·сут·кг-1) доля спермиев с поступательным характером движения достоверно снижалась на 14,5% - за счет увеличения относительного содержания малоподвижных клеток на 17,3% и неподвижных гамет на 68,3%. Однонаправленные, но более выраженные сдвиги были зарегистрированы в эякуляте крыс, получавших бльшую дозу токсиканта. К окончанию срока наблюдения (60 дней) у самцов этой группы сперматозоиды с поступательной двигательной активностью отсутствовали, а доля неподвижных половых гамет достигала 43,2%, тогда как относительное содержание последних в сперме данных животных до начала введения совола не превышала 3,0%.
Специальная серия экспериментов была посвящена изучению некоторых параметров фертильности самцов крыс, подвергнутых отравлению полихлорированными бифенилами при их спаривании с интактными самками.
Таблица 1 – Концентрация и двигательная активность сперматозоидов в эякуляте крыс, подвергшихся воздействию соволом в дозе 5 мг·сут·кг-1
| 1. 0 день | 2. 15 день | 3. 30 день | 4. 45 день | 5. 60 день | |
| концентрация, млн/мл | 44,0 [35,0;55,0] | 43,0 [34,0;54,0] р1-2=0,4876 | 38,00 [29,0;48,0] р1-3=0,1530 р2-3=0,1779 | 34,0 [27,0;43,0] р1-4=0,0373 р2-4=0,0550 р3-4=0,2530 | 29,5 [23,0;37,0] р1-5=0,0042 р2-5=0,0079 р3-5=0,0454 р4-5=0,1779 |
| поступательные, % | 61,72 [60,00;62,06] | 52,78 [52,38;53,33] р1-2=0,0002 | 37,50 [37,20;37,93] р1-3=0,0002 р2-3=0,0002 | 25,00 [25,00;25,58] р1-4=0,0002 р2-4=0,0002 р3-4=0,0002 | 21,68 [21,21;22,58] р1-5=0,0002 р2-5=0,0002 р3-5=0,0002 р4-5=0,0002 |
| колебательные, % | 35,94 [34,48;36,66] | 42,16 [41,46;42,59] р1-2=0,0002 | 50,94 [50,00;51,51] р1-3=0,0002 р2-3=0,0002 | 58,72 [58,33;59,25] р1-4=0,0002 р2-4=0,0002 р3-4=0,0002 | 51,56 [51,21;52,38] р1-5=0,0002 р2-5=0,0002 р3-5=0,0304 р4-5=0,0002 |
| неподвижные, % | 2,96 [2,38;3,33] | 4,98 [4,44;5,55] р1-2=0,0005 | 11,69 [11,11;12,50] р1-3=0,0002 р2-3=0,0002 | 15,98 [15,38;16,66] р1-4=0,0002 р2-4=0,0002 р3-4=0,0002 | 26,57 [25,80;27,02] р1-5=0,0002 р2-5=0,0002 р3-5=0,0002 р4-5=0,0002 |
Доля самок, принесших приплод после спаривания с самцами, получавшими по 5 мг·сут·кг-1 смеси ПХБ в течение 30 и 60-и дней снизилась на 20% и 30% от группы контроля, соответственно (рис. 2). Увеличение дозы совола приводило к более выраженным нарушениям мужской фертильности. При спаривании с самцами групп 3 и 6 потомство было получено лишь у шести и двух из десяти самок, соответственно. Наблюдалось значительное уменьшение (на 26-65% от контроля) количества новорожденных крысят в одном помете.
Полученные результаты свидетельствуют о наличии у полихлорбифенилов выраженных антиандрогенных и спермотоксических свойств. Направленность и динамика обнаруженных сдвигов отдельных параметров репродуктивного статуса экспериментальных животных позволяет предположить, что механизмы репротоксичности бифенилов реализуются на различных уровнях оси гипофиз-гонады, а также на эякуляторном уровне. На это указывает, с одной стороны - развитие гипоандрогенного состояния, уменьшение общей концентрации спермиев через 1,5-2 мес. наблюдения, отсутствие адекватной реакции на эти сдвиги со стороны гипофиза; с другой - ухудшение двигательной активности гамет, обнаруженное уже в ранние сроки интоксикации.
Формирование сперматозоидов происходит в яичках из первичных половых клеток и состоит из последовательных фаз пролиферации сперматогоний, мейоза и спермиогенеза. Поэтому на следующем этапе выяснения механизмов репротоксичности ПХБ в условиях субхронической интоксикации соволом было проведено исследование важнейших морфо-функциональных и биохимических параметров тестикулярной ткани.
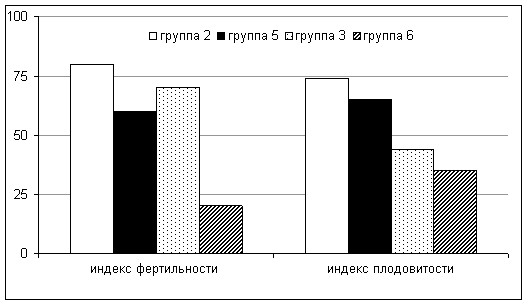
Рисунок 2. Параметры репродуктивного статуса самцов крыс, подвергшихся воздействию совола в различных дозах (% от контроля)
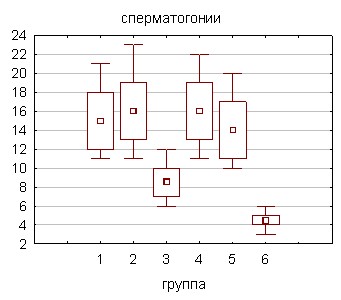
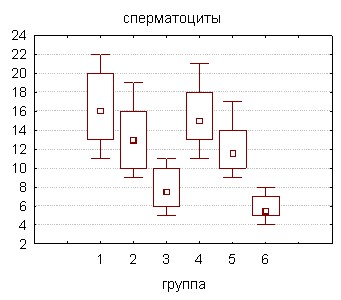
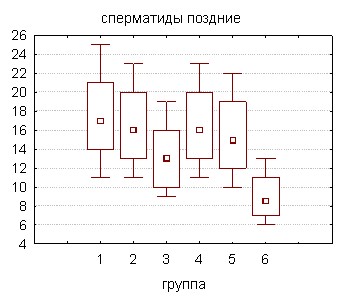
Отравление в течение 60 суток позволяет оценить влияние токсиканта на все этапы сперматогенеза, продолжительность которого у крыс составляет около 40 дней. Для морфологического исследования использовали левый семенник крыс, подвергшихся интоксикации соволом в суточных дозах 5 и 10 мг·кг-1 массы животного. Забой животных осуществляли с периодичностью в 30 дней. В приготовленных из тестикулярной ткани мазках осуществляли подсчет количества отдельных клеток гаметогенеза: сперматогоний, сперматоцитов, ранних и поздних сперматид, сперматозоидов. Воздействие токсиканта в меньшей суточной дозе (5 мг·кг-1) в течение 30 дней не оказывало заметного влияния на изучаемые параметры за исключением сперматоцитов, количество которых достоверно снижалось на 18,7% по сравнению с контролем (рис. 3).
Возможно, фаза активного деления является наиболее чувствительной к токсическому действию поллютанта, образование сперматоцитов происходит в результате нескольких митотических делений и морфофункциональной перестройки родоначальных клеток гаметогенеза. С увеличением длительности введения ксенобиотика наблюдается снижение количественного содержания сперматогоний, клеток дальнейших этапов формирования спермиев и собственно сперматозоидов. Наиболее выраженные сдвиги зафиксированы у животных, получавших бльшую суточную дозу токсиканта (10 мг·кг-1). Полученные данные указывают на глубокое поражение сперматогенеза, а наиболее чувствительными, вероятно, являются этапы ранней дифференцировки половых клеток.
Эндокринная функция яичек выполняется клетками интерстициальной ткани Лейдига, являющимися главными продуцентами мужских половых стероидов [Нишлаг Э., 2005]. Анализ мазков тестикулярной ткани выявил достоверное трехкратное падение содержания эндокриноцитов к концу экспериментального отравления соволом в максимальной дозе, что, очевидно, является непосредственной причиной развития ПХБ-индуцированной андрогенной недостаточности.
 |  |
 |  |
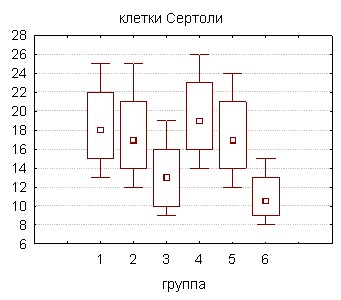 | 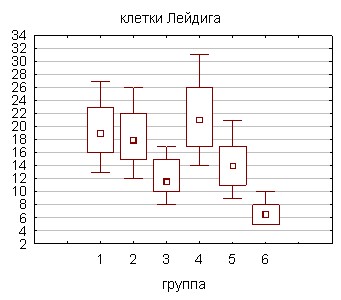 |
Рисунок 3. Клеточный состав тестикулярной ткани крыс, подвергшихся воздействию соволом в дозах 5 и 10 мг·сут·кг-1 (% от контроля)
Большая часть (60-80%) объема яичек образована семенными канальцами, выстланными сустентоцитами – клетками Сертоли, обеспечивающими нормальное развитие сперматогенных клеток и выполняющими трофическую, барьерную, фагоцитарную и эндокринную функции [Griswold M.D., 1995].
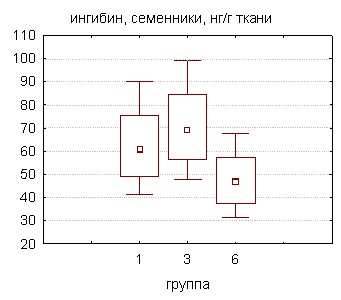
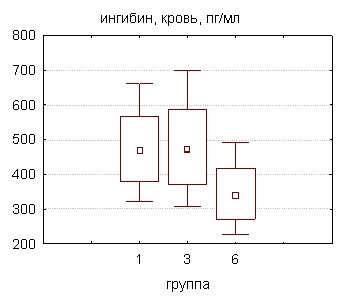
Согласно полученным данным, их количество в тестикулярной ткани крыс также снижалось, особенно при длительной экспозиции токсикантом в обеих дозах - на 27,8% (группа 5) и 44,7% (группа 6) от уровня контроля. Клетки Сертоли принимают непосредственное участие в механизмах регуляции гонадостата, синтезируя и секретируя в кровь углеводсодержащие белки ингибин и активин. Их биологические эффекты на системном уровне проявляются разнонаправленным действием – подавлением, либо стимуляцией секреции гипофизарного гонадотропина – ФСГ.
 |  |
 | 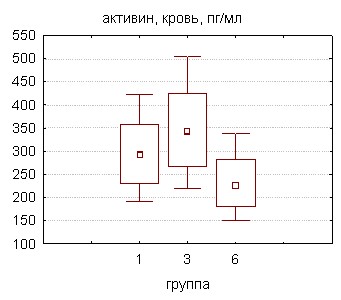 |
Рисунок 4. Влияние совола на концентрацию ингибина и активина в сыворотке крови и тестикулярной ткани экспериментальных животных
Согласно экспериментальным данным (рис. 4), на 30 сутки отравления ПХБ в большей дозе зафиксировано достоверное увеличение уровня активина в гомогенате ткани яичек крыс, тогда как в условиях 60-дневного воздействия токсиканта наблюдалось заметное снижение и тестикулярного, и сывороточного содержания обоих димеров, что указывает на срыв регуляторных механизмов в силу, вероятно, прямого токсического действия ксенобиотика на гонады.
Эксперименты по изучению интенсивности биосинтеза белка в семенниках крыс при интоксикации соволом в экспериментах с введением [2-14С]-гистидина и [2-14С]-аланина выявили снижение темпов включения меченых аминокислот в состав суммарных белков ткани (рис. 5). Изменения были достоверными и носили отчетливый дозо- и хронозависимый характер. Зафиксированное уменьшение масс семенников экспериментальных животных, подвергшихся отравлению соволом также свидетельствует о выраженном гонадотоксическом действии полихлорбифенилов и катаболической направленности сдвигов метаболизма в тестикулярной ткани.
![Скорость инкорпорации [2-14С]-гистидина и [2-14С]-аланина в-12](/images1/153413/skorost-inkorporacii-2-14s-gist.jpg) | ![Скорость инкорпорации [2-14С]-гистидина и [2-14С]-аланина в-13](/images1/153413/13-skorost-inkorporacii-2-14s-gist.jpg) |
Рисунок 5. Скорость инкорпорации [2-14С]-гистидина и [2-14С]-аланина в белки семенников самцов крыс при воздействии совола (% от контроля)
В условиях воздействия токсикантов одной из существенных причин повреждения и гибели клеток является развивающаяся недостаточность энергообеспечения, связанная, с одной стороны, с повышенным расходом энергии (работа систем детоксикации, активация транспортных АТФаз для компенсации шунтовых потоков ионов в поврежденных участках биомембран и др.), и недостаточным синтезом макроэргов в клетке с другой (повреждение мембран, ферментов биологического окисления, в том числе дыхательной цепи митохондрий, нарушение окислительного фосфорилирования).
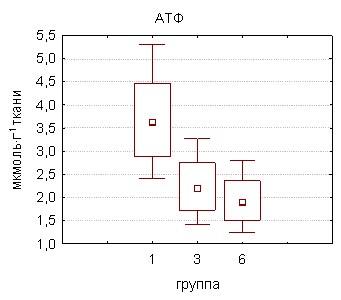
Исследования по определению содержания АТФ в гомогенате семенников крыс, подвергшихся экспериментальной интоксикации соволом, продемонстрировали существенное снижение тканевой концентрации макроэрга (рис. 6). Учитывая важнейшую роль АТФ в обмене веществ, не будет преувеличением утверждение о том, что значительная часть метаболических сдвигов при отравлении ПХБ прямо или опосредованно связана с недостаточностью макроэрга.
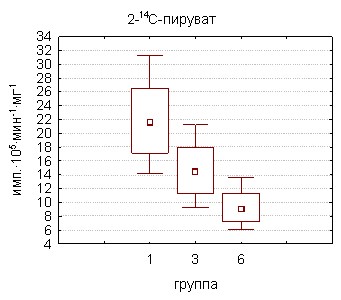
Необходимым звеном энергетического метаболизма митохондрий является ферментный комплекс биологического окисления и тканевого дыхания, осуществляющий окисление различных энергетических субстратов. В его состав входят ферменты окислительного декарбоксилирования пирувата, цикла трикарбоновых кислот и дыхательной цепи, локализованные в матриксе и в плоскости внутренней мембраны митохондрий. Важным показателем интегральной работы всего энзиматического ансамбля может являться скорость утилизации энергетических субстратов. Исходя из этого, мы сочли необходимым охарактеризовать окислительную активность митохондрий семенников. Экспериментальные данные свидетельствуют о разнонаправленных сдвигах поглощения митохондриями энергетических субстратов под влиянием различных режимов интоксикации ПХБ.
 |  |
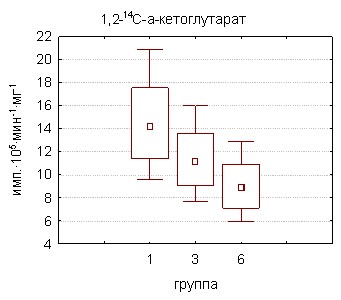 | 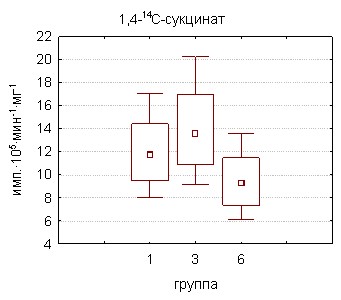 |
Рисунок 6. Содержание АТФ и интенсивность окисления энергетических субстратов в тестикулярной ткани крыс, подвергшихся отравлению соволом
Окисление -кетоглутарата и, особенно, пирувата под действием совола замедлялось, указывая на уязвимость пируватдегидрогеназного комплекса к действию токсиканта и, возможно, наличие метаболического блока на этом уровне, либо на начальных этапах цикла Кребса.
Несколько иная ситуация наблюдалась на ФАД-зависимом участке цикла трикарбоновых кислот. На 30-й день поступления токсиканта наблюдалась тенденция к увеличению по сравнению с контролем интенсивности выделения меченого углекислого газа из инкубационной среды, содержащей сукцинат. Некоторая активация окисления сукцината митохондриями может иметь целью энергообеспечение активирующихся детоксикационных (микросомальное окисление и конъюгация) и пластических процессов в клетках. При отравлении ксенобиотиком относительная активация сопряженного окисления янтарной кислоты может также отражать достаточную сохранность звена II дыхательной цепи и мембраностабилизирующую активность сукцината. Резюмируя изложенные сведения, можно предположить, что в этих условиях происходит «переключение» митохондриальных энергопродуцирующих систем с окисления НАД-зависимых субстратов на преимущественное потребление сукцината, использование которого характеризуется более высокими скоростями поставки макроэргов. Подобные изменения представляют собой универсальный механизм, обеспечивающий энергетические потребности тканей в условиях воздействия любого раздражителя [Кондрашова М.Н., 1996].
Однако, увеличение суточной дозы токсиканта приводило к однозначному угнетению поглощения всех использовавшихся энергетических субстратов, наиболее выраженному в отношении пирувата. Такой эффект, по-видимому, обусловлен значительным повреждением мембран митохондрий и их ферментных ансамблей как самим поллютантом и его метаболитами, так и в результате действия продуктов липопероксидации.
Таким образом, полученные данные свидетельствуют о выраженном повреждающем воздействии полихлорбифенилов на энергетическую систему тестикулярной ткани экспериментальных животных, что в сочетании с другими патохимическими сдвигами может вносить серьезный вклад в патогенез нарушения мужской фертильности в условиях экологического неблагополучия.
Результаты экспериментального исследования скорости окисления основного энергетического субстрата тканей - глюкозы свидетельствуют об усилении катаболизма [1-14С]-глюкозы при 30 дневной интоксикации и замедлении ее метаболизма в условии более продолжительного воздействия ПХБ. Ведущим метаболическим путем отщепления первого атома углерода в тканях служит гексозомонофосфатный путь окисления, являющийся в цитоплазме клеток основным источником восстановленных НАДФН и пентозофосфатов. Исходя из полученных данных, представлялось целесообразным определить активность Г-6-Ф дегидрогеназы и уровень НАДФН в семенниках крыс, подвергнутых воздействию ПХБ, а также в печени, как основном органе детоксикации.
Полученные данные выявили органоспецифические особенности реакции тканей на воздействие ПХБ (рис. 7). Если 30-дневное отравление соволом сопровождалось повышением уровня НАДФН как в печени, так и в тестикулах, то с увеличением длительности интоксикации зарегистрировано статистически значимое уменьшение концентрации кофактора в семенниках при относительной сохранности его содержания в печеночной ткани. В то же время, в печени, но не семенниках экспериментальных животных, получавших 10 мг·сут·кг-1 токсиканта в течение одного месяца, наблюдалась кратковременная индукция активности Г-6-Ф ДГ. Восстановленные формы НАДФ при действии ПХБ могут интенсивно вовлекаться в процессы детоксикации как на уровне активации микросомальных монооксигеназ, так и на уровне второй фазы биотрансформации ксенобиотиков для восстановления глутатиона, как одного из важнейших факторов резистентности к воздействию на клетки негативных факторов [Тиунов Л.А., 1988; Кулинский В.И., 1990, Куценко А.С, 2004].
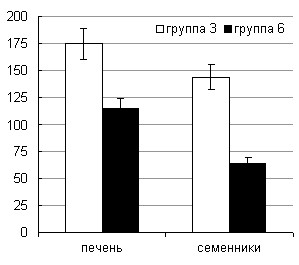 | 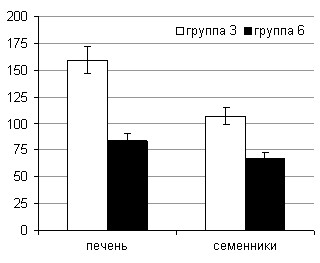 |
Рисунок 7. Содержание НАДФН и активность Г-6-Ф ДГ в семенниках и печени крыс, подвергшихся интоксикации ПХБ (% от контроля)
Способность к оплодотворению зависит также от функционально-метаболического статуса акцессорных репродуктивных органов, принимающих непосредственное участие в формировании микросреды для половых клеток. Для оценки функциональной активности придаточных половых желез используются различные биохимические маркеры, такие как цитрат, цинк, ГГТ, кислая фосфатаза, фруктоза, простагландины, свободный L-карнитин, глицерофосфохолин, нейтральная -гликозидаза и др. [Руководство ВОЗ, 2001]. Доказано, что активность кислой фосфатазы служит достоверным показателем функции предстательной железы. Основным маркером функции семенных пузырьков принято считать содержание фруктозы в семенной жидкости или тканях. Наиболее чувствительным и специфичным показателем функции эпидидимиса является нейтральная -гликозидаза, снижение уровня активности которой указывает на имеющуюся патологию придатка. Количественное определение фруктозы в семенных пузырьках показало заметное падение ее концентрации у животных групп 3, 5, 6 на 19,6%, 36% и 45,3% от значений интактных самцов соответственно (рис. 8).
Активность нейтральной гликозидазы в эпидидимисе крыс при подострой интоксикации ПХБ в течение месяца в обеих дозах оставалась практически неизменной. При более продолжительном воздействии ксенобиотика наблюдалось ее угнетение на 28,5% при ежесуточном поступлении совола в дозе 5 мг·сут·кг-1 и на 44,3% при увеличении дозы до 10 мг·сут·кг-1.
Отравление бифенилами в дозе 10 мг·сут·кг-1 в течение одного месяца и 60-и дней сопровождалось также уменьшением активности кислой фосфатазы в ткани вентрального отдела предстательной железы экспериментальных животных до 75,3% и 50,2% от уровня контроля, соответственно. Кроме того, в простате крыс группы 3 обнаружено заметное угнетение фосфатазы, составившее 72,3% от контрольных значений. Вышеизложенные результаты позволяют прийти к заключению, что отравление полихлорбифенилами оказывает выраженное негативное влияние на метаболический статус ткани акцессорных половых органов самцов экспериментальных животных, что, возможно, является следствием, как ослабления андрогенной стимуляции, так и прямого токсического действия ПХБ. В литературе имеются сообщения об их накоплении в органах репродуктивной системы с высоким содержанием липидов, в том числе в ткани эпидидимиса. [Andric S.A., 2000; Абдуллина А.З., 2009].

Рисунок 8. Уровни показателей функциональной активности акцессорных половых органов самцов крыс при отравлении соволом (% от контроля)
Согласно экспериментальным данным, длительное поступление токсиканта в максимальной дозе сопровождалось статистически значимым снижением содержания общего белка в спермиях экспериментальных животных на 30,7%) по отношению к контролю (рис. 9). Интересно, что в режиме минимальной токсической нагрузки наблюдалось заметное увеличение концентрации белка в сперме на 34,2% от показателей контрольной группы. Концентрация альбумина в сперме крыс при интоксикации ПХБ в обеих дозах в течение месяца практически не отличалась от нормы, тогда как двухмесячное поступление ксенобиотика в дозе 5 мг·сут·кг-1 приводило к падению уровня альбумина на 15,5%, а в дозе 10 мг·сут·кг-1 – на 30,3% от показателей интактных животных. Концентрация мочевой кислоты в этих же условиях, напротив заметно возрастала на 47,9% (группа 5) и 56,7% (группа 6), указывая на интенсификацию образования одного из конечных продуктов пуринового метаболизма.
Значительные колебания были обнаружены при определении содержания глюкозы в сперме экспериментальных животных. Если интоксикация соволом в течение месяца в меньшей дозе (5 мг·сут·кг-1) сопровождалась значительным приростом концентрации глюкозы до 158,1% от контроля, то увеличение продолжительности токсического воздействия до 60 дней в дозах 5 и 10 мг·сут·кг-1 приводило к ее резкому снижению на 32,6% и 73,4% соответственно.
Анализ содержания фруктозы в лизате сперматозоидов не выявил столь существенных сдвигов. Заметное изменение ее концентрации отмечалось лишь в сперме животных группы 6, получавших наибольшее количество ксенобиотика (по 10 мг·сут·кг-1 в течение 60 дней), проявившееся в падении до 74,4% от контрольных значений.
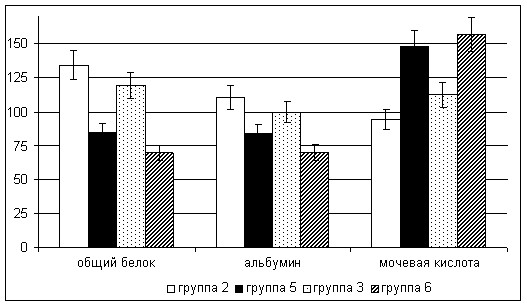
Рисунок 9. Влияние субхронической интоксикации бифенилами на содержание общего белка, альбумина и мочевой кислоты в эякуляте крыс (% от контроля)
При изучении активностей аминотрансфраз и щелочной фосфатазы в сперме крыс, подвергшихся месячному отравлению соволом, заметных сдвигов не выявлено. Угнетение АсТ зафиксировано на 60-день воздействия ксенобиотика в большей дозе (10 мг·сут·кг-1) на 25% (рис. 10). У них же выявлено снижение активностей АлТ и ЩФ до 69,3% и 63,8% от контрольных значений. В то же время активность АлТ снижалась до 62,6%, а ЩФ – до 71,5% от показателей интактных самцов и при меньшей суточной дозе (5 мг·кг-1) поллютанта, но в условиях более длительного - двухмесячного отравления.
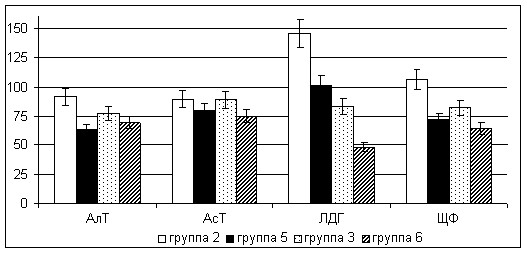
Рисунок 10. Динамика активностей АлТ, АсТ, ЛДГ, ЩФ в эякуляте крыс при субхронической интоксикации соволом (% от контроля)
Подострое отравление ксенобиотиком в меньшей дозе сопровождается заметной индукцией активности ЛДГ до 145,5%, сменяющейся угнетением до 48,0% от уровня контроля с увеличением интенсивности интоксикации.
Таким образом, полученные данные показывают, что субхроническая интоксикация низкими концентрациями хлорбифенилов оказывает существенное влияние на биохимические параметры спермиев. Если непродолжительное поступление низких доз ПХБ не оказывает существенного негативного влияния на большинство исследованных параметров, то с увеличением дозы и продолжительности введения токсиканта наблюдаются выраженные изменения практически всех биохимических констант спермы, что свидетельствует о многоуровневом характере стерилизующего действия бифенилов.
Для установления биохимических механизмов, лежащих в основе выявленных под действием ПХБ морфо-функциональных, гормональных и метаболических сдвигов, было предпринято исследование оксидантно-антиоксидантной системы тестикулярной ткани крыс, подвергшихся интоксикации соволом в низких дозах. Доказательства нарушения оксидантного баланса в тестикулярной ткани самцов крыс под действием поллютанта были получены уже при определении тканевой концентрации продуктов липопероксидации. Уровень ТБК-реагирующих продуктов в семенниках возрастал на 29,5% и 167,6% уже к 30-м суткам воздействия ксенобиотика в дозах 5 и 10 мг·сут·кг-1 соответственно. Увеличение длительности интоксикации приводило к дальнейшему повышению содержания ТБК-РП. Одновременное снижение общей антиоксидантной активности гомогенатов яичек животных наблюдалось в условиях интоксикации соволом в бльшей дозе (10 мг·сут·кг-1) как на 30-е сутки – до 72,5%, так и к окончанию наблюдения (60-е сутки) – до 72,6% от показателей интактных самцов.
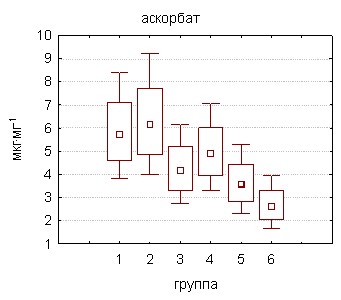
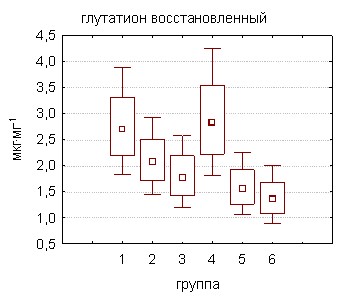
Обнаруженное снижение ОАА тестикулярной ткани, как показали дальнейшие исследования, обусловлено нарушениями в структуре неферментативного и энзиматического звеньев антиоксидантной системы. При этом наиболее чувствительным к воздействию поллютантов параметром оказался восстановленный глутатион, уровень которого достоверно снижался уже к 30-м суткам интоксикации ксенобиотиком в обеих дозах (рис. 11). В условиях более длительного отравления животных содержание глутатиона восстановленного продолжало уменьшаться, достигая 55,1% (группа 5) и 48,0% (группа 6) значений самцов контрольной группы. Заметное падение концентрации другого водорастворимого антиоксиданта прямого действия – аскорбата также наблюдалось в ранние сроки поступления совола в бльшей дозе (10 мг·сут·кг-1) – на 72,9% от уровня контроля, а к 60-му дню при отравлении животных в обеих дозах до 72,9% (группа 5) и 53,8% (группа 6).
Содержание в тестикулярной ткани -токоферола – основного жирорастворимого антиоксиданта биомембран снижалось по сравнению с контролем к концу двухмесячной интоксикации полихлорбифенилами на 20,4%, у крыс группы 5, получавших ежедневно совол по 5 мг·кг-1 и на 28,1% у крыс группы 6. Наиболее устойчивым параметром к воздействию стойкого органического загрязнителя оказался уровень свободных сульфгидрильных групп, заметное падение которого на 36,2% было зарегистрировано только в условиях максимальной экспозиции ПХБ (группа 6).
 |  |
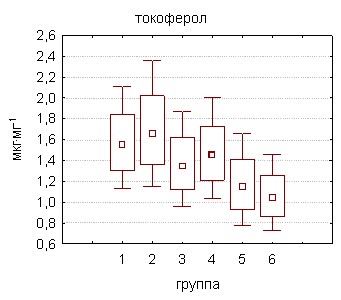 | 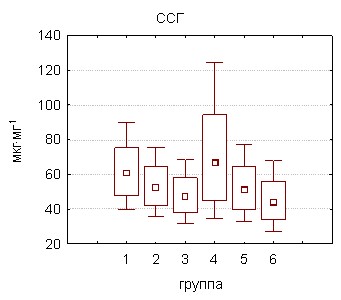 |
Рисунок 11. Содержание неферментных антиоксидантов в тестикулярной ткани крыс под действием полихлорированных бифенилов
При изучении активностей некоторых ферментов детоксикации и антиоксидантной защиты также выявлены заметные дозо- и хронозависимые сдвиги. Так, в условиях месячной интоксикации соволом в дозе 5 мг·сут·кг-1 (группа 2) наблюдалось повышение активности глутатионпероксидазы на 40,1% (рис. 12). Увеличение длительности воздействия смеси ПХБ в той же дозе до 2-х месяцев приводило к обратному снижению активности ГПО до показателей интактных животных. В условиях более высокой токсической нагрузки (10 мг·сут·кг-1) наблюдалось незначительное снижение активности ГПО к 30-м суткам (до 86,8%) и ее существенное падение до 62,9% от контрольных значений спустя два месяца отравления. Важнейший фермент обезвреживания токсических соединений эндогенного происхождения и поступающих извне - глутатионтрансфераза также оказался относительно устойчив к воздействию поллютантов. Заметное угнетение ГТ зарегистрировано при максимальной токсической нагрузке (10 мг·сут·кг-1 в течение 60 дней) - на 55,9% от уровня контрольных значений. В остальных условиях экспериментальной интоксикации активность ГТ колебалась на уровне интактных животных.
Возможной причиной обнаруженного снижения активности ГПО и ГТ может являться неадекватная кофакторная обеспеченность. Поэтому для оценки состояния системы регененерации и ресинтеза глутатиона было предпринято исследование активностей глутатионредуктазы и гамма-глутамилтрансферазы в тестикулярной ткани крыс.
Активность ГГТ при интоксикации соволом в меньшей дозе (5 мг·сут·кг-1) несколько снижалась от уровня контроля на 19,6% и 21,9% соответственно (группы 2 и 5), однако эти сдвиги не достигали уровня статистической значимости. Отравление в бльшей дозе ПХБ сопровождалось более заметным падением активности ГГТ - на 30-й день наблюдения на 30,3%, и на 60-й– на 43,6%.
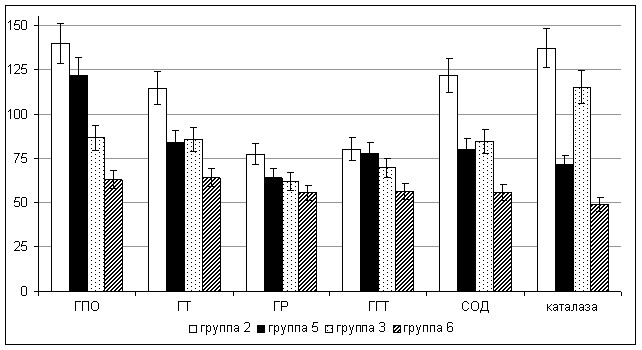
Рисунок 12. Влияние длительного воздействия ПХБ на активности ферментов антиоксидантной системы и обмена глутатиона в яичек крыс (% от контроля)
Глутатионредуктаза оказалась менее устойчивой к воздействию поллютанта. Значительное уменьшение ее активности зафиксировано в тестикулах всех крыс, независимо от модели экспериментальной интоксикации. Пероральное введение смеси ПХБ приводило к снижению глутатионредуктазной активности на 30-е сутки воздействия на 22,4%, а к 60-м суткам - на 36%. При двукратном увеличении дозы поллютанта выявлено более значительное угнетение ГР - на 38,1% и 44,6%, соответственно, от уровня контроля. Похожие сдвиги были зафиксированы при изучении активностей и других ферментов антиоксидантной защиты тканей. Они практически не изменялись на 30-й день экспериментальной интоксикации соволом за исключением прироста активности каталазы на 37,1% при отравлении крыс в дозе 5 мг·сут·кг-1. Угнетение активности СОД тестикулярной ткани крыс зарегистрировано у животных группы 6 - на 44,2%, а каталазы – у самцов групп 5 и 6 – на 28,1% и 50,9%, соответственно, от уровня контроля.
Таким образом, субхроническая интоксикация ПХБ сопровождалась дозо- и хронозависимым усилением в ткани семенников крыс процессов липопероксидации на фоне снижения активности физиологической системы антиокислительной защиты. При этом в ранние сроки наблюдения у животных группы 2, очевидно, усиливалось потребление ГВ важнейшими глутатионзависимыми ферментами антиоксидантного действия – глутатионпероксидазой и глутатионтрансферазой. При этом активности ферментов восстановления и ресинтеза глутатиона (ГР и ГГТ) снижались, что с увеличением дозы поллютанта и пролонгацией отравления приводило к снижению уровня ГВ, а также активностей других, синергично действующих, антиоксидантных ферментов. Безусловно, накопление в семенниках активных форм кислорода и других радикалов, усиление пероксидации липидов, белков и нуклеиновых кислот с образованием токсичных продуктов окисления, очевидно, приводит к выраженным нарушениям метаболизма клеток тестикул и, как следствие, функционального состояния главного репродуктивного органа в целом.
Аналогичные изменения были выявлены при оценке оксидантного статуса придатка яичка и вентральной части предстательной железы. Высокое содержание полиненасыщенных жирных кислот в составе билипидного слоя клеточной мембраны сперматозоидов делает их особенно чувствительными к повреждающему действию свободных радикалов.
Обобщая полученные результаты оценки уровня ТБК-РП и параметров антиоксидантной системы эякулята крыс, подвергшихся интоксикации ПХБ, следует выделить наиболее характерную отличительную особенность, заключающуюся в отсутствии сколько-нибудь заметных адаптивных сдвигов со стороны антиоксидантной системы спермы крыс (рис. 13, 14).
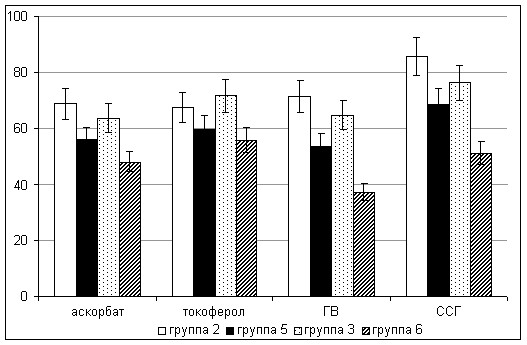
Рисунок 13. Влияние субхронической интоксикации соволом на содержание
аскорбата, токоферола, ГВ и ССГ в эякуляте крыс (% от контроля)
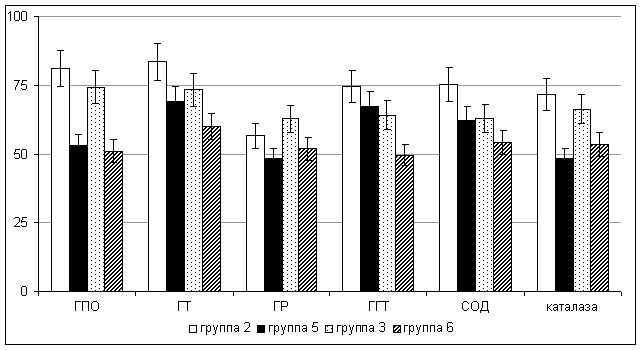
Рисунок 14. Активности ферментов антиоксидантной защиты и метаболизма глутатиона в эякуляте крыс при отравлении соволом (% от контроля)
На фоне инициации окислительной модификации липидов и последующей эскалации процессов липопероксидации наблюдается столь же быстрое истощение антиоксидантных резервов эякулята. Динамика, с которой исчерпываются антиоксиданты прямого действия в эякуляте крыс в условиях интоксикации ПХБ, является не только, а может быть и не столько следствием увеличения концентрации свободных радикалов, сколько результатом глубокого угнетения антиоксидантных систем с возобновляемой активностью и ферментов обмена и регенерации глутатиона, выполняющего функции кофактора и репарации прямых водо- и жирорастворимых антиоксидантов. В этих условиях сперматозоид оказывается лишенным эффективных механизмов защиты от цепных свободнорадикальных реакций повреждения его наружной мембраны и внутриклеточных структур и неспособным осуществлять биологическую задачу сохранения и передачи генетической информации.
В основе развития окислительного стрема при интоксикации ПХБ может лежать AhR-опосредованная активация экспрессии генов семейства цитохромов CYP1A1, 1A2, способных генерировать активированные кислородные метаболиты (АКМ) в процессе окисления эндогенных и экзогенных субстратов (в т.ч. низкохлорированных ПХБ) [Safe S., 2000; Twarovski T.P., 2001]. Образующиеся при этом моно- и дигидроксильные метаболиты могут спонтанно, либо ферментативно окисляться до семихинонов и хинонов [MсLean M.R., 2000]. АКМ могут также формироваться при дальнейших окислительно-восстановительных превращениях ПХБ-хинонов. ПХБ, в свою очередь, могут реагировать с H2O2 с образованием наиболее реакционно-способного гидроксил-радикала [Murugesan P., 2007]. Активированные кислородные метаболиты способны атаковать молекулы липидов, ДНК, белков и, в меньшей степени, углеводов, что приводит к инактивации и потере нативных функций соответствующих биологически активных соединений [Зенков Н.К., 2001; Ланкин В.З., 2005; Дубинина Е.Е., 2006; Меньщикова Е.Б., 2008]. Действительно, в отдельной серии экспериментов нами выявлено повышение интенсивности окислительной модификации белков репродуктивных тканей, спермы и печени экспериментальных животных, подвергшихся длительному воздействию полихлорбифенилов.
Данные корреляционного анализа полученных результатов подтверждают предположение о ведущей роли активации пероксидативных процессов в патогенезе репротоксического действия бифенилов. Тесная положительная связь выявлена между концентрацией ТБК-РП в семенниках и долей неподвижных гамет в эякуляте экспериментальных животных. Напротив, обнаружена обратная зависимость относительного содержания спермиев, лишенных какой-либо двигательной активности от уровня как антиоксидантов прямого действия – восстановленного глутатиона, аскорбата, -токоферола, так и ферментной природы – СОД, каталазы, ГПО, ГТ. С уровнем тканевой концентрации аскорбиновой кислоты, необходимой в процессе стероидогенеза, взаимосвязаны также содержание в тестикулярной ткани эндокриноцитов, сывороточные уровни синтезируемого ими тестостерона и стимулирующего их функциональную активность лютеинизирующего гормона. Количество клеток Лейдига, в свою очередь, тесно коррелирует с содержанием в крови тестостерона, ЛГ и эстрадиола и активностью СОД, ГПО и уровнем ГВ.
Сывороточная концентрация ФСГ оказалась связанной прямой корреляцией с общей концентрацией сперматозоидов в эякуляте, со всеми изученными показателями антиоксидантной системы тестикулярной ткани, с содержанием в ней сперматогоний, сперматоцитов, клеток Сертоли. Отрицательная связь выявлена между уровнем ФСГ в крови и долей неподвижных мужских половых клеток. Уменьшение содержания клеток Сертоли в семенниках крыс, подвергшихся в течение 60 суток интоксикации ПХБ в ежесуточной дозе 10 мг·кг-1, коррелирует со снижением продуцируемого ими ингибина В, что в совокупности с другими сведениями свидетельствует о нарушениях обратной связи в системе гипофизарного контроля тестикулярных функций и является косвенным подтверждением прямого повреждения ткани гипофиза при отравлении ПХБ. Тесно связанным со всеми изучаемыми показателями оказался уровень тестостерона, что, впрочем, выглядит вполне логично и в очередной раз доказывает важность гормональных сдвигов при интоксикации ПХБ в развитии субфертильности крыс-самцов. Кроме того, обнаружена обратная зависимость от уровня конечных продуктов липопероксидации общей концентрацией сперматозоидов в эякуляте, относительным содержанием в тестикулярной ткани сперматогоний, сперматоцитов, сперматид поздних, клеток Сертоли и Лейдига.
Большим количеством сильных корреляционных связей с показателями морфофункционального состояния сперматогенеза и гормонального статуса оказался уровень глутатиона восстановленного (таблица 2). Его тестикулярная концентрация сильно коррелирует с общей концентрацией и долей неподвижных сперматозоидов в сперме, содержанием в ткани семенников сперматоцитов, клеток Сертоли, клеток Лейдига, сывороточными уровнями тестостерона, эстрадиола, ФСГ, ЛГ, ингибина В. Все это позволяет прийти к выводу, что механизмы поддержания межорганного оборота и регенерации восстановленного глутатиона, занимающего центральное место в антиоксидантной системе, имеют важнейшее значение для адекватного функционирования мужской репродуктивной системы в норме и определяет глубину адаптационных резервов тканей в условиях воздействия агрессивных факторов окружающей среды.
Таблица 2 –Взаимосвязи между отдельными показателями оксидантного статуса семенников и гормонального профиля экспериментальных животных
| тестостерон | эстрадиол | ФСГ | ЛГ | ингибин В | |
| ТБК-РП | r=-0,8909 р=0,0005 | r=-0,7212 р=0,0185 | r=-0,9515 р=0,00002 | r=-0,8666 р=0,0011 | r=-0,6363 р=0,0479 |
| ГВ | r=0,8424 р=0,0022 | r=0,6606 р=0,0375 | r=0,8060 р=0,0048 | r=0,6848 р=0,0288 | r=0,7939 р=0,0061 |
| аскорбат | r=0,8545 р=0,0016 | r=0,6848 р=0,0288 | r=0,6606 р=0,0375 | r=0,7212 р=0,0185 | r=0,5757 р=0,0815 |
| токоферол | r=0,9030 р=0,0003 | r=0,5636 р=0,0897 | r=0,9030 р=0,0003 | r=0,6484 р=0,0425 | r=0,7575 р=0,0111 |
| СОД | r=0,8181 р=0,0038 | r=0,6242 р=0,0537 | r=0,7818 р=0,0075 | r=0,7333 р=0,0158 | r=0,6242 р=0,0537 |
| каталаза | r=0,8545 р=0,0016 | r=0,3696 р=0,2930 | r=0,8666 р=0,0011 | r=0,5030 р=0,1383 | r=0,8060 р=0,0048 |
| ГПО | r=0,8424 р=0,0022 | r=0,5151 р=0,1275 | r=0,8181 р=0,0038 | r=0,6121 р=0,0599 | r=0,8060 р=0,0048 |
| ГТ | r=0,7696 р=0,0092 | r=0,3333 р=0,3465 | r=0,7939 р=0,0061 | r=0,5151 р=0,1275 | r=0,7212 р=0,0185 |
Таким образом, сопоставление результатов экспериментального исследования влияния субхронической интоксикации ПХБ на репродуктивный статус самцов, гормональный профиль, морфофункциональные и биохимические параметры тестикул и эякулята, позволяет прийти к заключению о том, что негативное действие ксенобиотиков данного класса на оплодотворяющую способность опосредовано цитотоксическими эффектами поллютантов, патохимической основой которых является интенсификация свободнорадикальных процессов в тканях мужской репродуктивной системы.
2. Экспериментальная оценка эффективности применения различных способов фармакологической коррекции ПХБ-индуцированного повреждения репродуктивной системы самцов крыс
Рядом исследователей показана эффективность применения антиоксидантной терапии в лечении заболеваний, важным патогенетическим фактором которых является окислительный стресс [Ланкин В.З. и др., 2000; Зенков Н.К. и др., 2001; Шанин Ю.Н. и др., 2003; Меньщикова Е.Б. и др., 2008].
В условиях развития нарушений оксидантного статуса репродуктивных органов при отравлении соволом патогенетически обоснованным представляется введение лекарственных препаратов, способных снижать чрезмерную интенсивность реакций пероксидации, а также повышать содержание и/или активность эндогенных антиоксидантов.
Согласно опубликованным в литературе данным [Лазарева Д.Н. и др., 1983; Алехин Е.К. и др., 1985; Мышкин В.А. и др., 2000; Хабиров Р.Э., 2005; Савлуков А.И. и др., 2007; Макашева Л.О., 2010], использование триовита, селмевита и оксиметилурацила (ОМУ) при отравлении промышленными смесями ПХБ способствует существенному улучшению функционального и метаболического статуса печени, яичек и акцессорных репродуктивных органов крыс-самцов.
Триовит – представляет собой селенсодержащий витаминный препарат. Одна капсула триовита содержит 10 мг -каротина, 40 мг токоферола ацетата, 100 мг аскорбиновой кислоты и 50 мкг селена. Препарат обладает защитными свойствами от поражающего воздействия свободных радикалов. Триовит повышает иммунную и общую сопротивляемость организма, снижает вероятность онкологических, сердечно-сосудистых, репродуктивных нарушений и катаракты. Капсулы триовита производятся фирмой KRKA, d.d., Novo mesto, Словения; препарат зарегистрирован в РФ 22 декабря 1999г. № 011595/01-1999.
Витаминно-минеральный комплекс «Селмевит» (препарат ОАО Фармстандарт-УфаВИТА зарегистрирован МЗ РФ Фармакологическим Государственным Комитетом 25 сентября 1997г.). Одна таблетка селмевита содержит ретинола ацетата - 0,568 мг, альфа-токоферола ацетата – 7,5 мг, тиамина хлорида - 0,581 мг, рибофлавина - 1 мг, пиридоксина гидрохлорида - 2,5 мг, кислоты аскорбиновой - 35 мг, никотинамида - 4 мг, кислоты фолиевой - 50 мкг, рутина - 12,5 мг, кальция пантотената - 2,5 мг, цианокобаламина -3 мкг, кислоты липоевой - 1 мг, метионина - 100 мг, сульфата железа - 2,5 мг, сульфата кальция - 25 мг, сульфата кобальта - 50 мкг, фосфата и карбоната магния - 40 мг, сульфата марганца - 1,25 мг, сульфата меди - 0,4 мг, селенита натрия - 25 мкг, фосфора (в виде фосфатов кальция и магния) - 30 мг, сульфата цинка - 2 мг.
Оксиметилурацил (2,4-диоксо-5-гидрокси-6-метил-1,2,3,4,-тетрагидро-пиримидин, «Иммурег») обладает анаболическими и антикатаболическими свойствами, стимулирует гемопоэз (эритро- и лейкопоэз), участвует в активации биоэнергетических процессов и стабилизации мембран клеток и органелл, усиливает активность мембраносвязанных ферментов, ингибирует свободнорадикальное окисление и процессы липопероксидации. Спектр фармакологических эффектов оксиметилурацила заключается в ускорении процессов клеточной регенерации, заживления ран, иммуномодулирующем, противовоспалительном, антиоксидантном и гепатопротекторном действии. Приказом Министерства Здравоохранения и медицинской промышленности №302 от 29 июля 1996г. препарат разрешен для применения в медицинской практике и к промышленному производству. ОМУ вводили внутрижелудочно с помощью зонда в виде суспензии в 2% растворе крахмала.
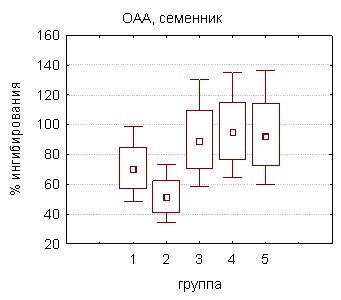
Первая серия экспериментов была посвящена предварительному анализу влияния различных препаратов на уровень продуктов липопероксидации и общую антиокислительную активность тканей печени, семенников и эякулята крыс, находившихся в условиях продолжающейся подострой интоксикации полихлорированными бифенилами.
Все животные были разделены на 5 групп по 10 крыс. Самцам группы 1 (контроль) вводили оливковое масло, группам 2, 3, 4, 5 - совол в суточной дозе 10 мг·кг-1 массы тела животного в течение 28 дней. Животные групп 3, 4, 5, получали на фоне введения токсиканта, начиная с 14-го дня эксперимента, триовит, селмевит и оксиметилурацил, соответственно. Важно подчеркнуть, что введение препаратов в тех же дозах интактным самцам не сопровождалось статистически значимыми изменениями изучаемых параметров.
 |  |
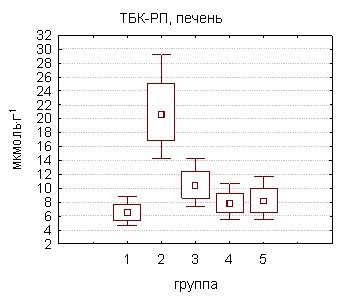 | 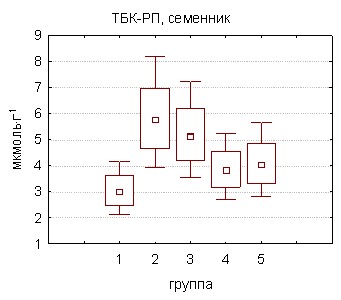 |
Рисунок 15. Содержание ТБК-РП и ОАА в печени и семенниках крыс в условиях подострой интоксикации ПХБ и применения фармакологических препаратов
Ведение каждого из препаратов достоверно (в сравнении с группой крыс, получавших только совол) сопровождалось снижением уровня ТБК-РП в печени отравленных животных, однако лишь применение селмевита, а также оксиметилурацила способствовало его нормализации. Различия показателей концентрации продуктов липопероксидации групп 3 и 4, групп 3 и 5 достигали уровня статистической значимости (рис. 15). При изучении влияния препаратов на аналогичные параметры семенников и эякулята самцов также происходило восстановление ОАА, но снижения концентрации ТБК-РП до уровня показателей интактных животных не наблюдалось. В то же время применение витаминно-минерального комплекса или ОМУ сопровождалось более выраженным снижением уровня ТБК-РП в изученных тканях самцов крыс, подвергшихся подострому отравлению.
Острые и подострые промышленные интоксикации встречаются реже и рассматриваются как чрезвычайные происшествия, тогда как длительного воздействия стойких органических загрязнителей избежать практически невозможно. Исходя из этого, и с учетом результатов предварительного скрининга препаратов в последующих экспериментах были использованы ОМУ, селмевит и их комбинация на модели субхронической интоксикации соволом (10 мг·сут·кг-1 в течение 2 месяцев). Группа 1 (контроль) получала оливковое масло, группа 2 – совол, группы 3, 4, 5, помимо токсиканта с 30-го дня и до окончания эксперимента (60-й день) получали селмевит, иммурег, комбинацию селмевит+иммурег, соответственно.
Таблица 3 – Уровни ТБК-РП, ГВ, ССГ и ОАА в семенниках экспериментальных животных при фармакологической коррекции интоксикации ПХБ
| Группа 1 | Группа 2 | Группа 3 | Группа 4 | Группа 5 | |
| ТБК-РП, мкмоль·г-1 ткани | 3,19 [2,67;3,78] | 8,32 [6,78;10,08] р1-2=0,0001 | 4,78 [3,95;5,73] р1-3=0,0024 р2-3=0,0003 | 4,57 [3,79;5,45] р1-4=0,0040 р2-4=0,0003 р3-4=0,7054 | 4,07 [3,27;4,99] р1-5=0,0493 р2-5=0,0002 р3-5=0,1509 р4-5=0,3257 |
| ОАА, % ингибирова-ния | 74,14 [61,15;88,78] | 48,57 [39,33;59,11] р1-2=0,0024 | 65,67 [53,59;79,36] р1-3=0,2899 р2-3=0,0283 | 59,17 [49,06;70,53] р1-4=0,0493 р2-4=0,0963 р3-4=0,3257 | 70,65 [57,81;85,19] р1-5=0,7054 р2-5=0,0081 р3-5=0,7054 р4-5=0,0963 |
| ГВ, мг·г-1 белка | 3,12 [2,54;3,78] | 1,51 [1,22;1,85] р1-2=0,0002 | 2,28 [1,81;2,82] р1-3=0,0283 р2-3=0,0072 | 2,50 [2,03;3,05] р1-4=0,0963 р2-4=0,0010 р3-4=0,4056 | 2,93 [2,31;3,65] р1-5=0,5967 р2-5=0,0003 р3-5=0,0889 р4-5=0,1987 |
| ССГ, мг·г-1 белка | 77,27 [61,56;95,32] | 43,41 [34,13;54,17] р1-2=0,0008 | 61,65 [48,86;76,41] р1-3=0,0963 р2-3=0,0283 | 68,80 [55,26;84,31] р1-4=0,2899 р2-4=0,0024 р3-4=0,2899 | 81,59 [64,31;101,57] р1-5=0,7054 р2-5=0,0008 р3-5=0,0451 р4-5=0,1736 |
Согласно полученным данным, уровень свободных сульфгидрильных групп в ткани семенников крыс, получавших тот или иной препарат заметно увеличивался и не отличался от показателей интактных животных (таблица 3). Применение витаминно-минерального комплекса, но не оксиметилурацила, способствовало достоверному восстановлению до контрольных значений ОАА тестикулярной ткани крыс, подвергавшихся отравлению ПХБ. В противоположность этому, уровень глутатиона восстановленного в гонадах самцов достигал показателей интактных животных при использовании ОМУ, чего на фоне значительного прироста содержания низкомолекулярного тиола, не наблюдалось при назначении селмевита. В то же время, комбинированное применение препаратов сопровождалось нормализацией обоих этих параметров. Несмотря на статистически значимое снижение, в сравнении с животными, получавшими только токсикант, уровень ТБК-РП в яичках оставался заметно выше контрольных значений у крыс всех экспериментальных групп.
Применение оксиметилурацила как в виде монотерапии, так и в комбинации препятствовало имевшему место при интоксикации соволом, подавлению ферментативных активностей антиоксидантных энзимов, потребляющих в качестве кофактора восстановленный глутатион (ГПО и ГТ) и участвующих в его межорганном обороте, ресинтезе и восстановлении – ГГТ и ГР (рис. 16). Зафиксированные сдвиги способствуют усилению поступления тиола в тестикулярную ткань из крови и активации внутриклеточной регенерации трипептида, что в определенной степени объясняет зафиксированное восстановление уровня глутатиона и активностей глутатионзависимых ферментов.
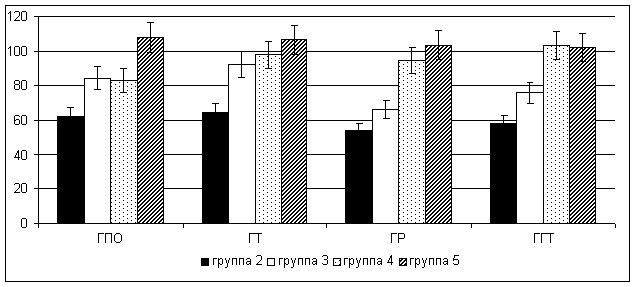
Рисунок 16. Активности ферментов в семенниках крыс в условиях отравления соволом и фармакологической коррекции (% от контроля)
Изучение аналогичных биохимических показателей акцессорных половых органов самцов выявило эффективность применения селмевита на фоне отравления соволом в отношении нормализации уровней ОАА, ГВ и ССГ в ткани придатка яичек животных, тогда как введение ОМУ способствовало восстановлению только ССГ. Помимо этого, при использовании какого-либо из указанных фармакологических препаратов, наблюдалось существенное уменьшение уровня продуктов ТБК-РП, свидетельствующее об ингибировании процессов липопероксидации в эпидидимисе самцов по сравнению с животными, не получавшими лечения при интоксикации ПХБ. Тем не менее, концентрация ТБК-РП превышала контрольные значения на 50-70%. При изучении ферментов различных уровней антиоксидантной защиты зарегистрировано заметное, достигающее контрольных значений, восстановление активности глутатионпероксидазы в эпидидимиальной ткани крыс, которым, помимо ксенобиотика перорально вводили селмевит. Назначение ОМУ в тех же условиях способствовало нормализации активностей ГТ, ГР и ГГТ. Изменения оксидантного статуса предстательной железы отравленных животных на фоне раздельного применения указанных препаратов носили однотипный характер и положительную направленность.
В условиях совместного использования оксиметилурацила и витаминно-минерального комплекса, в отличие от двух предпринятых нами схем экспериментальной монотерапии, зафиксировано более выраженное улучшение большинства описанных выше показателей, независимо от типа изученных тканей. Кроме этого, в тестикулах крыс, подвергшихся субхроническому воздействию совола, наблюдалось восстановление содержания АТФ и НАДФН до показателей интактных животных (рис 17). Активность Г-6-Ф ДГ в яичках крыс также достигала контрольных значений – 92,3%. Сочетанное введение животным комплекса витаминов и минералов с оксиметилурацилом оказывало стимулирующее влияние на биосинтез белков в пораженных соволом тестикулах крыс при интоксикации дозой 10 мг·сут·кг-1. Увеличение скорости включения [2-14С]-аланина в общие белки тестикул достигало 25% от показателей животных, получавших только совол. Зарегистрированное в этих экспериментах улучшение состояния различных видов обмена веществ в тестикулярной ткани предполагает возможность восстановления утраченной под действием ксенобиотика функциональной активности гонад как главного органа мужской репродуктивной системы.
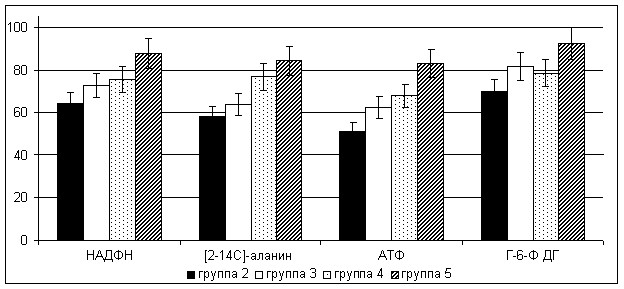
Рисунок 17. Влияние экспериментальной фармакологической коррекции на уровень НАДФН, АТФ, активность Г-6-Ф ДГ в семенниках и скорость включения [2-14С]-аланина в суммарные белки яичек крыс при отравления ПХБ
Статистически значимые изменения зарегистрированы при оценке содержания сперматозоидов, клеток Сертоли и Лейдига в тестикулярной ткани крыс, получавших комбинацию препаратов на фоне отравления соволом. Если у подопытных животных к концу эксперимента эти количественные показатели снижались в 2-3 раза, то при лечении они существенно улучшались (рис. 18).
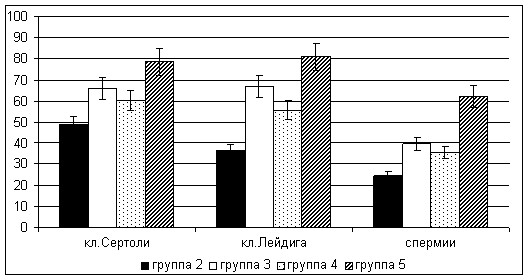
Рисунок 18. Содержание клеток Сертоли, Лейдига и сперматозоидов в тестикулярной ткани крыс, при изолированном и комбинированном применении фармакологических препаратов на фоне интоксикации ПХБ (% от контроля)
Особое значение имеет обнаруженное при экспериментальной коррекции восстановление гормонсинтетической активности тестикул крыс, находившихся в течение 60 дней под воздействием совола (рис. 19). Обнаружена нормализация сывороточных уровней ингибина и активина, продуцируемых в яичках клетками Сертоли.
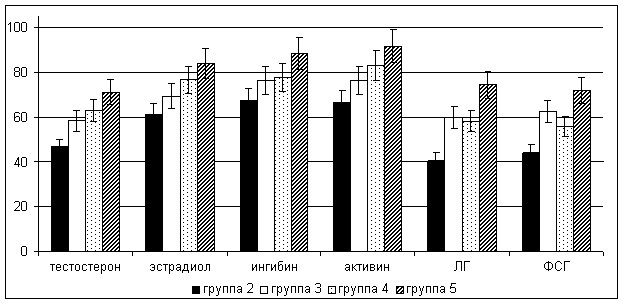
Рисунок 19. Влияние фармакологических препаратов на эндокринный статус крыс при длительном поступлении полихлорбифенилов (% от контроля)
Наблюдавшееся при субхронической интоксикации полихлорбифенилами падение концентрации эстрадиола в крови не зафиксировано у крыс, которые с 30-го дня отравления дополнительно получали комплекс селмевит+ОМУ.
При оценке состояния гормональной тестикулярно-гипофизарной оси репродуктивной системы экспериментальных животных также обнаружены позитивные эффекты антиоксидантной терапии. Применение препаратов на фоне интоксикации сопровождалось статистически значимым увеличением сывороточных концентраций тестостерона, лютеинизирующего и фолликулостимулирующего гонадотропинов. В то же время, полного восстановления их уровней до показателей интактных животных не происходило.
Таблица 4 – Уровень продуктов липопероксидации, неферментативных антиоксидантов и ОАА и в эякуляте экспериментальных животных
| Группа 1 | Группа 2 | Группа 3 | Группа 4 | Группа 5 | |
| ТБК-РП, мкмоль·г-1 ткани | 3,46 [2,89;4,10] | 10,77 [8,77;13,06] р1-2=0,0001 | 5,50 [4,54;6,59] р1-3=0,0008 р2-3=0,0002 | 6,22 [5,16;7,42] р1-4=0,0002 р2-4=0,0003 р3-4=0,2899 | 5,00 [4,02;6,14] р1-5=0,0051 р2-5=0,0001 р3-5=0,4056 р4-5=0,0821 |
| ОАА, % ингибирования | 74,85 [59,30;91,92] | 38,07 [29,78;47,18] р1-2=0,0003 | 57,56 [45,85;71,82] р1-3=0,0963 р2-3=0,0081 | 52,32 [41,67;64,69] р1-4=0,0155 р2-4=0,0283 р3-4=0,2899 | 61,80 [49,51;77,47] р1-5=0,1736 р2-5=0,0024 р3-5=0,7054 р4-5=0,2264 |
| ГВ, мг·г-1 белка | 1,11 [0,93;1,32] | 0,42 [0,34;0,51] р1-2=0,0001 | 0,86 [0,72;1,04] р1-3=0,0283 р2-3=0,0001 | 0,79 [0,66;0,94] р1-4=0,0081 р2-4=0,0002 р3-4=0,3257 | 0,92 [0,74;1,13] р1-5=0,1041 р2-5=0,0001 р3-5=0,5453 р4-5=0,1858 |
| ССГ, мг·г-1 белка | 35,75 [28,99;44,10] | 19,33 [15,50;24,12] р1-2=0,0003 | 32,57 [25,87;40,37] р1-3=0,2899 р2-3=0,0024 | 29,75 [24,06;36,46] р1-4=0,0963 р2-4=0,0051 р3-4=0,4496 | 36,61 [28,86;45,58] р1-5=0,8798 р2-5=0,0006 р3-5=0,2899 р4-5=0,1124 |
| Аскобат, мг·г-1 белка | 1,59 [1,34;1,89] | 0,78 [0,64;0,95] р1-2=0,0001 | 1,19 [0,99;1,43] р1-3=0,0126 р2-3=0,0024 | 0,96 [0,80;1,15] р1-4=0,0004 р2-4=0,0821 р3-4=0,0756 | 1,31 [1,06;1,61] р1-5=0,1041 р2-5=0,0008 р3-5=0,4056 р4-5=0,0155 |
| Токоферол, мг·г-1 белка | 2,66 [2,19;3,19] | 1,47 [1,23;1,75] р1-2=0,0003 | 1,98 [1,61;2,41] р1-3=0,0283 р2-3=0,0172 | 1,87 [1,55;2,23] р1-4=0,0081 р2-4=0,0283 р3-4=0,5707 | 2,17 [1,82;2,58] р1-5=0,0821 р2-5=0,0024 р3-5=0,3846 р4-5=0,1041 |
Нативный эякулят, полученный путем трансректальной электростимуляции, как ткань, непосредственно участвующая в процессе оплодотворения, был подвергнут более тщательному анализу. В целом, использование селмевита и ОМУ в спермопротекторных целях проявилось положительными эффектами в равной или близкой степени. В то же время, назначение селмевита, в отличие от ОМУ, сопровождалось большей выраженностью позитивного влияния на уровни аскорбиновой кислоты, токоферола, и, особенно, активности СОД и каталазы (таблица 4, рис. 20).
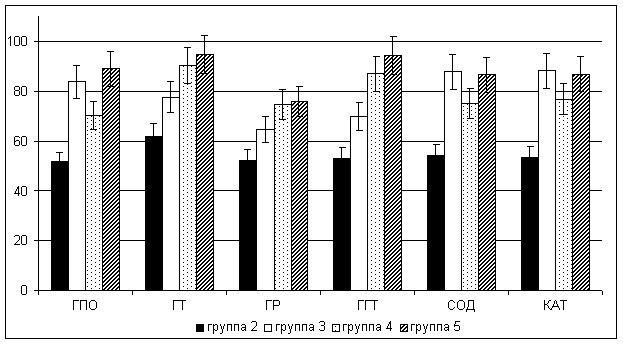
Рисунок 20. Активности ферментов антиоксидантной системы и обмена глутатиона в эякуляте крыс в условиях экспериментального применения фармакологических препаратов на фоне воздействия бифенилов (% от контроля)
Это может служить свидетельством нормализации функции метаболических систем в условиях предпринятой фармакологической коррекции. По-видимому, эти характерные особенности объясняются наличием в составе комплексного препарата «Селмевит» таких компонентов, как витамины С и Е, либо других (Se, Cu, Zn, Fe), входящих в состав активных центров ферментов, активности которых изучались в данной серии экспериментов.
Позитивные изменения гормонально-метаболического статуса тестикулярной ткани крыс сопровождались восстановлением сперматогенной функции и репродуктивного потенциала животных (таблица 5). Совместное назначение ОМУ и витаминно-минерального комплекса самцам (группа 5), подвергшимся субхронической интоксикации ПХБ в суточной дозе 10 мг·кг-1 массы тела, способствовало статистически значимому росту и нормализации общей концентрации сперматозоидов в эякуляте экспериментальных животных.
Наблюдалось заметное улучшение двигательной активности гамет. Если в группе животных, подвергшихся двухмесячному воздействию соволом мужских половых клеток, способных к активному поступательному движению не выявлялось, то в условиях применения на фоне интоксикации комплекса ОМУ с селмевитом доля спермием с прогрессивным типом двигательной активности в эякуляте составляла 40%.
Таблица 5 - Эффективность применения различных способов фармакологической коррекции ПХБ-индуцированных нарушений репродуктивного статуса самцов экспериментальных животных
| Группа 1 | Группа 2 | Группа 3 | Группа 4 | Группа 5 | |
| плодовитость | 10,5 [9,0;13,0] | 5,5 [5,0;7,0] р1-2=0,0001 | 7,5 [6,0;9,0] р1-3=0,0065 р2-3=0,0113 | 7,5 [7,0;9,0] р1-4=0,0045 р2-4=0,0072 р3-4=0,9097 | 8,5 [7,0;11,0] р1-5=0,0756 р2-5=0,0019 р3-5=0,2413 р4-5=0,2568 |
| концентрация сперматозоидов в эякуляте, млн·мл-1 | 47,0 [39,0;56,0] | 24,0 [20,0;29,0] р1-2=0,0001 | 28,5 [24,0;34,0] р1-3=0,0005 р2-3=0,1509 | 30,5 [25,0;36,0] р1-4=0,0013 р2-4=0,0493 р3-4=0,5205 | 38,0 [31,0;46,0] р1-5=0,0696 р2-5=0,0024 р3-5=0,0233 р4-5=0,0640 |
| доля сперматозоидов с поступательным движением, % | 71,0 [58,0;86,0] | 0 р1-2=0,0001 | 30,5 [25,0;38,0] р1-3=0,0001 р2-3=0,0001 | 22,0 [18,0;27,0] р1-4=0,0001 р2-4=0,0001 р3-4=0,0211 | 39,0 [31,0;49,0] р1-5=0,0005 р2-5=0,0001 р3-5=0,0821 р4-5=0,0008 |
Благодаря этому и, возможно, с учетом повышенного запаса прочности репродуктивного потенциала самцов крыс, в этой группе самцов наблюдалось существенное улучшение способности к оплодотворению, установленное в экспериментах по их спариванию с интактными самками. Так, если доля интактных самок, принесших приплод от самцов, подвергшихся субхронической интоксикации ПХБ в суточной дозе 10 мг·кг-1, составляла 20%, то при назначении указанных препаратов - 80% по отношению к контролю. О заметном восстановлении репродуктивного статуса отравленных животных путем перорального введения комбинации ОМУ и селмевита свидетельствует существенное увеличение плодовитости с 5,5 крысят в одном помёте до 8,5, что практически соответствует результатам спаривания интактных самцов и самок (10,5).
Резюмируя вышеизложенное, необходимо подчеркнуть, что выявленная в эксперименте эффективность применения фармакологических препаратов с антиоксидантным механизмом действия, с одной стороны, подтверждает предположения о том, что патохимической основой репротоксических эффектов бифенилов является развитие тяжелого окислительного стресса в различных тканях экспериментальных животных, с другой - определяет возможные пути патогенетически обоснованной репропротекторной терапии и профилактики развития субфертильных состояний, обусловленных отравлением полихлорированными бифенилами.
ВЫВОДЫ
1. Полихлорированные бифенилы оказывают повреждающее действие на репродуктивную функцию самцов крыс на различных уровнях организации мужской половой системы и её регуляции. Степень выраженности патологических сдвигов зависит от интенсивности, длительности и дозы поступления токсиканта.
2. При отравлении соволом развиваются нарушения эндокринного статуса экспериментальных животных, проявляющиеся в заметном снижении сывороточных концентраций половых гормонов, лютеинизирующего и фолликулостимулирующего гонадотропинов, а также трийодтиронина, тироксина и тиротропина.
3. Гонадотоксическое действие смеси ПХБ проявляется в выраженном нарушении биохимического статуса и морфофункционального состояния тестикул крыс. Экспериментальная интоксикация соволом приводит к гипотрофии яичек, уменьшению в тестикулярной ткани количества спермиев, клеток различных этапов сперматогенеза и гормонопоэза. Снижение содержания клеток Лейдига и Сертоли сопровождается падением уровня тестостерона, эстрадиола, активина, ингибина в крови экспериментальных животных.
4. В условиях длительного воздействия полихлорбифенилов наблюдается снижение тканевых уровней маркерных показателей функциональной активности семенных пузырьков, эпидидимиса, вентральной простаты - содержания фруктозы, активностей нейтральной -гликозидазы и кислой фосфатазы.
5. В условиях продолжительного поступления поллютанта происходит снижение репродуктивного потенциала крыс-самцов. При спаривании с интактными самками зафиксировано уменьшение количества успешных родов и индекса плодовитости. В нативном эякуляте животных, подвергавшихся длительной интоксикации ПХБ, зарегистрировано динамическое снижение общего содержания мужских половых гамет. Наиболее ранними признаками спермотоксического действия совола являются изменения биохимического и функционального статуса сперматозоидов.
6. Нарушение оксидантного баланса в мужских репродуктивных органах и эякуляте крыс является ведущим биохимческим механизмом патогенеза репродуктивной токсичности полихлорированных бифенилов. В тканях яичек, эпидидимиса, семенных пузырьков, предстательной железы и печени наблюдается истощение содержания глутатиона восстановленного, свободных сульфгидрильных групп, аскорбата, -токоферола, угнетение ферментативного звена антиоксидантной системы, общей антиокислительной активности и значительное увеличение содержания продуктов липопероксидации и окислительной модификации белков.
7. Применение фармакологических препаратов с антиоксидантным механизмом действия на фоне подострой интоксикации ксенобиотиком сопровождается значительным восстановлением оксидантного баланса в семенниках, сперме и печени крыс, что подтверждает важную роль окислительного стресса в развитии ПХБ-индуцированного угнетения мужской фертильности.
8. Оксиметилурацил, а также витаминно-минеральный комплекс «Селмевит» обладают корригирующим действием на оксидантный статус тканей репродуктивной системы самцов экспериментальных животных, подвергавшимся фоновому отравлению смесью полихлорбифенилов.
9. Комбинированное применение фармакологических препаратов («Селмевит» и «Иммурег») на фоне длительного поступления поллютанта оказывает выраженное репропротекторное действие и способствует значительному улучшению гормонального-метаболического статуса, функционального состояния мужской репродуктивной системы и оплодотворяющей способности самцов крыс.
Список основных работ, опубликованных по теме диссертации
1. Синдром андрогенной недостаточности как маркер техногенного загрязнения среды обитания / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко, Х.Г. Валеева, А.П. Голощапов, В.И. Иваха // Проблемы репродукции. – 2002. - № 1. – С. 46-51.
2. Морфометрические показатели клеток Лейдига при воздействии хлорорганических поллютантов / Ш.Н. Галимов Г.Р. Валеева, Д.Ш. Хамзина, Э.Ф. Аглетдинов, Э.Ф. Галимова // Морфология. – 2002. – Т. 121, № 2-3. – С. 37.
3. Влияние полихлорированных бифенилов на оплодотворяющую способность крыс в экспериментальных условиях / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин, О.Н. Шевантаева, К.В. Булыгин // Морфологические ведомости. – 2008. - № 2. – С. 123-125.
4. Патохимические механизмы тестикулярной токсичности стойких органических загрязнителей / Ф.Х. Камилов, Е.К. Алехин, Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева // Медицинская наука и образование Урала. – 2008. - № 6. – С. 44-46.
5. Изучение гонадотоксических эффектов полихлорированных бифенилов в условиях экспериментального отравления крыс-самцов / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин, М.Г. Романцов, К.В. Булыгин, Л.О. Макашева // Антибиотики и химиотерапия. - 2008. - Т. 53, № 7-8. - С. 15-18.
6. Гонадотоксическая активность полихлорированных бифенилов в условиях экспериментального отравления ксенобиотиками / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин, К.В. Булыгин, Л.О. Макашева // Вестник Санкт-Петербургской государственной медицинской академии им. И.И.Мечникова. – 2008. - № 3 (28). - С. 183-187.
7. Аглетдинов, Э.Ф. Влияние стойких загрязнителей на антиоксидантный статус печени крыс / Э.Ф. Аглетдинов, А.А. Никоноров, Ф.Х. Камилов // Гигиена и санитария. – 2009. - № 4. – С. 66-68.
8. Аглетдинов, Э.Ф. Фармакологическая коррекция тестикулярных эффектов полихлорированных бифенилов в эксперименте / Э.Ф. Аглетдинов, А.А. Никоноров, Ф.Х. Камилов // Гигиена и санитария. – 2009. - № 4. – С. 68-70.
9. Состояние антиоксидантной системы эякулята крыс в условиях субхронической интоксикации бифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева, Г.М. Абдуллина, Е.К. Алехин, Ф.Х. Камилов // Вестник Санкт-Петербургской государственной медицинской академии им. И.И.Мечникова. – 2009. - № 2 (31). - С. 142-145.
10. Аглетдинов, Э.Ф. Некоторые механизмы тестикулотоксичности полихлорбифенилов / Э.Ф. Аглетдинов // Антибиотики и химиотерапия. - 2009. - Т. 54, № 9-10. - С. 33-36.
11. Аглетдинов, Э.Ф. Окислительный стресс – основа нарушения мужской репродуктивной функции при отравлениях / Э.Ф. Аглетдинов // Вестник Санкт-Петербургской государственной медицинской академии им. И.И.Мечникова. – 2009. - № 4 (33). - С.195-198.
12. Аглетдинов, Э.Ф. Состояние антиоксидантной системы придатка яичка при экспериментальной интоксикации бифенилами / Э.Ф. Аглетдинов // Фундаментальные исследования. – 2010. - № 1. – С. 7-12.
13. Аглетдинов, Э.Ф. Нарушение энергетического обмена тестикулярной ткани крыс, подвергшихся отравлению полихлорированными бифенилами / Э.Ф. Аглетдинов // Фундаментальные исследования. – 2010. - № 2. – С. 9-13.
14. Антропогенное загрязнение среды обитания и репродуктивное здоровье мужчины / Ф.Х. Камилов, Ш.Н. Галимов, Д.С. Громенко, Э.Ф. Аглетдинов // Химическая экология: материалы школы-семинара. – Уфа: Изд-во БГУ, 2001. – С. 163-166.
15. Оценка риска репродуктивному здоровью мужчин в Республике Башкортостан / Ф.Х. Камилов, Н.И. Симонова, Д.С. Громенко, А.П. Голощапов, В.И. Иваха, Ш.Н. Галимов, Э.Ф. Аглетдинов // Проблемы интеграции науки, образования и производства южного региона Республики Башкортостан: сборник научных трудов Респ. научно-практической конференции. – Уфа: Изд-во «Гилем», 2001. – С. 13-16.
16. Репродуктивное здоровье мужчин как индикатор экологического неблагополучия / Д.С. Громенко, Ф.Х. Камилов, Ш.Н. Галимов, Х.Г. Валеева, В.И. Иваха, Э.Ф. Аглетдинов // Лечение бесплодия: нерешенные проблемы: сборник научных трудов VII конференции Российской ассоциации репродукции человека. – Саратов, 2001. – С. 15-16.
17. Экологические факторы и снижение риска репродуктивному здоровью в Республике Башкортостан: роль СМИ, перспективы сотрудничества / Ш.Н. Галимов, Э.Ф. Аглетдинов, Д.С. Громенко, Н.И. Симонова, В.И. Иваха, Ф.Х. Камилов // Экология. Бизнес. СМИ: сборник материалов Башкирской республиканской конференции. - Уфа: НИИБЖДРБ, 2001. – С. 38-42.
18. Оценка репродуктивного здоровья мужчин – рабочих одного из предприятий г. Туймазы / А.В. Варшавский, Д.С. Громенко, Э.Ф. Аглетдинов, М.И. Павлов, А.А. Ракчаев // Материалы научно-практической конференции молодых ученых Республики Башкортостан, посвященной Году матери, по специальности медицина. Здравоохранение Башкортостана. – Уфа, 2001. – Спецвыпуск №8. – С. 28-32.
19. Методы оценки репродуктивной функции мужчин. Учебное пособие для студентов, практических врачей и курсантов ИПО / Ш.Н. Галимов, Д.С. Громенко, Ф.Х. Камилов, Э.Ф. Аглетдинов, Р.Р. Фархутдинов, Н.И. Симонова, В.И. Иваха.– Уфа: Здравоохранение Башкортостана.- 2001.– 48 с.
20. Характеристика метаболических процессов в репродуктивных органах самцов крыс при воздействии экотоксикантов класса феноксигербицидов / Э.Ф. Аглетдинов, Э.Ф. Галимова, Ф.Х. Камилов, Ф.А. Сагидуллин // Тезисы научных докладов III съезда Биохимического Общества. – СПб., 2002. – С. 147.
21. Репродуктивное здоровье мужчин – жителей экологически кризисных территорий. Эндокринно-метаболические расстройства и их коррекция / Ф.Х. Камилов, А.П. Голощапов, Р.С. Кидрасова, Э.Ф. Аглетдинов // Тезисы научных докладов III съезда Биохимического Общества. – СПб.: Фарос Плюс, 2002. – С. 167-168.
22. Диоксины и репродуктивное здоровье мужчин в РБ / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко, Х.Г. Валеева, А.П. Голощапов, В.И. Иваха, Н.И. Симонова, Д.Ш. Хамзина // Национальный план действий по экологически обоснованному управлению диоксинами/фуранами и диоксиноподобными веществами: материалы Российской конференции. – СПб., 2002. – С. 92-96.
23. Окружающая среда и репродуктивное здоровье мужчин, проживающих в индустриальных городах РБ / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко, Э.Ф. Галимова // Актуальные вопросы охраны репродуктивного здоровья в медицине труда: материалы Всероссийской конференции. – Самара, 2002. – С. 39-42.
24. Хлорароматические экотоксиканты: эндокринно-метаболические расстройства и их коррекция / Ф.Х. Камилов, Ф.А. Сагидуллин, Ш.Н. Галимов, Э.Ф. Аглетдинов, Г.М. Абдуллина, Р.С. Кидрасова, Н.Т. Габдуллина // Медицинская наука – здравоохранению: материалы юбилейной конф., посвященной 70-летию БГМУ. – Уфа: Изд-во БГМУ, 2002. – С. 24-28.
25. Опыт оценки риска репродуктивному здоровью мужчин в Республике Башкортостан / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко, Э.Ф. Галимова // Влияние загрязнения окружающей среды на здоровье человека: материалы 1-й Всероссийской научной конф. с международным участием. – Новосибирск, 2002. – С. 173-174.
26. Гормонально-метаболические аспекты действия хлорированных бифенилов / Э.Ф. Аглетдинов, Ф.Х. Камилов, Э.Ф. Галимова, Ш.Н. Галимов, Г.М. Абдуллина, Н.Т. Габдуллина // Влияние загрязнения окружающей среды на здоровье человека: материалы 1-й Всероссийской научной конф. с международным участием. – Новосибирск, 2002. – С. 49-50.
27. Галимова, Э.Ф. Биохимические показатели спермоплазмы при экспериментальной интоксикации соволом / Э.Ф. Галимова, Э.Ф. Аглетдинов // Здравоохранение Башкортостана. – 2002. – Спецвыпуск №3. – С. 56-58.
28. Исчезающий пол: мужчина в зеркале эволюции и экологии / Ш.Н. Галимов, Э.Ф. Аглетдинов, Д.С. Громенко, А.З. Абдуллина Э.Ф. Галимова // Мужское здоровье и долголетие: материалы Российского научного форума. – М., 2003. – С. 44-45.
29. Коррекция биоэнергетических процессов: ключ к здоровью и долголетию / Ш.Н. Галимов, Р.М. Мухаметзянов, Э.Ф. Галимова, Э.Ф. Аглетдинов // Мужское здоровье и долголетие: материалы Российского научного форума. – М., 2003. – С. 30-31.
30. Дефицит андрогенов у мужчин в индустриальных городах Башкортостана: результаты обследования 2200 мужчин / Ш.Н. Галимов, Д.С. Громенко, Э.Ф. Аглетдинов, Э.Ф. Галимова, Ф.Х. Камилов // Андрология и генитальная хирургия. – 2003. - № 3, прил. – С. 128-129.
31. Андрогенный статус мужчин, проживающих на экологически несбалансированных территориях / Ф.Х. Камилов, Э.Ф. Аглетдинов, Э.Ф. Галимова, Ш.Н. Галимов // Проблемы популяционного здоровья: материалы Первой международной конф. – Челябинск; Монреаль: Изд-во ЧГМА, 2003. – С. 155-160.
32. Ecotoxicants and man reproductive health: the global threat / Ш.Н. Галимов, Э.Ф. Аглетдинов, Э.Ф. Галимова, Д.С. Громенко, З.К. Амирова, А.З. Абдуллина, Д.Ш. Хамзина // Environment and Human Health: The complete Works of International Ecologic Forum, June 29 – July 2, 2003, St. Petersburg, Russia / Editor in chief G.A. Sofronov. – SPb.: SpecLit, 2003. – P. 347-348.
33. Среда обитания и репродуктивное здоровье мужчин / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов, Д.С. Громенко // Влияние окружающей среды на формирование личности: материалы Российской научно-практической конференции. – Уфа: Восточный университет, 2003. – С. 193-195.
34. Лечение мужского бесплодия: новый взгляд на старую проблему / Ш.Н. Галимов, Р.М. Мухамедзянов, Д.С. Громенко, Э.Ф. Галимова, Э.Ф. Аглетдинов, Ф.Х. Камилов // Мужское здоровье и долголетие: материалы 2-го Российского научного форума. – М., 2004. – С. 33-34.
35. Экология и формирование здоровья населения: влияние стойких органических загрязнителей / Ф.Х. Камилов, А.Ж. Гильманов, Ш.Н. Галимов, Э.Ф. Аглетдинов, Г.Р. Валеева, Г.М. Абдуллина // Биологические и социально-экономические основы формирования здоровья населения Республики Башкортостан: сборник докладов Респ. Межведомственной научно-практической конференции-семинара. – Уфа, 2003. – С. 128-139.
36. Аглетдинов, Э.Ф. Состояние процессов энергопродукции в тканях семенников при экспериментальной интоксикации хлорорганическими соединениями / Э.Ф. Аглетдинов, Э.Ф. Галимова, Ф.А. Сагидуллин // Биохимия: от исследования молекулярных механизмов - до внедрения в клиническую практику и производство: Материалы межрегиональной конф. биохимиков Урала, Западной Сибири и Поволжья. – Оренбург, 2003. – С. 160-163.
37. Экополлютанты и репродуктивное здоровье мужчин: от оценки риска до профилактики нарушений / Ш.Н. Галимов, Э.Ф. Аглетдинов, Э.Ф. Галимова, А.З. Абдуллина, Р.М. Мухамедзянов, Ф.Х. Камилов // Профилактика нарушений репродуктивного здоровья от профессиональных и экологических факторов риска: материалы Международного конгресса / под ред. Н.Ф. Измерова, И.В. Дардынской, О.В. Сивочаловой, Н.И. Латышевской. – Волгоград, 2004. – С. 6-9.
38. Галимов, Ш.Н. Репродуктивное здоровье мужчин – индикатор экологического неблагополучия / Ш.Н. Галимов, Ф.Х. Камилов, Э.Ф. Аглетдинов // Биологические аспекты экологии человека: сборник материалов Всероссийской конференции с международным участием. – Архангельск, 2004. – Т. 1. - С. 219-221.
39. Аглетдинов, Э.Ф. Про- и антиоксидантный статус тканей репродуктивных органов крыс-самцов при экспериментальной интоксикации полихлорбифенилами / Э.Ф. Аглетдинов, Р.Э. Хабиров, К.В. Булыгин // Вопросы теоретической и практической медицины: материалы 71-ой итоговой Республиканской научной конференции студентов и молодых ученых с международным участием. – Уфа, 2006. – С. 257-258.
40. Камилов, Ф.Х. Эффективность комплексного препарата «Триовит» при повреждениях репродуктивных органов полихлорироваными бифенилами / Ф.Х. Камилов, Р.Э. Хабиров, Э.Ф. Аглетдинов // Медицинский вестник Башкортостана. – 2006. – Т. 4, № 1. – С. 235-238.
41. Камилов, Ф.Х. Фармакологическая коррекция токсических повреждений репродуктивной системы полихлорированными бифенилами в условиях эксперимента / Ф.Х. Камилов, Э.Ф. Аглетдинов, Р.Э. Хабиров // Медицинский вестник Башкортостана. – 2006. – Т. 4, № 1. – С. 238-241.
42. Гормонально-метаболические нарушения репродуктивной функции в условиях отравления хлорорганическими соединениями / Ф.Х. Камилов, Ш.Н. Галимов, Э.Ф. Галимова, Э.Ф. Аглетдинов, Р.Э. Хабиров // Медицинский вестник Башкортостана. – 2007. – Т. 2, № 3-4. – С. 235-238.
43. Камилов, Ф.Х. Токсическое поражение полихлорбифенилами системы энергопродукции семенников крыс в эксперименте / Ф.Х. Камилов, Е.К. Алехин, Э.Ф. Аглетдинов // Медицинский вестник Башкортостана. – 2007. – Т. 2, № 5. – С. 66-68.
44. Состояние энергопродукции в тканях семеников крыс в условиях экспериментального воздействия полихлорированых бифенилов / Э.Ф. Аглетдинов, К.В. Булыгин, Р.Э. Хабиров, Л.О. Макашева // Научный прорыв-2007: сборник научных трудов конференции ученых Республики Башкортостан, посвященной Году 450-летия Единства Башкортостана и России, 75-летию БГМУ, Дню Республики. – Уфа, 2007. – С. 3-6.
45. Влияние полихлорированных бифенилов на оксидантный статус тканей репродуктивных органов самцов крыс / Э.Ф. Аглетдинов, К.В. Булыгин, Р.Э. Хабиров, Л.О. Макашева // Научный прорыв-2007: сборник научных трудов конференции ученых Республики Башкортостан, посвященной Году 450-летия Единства Башкортостана и России, 75-летию БГМУ, Дню Республики. – Уфа, 2007. – С. 6-8.
46. Аглетдинов, Э.Ф. Тестикулярные эффекты подострой интоксикации полихлорбифенилами в эксперименте / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева // Вестник Российской военно-медицинской академии. – 2008. - № 3 (23): прил. 2. – С. 49.
47. Аглетдинов, Э.Ф. Состояние неферментативного звена антиоксидантной системы тканей семенников в условиях подострого отравления бифенилами / Э.Ф. Аглетдинов, Л.О. Макашева, К.В. Булыгин // Вестник Российской военно-медицинской академии. – 2008. - № 3 (23): прил. 2. – С.50.
48. Камилов, Ф.Х. Фармакологическая коррекция ПХБ-индуцированных нарушений активности некоторых ферментов антиоксидантной системы семенников экспериментальных животных / Ф.Х. Камилов, Е.К. Алехин, Э.Ф. Аглетдинов // Вестник Российской военно-медицинской академии. – 2008. - № 3 (23): прил. 2. – С. 52.
49. Влияние полихлорированных бифенилов на оплодотворяющую способность крыс в экспериментальных условиях / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин, К.В. Булыгин // Медицинский вестник Башкортостана. – 2008. – Т. 3, № 2, прил.: Морфофункциональные аспекты нормы и патологии: материалы Российской межрегиональной конференции С. 8-11.
50. Состояние глутатион-зависимой антиоксидантной системы печени крыс в условиях экспериментального отравления полихлорированными бифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева, Е.К. Алехин, Ф.Х. Камилов // Астраханский медицинский журнал – 2008. – Т. 3, № 3: прил. – С. 240-242.
51. Сперматогенез в условиях экспериментальной интоксикации полихлорбифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева, Ф.Х. Камилов // ІV съезд Российского общества биохимиков и молекулярных биологов: сборник материалов. – Новосибирск, 2008. – С. 420.
52. Состояние системы глутатиона печени крыс в условиях интоксикации бифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева, Ф.Х. Камилов // ІV съезд Российского общества биохимиков и молекулярных биологов: сборник материалов. – Новосибирск, 2008. – С. 464.
53. Аглетдинов, Э.Ф. Экспериментальная попытка фармакологической коррекции нарушений антиоксидантного статуса семенников крыс / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин // Мужское здоровье и долголетие: материалы 6-ой Международной медицинской выставки. – М., 2008. – С. 8.
54. Булыгин, К.В. Нарушения сперматогенной функции крыс в условиях подострой интоксикации полихлорбифенилами / К.В. Булыгин, Э.Ф. Аглетдинов, Л.О. Макашева // Мужское здоровье и долголетие: материалы 6-ой Международной медицинской выставки. – М., 2008. – С. 28.
55. Макашева, Л.О. Некоторые особенности состояния антиоксидантного статуса тканей семенников в условиях подострого отравления бифенилами / Л.О. Макашева, Э.Ф. Аглетдинов, К.В. Булыгин // Мужское здоровье и долголетие: материалы 6-ой Международной медицинской выставки. – М., 2008. – С. 65.
56. Клеточный состав семенников крыс, подвергшихся подострому отравлению хлорированными бифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Л.О. Макашева, Ф.Х. Камилов // Актуальные проблемы теоретической и прикладной биохимии: Всероссийская конференция, посвященная 80-летию со дня рождения профессора Р.И. Лифшица. - Челябинск, 2009. – С. 205-207.
57. Экспериментальная коррекция спермотоксических эффектов полихлорированных бифенилов / К.В. Булыгин, Э.Ф. Аглетдинов, Л.О. Макашева, Е.К. Алехин, Ф.Х. Камилов // Актуальные проблемы теоретической и прикладной биохимии: Всероссийская конференция, посвященная 80-летию со дня рождения профессора Р.И. Лифшица. - Челябинск, 2009. – С. 101-103.
58. Влияние полихлорбифенилов на состояние антиоксидантной системы эякулята крыс / Л.О. Макашева, Э.Ф. Аглетдинов, К.В. Булыгин, Г.М. Абдуллина // Актуальные проблемы теоретической и прикладной биохимии: Всероссийская конференция, посвященная 80-летию со дня рождения профессора Р.И. Лифшица. - Челябинск, 2009. – С. 236-238.
59. Аглетдинов, Э.Ф. Влияние токсикантов на мужскую фертильность (экспериментальные исследования) / Э.Ф. Аглетдинов, Ф.Х. Камилов, Е.К. Алехин // Фармакотерапевтический альманах. – 2009. – Вып. 3. – С. 93-95.
60. Антиоксидантный статус эпидидимиса крыс в условиях подострой интоксикации полихлорбифенилами / Э.Ф. Аглетдинов, К.В. Булыгин, Н.Т. Карягина, Ф.Х. Камилов // Астраханский медицинский журнал – 2010. – Т. 5, № 1: прил. – С. 220-222.

