No-синтазная активность лактобацилл: обнаружение, геномные детерминанты, функции
На правах рукописи
ЯРУЛЛИНА Дина Рашидовна
NO-СИНТАЗНАЯ АКТИВНОСТЬ ЛАКТОБАЦИЛЛ:
ОБНАРУЖЕНИЕ, ГЕНОМНЫЕ ДЕТЕРМИНАНТЫ, ФУНКЦИИ
03.00.07 - Микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Казань – 2007
Работа выполнена на кафедре микробиологии биолого-почвенного факультета Казанского государственного университета им. В.И.Ульянова-Ленина.
Научный руководитель: доктор биологических наук, профессор
Ильинская Ольга Николаевна
Официальные оппоненты: доктор биологических наук, профессор
Селивановская Светлана Юрьевна
(кафедра прикладной экологии
Казанского государственного университета,
г. Казань)
доктор медицинских наук, профессор
Дармов Илья Владимирович
(кафедра микробиологии
Вятского государственного университета,
г. Киров)
Ведущая организация: Институт экологии и генетики микроорганизмов
УрО РАН, г. Пермь.
Защита состоится «27» сентября 2007 г. в __ часов на заседании диссертационного совета Д 212.081.08 при Казанском государственном университете им. В.И.Ульянова-Ленина по адресу: 420008, г. Казань, ул. Кремлевская, д. 18, главное здание, ауд. 209.
С диссертацией можно ознакомиться в научной библиотеке им. Н.И.Лобачевского Казанского государственного университета.
Автореферат разослан «___» ____________ 2007 г.
Ученый секретарь диссертационного совета,
![]()
доктор биологических наук Абрамова З.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В последние несколько десятилетий проблема исследования оксида азота (NO) является одним из наиболее активно развивающихся направлений биомедицинских исследований [Ванин, 1998]. Лавинообразный рост публикаций по биологии NO, начавшийся с конца 80-х годов, позволил редакции журнала «Science» в 1992 г. провозгласить NO молекулой года [Koshland, 1992]. Спустя несколько лет в 1998 г. группа американских ученых была удостоена Нобелевской премии в области физиологии и медицины за выяснение роли NO как сигнальной молекулы в регуляции сердечно-сосудистой системы. Непрерывно вырабатываемый в организме животных и человека ферментативным путем из L-аргинина, оксид азота является одним из универсальных регуляторов клеточного и тканевого метаболизма. Наряду с регуляторными функциями NO обнаруживает также цитотоксическую/цитостатическую активность, выступая в качестве одного из основных эффекторов системы клеточного иммунитета [Alderton et al., 2001].
В отличие от эукариотического, процесс бактериального синтеза NO исследован недостаточно. Лактобациллы – это одни из немногих микроорганизмов, у которых обнаружен альтернативный денитрификации NO-синтазный (NOS) путь образования оксида азота [Adawi et al., 1997; Morita et al., 1997]. Бактерии рода Lactobacillus представляют собой важный компонент естественной микрофлоры кишечного и урогенитального трактов человека и животных, где они подавляют рост патогенных микроорганизмов, способствуют регенерации эпителия слизистой оболочки, оказывают иммуномодулирующее действие [Orrhage, Nord, 2000]. Высокая биологическая активность микроорганизмов этой группы обусловила их широкое использование в производстве продуктов питания и промышленно важных пробиотических препаратов [Nguyen et al., 2007]. Изучение закономерностей биосинтеза оксида азота комменсальными кишечными бактериями L. plantarum позволит разработать фундаментальные основы практического манипулирования внутриклеточными регуляторами на молекулярном уровне и наметить конкретные технологические подходы использования пробиотических препаратов для лечения заболеваний человека и животных, обусловленных теми или иными отклонениями в образовании NO.
Цель настоящей работы - поиск альтернативного пути образования оксида азота, отличного от денитрификации, подтверждение его наличия на основе генетического анализа и оценка физиологической роли NO у лактобацилл.
Основные задачи исследования:
- Проанализировать возможность образования оксида азота у L. plantarum в процессе диссимиляционной нитритредукции, а также небиологическим путем.
- На генетическом уровне оценить потенциальную возможность проявления NO-синтазной активности у L. plantarum.
- Выявить и охарактеризовать NO-синтазную активность у L. plantarum прямыми методами регистрации оксида азота (ЭПР, флуоресцентное окрашивание и микроскопия), а также с помощью иммунологических подходов.
- Оценить возможность ингибирования бактериальной NO-синтазы классическими ингибиторами NO-синтазы эукариот.
- Выявить влияние прокариотической NO-синтазной системы на рост и жизнеспособность продуцентов, а также морфофизиологическое состояние поверхности клеток.
- Установить роль оксида азота NO-синтазного происхождения как универсального фактора стрессорного и адаптивного ответов клеток различного уровня организации в условиях токсического и температурного стресса.
Научная новизна. Методом ЭПР-спектроскопии и флуоресцентного окрашивания впервые обнаружен специфичный для L. plantarum NO-синтазный путь образования оксида азота. Впервые приведены убедительные доказательства того, что исследуемые микроорганизмы не образуют NO в процессе денитрификации. Впервые использован метод окрашивания флуоресцентными красителями для регистрации молекулы оксида азота в метаболизме лактобацилл. В работе впервые с помощью методов биоинформатики проведен системный анализ генетической обусловленности биосинтеза оксида азота у L. plantarum. Намечены подходы к оценке физиологического смысла образования оксида азота клетками лактобацилл. Установлено, что индуцированный L-аргинином синтез NO нетоксичен для продуцента, но приводит к изменению морфофизиологического состояния поверхности клеток. Впервые получены свидетельства наличия у L. plantarum S-слоя, обнаруживаемого в условиях активации NO-синтазы. Впервые приведены данные, указывающие на участие микробного NO в стресс-реакциях бактерий, позволяющие рассматривать оксид азота как универсальный фактор стрессорного и адаптивного ответов клеток различного уровня организации.
Практическая значимость. Перспективы внедрения результатов работы обусловлены двумя аспектами: функциональной активностью NO и высокой промышленной и медицинской значимостью объекта исследования – лактобацилл. Установленное участие NO в регуляции формирования поверхностного S-слоя бактерий, определяющего адгезию клеток на эпителии кишечника, позволит разработать подходы к увеличению колонизирующей способности лактобацилл, а следовательно, и положительного влияния на здоровье человека. Обнаружение закономерностей регуляции биосинтеза NO у микроорганизмов имеет огромное значение для биотехнологии и медицины, поскольку обеспечивает потенциальную возможность направленной регуляции синтеза NO комменсальными бактериями в кишечнике человека с целью поддержания уровня оксида азота на необходимом для нормальной жизнедеятельности организма уровне. В целом, проведенные исследования открывают перспективы использования пробиотиков на основе L. plantarum в качестве альтернативного фармакологического и терапевтического средства борьбы с заболеваниями человека и животных, связанными с отклонениями в образовании NO.
В ходе экспериментальной работы была разработана и опробована оригинальная методика определения оксида азота с помощью NO-чувствительных флуоресцентных красителей, а также осуществлен экспериментальный подбор спиновой ловушки для детекции бактериального NO методом ЭПР-спектроскопии.
Связь работы с научными программами и собственный вклад автора в исследования. Работа проводится в соответствии с тематическим планом НИР КГУ 1.15.06 «Механизмы регуляции функциональной активности клетки». Исследования автора по тематике работы поддержаны федеральными программами «Развитие научного потенциала высшей школы» РНП.2.1.1.1005, РНП.2.1.1.3222 и «Исследования и разработки по приоритетным направлениям науки и техники», ГК 02.434.11.3020, ГК 02.512.11.2050, ГК ФЦКП КГУ 02.451.11.7019. Авторские исследования получили персональную поддержку Института фармакологии г. Гиссен, Германия (2006, 2007 гг.), Немецкой службы академических обменов (DAAD) (2005 г., 2007 – 2008 гг.), Немецкого Общества физиологов (2006 г.), а также программы партнерских отношений Казанского государственного университета (Казань, Россия) и Университета им. Юстуса-Либиха (Гиссен, Германия) (2005 г.). Научные положения диссертации и выводы базируются на результатах собственных исследований автора. Флуоресцентную детекцию оксида азота проводили на базе Института фармакологии г. Гиссен, Германия. ЭПР-спектроскопия выполнена на кафедре электроники и радиоспектроскопии КГУ. Атомную силовую микроскопию осуществляли на кафедре оптики и нанофотоники КГУ. Сканирующая электронная микроскопия выполнена на кафедре полезных ископаемых и разведочного дела КГУ.
Положения, выносимые на защиту:
- Бактерии L. plantarum обладают специфическим, отличным от денитрификации, NO-синтазным механизмом образования оксида азота.
- Генетическая программа L. plantarum подтверждает наличие у них NO-синтазной активности, отличной от NO-синтазы эукариот и прокариот - обладателей оксигеназного домена NO-синтазы.
- Оксид азота NO-синтазного происхождения у бактерий играет роль универсального фактора стрессорного и адаптивного ответов клеток.
- При индукции NO-синтазы субстратом L-аргинином происходит изменение морфофизиологического состояния поверхности клеток L. plantarum, связанное с формированием S-слоя.
Апробация работы. Материалы диссертации доложены и обсуждены на Международной конференции студентов, аспирантов и молодых ученых «Ломоносов – 2007» (Москва, 2007), XI Международной экологической студенческой конференции «Экология России и сопредельных территорий. Экологический катализ» (Новосибирск, 2006), молодежной научно-практической конференции «Актуальные проблемы науки и образования», (Зеленодольск, 2006), Международной конференции Немецкого Общества физиологов и Федерации Европейских физиологических обществ (Мюнхен, 2006), II Международной конференции «Микробное разнообразие: состояние, стратегия сохранения, биологический потенциал» (Пермь, 2005), 9-ой Международной Пущинской школе-конференции молодых ученых «Биология - наука XXI века» (Пущино, 2005), 79-ой всероссийской студенческой конференции, посвященной 1000-летию Казани (Казань, 2005), конференции «Постгеномная эра в биологии и проблемы биотехнологии» (Казань, 2004), междисциплинарной конференции с международным участием «Новые биокибернетические и телемедицинские технологии 21 века для диагностики и лечения заболеваний человека» (Петрозаводск, 2003), V, VII конференциях НОЦ КГУ «Материалы и технологии XXI века» (Казань, 2005, 2007), а также на итоговых конференциях КГУ (2004-2007).
Публикации. По теме диссертации опубликовано 17 научных работ.
Структура и объем диссертации. Работа изложена на 155 страницах, содержит 8 таблиц и 33 рисунка и состоит из введения, обзора литературы, описания материалов и методов, результатов исследований, обсуждения результатов, выводов и списка литературы, включающего 301 источник, из них 275 на иностранном языке.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Объектом исследования служили бактерии Lactobacillus plantarum №52 из коллекции НИИ сельскохозяйственной микробиологии РАСХН (г. Санкт-Петербург) и Lactobacillus plantarum 8P-A3, выделенные из препарата «Лактобактерин сухой» (ФГУП «Пермское НПО «Биомед», г. Пермь). Индукцию синтеза оксида азота биназой (РНКазой Bacillus intermedius) фиксировали с помощью фибробластов мыши NIH3T3 и фибробластов мыши, трансформированных онкогеном ras, (ras-NIH3T3) из коллекции Института фармакологии г. Гиссен, Германия.
Визуализацию объектов исследования проводили с помощью растрового электронного микроскопа XL 30 (Philips, Нидерланды), атомно-силового микроскопа Solver P47H (ЗАО «НТ-МДТ», Россия) полуконтактным методом на воздухе [Коновалова с соавт., 2005] и флуоресцентных микроскопов DM 6000B и DMIRE2 (Leica, Германия).
Способность бактерий к денитрификации определяли стандартными методами по содержанию нитратов, нитритов и газообразных продуктов денитрификации в культуральной жидкости [Сайманова, Захарова, 1980; Герхардт, 1984].
Анализ токсичности субстрата (L-аргинина) и ингибиторов NOS проводили, оценивая выживаемость штаммов бактерий; эффекты длительного (3, 6 и 24 ч) контакта бактерий с L-аргинином на число КОЕ; влияние L-аргинина и L-NAME на динамику роста бактерий, а также с помощью селективного флуоресцентного окрашивания клеток реактивом LIVE/DEAD BacLight Bacterial Viability Kits (Molecular Probes).
Регистрацию оксида азота методом ЭПР-спектроскопии проводили на спектрометре Bruker ESP-300 (Германия). На способность формировать с оксидом азота, продуцируемым L. plantarum 8Р-А3, комплексы, детектируемые методом ЭПР, исследовали аскорбиновую кислоту [Kuropteva, Kudryavtsev, 1997], комплекс Fe2+(DETC)2 [Mikoyan et al., 1997] и железосерные центры белков лактобацилл [Жумабаева с соавт., 2001]. Опытный вариант для NO-синтазы содержал L-аргинин и NADPH и инкубировался аэробно. Для регистрации NO в процессе денитрификации в реакционную смесь добавляли KNO3 и выдерживали в анаэробных условиях в атмосфере углекислого газа.
Флуоресцентное определение оксида азота и активных форм кислорода (АФК) проводили с помощью NO-чувствительных флуоресцентных красителей: позволяющего визуализировать только внутриклеточный NO диацетильного производного 4-амино-5-метиламино-2’,7’-дифторфлуоресцеина (DAF-FM DA) (Molecular Probes) и детектирующего весь оксид азота пробы 1,2-диаминоантрахинона (DAA) (Molecular Probes). Внутриклеточные АФК окрашивали с помощью реактива Image-iTTM LIVE Green Reactive Oxygen Species Detection Kit (Molecular Probes), основным действующим агентом которого является диацетильное производное 5,6-карбокси-2’,7’-дихлордигидрофлуоресцеина (карбокси-H2DCFDA). Также проводили комбинированное окрашивание йодидом пропидия (PI) и DAF-FM DA и PI и карбокси-H2DCFDA.
Иммуноблотинг клеточных экстрактов L. plantarum №52 проводили с использованием мышиных антител к nNOS (BD Biosciences, разведение 1:500), eNOS и iNOS (BD Biosciences, разведение 1:2500). Иммунодетекцию осуществляли с помощью конъюгированных с пероксидазой хрена козьих антител против иммуноглобулинов мыши (Dako, Великобритания; разведение 1:2000) и набора ECL (Amersham, Великобритания).
Методы биоинформатики. Для анализа использовали полную последовательность генома L. plantarum WCFS1 (NC_004567) [Kleerebezem et al., 2003]. Поиск гомологичных последовательностей в базе данных GenBank [Benson et al., 1999] осуществляли с помощью программы BLAST [Altschul et al., 1997] (http://www.ncbi.nlm.nih.gov/BLAST/). Бактериальные пептиды, использовавшиеся в качестве запроса при скрининге генома L. plantarum WCFS1 на наличие гомологов bNOSoxy, перечислены в табл. 1. Для множественного выравнивания использовали алгоритм ClustalW [Chenna et al., 2003] (http://www.ebi.ac.uk/clustalw/). Метаболические пути анализировали, используя базу данных KEGG [Kanehisa et al., 2002] (http://www.genome.ad.jp/kegg/).
Статистическую обработку результатов проводили с помощью компьютерной программы «Microsoft-Excel».
Таблица 1
Известные бактериальные NO-синтазы (оксигеназный домен), bNOSoxy
| № | Штамм | Белок |
| 1 | Bacillus cereus ATCC 14579 | NP_835105 |
| 2 | Bacillus halodurans C-125 | NP_241689 |
| 3 | Bacillus subtilis | O34453 |
| 4 | Deinococcus radiodurans R1 | Q9RR97 |
| 5 | Oceanobacillus iheyensis HTE831 | NP_693612 |
| 6 | Staphylococcus aureus N315 | NP_375287 |
| 7 | Staphylococcus aureus N315 | NP_374522 |
| 8 | Staphylococcus aureus Mu50 | BAB58076 |
| 9 | Staphylococcus aureus MW2 | BAB95720 |
| 10 | Staphylococcus aureus | P0A004 |
| 11 | Staphylococcus epidermidis ATCC 12228 | AAO05197 |
| 12 | Streptomyces acidiscabies | AAO53226 |
| 13 | Streptomyces scabies | AAO53225 |
| 14 | Streptomyces turgidiscabies | AAO53227 |
Результаты исследования
Оценка возможности синтеза NO в ходе денитрификации
Чтобы исключить возможность синтеза NO бактериями L. plantarum в ходе денитрификации, провели комплексный анализ возможности этого процесса у исследуемых лактобацилл с использованием средств биоинформатики, классических микробиологических подходов и ЭПР-спектроскопии.
В геноме L. plantarum WCFS1 обнаружен кластер генов нитратредуктазы: narG, narH, narJ и narI, кодирующие альфа, бета, дельта и гамма цепи нитратредуктазы, и отсутствие генов нитритредуктазы, катализирующей восстановление нитрита до NO. Скрининг генома исследуемого микроорганизма на наличие гомологов известных нитритредуктаз бактерий выявил два белка с e-value менее 0.01: SufI (CAD63002) и lp_2219 (CAD64560). Функция одного из них, SufI (CAD63002), известна и состоит в участии в процессе клеточного деления. Биологическая роль второго белка - lp_2219 (CAD64560) - не определена. Проведенный поиск его структурных гомологов установил, что по аминокислотной последовательности он очень сходен с 3-карбоксимуконат циклазой Leuconostoc mesenteroides ATCC 8293 (YP_818140) (e-value 4e-102), что позволяет предположить участие белка lp_2219 в метаболизме углеводородов.
Результаты изучения способности лактобацилл к денитрификации (табл. 2) показывают, что исследуемые бактерии не способны вести полный процесс денитрификации, однако могут восстанавливать нитраты до нитритов.
Таблица 2
Исследование способности лактобацилл к денитрификации
| Штамм | Нитраты | Нитриты, мкг/л (ср. ± ст. откл.) | Газообразные продукты денитрификации |
| L. plantarum №52 | + | 6,97 ± 1,77 | |
| L. plantarum 8P-A3 | + | 6,94 ± 0,74 |
+ - обнаруживаются в пробе, - не обнаруживаются в пробе.
Чтобы убедиться в отсутствии у L. plantarum нитритредуктазы с низкой каталитической активностью, нами проведена ЭПР-спектроскопия проб, инкубируемых в условиях, благоприятных для денитрификации. В инкубируемых анаэробно и содержащих 20 мМ KNO3 пробах на активность нитритредуктазы регистрировали сигнал от комплекса (DETC)2-Fe2+-NO (рис. 1Б), свидетельствующий о присутствии в реакционной смеси оксида азота. Однако увеличение времени инкубации проб приводило к снижению концентрации парамагнитных комплексов, а удаление из реакционной смеси бактерий не влияло на концентрацию NO в пробах (рис. 1А). По-видимому, данный эффект вызван небиологическим происхождением регистрируемого NO из нитритов в кислой среде [Weitzberg, Lundberg, 1998; Zweier et al., 1999].
  | Рис. 1. (А) - Содержание NO в пробах L. plantarum 8Р-А3, инкубируемых анаэробно с KNO3 (20 мМ) в присутствии (светлые столбцы) и в отсутствие (заштрихованный столбец) бактерий. * - достоверно отличается от вариантов с 60 мин инкубацией (р 0.05). (Б) - Спектр ЭПР клеток L. plantarum 8Р-А3, зарегистрированный с использованием комплекса Fe2+(DETC)2 в качестве спиновой ловушки NO. |
Таким образом, в условиях, благоприятных для денитрификации (дефицит кислорода и наличие нитратов в среде культивирования), биологическим путем оксид азота не образуется, что свидетельствует об отсутствии активности фермента нитритредуктазы у L. plantarum 8Р-А3. Данные микроорганизмы обнаруживают способность вести лишь первый этап денитрификации, что полностью согласуется с их генетической программой.
Влияние субстрата и ингибиторов NO-синтазы на рост лактобацилл
Цитотоксичность используемых в работе ингибиторов и субстрата NOS была исследована в различных тест-системах. Сравнение динамики роста L. plantarum 8Р-А3 и L. plantarum №52 в присутствии и в отсутствие 100 мкМ L-аргинина и 100 мкМ L-NAME (рис. 2) показало, что в данной концентрации эти вещества не оказывают влияние на рост бактерий. Полученные данные нашли подтверждение в результатах экспериментов по определению жизнеспособности бактерий с помощью теста LIVE/DEAD: инкубация бактерий L. plantarum 8Р-А3 и L. plantarum №52 с 100 мкМ L-аргинина, 100 мкМ L-NAME, 100 мкМ L-NIL или 10 мкМ nNOS ингибитора I не влияет на жизнеспособность микробных клеток (рис. 3).
 | 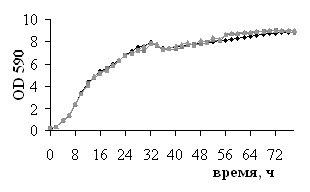 | ||
| Рис. 2. Динамики роста культур L. plantarum 8Р-А3 (I) и L. plantarum №52 (II), инкубируемых в отсутствие (А) и в присутствии (Б) 100 мкМ L-аргинина или 100 мкМ L-NAME (В). | |||
 | 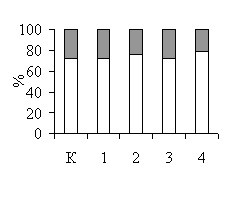 | ||
Рис. 3. Токсичность субстрата (1 – 100 мкМ L-аргинин) и ингибиторов NOS (2 – 100 мкМ L-NAME, 3 – 100 мкМ L-NIL, 4 – 10 мкМ nNOS ингибитор I) по отношению к культурам L. plantarum 8Р-А3 (А) и L. plantarum №52 (Б), определенная с помощью LIVE/DEAD BacLight Bacterial Viability Kits. К – контроль.
Поиск генетических детерминант NO-синтазной активности у лактобацилл
С помощью программы BLAST в геноме исследуемых микроорганизмов обнаружили ряд гомологов bNOSoxy (табл. 1), а именно, 92 пептида, среди которых мы выделили 2 группы белков, предположительно способных осуществлять акт каталитического окисления L-аргинина: собственно оксидоредуктазы (5 белков) и белки с неизвестной функцией (8 белков) (табл. 3). Пептиды, обладающие известной, но отличной от оксидоредуктазной активностью, несмотря на гомологию c bNOSoxy, были исключены как неспособные к выполнению заданной каталитической функции. Проведенные выравнивания белков табл. 3 с известными bNOSoxy, а также тремя различными изоформами NO-синтазы млекопитающих (eNOS Bos taurus (NP_851380), nNOS Homo sapiens (NP_000611), iNOS Rattus norvegicus (NP_036743)) идентифицировали их незначительную гомологию с NOS бактерий и животных в функционально активных сайтах: сайтах связывания гемовой группы, птеридинового кольца тетрагидробиоптерина (BH4) и субстрата L-аргинина. Однако это не исключает возможности выполнения данными белками каталитической функции NO-синтазы, а низкая степень гомологии может объясняться многообразием семейств NOS,
Таблица 3
Гомологи известных бактериальных NO-синтаз (bNOSoxy) в геноме
L. plantarum WCFS1
| Группа | Название белка L. plantarum WCFS1 | Регистрацион-ный номер белка L. plantarum WCFS1 в GenBank | Гомологом чего является | e-value | |
| Регистрацион-ный номер белка в GenBank | Микроорганизм -источник | ||||
| I. Окси-доредук-тазы | Короткоцепочечн.дегидрогеназа | NP_784171 | NP_835105 | Bacillus cereus ATCC 14579 | 0.29 |
| NP_241689 | Bacillus halodurans C-125 | 0.021 | |||
| O34453 | Bacillus subtilis | 3.0 | |||
| NP_693612 | Oceanobacillus iheyensis HTE831 | 0.88 | |||
| AAO53226 | Streptomyces acidiscabies | 2.2 | |||
| AAO53225 | Streptomyces scabies | 2.2 | |||
| AAO53227 | Streptomyces turgidiscabies | 0.44 | |||
| Алкоголь-дегидрогеназа | NP_785248 | O34453 | Bacillus subtilis | 3.9 | |
| NP_375287 | Staphylococcus aureus N315 | 5.6 | |||
| Оксидоредуктаза | NP_785816 | NP_375287 | Staphylococcus aureus N315 | 5.6 | |
| Аспартат-семиальдегид- дегидрогеназа | NP_784981 | BAB58076 | Staphylococcus aureus Mu50 | 2.5 | |
| BAB95720 | Staphylococcus aureus MW2 | 2.5 | |||
| P0A004 | Staphylococcus aureus | 2.5 | |||
| Короткоцепочечн. дегидрогеназа/ок-сидоредуктаза | NP_785994 | AAO05197 | Staphylococcus epidermidis ATCC 12228 | 4.2 | |
| II. Бел-ки с не-извест-ной функ-цией | белок lp_2589 | NP_786009 | NP_241689 | Bacillus halodurans C-125 | 7.4 |
| белок lp_1531 | NP_785135 | O34453 | Bacillus subtilis | 6.6 | |
| белок lp_3275 | NP_786535 | 6.8 | |||
| белок lp_0457 | NP_784249 | Q9RR97 | Deinococcus radiodurans R1 | 5.5 | |
| белок lp_0444 | NP_784238 | NP_375287 | Staphylococcus aureus N315 | 7.4 | |
| белок lp_0948 | NP_784663 | NP_374522 | Staphylococcus aureus N315 | 2.8 | |
| белок lp_2149 | NP_785655 | 3.7 | |||
| белок lp_3683 | NP_786870 | AAO53227 | Streptomyces turgidiscabies | 6.3 | |
зачастую очень различных по аминокислотным последовательностям [Zemojtel et al., 2004].
В геноме L. plantarum WCFS1 обнаружен белок флаводоксин (CAD63933), который на 50-57% гомологичен редуктазному домену NOS (NOSred) млекопитающих. Сходство аминокислотных последовательностей (рис. 4) и идентичность выполняемых функций позволяют с большой долей вероятности ожидать, что флаводоксин может выполнять в клетках лактобацилл роль NOSred.
human eNOS VKATILYGSETGRAQSYAQQLG-RLFRKAFDPRVLCMDEYDVVSLEHETLVLVVTSTFGNGDP
human nNOS VKATILYATETGKSQAYAKTLC-EIFKHAFDAKVMSMEEYDIVHLEHETLVLVVTSTFGNGDP
human iNOS VRVTILFATETGKSEALAWDLG-ALFSCAFNPKVVCMDKYRLSCLEEERLLLVVTSTFGNGDC
flavodoxin MKAEIIYASLTGNNEEIAEIIQNQLREHHVDTNFTEIGQADAFDLPVADLIVIVPYTYGEGDL
::. *::.: **. : * : :.:... : : * *:::*. *:*:**
human eNOS PENGESFAAALMEMS-//-LGTLRFCVFGLGSRAYPH-FCAFARAVDTRLEELGGERLLQLGQG
human nNOS PENGEKFGCALMEMR-//-LANVRFSVFGLGSRAYPH-FCAFGHAVDTLLEELGGERILKMREG
human iNOS PGNGEKLKKSLFMLK-//--NKFRYAVFGLGSSMYPR-FCAFAHDIDQKLSHLGASQLTPMGEG
flavodoxin PEEGLDFFDDLQDVN-//-LSGTVFGVAGSGDRWYAEDYCKAVVEFDHQLETTGAT------QG
* :*.: * : : : * * *. *.. :*.* *. *. : : :*
human eNOS -//-LLPGLIHVHRRKMFQATIRSVENLQSSKSTRATI 717
human nNOS -//-LTQGLSNVHKKRVSAARLLSRQNLQSPKSSRSTI 954
human iNOS -//-LSKALSSMHAKNVFTMRLKSRQNLQSPTSSRATI 691
flavodoxin -//-VQPLFIDLHPEDADEQRLDDFTTSLIKTATQLGV 117
: : :*. :...::: :
Рис. 4. Выравнивание аминокислотных последовательностей NOS человека (eNOS Homo sapiens (NP_000594), nNOS Homo sapiens (P29475), iNOS Homo sapiens (P35228)) и флаводоксина L. plantarum WCFS1 (CAD63933). Символами обозначены идентичные (*), консервативные (:) и слабо подобные аминокислотные остатки (.).
Компьютерный анализ метаболических путей штамма L. plantarum WCFS1 констатировал отсутствие у него ферментов биосинтеза BH4, однако обнаружил целый ряд метаболических путей, ведущих к образованию тетрагидрофолата (табл. 4), который в составе бактериальной NO-синтазы является структурным и функциональным аналогом BH4 [Adak et al., 2002a; Adak et al., 2002b].
Таблица 4
Ферменты биосинтеза тетрагидрофолата L. plantarum WCFS1
| Номер EC | Название | Регистрац. номер белка в базе данных GenBank |
| EC 2.1.2.3 | фосфорибозиламиноимидазолкарбоксамид формилтрансфераза | CAD64957 |
| EC:2.1.1.13 | 5-метилтетрагидрофолат-гомоцистеин S-метилтрансфераза | CAD63851 |
| EC:2.1.2.2 | фосфорибозилглицинамид формилтрансфераза | CAD64958 |
| EC:2.1.2.9 | метионил-тРНК формилтрансфераза | CAD64056 |
| EC:1.5.1.3 | дигидрофолат редуктаза | CAD64265 |
| EC:2.1.2.1 | серин гидроксиметилтрансфераза | CAD64690 |
Таким образом, генетическая программа лактобацилл не исключает наличия у них NO-синтазной активности. На следующем этапе работы мы экспериментально исследовали способность L. plantarum 8Р-А3 и L. plantarum №52 синтезировать оксид азота по NO-синтазному пути.
Выявление NO-синтазной активности лактобацилл прямыми методами определения NO
а) Идентификация NO-синтазной активности с помощью ЭПР
ЭПР-исследованию NO-синтазной активности лактобацилл предшествовал экспериментальный подбор спиновой ловушки, который позволил отобрать комплекс Fe2+(DETC)2 в качестве оптимальной для целей настоящего исследования ловушки.
В пробах на активность NO-синтазы, содержащих L-аргинин и инкубируемых аэробно, регистрировали характерный трехкомпонентный ЭПР сигнал комплекса (DETC)2-Fe2+-NO. Существенно, что концентрация NO повышалась с течением времени инкубации (рис. 5, светлые столбцы), что характерно для ферментативных реакций и подтверждает биологическое происхождение регистрируемого NO. Следует отметить, что в пробах, не содержащих бактерий, также обнаружили оксид азота (рис. 5, заштрихованный столбец), однако, количество образованного NO в данном случае значительно меньше по сравнению с опытным вариантом на активность NO-синтазы (рис. 5, светлые столбцы). Образование NO неэнзиматическим путем вероятно можно объяснить известным фактом его синтеза из L-аргинина и H2O2 [Nagase et al., 1997]. Физиология лактобацилл действительно предполагает их устойчивость к значительным количествам H2O2 [Lee et al., 2005].
 | Рис. 5. Содержание NO в пробах L. plantarum 8Р-А3, инкубируемых аэробно c L-аргинином (20 мМ) в присутствии (светлые столбцы) и в отсутствие (заштрихованный столбец) бактерий. * - достоверно отличается от вариантов с 30 мин инкубацией и инкубацией без бактерий (р 0.05). |
Таким образом, с использованием метода ЭПР мы впервые обнаружили, что в аэробных условиях бактерии L. plantarum 8Р-А3, подобно клеткам млекопитающих, образуют оксид азота из L-аргинина по NO-синтазному пути.
б) Регистрация NO-синтазной активности флуоресцентным методом
В данной работе мы впервые применили к лактобациллам высоко чувствительный, специфичный и простой в реализации флуоресцентный метод регистрации NO-синтазной активности. Окрашивание DAA и DAF-FM DA клеток L. plantarum 8P-A3 и L. plantarum №52 свидетельствует о том, что в исследуемых бактериях присутствует оксид азота (рис. 6). Индикатор внутриклеточного NO DAF-FM DA окрашивает не все клетки культур L. plantarum 8P-A3 и L. plantarum №52 (рис. 6Б, Д), вероятно, детектируя неодинаковый уровень NO в клетках, находящихся на разных этапах клеточного цикла. Обработка предварительно окрашенных DAF-FM DA лактобацилл PI, маркерные свойства которого основаны на его проницаемости через мембраны мертвых клеток, показала, что NO-синтазная активность присуща именно клеткам с нарушенной целостностью мембран, что подтверждает сделанное нами предположение об участии сигнальной молекулы оксида азота в сопротивляемости лактобацилл различным стрессам (рис. 7).
| DAA | DAF-FM DA | контроль |
 |  |  |
 |  |  |
Рис. 6. Уровень оксида азота в клетках L. plantarum 8P-A3 (А, Б, В) и L. plantarum №52 (Г, Д, Е), установленный с помощью DAA (весь оксид азота пробы) (А, Г) и DAF-FM DA (внутриклеточный оксид азота) (Б, Д); В, Е – контроль на автофлуоресценцию бактерий, не содержащий красителя. Масштабная линейка – 5 мкм.
| DAF-FM DA | PI | совмещение |
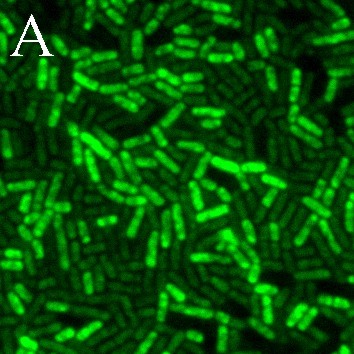 |  |  |
Рис. 7. Внутриклеточный оксид азота в бактериях L. plantarum 8P-A3. А – уровень NO в клетках лактобацилл, установленный с помощью DAF-FM DA; Б – бактерии с нарушенной целостностью мембраны, окрашенные PI. Правое изображение (совмещение) получили с помощью компьютерного совмещения левого и центрального изображений. Желтое окрашивание соответствует совместной локализации флуорофоров. Масштабная линейка – 5 мкм.
В работе флуоресцентным методом обнаружена способность бактерий L. plantarum 8P-A3 и L. plantarum №52 синтезировать АФК. При этом выявлены субпопуляции клеток, различающихся по содержанию АФК. Добавление к бактериям, окрашенным карбокси-H2DCFDA, индикатора клеточной гибели PI показало, что в бактериях с нарушенной целостностью мембран уровень АФК резко снижен по сравнению с нативными клетками (рис. 8).
| карбокси-H2DCFDA | PI | совмещение | |||
 |  | 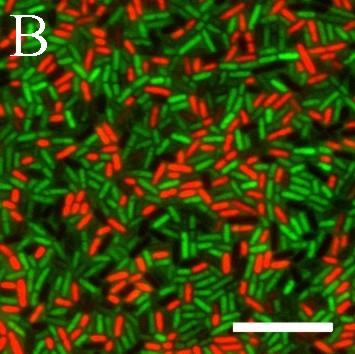 | |||
Рис. 8. АФК в бактериях L. plantarum 8P-A3. А – уровень АФК в клетках лактобацилл, установленный с помощью карбокси-H2DCFDA; Б – бактерии с нарушенной целостностью мембраны, окрашенные PI. Правое изображение (совмещение) получили с помощью компьютерного совмещения левого и центрального изображений. Масштабная линейка – 10 мкм.
Особенности влияния L-аргинина и ингибиторов NO-синтазы млекопитающих на NO-синтазную активность лактобацилл
В работе исследована индукция NO-синтазной активности L. plantarum 8Р-А3 и L. plantarum №52 экзогенным L-аргинином («парадокс L-аргинина»). Внесение в среду роста L. plantarum 8Р-А3 100 мкМ L-аргинина приводило к увеличению уровня общего NO по сравнению с клетками, инкубируемыми без аргинина, при этом внутриклеточная концентрация оксида азота и АФК не менялась (рис. 9). Поскольку L-аргинин не активирует рост бактерий (см. рис. 2, 3), вышеописанное усиление флуоресценции при добавлении этой аминокислоты не связано с ее воздействием на рост культуры. Таким образом, с помощью флуоресцентного метода впервые установили, что в клетках L. plantarum 8Р-А3, как и в клетках млекопитающих, происходит увеличение продукции оксида азота под воздействием экзогенного L-аргинина («парадокс L-аргинина»).
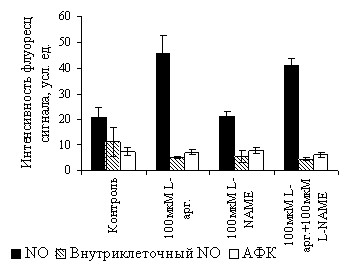 | Рис. 9. Влияние субстрата NOS L-аргинина (100 мкМ) и ингибитора NOS L-NAME (100 мкМ) на синтез NO и АФК бактериями L. plantarum 8Р-А3. Уровень оксида азота и АФК определяли с помощью DAA (общий уровень NO), DAF-FM DA (внутриклеточный NO) и карбокси-H2DCFDA (концентрация АФК). * - достоверно отличается от контроля (р 0.05). |
В исследовании влияния ингибиторов NOS млекопитающих на NO-синтазную активность лактобацилл использовали ингибиторы трех различных изоформ NOS млекопитающих: конкурентный ингибитор eNOS L-NAME, iNOS - L-NIL и nNOS - nNOS ингибитор I. Присутствие в среде инкубации лактобацилл 100 мкМ L-NAME, 100 мкМ L-NIL или 10 мкМ nNOS ингибитора I не оказывало существенного ингибирующего действия на NO-синтазную активность L. plantarum 8Р-А3 и L. plantarum №52.
L-NAME не оказывает влияние на образование NO клетками L. plantarum 8Р-А3 независимо от того, происходит оно из эндогенного аргинина или вызвано добавлением аминокислоты извне (рис. 9). Отметим также, что внесение L-NAME в среду роста не изменяло концентрацию внутриклеточного NO и АФК (рис. 9).
В клетках L. plantarum №52 уровень оксида азота и АФК не изменяется под действием 100 мкМ L-аргинина. На его значении не сказывалось также внесение в среду роста 100 мкМ ингибитора L-NAME.
Анализ иммунологических свойств NO-синтазы лактобацилл
Вестерн-блот анализ с использованием антител млекопитающих к трем известным изоформам NOS (nNOS, iNOS и eNOS) показал отсутствие экспрессии ферментов nNOS, iNOS и eNOS у L. plantarum №52.
Характеристика физиологической активности оксида азота в клетках различного уровня организации
а) Роль NO в культурах клеток эукариот в условиях индуцированного рибонуклеазой Bacillus intermedius стресса
Исследованию физиологической активности NO у бактерий предшествовала оценка цитопротекторного потенциала этого агента в клетках эукариот. С этой целью определяли NO-синтазную активность в фибробластах мыши в условиях стресса, индуцированного биназой (рис. 10).
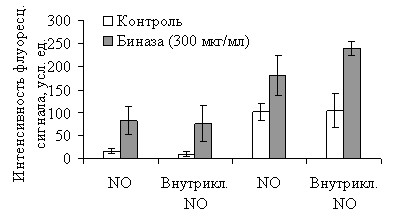 | Рис. 10. Влияние биназы (300 мкг/мл) на образование оксида азота в клетках HIN3T3 и ras-NIH3T3. Содержание NO определяли с помощью окрашивания флуоресцент-ными индикаторами оксида азота DAA (NO) и DAF-FM DA (внутриклеточный NO). |
Мы показали, что способность образовывать NO присуща обоим исследованным типам клеток (NIH3T3 и ras-NIH3T3), однако NO-синтазная активность существенно выше в клетках, экспрессирующих Ras-белок по сравнению с нормальными фибробластами (рис. 10, светлые столбцы). Длительное культивирование (66 ч) с биназой (300 мкг/мл) всегда приводит к значительному увеличению уровня NO (рис. 10, темные столбцы), что позволяет рассматривать последний как сигнал активации защитных функций клетки.
б) Влияние температурного стресса на NO-синтазную активность лактобацилл
Для индукции температурного стресса использовали нагревание до 80оС в течение 30 мин, зарекомендовавшее себя как летальная обработка для лактобацилл [Alakomi et al., 2005]. Жизнеспособность исследуемых микроорганизмов определяли флуоресцентным окрашиванием с помощью теста LIVE/DEAD, а также классическим чашечным методом. Нагревание губительным образом сказывалось на жизнеспособности клеток, что выражалось в характерной желто-оранжевой флуоресценции клеток и снижении на 100% количества колоний на чашках по сравнению с контрольным вариантом, не подверженным действию высокой температуры. Известный денатурирующий эффект высоких температур на белковые структуры нашел подтверждение в инактивации эстераз бактерий, которую зафиксировали по исчезновению флуоресценции у окрашенных DAF-FM DA, нагретых клеток лактобацилл (рис. 11В, Г). DAA идентифицировал увеличение концентрации оксида азота в клетках лактобацилл после нагревания (рис. 11А, Б). Это наблюдение находится в русле современного представления об NO как о сигнальной молекуле, участвующей в регуляции противостояния бактерий различным стрессорам, в том числе и температурным [Malyshev et al., 1995]. Существенно, что повышение уровня NO отмечалось практически во всех клетках популяции, что указывает на высокую функциональность этого агента в повышении толерантности бактерий к нагреванию.
| Оксид азота | Внутриклеточный оксид азота | ||
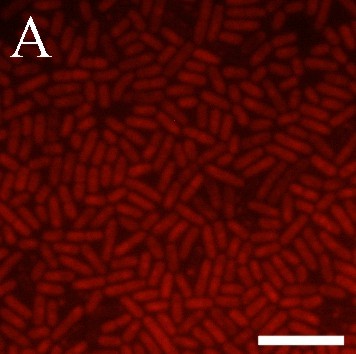 |  |  |  |
Рис. 11. NO-синтазная активность в нативных (А, В) и подвергшихся нагреванию до 80оС в течение 30 мин (Б, Г) клетках L. plantarum №52. Общий уровень NO (А, Б) определяли с помощью DAA, внутриклеточный NO (В, Г) - с помощью DAF-FM DA. Масштабная линейка – 5 мкм.
в) Оценка влияния индуцированного L-аргинином синтеза NO на формирование S-слоя у L. plantarum
При выращивании на среде с добавлением 10 мМ L-аргинина у L. plantarum 8P-A3 с помощью метода АСМ наблюдали сглаживание поверхности клеток, свидетельствующее о формировании у них S-слоя (рис. 12Б). Добавление в среду культивирования лактобацилл положительно заряженной, но не участвующей в метаболизме NO аминокислоты L-гистидина (10 мМ) не приводило к изменению поверхности клеток (рис. 12В), что исключает вклад катионности L-аргинина в указанный эффект. Так как ранее была показана возможность индукции синтеза NO L-аргинином, мы предполагаем, что роль регуляторного фактора, запускающего экспрессию генов S-белков, выполняет оксид азота.
 |  |  |
Рис. 12. Влияние 10 мМ L-аргинина (Б) и 10 мМ L-гистидина (В) на морфологию клеток L. plantarum 8P-A3. В контрольном варианте (А) бактерии выращивали на среде MRS без дополнительного внесения аминокислот. АСМ-изображения получены полуконтактным методом на воздухе при комнатной температуре в режиме сигнала рассогласования с разрешением 10241024 точек. Размер скана 3 3 мкм.
Обсуждение результатов
Альтернативные пути биосинтеза NO у L. plantarum
Детекция NO-синтезирующей способности у L. plantarum прямыми методами регистрации оксида азота, а также компьютерный анализ генетической обусловленности этого процесса, вместе с данными ряда биохимических и микробиологических исследований, позволили по-новому взглянуть на процессы биосинтеза оксида азота у бактерий этого вида. Как известно, в мире прокариот возможны два пути синтеза NO: денитрификация [Zumft, 1997] и катализируемое ферментом NO-синтазой окисление L-аргинина [Salard et al., 2006]. Нами была рассмотрена возможность протекания этих процессов у L. plantarum.
Денитрификационный путь синтеза NO. Анализ данных литературы показал, что диссимиляционная нитритредукция не может быть исключена как источник оксида азота у L. plantarum, а денитрификационный путь метаболизма у лактобацилл этого вида требует дополнительного, более детального изучения. Мы показали, что при росте в микроаэрофильных условиях и при наличии нитратов в среде инкубации L. plantarum экспрессируют нитратредуктазу. Это наблюдение находится в соответствии с генетической программой бактерий и не противоречит данным литературы [Wolf, Hammes, 1988]. Однако активность диссимиляционной нитритредуктазы в условиях, благоприятных для денитрификации (дефицит кислорода и наличие нитратов в среде культивирования), зафиксирована не была, а также не были обнаружены гены этого фермента. Проведенные исследования, с одной стороны, исключают возможность синтеза NO бактериями L. plantarum в ходе денитрификации, а с другой - в целом проливают свет на данный метаболический путь у микроорганизмов этого вида.
Синтез NO из L-аргинина NO-синтазой. Результаты ЭПР-спектроскопии (рис. 5) и флуоресцентного окрашивания (рис. 6) свидетельствуют о том, что бактерии L. plantarum обнаруживают NO-синтазную активность, однако этот процесс у них имеет ряд особенностей, отличающих его от такового млекопитающих и прокариот - обладателей bNOSoxy. Так, мы показали, что индукция NOS экзогенным L-аргинином («парадокс L-аргинина») у L. plantarum в целом возможна (рис. 9), однако в отличие от NOS большинства других организмов зависит также от неких дополнительных факторов. Причины, обуславливающие увеличение продукции NO клетками млекопитающих при добавлении экзогенного L-аргинина, остаются невыясненными. Предполагают, что оно связано с наличием эндогенных ингибиторов NOS, в частности, асимметричного диметиларгинина [Tsikas et al., 2000b]. Возможно, биосинтез таких эндогенных ингибиторов NOS у L. plantarum кодируют плазмидные гены, которые варьируют у представителей различных штаммов одного вида, в результате чего мы наблюдаем различия в способности к индукции NOS аргинином у двух штаммов L. plantarum.
Действие ингибиторов NO-синтазы млекопитающих на NO-синтазную активность бактерий. На отличия NOS L. plantarum от известных NOсинтаз животных указывают результаты, полученные нами при изучении эффектов избирательных ингибиторов трех различных изоформ NOS млекопитающих в отношении NO-синтазной активности L. plantarum. Отметим, что ингибиторы NOS млекопитающих очень часто оказываются неэффективны в отношении NO-синтазной активности бактерий [Cohen, Yamasaki, 2003; Creus et al., 2005]. Это может быть связано с деградацией ингибиторов ферментами микроорганизмов [Choi et al., 1998], а также невысокой проницаемостью бактериальных мембран для ингибиторов NOS млекопитающих [Wach et al., 2005]. Наиболее вероятную причину неэффективности используемых в работе ингибиторов NOS в отношении NO-синтазной активности L. plantarum мы видим в структурных и функциональных различиях между NOS млекопитающих и лактобацилл. Они становятся еще более очевидными, если принять во внимание установленный с помощью Вестерн-блот гибридизации факт отсутствия иммунологического родства NO-синтазы L. plantarum с NOS млекопитающих.
Компьютерный поиск генетических детерминант NO-синтазы лактобацилл. Обнаруженный экспериментально бактериальный ферментативный синтез NO из L-аргинина находит подтверждение в результатах компьютерного анализа генома L. plantarum WCFS1. Суммированные и подкрепленные данными литературы, они позволяют в общем виде представить NO-синтазную систему L. plantarum (табл. 5).
Результаты исследования позволяют считать, что L. plantarum обладают специфической NO-синтазной системой, отличной от известных NOS про- и эукариот, подобно Helix pomatia [Huang et al., 1997] и Arabidopsis thaliana [Guo et al., 2003] – организмам, не имеющим генов NOS, в клетках которых, тем не менее, обнаружена NO-синтазная активность. Полученные данные предполагают важность дальнейших исследований регуляторной роли NO у лактобацилл, особенно в связи с их высокой практической значимостью как пробиотиков, а также находятся в русле современной концепции [Свердлов, 1999] о приоритете функциональной активности белков над их генетической программой.
Таблица 5
Строение NO-синтазы L. plantarum
| № | Элемент NOS млекопитающих | Аналог элемента NOS у L. plantarum | Примечание (Сведения об аналоге) |
| 1 | Редуктазный домен (NOSred) | Флаводоксин | Высокая гомология флаводоксина с NOS млекопитающих (50-57%) и идентичность выполняемых функций позволяют с большой долей вероятности ожидать, что флаводоксин может выполнять в клетках L. plantarum роль NOSred. |
| 2 | Оксигеназный домен (NOSoxy) | Не установлен | Обнаружен ряд гомологов NOSoxy (см. табл. 3) с низкой гомологией в функционально активных сайтах. Тем не менее, активность NOS была неоднократно зарегистрирована у L. plantarum прямыми методами определения NO. |
| 3 | Гем | Гем | Лактобациллы самостоятельно синте-зировать гем не способны, он потребляется из среды культивирования. |
| 4 | Тетрагидробиоптерин (BH4) | Тетрагидрофолат | Синтезируется серией ферментов L. plantarum (см. табл. 4). |
| 5 | Кальмодулин | Неизвестен | Гомолог кальмодулина эукариот обнаружен только у некоторых грамположительных бактерий с высоким GC-содержанием [Yang, 2001]. |
| 6 | FMN | FMN | Стандартный компонент метаболической сети лактобацилл. |
| 7 | FAD | FAD | |
| 8 | NADPH | NADPH |
Физиологическая роль NO у лактобацилл
Среди многообразия физиологических функций NO можно выделить два основных взаимоисключающих направления. Во-первых, NO является мощным цитотоксическим агентом [Fang, 2003]. Во-вторых, NO может играть роль одного из ключевых регуляторов различных физиологических процессов в основном за счет участия в передаче сигналов и регуляции транскрипции генов.
NO как цитотоксический агент. Губительное действие высоких концентраций NO на микробные клетки известно и не вызывает сомнений [MacMicking et al., 1997]. Тем не менее, индуцированная L-аргинином повышенная генерация NO не оказывала влияния на рост и жизнеспособность продуцента: выращивание в присутствии 100 мкМ L-аргинина не влияло на кривые роста лактобацилл (рис. 2) и соотношение нативных и поврежденных клеток (рис. 3А). При этом отмечали увеличение общего содержания оксида азота в пробах, но внутриклеточная концентрация NO и АФК оставалась без изменений (рис. 9). По-видимому, лактобациллы обладают системой защиты от повышенных концентраций NO и АФК путем элиминации из клеток избытка токсических агентов. Не исключено, что данная адаптивная система играет существенную роль в выживании бактерий в естественных местах их обитания – желудочно-кишечном тракте человека и животных [Molin et al., 1993; Ahrne et al., 1998].
NO как сигнал к адаптации. Удивительная консервативность NOS-подобных белков в процессе эволюции указывает на важную физиологическую функцию NO, обусловившую наличие NOS у подавляющего большинства живых организмов. Поэтому логично ожидать, что роль NO-синтазной системы у лактобацилл не ограничивается синтезом потенциально токсичной молекулы. Мы показали, что бактерии, целостность оболочки которых оказалась нарушена, характеризуются повышенными внутриклеточными концентрациями NO (рис. 7). Однако, АФК в таких клетках отсутствуют (рис. 8). Не исключено, что представленные данные являются первым подтверждением этапности процесса клеточной гибели и определяют основополагающую роль в этом явлении свободнорадикальных соединений NO и АФК. С другой стороны, представленные данные по внутриклеточной локализации АФК у лактобацилл находятся в соответствии с современной теорией, признающей наряду с токсическим эффектом АФК цитопротекторное действие этих агентов [Кулинский, 1999]. Нами обнаружено присутствие АФК в нативных клетках L. plantarum, предполагающее определенную физиологическую функцию в них этих веществ. Полученные результаты не противоречат данным литературы, указывающим на возможность присутствия внутри бактерий рода Lactobacillus некоторого количества АФК [Lee et al., 2005]. DAA детектировал наличие оксида азота во всех клетках культуры (рис. 6А, Г), что указывает на высокую функциональность этого агента.
Представление об NO как о важном стресс-лимитирующем факторе получило дальнейшее развитие в проведенном нами исследовании влияния высокотемпературного воздействия на NO-ергическую систему лактобацилл. Мы показали, что для подвергшихся нагреванию клеток L. plantarum характерно увеличение продукции NO (рис. 11). Существенно, что аналогичная реакция сопровождает тепловой шок у млекопитающих [Malyshev et al., 1995] и является одним из ключевых звеньев в адаптации клеток животных [Малышев, Манухина, 1998]. Полагаем, что активация биосинтеза NO у L. plantarum при температурном воздействии также происходит с целью адаптации к повышению температуры.
Свидетельством универсальности NO-ергических систем адаптации клеток различного эволюционного уровня явилась наблюдаемая активация NOS в фибробластах мыши под действием токсичных концентраций биназы (рис. 10). Биназа способна оказывать на клетки апоптозиндуцирующее действие [Зеленихин с соавт., 2005], которое сопровождается повышением в них уровня NO (рис. 10). Поскольку апоптоз рассматривают как раннюю стадию токсического поражения клеток [Corcoran et al., 1994], мы склонны считать, что наблюдаемая активация синтеза NO служит стресс-лимитирующим механизмом, направленным на повышение защитных функций клеток. Принимая во внимание известные токсические эффекты NO [Маеда, Акаике, 1998], мы не исключаем, что чрезмерная активация этого механизма может вести к повреждающему действию на клетки, и стресс-реакция из звена адаптации превратится в звено патогенеза.
Исходя из полученных данных, свидетельствующих об активации NOS в фибробластах под действием биназы (рис. 10) и в клетках L. plantarum при высокотемпературном воздействии (рис. 11), мы рассматриваем оксид азота NO-синтазного происхождения как универсальный фактор стрессорного и адаптивного ответов клеток различного уровня организации.
NO как индуктор образования S-слоя у лактобацилл. В связи с перспективами использования L. plantarum в качестве пробиотических препаратов, актуальными являются исследования факторов, определяющих функциональную активность этих микроорганизмов, в частности, адгезивных свойств бактерий. Мы впервые показали, что индуцированный L-аргинином синтез NO специфически влияет на морфофизиологическое состояние поверхности L. plantarum 8Р-А3, приводя к формированию S-слоя (рис. 12). Полученные результаты согласуются с данными литературы, косвенно свидетельствующими о возможности образования S-слоя у бактерий этого вида [Kahala, Palva, 1999; Siezen et al., 2006; Tallon et al., 2007]. Основываясь на известной способности NO участвовать в регуляции активности генетического аппарата [Nunoshiba et al., 1993; Pantopoulos et al., 1994; Shyy et al., 1994], мы предполагаем, что синтезируемый при ферментативном окислении L-аргинина оксид азота выполняет роль регуляторного фактора, запускающего экспрессию генов S-белков.
В целом, результаты проведенных исследований определяют важную функцию NO-синтазной системы L. plantarum в пробиотической активности бактерий этого вида. Токсическая молекула оксида азота расширяет спектр известных бактерицидных и бактериостатических веществ, благодаря которым лактобациллы - симбионты человека и животных проявляют антагонистическую активность по отношению к патогенным и условно-патогенным бактериям. Эффективность пробиотиков во многом зависит от успешной колонизации желудочно-кишечного тракта входящими в их состав бактериями, которая, в свою очередь, определяется адгезивными свойствами микроорганизмов [Schr-Zammaretti, Ubbink, 2003]. Как известно, последние в значительной степени детерминированы наличием у бактерий S-слоев [Schneitz et al., 1992; Toba et al., 1995; Hynnen et al., 2002; Lorea et al., 2002]. По-видимому, NO-синтазная система L. plantarum влияет на способность бактерий прикрепляться к эпителию животных и человека за счет участия в регуляции образования S-слоя белков на поверхности микроорганизмов. Подчеркнутая функциональная активность NO-синтазной системы у промышленно значимой группы лактобацилл обуславливает важность проведенных исследований как способствующих развитию пробиотикотерапии – стратегической ветви современной медицины, направленной на поддержание и восстановление здоровья человека.
ВЫВОДЫ
- У Lactobacillus plantarum денитрификационный путь синтеза оксида азота отсутствует в связи с отсутствием энзиматической активности и генетических детерминант нитритредуктазы - фермента ключевой стадии диссимиляционной нитратредукции.
- Впервые комплексом экспериментальных методов прямой регистрации оксида азота, а именно, электронным парамагнитным резонансом и флуоресцентной микроскопией, обнаружен и охарактеризован специфичный для лактобацилл NO-синтазный путь образования оксида азота.
- Впервые проведен компьютерный анализ и выявлены геномные детерминанты NO-синтазного пути образования оксида азота у Lactobacillus plantarum, обеспечивающие биосинтез редуктазного домена и необходимых кофакторов и простетических групп NOS.
- Оксид азота NO-синтазного происхождения служит сигналом активации защитных функций клеток различного эволюционного уровня, поскольку его продукция усиливается в условиях стресса, вызванного (а) экзогенными токсикантами (РНКазой Bacillus intermedius) в культуре фибробластов; (б) высокотемпературным воздействием на бактерии Lactobacillus plantarum.
- Лактобациллы обладают системой защиты от токсического действия генерируемого ими оксида азота, связанной с его элиминацией из клетки через цитоплазматическую мембрану.
- Впервые методом атомно-силовой микроскопии у Lactobacillus plantarum установлено наличие на поверхности клетки S-слоя белков, экспрессия которых происходит в условиях активации NO-синтазы и связана с повышением биосинтеза оксида азота.
Список работ, опубликованных по теме диссертации
- Яруллина, Д.Р. Оксид азота как новая регуляторная молекула и конечный продукт денитрификации [Текст]/ Д.Р.Яруллина, О.Н.Ильинская, Н.И.Силкин // Новые биокибернетические и телемедицинские технологии 21 века для диагностики и лечения заболеваний человека: Матер. междисц. конф. с междунар. участием. - Петрозаводск, 2003. – С. 68.
- Яруллина, Д.Р. Оксид азота NO-синтазного происхождения у лактобацилл [Текст]/ Д.Р.Яруллина, Д.Г.Зверев, О.Н.Ильинская // Вестник Татарстанского отделения Российской Экологической Академии. - 2004. - 4 (22). - С. 11-14.
- Яруллина, Д.Р. Перспективы использования NO-синтезирующих бактерий в разработке фармакологических препаратов [Текст]/ Д.Р.Яруллина, Д.Г.Зверев, Н.И.Силкин, О.Н.Ильинская // Постгеномная эра в биологии и проблемы биотехнологии: Матер. научн. конф. - Казань, 2004. – С. 91-92.
- Смоленцева, О.А. NO-синтезирующие лактобациллы как биогенный источник оксида азота для фармакологических препаратов [Текст]/ О.А.Смоленцева, Д.Р.Яруллина, Д.Г.Зверев, О.Н.Ильинская // Сб. тез. 79-ой всерос. студ. конф., посвящ. 1000-летию Казани. - Казань, 2005. - С. 77.
- Яруллина, Д.Р. Идентификация NO-синтезирующих систем у бактерий рода Lactobacillus методом ЭПР-спектроскопии [Текст]/ Д.Р.Яруллина, Д.Г.Зверев, О.Н.Ильинская // Биология - наука XXI века: Сб. тез. 9-ой Междунар. Пущинской школы-конф. молодых ученых. - Пущино, 2005. – С. 223.
- Яруллина, Д.Р. Определение активности бактериальной NO-синтазы методом ЭПР [Текст]/ Д.Р.Яруллина, Д.Г.Зверев, О.Н.Ильинская // Материалы и технологии XXI века: Тез. докл. V Научн. конф. научно-образоват. центра КГУ - Казань, 2005. - С. 91.
- Yarullina, D.R. Lactobacilli synthesize nitric oxide through nitric oxide synthase system [Text]/ D.R.Yarullina, O.N.Ilinskaya, N.I.Silkin, K.Beuerlein // Microbial diversity: current situation, conservation strategy and biotechnological potentialities: Abstr. II International conference. - Perm-Kazan-Perm, 2005. - P. 213-214.
- Яруллина, Д.Р. Идентификация NO-синтазной активности у лактобацилл методами ЭПР-спектроскопии и флуоресцентного окрашивания [Текст]/ Д.Р.Яруллина, О.Н.Ильинская, Н.И.Силкин, Д.Г.Зверев, А.В.Аганов // Ученые записки Казанского государственного университета. Сер. Естественные науки. - 2006. - Т. 148, Кн. 1. - С. 57-70.
- Яруллина, Д.Р. Альтернативные пути образования оксида азота у лактобацилл: обнаружение возможной NO-синтазной активности методом ЭПР [Текст]/ Д.Р.Яруллина, О.Н.Ильинская, А.В.Аганов, Н.И.Силкин, Д.Г.Зверев // Микробиология. - 2006. - Т. 75, № 6. - С. 731-736.
- Yarullina, D.R. Production of nitric oxide by gastrointestinal commensal lactobacilli [Text]/ D.R.Yarullina, O.N.Ilinskaya, N.I.Silkin, K.Beuerlein // Acta Physiologica: Abstr. The International Meeting of the German Physiological Society and the Federation of European Physiological Societies. - V. 186, Supplement 1. - 2006. – Munich, 2006. - P. 158.
- Смоленцева, О.А. Применение ЭПР-спектроскопии для определения NO в клетках стрептомицетов [Текст]/ О.А.Смоленцева, Д.Р.Яруллина, Д.Г.Зверев, О.Н.Ильинская // Актуальные проблемы науки и образования: Матер. молодежн. научно-практ. конф. - Зеленодольск, 2006. - С. 59-62.
- Смоленцева, О.А. Применение метода ЭПР-спектроскопии для регистрации NO-синтазной активности у актиномицетов рода Streptomyces [Текст]/ О.А.Смоленцева, Д.Р.Яруллина // Экология России и сопредельных территорий. Экологический катализ: Матер. XI Междунар. экологич. студенч. конф. – Новосибирск, 2006. – С. 97-98.
- Яруллина, Д.Р. Детекция NO-синтазной активности лактобацилл методом флуоресцентного окрашивания (краткое сообщение) [Текст]/ Д.Р.Яруллина, О.Н.Ильинская // Микробиология. - 2007. - Т. 76, № 4. –C. 570-572.
- Яруллина, Д.Р. Геномные детерминанты биосинтеза оксида азота у Lactobacillus plantarum: потенциальные возможности и действительность [Текст]/ Д.Р.Яруллина, О.Н.Ильинская // Молекулярная биология. - 2007. – Т. 41, №5. – С. 899-907.
- Яруллина, Д.Р. NO-синтазный путь образования оксида азота у комменсальных кишечных лактобацилл [Текст]/ Д.Р.Яруллина, О.Н.Ильинская // Ломоносов – 2007: Тез. докл. Междунар. конф. студентов, аспирантов и молодых ученых, секция Биология. – Москва, 2007. – С. 124-125.
- Смоленцева, О.А. Применение метода атомно-силовой микроскопии в исследовании свойств поверхности медицински значимых лактобацилл, ферментативно синтезирующих оксид азота [Текст]/ О.А.Смоленцева, Д.Р.Яруллина, Д.С.Налимов, О.А.Коновалова, О.Н.Ильинская // Материалы и технологии XXI века: Тез. докл. VII Научн. конф. научно-образоват. центра КГУ. - Казань, 2007. - С. 117.
- Смоленцева, О.А. Молекула оксида азота (NO) в метаболизме Lactobacillus plantarum: синтез, влияние на поверхностные структуры и жизнеспособность продуцента [Текст]/ О.А.Смоленцева, Д.Р.Яруллина, Д.С.Налимов, О.А.Коновалова, О.Н.Ильинская // Структура и динамика молекулярных систем: Сб. тез. XIV Всерос. конф. - Казань, 2007. - С. 217.
Автор выражает глубокую признательность научному руководителю проф. О.Н.Ильинской за поддержку и внимательное отношение к работе; проф. Ф.Драйеру и доктору К.Бойерляйну (Институт фармакологии, г. Гиссен, Германия) за возможность проведения ряда экспериментов на базе Института; доц. Н.И.Силкину (каф. электроники и радиоспектроскопии КГУ) за помощь в проведении ЭПР-спектроскопии; доц. О.А.Коноваловой (каф. оптики и нанофотоники КГУ) за постановку экспериментов по атомно-силовой микроскопии; доц. В.Г.Изотову и доц. Л.М.Ситдиковой (каф. полезных ископаемых и разведочного дела КГУ) за проведение сканирующей электронной микроскопии; Р.А.Шурхно (Центр аналитических исследований ГНУ «ТатНИИ РАСХН», г. Казань) за предоставление штаммов лактобацилл; доц. В.Г.Штырлину (НИЛ координационных соединений каф. неорганической химии Химического института им. А.М.Бутлерова, г. Казань) за приготовление концентрационной серии Cu2+(DETC)2.

