Клинико-биохимический анализ экстракардиальных адаптационных реакций у больных, перенесших инфаркт миокарда
На правах рукописи
Гридасова Рита Анатольевна
КЛИНИКО-БИОХИМИЧЕСКИЙ АНАЛИЗ ЭКСТРАКАРДИАЛЬНЫХ АДАПТАЦИОННЫХ РЕАКЦИЙ
У БОЛЬНЫХ, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА
03.01.04 – биохимия
14.03.03 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Краснодар – 2012
Работа выполнена в государственном бюджетном образовательном учреждении
высшего профессионального образования «Ростовский государственный медицинский университет» Министерства здравоохранения и социального развития
Российской Федерации
(ГБОУ ВПО РостГМУ Минздравсоцразвития России)
Научные консультанты: доктор биологических наук, профессор
Микашинович Зоя Ивановна
доктор медицинских наук, профессор
Терентьев Владимир Петрович
Официальные оппоненты:
Павлюченко Иван Иванович, доктор медицинских наук, профессор,
государственное бюджетное образовательное учреждение высшего профессионального образования «Кубанский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, профессор кафедры фундаментальной и клинической биохимии
Бородулин Владимир Борисович, доктор медицинских наук, профессор, государственное бюджетное образовательное учреждение высшего профессионального образования «Саратовский государственный медицинский университет имени В.И.Разумовского» Министерства здравоохранения и социального развития Российской Федерации, заведующий кафедрой биохимии
Власов Тимур Дмитриевич, доктор медицинских наук, профессор,
государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный медицинский университет имени академика Ивана Петровича Павлова» Министерства здравоохранения и социального развития Российской Федерации, заведующий кафедрой патофизиологии с курсом клинической патофизиологии
Ведущая организация:
государственное бюджетное образовательное учреждение высшего профессионального образования «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Министерства здравоохранения и социального развития Российской Федерации (г. Москва)
Защита состоится _______2012 г. в __ часов на заседании диссертационного совета Д208.038.02 на базе ГБОУ ВПО КубГМУ Минздравсоцразвития России (350063, г.Краснодар, ул.Седина, 4, тел. (861)262-73-75
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО КубГМУ Минздравсоцразвития России.
Автореферат разослан «_____»______________ 2012 г.
Учёный секретарь
диссертационного совета
Д208.038.02 профессор Скорикова Людмила Анатольевна
ВВЕДЕНИЕ
Актуальность исследования
Ишемической болезни сердца (ИБС) принадлежит ведущее место в структуре непосредственных причин смертности и инвалидизации населения от заболеваний сердечно-сосудистой системы (Р.Г.Оганов, Г.Я.Масленникова, 2009; Н.П.Бочков, Д.А.Воронов, 2010; Е.И.Чазов и соавт, 2011; С.А.Шальнова, А.Д.Деев, 2011). В последние годы отмечено увеличение числа больных с острым коронарным синдромом, в том числе с повторными коронарными катастрофами (И.Н.Ступаков, Р.Г.Гудкова, 2008; Е.И.Чазов, С.А.Бойцов, 2009; О.П.Щепин и соавт., 2009; К.Teo, D.Catelier, 2001; М.Law et al., 2002).
Вместе с тем, в реальной клинической практике ведение больных с повторным инфарктом миокарда (ИМ) и достижение оптимальной эффективности терапии затруднено из-за отсутствия учета индивидуальных особенностей приспособительно-адаптивных реакций при повторных коронарных инцидентах и невозможности адекватного терапевтического мониторинга пациента. На первый план выходят выяснение особенностей приспособительных реакций организма и поиск информативных лабораторно-биохимических методов оценки его потенциальных ресурсов.
Если морфологическая основа ишемического процесса очевидна, то молекулярная основа перестройки функциональных элементов сердечно-сосудистой системы все еще остается несистематизированной, что затрудняет проведение структурно-функциональных параллелей на всех стадиях формирования кардиосклероза после повторных коронарных катастроф.
Воздействие гипоксического стимула вызывает формирование адаптивно-приспособительных реакций всего организма, направленных на аварийную перестройку функциональной активности клеток. Наряду с этим, особенности нарушений сердечно-сосудистой системы в зависимости от степени выраженности гипоксического сдвига и состояния функциональных элементов сосудистого русла остаются недостаточно изученными.
Кровь является чувствительным индикатором изменений функционального состояния организма и наиболее доступна для анализа (И.И.Павлюченко, 2005; В.В.Новицкий и соавт., 2006; И.М.Щербаченко, 2008). Можно полагать, что анализ клеток крови, как функционального элемента системы кровообращения, может дать достаточно адекватное представление об энергетическом обеспечении мышцы сердца, уровне окислительных процессов и состоянии реактивности сердечно-сосудистой системы у больных ИМ.
Выяснение механизмов внутриклеточных сдвигов является необходимым этапом для последующего выбора критериев индивидуального контроля клинико-функционального состояния больных. Тестирование изменений важнейших гомеостатических систем у пациентов, перенесших ИМ, позволяет выявить группы риска развития повторных коронарных катастроф и оценить клинический эффект метаболической коррекции. В то же время, вопросы эффективности и оправданности такой метаболической коррекции, в частности, применения препаратов с антиоксидантными свойствами остаются дискутабельными.
Повышение жизнеспособности ишемизированного миокарда невозможно без теоретического осмысления патобиохимических сдвигов и разработки новых подходов к метаболической терапии, направленной на уменьшение выраженности окислительного стресса, повышение уровня энергопродукции и снижение тяжести тканевой гипоксии.
Таким образом, актуальность выяснения особенностей метаболического обеспечения компонентов периферической крови и отбор информативных параметров оценки адаптивно-приспособительного потенциала, а также разработка способов повышения резистентности организма у больных, перенесших ИМ, не вызывает сомнений.
Цель работы
Выяснить закономерности метаболических адаптивных перестроек у больных ИМ, на этой основе разработать способы прогнозирования, дифференциальной диагностики различных форм ИБС, обосновать пути метаболической коррекции адаптивных реакций у больных, с разной кратностью перенесших ИМ.
Задачи исследования
1. Выявить особенности приспособительных реакций клеток крови к гипоксии у больных, перенесших ИМ.
2. Сопоставить метаболическое обеспечение функциональной активности эритроцитов у больных после первичного и повторного ИМ.
3. Исследовать соотношение общей, свободной и связанной форм воды во фракциях крови у больных, однократно и повторно перенесших коронарную катастрофу.
4. Оценить уровень активности ферментов антиоксидантной защиты крови у больных, перенесших ИМ.
5. Проанализировать особенности липопротеинового спектра сыворотки крови у пациентов с различными формами ИБС.
6. Отобрать информативные лабораторные параметры верификации риска развития повторных коронарных катастроф.
7. Разработать способы дифференциальной диагностики различных форм ИБС и прогнозирования повторного ИМ.
8. Уточнить влияние препаратов липоевой кислоты на метаболические процессы, повышающие устойчивость к гипоксии у больных, перенесших ИМ.
Научно-практическая значимость работы
Разработана концепция формирования адаптивных реакций в клетках крови у больных с измененной реактивностью в результате перенесенного ИМ. С этой целью впервые проведено сравнительное комплексное исследование особенностей функционирования экстракардиальных адаптационно-компенсаторных механизмов, включающее в себя анализ распределения водных фракций, состояния газотранспортной функции крови, антиоксидантной системы, липопротеидного спектра сыворотки крови у больных, перенесших первичный и повторный ИМ. Доказано, что характер адаптивных реакций на клеточном уровне зависит от про- и антиоксидантного равновесия, энергетических ресурсов, соотношения различных форм воды, отличающихся в зависимости от кратности перенесенного ИМ, а также характеризующих мощность защитных систем и отражающих индивидуальность организма.
Анализ взаимосвязей клинических манифестов и обсуждаемых показателей продемонстрировал особенности индивидуальных функционально-метаболических перестроек в клетках крови, как реакции на гипоксический стимул, что явилось теоретической основой для разработки новых диагностических методов и оптимизации патогенетически обоснованной метаболической коррекции у больных с различными формами ИБС.
Представленный фактический материал позволил сформировать представления об особенностях и различиях приспособительных реакций к гипоксии у больных в зависимости от кратности перенесенного ИМ и обосновать на этой основе способы оптимизации адаптивных реакций.
Выявлены дополнительные маркеры, позволяющие выделить контингенты больных, отличающиеся по адаптивно-компенсаторным возможностям, с целью дифференцированной коррекции нарушений приспособительных механизмов для предупреждения повторных коронарных катастроф.
Выяснены особенности влияния липоевой кислоты на метаболические механизмы формирования приспособительных реакций к гипоксии у больных, перенесших ИМ.
Основные положения диссертации, выносимые на защиту
1. Выявленные количественно-качественные отличия молекулярных процессов, обеспечивающих адаптивные перестройки в клетках крови, зависят от кратности перенесенных ИМ. Стратегия адаптации после перенесенного повторного ИМ характеризуется тотальной окислительной модификацией липопротеинов в эритроцитах, усилением накопления ключевых субстратов гликолиза (пируват, лактат, 2,3-дифосфоглицерат) на фоне имеющегося разобщения ферментативного и неферментативного звеньев антиоксидантной защиты (супероксиддисмутаза, каталаза, мочевая кислота, церулоплазмин), что свидетельствует о манифестации окислительного стресса и формировании выраженного синдрома гипоксии.
2. У пациентов, перенесших повторный ИМ, регистрируется усиление проницаемости мембран, нарушение протеазно-ингибиторного баланса, снижение уровня суммарных метаболитов азота, рост эластазной активности и миелопероксидазы, что указывает на усиление распада белков, активацию функционально-метаболических процессов в нейтрофилах, вазоконстрикцию и повышение «цены адаптации».
3. Проведенный клинико-биохимический анализ выявил информативные критерии (уровень внеэритроцитарного гемоглобина, концентрации окислительно модифицированных и резистентных к окислению липопротеинов, соотношение свободной и связанной воды), на основании которых разработаны новые способы дифференциальной диагностики различных форм ИБС и прогнозирования развития повторного ИМ.
4. Установлена возможность оптимизации молекулярных приспособительных механизмов путем включения липоевой кислоты в комплексную терапию больных, перенесших первичный и повторный ИМ.
Апробация работы
Основные положения диссертации доложены и обсуждены на съезде «Современные проблемы сердечно-сосудистой патологии» (Ростов-на-Дону, 2002), межвузовских научно-практических конференциях «Обмен веществ при адаптации и повреждении» (Ростов-на-Дону, 2002, 2003, 2004, 2005, 2008, 2010, 2011, 2012), Пленуме Российского научного медицинского общества терапевтов «Инновационные технологии и прогресс терапевтической клиники» (Ростов-на-Дону, 2010), Российском национальном конгрессе кардиологов (Москва, 2011), XI съезде кардиологов Юга России (Ростов-на-Дону, 2012).
Основные положения работы используются в научно-педагогической деятельности кафедры общей и клинической биохимии №1, кафедры патологической физиологии, кафедр внутренних болезней №1, №4 ГБОУ ВПО РостГМУ Минздравсоцразвития России.
Основные положения диссертационной работы отражены в 47 публикациях, в том числе в 17 научных журналах и изданиях, рекомендуемых ВАК при Министерстве образования и науки РФ, получено два патента РФ № 2424531 и №2429489.
Структура и объем работы
Диссертационная работа состоит из введения, обзора литературы, семи глав собственных исследований, заключения, выводов, библиографического указателя, содержащего 271 отечественных и 135 зарубежных источников. Объем диссертации - 237 страниц, включая 22 таблицы, 36 рисунка.
Материалы и методы исследования
Краткая характеристика клинического материала
Обследовано 349 больных с различными формами ИБС. Рандомизация осуществлялась с учетом пола, возраста обследуемых больных, кратности перенесенных ИМ. Пациенты давали информированное согласие. Исследование было одобрено Локальным этическим комитетом Государственного образовательного учреждения высшего профессионального образования «Ростовский государственный медицинский университет Федерального агенства по здравоохранению и социальному развитию» (протокол № 50/1 от 27 ноября 2007 года). Все пациенты в соответствии с поставленными задачами были разделены на пять групп:
первая группа – практически здоровые - 30 человек; средний возраст - 47±3,7 лет;
вторая группа (группа сравнения) - ИБС - 22 больных с хронической формой ИБС стабильной стенокардией напряжения; средний возраст - 51±4,2 года. Достоверность диагноза подтверждалась комплексом клинико-инструментальных исследований, включающим велоэргометрию, холтеровское мониторирование электрокардиографию (ЭКГ), коронароангиографию;
третья группа - ПИКС1 – 60 больных, перенесших первичный ИМ и обследованных через 5-8 месяцев от момента развития коронарной катастрофы; средний возраст - 48±7,3 года;
третья группа была подразделена на две клинические подгруппы в зависимости от характера метаболического компонента базисной терапии:
первая подгруппа - ПИКС1+ липоевая кислота – 35 человек, которым в схему проводимого лечения была включена липоевая кислота;
вторая подгруппа - ПИКС1 + триметазидин - 25 человек, которым в схему проводимого лечения был включен триметазидин;
четвертая группа - повторный ИМ – 149 больных с острым повторным крупноочаговым ИМ, обследованных не позднее двух суток с момента развития некроза миокарда; средний возраст - 53±6,1 года;
пятая группа - ПИКС2 – 118 пациентов, перенесших повторный ИМ и обследованных через 5-8 месяцев от момента развития повторного коронарного инцидента; 93 пациентам в схему проводимого лечения была включена липоевая кислота; средний возраст - 51±7,9 лет (рис. 1).

Рис. 1. Материалы исследования
Все пациенты как в условиях стационара, так и амбулаторно получали базисную терапию, которая была максимально унифицирована в соответствии со стандартами и включала блокаторы, дезагреганты, статины, нитраты, ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы рецепторов ангиотензина II. В схему лечения пациентов первой подгруппы третьей группы и пятой группы в состав базисной терапии был включен тиоктацид БВ (липоевая кислота) компании MEDAPHARMAGmbH&Co.KG перорально в дозе 600 мг один раз в сутки за 30 минут до еды в течение 30 дней. В схему лечения пациентов второй подгруппы третьей группы в состав базисной терапии был включен предуктал МВ (триметазидин) компании Сервье перорально в дозе 35 мг два раза в сутки в течение 30 дней.
Критерии включения в исследование: мужской пол; возраст в диапазоне 36-74 года; наличие у больных ИБС, в анамнезе перенесенного первичного ИМ за 5-8 месяцев до исследования, повторного ИМ, в анамнезе повторного ИМ, перенесенного за 5-8 месяцев до исследования.
Диагноз повторного ИМ устанавливался на основании критериев, предложенных экспертами Всероссийского научного общества кардиологов (2007), включающих, в частности, перенесенный ранее ИМ в срок более шестидесяти одного дня до развития повторного коронарного инцидента, приступ ангинозных болей интенсивностью выше обычных и длительностью не менее двадцати минут и/или изменение ЭКГ (деформация комплекса QRS в нескольких отведениях ЭКГ), а также появление и/или повышение уровня биохимических маркеров некроза миокарда в периферической крови: МВ-креатинфосфокиназа, тропонин Т и тропонин I.
Критерии исключения из исследования: сахарный диабет; артериальное давление свыше 180/100 мм рт.ст.; хроническая сердечная недостаточность IV функциональный класс по NYHA; гемодинамически значимые нарушения ритма (фибрилляция предсердий, трепетание предсердий, атриовентрикулярные блокады II, III степеней); тяжелые заболевания почек и печени; хронические обструктивные и интерстициальные заболевания легких; внесердечные заболевания в стадии обострения.
Для решения поставленных задач проводили комплексное инструментальное и лабораторно-биохимическое обследование пациентов (рис. 2).
Рис. 2. Дизайн исследования
Лабораторные методы исследования
Метаболические изменения в крови больных оценивали по комплексу биохимических показателей, характеризующих состояние ферментативной антиоксидантной защиты эритроцитов, калликреин-кининовой системы и спектр липопротеинов (ЛП) сыворотки крови. Для углубленного анализа функционального состояния эритроцитов определяли содержание конечных метаболитов гликолиза, а также уровень 2,3-дифосфоглицерата. Наряду с этим, изучались отдельные показатели, отражающие функциональное состояние сосудистого эндотелия и лейкоцитов крови.
Эритроциты выделяли из крови, стабилизированной гепарином (10 ед/мл), отделяли от лейкоцитов и тромбоцитов в 3% желатиновом растворе с последующим центрифугированием (320 g, 15 минут). После отделения плазмы и верхнего слоя клеток эритроциты отмывали охлаждённым физиологическим раствором (2-3 раза). Для получения плотного осадка при определении субстратов отмытые эритроциты центрифугировали при 640g в течение 30 минут.
Для определения активности ферментов в клетках крови использовали 20% гемолизат, приготовленный на бидистилированной воде.
Методы определения активности антиоксидантных ферментов
в эритроцитах и плазме крови
Определение активности супероксиддисмутазы (СОД) (КФ 1.15.1.1) проводили по методу Н.Р. Misra и J. Fridovich (1972). За единицу активности СОД принимали такое количество фермента, которое при добавлении к реакционной смеси изменяет на 50% скорость автоокисления адреналина в стандартных условиях. В эритроцитах активность СОД выражали в условных единицах на г гемоглобина (Нb) в мин. В плазме - в условных единицах на мг белка в мин.
Определение активности каталазы (КФ 1.11.1.6) основано на том, что неразложившаяся перекись водорода образует с молибдатом аммония (NH4)6Мо7O24 комплексное соединение, окрашенное в желтый цвет, интенсивность окраски которого измеряли на фотоэлектрокалориметре при длине волны =400 нм против контроля (М.А.Королюк и др., 1988). Активность каталазы рассчитывали, исходя из коэффициента миллимолярной экстинкции =22,2 103 ммоль-1 см-1. В эритроцитах результат выражали в мКат на г Hb в мин. В плазме результат выражали в мКат на г белка в мин.
Активность глутатионпероксидазы (ГПО) (КФ 1.11.1.9) в эритроцитах определяли по методу, предложенному А.И. Карпищенко и др. (1999). Метод основывается на способности ГПО катализировать реакцию взаимодействия восстановленного глутатиона с гидроперекисью третичного бутила. Активность фермента при этом может быть оценена по изменению содержания восстановленного глутатиона в пробах до и после инкубации с модельным субстратом с помощью цветной реакции с дитиобис-нитробензойной кислотой. Активность данного фермента выражали в мкмоль израсходованного в реакции субстрата на г Нb в мин.
Определение количества церулоплазмина сыворотки крови проводили модифицированным колориметрическим методом Ревина, описанным В.Г. Колб и соавторами (1982). Принцип метода основан на окислении парафенилендиамина при участии церулоплазмина. Ферментативную реакцию останавливали добавлением NaF. Оптическую плотность образующихся продуктов измеряли при длине волны = 530 нм, по оптической плотности судили о концентрации церулоплазмина. Содержание церулоплазмина выражали в мг/л.
Определение содержания метаболитов
Определение концентрации восстановленного глутатиона проводили методом G.L. Ellman (1959) в описании В.С. Камышникова (2004). В основе метода лежит реакция 5,5-дитиобис(2-нитробензойной) кислоты с восстановленным глутатионом, в ходе которой образуется окрашенное соединение с максимумом поглощения при длине волны =412 нм. Концентрацию восстановленного глутатиона в эритроцитах выражали в мкмоль/г Нb.
Определение концентрации мочевой кислоты в плазме осуществляли с использованием диагностической тест-системы «Эколаб». Метод основан на способности мочевой кислоты в щелочной среде восстанавливать фосфорновольфрамовый реактив с образованием окрашенного соединения, интенсивность которого пропорциональна содержанию мочевой кислоты. Результаты выражали в ммоль/л.
Концентацию водорастворимого белка в плазме определяли методом Лоури (С.Lowry et al., 1953) в описании В.С. Камышникова (2004). Метод основан на образовании комплекса, который в присутствии фенола дает характерную синюю окраску. Интенсивность окрашивания пропорциональна количеству белка; ее измеряли при длине волны 680 нм. Результаты выражали в мг/мл плазмы.
Содержание малонового диальдегида (МДА) в плазме определяли колориметрическим способом (И.Д.Стальная, 1974). Метод основан на образовании в кислой среде триметинового комплекса, состоящего из одной молекулы МДА и двух молекул 2тиобарбитуровой кислоты, имеющего розовый цвет, оптическую плотность которого определяли колориметрически при длине волны =540 нм. Количество МДА рассчитывали, исходя из 0 = 1,56 х 105 М-1 см-1, и выражали в нмоль/мг белка.
Внеэритроцитарный гемоглобин плазмы крови определяли спектрофотометрическим методом при длинах волн =540 и =680 нм, описанным А.В. Каракшевым, В.П. Вячевым (1973); полученные результаты выражали в ммоль/л.
Содержание общей, свободной и связанной воды в цельной крови, плазме и эритроцитах определяли объемно-весовым дилатометрическим методом Р.А. Сахановой (1974). Результаты выражались в %.
Одноэтапное определение уровня суммарных метаболитов азота в сыворотке крови осуществляли по методу В.А. Метельской, Н.Г. Гумановой (2005), адаптировав его для спектрофотометрического анализа. Метод основан на способности хлорида ванадия восстанавливать нитраты в нитриты, которые вступают в реакцию диазотирования сульфаниламида в составе реактива Грисса. Результаты выражали в мкмоль/л.
Методы определения показателей газотранспортной функции
эритроцитов крови
Содержание гемоглобина (Нb) определяли в гемолизате по методу, описанному И.С. Лугановой, М.Н. Блиновым (1975), спектрофотометрически при длине волны =540 нм в присутствии аммиачного раствора. Концентрацию гемоглобина выражали в г/л.
2,3-дифосфоглицерат (2,3-ДФГ) определяли неэнзиматическим методом Dyse, Bessman в модификации И.С. Лугановой, М.Н. Блинова (1975), основанном на колориметрическом измерении содержания фосфора в хлорнокислом экстракте после удаления кислоторастворимых нуклеотидов абсорбцией на активированном угле. Содержание 2,3-ДФГ рассчитывали по разнице величины общего и неорганического фосфора. Результаты выражали в мкмоль/мл плотного осадка эритроцитов.
Пировиноградную кислоту (ПВК) определяли по Фридеману и Хаугену в модификации М.П.Бабаскина (1981). Безбелковый экстракт получали воздействием 10% раствора трихлоруксусной кислоты с последующей обработкой его дифенилгидразином (ДНФГ) и фотометрией смеси. Для повышения точности способа и ускорения его в реакционную смесь, содержащую ДНФГ, вносили водный раствор щёлочи. Результаты выражали в мкмоль/мл плотного осадка эритроцитов.
Количественное определение содержания молочной кислоты (лактата) проводили на биохимическом автоматическом анализаторе «ХИТАЧИ 911». Результаты выражали в мкмоль/мл плотного осадка эритроцитов.
Определение показателей лейкоцитарной активности в плазме крови
Определение активности миелопероксидазы (МПО) (КФ 1.11.1.7) в плазме крови проводили по методу Klebanoff (1992), описанному Л.А. Даниловой (2003). Метод основан на способности МПО катализировать окисление одионизидина в присутствии Н2О2. Пробы фотометрируют на спектрофотометре против контроля при длине волны =412 нм. Результаты выражали в мкмоль/мг белка в минуту.
Активность цитохромоксидазы (ЦХО) (КФ 1.9.3.1) определяли спектрофотометрически в реакции с диметилпарафениленом по принципу метода Р.С. Кривченковой (1977) в описании З.И. Микашинович (1989). Результаты выражали в нмоль/мг белка в мин.
Методы определения липидов и липопротеинов сыворотки крови
Определение уровня общего холестерина (ХС) сыворотки проводили ферментативным методом с использованием диагностической тест-системы «Эколаб». Метод основан на окислении свободного ХС холестеролоксидазой в присутствии 4-аминоантипирина, фенола и пероксидазы. Результат выражали в ммоль/л.
Определение концентрации триацилглицеролов (ТАГ) осуществляли с использованием диагностического набора «Lachema». Метод основан на способности ТАГ омыляться гидроксидом калия в глицерин, при окислении которого образуется формальдегид. Образующийся формальдегид определяют по реакции с метилацетоном в виде 3,5-диацетил-1,4-дигидролутидин. Результаты выражали в ммоль/л.
Оценивали концентрацию основных показателей ЛП спектра сыворотки крови. Определение уровней общего ХС, ХС липопротеинов высокой плотности (ЛПВП), ХС липопротеинов низкой плотности (ЛПНП) и ХС липопротеинов очень низкой плотности (ЛПОНП) исследовали на биохимическом анализаторе OlympusAU-400. Результаты выражали в мкмоль/л.
Индекс (коэффициент) атерогенности (ИА), выражающий соотношение атерогенных и антиатерогенных ЛП в плазме крови, рассчитывался по формуле, предложенной А.Н. Климовым (1992): ИА=(ХС общий - ХС ЛПВП)/ХС ЛПВП.
Определение -ЛП проводили по методу Бурштейн и Самай, описанному Л.А. Даниловой (2003) в присутствии 0,025 М раствора СаCl2. Результаты выражали в г/л.
Определение окислительно модифицированных ЛП осуществляли по методу K. Yagi, в описании Г.И. Музя и соавт. (1999). Определение степени окисленности ЛП в сыворотке крови проводили после её предварительной инкубации в течение 1 часа при 37°С в присутствии 50 ммоль раствора CuSO4. Максимум поглощения продукта пероксидации ЛП соответствует максимуму поглощения МДА, поэтому о степени окисляемости ЛП судили по последующему определению концентрации МДА колориметрическим способом (И.Д.Стальная, 1974). Результаты выражали в нмоль МДА на мг белка ЛП.
Определение резистентности к окислению ХС ЛПНП и ХС ЛПОНП (гепариносажденных -ЛП) сыворотки крови осуществляли по методу, предложенному Ю.И. Рагино и соавт. (2006). Гепарин в присутствии солей марганца преимущественно осаждает -фракцию ЛП (ЛПНП и ЛПОНП). Метод основан на способности гепариносаждённых ЛП подвергаться окислению в присутствии металлов переменной валентности при нормальных условиях. О степени резистентости ЛП к окислению судили по уровню МДА. Результаты выражали в нмоль МДА на мг белка ЛП.
Методы определения показателей протеолитических
систем крови
Определение активности 1- протеиназного ингибиторa (1- ПИ) проводили в сыворотке крови. Кровь помещали в силиконовую пробирку и после образования сгустка центрифугировали при 3000 об/мин в течение 10 минут. Активность 1- ПИ определяли спектрофотометрически по торможению аргинин-эстеразной активности трипсина разведенной в 50 раз сыворотки крови по методу В.Ф. Нартиковой и соавторов (1979). Активность 1- ПИ выражали в условных ингибиторных единицах в мл сыворотки крови (ИЕ/мл).
Измерение общей эластазоподобной активности (ОЭА) и активности лейкоцитарной (гранулоцитарной) эластазы (ЭА) (КФ 3.4.21.37) проводили по гидролизу синтетического субстрата N-бутилоксикарбонил-L-аланил-нитрофенилового эфира (БАНЭ) методом, описанным В.Л. Доценко и соавт. (1989). Результаты выражали в нмолях гидролизованного субстрата за 1 мин в пересчете на 1 мл биологического материала (нмоль БАНЭ/млмин).
Активность АПФ определяли спектрофотометрическим методом с использованием с синтетического субстрата АПФ - фурилакрилоилфенилаланил-глицилглицина (ФАПГГ) (П.П.Голиков, Н.Ю.Николаева,1998). Исследуемую сыворотку разливали в две пробирки по 0,02 мл, затем в одну пробирку добавляли 0,1 мл 1мМ раствора ФАПГГ (Sigma-Aldrich, USA) - субстрата (опыт), в другую - 0,1мл 20мМ раствора ЭДТА (Merk, Germany) (контроль). Пробы инкубировали в термостате при 37°С 30 минут. Затем пробирки помещали в ледяную баню и в одну из них добавляли 0,1мл раствора ЭДТА (опыт), а в другую - 0,1 мл раствора субстрата ФАПГГ (контроль), тщательно смешивали. Через 5 минут в обе пробирки вносили по 2,3 мл буферного раствора, содержащего 50 мМ трис-(оксиметил)- аминометана и 300 мМ хлорида натрия, рН 8,3 и измеряли на спектрофотометре оптическую плотность проб при длине волны 334 нм против дистиллированной воды. Расчет активности АПФ проводили по изменению оптической плотности в пробе за 1 мин и выражали в мкмолях гидролизованного ФАПГГ за 1 мин в пересчете на 1 л сыворотки крови (мкмоль/мин/л).
Статистическая обработка экспериментальных данных
Статистическую обработку полученных данных осуществляли с помощью программ «Microsoft Excel 7.0» и «Statistica for Windows 6.0» (О.Ю.Реброва, 2002; В.П.Боровиков, 2003). В ходе исследования определяли основные статистические характеристики: среднее (М), средняя квадратическая погрешность (m), при этом количественные значения представляли в виде M±m. После проверки на нормальность достоверность различий оценивали по двухвыборочному критерию Стьюдента. В случае возникновения сомнений в допустимости аппроксимации эмпирического распределения нормальным законам применяли непараметрический парный тест Манна-Уитни-Уилкоксона. Различия средних величин признавались достоверными при уровне значимости р0,05, что соответствует критериям, принятым в медико-биологических исследованиях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Теоретическое осмысливание фактического материала и анализ полученных результатов, характеризующих особенности компенсаторно-адаптивных реакций при ремоделировании миокарда после перенесенных первичного и повторного ИМ, позволили акцентировать внимание на процессах, происходящих в водных бассейнах организма. Вода является универсальным биологическим механизмом приспособительных реакций, представляя структурную основу адаптации (Н.Ф.Фаращук, Ю.А.Рахманов, 2004).
В научном аспекте особый интерес представлял анализ взаимоотношений между распределением фракций воды в крови и клетках крови, так как лабильность физико-химического состояния и структуры воды является важным механизмом регуляции гомеостаза, формируя наиболее адекватные условия хода метаболических реакций, обеспечивающих в эритроцитах газотранспортные процессы.
Установлено, что у пациентов, перенесших первичный ИМ, роль регулятора водного гомеостаза отводилась в большей степени цельной крови и плазме, нежели эритроцитам (рис. 3). У пациентов, перенесших коронарную катастрофу, имел место достоверный рост общей воды в цельной крови на 17,8% (p<0,001) относительно группы сравнения. Отмечалось значимое увеличение связанной воды на 24% (p<0,001) при снижении количества свободной фракции на 10,9% (p<0,05), что подтверждалось снижением коэффициента свободная/связанная вода на 33,3% (p<0,001).

Рис. 3. Особенности водного обмена у пациентов с различными
формами ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; статистически значимые различия с показателями группы сравнения: *- р<0,05; - р<0,01; - р<0,001
Что касается изменений фракции воды в плазме крови, то нами установлен достоверный рост концентрации связанной воды на 16% (p<0,05) на фоне отсутствия статистически значимых отличий свободной воды плазмы относительно группы сравнения. Таким образом, после перенесенного первичного ИМ, наибольшие изменения касались фракции связанной воды.
После перенесенного повторного ИМ также наблюдалась перестройка водного обмена, которая имела свои особенности. В цельной крови имел место статистически достоверный рост уровня общей воды на 8,6% (p<0,001) за счет выраженного роста свободной ее фракции на 24,5% (p<0,001) на фоне значимого снижения связанной фракции на 36,9%(p<0,001) относительно группы сравнения.
При этом коэффициент свободная/связанная вода достоверно превышал значения группы сравнения (больные с ИБС). В плазме у пациентов, перенесших повторный ИМ, нами обнаружены значительные статистически достоверные изменения в виде роста свободной на 88,4% (p<0,001) и связанной воды на 65,2% (p<0,001). Имел место статистически значимый рост концентрации связанной воды эритроцитов на 61,1% (p<0,001) относительно группы сравнения, что указывало на более выраженную структурную перестройку эритроцитов, отражающую формирование гидратной оболочки макромолекул являющейся показателем устойчивой адаптации.
Таким образом, выявлены отличия аварийной перестройки водного гомеостаза в анализируемых группах. После перенесенного первичного ИМ наибольшие сдвиги происходили в плазме. Рост связанной воды плазмы несомненно вносил вклад в увеличение объема циркулирующей крови, пред- и постнагрузки на сердце. Что касается пациентов, перенесших повторный ИМ, то имело место включение всех механизмов компенсации, которые сопровождались гипергидратацией клеточных элементов и, следовательно, изменением их структурной организации. Повышение уровня связанной воды после повторного ИМ наиболее выраженное в эритроцитах отражает своеобразие водных адаптивных реакций, характеризующихся усилением связывания ионов и белковых молекул с водой. Такая перестройка водных реакций несомненно влияет на процессы трансмембранного переноса, скорость ферментативных реакций, регуляцию доставки кислорода тканям.
Сдвиг в распределении водных пространств сочетался с изменениями газотранспортной функции. У пациентов, перенесших первичный ИМ, нами выявлена тенденция к увеличению концентрации 2,3-ДФГ относительно показателей группы сравнения на 12% (р>0,05) (рис. 4).
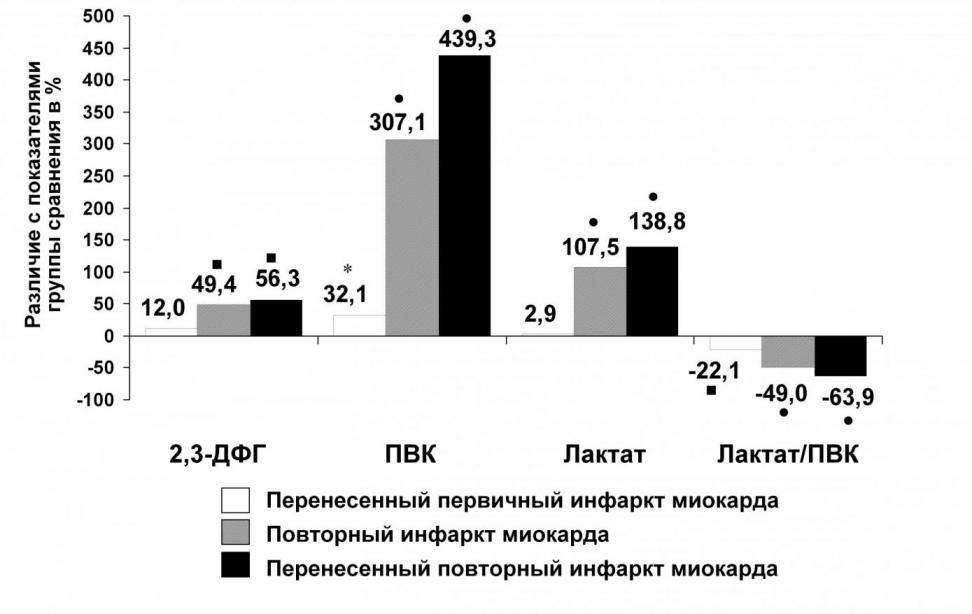
Рис. 4. Динамика показателей, отражающих кислородтранспортную функцию эритроцитов, у пациентов с различными формами ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; 2,3-ДФГ – 2,3-дифосфоглицерат; ПВК – пировиноградная кислота; статистически значимые различия с показателями группы сравнения: *- р<0,05; - р<0,01; - р<0,001
Наряду с этим отмечался статистически достоверный рост концентрации ПВК на 32,1% (p<0,05) на фоне отсутствия значимых изменений концентрации лактата. Документальным свидетельством изменения соотношения «узловых» метаболитов у больных, перенесших первичный ИМ, являлось статистически достоверное снижение величины коэффициента лактат/ПВК на 22,1% (p<0,01) относительно группы сравнения, что могло отражать метаболические перестройки, направленные на усиление отдачи кислорода тканями. Обращает внимание, что у пациентов, перенесших повторный ИМ, отмечался статистически достоверный рост концентрации 2,3-ДФГ относительно группы сравнения на 56,3% (p<0,01).
Вместе с тем имело место статистически значимое увеличение концентрации пирувата более чем в четыре раза, на 439,3% (p<0,001), на фоне роста концентрации лактата почти на 138,8% (р<0,001). Необходимо указать, что за счет резкого накопления пирувата коэффициент лактат/ПВК у пациентов, перенесших повторный ИМ, оказался ниже значений группы сравнения и ниже показателей группы больных, перенесших первичный ИМ.
Итак, из анализа фактического материала следует, что ведущая роль в формировании молекулярных приспособительных механизмов прогрессирующей гипоксии у больных принадлежит эритроцитарному модуляционному механизму. Судя по характеру метаболического обеспечения газотранспортной функции эритроцитов, данный механизм формируется уже после перенесенного первичного ИМ и является патогенетически значимым, так как отражает высокую чувствительность молекулярных механизмов, обеспечивающих функциональную активность сердца, к недостатку кислорода. Изменения метаболизма у больных, перенесших первичный ИМ, свидетельствуют о формировании блока на уровне вовлечения ПВК в метаболические процессы, который после повторного ИМ был еще более выражен. Резкое накопление ПВК, уровня 2,3-ДФГ и лактата отражают изменение функционального состояния эритроцитов и их возрастающую патогенетическую роль. Эти факты согласуются с данными З.И. Микашинович и соавт. (1984, 2011) о том, что в ответ на гипоксический стимул эритроциты гибко меняют свой обмен и качественный состав. Активация анаэробного пути окисления глюкозы, накопление недоокисленных продуктов у больных, перенесших повторный ИМ, повышают потенциал процессов свободнорадикального окисления за счет нарушения равновесия в системе синтеза и распада гема в сторону накопления прооксидантов.
Известно, что свободнорадикальные процессы контролируются наличием мощной антиоксидантной защиты, которая является важной составляющей адаптивного потенциала организма. В ходе проведенного исследования установлено, что в группе больных, перенесших первичный ИМ, отмечался дисбаланс в работе внутриклеточных ферментов первой линии антиоксидантной защиты (рис. 5).В частности, активность СОД эритроцитов статистически достоверно увеличивалась на 42,5% (p<0,001) относительно показателя группы сравнения.
Но при этом имело место статистически значимое угнетение активности каталазы на 14,3% (p<0,05), что вело к накоплению пероксида, создающего угрозу для целостности мембран эритроцитов. На превалирование факторов повреждения в этот период указывало увеличение концентрации ВЭГ плазмы на 80,2% (р<0,001).
Однако, исследовав активность данных ферментов в плазме крови пациентов, перенесших первичный ИМ, мы обнаружили тенденцию к снижению активности, как СОД на 12,6%, так и каталазы на 18,4% соответственно, относительно показателей группы сравнения. Эти данные, на наш взгляд, отражали общую реакцию организма, указывали на формирование окислительного стресса и угнетение механизмов антиоксидантной защиты, направленных на снижение уровня активных форм кислорода (АФК).
Наряду с этими данными нами установлено статистически значимое снижение активности ГПО на 19,8% (p<0,01) относительно группы сравнения. При этом следует указать, что имел место статистически достоверный рост концентрации восстановленного глутатиона на 15,5% (p<0,05) относительно группы сравнения.
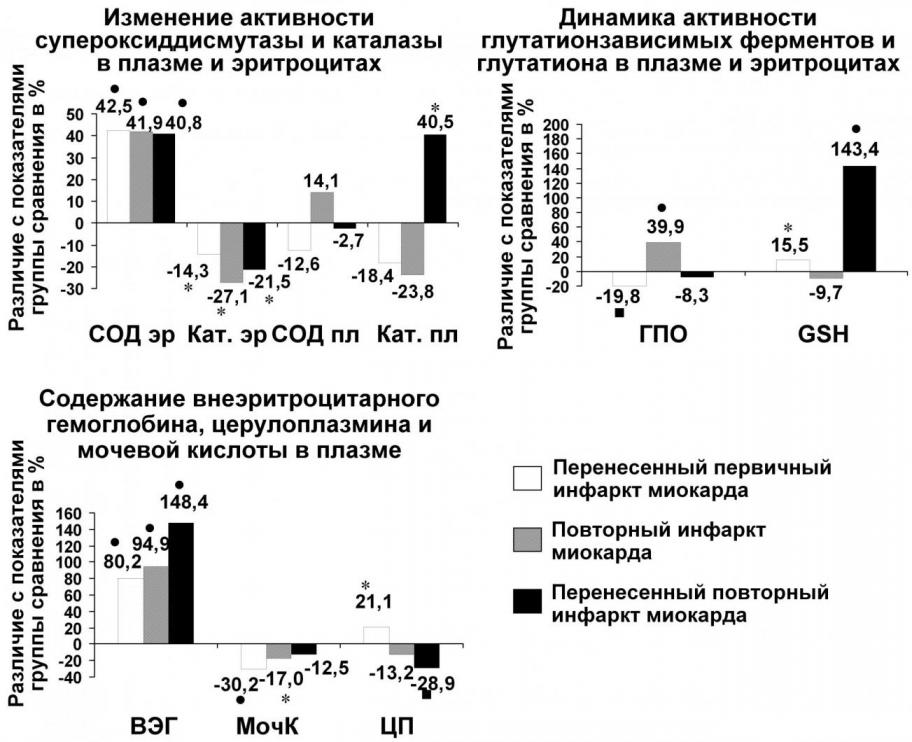
Рис. 5. Особенности антиоксидантного статуса у пациентов с различными формами ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; СОД – супероксиддисмутаза; Кат – каталаза; ГПО – глутатионпероксидаза; GSH – восстановленный глутатион; ВЭГ – внеэритроцитарный гемоглобин; МочК – мочевая кислота; ЦП – церулоплазмин; статистически значимые различия с показателями группы сравнения: *- р<0,05; - р<0,01; - р<0,001
Важно подчеркнуть, что у больных, перенесших первичный ИМ, происходили изменения и в неферментативном звене антиоксидантной защиты. В частности, регистрировалось снижение концентрации мочевой кислоты на 30,2% (p<0,001).
Обращает внимание, что снижение концентрации сывороточного антиоксиданта - мочевой кислоты, сочеталось с достоверным ростом концентрации церулоплазмина на 21,1% (p<0,05) относительно группы сравнения.
В группе пациентов, перенесших первичный ИМ, отмечался выраженный достоверный рост активности МПО на 176,1% (p<0,001) относительно показателей группы сравнения, что указывало на стимуляцию функциональной активности клеток белой крови и усиление инфильтрации нейтрофилами ишемизированной ткани миокарда.
В группе больных, перенесших повторный ИМ, в эритроцитах активность СОД статистически достоверно возросла на 40,8% (p<0,001), тогда как активность каталазы, напротив, достоверно снизилась на 21,5% (p<0,05) относительно данных группы сравнения, что указывало на усиление формирования окислительного стресса и накопление в клетках пероксидов, агрессивно воздействующих на клеточные мембраны и активизирующие вазоконстрикцию. Подтверждением этого являлись данные определения ВЭГ. Заметим, что в группе пациентов, перенесших повторную коронарную катастрофу, регистрировался максимальный рост концентрации ВЭГ на 148,4% (p<0,001). Разница в изменении ВЭГ между группами больных, перенесших первичный и повторный ИМ, на 68,2% позволила отнести данный параметр в группу информативных показателей выраженности повреждения мембран.
У пациентов, перенесших повторный ИМ, отмечалось незначительное угнетение активности ГПО на 8,3%. Обращает на себя внимание статистически достоверный рост концентрации восстановленного глутатиона на 143,4% (p<0,001) относительно показателей группы сравнения, что ставило вопрос о снижении его использования в защитных реакциях эритроцитов.
Что касается концентрации мочевой кислоты в группе больных, перенесших повторный ИМ, то наблюдается тенденция к ее снижению относительно аналогичных параметров группы сравнения на 12,5 % (р>0,05), что указывает на снижение роли низкомолекулярных антиоксидантов в реализации защитных реакций.
После перенесенного повторного ИМ еще более выражен рост уровня восстановленного глутатиона. на 143,4% (p<0,001). Это может свидетельствовать о снижении вовлечения восстановленного глутатиона в обменные процессы, что отражает повреждение защитных механизмов в эритроцитах и возрастание угрозы гемолиза. Выявленные нарушения со стороны эритроцитов как функционального элемента системы крови вносят вклад в формирование дезадаптивной формы ремоделирования миокарда, характерной для пациентов, перенесших повторную коронарную катастрофу. Это предположение сочетается с известными данными о том, что восстановленный глутатион обеспечивает процесс гидроксилирования пролина и лизина, принимает участие в стабилизации тройной спирали коллагена и сборке коллагеновых фибрил. Таким образом, уровень восстановленного глутатиона может служить надежным биохимическим маркером выраженности патологического хода приспособительных реакций у пациентов с постинфарктным кардиосклерозом (ПИКС). В этой группе изменения активности изучаемых ферментов свидетельствовали о нарушении работы антиоксидантной защиты на уровне обезвреживания Н2О2 каталазой, что подтверждает положение об окислительном механизме повреждения сосудов. Увеличение сосудистого тонуса, тенденция к вазоконстрикции, изменение функции эндотелия тесно связаны с АФК и липидным статусом, а по уровню окислительно модифицированных ЛП можно судить о выраженности окислительного стресса.
В ходе исследования установлено, что в группе больных, перенесших первичный ИМ, отмечались выраженные нарушения липидного статуса (рис. 6). Так, нами зарегистрировано статистически достоверное снижение общего количества ТАГ на 38,2% (p<0,001) относительно группы сравнения на фоне отсутствия достоверных отличий количества общего ХС сыворотки крови.

Рис. 6. Особенности обмена липидов и липопротеинов у пациентов с различными формами ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; ТАГ – триацилглицеролы; ХС – холестерин; ХСЛПОНП – холестерин липопротеинов очень низкой плотности; ХСЛПНП – холестерин липопротеинов низкой плотности; ХСЛПВП – холестерин липопротеинов высокой плотности; КА – коэффициент атерогенности; ОЛП – окисленно модифицированные липопротеины; РЛП – резистентные к окислению липопротеины; статистически значимые различия с показателями группы сравнения: *- р<0,05; - р<0,01; - р<0,001
Отмечено, что имело место статистически значимое снижение количества антиатерогенных фракций ХСЛПВП на 29,1% (p<0,001) на фоне более значимого снижения ХСЛПОНП на 37,7% (р<0,001) относительно группы сравнения. При этом отмечался статистически достоверный рост ХСЛПНП на 59,8%. (p<0,001).
Однако у пациентов, перенесших первичный ИМ, зарегистрировано статистически значимое снижение уровня окислительно модифицированных ЛП на 40,5% (p<0,001) при одновременном росте уровня резистентных к окислению ЛП на 18,8% (р<0,01) относительно группы сравнения. ИА в данной группе пациентов оказался равным 4,72±0,028, что статистически значимо превышало показатели группы сравнения: 3,22±0,030 (p<0,001).
В группе больных, перенесших повторный ИМ, отмечалось статистически достоверное, но менее выраженное снижение концентрации ТАГ сыворотки на 18,3% (p<0,05) относительно группы сравнения на фоне тенденции к снижению уровня ХС.
Кроме того, выявлены изменения в обмене ЛП, характеризующиеся преобладанием атерогенных фракций. Так, отмечалось значительное снижение ХСЛПВП на 49,5% (p<0,001), при этом нами зарегистрирован выраженный рост концентрации ХСЛПНП на 45,5% (p<0,001) на фоне снижения уровня ХСЛПОНП на 17,1% (p<0,001) относительно показателей группы сравнения. Необходимо указать, что у пациентов, перенесших повторный ИМ, отмечалось достоверное снижение концентрации окислительно модифицированных ЛП на 42,6% (p<0,001) и резистентных к окислению ЛП на 58,6% (р<0,001) относительно группы сравнения.
Что касается коэффициента атерогенности, то он у пациентов данной клинической группы составил 0,49±0,024, что значительно ниже показателей группы сравнения и данных первой группы.
В ходе проведенного исследования нами установлено, что анализируемые формы ИБС сопровождаются гипер--липопротеидемией. При этом показатели группы больных, перенесших первичный ИМ, характеризовались снижением потенциальной способности к окислению ЛП, что указывало на их тотальную модификацию, свидетельствовало о манифестации окислительного стресса и служило молекулярной основой развития эндотелиальной дисфункции. В группе больных, перенесших повторный ИМ, в период формирования кардиосклероза в отличие от пациентов, перенесших первичный ИМ, выявлено синхронное снижение окислительно модифицированных и резистентных к окислению ЛП, что может отражать дисметаболические процессы, последствием которых является не только эндотелиальная дисфункция, но и формирование ригидности тканей.
Результаты исследований группы больных, перенесших повторный ИМ, представляли особый интерес, так как являлись документальным свидетельством возможностей молекулярных адаптивных механизмов при углублении атерогенеза. Таким образом, наряду с изменениями состояния интегративных систем (нейроэндокринной, иммунной), затрудняющими репаративные процессы при повторном ИМ, регистрировалась дезинтеграция метаболических процессов, обеспечивающих функциональную полноценность структур системы кровообращения, что в итоге потенцировало возникновение аритмий, характерных для больных, перенесших повторный ИМ.
Для осуществления дифференциальной лабораторной диагностики различных форм ИБС (заживающего ИМ и ПИКС) мы предлагаем определять в сыворотке крови резистентные к окислению ЛП, а в плазме крови - ВЭГ. Так установлено, что снижение уровня резистентных к окислению ЛП ниже 4,0 нмоль МДА/мг белка ЛП и повышении ВЭГ более 60 ммоль/л диагностировали заживающий ИМ, а при повышении уровня резистентных к окислению ЛП более или равным 4,0 нмоль МДА/мг белка ЛП и снижении уровня ВЭГ менее или равным 60 ммоль/л диагностировали ПИКС (патент РФ № 2429489).
Помимо вышеизложенного, для своевременного прогнозирования повторного ИМ мы предлагаем в стадии заживающего ИМ проводить исследование сыворотки крови, в которой определяют окислительно модифицированные ЛП и ВЭГ. При значениях окислительно модифицированных ЛП 13,5 нмоль МДА/мг белка ЛП и выше, а уровня ВЭГ 60 ммоль/л и выше прогнозировали развитие повторного ИМ (патент РФ № 2424531).
Несмотря на многочисленные исследования, вопрос о причинно-следственных отношениях изменений водных структур, влияющих на протеиназную активность и реологические свойства крови, факторов регуляции функциональной активности эндотелия сосудистой стенки на уровне интеграции адаптивных процессов при повторных коронарных катастрофах остаётся далёким от разрешения.
Установлено, что в группе больных, перенесших первичный ИМ, отмечалось повышение концентрации суммарных метаболитов азота на 19,2% (p<0,05) относительно данных группы сравнения (рис. 7).

Рис. 7. Ферменты и метаболиты - регуляторы эндотелиальной функции и тонуса сосудистой стенки, параметры калликреин-кининовой системы у пациентов с различными формами ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; СМА – суммарные метаболиты азота; АПФ – ангиотензинпревращающий фермент; ПИ – 1-протеиназный ингибитор; статистически значимые различия с показателями группы сравнения:
*- р<0,05; - р<0,01; -р<0,001
Эти изменения с одной стороны способствуют уменьшению вазоконстрикции. С другой стороны снижение вазоконстрикторных эффектов на периферические сосуды достигается уменьшением выработки ангиотензина II, что документируется статистически значимым угнетением активности АПФ на 39,3% (p<0,001) относительно группы сравнения.
Установлен рост активности 1-ПИ на 70,8% (p<0,001) и ЭА на 21,5% (p<0,001) относительно показателей группы сравнения (рис. 8). При этом регистрируется снижение ОЭА на 20,4% (p<0,05).
Течение ПИКС после перенесенного повторного ИМ также характеризуется выраженным угнетением активности АПФ на 35,2% (р<0,05) относительно группы сравнения. При этом имеет место тенденция к снижению концентрации суммарных метаболитов азота относительно показателей той же группы. У пациентов, перенесших повторный ИМ, увеличивается активность как ОЭА на 31% (p<0,05), так и ЭА на 38,4% (p<0,05) относительно показателей группы сравнения. Очевидно, что такая ситуация является результатом снижения ингибирующего влияния 1-ПИ на 42,6% (p<0,01).

Рис. 8. Эластазная активность в сыворотке крови и активность миелопероксидазы в плазме крови у пациентов с различными форма ми ишемической болезни сердца:
группа сравнения – больные с ишемической болезнью сердца без инфаркта миокарда; ОЭА – общая эластазоподобная активность; ЭА – эластазная активность; МПО – миелопероксидаза; статистически значимые различия с показателями группы сравнения: *- р<0,05; - р<0,01; - р<0,001
Следовательно, в группе больных, перенесших первичный ИМ, угнетение АПФ сопровождается активацией лейкоцитарных клеток крови. После перенесенного повторного ИМ изменения анализируемых метаболических процессов указывают на превалирование сосудосуживающих факторов, а снижение пула ингибиторного звена и рост ЭА указывает на прогрессирующий распад белков, особенно металлсодержащих, что способствует накоплению в среде прооксидантов и окислительно модифицированных ЛП.
Выше перечисленные метаболические сдвиги усиливают атеросклеротическое повреждение сосудов, а также оказывают влияние на сократительную функцию сердечной мышцы. Наряду с этим сохраняющаяся активация МПО свидетельствует о высокой цитотоксичности нейтрофилов, которые поддерживают высокий уровень окисления белковой части ЛП (например, апо В). В свою очередь окислительно модифицированные ЛП усиливают адгезию клеток к эндотелию, индуцируют экспрессию факторов роста в гладкомышечных клетках, ингибируют экспрессию NO-синтазы (снижая уровень NO), а также снижают релаксацию сосудов. Полученные нами данные не только позволяют получить дополнительную информацию о патогенезе заболевания на различных этапах патогенетической эволюции ИБС, но и отобрать информативные критерии оценки состояния адаптивных механизмов после перенесенного повторного ИМ. Они характеризуются высокой активностью МПО на фоне снижения NО и АПФ.
Согласно современным представлениям, человеку присущ определенный набор ключевых метаболитов, совокупность которых характеризует специфику жизненно важных обменных процессов и возможность их приспособительных отклонений от физиологической нормы – метаболом.
Описанные в диссертационном исследовании показатели водного обмена, метаболической регуляции кислородной функции крови, состояние антиоксидантной защиты, особенности обмена липидов, ЛП, метаболиты и ферменты-регуляторы эндотелиальной функции, параметры ККС являются важнейшими компонентами метаболома человека, гибкость изменений которых могут характеризовать «метаболический адаптивный потенциал».
Оценка более широкого спектра метаболитов, чем это принято в клинической практике в настоящее время, позволит оптимизировать раннюю диагностику патологического процесса.
Таким образом, степень изменения изученных в работе метаболитов, их клинико-патофизиологический анализ могут быть использованы как маркеры дифференциации перенесенных первичного или повторного ИМ.
На заключительном этапе исследования на основании данных клинико-патофизиологического анализа установлены ключевые отличия организации приспособительных реакций и теоретически определены принципы метаболической коррекции. Препаратами первого ряда явились медицинские средства, снимающие метаболический блок на уровне ключевых метаболитов и имеющие, в том числе, антиоксидантную направленность действия. Следует особо подчеркнуть, что у пациентов, перенесших первичный ИМ, после курсового включения липоевой кислоты в проводимую базисную терапию наблюдали снижение концентрации ПВК на 35,1% (p<0,001), что указывает на снятие «блока» и вовлечение этого метаболита в биохимические реакции. Установлено, что в группе больных, перенесших первичный ИМ, уровень 2,3-ДФГ в эритроцитах достоверно увеличился на 31,3% (p<0,001) относительно показателей до лечения.
Для сравнительного анализа метаболических эффектов проводили курс терапии с включением триметазидина у пациентов, перенесших первичный ИМ. Выявлена тенденция к снижению концентрации 2,3ДФГ, и статистически достоверное повышение концентрации ПВК на 237,8% (p<0,001) в сравнении с данными до лечения.
При определении активности ферментов первой линии антиоксидантной защиты в эритроцитах выявлено достоверное снижение повышенной активности СОД как после курса терапии с включением липоевой кислоты на 43,1% (p<0,001), так и после курса терапии с триметазидином на 31% (p<0,01) относительно показателей до лечения. Следует подчеркнуть, что несмотря на однонаправленность изменений СОД активность фермента приблизилась к показателям практически здоровых людей в подгруппе с липоевой кислотой, что способствует синхронизации работы СОД и каталазы, хотя в обеих подгруппах и после лечения сохраняется пониженная активность этого фермента.
Таким образом, динамика активности СОД после курсового включения в проводимую терапию липоевой кислоты и триметазидина отражала тенденцию к нормализации процессов устранения АФК в эритроцитах.
Установлено, что активность МПО в плазме крови пациентов, перенесших первичный ИМ, после курсового включения липоевой кислоты в базисную терапию соответствовала показателям контрольной группы, то есть функциональная активность лейкоцитов приблизилась к показателям практически здоровых людей. Обращает на себя внимание тот факт, что при использовании триметазидина активность МПО статистически достоверно снизилась на 50,7% (p<0,001) по сравнению с показателями до лечения и стала почти в два раза ниже показателей практически здоровых людей, что может отражать снижение активности фагоцитоза и антибактериальной резистентности.
Изменения активности МПО и ЦХО в совокупности отражали снижение тяжести воспаления после курсового применения липоевой кислоты в схеме базисной терапии у больных, перенесших первичный ИМ.
Анализ характеристик метаболических сдвигов у больных, перенесших первичный и повторный ИМ, после введения в терапевтический комплекс липоевой кислоты позволил прийти к следующему заключению: несмотря на сохраняющуюся гипоксию и напряжение модуляционного механизма адаптации клеток крови у больных, перенесших первичный ИМ, регистрировалось статистически значимое снижение уровня пирувата на 35,1% (p<0,001) на фоне роста лактата на 25,7% (р<0,05). У пациентов, перенесших повторный ИМ, отмечалось более выраженное снижение ПВК на 86,1% (p<0,001) с параллельным статистически значимым снижением лактата на 47,1% (p<0,001), что свидетельствовало об уменьшении уровня метаболического ацидоза и отражало позитивные тенденции. Таким образом, степень уменьшения уровня пирувата после коррекции липоевой кислотой имеет важное патогенетическое значение и является информативным показателем оптимизации адаптивных реакций эритроцитов, отражающих корригирующий эффект липоевой кислоты.
В результате применения липоевой кислоты в двух анализируемых группах происходили следующие изменения спектра ЛП: у больных, перенесших первичный ИМ, отмечались однонаправленные статистически значимые снижения концентрации окислительно модифицированных ЛП на 77,8% (p<0,001) и резистентных к окислению ЛП на 76,4% (p<0,001). У пациентов, перенесших повторный ИМ, отмечались разнонаправленные сдвиги концентрации окислительно модифицированных и резистентных к окислению ЛП: окислительно модифицированные ЛП снижались на 77,3% (p<0,001), резистентные к окислению ЛП повышались на 87,5% (p< 0,001). Причем резистентные к окислению ЛП восстанавливали свои значения до уровня практически здоровых людей. Иначе говоря, у больных, перенесших повторный ИМ, после курсового применения липоевой кислоты ЛП становятся более устойчивы к действию прооксидантов, что может свидетельствовать о восстановительных реакциях в сосудистом эндотелии. Такие изменения могут указывать на торможение атеросклероза и, следовательно, отражать повышение эффективности приспособительных механизмов.
Известно, что в атеросклеротических бляшках макрофаги содержат большое количество АПФ. У больных, перенесших первичный ИМ, изменения ОЭА и суммарных метаболитов азота носят однонаправленный характер: отмечается снижение данных показателей на 24% (p<0,05) и на 55,5% (p<0,001) соответственно. У больных, перенесших повторный ИМ, изменения ОЭА и суммарных метаболитов азота также носят однонаправленный характер. Выявленные нами изменения свидетельствуют о снижении функциональной активности макрофагов в исследуемых группах после курсового применения липоевой кислоты на фоне базисной терапии, что может указывать на угасание воспалительного процесса. Исходя из данных литературы известно, что АПФ влияет на состояние ядерного фактора B, который играет ключевую роль в атерогенезе и активации макрофагов. В этой связи можно полагать, что после метаболической коррекции замедляются процессы патологического ремоделирования сосудов и миокарда за счёт уменьшения процессов перекисного окисления липидов, выработки цитокинов, факторов роста, поддерживающих воспаление.
Липоевая кислота усиливает утилизацию субстратов энергообмена, что потенцирует уровень функционирования кислородтранспортных систем, оптимизирует гомеостатические реакции лейкоцитов и эритроцитов, гармонизирует баланс ингибиторов ККС.
Эта тенденция особенно чётко выявляется при анализе метаболических перестроек у больных, перенесших повторный ИМ, после лечения с использованием липоевой кислоты.
Проведённое исследование позволило сформировать новые представления о метаболических эффектах липоевой кислоты при ишемизации миокарда и продемонстрировало возможности оптимизации адаптационного эффекта не только за счёт антиокислительного действия препарата. Включение в комплекс базовой терапии липоевой кислоты, особенно при повторных коронарных инцидентах, обеспечивало антигипоксический, антирадикальный, антилипидемический эффекты на фоне оптимального уровня антибактериальной резистентности лейкоцитов, поэтому для качественной оценки реактивности организма необходимо изучение комплекса ключевых параметров гомеостаза, характеризующих состояние элементов данной системы. Обращает внимание, что адекватность функционирования приспособительных реакций системы крови зависит как от исходной реактивности организма, так и от кратности патологического процесса.
Особый интерес представляют полученные нами данные о возможности диагностики различий в индивидуальном уровне адаптивных реакций у больных, перенесших первичный и повторный ИМ, с помощью современных лабораторных методов.
Полученные нами данные позволяют считать, что одним из факторов истощения адаптивно-компенсаторных механизмов после первичного и повторного ИМ является риск развития цитоэнергетической недостаточности, связанной с накоплением неиспользованных субстратов. Метаболическая коррекция с применением липоевой кислоты явилась патофизиологическим методом анализа, позволившим понять работу элементов системы кровообращения, обеспечивающих формирование нового уровня гомеостатического равновесия в условиях выраженной гипоксии и получить выраженный клинический эффект у больных, перенесших повторный ИМ. Проведенные исследования позволили разработать концепцию адаптивных реакций важнейших гомеостатических параметров, характеризующих качественно-количественные перестройки клеток крови и элементов сосудистого русла в зависимости от кратности перенесенного ИМ, дали возможность обосновать пути оптимизации защитных реакций и разработать информативные методы диагностики и прогнозирования повторного ИМ (рис. 9).

Рис. 9. Патофизиологический анализ адаптивных экстракардиальных реакций после перенесенных
коронарных инцидентов
ВЫВОДЫ
1. Молекулярные адаптивные реакции зависят от кратности перенесенных инфарктов миокарда и определяются степенью активации кислородтранспортной системы, обеспечиваются изменением соотношения активных форм кислорода в сторону роста уровня перекиси водорода, характеризуются возрастанием патогенетической роли антиоксидантной защиты на фоне изменения уровня суммарных метаболитов азота и способности к индуцированному окислению липопротеинов.
2. В аварийной перестройке водного гомеостаза у пациентов, перенесших повторный инфаркт миокарда, выявлены отличия относительно группы больных, перенесших первичный инфаркт миокарда, связанные с гипергидратацией эритроцитов за счет роста доли связанной воды эритроцитов, что отражает нарушения водно-электролитного баланса и гемодинамики.
3. Характер изменения параметров метаболического обеспечения газотранспортных процессов эритроцитов указывает на усиление гипоксических сдвигов после перенесенного повторного инфаркта миокарда, что подтверждается ростом 2,3-дифосфоглицерата, лактата и резким накоплением пирувата в клетках красной крови.
4. Установлена патогенетическая значимость изменений первой линии ферментов антиоксидантной защиты, которая документируется активацией супероксиддисмутазы эритроцитов на фоне угнетения активности каталазы эритроцитов, наиболее выраженных у больных, перенесших повторный инфаркт миокарда. После перенесенного повторного инфаркта миокарда в эритроците регистрируется резкий рост глутатиона, что может служить маркером состояния защитных реакций в клетках крови и повышения «цены адаптации».
5. Выявлена разнонаправленная динамика сдвигов показателей, характеризующих функциональное состояние эндотелиальных элементов при постинфарктном кардиосклерозе. После перенесенного первичного инфаркта миокарда в плазме регистрируется увеличение уровня суммарных метаболитов азота и уменьшение активности ангиотензинпревращающего фермента, тогда как после перенесенного повторного инфаркта миокарда имеет место тенденция к снижению уровня суммарных метаболитов азота и выраженное угнетение активности данного фермента относительно группы сравнения.
6. При постинфарктном кардиосклерозе регистрируется высокая функционально-метаболическая активность лейкоцитов, об этом свидетельствует рост активности эластазы и активности миелопероксидазы, особенно это выраженно у пациентов, перенесших повторный инфаркт миокарда.
7. Показатели ингибиторно-протеолитического комплекса изменяются по-разному в зависимости от кратности инфаркта миокарда. Так, после перенесенного первичного инфаркта миокарда отмечается достоверное увеличение 1-протеазного ингибитора, тогда как после перенесенного повторного инфаркта миокарда количество ингибитора достоверно снижается.
8. Выявленные изменения окислительно модифицированных, резистентных к окислению липопротеинов и внеэритроцитарного гемоглобина в системе крови несут диагностическую и прогностическую информацию о течении постинфарктного кардиосклероза как после первичного, так и после повторного инфаркта миокарда, что легло в основу разработки новых методов дифференциальной диагностики и прогнозирования различных форм ишемической болезни сердца.
9. Липоевая кислота усиливает утилизацию субстратов энергообмена, что потенцирует необходимый уровень функционирования кислородтранспортных систем, оптимизирует гомеостатические реакции лейкоцитов и эритроцитов, регистрируется тенденция к гармонизации баланса элементов калликреин-кининовой системы и липопротеинов.
10. Клинико-патогенетический анализ важнейших гомеостатических реакций, отражающих функционально-метаболическое состояние клеток крови и элементов сосудистого русла, позволил обосновать возможность оптимизации защитных реакций сердечно-сосудистой системы и разработать информативные методы диагностики и прогнозирования развития повторного инфаркта миокарда.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ В ВАК-рецензируемой печати
1. Микашинович, З.И. Оценка водного обмена у пациентов при заболеваниях сердечно-сосудистой системы / З.И. Микашинович, Р.А. Суроедова, Е.В. Олемпиева // Вестник Российского университета дружбы народов. Серия: Медицина. - 2009. - №4. - С. 628-629.
2. Микашинович, З.И. Параметры водного гомеостаза у пациентов с острым инфарктом миокарда и постинфарктным кардиосклерозом / З.И. Микашинович, Р.А. Суроедова, Е.В. Олемпиева // Кубанский научный медицинский вестник. - 2009. - №3. - С. 84-86.
3. Микашинович, З.И. Особенности газотранспортной системы крови у пациентов с постинфарктным кардиосклерозом / З.И. Микашинович, Р.А. Суроедова, Е.В. Олемпиева // Клиническая лабораторная диагностика.- 2009. - №10. - С. 19-21.
4. Микашинович, З.И. Оценка степени риска развития повторного инфаркта миокарда у пациентов с метаболическим синдромом / З.И. Микашинович, Р.А. Гридасова, Е.В. Олемпиева // Вестник Российского университета дружбы народов. Серия: Медицина. - 2010.- №3. - С. 116-118.
5. Микашинович, З.И. Особенности процессов свободнорадикального окисления и состояния антиоксидантного статуса у пациентов с разными формами ишемической болезни сердца / З.И. Микашинович, Е.В. Олемпиева, Р.А. Гридасова, А.А. Швецов // Кубанский научный медицинский вестник. – 2010.- №3-4. - С. 131-135.
6. Микашинович, З.И. Изменение активности ферментов антиоксидантной защиты у пациентов с разными формами ишемической болезни сердца / З.И.Микашинович, Р.А.Гридасова, Е.В.Олемпиева // Клиническая лабораторная диагностика. - 2010. - №5. - С. 11-13.
7. Микашинович, З.И. Молекулярные механизмы формирования эндотелиальной дисфункции у пациентов с кардиоваскулярной патологией и метаболическим синдромом / З.И. Микашинович, Е.В. Олемпиева, Р.А. Гридасова, О.Г. Ишонина, И.А. Маринина // Валеология. - 2010. - №2. - С. 5-9.
8. Микашинович, З.И. Молекулярные механизмы развития окислительного стресса при остром инфаркте миокарда / З.И. Микашинович, Е.В. Олемпиева, В.П. Терентьев, Р.А. Гридасова, Т.Д. Коваленко // Валеология. - 2010. - №2. - С. 12-16.
9. Гридасова, Р.А. Активность нейтрофильных лейкоцитов крови при постин фарктном кардиосклерозе / Р.А.Гридасова, З.И.Микашинович, В.П.Терентьев // Профилактическая медицина.- 2011.-Т.14.-№5.-С.41-42.
10.Гридасова, Р.А. Антиоксидантный ферментативный статус эритроцитов у больных, перенесших инфаркт миокарда / Р.А. Гридасова, З.И. Микашинович, В.П. Терентьев // Профилактическая медицина.- 2011. – Т.14.- №5.- С.42.
11.Гридасова, Р.А. Метаболические цитопротекторы в комплексной терапии пациентов с постинфарктным кардиосклерозом / Р.А.Гридасова // Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки.- 2011.- №6.- С. 97-99.
12. Гридасова, Р.А. Особенности изменения молекулярных процессов утилизации кислорода в постинфарктном периоде у пациентов с разной кратностью инфаркта миокарда / Р.А.Гридасова // Кубанский научный медицинский вестник.- 2011.- №6(129).- С.33-36.
13. Гридасова, Р.А. Возможности фармакологической коррекции метаболических нарушений у больных с ишемической болезнью сердца, перенесших инфаркт миокарда / Р.А.Гридасова // Профилактическая медицина.-2011.-Т.14.-№4(выпуск 2).- С.18-19.
14. Гридасова, Р.А. Биохимические маркеры дисфункции эндотелия у больных с ишемической болезнью сердца, перенесших инфаркт миокарда / Р.А.Гридасова // Профилактическая медицина.- 2011.- Т.14,№4 (выпуск 2).-С.19.
15. Гридасова, Р.А. Информативность изменения липидного статуса и проницаемости клеточных мембран для дифференциальной диагностики разных форм ишемической болезни сердца / Р.А.Гридасова, З.И.Микашинович // Владикавказский медико-биологический вестник.- 2011.- Т.13.- Вып.21.- С.126-130.
16. Гридасова, Р.А. Особенности изменения фракций воды в крови пациентов с различными вариантами течения ишемической болезни сердца / Р.А.Гридасова, З.И.Микашинович // Валеология.- 2012.- №2.- С. 84-87.
17. Гридасова, Р.А. Хронопатологические аспекты и особенности изменения кислородтранспортных процессов в крови у больных, перенесших повторный инфаркт миокарда / Р.А.Гридасова // Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки.- 2012.- №1.- С.107-109.
ОСНОВНЫЕ ПУБЛИКАЦИИ ПО ТЕМЕ ДИССЕРТАЦИИ
18. Суроедова, Р.А. Влияние алиментарного фактора на компенсаторные процессы у больных с Q-инфарктом миокарда / Р.А. Суроедова, З.И. Микашинович, Т.Э. Харатян., А.А. Стадников // Сборник докладов и тезисов на адаптивно съезда «Современные проблемы сердечно-сосудистой патологии». - Ростов-на-Дону, 2002. - С. 349-351.
19. Суроедова, Р.А. Роль метаболического синдрома Х в патогенезе гипоксии у больных Q-инфарктом миокарда / Р.А. Суроедова, З.И. Микашинович, В.П. Терентьев // Сборник тезисов Российского национального конгресса кардиологов. – Санкт-Петербург, 2002. - С. 399.
20. Суроедова, Р.А. Состояние молекулярных механизмов компенсаторно-адаптивных процессов при разных вариантах течения инфаркта миокарда / Р.А. Суроедова, А. Халил, И. Журавлева, Ю. Перепечаева // Материалы первой межвузовской научно-практической конференции студентов, молодых ученых и специалистов «Обмен веществ при адаптации и повреждении». - Ростов-на-Дону, 2002. - С. 58.
21. Александрук, О.А. Сравнительная оценка показателей липидного обмена у больных ишемической болезнью сердца / О.А. Александрук, А.А. Абрамова, З.П. Джелаухян, Е.В. Ветрова, Р.А. Суроедова, А.Е. Самсонов, И.А. Радченко // Тезисы докладов второй межвузовской международной конференции молодых ученых, специалистов и студентов «Обмен веществ при адаптации и повреждении». - Ростов-на-Дону, 2003. - С. 13 -14.
22. Суроедова, Р.А. Влияние алиментарного фактора на метаболический профиль эритроцитов у больных осложненным инфарктом миокарда / Р.А. Суроедова // Сборник научных трудов, посвященный 50-летию Ростовской областной клинической больницы. - Ростов-на-Дону, 2003. - С. 133-134.
23. Суроедова, Р.А. Особенности адаптации к гипоксии у больных Q-инфарктом миокарда, осложненным сердечной недостаточностью / Р.А.Суроедова, З.И.Микашинович, В.П.Терентьев, Е.Е.Гурнак // Материалы 5-го Российского научного форума «КАРДИОЛОГИЯ 2003».-Москва, 2003.- С.156-157.
24. Суроедова, Р.А. Адаптационно-компенсаторные реакции газотранспортной функции крови при повторном инфаркте миокарда / Р.А. Суроедова, О.А. Александрук, Е.С. Рыбьякова // Труды III межвузовской международной конференции молодых ученых, специалистов и студентов «Обмен веществ при адаптации и повреждении». - Ростов-на-Дону, 2004. - С. 73-74.
25. Суроедова, Р.А. Уровень холестерина в составе липопротеинов низкой плотности и их способность к спонтанному и индуцированному окислению у больных ИБС / Р.А. Суроедова, Е.В. Ветрова, Л.И. Костромитина, Е.В. Гудкова, А.Ч. Каитова, Д.В. Бакузова // Труды III межвузовской международной конференции молодых ученых, специалистов и студентов «Обмен веществ при адаптации и повреждении». - Ростов-на-Дону, 2004. - С. 74-75.
26. Суроедова, Р.А. Исследование антиоксидантных ферментов и низкомолекулярных антиоксидантов в крови у больных с различными формами ИБС / Р.А. Суроедова, Е.В. Ветрова, Е.В. Гудкова, Д.В. Бакузова, О.А. Александрук // Труды IV межвузовской международной конференции «Обмен веществ при адаптации и повреждении», Ростов-на-Дону, 2005. - С. 151-152.
27. Суроедова, Р.А. Биохимическое обоснование способов диагностики у больных ИБС с повторным инфарктом миокарда / Р.А. Суроедова // Труды V международной конференции «Обмен веществ при адаптации и повреждении».- Ростов-на-Дону, 2006. - С. 193-194.
28. Суроедова, Р.А. Взаимосвязь состояния липидограммы крови с окислительным потенциалом липопротеинов низкой плотности у пациентов с инфарктом миокарда / Р.А. Суроедова, Е.В. Ветрова, Е.В. Опанасенко, В.В. Вилинова // Материалы VII межвузовской конференции с международным участием «Обмен веществ при адаптации и повреждении». - Ростов-на-Дону, 2008. - С. 122-123.
29. Суроедова, Р.А. Особенности водного гомеостаза у пациентов с острым инфарктом миокарда / Р.А. Суроедова, Е.В. Олемпиева, Е.А. Богомазова, А.Е. Волошина // Материалы IV научно-практической конференции молодых ученых с международным участием «Завадские чтения». - Ростов-на-Дону, 2009. - С. 130-131.
30. Суроедова, Р.А. Кислородтранспортная функция крови при заболеваниях сердечно-сосудистой системы / Р.А. Суроедова, Е.В. Олемпиева, О.Ю. Ловягина, О.Я. Симак // Материалы IV научно-практической конференции молодых ученых с международным участием «Завадские чтения». - Ростов-на-Дону, 2009. - С. 132-133.
31. Микашинович, З.И. Способ медикаментозной коррекции метаболических нарушений у пациентов с острым инфарктом миокарда / З.И. Микашинович, Р.А. Гридасова // Материалы VIII межвузовской конференции с международным участием.- Ростов-на-Дону, 2009. - С. 85-86.
32. Микашинович, З.И. Особенности кислородтранспортной системы крови у пациентов с разными формами кардиоваскулярной патологии / З.И. Микашинович, Е.В. Олемпиева, Р.А. Гридасова, М.А. Шевченко, А.А. Швецов // Материалы IX межвузовской конференции с международным участием. - Ростов-на-Дону, 2010. - С. 89-92.
33. Гридасова, Р.А. Особенности антиоксидантного статуса крови у пациентов с повторным инфарктом миокарда / Р.А. Гридасова, З.И. Микашинович, В.П. Терентьев // Материалы Пленума Российского научного медицинского общества терапевтов и межрегиональной конференции, посвященной 80-летию Ростовского областного научно-медицинского общества терапевтов «Инновационные технологии и прогресс терапевтической клиники». - Ростов-на-Дону, 2010. - С. 34.
34. Гридасова, Р.А. О возможности применения липоевой кислоты у пациентов с постинфарктным кардиосклерозом / Р.А. Гридасова // Материалы Х межвузовской конференции с международным участием «Обмен веществ при адаптации и повреждении (дни медицинской лабораторной диагностики).- Ростов-на-Дону, 2011. - С. 46-48.
35. Гридасова, Р.А. Особенности нарушений липидного обмена у больных, перенесших повторный инфаркт миокарда / Р.А. Гридасова // Материалы VI научно-практической конференции молодых ученых с международным участием, посвященной 95-летию кафедры внутренних болезней №1 «Завадские чтения». - Ростов-на-Дону, 2011. - С. 40-41.
36. Гридасова, Р.А. Зависимость влияния времени развития повторного инфаркта миокарда на его исход / Р.А. Гридасова, Е.В. Игнатьева, Е.И. Мирошниченко // Материалы Всероссийского научно - образовательного форума «Профилактическая кардиология 2011». - Москва, 2011. - С. 35.
37. Гридасова, Р.А. Особенности обмена форм воды и показателей липидного спектра крови у больных, перенесших инфаркт миокарда / Р.А. Гридасова // Материалы VI научно- практической конференции молодых ученых с международным участием, посвященной 95-летию кафедры внутренних болезней №1 «Завадские чтения».- Ростов-на-Дону, 2011. - С. 41-42.
38. Гридасова, Р.А. Повторный инфаркт миокарда и время суток / Р.А. Гридасова, Е.В. Игнатьева, Е.И. Мирошниченко, Л.В. Боханова // Материалы VI научно-практической конференции молодых ученых с международным участием, посвященной 95-летию кафедры внутренних болезней №1 «Завадские чтения». - Ростов-на-Дону, 2011. - С.43-46.
39. Гридасова, Р.А. Особенности липидного статуса сыворотки крови у больных повторным инфарктом миокарда / Р.А. Гридасова // Материалы Х съезда кардиологов и кардиохирургов Южного федерального округа «Совершенствование оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями - новые подходы и перспективы». - Краснодар, 2011. - С. 65-67.
40. Гридасова, Р.А. Эндотелиальная дисфункция и особенности липидного статуса у пациентов, перенесших инфаркт миокарда / Р.А. Гридасова // Материалы IX Российской научной конференции с международным участием «Реабилитация и вторичная профилактика в кардиологии». - Москва, 2011. - С. 29-31.
41. Гридасова, Р.А. Особенности кислородтранспортной функции крови при различных формах ишемической болезни сердца / Р.А.Гридасова, З.И.Микашинович, В.П.Терентьев // Сборник материалов XVIII Российского национального конгресса «Человек и лекарство» (тезисы докладов).- Москва, 2011.-С.42.
42. Гридасова, Р.А. Оценка активности антиоксидантных ферментов эритроцитов при различных формах ишемической болезни сердца / Р.А.Гридасова, З.И. Микашинович, В.П.Терентьев // Сборник материалов XVIII Российского национального конгресса «Человек и лекарство» (тезисы докладов).- Москва, 2011.-С.43.
43. Гридасова, Р.А. Лабораторно-диагностические критерии прогнозирования развития повторного инфаркта миокарда / Р.А.Гридасова // Объединенная научно-практическая конференция «Кардиоваскулярная профилактика и реабилитация 2011» и «Неинфекционные заболевания и здоровье населения России». Тезисы докладов.- Приложение I к журналу «Кардиоваскулярная профилактика» 2011.- 10 (4).-С.52.
44. Гридасова, Р.А. Медикаментозная коррекция метаболических изменений газотранспортной функции крови у больных, перенесших инфаркт миокарда /Р.А.Гридасова // Материалы Российского национального конгресса кардиологов.- Приложение I к журналу «Кардиоваскулярная терапия и профилактика»2011.- 10(6).- С.83.
45. Гридасова, Р.А. Влияние тиоктацида БВ на показатели липидного обмена у больных с ишемической болезнью сердца, перенесших инфаркт миокарда / Р.А.Гридасова // Материалы Российского национального конгресса кардиологов.- Приложение I к журналу «Кардиоваскулярная терапия и профилактика»2011.- 10(6).- С.82.
46.Гридасова, Р.А. Патобиохимические особенности адаптивных реакций у пациентов с разной кратностью инфаркта миокарда / Р.А.Гридасова // Материалы ХI межвузовской конференции с международным участием «Обмен веществ при адаптации и повреждении (дни медицинской лабораторной диагностики).- Ростов-на-Дону, 2012. - С. 16-17.
47. Гридасова, Р.А. Оценка клинической эффективности липоевой кислоты у пациентов с постинфарктным кардиосклерозом / Р.А.Гридасова, З.И.Микашинович, Е.С.Белоусова, Т.Д.Коваленко // Журнал фундаментальной медицины и биологии.- 2012.- №1.- С. 57-61.
Патенты
1. Патент 2424531 Российская Федерация, МПК G01N 33/72 (2006.01) G01N 33/92 (2006/01) Способ прогнозирования повторного инфаркта миокарда / Гридасова Р.А., Микашинович З.И., Олемпиева Е.В., Терентьев В.П.; заявитель и патентообладатель Гридасова Р.А.- №2010119412/15; заявл.14.05.2010; опубл. 20.07.2011, Бюл.№20.- 10 с.
2. Патент 2429489 Российская Федерация, МПК G01N 33/92 (2006.01) Способ дифференциальной диагностики различных форм ишемической болезни сердца / Гридасова Р.А., Микашинович З.И., Олемпиева Е.В., Терентьев В.П.; заявитель и патентообладатель Гридасова Р.А. - №2010119414/15; заявл.14.05.2010; опубл. 20.09.2011, Бюл. № 26. - 9 с.
СПИСОК СОКРАЩЕНИЙ
АПФ - ангиотензинпревращающий фермент
АФК - активные формы кислорода
БАНЭ - N-бутиоксикарбонил-L-аланил-нитрофеноловый эфир
ГПО - глутатионпероксидаза
ДНФГ - дифенилгидразин
ДФГ - дифосфоглицерат
ИА - индекс атерогенности
ИБС - ишемическая болезнь сердца
ИМ - инфаркт миокарда
ЛП - липопротеины
ЛПВП - липопротеины высокой плотности
ЛПНП - липопротеины низкой плотности
ЛПОНП - липопротеины очень низкой плотности
МДА - малоновый диальдегид
МПО - миелопероксидаза
ОЭА - общая эластазоподобная активность
ПИКС - постинфарктный кардиосклероз
ПВК - пировиноградная кислота
СОД - супероксиддисмутаза
ХС - холестерин
ЦХО - цитохромоксидаза
ЭА - эластазная активность
ЭКГ - электрокардиография
1ПИ - 1- протеиназный ингибитор

