Исследование динамики гибели адипоцитов при гипертермии и воздействии лектинов
На правах рукописи
Черкасова Ольга Алексеевна
Исследование динамики гибели адипоцитов при гипертермии и воздействии лектинов
Специальность 03.00.02 – биофизика
Автореферат
диссертации на соискание ученой степени
кандидата физико-математических наук
Саратов – 2007
Работа выполнена в Саратовском государственном
университете им. Н. Г. Чернышевского
Научный руководитель: Заслуженный деятель науки РФ,
доктор физико-математических наук, профессор Тучин В. В.
Официальные оппоненты: доктор физико-математических наук, профессор Березин Валентин Иванович
доктор биологических наук, ведущий научный сотрудник Дыкман Лев Абрамович
Ведущая организация: Санкт-Петербургский государственный университет информационных технологий, механики и оптики
Защита состоится 13 ноября 2007 года в 15.30 часов на заседании диссертационного совета Д 212.243.05 в Саратовском государственном университете им. Н. Г. Чернышевского по адресу: 410012, Саратов, ул. Астраханская, 83.
С диссертацией можно ознакомиться в Научной библиотеке Саратовского государственного университета.
Автореферат разослан 10 октября 2007 г.
Ученый секретарь
диссертационного совета
д.ф.-м.н., профессор Дербов В. Л.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Исследование механизмов гибели клетки является одной из актуальных проблем биофизики. Несмотря на большое количество экспериментальных данных, до сих пор остаются не выясненными многие механизмы этого явления, в частности, не до конца понятны механизмы регуляции гибели отдельных клеток в целостном многоклеточном организме (Фильченко А.А., Стойка Р.С., 1999). Актуальность этой проблемы определяется взаимосвязью нарушения регуляции процесса запрограммированной гибели клетки с большинством заболеваний. Выявление конкретных механизмов нарушения регуляции клеточной гибели, сопровождающих конкретные заболевания, позволит определить этиологию и патогенез данных заболеваний. Детерминация гибели клеток и ее регуляция – одна из центральных проблем биологии клетки (Уманский С.Р., 1996; Abastado J.-P., 1996; Prins J.B. et al., 1994, 1997; Білий Р. О., Стойка Б. Р., Стойка Р. С., 2002).
В последние годы в биофизике успешно развиваются новые методы исследования человеческих тканей и органов, основанные на хорошо контролируемом по температуре, времени и пространству нагреве. С этой точки зрения особый интерес представляет жировая ткань. Так, например, жировая ткань характеризуется достаточно низкой температурой плавления, близкой к физиологической, что может значительно повлиять на динамику поведения тканей, имеющих жировые накопления. При нагреве от 24С до 45С жировая ткань претерпевает несколько фазовых переходов. Фазовые превращения “кристаллическая фаза – жидкость” в адипоцитах человека протекают в широком диапазоне температур, что связано с многокомпонентностью запасённого жира (Garti N., Sato K., 1988).
Одной из важных проблем современной медицины и, косметологии в частности, является исследование способов физического воздействия на жировые клетки с целью их разрушения. Одним из самых простых, но эффективных способов физического воздействия на жировые клетки, является гипертермия (Prins J.B., Walker N.I. et al., 1994), эффективность которой можно усилить с помощью биоактивных веществ.
В настоящее время в качестве гистохимических реагентов большое внимание уделяется использованию лектинов. Это позволяет эффективно проводить селективное гистохимическое маркирование отдельных типов и популяций клеток, тканевых структур, а также осуществлять управление биохимическими процессами в клетках, в частности вызывать апоптоз (Bilyy R., Stoika R., 2003; Porras F. et al., 2000; Антонюк Л.П., Игнатов В.В., 2001; Лахтин В.М., 1987; Луцик М.Д., Кусень С.И., 1987; Никитина В.Е. и соавт., 1998; Франц Х., 1980).
Анализ литературы показывает, что проблема управления процессами гибели адипоцитов еще очень далека от своего решения. Например, недостаточно полно изучены механизмы повреждения жировых клеток при воздействии физических факторов и биологически активных веществ. Всё это не позволяет пока однозначно осуществить выбор внешнего фактора, активного вещества и предсказать результаты этих воздействий на биоткань. Таким образом, возникает потребность проведения исследований, направленных на определение морфологических изменений в адипоцитах, механизма гибели жировой ткани под воздействием физических (нагрев, ИК излучение) и биохимических факторов.
В данной работе в качестве физических факторов выбрано тепловое воздействие (гипертермия), вызванная контактным нагревом или нагревом ИК лазерным излучением; в качестве биологически активных агентов выбраны нетоксичные фукозоспецифичные лектины Azospirillum brasilense Sp7 и Laburnum anagyroides.
Целью данной работы явилось комплексное изучение морфологических изменений адипоцитов жировой ткани человека и механизмов их гибели в условиях гипертермического воздействия, анализ участия лектинов в регуляции клеточной гибели адипоцитов человека, склонного к ожирению в норме и при патологии сахарного диабета, а также исследование динамики гибели адипоцитов в условиях ИК (805 нм) лазерного нагрева.
В рамках работы решались следующие задачи:
- изучение морфологических изменений при гипертермии в адипоцитах жировой ткани человека в норме и при патологии;
- разработка методики воздействия лектинов на жировые клетки;
- изучение влияния лектинов на процесс гибели адипоцитов при гипертермии;
- исследование влияния углеводной специфичности лектина азоспирилл на структурные изменения в адипоцитах при нагреве;
- анализ морфологических изменений адипоцитов при ИК лазерном воздействии;
- изучение процесса гибели жировых клеток в условиях действия лектина азоспирилл и ИК лазерного излучения.
Научная новизна работы
- Исследована динамика гибели адипоцитов жировой ткани человека при нагреве в диапазоне физиологической гипертермии и при ИК лазерном воздействии.
- Впервые изучено действие фукозоспецифичных лектинов Azospirillum brasilense Sp7 и Laburnum anagyroides на жировую ткань. Установлено, что лектины при нагреве оказывало разное влияние на адипоциты жировой ткани. Растительный лектин Laburnum anagyroides не оказывал влияния на гибель клеток, в то время как лектин бактерий рода Azospirillum brasilense Sp7 активировал скорость гибели клеток.
- Впервые на примере жировой ткани показано, что лектин азоспирилл в совокупности с нагревом ((43,5±0,5)0C) активирует клеточную гибель.
- Показано, что углеводсвязывающий центр лектина азоспирилл принимает участие в его воздействии на клетки жировой ткани человека. Однако влияние лектина характеризуется не только специфическим, но и не специфическим воздействием на адипоциты, поскольку и с заблокированным активным центром лектин продолжает оказывать влияние на адипоциты, хотя и менее выраженное.
- Впервые рассмотрена динамика гибели адипоцитов жировой ткани людей с нормальной массой тела, склонных к ожирению и больных сахарным диабетом.
Практическая значимость
Проведенные исследования процесса гибели адипоцитов при комбинированном внешнем воздействии позволяет подвести теоретическую базу для разработки эффективных методов коррекции жировой массы, борьбы с опухолевыми новообразованиями, для выяснения механизма клеточной гибели (апоптоз или некроз).
Исследования изменения структуры адипоцитов в условиях внешнего воздействия (контактный и лазерный нагрев), а также влияние биологического фактора (лектина) на гибель адипоцитов в норме и при патологии, существенно расширяют возможности диагностики и дифференциации патологий жировой ткани по характеру гибели адипоцитов и открывают новые возможности для изучения мембраны жировых клеток.
Достоверность результатов
Достоверность полученных результатов обеспечивается адекватностью используемых методов измерения, обработки и анализа экспериментальных данных. Результаты проведенных исследований подвергались статистической обработке общепринятыми методами с использованием t-критерия Стьюдента, достоверными считали различия при р0,05. Все оригинальные результаты воспроизводятся при повторении экспериментов.
Основные результаты и положения, выносимые на защиту
- При нагреве до температуры (43,5±0,5)0C возникают морфологические признаки апоптоза у адипоцитов здорового человека с нормальной массой тела и некроза у жировых клеток человека с нормальной массой тела и патологией сахарного диабета. Время гибели клеток здорового человека примерно в 2 раза меньше, чем время гибели адипоцитов людей с нормальной массой тела и патологией сахарного диабета.
- В условиях комбинированного воздействия лектина азоспирилл и нагрева до температуры (43,5±0,5)0C ускоряется процесс гибели клеток жировой ткани, как здоровых, так и больных сахарным диабетом людей СКО, при этом воздействие лектина азоспирилл характеризуется не только специфическим, но и не специфическим воздействием на адипоциты, поскольку и с заблокированным активным центром данный лектин продолжает оказывать влияние на адипоциты.
- Нагрев адипоцитов ИК лазерным излучением до температуры (40,5±0,5)0C приводит к увеличению скорости гибели клеток в 2 раза по сравнению с контактным нагревом.
Апробация работы
Результаты работы докладывались и обсуждались на следующих международных конференциях: II международная научная молодежная школа “Оптика – 2002” (С.-Петербург, октябрь 2002); “Saratov Fall Meeting: International School on Optics, Laser Physics & Biophysics” (Саратов, октябрь 2002, 2003, сентябрь 2004, 2005, 2006); II International Conference “Laser Optics for young Scientists 2003” (С.-Петербург, июнь 2003); III международная конференция молодых ученых и специалистов “Оптика – 2003” (С.-Петербург, октябрь 2003); IV международная конференция молодых ученых и специалистов “Оптика – 2005” (С.-Петербург, октябрь 2005); Международная научно-практическая конференция “Современная техника и технологии в медицине, биологии и экологии” (Новочеркасск, декабрь 2003); Пироговская студенческая научная конференция (Москва, март 2004, 2005, 2006, 2007); X Всероссийская научная конференция студентов-физиков и молодых учёных “ВНКСФ-10” (Москва, апрель 2004); международная научно-техническая конференция “Наука и образование – 2004” (Мурманск, апрель 2004); IV Международная научно-практическая конференция “Медицинская экология” (Пенза, июнь 2005); V Всероссийский научный семинар и Молодежная научная школа “Химия и медицина” (Уфа, сентябрь 2005 г); 10-я Пущинская школа-конференция молодых ученных “Биология – наука XXI века” (Пущино, апрель 2006 г.); Всероссийская конференция с международным участием “Фундаментальные и прикладные аспекты исследования симбиотических систем” (Саратов, сентябрь 2007 г.).
Исследования, проводимые по теме диссертации, выполнялись в рамках грантов: грант РФФИ “Ведущие научные школы” № 00-15-96667 2000-2002 гг. (руководитель – профессор В.В. Тучин); международный грант CRDF № REC-006 2000-2003 гг.; грант Мин. образования РФ “Ведущие научно-образовательные коллективы” № 01.2003.15221; грант президента РФ “Поддержка научных школ” № 25.2003.2.
Публикации
По теме диссертации опубликовано 22 работ (5 статей в рецензируемых журналах, 15 статей в научных сборниках, 2 статьи в сборнике тезисов докладов конференций).
Личный вклад соискателя
Личный вклад соискателя состоит в самостоятельной постановке и проведении экспериментов, обработке и интерпретации полученных результатов. Постановка исследовательских задач осуществлялась профессором, д. ф.-м. н. Тучиным В. В. Исследования с лектинами проводили совместно с к.б.н. Е. Г. Пономарёвой и д.б.н. В.Е. Никитиной (ИБФРМ РАН, Саратов). Исследование по воздействию температурного фактора проводили совместно с к. ф.-м. н. Г. В. Симоненко.
Структура и объём работы
Диссертация состоит из введения, четырех глав, заключения и списка цитируемой литературы из 357 наименований. Работа изложена на 168 страницах, иллюстрирована 93 рисунками, из них 50 фотографии.
КРАТКОЕ СОДЕРЖАНИЕ РАБОТЫ
Во Введении обоснована актуальность решаемых задач, сформулирована цель работы, её научная новизна, научно-практическая значимость, основные положения и результаты, выносимые на защиту.
Первая глава диссертации носит обзорный характер. В этой главе на основе данных, опубликованных в литературе, вводятся основные понятия и рассматриваются особенности основных форм повреждения жировой ткани.
В данной главе указаны основные характеристики жировой ткани. Описываются ее состав, физические и биохимические свойства, а также функциональные особенности. Представлены механизмы повреждения жировой ткани и их причины, рассматриваются характеристики основных форм повреждения клеток. Описываются особенности некроза и апоптоза клеток. Также перечислены способы воздействия на жировую ткань, описано применение нагрева и лазерного излучения для редукции жировой ткани.
Материалы и методы рассмотрены в начале каждой главы, посвященной экспериментальным исследованиям (главы 2, 3 и 4).
Материалы и методы исследования
В качестве объекта исследования в рамках данной работы был выбран подкожный жир человека, взятый из области брюшной полости и ягодиц пациентов. Использовали подкожный жир практически здоровых и больных сахарным диабетом людей (инсулинозависимых), с нормальной массой тела (ИМТ<25 кг/м2) и людей, склонных к ожирению (СКО, ИМТ 25-29,9 кг/м2). Возраст пациентов составлял 32 – 40 лет.
Эксперименты проводились на клетках подкожной жировой ткани поверхностного слоя, который состоит из плотных пакетов жира, заключенных в хорошо организованную фиброзную оболочку, на гистологических образцах, где клетки были изолированы от организма, но оставались живыми и реагировали на внешние воздействия.
Для изучения морфологии клеточной гибели в эксперименте использовали установку, состоящую из микроскопа (МФН-11 NXA1951), который снабжен цифровой фотокамерой (Nikon coolpix 995), подключенной к персональному компьютеру, и термостатируемого столика (термостолик). Для контактного нагрева жировой ткани использовали термостолик.
Эксперименты выполнялись на свежих жировых клетках подкожного жира человека, полученных в процессе хирургического вмешательства. После извлечения жировая ткань помещалась в физиологический раствор (0,9% водный раствор NaCl с pH 6,8) и промывалась фосфатно-солевым буфером (PBS). Затем её замораживали при температуре минус 10°С. Жировая ткань использовалась в течение первых шести суток после изъятия. В результате экспериментального исследования и в соответствии с литературными данными было подобрано время хранения ткани (Граменицкий Е.М., 1963). Все операции по подготовке образцов были выполнены при комнатной температуре.
После замораживания, делали тонкие срезы размером 11 см и толщиной 100-200 мкм, с помощью микротома, и постепенно нагревали до температуры (20-25)0С. Жизнеспособность изучаемых адипоцитов фиксировали с помощью окраски 0,2 %-ным раствором метиленового синего по методу В. Я. Александрова (Граменицкий Е.М., 1963, Александров В.Я., 1949, Фихман Б.А., 1967). В растворе краски аутопсированный материал выдерживался при комнатной температуре в течение 1-1 часов. Также проводилось исследование изменения характера прижизненной окраски адипоцитов после воздействия.
После того как была проверена жизнеспособность клеток в образце ткани, его помещали на термостолик, который фиксировался с помощью зажимов на предметном столике поляризационного микроскопа. Температура термостолика в ходе эксперимента поддерживалась постоянной в пределах физиологической гипертермии (43,5±0,5)0C.
В отдельной серии экспериментов были изучены структурные изменения адипоцитов в условиях воздействия фукозоспецифичных лектинов (лектин бобовника и лектин азоспирилл) и гипертермии, с последующей блокадой лектина азоспирилл специфичными гаптенами. Для анализа взаимодействия лектинов с адипоцитами использовали лектины в концентрации 10 мкг/мл, гаптены в концентрациях 0,3 М (L-фукоза, D-галактоза) и 1,5 мг/мл ( глюкозидаза).
Способность различных гаптенов ингибировать или активировать специфичность лектина проверяли смешиванием равных объёмов (1:1) раствора лектина и раствора соответствующего гаптена. Тонкие срезы жировой ткани, подвергшиеся воздействию биоактивных веществ, помещали во влажную среду чашки Петри на 30 минут при комнатной температуре. При прошествии данного времени образцы промывали раствором PBS. Полученные образцы жировой ткани с жизнеспособными адипоцитами помещали на термостолик. Контролем служили образцы, не подвергавшиеся нагреву, а также образцы, не обработанные биоактивными веществами, но находившиеся под действием гипертермии.
Были изучены характерные особенности гибели адипоцитов у людей СКО в норме при облучении диодным лазером (OPC-B015-MMM-FCTS) с =805 нм. В отдельной серии экспериментов образцы окрашивали 0,2 %-ным раствором индоцианина зеленого (ICG), с последующей инкубацией при комнатной температуре в течение 3 часов. В другой части экспериментов образцы жировой ткани не подвергались предварительной окраске ICG. Обработку образцов жировой ткани проводили при мощности излучения 2 и 3 Вт. Диаметр лазерного пятна 13 мм, расстояние между торцом волокна и поверхностью образца составляло 17 мм, плотность мощности облучения составляла 1,5 и 2,3 Вт/см2. Начальная температура образца была постоянной (33,5±0,5)С. Аналогичные серии экспериментов были проведены на адипоцитах после воздействия лектина азоспирилл.
Результат гибели клеток при микроскопическом исследовании определялся по отсутствию светящегося ободка клеточной стенки. Появление яркого изображения границы (мембраны) клетки в норме (без разрывов мембраны) связано с дифракцией и многократным внутренним отражением между границами трех прилегающих и отличающихся по показателю преломления сред (окружающая среда, мембрана клетки и цитоплазма (жировая капля)). Для клетки с целостной мембраной яркость изображения наибольшая. Для жировых клеток нарушение целостности мембраны изменяет характер светопреломления таким образом, что изображения клеток становятся все менее контрастными по мере фрагментации стенки. Окрашивание образцов по окончании эксперимента витальным красителем не выявляло клеточных структур, что подтверждает эти наблюдения.
Основными параметрами, по которым судили о состоянии жировых клеток, были выбраны линейные размеры клеток (большой и малый размер), а также площадь. Данный выбор сделан потому, что это самый наглядный и простой способ наблюдения изменений, которые происходят с клетками во время воздействия на них внешних факторов. Изображения, полученные с помощью цифровой фотокамеры, переносились на ПК. Во время нагрева образца, фотографии делались через каждые 2 мин. Наблюдения велись непрерывно за одними и теми же клетками. С помощью программ для обработки растровых изображений вычислялись значения размеров выбранной клетки в пикселях по всем элементам изображения образца. Необходимо отметить, что измерения размеров клетки проводились с погрешностью разрешения монитора (3,7 пикселей/мм). Калибровка результатов измерений геометрических характеристик образцов осуществлялась по стандартной методике с использованием объект – микрометра проходящего света (ОМ-П) (Zimnyakov D.A. et al., 2001).
Полученные результаты статистически обрабатывались. Статистическая обработка проводилась на группах близких по размерам и по времени гибели клеток. За величину среднего линейного размера одного адипоцита было взято среднее значение между его большим и малым размером. Группа близких по размеру жировых клеток формировалась как среднее значение между средними линейными размерами адипоцитов, входящих в данную группу. Площадь по группе определялась как среднее значение всех площадей адипоцитов, входящие в группу. Результатом всех измерений является построение зависимости средних линейных размеров или средней площади групп клеток от времени нагрева образцов жировой ткани. Достоверными считали различия при Р0,05.
Во второй главе представлено экспериментальное исследование воздействия гипертермии на жировую ткань человека с нормальной массой тела. Основное внимание уделено изучению характера гибели адипоцитов в образцах жировой ткани человека практически здорового и больного сахарным диабетом.
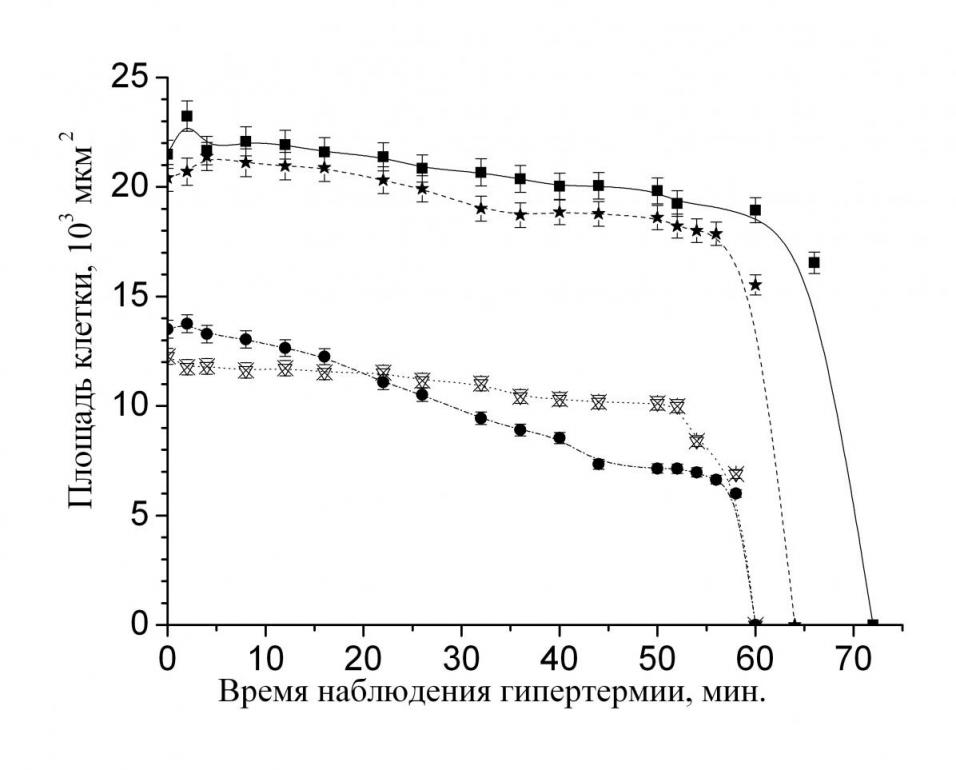
Проведенные исследования показали различие в механизме гибели жировых клеток здорового человека и человека больного сахарным диабетом при гипертермии (рис. 1). Время полного разрушения жировых клеток практически здоровых людей и больных сахарным диабетом различается в 2 раза. Предполагая из формы кривых, изображённых на рис. 1, экспоненциальный спад на выбранных участках, можно записать закон изменения площади клеток в виде:
![]() , (1)
, (1)
где S0 – площадь клеток в образце ткани непосредственно перед началом нагрева, k – эффективная константа скорости гибели адипоцитов, t – время. При t0 тангенс угла наклона увеличивается, следовательно, площадь клеток S(t) будет стремиться к величине S0. В случае, когда время растёт вплоть до t, тангенс угла наклона уменьшается, а площадь клеток при этом будет стремиться к нулю. Поток вещества будет уменьшаться при уменьшении объёма. Следовательно, k характеризует изменение площади в е раз. Наклон прямой полулогарифмической зависимости равен тангенсу угла наклона с одной стороны, а с другой – минус k.
 |  |
| а) здорового человека | б) человека больного сахарным диабетом |
| Рис. 1. Динамика изменения площади адипоцитов при гипертермии | |
В результате расчёта установили, что константа скорости гибели адипоцитов здорового человека (kзд = 0,0064 мин-1) больше в 2,8 раза константы скорости тепловой гибели адипоцитов больного сахарным диабетом (kбд = 0,0023 мин-1), следовательно, адипоциты гибнут быстрее.
Было установлено, что у адипоцитов жировой ткани человека с патологией наблюдались разрывы мембран клеток. Так как разрыв мембраны происходит только при некрозе, то для жировой ткани человека больного сахарным диабетом гибель адипоцитов идет по некрозному механизму гибели клетки.
В отличие от адипоцитов жировой ткани человека с патологией гибель жировых клеток здорового человека идёт по механизму подобному апоптозу. При гипертермии адипоцитов практически здорового человека наблюдались морфологические изменения клеток: образование “клеточных телец”, которые впоследствии увеличивались в размерах, и затем происходило слияние некоторых клеток друг с другом. В процессе образования этих телец, размер исходных клеток уменьшается. Все эти изменения характерны при самопрограммируемой клеточной гибели. Таким образом, механизм гибели адипоцитов зависит от типа ткани (здоровая ткань или с патологией).
В третьей главе описано экспериментальное исследование структурных изменений жировых клеток здоровых и больных сахарным диабетом людей, СКО, при гипертермии и совместном воздействии нагрева и лектинов различной природы. В результате исследований установили, что клетки жировой ткани человека СКО также подчиняются закону (1). Существенным различием было то, что адипоциты практически здорового человека СКО под действием температуры гибли в среднем за 130±10 мин, в то время как клетки жировой ткани человека СКО с патологией гибли за 220±20 мин (рис. 2).
Для описания динамики изменения площади адипоцитов применяем закон распределения (1) на участках t[0;100] мин (для здорового человека СКО рис. 2а) и t[0;180] мин (для человека СКО с патологией рис. 2б). В результате установили, что эффективные константы тепловой гибели адипоцитов тучного человека в норме и при патологии равны соответственно: 0,0029 и 0,0013 мин-1. Сравнивая результаты, полученные на адипоцитах человека с патологией сахарного диабета (рис. 1б) и практически здорового человека СКО (рис. 2а), видим, что время гибели составляет 130±10 минут для обоих случаев, при этом константы скорости близкие по значению (0,0023 мин-1 и 0,0029 мин-1).
 |  |
| а) практически здорового | б) больного сахарным диабетом |
| Рис. 2. Динамика изменения площади адипоцитов человека СКО при гипертермии | |
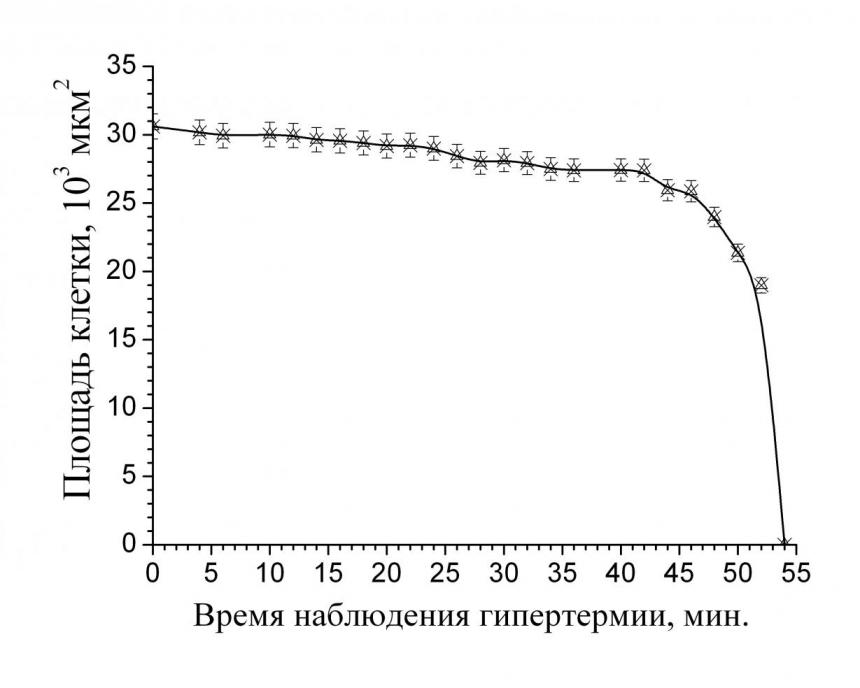
Обработка образцов жировой ткани лектином азоспирилл предполагала возможность его влияния на время разрушения адипоцитов. В ходе эксперимента было установлено, что совместное действие гипертермии и бактериального лектина азоспирилл на образцы ткани оказало активирующее влияние на гибель адипоцитов человека СКО как в норме, так и при патологии. В результате исследований было обнаружено, что предварительная обработка лектином перед нагревом дает существенный сдвиг (в сторону увеличения) скорости гибели адипоцитов. Здесь можно предположить, что лектин, действуя на адипоциты человека СКО, запускает механизм их гибели. Такое действие лектина азоспирилл характерно для ткани, как в норме, так и при патологии (рис 3).
Связывание лектинов с мембраной вызывает целый ряд изменений в молекулярной организации мембраны и ее функции (Луцик М.Д., 1981). Такова примерная закономерность связывания лектинов с мембранными рецепторами. Первоначально рецепторы равномерно распределены на поверхности клетки. Связывание лектина индуцирует перемещение рецепторных комплексов в плоскости мембраны с образованием кластеров, которые постепенно укрупняются до бляшек и собираются на одном полюсе клетки, образуя так называемые шапочки. Таким образом, меняется конформационное состояние мембраны, что, возможно, и обусловливает различие в воздействии на адипоциты нагрева и лектина, и только нагрева. Без температурного воздействия лектин не оказывал влияния на морфологию контрольного образца жировой ткани.
 |  |
| а) практически здорового | б) больного сахарным диабетом |
| Рис. 3. Изменение площади клеток тучного человека при действии гипертермии и лектина | |
Для описания динамики изменения площади адипоцитов тучного человека в условии гипертермии и воздействии лектина применяем закон изменения площади (1) на участках t[0;45] мин (для здорового человека СКО рис. 3а) и t[0;80] мин (для человека СКО с патологией рис. 3б). В результате установили, что эффективные константы тепловой гибели адипоцитов тучного человека в норме и при патологии в условии гипертермии и воздействии лектина равны соответственно: 0,006 и 0,0036 мин-1.
Проведенные исследования показали, что предварительная обработка жировой ткани бактериальным лектином усиливает воздействие нагрева на клетки жировой ткани как здорового человека СКО, так и тучного человека больного сахарным диабетом. Обнаружены различия во времени гибели адипоцитов при нагреве и в присутствии лектина в зависимости от физиологического состояния ткани. Таким образом, клетки жировой ткани, подвергнутые нагреву и предварительной обработке лектином азоспирилл, заметно уменьшаются в размере, а затем и погибают, в отличие от контрольных образцов ткани, обработанных только лектином и не подвергавших нагреву.
Однако в результате исследований влияния на физиологию адипоцитов другого фукозоспецифичного лектина – Laburnum anagyroides аналогичного действия не выявлено. Из полученных данных можно сделать вывод, что активность лектина зависит не только от его углеводной специфичности, но и от природы макромолекулы. Такой же результат получили на образцах, под действием гипертермии и белка бычий сывороточный альбумин (BSA).
Изучение биологической активности лектина азоспирилл дает возможность оценить их вклад во взаимодействии с животными клетками, поэтому были проведены исследования по изучению роли углеводсвязывающего центра бактериального лектина при воздействии гипертермии на структурные изменения адипоцитов жировой ткани СКО человека в норме и при патологии.
Была проведена серия экспериментов по воздействию гипертермии и лектина азоспирилл, с заблокированным специфичным гаптеном углеводсвязывающим центром, на адипоциты людей СКО.
  |  |  |  |
| а) до нагрева | б)58-я мин нагрева | в)72-я мин нагрева | г)76-я мин нагрева |
| Рис. 4. Гистологический срез жировой ткани человека СКО, предварительно обработанный лектином, блокированным L-фукозой, и подвергнутым нагреву | |||
Лектин бактерий Azospirillum brasilense Sp7, имеет специфичность к D-галактозе и ярко выраженную к L-фукозе. Согласно полученным результатам, у адипоцитов “практически” здорового человека СКО, при гипертермии и лектином с заблокированной активностью (в качестве блокирующего агента выступала L-фукоза), были обнаружены характерные признаки апоптоза: изменение формы клеток, образование щупалец и апоптозоподобных телец (рис. 4). Особое внимание, по-нашему мнению, необходимо уделить изменению формы адипоцитов в последний период нагрева. Рассмотрим, конкретный образец с 5 клетками. Подобная картина фиксировалась во всех проведенных экспериментах. Наиболее интересные изменения происходят с адипоцитами № 1 и № 2, начиная с 58 минуты нагрева (рис. 4б). Клетки как бы отпочковываются, образуя щупальца, которые в конечном итоге обособляются от самой клетки, образуя везикулы, окруженные мембраной. По окончанию образования везикул клетка стремится к восстановлению своей первоначальной формы. По прошествии 75 минут (рис. 4г) эксперимента клетки №1, №4, № 5 вновь увеличиваются в размере, по-видимому, в этот момент они выполняют роль фагоцитов: захватывают близлежащие везикулы малого размера, что и проиллюстрировано фотографиями (рис. 4б,в,г).
Процесс изменения формы адипоцитов имеет черты, схожие с процессом апоптоза, для которого характерны физиологические изменения: образование мембранных пузырей без нарушения целостности мембраны, сжатие клетки, образование апоптозных телец, фагоцитоз соседними клетками, отмирание одиночных клеток.
Сравнение результатов, полученных на образцах, обработанных лектином и лектином с блокированной активностью, показало, что время гибели клеток различно. При обработке лектином клетки здорового человека СКО при нагреве гибли в среднем за 55±5 мин, в то время как обработанные блокированным лектином за 80±5 мин. Жировые клетки здорового человека СКО, не обработанные лектином, под действием только нагрева гибнут за 130±10 мин.
Из полученных данных можно сделать вывод, что углеводсвязывающий центр бактериального лектина принимает участие в его воздействии на адипоциты. Блокирование активного центра лектина снижает его влияние на клетки. Однако воздействие лектина зависит, по-видимому, не только от активности его углеводсвязывающего центра, но и от других причин, не связанных с основным свойством лектина.
Аналогичные результаты получены на адипоцитах человека СКО больного сахарным диабетом. Если клетки здорового человека СКО претерпевают значительные изменения (форма клетки, образование везикул), то для адипоцитов ткани человека больного сахарным диабетом СКО эти изменения не обнаружены. В то же время наблюдается сжатие клеток, что характерно для начальной стадии апоптоза. В конце эксперимента клетка погибает, однако разрешающая способность микроскопа не позволила нам обнаружить разрывы мембраны и характерные признаки некроза. Результат гибели клеток, наблюдаемый при микроскопическом исследовании, определялся по отсутствию темного ободка клеточной стенки.
Под действием температуры и при обработки, как лектином, так и лектином с блокированной активностью адипоциты больного сахарным диабетом СКО гибли в среднем за 150±10 мин. Жировые клетки больного сахарным диабетом СКО, не обработанные лектином, под действием только нагрева гибнут за 220±20 мин. Результаты исследования позволяют сделать вывод, что углеводсвязывающий центр лектина не принимает участия во взаимодействии лектина с клетками при патологии сахарного диабета. Однако, независимо от этого, лектин увеличивает скорость гибели клеток патологической ткани. В данном случае причина влияния лектина на клетки остается неясной и требует дальнейшего изучения свойств лектина, не связанных напрямую с его углеводсвязывающим центром.
Помимо фукозы лектин бактерий рода Azospirillum brasilense Sp7 имеет специфичность к D-галактозе, однако блокирующая концентрация данного углевода на порядок выше. По-видимому, для данного лектина характерно присутствие “расширенного” связывающего центра, способного взаимодействовать не с одним, а с несколькими углеводными остатками. В данном случае можно говорить о существовании двух субцентров связывания углеводов.
В результате эксперимента было получено время гибели адипоцитов здорового человека СКО, что составило 60±5 мин, а человека больного сахарным диабетом СКО – 145±5 мин. В итоге установили, что воздействие гипертермии и лектина с заблокированным D-галактозой активным центром, не выявило влияния углеводсвязывающего центра лектина на гибель клеток.
Показано, что углеводсвязывающий центр лектина принимает участие в его воздействии на адипоциты жировой ткани человека СКО. Однако это воздействие не является полностью специфичным, поскольку и с заблокированным активным центром лектин продолжает оказывать влияние на адипоциты, хотя и менее выраженное. По-видимому, сродство рецептора к данному лектину на поверхности адипоцита определяется не только связывающейся с лектином углеводной детерминантой, но зависит также и от свойств рецептора как макромолекулы.
Блокирование лектиновой активности происходит по средствам рецепторов сахаров, поэтому необходимо было выявить степень влияния данных сахаров на адипоциты при гипертермии.
В случае, когда клетки обрабатывались блокированным раствором лектина, время гибели составляло 80±5 мин, при обработке чистым раствором L-фукозы – 55±5 мин. Данный результат говорит о том, что L-фукоза не ингибировала процесс гибели адипоцитов, а наоборот стимулировала его. Возможно, она участвует в ферментативных процессах, которые индуцируют гибель клеток. Аналогичный результат видим и в случае с жировой тканью человека СКО с патологией сахарного диабета. Клетки, обработанные неактивным лектином, гибли примерно за 150±10 мин, при обработке раствором фукозы за 105±5 мин.
Другая ситуация складывается когда адипоциты обработаны раствором D-галактозы и затем подвергнуты нагреву: клетки тучного человека гибнут за 120±5 мин, а адипоциты ткани СКО с патологией за 210±5 мин. Время гибели жировых клеток, обработанных D-галактозой, входит в интервал гибели адипоцитов при гипертермии. Следовательно, скорость гибели адипоцитов, обработанных D-галактозой, совпадает со скоростью гибели жировых клетках при гипертермии. Данное исследование показывает, что D-галактоза действует не так как L-фукоза, что вполне вероятно связано с изометрией данных сахаров, к тому же они принадлежат к разным генетическим рядам и классам.
Известно, что лектин азоспирилл проявляет активность и к ферменту -глюкозидаза. Было изучено действие на адипоциты раствора лектин-фермент и гипертермии. Эксперимент показал, что адипоциты жировой ткани тучного человека в среднем гибнут за 20±5 мин, а жировые клетки тучного человека больного сахарным диабетом за 50±5 мин.
Действие комплекса лектин-фермент на адипоциты может быть описано кинетической моделью:
 где в качестве субстрата (S) выступает триглицерид, а лектин является эффектором (Э). В нашем случае комплекс лектин-фермент активирует гибель жировых клеток ткани. Активность комплекса связана с особенностями как лектина, так и фермента -глюкозидаза.
где в качестве субстрата (S) выступает триглицерид, а лектин является эффектором (Э). В нашем случае комплекс лектин-фермент активирует гибель жировых клеток ткани. Активность комплекса связана с особенностями как лектина, так и фермента -глюкозидаза.
На основе проведенных экспериментов, строим гистограммы зависимости скорости гибели адипоцитов за определенный промежуток времени при гипертермии (рис. 5 и 6).
На первом месте располагаются жировые клетки в условиях гипертермии, обработанные раствором лектин-фермент, на втором – растворами L-фукозы, глюкозидазы, лектин-галактоза, лектина, лектин-фукоза, на третьем – раствором D-галактозы и на четвертом – действие гипертермии. Полученные данные хорошо демонстрируют термоиндукцию адипоцитов за счёт биологически активных веществ.
  |   |
| Рис. 5. Скорость гибели адипоцитов тучного человека (СКО) при нагреве | Рис. 6. Скорость гибели адипоцитов тучного человека с патологией при нагреве |
В четвертой главе описано экспериментальное исследование влияние лазерного излучения (805 нм) на адипоциты жировой ткани человека СКО. Было установлено, что за 1 час суммарных экспозиций клетки тучного человека погибали. Адипоциты отвечают на излучение лазера изменением распределения жира, жировая вакуоль медленно опустошается и этот эффект сохраняется длительное время, в зависимости от лазерной дозы. Во время облучения у клетки наблюдается разрыв мембраны и освобождение жира. При дальнейшем облучении клетки освобождаются от своих жировых вакуолей и гибнут. Время гибели адипоцитов при лазерном нагреве отличается от времени гибели при гипертермии.
 |
| Рис. 7. Динамика изменения площади жировых клеток человека, СКО, в период облучения |
На рис. 7 представлена графическая зависимость средней площади адипоцитов, предварительно обработанных 0,2 %-ным раствором ICG, от общего времени экспозиции. Видно, что площадь одной группы клеток падает по экспоненциальному закону. Однако площадь другой группы клеток наоборот растёт. Разрушение происходит только после этого увеличения. Увеличение площади может быть связано с попытками данной клетки захватить свободный жир и тем самым установить равновесие в окружающей её области. Следовательно, процесс гибели адипоцитов индивидуален и протекает в соответствии с физиологическими потребностями самих клеток.
Сравнивая эти результаты, с результатами, полученными на адипоцитах здорового человека СКО при нагреве, видим, что время гибели сильно отличается. Если в случае воздействия температуры адипоциты гибли в среднем за 130±10 мин, то при фототермическом эффекте за 60±5 мин. Таким образом, время гибели уменьшалось в 2 раза при лазерном нагреве.
Рассмотрим изменения в жировых клетках, на которые воздействовали излучением (805 нм) без предварительной окраски ICG. В результате эксперимента получили, что площадь групп клеток падает по экспоненциальному закону (2). Было установлено, что общее время облучение, в течение которого клетки погибали, составило 60±5 минут. Точно такой же результат получили при фототермическом эффекте. Следовательно, окрашивание образца ткани ICG не даёт значительного увеличения поглощаемой энергии, и в том и в другом случае имеем чисто тепловое воздействие.
Инфракрасное излучение умеренной интенсивности оказывает неспецифическое тепловое воздействие на жировую ткань. Рост интенсивности включает адаптационные и регуляционные механизмы клеток, позволяющие восстановить жизнедеятельность клетки, но при дальнейшем увеличении интенсивности клетки не справляются с восстановлением, и происходят необратимые процессы. Такие изменения нарастают и приводят к разрушению объекта исследования. Увеличим интенсивность до 2,3 Вт/см2 и исследуем адипоциты СКО. Особое внимание следует уделить изменению формы адипоцитов. Во время облучения у жировых клеток наблюдаются некоторые признаки апоптоза, клетки при длительном облучении сливаются – это хорошо демонстрируют фотографии одного из гистологических срезов (рис. 8), аналогичная картина наблюдается и в других экспериментах.
 |  |  |  |
| до облучения | 14 мин облучения | 30 мин облучения | 55 мин облучения |
| Рис. 8. Гистологический срез жировой ткани человека СКО при плотности излучения 2,3 Вт/см2 | |||
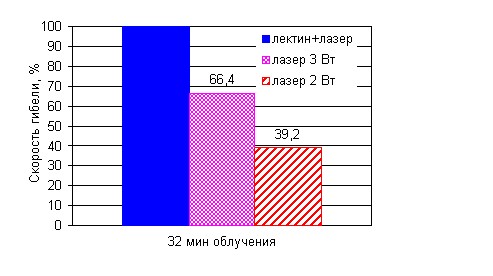
Увеличение интенсивности облучения до 2,3 Вт/см2 повлекло за собой увеличение скорости гибели клеток. Адипоциты гибли в среднем за 40±5 мин, что составляет 66,4 % от скорости гибели при мощности излучения в 2 Вт. Дальнейшее повышение температуры при росте мощности излучения до 5 Вт приводит сначала к испарению жидких сред в образце, а затем к обугливанию органических компонентов жировой ткани. Взаимодействие импульсного излучения большой энергии с тканью вызывает локальное повышение температуры, вследствие чего происходит разрушение ткани.
Время гибели жировых клеток, предварительно обработанных лектином, и подвергнутых воздействию лазерного излучения, с интенсивностью 1,5 Вт/см2, составляет 24±8 мин. За этот же интервал времени погибают 39% адипоцитов, подвергнутых действию только ИК лазерного излучения.
 |
| Рис. 9. Скорость гибели адипоцитов тучного человека СКО при облучении |
Используя полученные результаты, можем проанализировать скорость гибели клеток только при нагреве лазерном излучением и при совместном действии лектина и излучения (рис. 9). Время гибели адипоцитов, обработанных лектином, составляет 39% и 58% от времени гибели клеток, облучаемых только лазером при мощности 2 и 3 Вт, соответственно. Взаимодействие света с молекулами образца приводит к их возбуждению и последующему переходу в основное состояние за счёт безизлучательных переходов с выделением тепла.
В заключении сформулированы основные результаты и выводы диссертационной работы.
Основные результаты и выводы работы
- Исследована динамика гибели адипоцитов жировой ткани человека практически здорового и больного сахарным диабетом с нормальной массой тела и склонного к ожирению при гипертермии и совместного действия нагрева и биологически активных веществ, а также нагрева ИК излучения.
- Выявлен характер и особенности клеточной гибели адипоцитов. Обнаружено что при физиологической гипертермии (43,5±0,5)0C возникают морфологические признаки апоптоза у адипоцитов здорового человека с нормальной массой тела и некроза у жировых клеток человека с нормальной массой тела и патологией сахарного диабета.
- Установлено различие во времени гибели адипоцитов: клетки здорового человека гибли в 2 раза быстрее (время гибели составляло 60-70 мин), чем клетки человека с патологией сахарного диабета (время гибели - 120-140 мин).
- Впервые исследовано действие фукозоспецифичных лектинов (Azospirillum brasilense Sp7 и Laburnum anagyroides) на адипоциты тучных людей. Растительный лектин Laburnum anagyroides не воздействует на адипоциты. В то время как лектин бактерий рода Azospirillum brasilense Sp7 являлся активатором скорости гибели клеток.
- Впервые установлено, что воздействие бактериального лектина на адипоциты зависит, от его углеводной специфичности. Показано, что углеводсвязывающий центр лектина азоспирилл принимает участие в его воздействии на клетки жировой ткани человека. Однако это воздействие не является основным, поскольку и с заблокированным активным центром лектин продолжает оказывать влияние на адипоциты, хотя и менее выраженное. По-видимому, сродство рецептора к данному лектину на поверхности адипоцита определяется не только связывающейся с лектином углеводной детерминантой, но также зависит и от свойств рецептора макромолекулы.
- Впервые обнаружены особенности воздействия гаптенов, специфичных к лектину Azospirillum (сахара – L-фукоза и D-галактоза, фермент – -глюкозидаза) при нагреве на адипоциты. Обнаружено, что клетки гибнут быстрее, если их обработать раствором лектина Azospirillum, блокированным глюкозидазой, и затем подвергнуть нагреву.
- Выявлены особенности взаимодействия адипоцитов с лазерным излучением и совместного действия лектина Azospirillum и излучения. Установлено, что лазерное излучение активирует гибель адипоцитов, а предварительная обработка клеток лектином увеличивает скорость их гибели в 2 раза.
- Нагрев адипоцитов ИК лазерным излучением до температуры (40,5±0,5)0C приводит к увеличению скорости гибели клеток в 2 раза по сравнению с контактным нагревом.
Список работ, опубликованных по теме диссертации
- Черкасова О.А., Симоненко Г.В., Тучин В.В. Исследование жировой ткани при температурном воздействии // Проблемы оптической физики. – Саратов: Изд-во СГУ, 2003. – С. 32-38.
- Черкасова О.А., Симоненко Г.В., Тучин В.В. Моделирование апоптоза жировой ткани // Вторая научная молодежная школа “Оптика-2002”: Тр. Конференции. – С.-Пб.: СПбГУ ИТМО, 2002. – С. 27.
- Simonenko G.V., Cherkasova O.A., Denisova T.O., Tuchin V.V. Thermal action on the lipocells // SPIE, 2003. – Vol. 5068. – P. 458-461.
- Черкасова О.А. Исследование in vitro жировой ткани при внешних воздействиях // Вестник РГМУ, 2004. – № 3 (34). – С. 192.
- Черкасова О.А., Симоненко Г.В., Тучин В.В. Температурное воздействие на жировые клетки // III международная конференция молодых ученных и специалистов “Оптика-2003”: Тр. Конференции. – С.-Пб.: СПбГУ ИТМО, 2003. – С. 294-295.
- Черкасова О.А. Лектин как активатор гибели клеток жировой ткани // Современная техника и технологии в медицине, биологии и экологии / Материалы IV междунар. научн.-практ. конф., Новочеркасск, 19 дек. 2003 г. – Новочеркасск: ЮРГТУ, 2003. – С. 4-6.
- Черкасова О.А. Активаторы гибели жировых клеток человека // 10 Всероссийская научная конференция студентов-физиков и молодых ученных: в 2 т. – Екатеринбург-Красноярск: Изд. АСФ России. – 2004. Т. 2. – С. 870-872.
- Черкасова О.А. Исследование жировой ткани человека при воздействии на нее физического и биологического факторов. // Проблемы оптической физики. В 2 кн. – Саратов: Изд-во ГосУНЦ “Колледж”. – 2004. Кн. 1. – С. 149-153.
- Черкасова О.А. Действие лектина на жировые ткани человека с патологией. // Проблемы оптической физики. В 2 кн. – Саратов: Изд-во ГосУНЦ “Колледж”. – 2004. Кн. 1. – С. 153-157.
- Черкасова О.А., Пономарёва Е.Г., Никитина В.Е. Исследование влияния белков на адипоциты человека склонного к ожирению. // Наука и образование – 2004 / Материалы Международной научно-технической конференции: в 6 ч. – Мурманск: МГТУ. – 2004. – Ч. 6. – С. 131-135.
- Черкасова О.А., Пономарёва Е.Г. Влияние лазерного излучения высокой интенсивности на жировые клетки человека в присутствии лектина бактерий рода Azospirillum brasilense Sp7 // Вестник РГМУ, 2005. – № 3 (42). – С. 194.
- Cherkasova O.A., Simonenko G.V. Influence of laser radiation on fatty cells // II International conference on Laser Optics for Young Scientists (LOYS-2003). – St.-P., 2003. – P. 141.
- Cherkasova O.A. Influence of laser radiation on fatty cells // III международная конференция молодых ученых и специалистов “Оптика-2003”: Тр. Конференции. – С.-Пб.: СПбГУ ИТМО, 2003. – С. 296.
- Черкасова О.А. Взаимодействие ИК-излучения с адипоцитами // Медицинская экология: Сборник статей IV Международной научно-практической конференции. – Пенза, 2005. – С. 144-146.
- Синицына Р.В., Черкасова О.А. Расчет скоростей возмущенных двухстадийных процессов с использованием графов // Радиотехника, 2005. – № 4. – С. 91-95.
- Черкасова О.А., Пономарёва Е.Г., Никитина В.Е., Тучин В.В. Роль углеводсвязывающего центра бактериального лектина в его воздействии на морфологию адипоцитов при нагреве // 10-я Пущинская школа-конференция молодых ученных “Биология – наука XXI века”: Сборник тезисов, Пущино, 17-21 апр. 2006 г. – Пущино, 2006. – С.122.
- Черкасова О.А., Пономарёва Е.Г. Особенности морфологических изменений в адипоцитах при совместном действии нагрева и неактивного лектина азоспирилл // Вестник РГМУ, 2006. – № 2 (49). – С. 437.
- Черкасова О.А. Влияние лектина блокированного фукозой на адипоциты человека склонного к ожирению // IV международная конференция молодых ученых и специалистов “Оптика-2005”: Тр. Конференции. – С.-Пб.: СПбГУ ИТМО, 2005. – С. 315-316.
- Черкасова О.А. Влияние температуры на морфологию адипоцитов // IV международная конференция молодых ученых и специалистов “Оптика-2005”: Тр. Конференции. – С.-Пб.: СПбГУ ИТМО, 2005. – С. 317-318.
- Черкасова О.А., Пономарёва Е.Г. Влияние фукозоспецифичного лектина на процесс гибели адипоцитов // Новые лекарственные средства: успехи и перспективы / Под. ред. И.Б. Абдрахманова, Ф.С. Зарудия, М.С. Юнусова. – Уфа: Гилем, 2005. – С. 195-198.
- Черкасова О.А., Тучин В.В., Пономарёва Е.Г., Никитина В.Е. Влияние бактериального лектина и роль его углеводсвязывающего центра при воздействии на адипоциты при повышенной температуре // Биофизика, 2007. – Т. 52. – Вып. 4. – С. 687-692.
- Пономарёва Е.Г., Черкасова О.А., Никитина В.Е. Воздействие бактериального лектина и повышенной температуры на адипоциты // Фундаментальные и прикладные аспекты исследования симбиотических систем: Материалы всероссийской конференции с международным участием. Саратов, 25-27 сентября 2007г. – Саратов: Изд-во Научная книга, 2007. – С. 98.

