Дезире дезоксирибонуклеазы лимфоцитов периферической крови человека в норме и при атопической бронхиальной астме
На правах рукописи
Нсангу Молу Мама Дезире
Дезоксирибонуклеазы лимфоцитов периферической крови человека
в норме и при атопической бронхиальной астме
03.00.04 биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Казань 2007
Работа выполнена на кафедре биохимии и в лаборатории биохимии нуклеиновых кислот гоувпо «Казанский государственный университет им. В.И. Ульянова-Ленина»
Научный руководитель: доктор биологических наук,
Абрамова Зинаида Ивановна
Официальные оппоненты: доктор биологических наук, профессор
Шарипова Маргарита Рашидовна
(кафедра микробиологии Казанского
государственного университета, г. Казань)
кандидат биологических наук,
врач КДЛ высшей категории
Сатарова Лилия Ирековна,
(лаборатория иммунологии межрегионального клинико-диагностического центра, г. Казань
Ведущая организация: гоувпо “Казанский медицинский университет” Федерального агентства по здравоохранению и социальному развитию.
Защита состоится “22” марта 2007г. в 13ч на заседании диссертационного Совета Д 212.081.08 при Казанском государственном университете по адресу: г.Казань, ул. Кремлевская 18, главное здание КГУ, аудитория 209.
С диссертацией можно ознакомиться в Научной библиотеке
им. Н.И. Лобачевского Казанского государственного университета.
Автореферат разослан “ ” февраля 2007 г.
Ученый секретарь
диссертационного Совета, д.б.н. З.И. Абрамова
Введение
Бронхиальную астму, относят к заболеваниям, опосредованным торможением программируемой клеточной гибели (ПКГ). Считается, что ПКГ при воспалениях проявляется на завершающих этапах, где ей принадлежит важная роль, поскольку в этот период происходит устранение активированных клеток иммунной системы, выполнивших свои функции. То же относится к аллергическому воспалению, при котором упомянутая элиминация эффекторных клеток к тому же затруднена в связи с их способностью к самоподдержанию. Исследования процессов ПКГ лимфоцитов при развитии заболевания свидетельствуют об устойчивости данных клеток к апоптозу, что проявляется в замедлении фрагментации ДНК этих клеток при инкубации в среде in vitro и in vivo (Melis et al., 2000, 1998; Green, Scott, 1998), что приводит к нарушению элиминации лимфоцитов из легких, а также возникновению гиперреактивности бронхов. Фрагментация хромосом - один из важных признаков ПКГ. В настоящее время биохимические и генетические исследования показали, что фрагментация хромосом является комплексным биохимическим процессом, в котором участвует группа нуклеаз с различными активностями и субстратной специфичностью. Уникальность дезоксирибонуклеаз заключается в том, что они эффективно катализируют гидролиз фосфодиэфирной связи - самой стабильной из всех химических связей, найденных в биологических молекулах (Westheimer, 1987). ДНКазы имеют важное значение в процессах нуклеинового обмена и для поддержания физиологической концентрации ДНК в организме человека (Mashra,2002). «апоптотические» нуклеазы действуют кооперативно между собой и с другими не нуклеазными кофакторами для реализации поступенчатой фрагментации хромосом и деградации ДНК. Важен тот факт, что помимо непосредственного участия в разборке погибающей клетки, апоптотическая деградация ДНК может облегчить смерть клетки и другие события, например, элиминация апоптотических клеток. Более того, некоторые апоптотические нуклеазы, видимо, могут касаться и иных аспектов развития у животных и человека, включая иммунные ответы и их нарушение. Идентификация новых апоптотических нуклеаз и анализ их функций в апоптозе и в процессе развития должна проложить путь для дальнейших исследований по раскрытию новых функций этих нуклеаз, чтобы определять скрытые связи между апоптотической деградацией ДНК и заболеваниями человека (Parrish, Deng, 2006).
Таким образом, объяснимо наше внимание к изучению свойств нуклеаз лимфоцитов, выделенных из периферической крови пациентов с атопической бронхиальной астмой (АБА), и возможной роли этих нуклеаз в индукции аутоиммунных элементов при развитии заболевания.
Цель и задачи исследования. Целью работы была сравнительная характеристика ядерных и гранулярных нуклеаз лимфоцитов от пациентов с атопической бронхиальной астмой в зависимости от степени тяжести заболевания.
Для достижения поставленной цели необходимо было решить следующие задачи:
1. Выделить фракцию Т лимфоцитов из периферической крови больных с АБА и относительно здоровых доноров. Получить из них секреторные гранулы.
2. Изучить динамику структуры лейкоцитарной формулы у пациентов с АБА с различной степенью тяжести и провести сравнительный ультраструктурный анализ лимфоцитов.
3. Определить наличие нуклеазной активности в экстракте лимфоцитов методом зимографии (электрофорез в ПААГ-ДСН-ДНК) и выделить фракции цитоплазматических белков, хроматина ядер и секреторных гранул исследуемых лимфоцитов.
4. Изучить субстратную специфичность, влияние ионов двухвалентных металлов и рН на энзиматическую активность ядерных и гранулярных белков.
5. Изучить динамику ДНКазной активности белков при различной степени тяжести АБА.
Научная новизна
В работе исследована нуклеазная активность клеток специфического иммунного ответа, которые привлекаются в очаг воспаления при ХОБЛ- лимфоцитов. Впервые установлены морфологические отличия в структуре лимфоцитов периферической крови здоровых доноров и пациентов с АБА. У пациентов с интермиттирующей и легкой персистирующей астмой морфологические признаки раннего апоптоза: маргинация хроматина, выпячивания ядерной оболочки, вдавливания и выпячивания клеточной поверхности,- коррелируют с биохимическими - образованием крупных фрагментов ДНК. Установлена обратная корреляция между тяжестью заболевания и количеством Т-лимфоцитов
В секреторных гранулах CD4+Т-лимфоцитов периферической крови пациентов с АБА впервые установлено наличие ДНКазной активности, которая соответствует Ca2+-зависимому белку с молекулярной массой 66 кДа, активность которого напрямую коррелирует с тяжестью АБА.
В лимфоцитах пациентов с АБА впервые выявлены две активности: Ca2+,Mg2+- и Mg2+(Mn2+)- зависимая ДНКазная активности. Причем в клетках пациентов с АБА выше Mn2+ активность, а в клетках здоровых доноров Ca2+,Mg2+-ДНКазная активность. Особенно выражены эти отличия во фракциях белков, связанных с хроматином. показано, что в лимфоцитах пациентов с АБА с развитием болезни уровень ядерной кальций-магниевой активности падает, она становится более устойчивой к действию ингибитора – ионам цинка, а уровень Mg2+(Mn2+)-зависимой активности возрастает.
Практическая значимость. Установленные особенности морфологии и количественных показателей лимфоцитов при развитии заболевания; обнаруженная грануло-ассоциированная ДНКазная активность позволяет выдвигать предположение об аутоиммунных элементах развития заболевания, т.к. аналогичная нуклеазная активность локализована в секреторных гранулах Т4 и Т8 – лимфоцитах у пациентов с аутоиммунными заболеваниями (Pio,R et al.,1998). Модифицированы методы определения нуклеазной активности белков цитоплазмы и хроматина лимфоцитов здоровых доноров и при ХОБЛ, что позволяет использовать их как новые дополнительные молекулярно-биохимических маркеры при диагностике нарушений при атопических, аллергических и аутоиммунных патологиях и при постановке диагноза.
Связь работы с научными программами и собственный вклад автора в исследование. Работа в течение 2001-2005 гг. выполнялась в соответствии с планом НИР Казанского государственного университета ( № Г/Р 01.200300073). Научные положения диссертации и выводы базируются на собственных результатах исследований автора.
Положения, выносимые на защиту:
1. Морфологические изменения в структуре лимфоцитов периферической крови пациентов с АБА являются отражением биохимических изменений апоптотического процесса в лимфоцитах при развитии астмы.
2. Роль ДНКазной активности в апоптозе определяется тем, что фрагментация ДНК в лимфоцитах связана с увеличением уровня содержания ионов кальция, хелатированием внутриклеточного цинка или с закислением среды.
3. Нарушение ДНКазной активности «апоптотических» нуклеаз лимфоцитов – причина торможения апоптоза лимфоцитов при астме.
4. Обнаружение Zn-независимой ДНКазной активности в гранулах Т-лимфоцитов - элемент аутоиммунного процесса при развитии астмы.
Апробация работы. Основные результаты исследований докладывались на 10 школе – конференции «Биология-наука XXI века» (Пущино, 2006); научно-практической конференции молодых ученых Казанской государственной медицинской академии (Казань, 2006); конференции молодых ученых, аспирантов и студентов научно-образовательного центра Казанского государственного университета «Материалы и технологии XXI века» в 2006, а также на ежегодных итоговых научных конференциях КазГУ в 2005-2006 гг.
Публикации. По материалам диссертации опубликовано 6 работ.
Структура и объем диссертации. Диссертационная работа состоит из введения, обзора литературы, описания материалов и методов исследования, изложения собственных результатов, их обсуждения и выводов. Работа изложена на 175 стр. компьютерной верстки, содержит 9 таблиц, 31 рисунок. Список цитируемой литературы включает 250 наименований.
Материалы и методы исследования
Объектом исследования служили лимфоциты, выделенные из периферической крови здоровых доноров (15) и больных атопической бронхиальной астмой (66) (мужчины/женщины: 41/25; возраст ± SD:31±15). Диагноз атопической формы БА ставился на основании данных аллергического анамнеза, результатов кожных проб с бытовыми, эпидермальнымии, пыльцевыми аллергенами, провокационных назальных и ингаляционных тестов. Стандартное исследование периферической крови (общий анализ с лейкоцитарной формулой) проводили в лаборатории пульмонологического отделения РКБ МЗ РТ г. Казани.
Лимфоциты из периферической крови выделяли методом равновесного центрифугирования (Patel D et al., 1995) в растворе фиколл-верографина (=1.077 г/см). Суспензию лимфоцитов собирали и промывали в растворе Хенкса. Рабочая концентрация лимфоцитов содержала 2106 клеток в 1 мл.
Ультраструктурное исследование проводилось на осажденных центрифугированием лимфоцитах, которые последовательно фиксировали в 2,5%-ом глутаровом альдегиде на 0.1М Na-фосфатном буфере (рН 7,2) и 1%-ом растворе OsO4 в течение 1 ч. Полученные образцы заключали в Эпон-812. Срезы получали на ультрамикротоме LKB-III (Швеция) и просматривали на электронном микроскопе Hitachi HU-125E.
Получение белковых фракций хроматина. Для получения белковых фракций хроматина и цитоплазмы лимфоцитов использовали метод фракционирования белков хроматина, основанный на последовательной диссоциации цитоплазматических и ядерных белков в растворах NaCl возрастающей ионной силы (Георгиев и др., 1969). В результате при ступенчатом увеличении ионной силы раствора диссоциируются только определенные фракции белков. Для диссоциации использовали 0,01, 0,15, 0,4 М раствора NaCl в 0,01 М трис буфере, рН 7,2 (Беляева и др., 1970).
Экстракция цитоплазматических гранул лимфоцитов. Секреторные гранулы из лимфоцитов выделяли методом описанным в работе (Podack et al.,1984) на градиенте плотности перколла. После разрушения лимфоцитов и центрифугирования получали “постядерный” супернатант, который наслаивали на градиенте плотности перколла (=1,080г/см) и центрифугировали при 19500 об/мин в течение 35 мин (Beckman SW41Ti. Перколл удаляли из фракций центрифугированием при 45000 об/мин в течение 2,5 ч, при этом изперколла формировался плотный осадок, над которым располагался беловатый слой надосадка содержащего секреторные гранулы.
Получение плазмидной ДНК pBR 322. Для амплификации ДНК pBR 322 использовали бактериальную культуру / Eschericha сoli Hb 101-pBR 322. Сбор бактерий, их лизис, выделение и очистку проводили по методу (Маниатис, 1984). ДНК pBR322 очищали от РНК гель-хроматографией на колонке Sepharose CL-4B.
Специфичность отношения нуклеаз лимфоцитов ко вторичной структуре ДНК изучали электрофорезом в 0,7 % агарозном геле используя суперспиральную ДНК pBR 322 и регистрируя переход формы I через форму II (открытое ковалентно-замкнутое кольцо) до формы III (линейная ДНК). Концентрация белка-фермента в исследуемых фракциях уравнивалась и составляла 0,3-0,5мг/мл. Реакцию останавливали добавлением 2 мкл смеси, содержащей: 10% ДДС-Na / 0,1% БФС / 50% глицерина. Электрофорез проводили в горизонтальном направлении на пластинках размеры 10103 мм при силе тока 4 мА/см в течение 1,0-1,5 ч при 200С. Гель регистрировали на видеосистеме для регистрации гелей “DNA Analyzer” (НПФ “Литех”, Россия).
Ферментативную активность исследуемых белковых фракций определяли по приросту продуктов гидролиза ДНК (Белова и др., 1970). Активность выражали в спектрофотометрических единицах увеличения кислоторастворимых продуктов при гидролизе нДНК или дДНК при длине волны 260 нм за 60 мин инкубации при 370 С на 1мг белка (удельная активность) или на 1 мл ферментного раствора (общая активность).
ДНКазную активность в белковом экстракте гранул лимфоцитов определяли по способности гидролизовать геномную ДНК- морского ежа. Реакционная проба объемом 50 мкл содержала: 25 мкл нДНК (50 мкг/мл) / 15 мкл 20 мМ Трис-HCl (рН 7,5) / 5 мкл различных активаторов (Ca2+, Mg2+, Mn2+или Zn2+), 5 мкл экстракта гранул (0,35мг/мл). Для количественного определения ДНКазной активности и сравнительного анализа результатов, гели были сканированы и обработаны с помощью программы «Scion image» (Pio et al., 1998). Активность выражали как индекс фрагментации (F.I, %).
Электрофорез белков в полиакриламидном геле (ПААГ) Электрофорез белков в 10% ПААГ с ДДС-Na вели по методике Лаеммли (Laemmli, 1970). Молекулярную массу определяли в присутствии 0,1%-ного ДДС-Na. Электрофорез проводили при комнатной температуре при силе тока 10мА до внедрения проб в концентрирующий гель, концентрирование белков проводили при 20мА. Основной режим – 40мА, продолжительность электрофореза 2 часа.
Обнаружение ДНКаз в ПААГ-SDS-ДНК. Для приготовления геля ПААГ-ДНК 20мл 10% ПААГ смешивали с 1мл раствора ДНК до конечной концентрации ДНК в геле 20 мкг/мл. Гель после электрофореза промывали в дН2О и в буфере (1мМ Na2ЭДТА / 40мМ трис-HCl pH 7.6 /2мМ MgCl2). Для активации нуклеаз, находящихся в геле, последний помещали в инкубирующий буфер (10 мМ трис-HCl рН 7,6/ 1мМ CaCl2/ 50мМ NaCl2/ 10 мМ MgCl2), выдерживали 18-24 ч при 37°С, затем добавляли этидиум бромид. Результаты реакции регистрировали при помощи видеосистеме для регистрации гелей “DNA Analyzer” (НПФ “Литех”, Россия).
Математический анализ полученных результатов проводился на персональном компьютере с использованием пакета программ “Excel (Microsoft office 2003)”. Сравнение вариационных рядов осуществлялось с помощью непараметрического критерия Крускала-Уоллиса и T-критерия Манна – Уитни. Достоверность различия частоты встречаемости признака определяли, используя точный метод Фишера. Корреляционный анализ проводился методом ранговой корреляции Спирмена- rs.
Результаты исследования
1. Особенности морфологических и количественных показателей
лимфоцитов периферической крови при развитии атопической астмы
Патогенез АБА определяется, как специфический воспалительный процесс в бронхиальной стенке, в котором эозинофилы, макрофаги и Т-лимфоциты играют центральную роль. если Т-лимфоциты при развитии аллергических реакций, после выполнения своей функции не элиминируются путем апоптоза, это приводит к возникновению аутоиммунного заболевания, обусловленного присутствием в данной системе зрелых аутореактивных лимфоцитов. Следует отметь, что при АБА большинство Т-лимфоцитов, инфильтрованных в дыхательные пути, также не апоптозируются, при этом предполагается, что стойкость воспаления дыхательных путей зависит от повышенной выживаемости лимфоцитов в слизистой бронхов (Vignola.et.al.,1999).
В связи с этим важна количественная и морфологическая характеристика лимфоцитов периферической крови у больных с АБА различной степени тяжести.
Так как число лейкоцитов в крови отражает состояние защитных сил организма, мы изучили показатели общего анализа крови у здоровых доноров и пациентов с АБА и проследили изменение содержания форменных элементов крови. их уровень наглядно позволяет представить, не только каких лейкоцитов много, а каких мало, но и помогает в определении степени тяжести заболевания. Например, в норме содержание лимфоцитов в крови взрослого человека составляет 25–35% всех лейкоцитов, а одной из причин повышения числа лимфоцитов – абсолютного лимфоцитоза - является развитие бронхиальной астмы (Соколова,1998).
Таблица 1. Количественный анализ содержания лейкоцитов в периферической крови больных АБА.
| Лейкоциты : АБА 6,18109/л | N 6,3109/л | ||
| Содержание форменных элементов, в % от количества лейкоцитов: | |||
| при АБА | в норме (N) | ||
| лимфоциты | 27.3 | 30 | |
| нейтрофилы | 63.5 | 59 | |
| моноциты | 5.7 | 6,6 | |
| эозинофилы | 4.6 | 2,5 | |
В настоящей работе показано, что при АБА общее количество лейкоцитов в крови в среднем составило 6,18109, причем пониженное содержание лейкоцитов в группе больных было связано с уменьшением количества лимфоцитов и моноцитов. Содержание нейтрофилов и эозинофилов было выше у пациентов с АБА по сравнению со здоровыми донорами (табл.1).
По некоторым данным для диагностики АБА определение лейкоцитарной формулы не обязательно, так как оно показано только при подозрении на вторичную инфекцию. Тем не менее, при изучении структуры лейкоцитарной формулы, в данной работе были установлены особенности в изменении количества форменных элементов крови в зависимости от тяжести астмы (табл.2).
Таблица 2. Изменения структуры лейкоцитарной формулы периферической крови пациентов с АБА в зависимости от тяжести
| Степень тяжести | Интермит-тирующая,% | Персистирующая, %: | N, % | р | |||
| легкая | средняя | тяжелая | |||||
| Клетки : | |||||||
| лимфоциты | 28,8 | 37,8 | 25,4 | 17,3 | 30 | 0,05 | |
| нейтрофилы | 61,9 | 52,4 | 65 | 74,6 | 59 | 0,04 | |
| моноциты | 5,9 | 4,5 | 6,5 | 5,8 | 6,6 | 0,3 | |
| эозинофилы | 3,7 | 5,4 | 4,8 | 4,3 | 2,5 | 0,26 | |
Математический анализ этих результатов показал, что по трем из четырех параметров лейкоцитарной формулы динамика изменения форменных элементов крови в зависимости от тяжести АБА достоверна (р0,05). При этом обращает на себя внимание падение количества клеток при повышении степени тяжести заболевания (рис.1).
Далее мы изучили взаимосвязь уровня содержания лимфоцитов в периферической крови в зависимости от тяжести заболевания с использованием непараметрического Т- критерия Манна-Уитни и соответствующих структурных единиц (медиана и перцентили).
 | Рис.1. Изменение количества лимфоцитов в зависимости от тяжести АБА. |
В результате установлено, что различия в количестве лимфоцитов между легким и тяжелым персистирующими течениями АБА достоверны на уровне значимости 95% (р = 0,05) (рис.1).
С помощью методов корреляционного анализа было установлено, что в обследованной группе пациентов с АБА существует обратная корреляционная зависимость между количеством лимфоцитов и степенью тяжести заболевания (r = - 0,3, р =0,04) (рис.2.). Связан - ли факт снижения количества лимфоцитов в крови с апоптозом или с действием цитотоксических Т-лимфоцитов, которые могут уничтожать другие субпопуляции Т-клеток?
 | Рис.2. Обратная корреляционная зависимость между количеством лимфоцитов в периферической крови и тяжестью течения АБА. |
Чтобы ответить на данный вопрос, мы изучили ультраструктуру лимфоцитов на разных стадиях заболевания (рис.3).
Электронно-микроскопический анализ структуры лимфоцитов
из полученных данных следует, что клетки здоровых и больных доноров имеют различную морфологию. Причем, выявленные изменения в морфологии клеток больных с АБА, по-видимому, обусловлены апоптозом.
Лимфоциты у больных АБА с интермиттирующим течением имеют признаки апоптотических клеток (рис.3,Б). Ядра приобретают лопастной вид, обычно далее происходит его коллапс и распад на микроядра. В клетках обнаруживается маргинация хроматина, сущность которой заключается в концентрации хроматина по периферии ядра в виде полусфер или глыбок. На клеточной поверхности появляются вдавливания и выпячивания. в лимфоцитах больных с тяжелым персистирующим течением АБА (рис. 3,в) обнаруживаются довольно глубокие вдавливания ядерных мембран, происходит фрагментация ядер и обнаруживаются фрагменты ядра, ограниченные мембраной внутри клетки. Среди тонких ультраструктурных изменений, характерных для поздних стадий апоптоза, обнаружено изменение цитолеммы и поверхностных структур. В первую очередь утрата микроворсинок и десмосом. На отдельных клетках появляются выпячивания и пузыри на мембране – блеббинги. Нет четко видимых мембранных структур клетки – однако, наблюдаются крупные вакуоли. Но целостность мембран самих лимфоцитов не нарушена.
Следует отметить, что большинство изученных электронно-микроскопических образцов лимфоцитов пациентов с тяжелым персистирующим течением АБА имели подобную морфологию.
Таким образом, среди исследованных образцов было обнаружено довольно много клеток, с признаками позднего апоптоза, но не распавшихся на апоптотические тельца, что может быть свидетельством нарушения биохимического (т.е. нуклеазного) состава лимфоцитов.
 |  А А | ||
  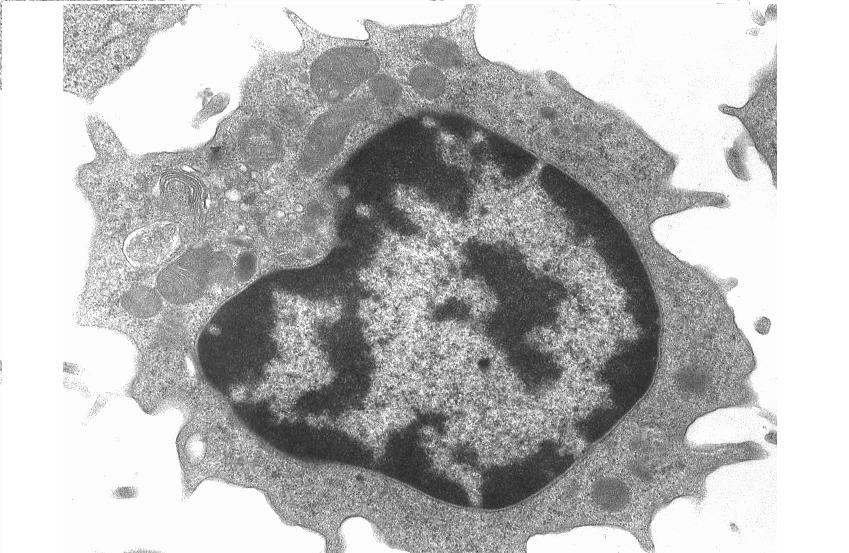 Б Б |    В В | ||
| Рис.3. Ультраструктура лимфоцитов крови здоровых доноров (А), пациентов с интермиттирующей (Б) и тяжелой перстистирующей АБА (В). | |||
2. Характеристика нуклеазного состава лимфоцитов
Морфологические преобразования в лимфоцитах, обнаруженные в процессе развития заболевания, выражены в разной степени распадом внутриклеточных компонентов. Одно из основных проявлений апоптоза на биохимическом уровне в ядре клетки состоит во фрагментации ядра (Егорова, 2001). Сначала происходит образование крупных фрагментов, содержащих, примерно, 300 т. п. о., несколько позже – 50-30 т. п.о. Результаты этих биохимических процессов коррелируют с морфологическими признаками: конденсация хроматина, выпячивания ядерной мембраны и др. Полагают, что именно этот начальный этап фрагментации хроматина является ключевым, после которого процесс становится необратимым (Погорелов, Козинец, 1995). Следующий этап фрагментации ДНК – межнуклеосомная деградация, при которой образуются фрагменты 180-200 п.о. Обычно они выявляются в виде «лесенки» при электрофорезе (Казанова, 1978).
 | Рис. 4. Электрофореграмма ДНК из лимфоцитов пациентов с АБА различной степенью тяжести. 1-ДНК pBR322; 2- хромосомная ДНК морского ежа; 3, 4, 5 – хромсомная ДНК ядер лимфоцитов на интермитирующей, легкой персистирующей и тяжелой персистирующей АБА, соответственно; 6, 7 –DNA /HindIII и DNA-ladder, соответственно. Электрофорез в 1%-ом агарозном геле, 3,5ч при напряжении 40 В (длина геля 10см). |
Появление таких фрагментов ДНК обеспечивается активацией Ca2+, Mg2+- зависимой эндонуклеазы, и как считает автор работы, только после межнуклеосомной деградации ДНК апоптоз в норме вступает в необратимую фазу и образуются апоптотические тельца.
В данной работе при исследовании структуры ДНК, выделенной из ядер лимфоцитов периферической крови пациентов с АБА, которые имели характерные морфологические изменения апоптотических клеток, четкой фрагментации ДНК в виде «апоптотической лесенки» обнаружено не было (рис. 4). Из представленного рисунка следует, что только у пациентов с интермиттирующей АБА в ядрах лимфоцитов обнаруживаются фрагменты ДНК длиной около 1000 п.о. в ядрах пациентов с персистирующей АБА такой картины не наблюдали. Осуществление различных этапов деградации ДНК при апоптозе связывают с проявлением активности разных ферментов, поэтому мы предположили, что происходит нарушение функционирования нуклеаз лимфоцитов при развитии АБА, что может приводить и к торможению межнуклеосомной деградации ДНК.
В связи с недостаточностью информации среди доступных нам литературных источников по этому вопросу, мы провели сравнительный анализ нуклеазного состава лимфоцитов относительно здоровых доноров и пациентов
с астмой.
ДНК pBR322 была использована для изучения взаимодействия ДНКазы лимфоцитов со структурными формами (рис.5).
 0 1 2,5 5 10 20 40 60 - мин 0 1 2,5 5 10 20 40 60 - мин | Рис. 5. Расщепление ДНК рBR 322 нуклеазой лимфоцитов в присутствии ионов Ca2+ и Mg2+. I–суперспиральная, II-кольцевая, III – линейная формы плазмидной ДНК. |
Как следует из рис.5 ДНКаза лимфоцитов здоровых доноров расщепляет полученную “суперспиальную” ДНК (I форма) до “открытого” кольца (II форма) уже в первые минуты реакции, через 60 мин молекулы линейной ДНК полностью гидролизованы.
При изучении взаимодействия ядерных и цитоплазматических белков лимфоцитов периферической крови пациентов с АБА с плазмидной ДНК установлено, что характер расщепления изменяется: активность снижается и через 20 мин не только не обнаруживается линейная ДНК, но и остается суперспиральная ДНК.
Анализ нуклеазной активности белковых экстрактов из лимфоцитов крови пациентов с АБА методом зимографии в присутствии ионов Ca2+ и Mg2+ выявил две основные активности (рис.6): среди цитоплазматических белков в области 29 кДа, среди ядерных белов, примерно, 40 кДа, которые отличались от зоны активности очищенной ДНКазы I. С ионами Mn2+ в данных условиях выявлена небольшая зона активности, примерно, 31 кДа. На денатурированной ДНК в данных условиях нуклеазной активности среди белков лимфоцитов обнаружено не было, кроме зоны активности ДНКазы I. Результаты зимографии (рис.6) в денатурирующих условиях, показывают, что обнаруженные в цитоплазматических и ядерных белках нуклеазные активности являются мономерными пептидными цепями.
При исследовании катионной зависимости инкубация цитоплазматических и ядерных белков в среде с различной комбинацией ионов Mg2+, Mn2+ и Ca2+ показала, что в обеих фракциях проявляется Mg2+-зависимая активность, которая усиливается, примерно, в 2-3 раза в среде с ионами Mn2+. Энзиматическая активность цитоплазматических белков (при равной концентрации по белку) была выше активности ядерных белков лимфоцитов. Добавление ионов Ca2+ в инкубационную среду с Mg2+ или Mn2+ приводило к повышению активности (рис.7).
 А А |
 Б Б |
Рис.6. Активность цитоплазматических (А) и ядерных (Б) белков лимфоцитов пациентов с АБА. дорожки 2, 3, 6 – легкая, дорожки 4, 5, 7 - тяжелая персистирующая АБА. Электрофорез в ПААГ-ДДС-нДНК.
 |  |
| Рис.7. Катионная зависимость ДНКазной активности белков лимфоцитов периферической крови пациентов с АБА. (фр.0,1) - цитоплазматические белки, (фр.0,4) - белки хроматина. | |
Нуклеазные активности белков лимфоцитов крови при тяжелой персистирующей астме ингибировались присутствием ионов Zn2+ (рис.8). В среде с ионами Mg2+ в 3-4 раза, а в среде с ионами Mn2+ в 15 раз.
а 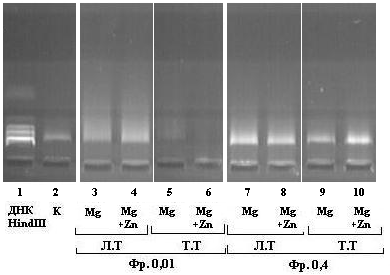 |  |
б  |  |
Рис.8. Влияние Zn2+ на уровень нуклеазной активности лимфоцитов крови с АБА
Следует отметить, что результаты реакции показывают, что при тяжелой астме ядерные белки менее чувствительны к синергическому действию ионов Mg2+(Mn2+)и Ca2+.
Таким образом, в данной работе были выявлены две нуклеазные активности - Ca2+,Mg2 - (цитоплазматическая, мол. м. ~ 29 кДа) и Mg2+(Mn2+)-зависимая (ядерная, мол. м. ~ 40 кДа), которые чувствительны к наличию в среде ингибитора (ионов Zn2+), особенно Mg2+(Mn2+)-зависимая активность при тяжелой персистирующей астме.
Лимфоциты периферической крови пациентов с тяжелой персистирующей астмой характеризуются серьезными морфологическими изменениями структурных компонентов по сравнению с клетками здоровых доноров и пациентов с интермиттирующей АБА.
Ингибирующее действие ионов цинка на белки лимфоцитов с признаками апоптоза может быть связано с данными, что ионы цинка способны блокировать межнуклеосомную деградацию ДНК. По данным литературных источников на апоптотических клетках показано, что нуклеаза, которая способствует межнуклеосомной деградации ДНК – это Ca2+,Mg2 –зависимая активность, а продукты деградации более ранних этапов апоптоза (фрагменты ДНК в 30-300 т.п.о.) – результат работы Mg2+-зависимой активности (Oberhammer et al., 1993).
В этой связи обращает на себя внимание апоптотическая ДНКаза-гамма, обнаруженная и выделенная из ядер тимоцитов крыс (мол. м.33 кДа), для работы которой требуются одновременно ионы Ca2+ и Mg2, причем эта потребность частично подавляется ионами Mn2+ (Higami еt al, 2003).
В данной работе был обнаружен высокий уровень проявления Mn-зависимой активности на легкой стадии АБА и высокий ответ энзиматической активности при кальций-марганцевом синергизме.
1 2 3 4 5 6 7 8 |
| ||||||||||||||||||||||||||||||||||||||||||
Рис.9. Электрофореграмма изменения ДНКазной активности белковых фракций в присутствие ионов двухвалентных Ме2+: Ca2+,Mg2+; Mn2. Дорожки: 1,2,5,6 -цитоплазматические белки; дорожки: 3,4,7,8-ядерные белки.
Это позволяет предположить, что при развитии АБА в лимфоцитах, выполнивших свою функцию происходит нарушение в функционировании Ca2+ и Mg2 – зависимой активности, в результате не происходит межнуклеосомная деградация ДНК в таких лимфоцитах, что приводит к торможению апоптоза этих клеток.
 |  2 3 4 5 6 7 8 9 2 3 4 5 6 7 8 9 |
 |  2 3 4 5 6 7 8 9 2 3 4 5 6 7 8 9 |
Рис.10. Изменения энзиматической активности белков лимфоцитов крови в зависимости от тяжести АБА.
Как следует из следующего рис.10, соотношение между кальций-магниевой и марганцевой активностями среди цитоплазматических белков, не зависимо от тяжести АБА, примерно, одинаковое 1,03 и 0,8, соответственно. Среди ядерных белков дисбаланс в уровне кальций-магниевой и марганцевой активностями изменяется в сторону повышения марганцевой активности. При легкой степени астмы уровень активности по индексу фрагментации выше, примерно, на 20%, а при тяжелой астме уровень марганцевой активности повышается более чем в 3 раза.
Следовательно, можно предположить, что Mg2+(Mn2+)-активность может подавлять активность Ca2+,Mg2+–зависимой активности, что ведет к торможению межнуклеосомной деградации ДНК
Дезоксирибонуклеазы секреторных гранул лимфоцитов периферической крови пациентов с АБА
Изучение нуклеазного состава гранул связано с ролью этих нуклеаз в развитии заболеваний, характеризующихся нарушениями в иммунном ответе. Иммунная система атакует аутологические ткани, приводя к глубоким изменениям. В этом случае ткани инфильтрируются Т-лимфоцитами, некоторых из них с цитотоксической активностью (цитотоксические Т-лимфоциты; ЦТЛ), что приводит к Т-опосредованному аутоиммунному заболеванию.
Лимфоцит-опосредованный цитолиз связывают с работой специфической нуклеазной активностью цитотоксических клеток (Pio, R. et.al 1998.). Это кислая ДНКаза с молекулярной массой 66 кДа активируется ионами Ca2+ и ингибируется Zn2+, специфична к днДНК.У больных рассеянным склерозом данная нуклеазная активность повышается и становится чувствительной к оксиду азота, но теряет чувствительность ионам цинка.
некоторые моменты при развитии астмы и орган-специфических аутоиммунных заболеваний (например, инфильтрация лимфоцитов в очаге заболевания) подвели нас к изучению нуклеазной активности секреторных гранул лимфоцитов крови пациентов с АБА.
Как следует из рис. 11 в гранулах здоровых доноров и больных с АБА обнаружена Са2+ и Mg2+ зависимая ДНКазная активность, которая различается по степени активности как в норме и при патологии, так и при персистенции воспаления.
ДНКазную активность в белковом экстракте гранул лимфоцитов определяли по способности гидролизовать геномную ДНК- морского ежа в буферной системе при рН 7,5 в присутствии ионов Са2+ и Mg2+ и установили, что активность, выраженная как “индекс фрагментации”, была обнаружена как в клетках здоровых доноров, так и пациентов с АБА (рис.11). Индивидуальные показатели различались разбросом, вероятно, отражая иммунный статус заболевания каждого пациента.
(А) 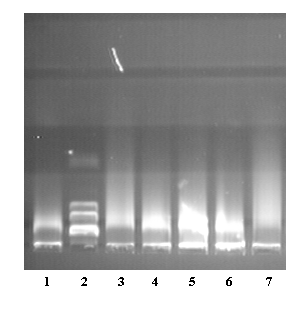 | (Б)  |
Рис.11. ДНКазная активность в гранулах лимфоцитов пациентов с АБА и здорового донора. (F.I), “ ” -среднее значение для каждой группы.
Чтобы убедиться, что ДНКазная активность присутствует в белковом экстракте гранул, выделенных из лимфоцитов и определить ее молекулярную
А
| Б
|
Рис. 12. Определение нуклеазной активности гранул
методом зимографии в ПААГ-ДСН-нДНК геле (А) и ее молекулярной массы (Б).
массу, мы использовали высокочувствительный метод “nuclease zymogram”, то есть визуализировали реакцию в геле ПААГ-ДСН, содержащем ДНК. (рис.12. ). Как следует из рисунка в геле с нДНК была обнаружена одна полоса на дорожке 3 с ДНКазойI (мол. масса 31 кДа) и одна широкая полоса на дорожке 1 с белковым экстрактом гранул, с большей молекулярной массой. Окрска геля позволила показать, что полоса состоит из двух близко расположенных полос менее интенсивной с мол. массой 68 кДа и более выраженной -66кДа. В геле с денатурированной ДНК – активнсть не была выявлена. Нуклеазная активность определялась в образцах секреторных гранул лимфоцитов крови с интермиттирующей и персистирующей астмой. При определении физико-химических свойств обнаруженной ДНКазной активности, мы изучили катионную зависимость, влиние ингибитора (Zn2+) и рН среды. Данные параметры определялись в прапаратах, полученных из гранул лимфоцитов пациентов с различной степенью тяжести астмы.
ДНКазная активность гранул при всех степенях тяжести повышалась, когда в икубационную среду при рН 7,5 добавляли Са2+.
(А)  | (Б)  |
Время реакции: 6 часов  | 12 часов  |
Рис. 13. Катионная зависимость активности ДНКаз. Белковый экстракт гранул лимфоцитов здорового донора (А) и больного АБА с тяжелым персистирующим течением (Б) инкубировали с нативной ДНК (40 мкг/мл) в 20мМ трис-HCl-буфере, рН 7,5 / 50мМ Mg2+. В каждую пробу добавляли соответствующие концентрации ионов Ca2+ и Zn2+. Время реакции: (А) 6 часов, (Б) 12 часов.
Рис.13 показывает фрагментацию ДНК типичного эксперимента, в котором использовали белковые экстракты здоровых доноров и пациентов с тяжелой формой астмы. Этот эксперимент проводили пять раз и во всех случаях высокая степень активности была при добавлении 1 мМ Са2+. Добавление 1 мМ Zn2+ приводило к ингибиции энзиматической активности, причем у здоровых на 73%, а у пациентов с тяжелой формой астмы на 45%. Выяснили, что при легком течении заболевания ДНКазная активность снижена по сравнению с тяжелым течением. Добавление Zn2+ ингибировало энзиматическую активность, примерно, на 50% в обоих случаях.
Таким образом, следует отметить, что ингибирующее действие ионов цинка ослаблено при персистенции астмы по сравнению с контролем (относительно здоровые доноры).
Нами была проведена серия экспериментов по изучению зависимости ДНКазной активности белковых экстрактов гранул лимфоцитов крови пациентов с легким и тяжелым персистирующим течением астмы от pH (рис.14). Фрагментацию ДНК определили при значениях pH 8.0, 7.0, и 5.0 в присутствии только ионов Mg2+ (Рис.14.А) и в присутствии ионов Mg2+ и Ca2+ (Рис.14.Б). Для каждой пробы определяли количественный уровень активности в виде “индекса фрагментации (рис.14). ДНКазная активность ассоциированная с гранулами лимфоцитов крови пациентов с разной степенью тяжести заболевания повышалась при закислении среды и добавления ионов кальция.
А  | Б  |
| Рис.14. Влияние рН на ДНКазную. активность гранул лимфоцитов больных АБА на легкой персистирующей (А) и больных АБА на тяжелой персистирующей стадиях (Б). Активность выражена как “индекс фрагментации” (F.I).ѕ - ионы Са 2++Mg2+, - ионы Mg2+.. | |
.
На тяжелой стадии при общем повышении активности на фоне подкисления среды, максимальный “индекс фрагментации” был отмечен при рН 7,0.
Не исключено, что это связано с проявлением ДНКазных активностей, поэтому мы изучили изменение активности белкового экстракта гранул при добавлении ионов Mn2+. В ходе эксперимента установлено, что в присутствии ионов Mn2+ ДНКазная активность белкового экстракта гранул ниже. Однако добавление ионов Ca2+ в инкубационную среду с Mn2+ приводит повышению активности как на легкой, так и тяжелой стадии на 121,6 и 105,4 %, соответственно, то есть в присутствии ионов марганца активность более чувствительна на повышение кальция в среде.
а –легкая, б – тяжелая персистирующая степени тяжести АБА. |
а | ||||||||||||||||||||||||||||
| б | ||||||||||||||||||||||||||||
Рис. 15. Гистограмма (А) изменения активностей гранулярных ДНКаз по индексу фрагментации (Б) при развитии заболевания.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис.16. Влияние ионов Zn2+ на активность гранул-ассоциированных нуклеаз. К-субстрат до реакции.
По результатам рис.15 можно предположить,что при развитии тяжести заболевания происходит повышение гранулярной Mn2+-зависимой активности (индекс фрагментации повышается на 62,4%) и Са 2+и Mg2–зависимой активности (на 61%).
ДНКзная активность в основном гидролизует плазмидную ДНК до кольцевой ДНК, активность проявляет устойчивость к действию ионов Zn2+ (рис.16).
Таким образом, показано, что в секреторных гранулах лимфоцитов локализуются ДНКаза, которая соответствует Ca2+-зависимому белку с молекулярной массой 66 кДа. Активность этого белка повышалась при использовании дцДНК в заполимеризованной в геле. При использовании в качестве субстрата плазмидной ДНК pBR322 показано, что в ДНКаза произвидит одноцепочечные разрывы и не чувствительна к ионам Zn2+, как ингибитору.
Заключение
В последние годы многими исследователями доказано, что нарушение ПКГ (апоптоза) может играть определенную роль в развитии воспаления дыхательных путей при атопической бронхиальной астме (Невзорова и др., 2001). Гиперактивация CD4+-Т-клеток в периферической крови и тканях дыхательных путей служит важным патологическим критерием респираторных аллергозов, поэтому значительное накопление активированных лимфоцитов, возможно, является следствием ингибирования процессов апоптоза. Однако механизмы устойчивости лимфоцитов к апоптозу до конца не раскрыты.
По данным литературы уже описана экспрессия ДНКазной активности ассоциированной с цитоплазматическими гранулами в активированных CD4+-Т-лимфоцитах после инкубации РВМС из здоровых доноров в присутствии иммуномодулирующих пептидов. Описано несколько эндонуклеаз в различных клетках, некоторым из этих нуклеаз отводится роль во фрагментации ДНК при апоптозе. Индукция этой активности в активированных CD4+-лимфоцитах человека и участие Т-клеток в аутоиммунных заболеваниях (Piо et al., 1998) натолкнула нас на изучение нуклеазного состава лимфоцитов и, в частности, на изучение возможного присутствия гранул-ассоциированных ДНКаз в Т-лимфоцитах крови пациентов с АБА.
В данной работе впервые показано, что помимо повышения ядерной Mg2+(Mn2+)-зависимой активности, деградирующей ДНК-клеток только на крупные фрагменты (до 30 т.п.о.), (что может способствовать торможению межнуклеосомной деградации ДНК и, как следствие, торможению образования апоптотических телец), Т4-лимфоциты из периферической крови больных атопической астмой различной степени тяжести содержат белки с ДНКазной активностью в секреторных гранулах. Эта гранул-ассоциированная ДНКаза соответствует кальций-зависимому белку, активность которого выше при кислом рН и при использовании дцДНК, обнаруженному группой Lopez-Moratalla N. (1998). Хотя еще не ясна роль этой ДНКазной активности, можно предположить, что это еще один цитолитический фактор. Эта мысль согласуется с идеей, что экспрессия энзимов содержащихся в секреторных гранулах может быть ассоциирована (Henkart, 1994) c цитолитическим потенциалом Т-лимфоцитов, и что цитолитический механизм ЦТЛ связан с активным трансфертом ДНК-фрагментирующего цитотоксического фактора в клетки-мишени. Можно предполагать, что описанная нами активность(ти) участвуют не только во фрагментации ДНК в клетках мишенях, но и в апоптозе самих Т-лимфоцитов. Это предположение совпадает с наблюдениями, что в тимоцитах паралелльно с увеличением концентрации Ca2+ и связывания внутриклеточного Zn2+ (Мамонтова, Кайдашев, 2004; oshimi et al., 1995; Ring et al., 1994) происходит увеличение фрагментации ДНК как следствие закисления. С другой стороны, показано, что ЦТК могут быть вовлечены в повреждения тканей-мишеней. Например, гранул-ассоциированная ДНКазная активность CD4+(Рio et al., 1998) повышена у больных циррозом печени, эта активность была ниже у пациентов с болезнью Гравса, что коррелирует с более глубоким (при циррозе печени) иммунорегуляторным расстройством. ДНКазная активность была еще ниже у пациентов с рассеянным склерозом. В данной работе также была обнаружена определенная динамика изменения нуклеазной активности при развитии тяжести астмы. Таким образом, обнаруженные активности могут играть определенную роль в протекании не только аутоиммунных заболеваний, но и при АБА. На роль аутоиммунита в патогенезе астмы и атопии через функционирование Т-лимфоцитов указывали Urboniene et al., 2005; Rottem et al., 2002; 1997; De Jong et al., 1997; Chau-Ching et al., 1996.
В плане дальнейшей работы по данной теме предполагается изучить ассоциацию данной активности с Тх/Тс- клетками, т.к. лимфоциты в органах-мишенях при атопических и аллергических заболеваниях имеют фенотип Т-хелперов, среднее соотношение СD4/СD8 составляет 7:1 (Курченко, 2002). И в их дисбалансе видят одну из причин персистирующего воспаления.
Выводы
1. Получена фракция лимфоцитов из периферической крови доноров с АБА и относительно здоровых доноров на 95%, состоящая из Т-клеток.
2. Изучена динамика структуры лейкоцитарной формулы у доноров с АБА. Установлена обратная корреляция между тяжестью заболевания и количеством Т-лимфоцитов (r= -0,3; p=0,04).
3. Методом трансмиссионной электронной микроскопии выявлены морфологические отличия в структуре лимфоцитов периферической крови здоровых доноров и пациентов с АБА. У пациентов с интермиттирующей и легкой персистирующей астмой морфологические признаки: маргинация хроматина, выпячивания ядерной оболочки, вдавливания и выпячивания клеточной поверхности,- коррелируют с биохимическими (образованием крупных фрагментов ДНК).
4. методом зимографии с использованием заполимеризованной нДНК обнаружены нуклеазные активности в цитоплазматических (29кДа) и в ядерных (40кДа) фракциях белков лимфоцитов. Установлена обратная корреляция между тяжестью астмы и нуклеазной активностью.
5. Показано, что с развитием болезни уровень ядерной кальций-магниевой активности падает, она становится более устойчивой к действию ингибитора – ионам цинка, а уровень Mg2+(Mn2+)-зависимой активности возрастает.
6. установлено наличие ДНКазной активности, ассоциированной с секреторными гранулами лимфоцитов, которая соответствует Ca2+-зависимому белку с молекулярной массой 66 кДа, активность которого коррелирует с тяжестью АБА.
Список работ, опубликованных по теме диссертации:
1. Нсангу, М.М.Д. Ядерные и гранулярные нуклеазы лимфоцитов при атопической бронхиальной астме /М.М.Д. Нсангу, С.А.Д. Водунон, З.И Абрамова //Деп. В ВИНИТИ.- № 186.- 2006.- 44с.
2. Нсангу, М.М.Д. Нуклеазная активность лимфоцитов больных бронхиальной астмой в зависимости от степени тяжести заболевания / М.М.Д. Нсангу, З.И. Абрамова // Биология-наука XXI века: сб. тез / 10-я Международная Пущинская школа-конференция молодых ученых.- Пущино, 2006. – С.86.
3. Нсангу, М.М.Д. Дезоксирибонуклеазы лимфоцитов периферической крови человека: активность, субстратная специфичность и локализация в норме и при бронхиальной астме /М.М.Д. Нсангу, А.В. Лунцов // Научно-практическая конференция молодых ученых: Тезисы докладов. Казань, 19 апреля 2006 г. / Под ред. д.м.н., профессора А.П. Цибулькина. – Казань, 2006. – С.80 – 81.
4. Абрамова, З.И. Дезоксирибонуклеазы лимфоцитов периферической крови человека при бронхиаьной астме. / З.И. Абрамова, М.М.Д. Нсангу, В.Г. Винтер // Ученые записки Казанского государственного университета.- 2006.- Т. 148. «Серия естественные науки», кн. 3.-С.123-137.
5. Курбанов, Р.А. Изучение гидролизующей активности антител к ДНК и ДНКаз лимфоцитов больных бронхиальной астмой /Р.А. Курбанов, М.М.Д Нсангу // VI Научная конференция молодых ученых, аспирантов и студентов научно-образовательного центра Казанского государственного университета «Материалы и технологии XXI века». Тезисы докладов. Казань, 28 апреля 2006г. – Казань: Казанский государственный университет им. В.И.Ульянова-Ленина, 2006. – С.67.
6. Нсангу, М.М.Д. Особенности морфологических показателей и количественной оценки лимфоцитов периферической крови больных атопической бронхиальной астмой / М.М.Д. Нсангу, А.С. Водунон, З.И. Абрамова, А.В. Лунцов, В. Н. Цибулькина // Казанский медицинский журнал. – 2007г.- Т. 88,№ 2. - С.182-185.
Факс биолого-почвенного факультета КГУ : 8432387121.




 1 2 3
1 2 3  1 2 3
1 2 3  а б а б а б а б
а б а б а б а б