Морфологические изменения в парауретральной области при введении тканеинженерной конструкции на основе мультипотентных стромальных клеток жировой ткани
На правах рукописи
Макаров Андрей Витальевич
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ПАРАУРЕТРАЛЬНОЙ ОБЛАСТИ ПРИ ВВЕДЕНИИ ТКАНЕИНЖЕНЕРНОЙ КОНСТРУКЦИИ НА ОСНОВЕ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ
03.00.25 – гистология, цитология, клеточная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2009
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательском институте морфологии человека РАМН
НАУЧНЫЙ РУКОВОДИТЕЛЬ: доктор биологических наук
Гольдштейн Дмитрий Вадимович
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ: доктор медицинских наук, профессор
Яглов Валентин Васильевич
доктор медицинских наук, профессор
Раденска-Лоповок Стефка Господиновна
ВЕДУЩАЯ ОРГАНИЗАЦИЯ:
ГОУ ВПО Московский государственный медико-стоматологический университет
Защита диссертации состоится «29» октября 2009 года в 14 часов на заседании диссертационного совета (Д 001.004.01) Учреждения Российской академии медицинских наук Научно-исследовательском институте морфологии человека РАМН по адресу: 117418, Москва, ул. Цюрупы, д. 3.
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии медицинских наук Научно-исследовательского института морфологии человека РАМН
Автореферат разослан «___» сентября 2009 года.
Ученый секретарь диссертационного совета
доктор медицинских наук Л.П. Михайлова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В современной медицинской практике при различных дефектах соединительной ткани используется введение восполняющих объём препаратов. К таким дефектам соединительной ткани, нуждающимся в коррекции, относятся дегенеративные заболевания кожи и собственно соединительной ткани, врождённые заболевания мочевыводящих путей, стрессовое недержание мочи и ряд других заболеваний.
Так, например, для коррекции стрессового недержания мочи у женщин разработано более 200 терапевтических и хирургических подходов [Пушкарь Д.Ю., 1996]. Методом выбора являются слинговые (петлевые) операции [Кулаков В.И., 2000]. Однако при использовании минимально инвазивных слинговых методик, их эффективность не достаточна, также лечение может сопровождаться осложнениями в виде пролежней и/или прорезания в просвет уретры синтетической ленты, что требует разработки принципиально новых подходов.
Наиболее эффективными для коррекции дефектов соединительной ткани являются методы, основанные на введении препаратов, создающих в области трансплантации дополнительный объём и направленные на достижение равновесного давления между мочевым пузырем и уретрой. Преимущества данного подхода заключаются в том, что пара- или периуретрально вводятся различные биоматериалы, которые образуют дополнительный искусственный неконтролируемый сфинктер, увеличивающий парциальное давление в просвете уретры [Pickard R., 2003], что также является конечной целью и при использовании слинговых операций.
В связи с тем, что создание такого препарата основано на способности организма реагировать на инородное тело, особые требования предъявляются к физико-химическим свойствам компонентов, входящих в его состав. Для создания продолжительного эффекта компоненты должны быть нетоксичными, длительное время сохраняться в области введения и не мигрировать в окружающие ткани.
В ряде работ показано, что использование клеточных суспензий (мультипотентных стромальных клеток) дает положительный эффект при введении в парауретральную область, который заключается во временной ремиссии клинических проявлений стрессового недержании мочи [Carr L.K., 2008; Mitterberger M., 2007]. Однако введение неприкрепленных клеток сопровождается их диффузной миграцией в окружающие ткани и массовой гибелью из-за стрессового воздействия изменений окружающей среды, в связи с чем данный эффект является непродолжительным. Поэтому перед исследователями стоит задача создать такой препарат, который был бы лишен этих недостатков. Данный препарат должен быть способным к восполнению собственного объёма, и замещать дефицит соединительной ткани. В связи с этим была поставлена задача создания тканеинженерной конструкции, которая включает клеточную культуру, способную восполнять объём соединительной ткани. При этом матрица-носитель должна обеспечивать сохранность клеток при малоинвазивном (инъекционном) способе введения, а также фиксировать клетки в месте введения.
При выборе оптимального носителя тканеинженерной конструкции были исключены многие синтетические препараты, из-за их неспособности к биодеградации, токсичности и неконтролируемым миграционным свойствам [Roques C., 2009; Fano V., 2007; Goldberg M., 2008]. Использование препаратов на основе полиэстеров органических кислот ограничено из-за невозможности создания инъекционной формы [Peter S.J., 1997]. Гели на основе коллагена и гиалуроновой кислоты не являются полностью биологически инертными и могут вызывать аллергические реакции [Hirsch R.J., 2008].
В качестве носителя тканеинженерной конструкции предложено использовать желатиновую губку. Желатин является продуктом денатурации коллагена, и поэтому, обладая всеми свойствами, характерными для коллагена, является невидоспецифичным, полностью инертным материалом, нашедшим широкое применение в медицине. Ряд авторов считает, что препараты на основе желатина являются оптимальными для создания биогелей и конструкций на их основе [Hsu S.H., 2007; Sung HW, 1999].
Выбор стромальной фракции жировой ткани в качестве клеточного компонента тканеинженерной конструкции был основан на соответствии культуры определенным параметрам. Благодаря малой травматичности забора первичного материала, получают именно аутологичную клеточную культуру. По данным литературы данная культура характеризуется высокой пролиферативной активностью и активным синтезом внеклеточного матрикса [Wang H.J., 2004]. При этом ряд авторов утверждает, что мультипотентные мезенхимальные стромальные клетки, выделенные именно из жировой ткани, обладают более выраженной способностью образовывать коллаген, при сравнении с клеточными культурами из других источников [Wagner W., 2005; Shvetsova E.V., 2008]. Однако, в современной литературе отсутствует описание морфологических изменений, которые развиваются при введении тканеинженерных конструкций на основе мультипотентных стромальных клеток фракции жировой ткани и желатиновой матрицы-носителя в область собственно соединительной ткани.
В свете приведенных положений, разрабатываемая проблема является актуальной, представляет не только теоретическое, но и практическое значение, что определяет актуальность данного экспериментального исследования.
Цель и задачи исследования. Целью исследования является изучение морфологических изменений в парауретральной области при введении тканеинженерной конструкции на основе мультипотентных стромальных клеток жировой ткани и желатиновой матрицы-носителя.
Для достижения указанной цели поставлены следующие задачи:
- Разработать тканеинженерную конструкцию (комбинированный трансплантат) на основе мультипотентных стромальных клеток фракции жировой ткани и желатиновой матрицы-носителя;
- Изучить морфологические изменения в парауретральной области при введении тканеинженерной конструкции на основе аутологичной клеточной культуры мультипотнетных стромальных клеток жировой ткани;
- Изучить морфологические изменения в парауретральной области при введении тканеинженерной конструкции на основе аллогенной клеточной культуры мультипотентных стромальных клеток жировой ткани;
- Изучить морфологические изменения в парауретральной области при введении тканеинженерной конструкции на основе девитализированной клеточной культуры стромальных клеток жировой ткани и при введении только желатинового матрикса конструкции без клеточного компонента.
Научная новизна работы. Впервые дана сравнительная структурная характеристика реакции соединительной ткани на введение инъекционной формы тканеинженерной конструкции на основе клеточной культуры стромальных клеток жировой ткани. Разработана оригинальная инъекционная форма тканеинженерной конструкции, содержащая желатиновую губку и клеточную культуру мультипотентных стромальных клеток жировой ткани, характеризующуюся высокой пролиферативной активностью. Впервые изучены морфологические изменения при парауретральном введении тканеинженерной конструкции в область представленную собственно соединительной тканью.
Парауретральное введение тканеинженерной конструкции, содержащей клеточную культуру стромальной фракции жировой ткани и желатиновую губку, в качестве носителя, сопровождается активным образованием соединительной ткани, что позволяет длительное время сохранять заданный объём. Сохранение массы образованной соединительной ткани конструкции обеспечивается функционированием трансплантированной культуры стромальных клеток жировой ткани. Трансплантация носителя или носителя с девитализированной клеточной культурой неэффективна и не приводит к выраженному образованию соединительной ткани и коллагеновых волокон.
Начальная стадия формирования соединительной ткани одинакова во всех группах и характеризуется преобладанием клеточного компонента в основных группах наблюдения. По мере удлинения срока эксперимента при использовании тканеинженерных конструкций, содержащих клеточные культуры, как аллогенные, так и аутологичные, отмечается увеличение объёма соединительной ткани, по сравнению с его деградацией в контрольных группах.
Иммуногистохимическое исследование выявило сохранение витальной метки Green fluorescent protein (GFP) на всех сроках эксперимента, что свидетельствует о длительном выживании трансплантированных клеточных культур.
Трансплантация тканеинженерной конструкции, содержащей аутологичную культуру стромальной фракции жировой ткани, вызывает наиболее быструю деградацию матрикса и образование максимального количества коллагена даже на ранних сроках эксперимента и является максимально эффективной.
Научно-практическая значимость работы. На основе изучения морфологических изменений соединительной ткани парауретральной области после введения тканеинженерной конструкции показано, что при использовании тканеинженерной конструкции, содержащей живые аутологичные клеточные культуры стромальной фракции жировой ткани, происходит формирование наибольшего количества коллагеновых волокон в области введения, при этом отмечена прямая корреляция между наличием трансплантированных клеток, количеством фибробластов и фиброцитов в области введения и площадью образованных коллагеновых волокон. Сравнительное исследование ТИК, содержащей девитализированные клеточные культуры показало незначительное образование коллагена в области введения, статистически значимо не отличающееся от группы, в которой вводился только матрикс без клеточной культуры. Полученные данные открывают перспективы для разработки методов коррекции дефектов собственно соединительной ткани при ряде патологических состояний.
Апробация работы. Основные положения работы доложены и обсуждены на Первом международный конгресс по репродуктивной медицине "Проблемы репродукции, Конференции в РГМУ (Москва, 2006); Ежегодной Всероссийской и международной научной конференции "Стволовые клетки и перспектива их использования в здравоохранении" (Москва, 2007); Британско-российском совещании в сотрудничестве с Европейской Комиссией «Стволовые клетки: законодательство, исследования и инновации. Международные перспективы сотрудничества» (Москва, 2007); XX юбилейном международном конгрессе с курсом эндоскопии "Современные технологии в диагностике и лечении гинекологических заболеваний" (Москва, 2007); Всероссийской научной школе-конференции «Аутологичные стволовые клетки: экспериментальные и клинические исследования (Москва, 2009); межлабораторной конференции в Учреждении РАМН НИИ морфологии человека РАМН (май, 2009).
Внедрение полученных результатов. Результаты диссертационного исследования используются в учебном процессе на кафедре гистологии, цитологии и эмбриологии Московского государственного медико-стоматологического университета.
Публикации. По материалам диссертации опубликовано 8 работ, из них 2 статьи в журналах, рекомендованных ВАК РФ, получен патент на изобретение.
Структура и объем диссертации. Работа изложена на 122 страницах и состоит из введения, обзора литературы (глава 1), описания материалов и методов исследования (глава 2), изложения результатов собственных исследований и их обсуждения (глава 3), заключения, выводов и списка литературы. Работа иллюстрирована 17 таблицами и 59 рисунками. Указатель цитируемой литературы включает 86 источников.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Выделение культуры мультипотенных стромальных клеток жировой ткани
Выделение клеточной культуры стромальной фракции жировой ткани проводили по методике, разработанной Mitchell J.B. et al [Mitchell J.B., 2006]. Материал (подкожную жировую ткань крыс) помещали в стерильные пробирки, содержащие транспортную среду (F12 с амикацином, 0,5 г/л) и доставляли в культуральную лабораторию в течение одного часа после забора. Всю работу с материалом проводили в стерильных условиях в ламинарном шкафу II класса защиты.
Кусочки ткани переносили в чашку Петри, максимально тщательно очищали от кровеносных сосудов и промывали раствором Хэнкса с цефазолином (1 г/л) 3-4 раза. Отобранный материал переносили в другую чашку Петри, также заполненную раствором Хэнкса с цефазолином, где его измельчали при помощи ножниц. Далее гомогенизированную ткань переносили пипеткой в 15 мл центрифужную пробирку, аккуратно отбирали раствор Хэнкса и заливали материал раствором Версена и 0,25% раствором трипсина в соотношении 1:1 так, чтобы материал был весь покрыт ферментами. Пробирки помещали в СО2-инкубатор (37С, 5% СО2) на 1,5–2 часа. Каждые 15 минут содержимое пробирки встряхивали при помощи вортекса.
После инкубирования в пробирку доливали раствор Хэнкса или культуральную среду для уменьшения концентрации ферментов и осаждали клетки центрифугированием (1100 об/мин, 10 мин). Супернатант удаляли, а осадок ресуспендировали в культуральной среде (DMEM/F12 1:1 с добавлением эмбриональной телячьей сыворотки до 10%, L-глутамина (584 мг/л), антибиотика (амикацин-500 мг/л) и переносили в культуральную посуду. Прикрепление клеток к подложке наблюдали через 12-24 часа.
После отмывания неприкрепленных клеток культура была достаточно однородной, представлена преимущественно вытянутыми веретеновидными малоотросчатыми фибробластоподобными клетками до 15-17 микрон в длину, с центральным расположением ядра и небольшим количеством гранул в цитоплазме.
Трансфекция культуры клеток маркерным геном Green Fluorescent Protein
Для трансфекции клеток маркерным геном Green Fluorescent Protein (GFP) использовали конструкцию на основе аденовируса (AD-5 EGFP), любезно предоставленную д.б.н. Народицким Б.С., руководителем лаборатории молекулярной биотехнологии ГУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи.
Для определения рабочего разведения вируса клетки рассаживали на 6-луночную плашку и инкубировали в среде с разным содержанием трансфицирующего агента. Оптимальное разведение определяли по эффективности трансфекции и отсутствию цитотоксического эффекта.
За двое суток до трансплантации клетки, достигшие монослоя, отмывали от сыворотки, добавляли бессывороточную среду с подобранной концентрацией вируса и инкубировали в течение 2,5-3 часов при 37°С. После инкубирования клетки повторно отмывали и добавляли поддерживающую среду (с пониженным до 1% содержанием сыворотки).
Эффективность трансфекции оценивали визуально. Начало зеленого свечения детектировали через 24 часа после трансфекции.
Девитализация культуры клеток
Необходимое количество клеток суспендировали в физиологическом растворе и переносили в криопробирку, которую помещали в жидкий азот (без добавления криопротекторов и соблюдения этапов замораживания). После замораживания суспензии пробирку помещали в горячую воду (90°С) до полного оттаивания. Процедуру повторяли 3 раза. Витальность клеток исключалась окрашиванием 0,4% трипановым синим. Гибель клеток также подтверждали неспособностью прикрепления к культуральному пластику в течение 48 часов после помещения их в стандартные культуральные условия.
Постановка экспериментального исследования
В работе использовали самок крыс Вистар, массой тела 250-300 г (питомник «Столбовая»). При работе с экспериментальными животными руководствовались приказом Минздрава СССР №755 от 12.08.1977 г. На проведение эксперимента получено разрешение биоэтической комиссии Учреждения РАМН НИИ морфологии человека РАМН (протокол №4 от12 марта 2007 г.).
Были сформированы четыре группы наблюдения: основная, в которой животным вводили конструкцию, содержащую измельченную желатиновую губку и аутогенную (АУ) клеточную культуру стромальной фракции жировой ткани; сравнения, в которой были использованы измельченная желатиновая губка и аллогенная (АЛ) клеточная культура; и две контрольных группы. В первой контрольной группе проводилось введение животным только матрикса (M) тканеинженерной конструкции, а во второй контрольной группе— введение измельченной желатиновой губки и девитализированной (Д) клеточной культуры стромальной фракции жировой ткани. В основных группах двум животным в каждой точке наблюдения вводили тканеинженерные конструкции с клеточной культурой, трансфицированной геном зелёного белка.
Животных вводили в наркоз путём внутримышечной инъекции раствора препарата «Золетил-50» в дозе 5мг/кг или ингаляцией диэтилового эфира. До начала основного эксперимента для получения аутогенных и аллогенных клеточных культур стромальной фракции жировой ткани в основной группе наблюдения забирали участки подкожной жировой ткани в области холки. Волосы в области операционного поля выстригали. Производили продольный разрез кожи, отсекали фрагмент жировой ткани размером 0,5х0,5 см, проводили гемостаз, накладывали швы на рану. Полученные образцы помещали в транспортную среду и при соблюдении температурного режима (+4°С) транспортировали в культуральную лабораторию. Для соблюдения принципа аутогенности животные были маркированы с помощью надрезов ушных раковин.
Подготовленный трансплантат вводили под эфирным наркозом, парауретрально с помощью инсулинового шприца со стандартной иглой (диаметр 0,6 мм). 5 млн. клеток вводили в объеме 0,1 мл физиологического раствора.
Сроки выведения животных в каждой группе составили: 7-е, 14-е, 30-е и 60-е сутки, по 6 животных в каждой точке наблюдения. В каждой точке эксперимента в группах сравнения и основной двум животным была введена клеточная культура, трансфицированная геном Green Fluorescent Protein. Из эксперимента животных выводили передозировкой диэтилового эфира. Самкам крыс проводили окаймляющий разрез кожи вокруг клитора с захватом верхней половины влагалища. Тупым и острым путем клитор был мобилизован до лонных костей, вместе с участком влагалища и отсечен на глубине 1 см.
Гистологические и морфометрические методы исследования
Гистологическое исследование образцов ткани проводили непосредственно после выведения животных из эксперимента. Полученный материал фиксировали в 10% растворе нейтрального формалина на фосфатном буфере по Лилли в течение 72 часов, после чего в течение 24 часов образцы ткани промывали в проточной воде. После стандартной гистологической проводки образцы тканей заливали в парафин («Гистомикс», Биовитрум), используя гистологические кольца (Биовитрум). Срезы получали на микротоме Microm HM430 толщиной 5 мкм. Для изучения срезов тканей парауретральной области использовали обзорные окраски – гематоксилином и эозином, по Маллори; пикросириусом красным для количественной оценки общей площади коллагеновых волокон и окраску по Романовскому-Гимзе для изучения морфологии клеточного инфильтрата. Локализацию GFP выявляли путем иммуногистохимического окрашивания гистологических срезов с использованием кроличьих поликлональных антител к GFP (Abcam, США). Гистологические препараты изучали и фотографировали, используя микроскоп Zeiss Axioplan-2, фотосъёмку проводили цифровой камерой Axiocam.
Для оценки морфологических изменений в области трансплантации проводили морфометрическое исследование матрикса конструкции, клеток, инфильтрирующих область введения конструкций, коллагеновых волокон; кровеносных сосудов.
На каждом срезе в области, соответствующей введению, делали 6 цифровых снимков при увеличении х200, используя камеру AxioCam микроскопа Axioplan 2 (Carl Zeiss, Германия), причем поля зрения выбирали по таблице случайных чисел. Подсчет проводили с помощью сетки из 100 узлов с использованием метода «полей» [Автандилов Г.Г., 1990], затем определяли относительный объем каждого из элементов.
Качественный состав клеточного инфильтрата оценивали путём подсчёта 100 клеток в «заинтересованной» области у одного животного. Во всех группах учитывались следующие клеточные элементы: макрофаги, фибробласты и фибоциты, клетки трансплантата.
Динамику изменения содержания коллагеновых волокон исследовали на срезах толщиной 4 мкм, окрашенных пикросириусом красным, позволяющим наиболее точно визуализировать коллаген [Junqueira L.C.U., 1979]. На каждом срезе в области введения, делали до 4-х цифровых снимков общим увеличением х20 и обрабатывали их с помощью пакета «Анализ» программы Adobe Photoshop CS3 extended (Adobe Systems Incorporated). Фракцию коллагеновых волокон вычисляли по отношению всех пикселей «коллагена» к общему количеству пикселей в поле зрения по формуле:
C=BA/(TA/100),
где С - содержание коллагеновых волокон в процентах, TA (Total Area) - общая площадь изображения, СA (Collagen Area) - общая площадь красных областей.
Статистические методы исследования
В группах определяли среднее арифметическое, стандартную ошибку среднего s по формуле для долей (Урбах В.Ю., 1975). Для стабилизации дисперсии использовали метод с вычислением статистики Колмогорова-Смирнова до и после трансформации. Трансформированные данные использовали для всех параметрических тестов (однофакторный дисперсионный анализ, t-тест с поправкой Бонферрони). Границы 95%-ных доверительных интервалов L определяли с помощью -преобразования для долей [Урбах В.Ю., 1975]. Статистический анализ результатов проводили с помощью программ Microsoft Excel 2007, Statistica 6.0 (StatSoft) и Sigma Stat 3.5 (Systat Software, Inc.), при 5% уровне достоверности.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В области введения на 7-е сутки при обзорной окраске в группе АУ отмечается значительное число клеточных элементов, инфильтрирующих ткань в области введения. Матрикс тканеинженерной конструкции не обнаруживается. Отмечается уменьшение числа клеточных элементов в соответствии с увеличением сроков наблюдения и постепенное увеличение коллагеновых волокон. Волокна коллагена располагаются хаотично.
На 7-е и 14-е сутки в группе АУ инфильтрат занимает практически всю область, куда вводилась тканеинженерная конструкция. Выявляются клетки полигональной формы с округлым небольшим ядром и зернистой цитоплазмой, так как при иммуногистохимическом исследовании именно данные клетки давали положительное окрашивание на зелёный белок, в расчётах они учитывались, как клетки трансплантата. Также выявлялись клетки веретеновидной формы с небольшим ядром. В небольшом количестве выявляются клетки с сегментированными ядрами. На 30-е и 60-е сутки преимущественно выявляются веретеновидные, полигональные клетки, располагающиеся в толще коллагеновых волокон.
В группе с введением тканеинженерной конструкции, содержащей аллогенную клеточную культуру (АЛ) отмечается наличие матрикса на 7-е сутки и обнаруживается значительное число клеточных элементов на 7-е и 14-е сутки. На 30-е и 60-е сутки число клеточных элементов уменьшается, появляются хаотично расположенные волокна коллагена. Состав клеточного инфильтрата аналогичен, представленному в группе АУ. В данной группе также выявлялись макрофаги, трансплантированные клетки, фибробласты и фиброциты, в небольшом количестве тучные клетки, полиморфноядерные лейкоциты и лимфоциты
В группе Д, где вводилась девитализированная клеточная культура отмечается в области введения тканеинженерной конструкции большое количество матрикса на 7-е и чуть меньшее на 14-е сутки. Число клеточных элементов на данных сроках невелико. Также невелико количество коллагеновых волокон на ранних сроках. Число клеточных элементов и коллагена увеличивается, начиная с 30-х суток. Клеточный состав в группе Д характеризуется преобладанием тканевых макрофагов, в том числе и с незавершенным фагоцитозом, что морфологически характеризуется полихроматичной окраской цитоплазмы, незначительным количеством фибробластов и фиброцитов, лимфоцитов, полиморфноядерных лейкоцитов, в единичных случаях выявлялись тучные клетки. На поздних сроках отмечается массивная гибель тканевых макрофагов, значительно увеличивается количество фибробластов и фиброцитов.
В области введения тканеинженерной конструкции в группе М, где вводился только матрикс конструкции на 7-е и 14-е сутки преобладает содержание матрикса и выявляются единичные клеточные элементы. На 30-е и 60-е сутки матрикс не обнаруживается, в некоторой степени увеличивается число клеток, обнаруживаются веретеновидные полигональные клетки, которые окружены волокнами коллагена. Волокна коллагена распложены преимущественно циркулярно, как вокруг уретры, так и в интактной ткани.
Клеточный состав в группе M характеризуется преобладанием макрофагов, значительное количество макрофагов содержит включения матрикса в цитоплазме. На поздних сроках появляются фибробласты и фиброциты. Выявляются единичные в поле зрения тучные клетки, клетки лимфоидного ряда, полиморфноядерные лейкоциты.
На 7-е сутки эксперимента максимальная доля клеточного компонента в области введения тканеинженерной конструкции отмечается в группе АУ (рис. 1), также значительна в группе АЛ и минимальна в группах Д и M. Статистически значимых различий в двух последних группах не выявлено.
На 14-е сутки значения доли клеточного компонента статистически значимо не различаются в группах АУ/АЛ и Д/M. Однако количество инфильтрата в группах, где вводились ткане-инженерные конструкции, содержащие живые клеточные элементы значительно превышает показатели контрольных групп. На 30-е и 60-е сутки отмечается уменьшение доли инфильтрата в основных группах эксперимента и увеличение в контрольных. На 60-е сутки доля инфильтрата примерно равна во всех группах.
На ранних сроках эксперимента в основных группах клеточный состав представлен трансплантированной клеточной культурой, которая к 30-м суткам элиминируется или превращается в клетки соединительной ткани. Последняя гипотеза подтверждается выявлением метки при иммуногистохимическом исследовании в аналогичных клетках. В группах, где вводились клеточные культуры на сроках 7 и 14 суток в составе инфильтрата значительную долю составили трансплантированные клетки. Увеличение и выравнивание количества клеток в контрольных группах на поздних сроках обусловлено в первую очередь тем, что на первых двух сроках практически всё поле зрения в зоне введения занимает матрикс, который, по-видимому, маскирует собственные клетки.
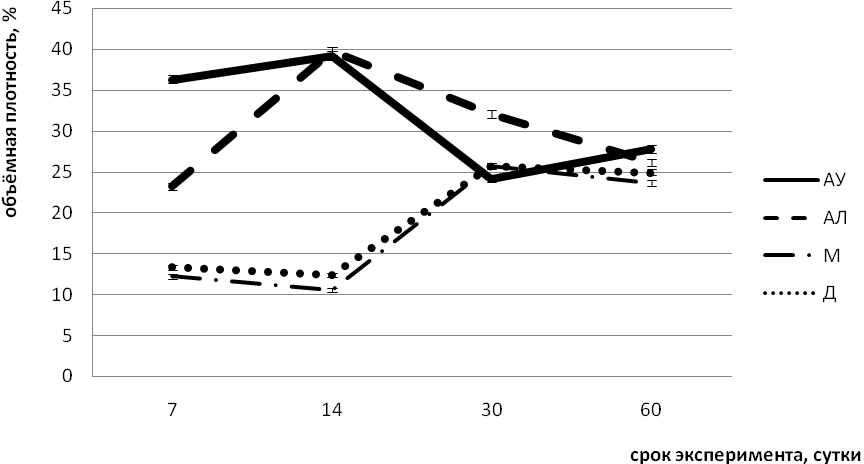
Рис. 1. Изменение объёмной плотности клеточных элементовв зоне введения тканеинженерных конструкций, содержащих аутологичную (АУ), аллогенную (АЛ), девитализированную (Д) клеточные культуры и изолировано матрикс (М) конструкции в различные сроки эксперимента
Клеточный состав на 7-е сутки различался: в группах, где вводились тканеинженерные конструкции с клеточными культурами преобладали фибробласты и фиброциты, а в контрольных бесклеточных группах – макрофаги (рис. 2).

Рис. 3. Морфологические показатели объёмной плотности клеточных элементов в зоне введения тканеинженерных конструкций, содержащих аутологичную (АУ), аллогенную (АЛ), девитализированную (Д) клеточные культуры и изолировано матрикс (М) конструкции на 7-е сутки эксперимента
На 30-е сутки эксперимента выявлено, что в основных группах наблюдения с введением клеточных культур преобладают фибробласты и фиброциты, в группе, где вводилась тканеинженерная конструкция с аутологичной культурой их количество максимальное. Следует отметить, что количество фибробластов и фиброцитов в группах наблюдения соответствует образованию коллагеновых волокон (рис. 3).


Рис. 3. Количество фибробластов (А) и коллагеновых волокон (Б) в зоне введения тканеинженерных конструкций, содержащих аутологичную (АУ), аллогенную (АЛ), девитализированную (Д) клеточные культуры и изолировано матрикс (М) конструкции на 30-е сутки эксперимента
Преобладание на ранних сроках среди клеточных элементов макрофагов в группах, где вводились тканеинженерные конструкции с девитализированной клеточной культурой и изолировано матрикс-носитель обусловлено развитием воспалительного процесса [Gregory C.D., 2004, Wynn T.A 2007]. В свою очередь, известно, что мультипотентные мезенхимальные клетки обладают выраженными иммуносупрессивными свойствами, что также могло повлиять на количество макрофагов в основных группах наблюдения.
Как уже указывалось выше, объемная плотность фибробластов и фиброцитов достоверно увеличивается на 30 сутки во всех группах, однако значительно больше данных клеток в группе, где вводилась аутологичная клеточная культура. В целом, количество фибробластов и фиброцитов соответствует образованию коллагеновых волокон: на 30-е сутки максимальное количество образованных коллагеновых волокон обнаруживается в группе с введением аутологичной клеточной культуры, меньшее в группе с введением аллогенной клеточной культуры и минимальное в контрольных группах. При этом в контрольных группах обнаруживается матрикс и достаточно высокое количество макрофагов. В группах M и Д объемная плотность всех макрофагов, значимо не различающаяся между собой, через 7 и 30 суток после операции статистически значимо выше, чем в группах с введением клеточных культур.
Таким образом, выраженность клеточного компонента через 7 суток не различается в группах без введения клеточных культур, а в группах с клетками более высокая за счет трансплантированных клеток.
Матрикс на всех сроках наблюдения в группе АУ (рис. 4) выявляется лишь в единичных случаях. На 7-е сутки эксперимента отмечается значительное содержание матрикса в группах M и Д (максимальное в группе M) и меньшее в группе АЛ. На 14-е сутки матрикс выявлялся только в контрольных группах, а на 30-е и 60-е сутки во всех группах его доля была небольшой. По количеству матрикса группы эксперимента также разделились: в основных (АУ и АЛ) матрикс конструкции элиминируется гораздо быстрее, а в контрольных (M и Д) сохраняется в единичных случаях даже на 60-е сутки.

Рис. 4. Изменение объёмной плотности матрикса конструкции в зоне введения тканеинженерных конструкций, содержащих аутологичную (АУ), аллогенную (АЛ), девитализированную (Д) клеточные культуры и изолировано матрикс (М) конструкции в различные сроки эксперимента
Следует отметить, что доля сосудов в группах наблюдения на всех сроках эксперимента не превышала 4 %, однако была статистически значимо выше в группах АУ и АЛ на всех сроках эксперимента.
Среднее значение площади коллагеновых волокон на всех сроках наблюдения значительно выше в основных группах эксперимента (рис. 5), при этом в группе АУ на 7-е и 14-е сутки статистически значимо среднее значение площади коллагеновых волокон выше, чем в группе АЛ. В контрольных группах эксперимента относительное содержание коллагеновых волокон меньше, чем в основных, и статистически значимо не различается между собой практически на всех сроках наблюдения.
Таким образом, формирование соединительной ткани в группах, где вводились тканеинженерные конструкции, содержащие клеточные культуры, происходит быстрее, образуется большее количество коллагеновых волокон.
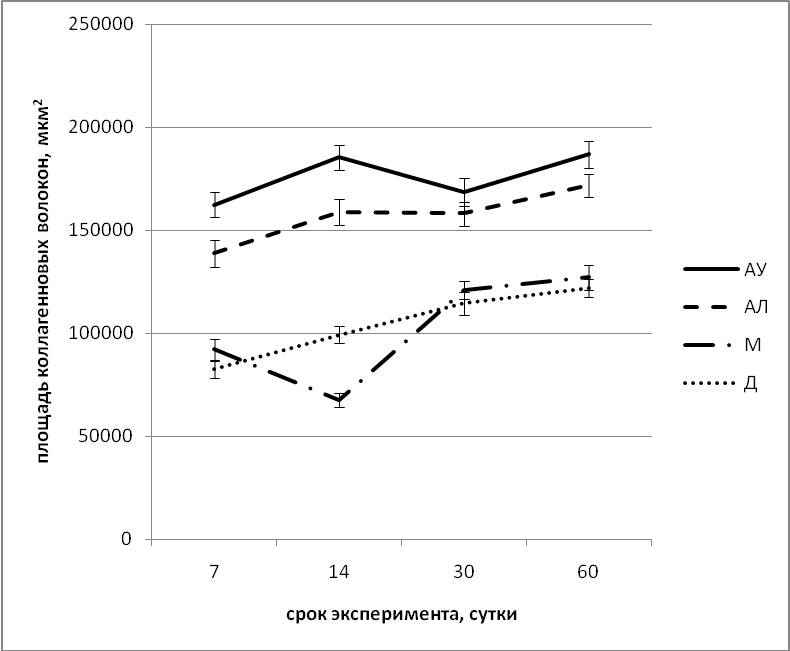
Рис. 5. Изменение показателей площади коллагеновых волокон в зоне введения тканеинженерных конструкций, содержащих аутологичную (АУ), аллогенную (АЛ), девитализированную (Д) клеточные культуры и изолировано матрикс (М) конструкции в различные сроки эксперимента
Следует отметить, что в данной работе тканеинженерная конструкция вводилась в парауретральную соединительную ткань. В месте введения образовывалась также соединительная ткань, что может говорить об ортологии процессов регенерации и влиянии микроокружения на дифференцировку стромальных клеток. Так, при введении аналогичной тканеинженерной конструкции в область представленную преимущественно жировой тканью отмечалось образование жировой ткани в работе Hong L et al [Hong L, 2006]. Исследователями было показано формирование жировой ткани при введении конструкции на основе аллогенной клеточной культуры стромальной фракции жировой ткани в область жирового тела щеки у иммунодефицитных мышей.
Ряд исследователей применял тканеинженерные конструкции на основе желатиновой губки для создания тканевых эквивалентов кожи, и также продемонстрировали выраженное образование коллагеновых волокон в области трансплантации клеточных культур [Wang H.J., 2004]. При этом ряд авторов утверждает, что мультипотентные мезенхимальные стромальные клетки, выделенные именно из жировой ткани, обладают более выраженной способностью образовывать коллагеновые волокна, при сравнении с клеточными культурами из других источников [Wagner W., 2005; Shvetsova E.V., 2008].
Несмотря на то, что использование предложенной тканеинженерной конструкции для образования соединительной ткани предложено впервые, нами также получены данные о выраженном образовании коллагеновых волокон при введении мезенхимальных стромальных клеток, особенно аутологичных, при этом отмечена прямая корреляция между наличием трансплантированных клеток, количеством фибробластов и фиброцитов в области введения и площадью образованных коллагеновых волокон.
Анализ данных литературы и результаты, полученные нами в настоящем экспериментальном исследовании, дают основание утверждать, что предложенный нами метод получения тканеинженерной конструкции лишен основных недостатков и имеет ряд преимуществ, по сравнению с другими методами. Созданная тканеинженерная конструкция на основе стромальных клеток жировой ткани в комбинации с матрицей-носителем для локального формирования соединительной ткани в парауретральной области характеризуется тем, что её носитель быстро деградирует, наличие живых клеточных культур сопровождается образованием соединительной ткани и коллагеновых волокон. Преимущества использования тканеинженерной конструкции по сравнению с введением неприкреплённых суспензионных культур заключается в наличии оптимального микроокружения, обеспечивающего выживание клеток, а также препятствующего миграции клеток в окружающие ткани. Данные эффекты, а также наличие живых клеточных культур в составе конструкции обеспечивает длительное и локальное увеличение соединительной ткани и площади коллагеновых волокон.
В ходе работы было впервые предложено для поставленной цели использовать тканеинженерную конструкцию, в состав которой вошли стромальные клетки жировой ткани и желатиновая губка в качестве матрикса-носителя. Отработан стандартный протокол, позволяющий получать стандартизированную тканеинженерную конструкцию, пригодную для инъекционного введения.
Морфологическое исследование выявило, что при использовании тканеинженерной конструкции, содержащей живые клеточные культуры стромальной фракции жировой ткани, обеспечивается значительное формирование коллагеновых волокон в области введения на всех сроках эксперимента. При этом, введение тканеинженерной конструкции, содержащей аутологичную клеточную культуру наиболее эффективно. Отмечается быстрая деградация матрикса, выраженность клеточного компонента в области введения и достоверно более высокая площадь коллагеновых волокон.
При иммуногистохимическом исследовании трансплантированные клетки, меченные зелёным флюоресцентным белком, выявлялись на поздних сроках эксперимента.
В нашей работе, в качестве дополнительного контроля была использована тканеинженерная конструкция, содержащая девитализированную клеточную культуру. Однако, при сравнительном исследовании данной группы было отмечено длительное сохранение трансплантированного матрикса, незначительное формирование клеточной инфильтрации и образование коллагеновых волокон в области введения, статистически значимо не отличающееся от группы, в которой вводился только матрикс без клеточной культуры.
Следует отметить, что положительное влияние живых клеточных культур, как аутологичных, так и аллогенных, заключается в том, что они способствуют длительному сохранению объёма соединительной ткани и постоянному её пополнению за счёт их пролиферации, тем самым обеспечивая более длительное функционирование конструкции, что не всегда сопровождало пересадку раннее используемых в медицине препаратов.
Таким образом, данные, полученные в ходе экспериментального исследования, позволяют говорить об эффективности использования тканеинженерной конструкции, содержащей аутологичную клеточную культуру стромальной фракции жировой ткани для локального формирования соединительной ткани. Перечисленные преимущества тканеинженерной конструкции открывают перспективы в области лечения дефектов собственной соединительной ткани при ряде патологических состояний.
ВЫВОДЫ
- Разработана инъекционная форма тканеинженерной конструкции, содержащая желатиновую губку и обладающую высокой пролиферативной активностью клеточную культуру стромальных клеток жировой ткани. При парауретральном введении тканеинженерной конструкции происходит образование собственно соединительной ткани.
- На ранних сроках после парауретральной инъекции тканеинженерных конструкций преобладают клеточные элементы, представленные макрофагами, фибробластами и фиброцитами, на поздних сроках — коллагеновые волокна.
- При трансплантации тканеинженерной конструкции содержащей аутологичную клеточную культуру стромальной фракции жировой ткани клеточный компонент максимален, в его составе преобладают фибробласты, фиброциты и трансплантированные клетки, матрикс конструкции деградирует на ранних сроках, образование коллагеновых волокон значительно выше, чем в других группах наблюдения.
- Трансплантация тканеинженерной конструкции, содержащей аллогенную культуру стромальной фракции жировой ткани характеризуется также выраженной клеточной инфильтрацией, представленной трансплантированными клетками, макрофагами, фибробластами и фиброцитами, быстрой деградацией матрикса конструкции и выраженным образованием коллагеновых волокон.
- Трансплантация тканеинженерных конструкций, содержащих девитализированную клеточную культуру и изолировано желатиновый матрикс, вызывает выраженную макрофагальную реакцию, выявляется небольшое количество фибробластов и фиброцитов, длительное, даже на поздних сроках, сохранение матрикса конструкции и низкий уровень образования коллагеновых волокон.
Список работ, опубликованных по теме диссертации
- Арутюнян И.В., Макаров А.В., Волков А.В., Адамян Л.В., Зайратьянц О.В., Опаленов К.В., Смольнова Т.Ю., Яроцкая Е.Л., Ржанинова А.А., Гольдштейн Д.В. Инъекционная форма тканеинженерной конструкции для формирования соединительнотканного эквивалента in vivo. // Современные технологии в диагностике и лечении гинекологических заболеваний, под.редакцией акад. РАМН Л.В.Адамян, М., 2007, с.350-352
- Макаров А.В., Волков А.В., Адамян Л.В., Зайратьянц О.В., Опаленов К.В., Смольнова Т.Ю., Яроцкая Е.Л., Арутюнян И.В., Ржанинова А.А., Гольдштейн Д.В. Разработка и изучение биологических свойств тканеинженерной конструкции для формирования соединительной ткани в парауретральной области с целью коррекции стрессового недержания мочи. // Современные технологии в диагностике и лечении гинекологических заболеваний, под.редакцией акад.РАМН Л.В.Адамян, М., 2007, с.359-361
- Макаров А.В., Волков А.В., Адамян Л.В., Зайратьянц О.В., Опаленов К.В., Смольнова Т.Ю., Яротская Е.Л., Арутюнян И.В., Ржанинова А.А., Гольдштейн Д.В. Разработка и изучение биологических свойств тканеинженерной конструкции для формирования соединительной ткани в парауретральной области с целью коррекции стрессового недержания мочи. // XX юбилейный международный конгресс с курсом эндоскопии "Современные технологии в диагностике и лечении гинекологических заболеваний", 2007, С. 34-36.
- Макаров А.В., Гольдштейн Д.В., Адамян Л.В., Зайратянц О.В., Арутюнян И.В., Опаленов К.В., Смольнова Т.Ю., Яротская Е.Л., Волков А.В., Ржанинова А.А. Инъекционная форма тканеинженерной конструкции для лечения стрессового недержания мочи. // Ежегодная Всероссийская и международная научная конференция "Стволовые клетки и перспектива их использования в здравоохранении", 2007, С.105-106.
- Макаров А.В., Волков А.В., Адамян Л.В., Зайратьянц О.В., Опаленов К.В., Смольнова Т.Ю., Яротская Е.Л., Арутюнян И.В., Ржанинова А.А., Гольдштейн Д.В. Коррекция стрессового недержания мочи у женщин с использованием ткане-инженерной конструкции. // Британско-российское совещание в сотрудничестве с Европейской Комиссией «Стволовые клетки: законодательство, исследования и инновации. Международные перспективы сотрудничества», 2007, С. 4.
- Макаров А.В., Волков А.В., Гольдштейн Д.В., Зайратьянц О.В., Адамян Л.В., Ржанинова А.А., Опаленов К.В., Яроцкая Е.Л., Быченко А.Б., Смольнова Т.Ю., Арутюнян И.В. Инъекционный комбинированный клеточный трансплантат и перспективы его использования для коррекции стрессового недержания мочи. // Проблемы репродукции, 2007, №2, т.13, с. 71-76.
- Макаров А.В., Арутюнян И.В., Большакова Г.Б., Волков А.В., Гольдштейн Д.В. Морфологические изменения в парауретральной области при введении тканеинженерной конструкции на основе стромальных клеток жировой ткани. // Клеточные технологии в биологии и медицине, 2009, №4, с. 38-47.
- Гольдштейн Д.В., Макаров А.В., Ржанинова А.А., Фатхудинов Т.Х., Волков А.В Трансплантат для восстановления дефектов соединительной ткани и способ его получения. // Патент РФ №2321897, зарегистрирован в Госреестре 10 апреля 2008 г.
Соискатель А.В. Макаров

