Морфофункциональное состояние и дифференцировочный потенциал культивируемых мультипотентных мезенхимальных стромальных клеток костного мозга человека при моделировании эффектов микрогравитации
УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК
Государственный научный центр Российской Федерации –
Институт медико-биологических проблем РАН
_________________________
На правах рукописи
Гершович Юлия Геннадьевна
Морфофункциональное состояние и дифференцировочный потенциал культивируемых мультипотентных мезенхимальных стромальных клеток костного мозга человека при моделировании эффектов микрогравитации
14.00.32 – авиационная, космическая и морская медицина
03.00.25 – гистология, цитология, клеточная биология
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2009
Работа выполнена в Учреждении Российской академии наук Государственном научном центре Российской Федерации – Институте медико-биологических проблем РАН
Научный руководитель:
доктор медицинских наук, профессор Буравкова Людмила Борисовна
Официальные оппоненты:
доктор медицинских наук, профессор Гаврилюк Борис Карпович
доктор медицинских наук, профессор Оганов Виктор Сумбатович
Ведущая организация:
Учреждение Российской академии наук Институт биологии развития имени
Н.К. Кольцова РАН
Защита диссертации состоится «25» июня 2009 г. в 1000 часов на заседании диссертационного совета Д 002.111.01 в Учреждении Российской академии наук Государственном научном центре Российской Федерации – Институте медико-биологических проблем РАН (ГНЦ РФ – ИМБП РАН) по адресу: 123007, г. Москва, Хорошевское шоссе, д. 76 а.
С диссертацией можно ознакомиться в библиотеке ГНЦ РФ – ИМБП РАН
Автореферат разослан «22» мая 2009 г.
Ученый секретарь диссертационного совета,
доктор биологических наук М.А. Левинских
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Результаты, полученные в условиях космического полета и в модельных экспериментах, неоспоримо свидетельствуют о том, что костная система не может неизменно функционировать в условиях микрогравитации. Совокупность зарегистрированных физиологических изменений включает отрицательный баланс кальция, общую потерю массы костной ткани, деминерализацию в костях, несущих осевую опорную нагрузку на Земле, увеличение содержания в крови и моче маркеров костной резорбции [Ступаков, Воложин, 1989; Григорьев, Воложин, Ступаков, 1994; Газенко, Григорьев, Егоров, 1997; Оганов, 2003; Collet et al., 1997; Caillot-Augusseau et al., 1998; Vico et al., 2001]. Очевидно, что этот факт может существенно лимитировать продолжительность пребывания человека в космическом пространстве из-за потенциального риска развития остеопороза и сопровождаться негативными последствиями при возвращении в условия земной гравитации. Тем не менее, клеточные механизмы наблюдаемых изменений до настоящего времени остаются не до конца ясными. Работы, выполненные в течение ряда последних лет, убедительно продемонстрировали, в том числе, и чувствительность культивируемых клеток остеобластического фенотипа к гравитационному фактору [Guignandon et al., 1995; Hughes-Fulford et al., 1996; Carmeliet et al., 1997; Kumei et al., 1998; Akiyama et al., 1999; Kacena et al.,2003; Hughes-Fulford et al., 2006; Kumei et al., 2006; Kumei et al., 2007]. Однако с увеличением количества экспериментальных данных перед исследователями встает новый вопрос: как может влиять микрогравитация или ее эффекты на различные аспекты функционирования менее зрелых клеточных форм, а именно на остеогенные клетки-предшественники и стволовые клетки. В постнатальном развитии основным источником стволовых клеток является костный мозг [Фриденштейн и др., 1976, 1981]. Мультипотентные мезенхимальные стромальные клетки (ММСК), локализованные в костном мозге и ряде других тканей и органов, способны к направленной дифференцировке в клеточные элементы костной, хрящевой и жировой тканей [Prockop, 1997; Jaiswal et al., 1997; Johnstone et al., 1998; Pittenger et al., 1999; Conget, Minguell, 1999; Muraglia et al., 2000; Janderova et al., 2003], а также клетки стромы, поддерживающей и регулирующей гемопоэз [Majumdar et al., 2003; McNiece et al., 2004; Maitra et al., 2004; Wagner et al., 2007]. Интерес к ММСК непрерывно растет, однако все большее число работ ставит новые вопросы в отношении вовлеченности ММСК в процессы самовозобновления и самоподдержания соединительных тканей и особенностей функционирования этих клеток in vitro и in vivo. Определение роли гравитационного фактора в морфофункциональном состоянии клеток-предшественников представляется важной, но не простой задачей. Механизмы влияния микрогравитации на клетку могут быть определены только в дорогостоящих космических исследованиях, временные рамки и методологические возможности которых чаще всего ограничены. В наземных условиях эффекты воздействия микрогравитации на клетку моделируют с помощью различных экспериментальных систем [Albrecht-Buehler, 1992; Moore, Cogoli, 1996; van Loon, 2007]. Тем не менее, исследования, посвященные изучению гравитационной чувствительности ММСК in vitro, крайне немногочисленны, затрагивают какие-то отдельные характеристики клеток-предшественников, временные экспозиции клеток в данных системах не превышают нескольких суток культивирования, а результаты, полученные при использовании различных моделей, зачастую противоречивы [Zayzafoon et al., 2004; Meyers et al., 2004; Meyers et al., 2005; Buravkova et al., 2005; Yuge et al., 2006; Dai et al., 2007]. Таким образом, дальнейшее комплексное исследование морфофункционального состояния и дифференцировочного потенциала ММСК в условиях длительного моделирования эффектов микрогравитации позволит приблизиться к более глубокому пониманию процессов, происходящих в ходе физиологического и патологического ремоделирования костной ткани, а также пролить свет на проблему механочувствительности стволовых клеток взрослого организма.
Цель работы: Изучение морфофункционального статуса и дифференцировочного потенциала мультипотентных мезенхимальных стромальных клеток (ММСК) костного мозга человека in vitro в условиях длительного моделирования эффектов микрогравитации с помощью различных экспериментальных установок.
В соответствии с данной целью были поставлены следующие
задачи исследования:
1) Подобрать оптимальные условия культивирования и индукции дифференцировки ММСК в условиях длительного моделирования эффектов микрогравитации, создаваемых с помощью горизонтального клиностата и Random Positioning Machine (Устройство для рандомизации положения, RPM);
2) Исследовать влияние моделирования эффектов микрогравитации на начальные стадии роста ММСК в норме и при их коммитировании к остеогенезу;
3) Провести иммунофенотипическую характеристику ММСК и остеогенных ММСК-производных после длительной экспозиции в условиях моделирования эффектов микрогравитации;
4) Изучить продукцию некоторых интерлейкинов в культурах ММСК и остеогенных ММСК-производных при моделировании эффектов микрогравитации;
5) Проанализировать эффективность начальных и конечных этапов индуцированной остеогенной дифференцировки ММСК и их остеогенных производных в условиях длительного моделирования эффектов микрогравитации;
6) Оценить эффективность индуцированной адипогенной дифференцировки ММСК и их адипогенных производных при длительном моделировании эффектов микрогравитации.
Научная новизна.
Впервые проанализировано влияние длительного (от 10 до 30-40 суток) моделирования эффектов микрогравитации с помощью двух различных наземных экспериментальных установок (горизонтальный клиностат и Random Positioning Machine – RPM) на основные характеристики ММСК костного мозга человека и производные от них коммитированные остеогенные клетки-предшественники, которые отражают морфофункциональное состояние культивируемых клеток. Получены новые данные, свидетельствующие о гравитационной чувствительности стволовых клеток взрослого организма и низкодифференцированных остеогенных клеток-предшественников. Впервые показано, что длительная экспозиция ММСК и остеогенных клеток-предшественников различного уровня коммитированности на горизонтальном клиностате или RPM подавляет клеточный прирост на начальных этапах воздействия, не влияя при этом на жизнеспособность клеток. Обнаружено, что длительное моделирование эффектов микрогравитации не оказывает влияния на экспрессию основных иммунофенотипических маркеров ММСК и производных от них остеогенных клеток (CD90, CD29, CD44), однако стимулирует выработку провоспалительного цитокина (ИЛ-8). Проведенные сравнительные исследования позволили установить, что в отличие от клиностатирования, которое оказывает незначительное влияние на завершающие этапы дифференцировки ММСК в остеогенном направлении, моделирование эффектов микрогравитации с помощью RPM подавляет как начальные (активация экспрессии мембранной формы щелочной фосфатазы, биосинтез коллагена I типа), так и терминальные этапы (формирование минерализованного матрикса) индуцированного остеогенеза остеогенных клеток-предшественников. Впервые показано, что в данных экспериментальных условиях направленная адипогенная дифференцировка культивируемых ММСК и полученных из них коммитированных адипогенных клеток-предшественников не изменяется.
Полученные данные расширяют сложившиеся теоретические представления о восприимчивости стволовых клеток и коммитированных остеогенных клеток-предшественников к изменению параметров гравитационной среды в условиях in vitro.
Научно-практическая значимость работы.
Результаты, полученные в работе, могут служить основой для использования низкодифференцированных стромальных клеток костного мозга человека, а также производных от них коммитированных клеток-предшественников в качестве удобной экспериментальной модели для изучения процессов дифференцировки клеток-предшественников в условиях изменения параметров гравитационной среды, а также механизмов клеточной механочувствительности.
Подтверждена потенциальная возможность включения стволовых клеток и низкодифференцированных остеогенных клеток-предшественников в развитие локальных клеточных процессов адаптивной перестройки костной ткани, наблюдаемых в условиях гипокинезии и микрогравитации.
Проведенные сравнительные исследования позволяют рекомендовать использование коммерческой экспериментальной установки RPM как более адекватной модели для предупреждения процессов индуцированной остеогенной дифференцировки стволовых клеток по сравнению с клиностатом. Результаты исследования могут быть использованы в материалах лекций по биологии стволовых клеток, авиационной, космической и морской медицине, а также учитываться при проведении биологических исследований.
Положения, выносимые на защиту:
I) Мультипотентные мезенхимальные стромальные клетки костного мозга человека, как и производные от них остеогенные клетки-предшественники, восприимчивы к моделированию эффектов микрогравитации, что подтверждается подавлением процессов клеточного роста и остеогенной, но не адипогенной дифференцировки клеток различного уровня коммитированности, а также активацией продукции интерлейкина-8.
II) Для изучения морфофункционального состояния и процессов коммитирования стволовых клеток в условиях измененной гравитации способ моделирования эффектов микрогравитации с помощью RPM имеет преимущество перед горизонтальным клиностатированием, поскольку оказывает влияние не только на морфофункциональные характеристики ММСК, но более существенно воздействует на остеогенную дифференцировку клеток-предшественников.
Апробация работы. Основные результаты и положения диссертации доложены на VI и VII конференциях молодых ученых и специалистов, аспирантов и студентов, посвященных Дню космонавтики (Москва, 2007, 2008); XXII Международной Пущинской школе-конференции молодых ученых «Биология-наука XXI века». (Пущино, 2008). V Международном Симпозиуме «Актуальные проблемы биофизической медицины» (Киев, 2007); I школе-конференции «Методы культивирования клеток» (Санкт-Петербург, 2008), 28th Annual International Gravitational Physiology Meeting. (Сан-Антонио, США, 2007); 29th Annual International Gravitational Physiology Meeting (Анже, Франция, 2008). По теме диссертации опубликовано 11 печатных работ, в том числе 3 статьи в журналах, рекомендованных ВАК РФ. Диссертация апробирована на заседании секции Ученого совета ГНЦ РФ – ИМБП РАН “Космическая физиология и биология” 27.04.2009 г. Связь работы с научными программами. Работа выполнена при поддержке гранта РФФИ №06-04-49781-а, гранта Президента Российской Федерации «Ведущие научные школы» НШ-3402.2008.4 и программы Фундаментальных исследований ГНЦ РФ - ИМБП РАН.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов исследования, обсуждения результатов, заключения, выводов и списка литературы. Текст диссертации изложен на 187 страницах, иллюстрирован 34 рисунками и 5 таблицами. Список литературы содержит 300 цитируемых источников, из которых 40 на русском и 260 на иностранном языке.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования являлись культуры мезенхимальных стромальных клеток костного мозга человека, любезно предоставленные д.б.н. Романовым Ю.А. (Научно-практическая лаборатория стволовых клеток человека НИИ РКНПК Росмедтехнологий). В экспериментах изучали влияние моделирование эффектов микрогравитации на ММСК 3-6 пассажей. Нормальные остеобласты человека были любезно предоставлены коллегами из Малайзии (Кен Университет).
Культивирование ММСК. В качестве среды для поддержания роста ММСК использовали среду DMEM-LG с содержанием глюкозы 1 г/л (Биолот, Россия), содержащую 2 мМ глутамина (MP Biomedicals, США), 1 мМ пирувата натрия, 12,5 мМ HEPES-буфера (Gibco или Sigma, США), 100 ед/мл пенициллина и 100 г/мл стрептомицина (Биолот, Россия), 10% эмбриональной телячьей сыворотки (Hyclone-Defined, США). При достижении клетками 90% монослоя проводили пассирование клеток, рассаживали в соотношении 1:3. При этом использовали 20 мМ фосфатный буфер (MP Biomedicals, США) и раствор 0,25 % трипсин/0,05 % ЭДТА (Gibco или Sigma, США). Замену среды проводили каждые 3-4 дня. Культивирование в стандартных условиях проводили при 37оС в СО2-инкубаторе (Sanyo, Япония).
Моделирование эффектов микрогравитации, экспериментальные группы. Для моделирования эффектов микрогравитации использовали две экспериментальные установки: 1) клиностат, который осуществляет рандомизацию положения объекта относительно вектора земной гравитации за счет медленного вращения (6 об/мин) объекта с постоянной скоростью вокруг горизонтальной оси (СКБ 201-12 при ИМБП, Россия) и 2) Устройство для рандомизации положения - Random Positioning Machine (RPM, Dutch Space, The Netherlands). В процессе работы RPM происходит рандомизация положения объекта относительно вектора гравитации за счет разнонаправленного вращения двух взаимоперпендикулярных рамок, к которым крепится платформа с экспериментальными образцами. Само направление вектора гравитации при этом не меняется, однако имитируется эффект снижения влияния силы тяжести на культуру клеток [van Loon, 2007].
Во всех сериях экспериментов в качестве контролей использовали клетки, культивируемые в горизонтальном положении в статическом состоянии, а для анализа вклада постоянного перешивания среды культивирования при клиностатировании или при работе RPM - на горизонтальном шейкере при 60 оборотах в минуту.
Индукция и детекция остеогенной дифференцировки ММСК костного мозга человека. Направленную остеогенную дифференцировку ММСК осуществляли по общепринятому протоколу путем культивирования клеток в среде (DMEM-LG или DMEM-advanced; Gibco, США), содержащей 10-8 М дексаметазона (Sigma, США); 10 мМ бета-глицерол-2-фосфата и 0,2 мМ 2-фосфо-L-аскорбиновой кислоты (Fluka, Германия), [Jaiswal et al., 1997]. Для эксперимента клетки рассаживали во флаконы с плотностью 2500-5000 кл/см2. Через 24 часа прикрепившиеся клетки отмывали раствором Хенкса (Sigma, США), затем флаконы полностью заполняли соответствующей средой (средой роста или остеогенной), не оставляя пузырьков воздуха, после чего дополнительно герметизировали эластичной пленкой «Парафильм», закрывали крышками и переносили на клиностат или RPM. Период культивирования составлял 10-40 суток. Эффективность остеогенеза в условиях моделирования эффектов микрогравитации оценивали на ранних и поздних этапах остеогенной дифференцировки клеток. Ранние этапы остеогенной дифференцировки клеток оценивали путем гистохимического выявления активности щелочной фосфатазы при помощи коммерческого набора «Alkaline phosphatase kit» (Sigma 86C-1kit, США) согласно инструкции производителя. Кроме того, количественная оценка процентного содержания клеток, вступивших на путь остеогенной дифференцировки, проводилась с помощью метода проточной цитофлюориметрии (проточный цитофлюориметр, Epics XL, Beckman Coulter, США) с использованием антител к щелочной фосфатазы, меченных PE (R&D, США). Активацию биосинтеза коллагена I типа в культурах остеогенных производных ММСК выявляли с помощью иммунофлюоресцентного микроскопического анализа, используя моноклональные антитела против коллагена I типа (Sigma, США). Поздние стадии остеогенеза клеток оценивали по накоплению минерализованных компонентов матрикса. Идентификацию кальциевых депозитов осуществляли путем гистохимического выявления солей кальция в культурах 40 мМ Ализариновым красным S (Alizarin red S, Sigma, США), рН 4,2 c добавлением 2,8% гидроксида аммония [Пирс, 1962].
Для оценки чувствительности остеогенных клеток-предшественников различного уровня коммитированности к моделированию эффектов микрогравитации использовали остеогенные производные ММСК, полученные путем предварительной остеогенной стимуляции. Для этого ММСК культивировали в течение 7 суток в остеогенной среде в стандартных условиях CO2-инкубатора. По прошествии 7 суток клетки пересаживали 1:1, после чего еще 3 дня поддерживали в остеогенной среде в CO2-инкубаторе, а затем культуры переносили на клиностат или RPM в соответствии с описанной выше процедурой.
Гистохимические реакции оценивали с помощью микроскопа Leica DMIL, оборудованного цифровой видеокамерой, иммунофлюоресцентное окрашивание анализировали на микроскопе Axiovert 25 (Zeiss, Германия), оснащенном цифровой видеокамерой AxioCam HRm (Zeiss, Германия).
Исследование прироста количества клеток в культурах ММСК костного мозга человека, а также в процессе коммитирования клеток к остеогенной дифференцировки проводили с помощью компьютеризированной видео-микроскопии, подсчитывая число клеток через 24, 48 и 72 часа в случайно выбранных фиксированных полях зрения фазово-контрастного микроскопа (Axiovert 25, Zeiss, Германия), оборудованного цифровой видеокамерой (AxioCam HRm, Zeiss, Германия), при помощи программы анализа изображений Sigma Scan Pro 5 (Sigma, США). В каждом флаконе с культурами просчитывали не менее восьми стационарных полей зрения, флаконы в экспериментальных группах были продублированы.
Жизнеспособность клеток оценивали по количеству апоптотических и некротических клеток методом проточной цитофлуориметрии с помощью набора ANNEXIN V-FITC Kit (Immunotech, Франция) согласно инструкции производителя. Апоптотические клетки определялись за счет высокоаффинного связывания аннексина V, меченого FITC. Некротические клетки определялись за счет происходящего при повреждении целостности клеточных мембран связывания пропидия йодида с ДНК. Иммунофенотипическую характеристику клеток проводили с помощью моноклональных антител (Beckman Coulter, Франция или Biolegend, США), меченых FITC (CD34, CD90, CD44, HLA A,B,C) и PE (CD45, CD29, CD106, HLA DR), методом проточной цитофлюориметрии (Epics XL, Beckman Coulter, США). В качестве контроля использовали пробы с добавлением неиммунных меченых FITC и PE моноклональных антител того же изотипа, что и антитела против исследуемого маркера.
Исследование количественного содержания цитокинов в кондиционированной среде культивирования проводили с помощью метода твердофазного иммуноферментного анализ, используя коммерческие наборы "Human IL-7", "Human IL-8/NAP-1", "Human TNF-" согласно инструкции производителя (BioSourse International Inc., Бельгия). Пробы кондиционированной среды культивирования ММСК и остеогенных производных ММСК отбирали каждые 10 суток.
Индукция и детекция адипогенной дифференцировки. Направленную адипогенную дифференцировку ММСК осуществляли путем культивирования клеток в среде роста DMEM-LG, либо обогащенной среде DMEM/F12 (Sigma, США), содержащей 10-6 М дексаметазона (Sigma, США), 200 µM индометацина, 0,5 мМ изобутил-метил-ксантина (Fluka, Германия) и 10 µM инсулина (Sigma, США) согласно общепринятому протоколу [Janderova et al., 2003]. Также изучали дифференцировочный потенциал полученных из ММСК престимулированных адипогенных производных. Для этого ММСК инкубировали в среде с адипогенными стимулами в течение 10 суток в стандартных условиях CO2-инкубатора, после чего коммитированные адипогенные культуры экспонировали на RPM еще 10 суток.
Эффективность адипогенеза оценивали по изменению морфологии клеток и накоплению в цитоплазме клеток липидных капель, которые визуализировали путем окрашивания с помощью 0,36% масляного красного (Oil Red O, Sigma, США). Подсчет количества окрашенных адипоцитов осуществляли в 10 случайно выбранных полях зрения микроскопа Leica DMIL, при 10-кратном увеличении объектива, используя программу анализа изображений Sigma Scan Pro 5 (Sigma, США).
Статистическая обработка результатов. В качестве характеристик полученных выборок использовали среднее, стандартное отклонение, стандартную ошибку среднего, объем выборки. Статистическую обработку результатов проводили с использованием методов вариационной статистики программы “Excel” для WinXP. Статистическую достоверность различий между двумя группами данных оценивали с помощью непараметрического критерия Манна-Уитни (для малых и средних выборок, n<30) или критерия Стьюдента (для больших выборок, n30). Межгрупповые отличия считали достоверными при p<0,05.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Характеристика культивируемых мультипотентных мезенхимальных стромальных клеток костного мозга человека.
Исследуемые клетки костного мозга человека представляли собой морфологически гомогенную популяцию адгезивных фибробластоподобных клеток, в которой были представлены клетки преимущественно веретеновидной или тригональной формы, равномерно покрывающие поверхность культурального пластика в процессе роста культуры (Рис.1). При посеве с низкой плотностью (50 кл/см2) клетки образовывали дискетные клональные колонии (Рис.2). При посеве с обычной плотностью (4000-5000 кл/см2) ранние пассажи ММСК, полученные от различных доноров, обладали похожей пролиферативной активностью, достигая стадии конфлюэнтного монослоя в среднем за 7-10 суток. Изучаемые клетки костного мозга человека экспрессировали целый ряд поверхностных мембранных антигенов (кластеров дифференцировки или CD), которые регулируют различные аспекты функционирования клеток-предшественников (адгезия, миграция, рецепция и ко-рецепция, рециркуляция), и в целом формируют характерный для ММСК иммунофенотипический профиль. В частности, у всех клеток, используемых в экспериментах, были выявлены поверхностные антигены, которые в настоящее время широко используются как позитивные критерии для идентификации ММСК [Тепляшин и др., 2005; Паюшина и др., 2006; Суздальцева и др., 2007; Pittenger et al., 1999; Conget, Minguell, 1999; Zuk et al., 2001; Majumdar et al., 2003; Wagner et al., 2005; Dominici et al., 2006], а именно: CD90 (Thy-1), CD105 (Endoglin, рецептор TGF-), CD44 (HCAM, рецептор гиалуроновой кислоты), CD29 (1-интегрин, ко-рецептор VCAM-1, фибронектина, коллагена, ламинина), CD106 (VCAM-1, молекула адгезии васкулярных клеток), CD54 (ICAM-1, молекула межклеточной адгезии, ко-рецептор 2-интегрина), HLA A,B,C, (MHC I класс), при этом клетки не экспрессировали маркеры гемопоэтических клеток, такие как HLA DR, CD34 и CD45 (Рис.3).


Рис. 1. Культура ММСК костного мозга
человека 6 пассажа,
фазовый контраст, Ув.х100.

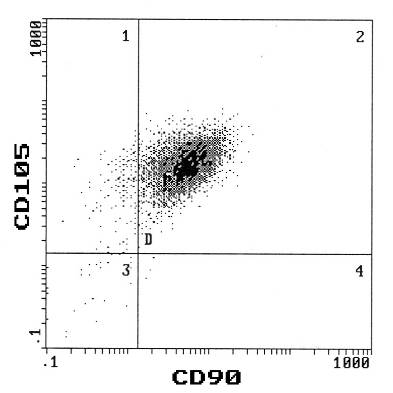




Рис. 3. Иммунофенотип ММСК костного мозга человека 7 пассажа. По оси абцисс – FITC, по оси ординат – PE, для каждого CD-кластера было проанализировано 10 тыс. клеток.
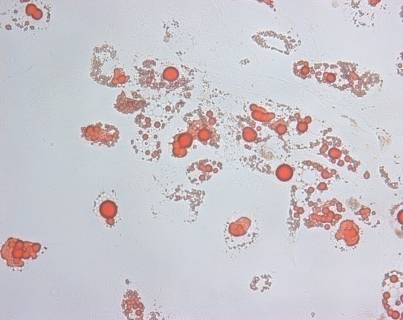





Рис. 4. Дифференцировочные потенции ММСК костного мозга человека 3 пассажа.
а - накопление и слияние липидных капель в ходе адиподифференцировки ММСК, Ув.х200; б – индуцированная активность щелочной фосфатазы в ходе остеодифференцировки ММСК, Ув.х100; в - единичные клетки, эндогенно экспрессирующие ЩФ, в культуре ММСК указаны стрелками; Ув.х100; г – эндогенная активность ЩФ в культуре остеобластов человека 9 пассажа, Ув.х100; д – отсутствие экспрессии ЩФ в культуре ММСК; е - экспрессия ЩФ в культуре остеобластов человека. (Кривая С указывает на процентное содержание позитивно окрашенных клеток в популяции).
При оценке дифференцировочного потенциала ММСК костного мозга человека была подтверждена их способность дифференцироваться в клетки мезенхимного происхождения (Рис.4, а,б), по крайней мере, по двум основным направлениям коммитирования (остеогенное, адипогенное) в ответ на присутствие соответствующих стимулов в среде культивирования [Jaiswal et al., 1997; Conget, Minguell, 1999; Pittenger et al., 1999; Janderova et al., 2003; Sekiya et al., 2004].
ММСК костного мозга человека не дифференцировались спонтанно в адипогенном направлении даже при длительном (20 суток) культивировании в среде роста. В ходе индуцированного адипогенеза клетки теряли способность к делению, приобретали сферическую или близкую к ней форму, группировались в пределах отдельных колоний или кластеров клеток, накапливающих в цитоплазме липидные включения различного размера, что соответствует фенотипу дифференцирующихся адипобластов [Janderova et al., 2003]. На поздних этапах дифференцировки мелкие липидные капли сливались в одну большую жировую каплю, заполняющую весь объем клетки (Рис.4, а). Для ММСК костного мозга человека не была характерна спонтанная инициация остеогенеза даже при длительном росте в культуре, что свидетельствует о высокой селективности метода выделения ММСК человека и чистоте популяции стволовых клеток от коммитированных остеогенных предшественников, экспрессирующих щелочную фосфатазу (ЩФ), и, как известно, обильно представленных в костном мозге. В неиндуцированном состоянии в исследуемых культурах ММСК эндогенная активность ЩФ выявлялась лишь в единичных случаях, а доля клеток, экспрессирующих мембранную форму ЩФ, не превышала 0,5-1% от всей популяции. В то же время, к примеру, у линии нормальных остеобластов человека эндогенная активность ЩФ и экспрессия мембранной формы белка была характерна для подавляющего большинства клеток (87%) в популяции (Рис.4, в,е). Под влиянием остеогенных стимулов количество клеток, в которых определялась индуцированная активность ЩФ, прогрессивно увеличивалось, при этом культуры теряли свойство останавливать дальнейший рост при достижении стадии конфлюэнтного монослоя, а ЩФ+- клетки формировали многослойные «узелки». В ходе остеогенной дифференцировки ММСК были способны проходить весь цикл от ранних остеогенных предшественников (ЩФ+) до зрелых форм, откладывающих соли кальция во внеклеточную среду и минерализующих органический матрикс, что соответствует известным представлениям об основных характеристиках остеогенеза ММСК in vitro. Таким образом, используемые клеточные культуры костного мозга человека характеризовались комплексом морфофункциональных параметров, отражающих их фенотипическую принадлежность, в частности, обладали свойственными ММСК морфологическими особенностями и высоким потенциалом к экспансии, сохраняющимся на протяжении ряда этапов субкультивирования; экспрессировали характерные поверхностные антигены и, наконец, были способны реализовать заложенные в них дифференцировочные потенции, что в совокупности свидетельствовало о сохранении и поддержании высокого уровня функциональной активности in vitro исследуемыми клетками.
Влияние клиностатирования на морфофункциональное состояние ММСК и остеогенных производных ММСК костного мозга человека.
Увеличение количества клеток в растущей клеточной линии можно рассматривать как один из информативных показателей поведения культуры, который отражает ее функциональное состояние. В результате проведенных нами исследований было установлено, что на начальных этапах экспозиции клеток на клиностате наблюдается статистически достоверное уменьшение прироста клеток, культивировавшихся как в обычной среде роста (собственно ММСК), так и в среде с добавлением остеогенных дифференцировочных стимулов (остегенные производные ММСК) (Рис.5, а,б). Было показано, что после 72 часов экспозиции клеток в условиях клиностатирования их прирост уменьшается в 4-6 раз по сравнению с группами статического контроля и шейкера.


Рис.5. Динамика роста клеток-предшественников 5 пассажа при клиностатировании. (Представлен средний прирост числа клеток в поле зрения и стандартное отклонение среднего n=18; p<0,01* - различия достоверны начиная с 24 часов воздействия, критерий Манна-Уитни). СК - статический контроль, КЛ – клиностат, Ост – значения получены при культивировании клеток в остеогенной среде.
Оценка жизнеспособности ММСК и клеток, коммитированных к остеогенной дифференцировке показала, что в условиях клиностатирования доля апоптотических и некротических клеток в популяции не увеличивается (Табл.1), что свидетельствует о том, что, несмотря на подавление роста клеток, моделирование эффектов микрогравитации с помощью клиностата не оказывает существенного влияния на их жизнеспособность.
В настоящее время высказывается мнение, что наблюдаемые реакции подавления роста остеогенных клеток в условиях микрогравитации связаны не с физической потерей числа рецепторов на мембране, которые при связывании с различными факторами роста обеспечивают переход клеток в фазу пролиферации, а скорее изменениями в системе трансдукции сигналов [Akiyama et al., 1999; Boonstra, 1999; Hughes-Fulford, 2001]. В частности эти эффекты могут быть обусловлены ингибированием сигнальных путей на уровне активности MAP-киназ (митоген-активируемых протеинкиназ), которые наряду с другими факторами вовлечены в регуляцию процессов пролиферации и остеогенной дифференцировки ММСК, тем более, что уменьшение уровня фосфорилирования ERK1/2MAPК в условиях гипогравитации и гипокинезии у коммитированных к остеогенезу ММСК было показано в некоторых работах [Zayzafoon et al., 2004; Dai et al., 2007; Pan et al., 2008]. Неспособность клеток нормально реагировать на митогенные сигналы в условиях микрогравитации в космическом полете была показана при исследовании остеобластоподобных клеток мыши линии MC3T3-E1 и нормальных остеобластов, выделенных из свода черепа цыпленка [Hughes-Fulford et al., 1996; Kacena et al., 2003]. Интересно, что ММСК человека, культивируемые в обычной среде, демонстрировали увеличение пролиферативной активности при кратковременной экспозиции на 3D-клиностате [Yuge et al., 2006].
Таблица. 1.
| группы %, клеток | AnnV+ - клетки | PI+ - клетки |
| СК | 4,9 ± 2,2 | 17,8 ± 7,2 |
| Ш | 4,0 ± 3,0 | 15,9 ± 7,6 |
| КЛ | 5,0 ± 2,0 | 18,0 ± 5,4 |
| СК Ост | 9,4 ± 7,6 | 26,6 ± 10,6 |
| Ш Ост | 7,4 ± 4,9 | 22,4 ± 3,9 |
| КЛ Ост | 7,6 ± 5,0 | 24,0 ± 7,0 |
При исследовании влияния 20-суточного клиностатирования на экспрессию некоторых поверхностных маркеров ММСК и клеток, коммитированных к остеогенной дифференцировке одновременно с началом экспозиции на клиностате, было обнаружено, что у клеток сохраняется экспрессия основных поверхностных антигенов стромальных клеток, таких как CD90, CD29 и CD44 и HLA I класса. (Табл.2), однако при остеогенном коммитировании клеток немного уменьшалась доля клеток, экспрессирующих HLA I класса. Изучение процентного содержания клеток, экспрессирующих CD106, показало, что уровень позитивно окрашиваемых клеток сильно варьирует на разных этапах культивирования ММСК, что согласуется с данными, полученными другими авторами [Анохина, Буравкова, 2007]. При этом было выявлено, что в культурах остеогенных производных ММСК, культивируемых в остеогенной среде в течение 20 суток, частично или полностью исчезает субпопуляция клеток, экспрессирующих CD106, что соответствует данным литературы [Liu et al., 2008]. Утрата экспрессии CD106 определенной долей клеток в популяции при остеогенном коммитировании ММСК может свидетельствовать о потере клетками свойства мультипотентности, так как в некоторых работах CD106 рассматривается в качестве специфического маркера именно стволовых клеток [Kolf et al., 2007]. Известно, что фибробласты кожи, используемые в ряде исследований в качестве примера терминально-дифференцированных клеток – производных мезенхимы, не обладают экспрессией CD106 и не мультипотентны [Суздальцева и др., 2007]. Кроме того, экспрессия CD106 не определяется на мезенхимных клетках-предшественниках, выделяемых из жировой ткани [Тепляшин и др., 2005; Zuk et al., 2002], что может указывать на их принадлежность к популяции коммитированных клеток-предшественников.
Таблица. 2. Иммунофенотип ММСК и остеогенных производных при клиностатировании.
| 3, 6 пассаж % клеток | CD90 (Thy-1) | CD29 (1-интегрин) | CD44 (HCAM) | HLA A,B,C (MHC-I) | CD106 (VCAM-1) | CD34 | CD45 |
| СК | 93,2 - 94,1 | 99,8 - 98,5 | 99,6 - 98,6 | 79,9 - 96,2 | 7,0 - 47,2 | 0,3 - 0,5 | 0,5 - 3,4 |
| Ш | 96,3 - 97,3 | 99,1 - 99,7 | 98,6 - 99,5 | 51,0 - 96,2 | 1,0 - 52,8 | 0,4 - 0,6 | 0,5 - 3,3 |
| КЛ | 94,2 - 96,7 | 98,8 - 99,4 | 98,1 - 99,3 | 61,4 - 94,7 | 7,4 - 29,9 | 0,6 - 1,0 | 0,5 - 2,4 |
| СК Oст | 91,0 - 96,2 | 98,3 - 99,2 | 95,9 - 98,5 | 73,0 - 84,9 | 0,1 - 16,7 | 0,2 - 0,2 | 0,1 - 3,5 |
| Ш Oст | 94,7 - 96,1 | 97,1 - 98,5 | 98,0 - 98,2 | 69,9 - 87,2 | 0,5 - 26,1 | 0,1 - 0,1 | 0,3 - 2,9 |
| КЛ Oст | 87,4 - 94,4 | 96,9 - 98,9 | 97,8 - 98,5 | 72,9 - 86,0 | 1,4 - 16,3 | 0,3 - 0,3 | 0,3 - 2,3 |
Для каждого CD-кластера было проанализировано 2-5 тыс. клеток. СК – статический контроль, Ш – шейкер, КЛ – клиностат, Ост – значения получены после 20-суточного культивирования клеток в остеогенной среде.
Гуморальные факторы, формирующие систему межклеточного взаимодействия, включают разнообразные метаболиты клеток. Цитокины являются наиболее универсальным классом внутри- и межтканевых «коммуникаторов» широкого спектра действия [Пальцев, Иванов, 1995]. Однако вопрос о вовлеченности ММСК и остеогенных клеток-предшественников в систему аутокринной и паракринной регуляции в условиях измененной гравитации остается открытым.
При анализе продукции интерлейкинов ММСК и остеогенными производными стромальных клеток было показано, что длительная (10 и 20 сут) экспозиция клеток на клиностате не приводит к активации продукции ИЛ-7 и TNF-, которые в культурах контрольных и опытных клеток не выявляются. Исследования показали, что 10-суточная экспозиция клеток на клиностате не приводит к значимым изменениям продукции ИЛ-8 в среду культивирования как ММСК, так и клеток, которые росли в среде, содержащей остеогенные стимулы. Продукция ИЛ-8 в культуре ММСК за 10 суток культивирования в среднем составляла 22,0±11,6 pg/ml в группе статического контроля, 23,3±14,4 pg/ml в группе клеток, экспонированных на шейкере, и 24,5±10,6 pg/ml в культуре клиностатируемых клеток. Однако более длительное клиностатирование приводило к значительной активации продукции ИЛ-8 в среду культивирования клеток. В стандартной среде роста продукция ИЛ-8 при клиностатировании в течение 20 суток возрастала в 1,4-2 раза для ММСК различных пассажей; в остеогенной - в 2,7-3,2 раза (Рис.6).
Таким образом, на поздних этапах экспозиции клеток в условиях клиностатирования происходит активация секреции провоспалительного нейтрофил-активирующего фактора - интерлейкина-8, вырабатываемого ММСК и их остеогенными производными. Этот факт, по-видимому, указывает на возможность протекания отсроченных стрессорных реакций как в популяциях низкодифференцированных, так и в более зрелых культурах остеогенных клеток-предшественников и может отражать ответную реакцию клеток мезенхимного происхождения на изменение физических параметров среды обитания.


Рис. 6. Продукция ИЛ-8 при клиностатировании в течение 20 суток. (а) – ММСК, (б) – остеогенные производные ММСК. (M±SD), СК – статический контроль, Ш – шейкер,
КЛ – клиностат.
Влияние клиностатирования на дифференцировочный потенциал ММСК и коммитированных клеток-предшественников.
По общему мнению, щелочная фосфатаза является наиболее ранним и характерным маркером остеобластического коммитирования клеток. При оценке влияния клиностатирования на начальные этапы остеогенной дифференцировки ММСК было показано, что в ходе приобретения клетками остеобластического фенотипа в условиях моделирования эффектов микрогравитации в течение 10-20 суток число клеток, экспрессирующих на своей поверхности ЩФ, существенно не отличается от наблюдаемого в группе клеток, культивируемых в статических условиях. Тем не менее, исследования показали, что в группе клеток, вступивших на путь дифференцировки при культивировании на шейкере, количество ЩФ+- клеток в среднем на 10% выше чем в других экспериментальных группах, что свидетельствует о стимулирующем влиянии перемешивания среды культивирования на начальные этапы дифференцировки ММСК в остеобласты (Рис.7, а,б).
В противовес полученным нами данным, при изучении влияния 3D-клиностатирования на остеогенную дифференцировку нормальных остеобластов человека было обнаружено, что определенные показатели дифференцировки клеток, такие как активность ЩФ, образование костных узелков, а также минерализация матрикса, значительно редуцируются [Yuge et al., 2003]. Аналогичное ингибирование активности ЩФ наблюдалось и при кратковременной экспозиции остеобластов мыши линии 2T3 на RPM [Pardo et al., 2005]. Высказывается предположение, что подавление начальных этапов остеогенной дифференцировки клеток-предшественников в условиях моделирования эффектов микрогравитации обусловлено изменениями в уровне активности киназы p38МАРК [Yuge et al., 2003] или киназы ERK МАРК [Zayzafoon et al., 2004].


Рис. 7. Индуцированная экспрессия мембранной формы щелочной фосфатазы. (а) – экспозиция 10 суток, (б) – экспозиция 20 суток. (M±m, суммарные данные четырех независимых экспериментов, в каждом из которых анализировали 5-10 тыс клеток). СК - статический контроль, Ш - шейкер,
Кл - клиностат.



А



Б


С
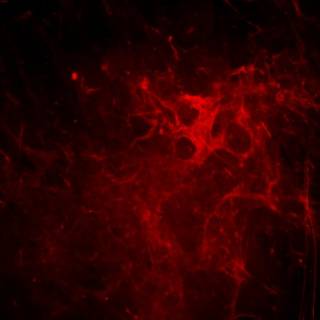
Следующий этап нашего исследования был посвящен оценке «качества» органических и неорганических компонентов внеклеточного матрикса. Небольшое количество коллагена I типа в цитоплазме клеток выявлялось и в культурах нестимулированных ММСК (Рис.8, А). Под влиянием остеогенных стимулов в культуре клеток значительно возрастала внеклеточная продукция коллагена, с формированием трехмерной разветвленной сети органического матрикса. Как показано на Рис. 8, в контрольных группах клеток внеклеточный матрикс был достаточно хорошо структурирован. Островки коллагенового матрикса были мельче и аморфнее в опытной группе клеток после 10 суток экспозиции на клиностате. Интересно, что к 20-м суткам экспозиции описанные различия практически исчезали. Таким образом, клиностатирование, вероятно, оказывало ингибирующее влияние, по крайней мере, на определенные этапы индуцированной остеогенной дифференцировки ММСК в ходе коммитирования клеток к остеогенезу в условиях моделирования эффектов микрогравитации, что выражалось в ухудшении биосинтеза коллагена I типа и сопутствующем уменьшении зон, занимаемых внеклеточным матриксом.


А


Б

На 30-40 сутки постоянного культивирования клеток в среде, содержащей остеогенные стимулы, в культурах остеогенных производных ММСК выявлялись очаги аморфного фосфатно-кальциевого вещества. В дальнейшем очаги кальциевой минерализации сливались друг с другом, превращая образованный коллагеном остеоид в обезыствленный костный матрикс, в результате чего культуры остеогенных производных ММСК оказывались «замурованы» в минерализованное межклеточное вещество. При оценке интенсивности кальцификации матрикса в растущих остеогенных культурах ММСК, последовательно прошедших все этапы остеогенеза в условиях клиностатирования, вопреки ожиданиям, не было выявлено значимых отличий в уровне кальциевой минерализации матрикса по сравнению с контролем, а сама интенсивность минерализации была достаточно низкой во всех экспериментальных группах (Рис. 9, А). Однако в случае экспозиции на клиностате престимулированных остеогенных производных ММСК, на аналогичных временных сроках экспозиции, процесс кальцификации в клиностатируемых культурах, хотя и не полностью, но подавлялся, что свидетельствует о замедлении терминальных этапов дифференцировки остеогенных клеток-предшественников в остеобласты в условиях клиностатирования (Рис. 9, Б).
При анализе адипогенного дифференцировочного потенциала ММСК костного мозга человека было отмечено, что эффективность адипогенеза после 20 суток воздействия адипогенных стимулов была сходной как в клиностатируемых, так и в контрольных культурах адипогенных производных (Рис. 10). При этом количество формирующихся адипоцитоподобных клеток было примерно равным в группах статического контроля и клиностата и немного сниженным при культивировании клеток на шейкере, что хорошо согласуется с фактом увеличения эффективности коммитирования клеток в остеогенном направлении в этом случае. Таким образом, моделирование эффектов микрогравитаци с помощью клиностатирования не оказывало заметного влияния на адипогенную дифференцировку ММСК костного мозга человека.
Морфофункциональное состояние ММСК и остеогенных производных ММСК в условиях моделирования эффектов микрогравитации с помощью RPM.
Динамику роста клеток костного мозга человека в условиях моделирования эффектов микрогравитации с помощью RPM, как и при клиностатировании оценивали в течение первых трех суток экспозиции. Было показано, что при моделировании эффектов микрогравитации также наблюдается статистически достоверное уменьшение клеточного прироста, как собственно ММСК, так и при коммитировании ММСК к остеогенезу (p<0,01, критерий Манна-Уитни, Рис 11). Уменьшение прироста клеток относительно контрольных групп составило 1,6-2 раза. Такое же угнетение клеточного прироста наблюдалось и в культурах нормальных остеобластов человека, культивируемых в обычных условиях и в среде, содержащей остеогенные стимулы.


Рис. 11. Динамика роста клеток при моделировании эффектов микрогравитации с помощью RPM. (Данные репрезентативного эксперимента с клетками 3 пассажа, представлен средний прирост числа клеток в поле зрения и стандартное отклонение среднего, n=16; p<0,01* - различия достоверны по критерию Манна-Уитни). СК - статический контроль, Ш – шейкер, Ост – значения получены при культивировании клеток в остеогенной среде.
При проведении иммунофенотипической характеристики ММСК костного мозга человека и клеток, коммитированных к остеогенной дифференцировке в условиях моделирования эффектов микрогравитации с помощью RPM, было показано, что доля клеток, экспрессирующих основные поверхностные антигены стромальных клеток - CD90, CD29 и CD44 остается постоянной, а экспрессия гемопоэтических маркеров CD45 и HLA DR не активируется (Табл.3). Было обнаружено, что экспозиция клеток на RPM не влияет на процентное содержание клеток, экспрессирующих CD106, однако при коммитировании ММСК к остеогенезу в условиях измененной гравитации доля клеток, экспрессирующих HLA I класса была на 10-20% выше по сравнению со значениями в контрольных группах клеток, что, вероятно, можно рассматривать как сохранение менее дифференцированного состояния культуры. Несмотря на отсутствие выраженных модификаций иммунофенотипа изучаемых клеток при длительном моделировании эффектов микрогравитации, существуют данные, указывающие на возможность таких изменений при кратковременных экспозициях. Так, в одной из работ было продемонстрировано, что 7-суточная экспозиция ММСК человека на 3D-клиностате приводит к увеличению доли клеток в популяции, экспрессирующих CD90/CD29 и CD90/CD44 [Yuge et al., 2006]. Интересно, что 5-суточное пребывание нормальных остеобластов крысы в условиях микрогравитации приводило к увеличению уровня мРНК CD44, при этом экспрессия 1-интегрина (CD29) в клетках не изменялась [Kumei et al., 2006].
Таблица. 3. Иммунофенотип ММСК и остеогенных производных при
моделировании эффектов микрогравитации с помощью RPM в течение 20 суток.
| 3,6 пассаж % клеток | CD90 (Thy-1) | CD29 (1-интегрин) | CD44 (HCAM) | HLA A,B,C (MHC-I) | CD106 (VCAM-1) | HLA DR (MHC-II) | CD45 |
| СК | 90,5 - 97,6 | 23,1 - 99,2 | 94,1 | 74,4 - 95,5 | 7,3 – 33,6 | 0,0 | 1,1 |
| Ш | 82,3 - 96,0 | 21,6 - 98,8 | 90,1 | 68,5 – 97,1 | 10,6 – 21,5 | 0,1 | 0,4 |
| RPM | 72,9 - 95,8 | 27,1 - 98,1 | 93,5 | 87,1 – 97,8 | 10,5 - 22,2 | 0,4 | 0,1 |
| СК Oст | 95,0 - 96,9 | 89,3 - 94,8 | 86,9 | 51,6 – 61,2 | 0,1 - 0,8 | 0,0 | 0,3 |
| Ш Oст | 89,3 - 91,1 | 91,2 - 85,0 | 87,5 | 52,9 - 50,0 | 0,6 - 1,0 | 0,1 | 0,1 |
| RPM Oст | 84,1 – 94,1 | 94,1 – 94,5 | 88,2 | 62,6 - 73,9 | 0,0 - 1,9 | 0,3 | 0,2 |
Для каждого CD-кластера было проанализировано 2-5 тыс. клеток. СК – статический контроль,
Ш – шейкер, КЛ – клиностат, Ост – значения получены после 20-суточного культивирования клеток в остеогенной среде.
Изучение уровня выработки ИЛ-8 в культурах ММСК и остеогенных производных ММСК различного уровня коммитированности показало, что экспозиция клеток на RPM в отличие от клиностатирования приводит к более ранней активации его продукции, однако эта активация была выражена в разной степени у ММСК различных пассажей. Так, культуры ММСК 3 пассажа экспонированные на RPM в течение 10 суток, вырабатывали 184,3±44,3 pg/ml ИЛ-8, против 25,1±6,1 pg/ml в группе статического контроля, а клетки 6 пассажа в опытной группе - 36,2±0,6 pg/ml против 16,4±0,2 pg/ml ИЛ-8. Кроме того, престимулированные остеогенные производные ММСК характеризовались более высоким уровнем продукции ИЛ-8, в опытной группе продукция ИЛ-8 составляла 1101±21,0 pg/ml, а в контрольной 632,5±5,5 pg/ml. Известно, что продукция ИЛ-8 у ММСК возрастает в результате реакции на циклическое механическое растяжение, при этом клетки, культивируемые в остеогенной среде, показывают максимально выраженное повышение продукции ИЛ-8, что свидетельствует о важной роли данного цитокина в механизмах клеточной механочувствительности [Sumanasinghe et al., 2008]. Интересно, что многократная активация продукции ИЛ-8 была выявлена у эндотелиальных клеток при моделировании эффектов микрогравитации c помощью RPM [Ulbrich et al., 2008], что указывает на потенциальное участие данного цитокина в паракринных реакциях различных типов клеток в этих условиях.
Дифференцировочный потенциал ММСК и коммитированных клеток-предшественников при моделировании эффектов микрогравитации с помощью RPM.
При исследовании уровня экспрессии ЩФ при коммитировании ММСК к остеогенезу в условиях моделирования эффектов микрогравитации с помощью RPM в течение 10-20 суток было выявлено достоверное уменьшение процентного содержания клеток на поверхности которых обнаруживается ЩФ (Рис.12). Максимальная доля ЩФ+-клеток в популяции выявлялась в остеогенных культурах, которые росли и дифференцировались в условиях перемешивания среды культивирования с помощью шейкера, группа статического контроля занимала промежуточное положение, и наконец, минимальное количество ЩФ+-клеток было выявлено при экспозиции клеток на RPM. Таким образом, многомерная рандомизация положения культуры клеток относительно вектора гравитации с помощью RPM значительно ухудшала эффективность начальных этапов остеобластической фенотипической трансформации ММСК.


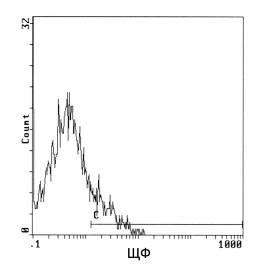
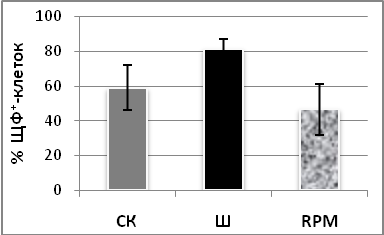
А Б
Рис. 12. Индуцированная экспрессия щелочной фосфатазы. А – экспозиция 10 суток, Б - 20 суток.
(M±m, данные четырех независимых экспериментов, в каждом из которых анализировали 5-10 тыс кл., p<0,05* - различия достоверны по сравнению с шейкером, критерий Манна-Уитни). СК - статический контроль, Ш - шейкер. (Кривая С указывает на процентное содержание окрашенных клеток в популяции).
При изучении выработки и структурной организации органического матрикса, образуемого в ходе остеогенной дифференцировки ММСК, было обнаружено, что у клеток, культивировавшихся в течение 10 суток в среде с остеогенными стимулами в статических условиях и на шейкере, коллагеновый матрикс был хорошо структурирован, отчетливо проявлялась его характерная зигзагообразная организация. В то же время, островки коллагенового матрикса практически отсутствовали при экспозиции клеток на RPM на тех же временных сроках. Интересно, что к 20-м суткам культивирования клеток в остеогенной среде описанные различия в структурной организации коллагенового матрикса между контрольными и опытными культурами немного сглаживались, но полностью не исчезали (Рис.13).



А Б
Рис. 13. Структурная организация внеклеточного коллагенового матрикса в культурах остеогенных производных ММСК. А – экспозиция 10 суток; Б – экспозиция 20 суток (а, в - статический контроль; б, г - RPM). Ув.х200.
При оценке поздних этапов остеогенной дифференцировки в культурах ММСК, последовательно прошедших все этапы остеогенеза при их экспозиции на RPM, при общем достаточно низком уровне кальцификации матрикса во всех экспериментальных группах между ними не было выявлено значимых отличий. Изучение формирования очагов кальцификации в культурах престимулированных остеогенных производных ММСК показало, что минерализация матрикса на определенных сроках экспозиции на RPM в культурах полностью отсутствует (Рис. 14, А). Мелкие островки кальциевого вещества обнаруживались в опытных культурах на гораздо более поздних этапах культивирования. В контрольных группах клеток в это же время очаги кальциевой минерализации сливались друг с другом, в результате чего до ~99% площади поверхности клеточных культур было «замуровано» в минерализованное межклеточное вещество, то есть процесс остеогенной дифференцировки клеток был на завершающих стадиях (Рис. 14, Б). Интересно, что примерно такая же картина наблюдалась и в культурах остеобластов, которые экспонировали на RPM c одновременной остеогенной стимуляцией, с той лишь разницей, что сам процесс формирования минерализованного матрикса происходил у них в более короткие сроки (Рис.14, С).
Таким образом, длительная экспозиция клеток различного уровня коммитированности на RPM приводила подавлению конечных этапов индуцированного остеогенеза как остеогенных производных ММСК, так и остеобластов, что, вероятно, свидетельствует об универсальном характере клеточных реакций на пребывание в условиях моделирования эффектов микрогравитации.



(А) Остеогенные производные ММСК



(Б) Остеогенные производные ММСК



(С) Остеобласты



Рис.15. Морфология адипоцитоподобных клеток, образованных в ходе адипогенеза
адипогенных производных ММСК в условиях моделирования эффектов микрогравитации
с помощью RPM в течение 10 суток. а – статический контроль, б – шейкер, в – RPM. Ув.х100.


Рис.16. Эффективность индуцированного адипогенеза ММСК (а) и адипогенных производных ММСК костного мозга человека (б) в условиях моделирования эффектов микрогравитации с помощью RPM. (Репрезентативные данные, представлено среднее значение числа клеток в поле зрения и стандартное отклонение среднего, n=10), СК - статический контроль, Ш - шейкер.
Исследования показали, что морфологические характеристики адипоцитоподобных клеток и эффективность индуцированной адипогенной дифференцировки ММСК, а также их престимулированных производных после 20 суток воздействия адипогенных стимулов не изменялись при экспозиции клеток в условиях моделирования эффектов микрогравитации с помощью RPM (Рис. 15, 16). Таким образом, несмотря на некоторые теоретические предпосылки, свидетельствующие о возможности активации адипогенной дифференцировки ММСК в условиях микрогравитации [Zayzafoon et al., 2004], на основании полученных данных можно заключить, что индуцированная адипогенная дифференцировка ММСК в отличие от индуцированной остеогенной дифференцировки не изменяется при моделировании эффектов микрогравитациии.
ВЫВОДЫ
1) Подобраны оптимальные режимы культивирования и индукции дифференцировки мультипотентных мезенхимальных стромальных клеток костного мозга человека (ММСК) и коммитированных клеток-предшественников на горизонтальном клиностате и Устройстве для рандомизации положения (RPM), которые позволяют воспроизводить эффекты влияния микрогравитации на культивируемые клетки в наземных условиях.
2) Моделирование эффектов микрогравитации приводит к изменению кинетики роста ММСК, а также коммитированных к остеогенезу клеток-предшественников. Прирост количества клеток после 72 часов экспозиции достоверно снижается в 4 - 6 раз при клиностатировании и в 1,6 - 2 раза при рандомизации положения культуры клеток с помощью RPM.
3) В условиях длительного моделирования эффектов микрогравитации (20 суток) ММСК и их остеогенные производные сохраняют экспрессию основных поверхностных антигенов стромальных клеток - CD29, CD90, CD44 и не экспрессируют гемопоэтические маркеры - CD34, CD45, HLA DR. Доля клеток, экспрессирующих рецептор адгезии CD106 значительно уменьшается при остеогенной дифференцировке ММСК. При коммитировании ММСК к остеогенезу моделирование эффектов микрогравитации с помощью RPM, но не клиностата, приводит к увеличению числа клеток, экспрессирующих HLA A,B,C.
4) Длительное моделирование эффектов микрогравитации приводит к возрастанию (1,7 - 3,2 раза) продукции интерлейкина-8 в культурах ММСК и их остеогенных производных, при этом моделирование эффектов микрогравитации с помощью RPM стимулирует продукцию ИЛ-8 на более ранних этапах экспозиции.
5) При коммитировании ММСК к остеогенезу в условиях моделирования эффектов микрогравитации с помощью RPM наблюдается достоверное уменьшение числа клеток, экспрессирующих щелочную фосфатазу, что свидетельствует о подавлении начальных этапов дифференцировки ММСК в остеобласты.
6) В условиях длительного моделирования эффектов микрогравитации ухудшается «качество» основных структурных компонентов костного матрикса. В ходе коммитирования ММСК к остеогенезу замедляется выработка коллагена I типа клетками, что сопровождается последующими изменениями в структурной организации органического матрикса. При экспозиции более дифференцированных остеогенных клеток снижается уровень кальциевой минерализации матрикса.
7) Длительное моделирование эффектов микрогравитации не влияет на эффективность индуцированной адипогенной дифференцировки ММСК и коммитированных адипогенных производных ММСК.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
• Для моделирования эффектов микрогравитации в наземных условиях рекомендуется использование Устройства для рандомизации положения культуры клеток относительно вектора земной гравитации – Random Positioning Machine (RPM).
• Для изучения молекулярно-клеточных механизмов дифференцировки стволовых клеток и остеогенных клеток-предшественников рекомендуется применять способ рандомизации положения объекта относительно вектора земной гравитации с помощью RPM, который имеет преимущество перед горизонтальным клиностатированием за счет меньшего вклада посторонних факторов, таких как перемешивание среды культивирования и действие центробежных сил, и более эффективной имитации влияния микрогравитации на культивируемые клетки-предшественники.
• Экспозиция клеток-предшественников на RPM способствует сохранению менее дифференцированного состояния культуры клеток, в связи с чем может быть рекомендована к использованию для предупреждения процессов спонтанной или индуцированной дифференцировки клеток в остеогенном направлении.
• Для изучения фактора силы сдвига жидкости и активации ранних этапов процесса коммитирования ММСК в остеогенном направлении целесообразно применять культивирование клеток на горизонтальном орбитальном шейкере при 60 об/мин, при условии полного заполнения культуральных флаконов средой.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО МАТЕРИАЛАМ ДИССЕРТАЦИИ
Статьи в журналах:
1) Морфофункциональное состояние и остеогенный дифференцировочный потенциал мезенхимальных стромальных клеток-предшественников человека при моделировании эффектов микрогравитации in vitro. Клеточные технологии в биологии и медицине. 2007. №4. С. 196-202. (Соавтор: Буравкова Л.Б.).
2) Продукция интерлейкинов в культуре мезенхимальных стромальных клеток человека при моделировании эффектов микрогравитации. Авиакосмическая и экологическая медицина. 2009. №3. С. 43-46. (Соавтор: Буравкова Л.Б.).
3) Cultured stem cells are sensitive to gravity changes. Acta Astronautica. 2008. №63. P. 603-608. (Co-authors: Buravkova L.B., Romanov Yu.A., Konstantinova N.A., Buravkov S.V., Grivennikov I.A.).
4) The primary effects of prolonged gravity vector randomization (2D-clinorotation) on precursor’s cells in vitro. Jornal of Gravitational Physiology. 2007. Vol. 14. №1. Р. 133-134. (Co-authors: Konstantinova N.A., Buravkova L.B., Gershovich P.M.).
Тезисы конференций:
5) Влияние рандомизации вектора гравитации на морфофункциональные характеристики клеток-предшественников мезенхимального ряда in vitro. V Международный Симпозиум «Актуальные проблемы биофизической медицины». Киев. 2007. С. 45. (Соавторы: Гершович П.М., Буравкова Л.Б.).
6) Адипогенная дифференцировка мезенхимальных стромальных клеток из костного мозга человека в условиях рандомизации вектора гравитации in vitro. 6-я Конференция молодых учёных и специалистов, аспирантов и студентов, посвящённая дню Космонавтики. Москва. 2007. С. 17.
7) The primary effects of prolonged gravity vector randomization (2D-clinorotation) on precursor’s cells in vitro. 28th Annual International Gravitational Physiology Meeting. Сан-Антонио, США. 2007. С. 117. (Co-authors: Konstantinova N.A., Gershovich P.M., Buravkova L.B.).
8) Влияние 3D-клиностатирования на индуцированную остеогенную дифференцировку различных культивируемых остеогенных клеток-предшественников человека. 7-я Конференция молодых учёных и специалистов, аспирантов и студентов, посвящённая дню Космонавтики. Москва. 2008. С. 14-15.
9) Reduced osteogenesis of human osteogenic precursors' cells cultured in the random positioning machine. 29th Annual International Gravitational Physiology Meeting. Анже, Франция. 2008. С. 51. (Co-author: Buravkova L.B.).
10) Мультипотентные мезенхимальные стромальные клетки костного мозга человека как модель для изучения гравирецепции клеток в культуре. 1-я конференция «Методы культивирования клеток». Санкт-Петербург. 2008. С. 799-800. (Соавторы: Гершович П.М., Буравкова Л.Б.).
11) Гравирецепция в культуре мезенхимальных клеток-предшественников. Тезисы докладов. 12-я международная Пущинская школа-конференция молодых ученых. «Биология-наука XXI века». Пущино. 2008. С. 172. (Соавторы: Гершович П.М., Буравкова Л.Б.).
СПИСОК СОКРАЩЕНИЙ
ИЛ-8 – интерлейкин-8
ММСК – мультипотентные мезенхимальные стромальные клетки
ЩФ – щелочная фосфатаза
FITC – флюоресцеинизотиоционат
PE – фикоэритрин
RPM – Random Positioning Machine
TNF- – фактор некроза опухолей альфа

