Механизмы нарушения программированной гибели лимфоцитов при хронических вирусных гепатитах
На правах рукописи
Михеев Сергей Леонидович
МЕХАНИЗМЫ НАРУШЕНИЯ
ПРОГРАММИРОВАННОЙ ГИБЕЛИ ЛИМФОЦИТОВ
ПРИ ХРОНИЧЕСКИХ ВИРУСНЫХ ГЕПАТИТАХ
14.00.16 – патологическая физиология
03.00.25 – гистология, цитология, клеточная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Томск - 2006
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научные руководители:
доктор медицинских наук Рязанцева
Наталья Владимировна
доктор медицинских наук, профессор, Новицкий
академик РАМН, Вячеслав Викторович
Заслуженный деятель науки РФ
Официальные оппоненты:
доктор медицинских наук, профессор Степовая
Елена Алексеевна
доктор медицинских наук, профессор, Шкурупий
академик РАМН Вячеслав Алексеевич
Ведущая организация:
ГУ НИИ физиологии Cибирского отделения РАМН, г. Новосибирск
Защита состоится «___» ноября 2006 г. в _______часов на заседании диссертационного совета Д 208.096.01 при Сибирском государственном медицинском университете (634050, г. Томск, ул. Московский тракт, 2)
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета (634050, Томск, пр. Ленина, 107)
Автореферат разослан «___» октября 2006 г.
| Ученый секретарь диссертационного совета |  | Суханова Г.А. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Хронические вирусные гепатиты являются одной из наиболее актуальных медицинских проблем. Заболеваемость хроническими вирусными гепатитами В и С, а также смертность от их осложнений (цирроз печени, гепатоцеллюлярная карцинома) в Российской Федерации и в мире в целом достигли высокого уровня: по данным Всемирной организации здравоохранения (ВОЗ), в мире ежегодно заболевают гепатитом В около 50 млн человек, умирают от его осложнений – до 2 млн человек; около 500 млн являются хроническими носителями вируса гепатита С [Ивашкин В.Т. и др., 2001; Williams I.T. et al., 2004; Chang M.H., 2006; Shepard C.W. et al., 2006].
Ключевую роль в иммунопатогенезе хронических вирусных гепатитов В и С отводят нарушению Т-клеточного иммунного ответа. Нарушение межклеточной кооперации иммунокомпетентных клеток, их субпопуляционный дисбаланс, нарушения функциональных свойств лимфоцитов, а также высокая изменчивость вирусных эпитопов способствуют длительной персистенции вирусов гепатита В и С в организме [Kao H.J. et al., 1995; Игнатова Т.М., Серов В.В., 2000; Toren F. et al., 2004]. К числу факторов, поддерживающих длительную персистенцию вирусов гепатита В и С, относится и способность вирусов к репликации в клетках лимфоидных органов (лимфоузлов, селезенки), а также в мононуклеарах периферической крови [Sugiyama K. et al., 1997; Лакина Е.И., Кущ А.А., 2002].
Фундаментальным механизмом регуляции иммунной системы является процесс апоптоза иммунокомпетентных клеток. Программированная гибель иммунокомпетентных клеток служит одним из основных способов селекции и дифференцировки лимфоцитов на всех стадиях их развития; с ее помощью осуществляется элиминация аутореактивных клонов [Ярилин А.А., 1996; Кадагидзе З.Г., 2003]. Активация процесса апоптоза лимфоцитов происходит в «иммунопривилегированных» зонах, а также в процессе старения клеток иммунной системы [Aggarwal S., Gupta S., 1998; Grullich C. et al., 2005].
Одним из важных механизмов формирования хронической инфекции является модуляция процессов апоптоза [Маянский А. Н., 1998; Feitelson M.A. et al., 1998; Аббасова С. Г., 1999; Freeman A.J. et al., 2001]. С одной стороны, индукция апоптоза чувствительных к действию вирусов гепатита В и С клеток может рассматриваться как механизм осуществления вирусного цитопатического действия [Kalkeri G. et al., 2001; Pianko S. et al., 2001]; активация программированной гибели иммунокомпетентных клеток - как механизм угнетения противовирусного иммунного ответа [Исаева М. П., 1998; Ehrmann J.Jr., 2000; Taya N. et al., 2000]. С другой стороны, модуляция программированной гибели клеток при хроническом вирусном гепатите может явиться результатом воздействия активированных иммуноцитов. Так, индукция апоптоза цитотоксическими Т-лимфоцитами и NK-клетками представляет собой основной механизм элиминации инфицированных мононуклеаров крови и гепатоцитов [Vaux D. L., Korsmeyer S. J., 1999]. Кроме того, запуск программы самоликвидации клетки в ответ на повреждение ее генома при инфицировании является ключевым защитным механизмом, препятствующим распространению вирусного агента [Маянский А. Н., 1998; Feitelson M.A. et al., 1998].
Существует несколько путей проведения апоптогенного сигнала (рецепторный, р53-зависимый, митохондриальный и др.). Первый из них опосредован физиологическими индукторами, действие которых осуществляется через мембранные рецепторы семейства TNFR (рецептор фактора некроза опухолей) – CD95, TNFR1, DR3, DR4, DR5 и другие «рецепторы смерти» [Thornbery N.A., Lazebnik Y., 1998]. Второй путь запуска танатогенной программы клеткой реализуется через активацию белка Р53, экспрессия которого повышается, в первую очередь, при нарушении целостности генетического аппарата клетки, например, при неадекватной работе системы ДНК-репарации [Tsujimoto J., Shimizu S., 2000]. Наконец, митохондриальный путь запуска апоптоза реализуется путем открытия гигантских пор в мембране митохондрий с последующим поступлением проапоптогенных факторов (цитохром С, APAF-1 и др.) в цитоплазму и запуском каспазного каскада. Открытие гигантских пор является потенциал-зависимым процессом, который регулируется группой мембранных белков семейства Bcl-2, часть которых проявляет проапоптогенные функции, а часть – блокирует запуск апоптоза [Gross A. et al., 1999]. В то же время накопленные к настоящему времени фактические данные о модуляции апоптоза лимфоцитов in vivo у пациентов с хроническими вирусными гепатитами В, С и В+С весьма фрагментарны и во многом являются противоречивыми.
Учитывая важную роль дизрегуляции апоптоза иммунокомпетентных клеток в генезе иммунных расстройств у пациентов с хроническим вирусным гепатитом В, С и В+С, изучение механизмов нарушения программированной гибели лимфоцитов у этой категории больных может быть положено в основу разработки новых эффективных методов профилактики и терапии персистентных вирусных инфекций.
Цель исследования: оценить состояние ключевых путей регуляции программированной гибели лимфоцитов крови у больных хроническими вирусными гепатитами В, С и В+С.
Для достижения поставленной цели были сформулированы следующие задачи исследования:
- Выявить общие закономерности и особенности реализации программированной гибели лимфоцитов крови у больных хроническими вирусными гепатитами В, С и В+С с учетом этиологического фактора, длительности заболевания, выраженности фиброза и активности воспалительного процесса в паренхиме печени.
- Оценить содержание Fas-R-позитивных лимфоцитов крови у больных в зависимости от особенностей клинического течения хронических вирусных гепатитов В, С и В+С.
- Оценить состояние митохондриального пути запуска апоптоза лимфоцитов крови у больных хроническими вирусными гепатитами В, С и В+С.
- Определить активность системы эксцизионной репарации ДНК лимфоцитов крови у больных хроническими вирусными гепатитами В, С и В+С.
Научная новизна. Впервые с использованием современных молекулярно-биологических и иммунологических подходов проведено комплексное исследование состояния ключевых путей регуляции апоптоза иммунокомпетентных клеток периферической крови при хронических вирусных гепатитах В, С и В+С в зависимости от этиологического фактора, степени активности воспалительного процесса, стадии фиброза паренхимы печени и длительности заболевания. Установлено, что формирование хронического вирусного гепатита В, С и В+С сопровождается выраженными нарушениями регуляции апоптоза лимфоцитов периферической крови. Впервые установлен факт активации Fas-рецепторного и р53-опосредованного путей запуска программированной гибели лимфоцитов крови у больных хроническим вирусным гепатитом В. Получены новые данные, свидетельствующие об угнетении реализации апоптотической гибели лимфоцитов у больных хроническим вирусным гепатитом С и В+С, несмотря на активацию митохондриального пути запуска апоптоза, повышение уровня экспрессии Fas-R и снижение активности системы эксцизионнной репарации ДНК.
Теоретическая и практическая значимость. Полученные в результате проведенного исследования фактические данные носят фундаментальный характер и описывают ключевые механизмы нарушения программированной гибели лимфоцитов крови у больных хроническими вирусными гепатитами В, С и В+С. Результаты работы позволяют обозначить новые патогенетические аспекты формирования и поддержания хронической вирусной инфекции. Основные положения исследования могут служить основой для дальнейшего изучения патогенетических механизмов персистенции вирусов гепатита В и С, а также для разработки новых патогенетически обоснованных технологий терапии хронических гепатитов и предупреждения хронизации острого инфекционного процесса, вызванного вирусами гепатита В и С, новых подходов в профилактике осложнений заболевания.
Положения, выносимые на защиту:
1. Дизрегуляция процессов программированной гибели лимфоцитов является важным патогенетическим механизмом дисбаланса Т-клеточного звена иммунитета при хроническом течении вирусных гепатитов В, С и В+С.
2. Выраженность угнетения апоптоза лимфоцитов крови у больных хроническими вирусными гепатитами С и В+С определяется длительностью заболевания и степенью активности воспалительного процесса в паренхиме печени.
3. У больных хроническими вирусными гепатитами В, С и В+С индуцированы Fas-зависимый и р53-опосредованный пути регуляции апоптоза лимфоцитов.
4. При хронических вирусных гепатитах С и В+С нарушен митохондриальный путь запуска программированной гибели лимфоцитов крови.
Апробация и реализация работы. Результаты проведенных исследований докладывались и обсуждались на 5-ом Конгрессе «Современные проблемы аллергологии, иммунологии и иммунофармакологии» (Москва, 2002), Второй международной конференции «Патофизиология и современная медицина» (Москва, 2004), Межрегиональной научной конференции, посвященной 100-летию со дня рождения академика АМН СССР С.П. Карпова (Томск, 2003), Второй Всероссийской конференции «Компенсаторно-приспособительные процессы: фундаментальные, экологические и клинические аспекты» (Новосибирск, 2004), V международном конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2004), Межгородской конференции «Актуальные проблемы патофизиологии» (Санкт-Петербург, 2005), Второй Международной конференции «Патофизиология и современная медицина» (Москва, 2004), IV съезде Научного общества гастроэнтерологов России (Москва, 2004), Межгородской конференции «Актуальные проблемы патофизиологии» (Санкт-Петербург, 2005), V научно-практической конференции с международным участием «Достижения фундаментальных наук в решении актуальных проблем медицины» (Астрахань, 2006).
Основные положения и выводы диссертационной работы используются в лекциях по патологической физиологии (разделы «Патофизиология инфекционного процесса», «Патофизиология иммунной системы», «Патофизиология клетки») для студентов 3 курса лечебного и педиатрического факультетов, а также в лекционном курсе по инфекционным болезням (раздел «Вирусные гепатиты») для студентов 5 курса лечебного и педиатрического факультетов ГОУ ВПО СибГМУ Росздрава.
Исследования поддержаны Советом по грантам при Президенте РФ для поддержки ведущих научных школ РФ по проблеме «Молекулярные механизмы нарушения структуры, метаболизма и функции клеток крови при патологии» (НШ-1051.2003.4), «Молекулярные основы нарушения гомеостаза клеток крови при актуальных заболеваниях инфекционной и неинфекционной природы» (НШ-4153.2006.7). Работа выполнена в рамках Федеральной целевой научно-технической программы «Исследования и разработки по приоритетным направлениям развития науки и техники на 2002-2006 годы» (Государственные контракты № 02.445.11.7110 от 05.09.2005 г.; № 02.442.11.7004 от 26.11.2005 г.; № 02.445.11.7419 от 09.06.2006 г.).
Публикации. По материалам диссертации опубликовано 14 работ, 5 из которых – в центральных рецензируемых журналах.
Объем и структура работы. Диссертация изложена на 152 страницах машинописного текста и состоит из введения, четырех глав, выводов и списка литературы, включающего 268 источников, из которых 35 - отечественных и 233 - иностранных. Работа иллюстрирована 21 таблицей и 11 рисунками.
ХАРАКТЕРИСТИКА КЛИНИЧЕСКОГО МАТЕРИАЛА И
МЕТОДЫ ИССЛЕДОВАНИЯ
В настоящей работе представлены результаты комплексного обследования 92 больных (47 мужчин и 45 женщин в возрасте от 18 до 57 лет) хроническим вирусным гепатитом В, С и В+С (по МКБ-10 рубрики В18.1, В18.2, В18.8) (табл. 1). Клинические группы были сформированы на основании классификации, принятой Всемирным конгрессом гастроэнтерологов в Лос-Анджелесе (1994): 1) больные хроническим гепатитом В – 30 человек; 2) больные хроническим гепатитом С – 39 человек; 3) больные хроническим микст-гепатитом В+С – 23 человека.
Обследование проводилось до назначения специфической противовирусной и иммунокоррегирующей терапии. Пациенты находились на диспансерном учете и стационарном лечении в гастроэнтерологическом отделении Томской областной клинической больницы. Набор клинического материала проводился под руководством заведующей кафедрой терапии ФПК и ППС ГОУ ВПО СибГМУ Росздрава, Заслуженного врача РФ, Заслуженного деятеля науки РФ, д.м.н., профессора Э.И. Белобородовой, за что автор приносит глубокую благодарность.
Активность вирусного гепатита устанавливали с помощью пункционной биопсии печени. Выраженность степени некроза паренхимы печени и воспалительной клеточной инфильтрации определяли с помощью индекса гистологической активности (ИГА) в соответствии с классификацией R. Knodell [1981]. Анамнез заболевания составлял от 2 до 16 лет (в среднем – 5±2 года).
Таблица 1
Распределение здоровых доноров и пациентов с хроническими вирусными гепатитами В, С и В+С в соответствии с методами оценки состояния ключевых путей реализации апоптоза
| № | Методы исследования | Группы обследованных | |||
| Здоровые доноры | Пациенты с хроническим вирусным гепатитом В | Пациенты с хроническим вирусным гепатитом С | Пациенты с хроническим вирусным гепатитом В+С | ||
| 1 | Определение количества лимфоцитов крови, экспрессирующих CD3-, CD4-, CD8-, CD22- и CD56-маркёры, иммуноцитохимическим методом | 23 | 15 | 25 | 17 |
| 2 | Цитофлуориметрическая оценка апоптоза общей популяции лимфоцитов периферической крови методом лазерной проточной цитометрии | 23 | 15 | 35 | 17 |
| 3 | Определение количества CD95-позитивных лимфоцитов периферической крови методом лазерной проточной цитометрии | 23 | 15 | 25 | 17 |
| 4 | Определение количества лимфоцитов периферической крови со сниженным митохондриальным потенциалом методом лазерной проточной цитометрии | 11 | 10 | 10 | 9 |
| 5 | Определение активности системы ДНК-репарации лимфоцитов периферической крови методом сцинтилляционной радиометрии | 17 | 22 | 28 | 14 |
Диагноз хронического вирусного гепатита устанавливали при наличии симптомов гепато- и спленомегалии, а также синдромов холестаза и цитолиза (табл. 2). Серологически диагноз подтверждали выявлением в крови маркеров вируса гепатита В (HBV) (HBs-антиген, Hbe-антиген, анти-Hbcor IgM, анти-Hbcor суммарные) и гепатита С (HCV) (анти-HCV Ig к cor, С-протеину, неструктурным белкам NS-3, NS-4, NS-5, анти-HCV Ig M), а также ДНК вируса гепатита В, РНК вируса гепатита С методом полимеразной цепной реакции.
В контрольную группу были включены 33 здоровых донора с аналогичными характеристиками по полу и возрасту, не страдавшие
Таблица 2
Клиническая характеристика обследованных пациентов с хроническими вирусными гепатитами В, С и В+С
| № ПП | Клиническая характеристика | Пациенты с хроническим вирусным гепатитом В | Пациенты с хроническим вирусным гепатитом С | Пациенты с хроническим вирусным гепатитом В+С | |
| 1 | Распределение по полу: Мужчины Женщины | 17 13 | 25 14 | 15 8 | |
| 2 | Длительность инфицирования: Менее 5 лет Более 5 лет | 14 16 | 18 21 | 9 14 | |
| 3 | Клиническое обследование: Болевой синдром Диспептический синдром Астено-вегетативный синдром Гепатомегалия Синдром желтухи | 16 22 19 12 2 | 20 28 17 18 4 | 15 13 11 14 2 | |
| 4 | Морфологическое исследование биоптата печени: Слабая активность воспаления Умеренная активность воспаления Стадия фиброза 1 Стадия фиброза 2 Стадия фиброза 3 | 22 8 25 5 - | 26 13 10 23 6 | 19 4 9 13 1 | |
| 5 | Лабораторные синдромы: Цитолиза Мезенхимально-воспалительный Холестаза | 18 12 2 | 26 13 4 | 20 8 2 | |
| 6 | Всего обследованных: | 30 | 39 | 23 | |
инфекционными заболеваниями и не предъявлявшие на момент обследования жалоб соматического профиля.
Материалом исследования являлась венозная кровь, стабилизированная гепарином (25 Ед/мл). Мононуклеары выделяли из цельной венозной крови методом градиентного центрифугирования с использованием Ficoll-Paque («Pharmacia», Швеция) (=1,077 г/см3) [Натвиг Дж. и соавт., 1980].
Оценку содержания CD3+-, CD4+-, CD8+-, CD22+- и CD56+-несущих лимфоцитов осуществляли иммуноцитохимическим методом с помощью набора реагентов фирмы «Novocastra Lab. Ltd» (Великобритания). Проводили подсчет 200 клеток, определяли процент положительно окрашенных клеток [Тотолян А.А. и соавт., 2002].
Выделенные клетки культивировали в течение 18 ч при температуре 37 и 5% СО2 в полной культуральной среде без митогена или с добавлением 10 мкг/мл фитогемагглютинина (ФГА) (“Difco”, Германия) для активации лимфоцитов [Хаитов Р.М. и соавт., 1995]. Оценку уровня спонтанного и активационного апоптоза в общей фракции лимфоцитарных клеток проводили с помощью аннексинового теста методом проточной лазерной цитометрии на проточном цитометре Epics XL («Beckman Coulter», Франция) [Ярилин А.А. и соавт., 2000].
В рамках диссертационной работы оценивали состояние ключевых путей индукции апоптоза лимфоцитов крови у пациентов с персистенцией вирусов гепатита В и С. Количество лимфоцитов, экспрессирующих Fas-рецептор (CD95), оценивали иммуноцитохимическим методом [Тотолян А.А. и соавт., 2002] с использованием набора реагентов фирмы «Novocastra Lab. Ltd.» (Великобритания). Для выявления молекул Fas-R на мембране клеток использовали моноклональные антитела мыши, специфичные к Fas-рецептору, в рабочем разведении 1:100. Анализ микроскопической картины проводили как указано выше.
Регистрацию лимфоцитов со cниженным трансмембранным потенциалом митохондрий проводили методом проточной цитометрии [Mathur A. et al., 2000] с использованием красителя JC-1 (5,5',6,6'-тетрахлор-1,1',3,3' тетраэтилбензимидазолкарбоцанин иодид/хлорид) («BDTM MitoScreen», США). Окрашенные JC-1 клетки дважды отмывали буфером и ресуспендировали, после чего подвергали проточной цитофлуориметрии на цитометре Epics XL («Beckman Coulter», Франция).
Активность репарационной системы ДНК лимфоцитарных клеток исследовали методом сцинтилляционной радиометрии [Дубинин Н.П., Засухина Г.Ф., 1975]. В каждом случае полученную лимфоцитарную взвесь подвергали ультрафиолетовому облучению лампой «ДБ-15» (длина волны света 254 нм). Затем инкубировали лимфоциты с эмбриональной телячьей сывороткой в 10 мкКи/мл среде 3Н-тимидина с удельной активностью 19,8 Ки/ммоль («Изотоп»). После инкубации пробы фильтровали через стекловолоконные фильтры («Wellcome», Норвегия). Затем фильтры промывали, фиксировали трихлоруксусной кислотой и этиловым спиртом и высушивали. Измерение радиоактивности (имп/с) проводили на сцинтилляционном счетчике «Mark III» (США). Индекс стимуляции репарационной системы ДНК определяли, рассчитывая отношение показателя радиоактивности облученной пробы к радиоактивности необлученного образца.
Биоптаты печени получали путем чрескожной пункционной биопсии печени по Menghini [Menghini G., 1958] иглой «Hepafix» (“B.Braun Melsungen AG”, Германия). Биоптаты фиксировали в нейтральном 10% формалине и затем заливали в парафиновые блоки по стандартной методике. Парафиновые срезы для исследования толщиной 1-3 мкм получали с помощью микротома "Gistopange 2280" (Германия). Для иммуногистохимических реакций использовали следующие моноклональные антитела: p 53 - Protein (DO-7) (RTU-p53-DO7) в разведении 1:50, bcl2 - Oncoprotein (RTU-bcl-2) и Novostain Super ABC Kit производства Novocastra Lab. Ltd (United Kindom) в разведении 1:80. Инкубацию срезов с моноклональными антителами проводили 30-60 мин при комнатной температуре во влажной камере. Затем срезы инкубировали с биотинированными антителами «Novocastra Lab. Ltd» (Великобритания). Пероксидазу выявляли раствором диаминобензидина (набор «Vector Lab.», США). Просмотр препаратов и микрофотосъемку проводили на световом микроскопе Jenaval производства «Carl Zeiss» (Германия).
Анализ полученных данных осуществляли с помощью программы Statistica for Windows Version 6.0 (StatSoft Inc., США). Для оценки гипотезы нормальности распределения имеющихся выборок данных использовали критерий Колмогорова-Смирнова. При соответствии нормальному закону распределения признака проверку гипотезы о равенстве средних выборочных величин проводили с использованием t-критерия Стьюдента. Для оценки достоверности различий независимых выборок, не подчиняющихся критерию нормального распределения, применяли непараметрический критерий Манна-Уитни, для зависимых выборок данных использовали критерий Вилкоксона. Различия считали достоверными при уровне значимости р<0,05 [Лакин А.В., 1989]. С целью обнаружения связи между исследованными показателями проводили корреляционный анализ с использованием критерия Спирмена [Бронштейн И.Н., 1986].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В настоящее время проблема хронических вирусных инфекций является актуальной с медицинской и общебиологической точки зрения, поскольку представляет собой пример длительного сохранения репликации инфектогена в зараженном организме на фоне выраженного иммунного ответа [Ahmed R. еt аl., 1996; Arbutnot P., Kew M., 2001]. Одним из механизмов выживания вирусов разных таксономических групп при формировании хронической инфекции считается модуляция процессов апоптоза [Аббасова С. Г., 1999; Freeman A.J. et al., 2001], которая является результатом как прямого, так и опосредованного иммунной системой воздействия вируса [Максимов С.Л. и соавт., 2002; Caronia S. et al., 2004]. Многие вирусы, в том числе возбудители гепатита В и С, способны изменять программу гибели клетки в соответствии со своей стратегией выживания, обусловливая тем самым формирование иммуносупрессивных и иммунопатологических реакций [Crovatto M. et al., 2000].
Учитывая важную роль процесса программированной клеточной гибели в механизмах формирования длительной вирусной персистенции, а также высокие показатели заболеваемости и смертности от осложнений хронических вирусных гепатитов В и С [Шаханина И. Л., 2001], наше внимание было сосредоточено на оценке состояния программированной гибели гепатоцитов и лимфоцитов при хроническом течении гепатита В, С и В+С. Столь пристальное внимание к функциональному состоянию лимфоцитов было обусловлено не только тем фактом, что эти клетки играют ключевую роль в реализации противовирусного иммунитета, но и тем обстоятельством, что лимфоциты сами по себе являются мишенью для действия вирусов, в частности вирусов гепатита В и С [Gowans E.J., 2000; Апросина З.Г., Серов В.В., 2001].
Для адекватного и эффективного осуществления противовирусных функций иммунной системы необходимо избирательное вовлечение в процесс субпопуляций лимфоцитов, несущих специфические рецепторы, а также их тесное взаимодействие [Ярилин А.А., 1999]. Однако известно, что эффективность функционирования Т-лимфоцитов при хронических вирусных гепатитах снижена и не приводит к элиминации инфекционного агента, в отличие от острого инфекционного процесса, для которого характерна высокая сенсибилизация Т-клеток к антигенам вируса и, как правило, выздоровление [Matloubian M.R. et al., 1994; Fan X.G. et al., 1998].
Как показало проведенное в нашей лаборатории исследование, у больных хроническим вирусным гепатитом В и С имело место значительное снижение числа CD3+-экспрессирующих лимфоцитов, что является отражением общего угнетения Т-клеточного звена (рис. 1). Выявленные нами изменения в системе Т-звена иммунитета проявлялись также повышением количества CD8-
Рис. 1. Иммунофенотипический профиль лимфоцитарной популяции у больных хроническим вирусным гепатитом
позитивных лимфоцитов на фоне сокращения численности CD4+-клеток у больных хроническим вирусным гепатитом С и В+С, а также у больных хроническим вирусным гепатитом В слабовыраженной степени активности (30,70±2,86% при норме 38,14±1,90%, р<0,05).
Достоверно низкий уровень экспрессии молекул CD4 на лимфоцитах у обследованных нами пациентов (р<0,05) подтверждает имеющиеся в литературе данные о том, что при хроническом течении вирусного гепатита Т-клеточный ответ на вирусные антигены является довольно слабым [Gramp M.E. et al., 1999; Маммаев С.Н., 2002]. Проведенное нами исследование продемонстрировало, что содержание CD22+-лимфоцитов в крови у пациентов с хроническим вирусным гепатитом достоверно не отличалось от нормы, что отражает отсутствие активации гуморального звена иммунитета (рис. 1). Выявленное нами увеличение количества CD56+-клеток у пациентов с хроническим вирусным гепатитом В, С и В+С свидетельствует, вероятно, о компенсаторной активации системы неспецифической резистентности в ответ на вирусную инфекцию [Ярилин А.А., 1999].
Таким образом, полученные нами результаты исследования субпопуляционного состава лимфоцитов периферической крови подтверждают имеющиеся в литературе данные, касающиеся проблемы длительного взаимодействия вирусов гепатита В и С и иммунной системы макроорганизма [Borrow P., 1997; Bramley A.M. et al., 1999; Маммаев С.Н., 2002; Фридлянд И.Ф. и соавт., 2002]. Выявленные изменения затронули прежде всего Т-клеточное звено иммунитета, а также систему натуральных киллеров.
Модуляция процессов апоптоза различных клеточных систем является одним из ключевых патогенетических механизмов формирования вирусной персистенции в макроорганизме, который объясняет отсутствие адекватной элиминации вируса и недостаточную эффективность терапии. При этом вирус способен как обеспечить защиту несущей чужеродный геном клетки от внешнего и внутреннего пути активации программы апоптоза [Lee Y.I. et al., 2001; He Y. et al., 2002], так и стимулировать программированную гибель клеток иммунной системы, отвечающих преимущественно за противовирусный иммунный ответ [Максимов С.Л. и соавт., 2002; Li L. et al., 2003].
При изучении показателей, характеризующих степень выраженности программированной гибели лимфоцитарных клеток, было установлено, что у пациентов с хроническим вирусным гепатитом В уровень подвергшихся спонтанному и ФГА-стимулированному апоптозу лимфоцитов не отличался от контрольных значений (рис. 2). Попытка выявить какие-либо закономерности в зависимости от длительности заболевания позволила установить, что с ее увеличением (более 5 лет) количество лимфоцитов на ранней стадии процесса апоптоза значительно снижалось (4,43±0,57% при норме 10,73±1,74%; р<0,05), однако интенсивность активационного апоптоза сохранялась на прежнем уровне (16,94±2,47% при 10,99±1,66% у здоровых доноров р>0,05). Указанный факт подтверждает также отрицательная корреляциионная связь между уровнем спонтанного апоптоза лимфоцитов и длительностью заболевания у больных хроническим вирусным гепатитом В (r= -0,72; р<0,01).
Отсутствие активационного эффекта фитогемагглютинина оказалось характерным для пациентов с хроническим гепатитом В длительностью заболевания до 5 лет: вероятно, высокий уровень виремии HBV сопровождается антиген-зависимой активацией большинства лимфоцитов периферической крови и отсутствием потенциала для их дальнейшей стимуляции фитогемагглютинином [Zhang J.L. et al., 2004]. Однако в условиях персистенции вируса гепатита В активация лимфоцитов не приводит к элиминации вируса, вызывая иммуноопосредованное повреждение паренхимы печени [Tsamandas A.C., 2003].
Угнетение апоптоза на поздних стадиях заболевания может быть связано как с функциональной активацией лимфоцитов на фоне длительной вирусной инфекции, так и с вирусной модуляцией программированной гибели клеток. Например, антиапоптотическая стратегия HBV сводится к вирусиндуцированному подавлению функции белка р53, инактивации каспаз, а также усилению экспрессии ингибитора апоптоза Bcl-XL [Lin Y. et al., 1997; Rust C., Gores G.J., 2000].
Рис. 2. Уровень спонтанного и активационного апоптоза лимфоцитов периферической крови у больных хроническим вирусным гепатитом.
Проведенное в нашей лаборатории исследование позволило выявить достоверно значимое увеличение абсолютного числа Fas-презентирующих лимфоцитов периферической крови у больных хроническим вирусным гепатитом В, что свидетельствует от активации рецептор-опосредованного пути запуска апоптоза (табл. 3).
Одним из механизмов ингибирования апоптоза у больных хроническим гепатитом В и С может являться снижение чувствительности лимфоцитарных клеток к Fas-индуцированному апоптозу, обусловленное нарушением функции данного рецептора [Ohishi M. et al., 1995]. За эту версию говорит тот факт, что презентация Fas-R на мембране лимфоцитов крови у больных хроническим вирусным гепатитом В с анамнезом заболевания более 5 лет оставалась на нормальном уровне (15,57±3,93% при норме 9,88±1,35%; р>0,05), в то время как выраженность спонтанного апоптоза лимфоцитов достоверно снижалась. Следует также отметить выявленную положительную корреляцию между общим числом лимфоцитов периферической крови и долей Fas+-клеток (r=0,62; р<0,01).
По всей видимости, при развивающемся в течение заболевания снижении числа Т-лимфоцитов в итоге выживают преимущественно не имеющие Fas-рецептора клетки, в то время как Fas-экспрессирующие лимфоциты подвергаются апоптозу. Проведенное нами исследование экспрессии Fas-R на лимфоцитах периферической крови у больных хроническим вирусным гепатитом В подтверждает это предположение: с увеличением длительности заболевания абсолютное содержание Fas-R-презентирующих клеток нормализуется. Таким образом, низкий уровень спонтанного апоптоза у больных хроническим вирусным гепатитом В с длительностью заболевания более 5 лет можно объяснить преобладанием в клеточной популяции лимфоцитов, устойчивых к рецептор-опосредованному апоптозу [Hayashi N., Mita E., 1997].
Эти результаты позволяют говорить о развитии функциональной недостаточности мононуклеаров периферической крови при хроническом гепатите В, которые играют ключевую роль в реализации противовирусных функций. При этом одним из ключевых механизмов вызванной HBV иммуносупрессии является, по всей видимости, индукция Fas-опосредованного апоптоза лимфоцитов. Кроме того, данные W. Ji et al. [1999] указывают на преимущественно иммунное повреждение гепатоцитов при хронической HBV-инфекции, а также позволяют предположить, что активация апоптоза мононуклеаров периферической крови является своего рода защитным механизмом, ограничивающим это повреждение.
Один из ключевых путей индукции программированной клеточной смерти начинается в митохондриях. В клетках, подвергшихся воздействию индуктора апоптоза, резко снижается мембранный потенциал () митохондрий [Kroemer G. et al., 1999], что обусловлено увеличением проницаемости внутренней мембраны органелл вследствие образования гигантских пор [Bernardi P. et al., 1998]. В результате раскрытия поры происходит набухание митохондриального матрикса, разрыв наружной мембраны митохондрий и высвобождение растворимых белков межмембранного пространства [Скулачев В.П., 1998]. Ключевую роль в реализации выхода митохондриальных факторов играют белки семейства Bcl-2, из которых некоторые, включая сам Bcl-2, препятствуют индукции апоптоза, блокируя открытие гигантских пор, в то время как другие белки семейства (например Bax, Bid) являются проапоптотическими [Gross A. et al., 1999].
В проведенном нами исследовании содержание лимфоцитов периферической крови со сниженным трансмембранным потенциалом митохондрий определяли методом лазерной цитофлуориметрии с использованием красителя JC-1 [Mathur A. et al., 2000]. Анализ полученных результатов не позволил выявить достоверного изменения количества клеток со сниженным потенциалом у пациентов с хронической HBV-инфекцией, что указывает на отсутствие модуляции митохондриального пути апоптоза лимфоцитов (табл. 3). В лимфоцитах снижению митохондриального потенциала может препятствовать конституционально высокая экспрессия антиапоптотических белков Bcl-2 и Bcl-xL (рис. 3) [Ярилин А.А., 2001].
Таблица 3
Содержание Fas-положительных лимфоцитов и лимфоцитов со сниженным трансмембранным потенциалом митохондрий у больных хроническим вирусным гепатитом
| Характеристика обследованных | Содержание Fas+-лимфоцитов | Содержание лимфоцитов со сниженным мембранным потенциалом митохондрий | ||
| % | ·109/л | % | ·109/л | |
| Здоровые доноры | 9,88±1,35 | 0,22±0,05 | 5,09±0,81 | 0,10±0,02 |
| Пациенты с хроническим вирусным гепатитом В | 15,87±1,76 p1<0,05 | 0,29±0,07 p1>0,05 | 3,53±0,91 р1>0,05 | 0,15±0,05 р1>0,05 |
| Пациенты с хроническим вирусным гепатитом С | 10,68±1,33 p1>0,05 p2>0,05 | 0,35±0,04 p1<0,05 p2>0,05 | 13,15±2,39 p1<0,01 p2<0,05 | 0,24±0,07 p1<0,01 p2>0,05 |
| Пациенты с хроническим вирусным гепатитом В+С | 13,62±1,63 p1<0,05 p2>0,05 p3>0,05 | 0,39±0,06 p1<0,05 p2>0,05 p3>0,05 | 35,22±7,38 p1<0,01 p2<0,01 p3<0,05 | 0,73±0,15 p1<0,01 p2<0,05 p3<0,05 |
Примечание: р1 – достоверность различий по сравнению с аналогичными показателями у здоровых доноров, р2 – у больных хроническим гепатитом В, р3 – у больных хроническим гепатитом С
Один из ключевых путей индукции апоптоза может реализоваться вследствие возникновения источника сигнала внутри самой клетки [Тронов Е.А., Константинов Е.М., 2000] и опосредуется через ключевой белок-регулятор P53 [Lane D.P., 1992]. Множество сигналов о состоянии клетки, целостности ее ДНК, активности систем репарации ДНК мониторируются полифункциональным геном р53 [Ichihara A., Tanaka K., 1995], который активируется в ответ на различные стрессорные воздействия и клеточные повреждения. Имеются данные, что белок Р53 обладает 3’-5’-экзонуклеазной активностью, способностью связываться с одноцепочечной ДНК и нуклеотидами [Jayaraman J., Prives C., 1995], что подразумевает его непосредственную ДНК-репарирующую функцию [Reed M. et al., 1995].
Одной из причин индукции апоптоза является накопление повреждений ДНК в инфицированных клетках, связанное с функциональной недостаточностью системы ДНК-репарации, вызванной вирусными белками [Максимов С.Л. и соавт., 2002]. Полученные нами результаты свидетельствуют о том, что лимфоцитарные клетки у больных хроническим гепатитом В обладают сниженной способностью к эксцизионной репарации ДНК. Так, средние значения индекса стимуляции системы репарации ДНК в лимфоцитах у больных составляли 1,12±0,05 усл. ед. (при норме 1,91±0,15 усл. ед.; р<0,05). Эти результаты соотносятся с данными других авторов [Capovilla A. et al., 1997] и подтверждают наличие функциональных нарушений в системе поддержания генетического гомеостаза клеткок при хронической вирусной инфекции.
Таким образом, у больных хроническим гепатитом В повышенна готовность лимфоцитов крови к запуску программы самоликвидации клетки, что проявлялось увеличением содержания Fas+-клеток, а также выражалось в угнетении системы репарации ДНК (рис. 3). В то же время уровень подвергающихся апоптозу лимфоцитов крови не отличался от нормы, что свидетельтвует о блокаде ключевых звеньев программы реализации апоптоза у этих больных.
При детальной оценке результатов обследования больных хроническим гепатитом С, а также микст-инфекцией В+С были установлены несколько иные закономерности. Так, у больных хроническим гепатитом С и В+С значительно снижалось относительное число апоптотических лимфоцитов. Уровень активационного апоптоза лимфоцитов у больных хроническим гепатитом С также оказался снижен по сравнению с контролем (рис. 2).
Спонтанный и ФГА-стимулированный апоптотический ответ лимфоцитов периферической крови у пациентов с микст-гепатитом В+С носил характер, аналогичный изменениям данного параметра у больных хроническим гепатитом С, что, вероятно, свидетельствует о более значимом влиянии HCV на
иммунологическую реактивность по сравнению с вирусом гепатита В. Эти результаты подтверждают данные других исследователей, указывающих на преобладание репликации и уровня виремии HCV у пациентов с хроническим вирусным гепатитом В+С [Sugiyama K. et al., 1997]. Более того, апоптотический ответ лимфоцитов крови на стимуляцию ФГА у пациентов с микст-гепатитом В+С также носил характер, аналогичный изменениям данного показателя у больных хроническим гепатитом С (рис. 2).
Сравнительный анализ полученных результатов исследования показал, что при хроническом гепатите С умеренной степени активности уровень
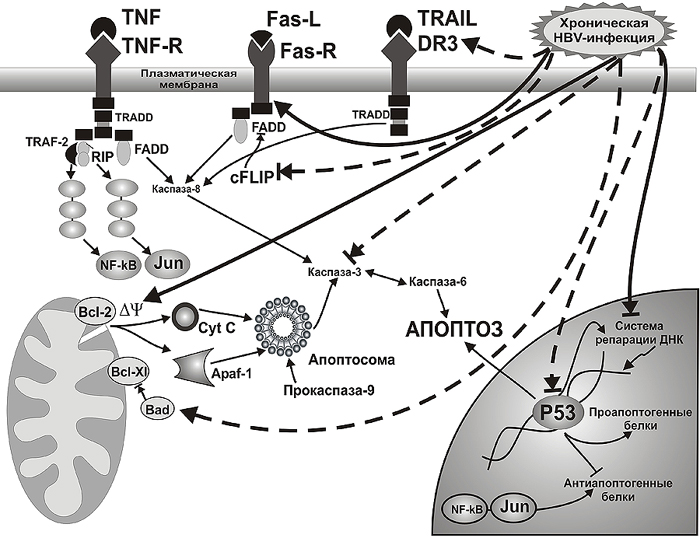
Рис. 3. Механизмы нарушения программированной гибели лимфоцитов у больных хроническим гепатитом В по данным S. Takada et al. [1999]; Y.I. Lee et al. [2001]; J. Pan et al. [2001]; P. Arbuthnot et al. [2002] ( ![]() ) и результатам собственных исследований (
) и результатам собственных исследований ( ![]() ).
).
* Примечание: ![]() - активирующее влияние,
- активирующее влияние, ![]() - ингибирующее влияние
- ингибирующее влияние
спонтанного апоптоза лимфоцитов оказался достоверно ниже по сравнению со значением данного показателя у пациентов со слабовыраженной степенью активности воспалительного процесса в паренхиме печени (4,02±0,83% и 7,26±1,08%, соответственно, р<0,05). Аналогичные результаты были получены W. Ji et al. [1999], который установил, что уровень апоптоза лимфоцитов крови у больных хроническим гепатитом С при минимальной и слабовыраженной степени активности воспалительного процесса значительно выше, чем при умеренной и высокой его активности.
Проведенное в нашей лаборатории исследование позволило выявить достоверно значимое увеличение числа Fas-презентирующих лимфоцитов периферической крови у больных хроническим вирусным гепатитом С и В+С (табл. 3). Угнетение же апоптоза лимфоцитов на этом фоне связано, по всей видимости, с нарушением нормального функционирования ключевых сигнальных путей, которое может быть результатом нарушения клеточного гомеостаза [Emi K. et al., 1999], а также действия вирусных белков [Ciccaglione A.R. et al., 2004].
Например, было показано, что белок NS5A способен угнетать апоптоз, активируя фосфоинозитол-3-киназу [Street A. et al., 2004], что приводит к фосфорилированию проапоптотического белка Bad [He Y. et al., 2002] и защищает вирус-инфицированные клетки от апоптоза. Кроме этого, белки HCV способны блокировать TNF-зависимую активацию каспазы-3 и выход цитохрома С из митохондрий [Lin L.Y. et al., 2003]. По всей видимости, вирусу необходима столь многофункциональная защита, так как макроорганизм способен индуцировать апоптоз несущих чужеродный геном клеток множеством независимых путей (рис. 4).
Проведенное нами исследование выявило значительное (более чем в 2 раза) увеличение содержания лимфоцитов со сниженным трансмембранным потенциалом митохондрий у пациентов с хронической HCV-инфекцией по сравнению с соответствующими параметрами у здоровых доноров и у больных хроническим вирусным гепатитом В (табл. 3). Угнетение активности системы эксцизионной репарации ДНК лимфоцитов выразилось в снижении индекса ее стимуляции у больных гепатитом С до 1,14±0,07 усл. ед. (р<0,05), у пациентов с микст-инфекцией В+С – до 1,09±0,06 усл. ед. (р<0,05).
Проведенное в нашей лаборатории иммуногистохимическое исследование биоптатов печени у больных хроническими вирусными гепатитами В и С ставило своей целью выявление экспрессии ключевых белков-регуляторов программированной клеточной гибели Р53 и Bcl-2 в гепатоцитах и других внутрипеченочных структурах (эндотелий сосудов, лимфоциты, эпителий желчных протоков). Однако у больных хроническим вирусным гепатитом В, а также пациентов с HCV-инфекцией окрашивание диаминобензидином комплексов антиген-антитело, содержащих в своем составе указанные белки, отсутствовало. Вероятно, повышенная экспрессия Р53 и Bcl-2 характерна только для трансформированных гепатоцитов на стадии предрака и клеток гепатоцеллюлярной карциномы [Arbuthnot P. et al., 2000].
Полученные нами результаты подтверждают данные проведенного J.Jr. Ehrmann et al. [1996] исследования уровня экспрессии белков-регуляторов
апоптоза в гепатоцитах и лимфоцитах при хронической HBV- и HCV-инфекции, выявившего отсутствие экспрессии Р53 и Bcl-2. Эти данные позволяют высказать предположение о том, что контроль клеточного цикла гепатоцитов при хроническом вирусном гепатите В и С могут осуществлять другие гены – Bax, Bcl-Xs, Fas. Например, было показано, что гепатоциты при хроническом вирусном гепатите В экспрессируют мРНК и белок Bax, что свидетельствует об их повышенной готовности к вступлению в апоптоз, так как уровень экспрессии Bax коррелирует с уровнем апоптоза гепатоцитов [Tsamandas A.C., 2003]. Кроме того, белок HBx отвечает за индукцию синтеза Fas-L в гепатоцитах [Shin E.C. et al., 1999].

Рис. 4. Механизмы нарушения программированной гибели лимфоцитов у больных хроническим гепатитом С и В+С по данным D.I. Tai et al. [2000]; Y. He et al. [2002]; K.H. Lan et al. [2002]; J.P. Moorman et al. [2003] ( ![]() ) и результатам собственных исследований
) и результатам собственных исследований
( ![]() ).
).
* Примечание: ![]() - активирующее влияние,
- активирующее влияние, ![]() - ингибирующее влияние
- ингибирующее влияние
Вероятно, как только клетки, находящиеся в паренхиме печени, в силу каких-либо причин начинают экспрессировать Fas-R, они тут же подвергаются апоптозу при условии, что их внутриклеточные системы работают адекватно [Mita E., Hayashi N., 1997]. При этом инфицированные гепатоциты получают несомненные преимущества ввиду блокады многих сигнальных и эффекторныхсистем вирусными белками, а неинфицированные гепатоциты и внутрипеченочные лимфоциты гибнут. Это приводит к нарушению элиминации вирус-инфицированных клеток при поддержании хронического воспаления в паренхиме печени.
Таким образом, следует отметить, что модуляция апоптоза различных клеточных систем в условиях длительной персистенции вирусов гепатита В и С носит разнонаправленный характер. Выявленные сдвиги могут быть обусловлены вирусным воздействием, а также нарушением ключевых механизмов регуляции программированной гибели: рецептор-опосредованного пути, р53-зависимого и митохондриального путей запуска каспазного каскада.
В целом, в проведенном нами исследовании были освещены некоторые вопросы модуляции ключевых путей регуляции апоптоза лимфоцитов при длительной персистенции вирусов гепатита В и С. Важная роль дизрегуляции программированной клеточной гибели клеток в формировании и поддержании хронической вирусной инфекции, развитии иммунного дисбаланса и тяжелых осложнений хронического заболевания не вызывает сомнения. Однако формат работы позволил обсудить лишь некоторые аспекты указанной проблемы. В то же время дальнейшие исследования в данной области позволят разработать новые подходы к предотвращению хронизации вирусной инфекции и будут способствовать созданию принципиально новых методов профилактики и лечения хронических вирусных гепатитов.
ВЫВОДЫ
- Механизмы формирования дисбаланса Т-клеточного звена иммунитета у больных хроническими гепатитами В, С и В+С сопряжены с дизрегуляцией процесса апоптоза лимфоцитов крови.
- Угнетение программированной гибели лимфоцитов крови у пациентов с хроническими вирусными гепатитами С и В+С наиболее выражено при умеренной степени активности воспалительного процесса в печени и длительности заболевания более 5 лет.
- У больных хроническими вирусными гепатитами В, С и В+С активирован Fas-рецепторный путь индукции апоптоза лимфоцитов крови.
- При хронических вирусных гепатитах С и В+С нарушен митохондриальный путь запуска программированной гибели лимфоцитов периферической крови.
- Хроническое течение вирусного гепатита В и С сопровождается цитогенетической нестабильностью лимфоцитов крови, проявляющейся снижением активности системы эксцизионной репарации ДНК
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Активность ДНК-репарационной системы лимфоцитов периферической крови у пациентов с хронической вирусной персистенцией // Эпидемиология и вакцинопрофилактика. – 2003. - №12. – С. 43-46 (в соавт. с Рязанцевой Н.В., Новицким В.В., Ткаченко С.Б., Чечиной О.Е., Жуковой О.Б., Литваком М.М., Токаревой Н.В.).
- Изменения цитогенетического статуса лимфоцитов периферической крови при хронических HBV- и HCV-инфекциях // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. – 2004. – Т.14, №1. – С. 37-40 (в соавт. с Рязанцевой Н.В., Белобородовой Э.И., Новицким В.В., Жуковой О.Б., Ткаченко С.Б., Белобородовой Е.В., Токаревой Н.В.).
- Апоптоз лимфоцитов крови у пациентов с хронической персистенцией вирусов // Межгородская конференция «Актуальные проблемы патофизиологии», г. Санкт-Петербург, 15-16 апреля 2004 г. – СПб, 2004. – С. 27-29 (в соавт. с Рязанцевой Н.В., Чечиной О.Е., Литваком М.М., Жуковой О.Б., Наследниковой И.О., Мельниковой А.П., Антошиной М.А., Ермолаевой Е.С., Хлаповым А.П., Пигузовой Е.А.).
- Патофизиология иммунных нарушений при хронических вирусных гепатитах // Вторая международная конференция «Патофизиология и современная медицина», г. Москва, 22-24 апреля 2004 г. – Москва, 2004. – С. 154-155 (в соавт. с Рязанцевой Н.В., Новицким В.В., Жуковой О.Б., Мельниковой А.П., Наследниковой И.О., Чечиной О.Е., Литваком М.М., Ермолаевой Е.С., Токаревой Н.В.)
- Изменение апоптотического потенциала лимфоцитов крови при хронических гепатитах В и С // IV съезд Научного общества гастроэнтерологов России, г. Москва, 11-12 февраля 2004 г. – Москва, 2004. – С. 20 (в соавт. с Чечиной О.Е., Рязанцевой Н.В., Новицким В.В., Жуковой О.Б., Наследниковой И.О., Антошиной М.А., Хлаповым А.П., Литваком М.М.).
- Нарушения реализации апоптоза иммунокомпетентных клеток крови при хроническом гепатите С // I Международная конференция «Молекулярная медицина и биобезопасность», г. Москва, 26-28 октября 2004 г. – Москва, 2004. – С. 79-80 (в соавт. с Рязанцевой Н.В., Новицким В.В., Чечиной О.Е., Ермолаевой Е.С., Белобородовой Е.В., Радзивил Т.Т., Литваком М.М., Жуковой О.Б., Зима А.П.).
- Апоптотическая гибель CD4+-лимфоцитов при длительной персистенции вируса гепатита С // Материалы Межгородской конференции «Актуальные проблемы патофизиологии», г. Санкт-Петербург, 21-22 апреля 2005 г. – СПб, 2005. – С. 85 (в соавт. с Чечиной О.Е., Рязанцевой Н.В., Новицким В.В., Радзивил Т.Т., Белобородовой Е.В., Литваком М.М., Жуковой О.Б., Зима А.П.).
- Реализация апоптоза лимфоцитов крови при персистенции вируса гепатита С // 6-я Всероссийская научно-практическая конференция «Вирусные гепатиты - проблемы эпидемиологии, диагностики, лечения и профилактики», г. Москва, 24-25 мая 2005 г. – Москва, 2005. – С. 178-179 (в соавт. с Литваком М.М., Рязанцевой Н.В., Новицким В.В., Чечиной О.Е., Радзивил Т.Т., Белобородовой Е.В., Жуковой О.Б., Зима А.П.).
- Роль митохондриально-опосредованного пути апоптоза лимфоцитов крови в механизмах реализации противовирусного иммунитета // Тезисы докладов V Сибирского физиологического съезда, Томск, 29, 30 июня–1 июля 2005 г. – Бюллетень сибирской медицины. – 2005. – Т.4, Приложение 1. – С. 115 (в соавт. с Литваком М.М., Рязанцевой Н.В., Новицким В.В., Чечиной О.Е., Жуковой О.Б., Зима А.П., Литвиновой Л.С., Радзивил Т.Т., Пигузовой Е.А.).
- Вирусиндуцированная дизрегуляция программируемой гибели иммунокомпетентных клеток: адаптация или патология? // Успехи физиологических наук. – 2005. – Т. 36, №3. – С. 33-44 (в соавт. с Рязанцевой Н.В., Новицким В.В., Литваком М.М., Жуковой О.Б., Чечиной О.Е.).
- Разработка технологии прогнозирования течения и исходов вирусных инфекций на основе идентификации молекулярных мишеней повреждения ключевых систем гомеостаза человека // Материалы II Международной конференции «Молекулярная медицина и биобезопасность», г. Москва, 20-21 октября 2005 г. – Москва, 2005. – С.132-133 (в соавт. с Рязанцевой Н.В., Зима А.П., Новицким В.В., Радзивил Т.Т., Литваком М.М., Жуковой О.Б., Чечиной О.Е., Мороз Е.А., Литвиновой Л.С., Колобовниковой Ю.В.).
- Вирусиндуцированная модуляция программы апоптотической гибели клетки // Бюллетень сибирской медицины. – 2005. – № 4. – С. 78-83 (в соавт. с Чечиной О.Е., Рязанцевой Н.В., Новицким В.В., Жуковой О.Б., Литваком М.М.).
- Состояние митохондриального пути апоптоза лимфоцитов крови при хронических вирусных гепатитах // Материалы научно-практической конференции с международным участием «Достижения фундаментальных наук в решении актуальных проблем медицины». – Астрахань, 2006. – С.126 (в соавт. с Жуковой О.Б., Рязанцевой Н.В., Новицким В.В., Мороз Е.А., Радзивилл Т.Т., Крат И.В., Божковой И.В., Часовских Н.Ю.).
- Роль нарушения регуляции апоптотической гибели в механизмах развития вирусиндуцированной цитогенетической нестабильности лимфоцитов крови // Бюллетень экспериментальной биологии и медицины. - 2006 г. – Т.141, №5. – С. 544-547 (в соавт. с Рязанцевой Н.В., Новицким В.В., Радзивил Т.Т., Жуковой О.Б., Чечиной О.Е., Зима А.П., Шиловым Б.В.).
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
ДНК – дезоксирибонуклеиновая кислота
ИГА – индекс гистологической активности
ПЦР – полимеразная цепная реакция
РНК – рибонуклеиновая кислота
ФГА – фитогемагглютинин
CD – кластер дифференцировки
CTL – цитотоксический Т-лимфоцит
HBV – вирус гепатита В
HCV – вирус гепатита С
IFN – интерферон
Ig – иммуноглобулин
IL – интерлейкин
МНС – главный комплекс гистосовместимости
NK – натуральный киллер
NS – неструктурный белок
Th – Т-хелпер
TNF – фактор некроза опухоли

