Неравный кроссинговер в гетерозиготных тандемных дупликациях у escherichia coli
На правах рукописи
Прокопьев Василий Валерьевич
НЕРАВНЫЙ КРОССИНГОВЕР В ГЕТЕРОЗИГОТНЫХ ТАНДЕМНЫХ ДУПЛИКАЦИЯХ У ESCHERICHIA COLI
03.00.15 - Генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2007
Работа выполнена в лаборатории генетики бактерий Федерального государственного унитарного предприятия Государственного научно- исследовательского института генетики и селекции промышленных микроорганизмов «ФГУП ГосНИИгенетика»
Научный руководитель:
доктор биологических наук, профессор В.В. Суходолец
Научный консультант:
кандидат биологических наук И.В. Манухов
Официальные оппоненты:
доктор биологических наук, профессор А.С. Миронов, ФГУП ГосНИИгенетика
доктор биологических наук, профессор А.А. Прозоров, Институт общей генетики РАН
Ведущая организация:
Кафедра генетики и селекции биологического факультета Московского Государственного Университета имени М. В. Ломоносова
Защита состоится «___ »____________ 2007 г. в 14 часов на заседании Диссертационного совета Д217.013.01 при ФГУП Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов по адресу: 113545, Москва, 1-ый Дорожный проезд д. 1.
С диссертацией можно ознакомиться в библиотеке ФГУП ГосНИИгенетика.
Автореферат разослан «___ »____________ 2007 г.
Ученый секретарь
Диссертационного совета кандидат биологических наук Г.Г. Заиграева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Исследование механизмов рекомбинации в тандемных дупликациях у бактерий занимает важное место в изучении взаимосвязи репликации и рекомбинации. В таких системах генетический обмен может приводить, прежде всего, к гаплоидизации, т.е. распаду самой дупликации, что можно считать равнозначным образованию делеции рекомбинационным путём [Lovett S.T. et al., 1993; Bierne H. et al., 1997; Galitski T. et al., 1997.]. Таким образом, исследование механизмов и генной регуляции рекомбинационных обменов в гетерозиготных тандемных дупликациях является ещё одним фрагментом, связывающем воедино «три Р» (рекомбинация, репарация и репликация) молекулярной генетики.
В подавляющем большинстве работ, связанных с изучением рекомбинации в дупликациях, используются относительно небольшие повторы гомологичных сегментов хромосомы. Но интерес также представляют и более протяженные, включающие от 25 до 300 и более тыс. п.н., тандемные дупликации, стабильность которых обеспечивается присутствием негомологичной вставки в одной из копий тандемного повтора. В результате исследований дупликаций данного типа выявлено, что в процессе рекомбинации они выщепляют не только гаплоидные сегреганты, а самые различные продукты обмена между повторами ДНК, включая сегреганты сохранившие диплоидное состояние. Исследование полученных рекомбинантов позволяет более детально изучать механизм рекомбинации.
Неравный кроссинговер, происходящий между сестринскими хромосомами у бактерий, как и кроссинговер, происходящий между хромосомами различного происхождения, приводит к образованию тандемных дупликаций, а также множественных амплификаций генов.
Для образования тандемных дупликаций путём неравного кроссинговера необходимо, чтобы в процессе репликации происходил сдвиг гомологичного соединения сестринских хромосом. Мишенью для неравного кроссинговера при образовании дупликаций и затем областью стыка между двумя гомологичными повторами ДНК могут служить гомологичные опероны рибосомальных РНК (rrn), а также короткие прямые повторы ДНК длинной 10-20 пн [Edlund T. et al., 1981., Whoriskey S.K. et al., 1987].
В настоящее время приято считать, что образование дупликаций является эволюционно сложившимся механизмом повышения активности генов. Изучение рекомбинации в протяжённых тандемных дупликациях у Escherichia coli – один из эффективных подходов к выяснению механизмов рекомбинации, а также её связи с такими генетическими явлениями как репарация и репликация.
Предыстория работы
В 1991 году впервые было сообщено о создании гетерозиготной тандемной дупликации с помощью конъюгационного скрещивания у Escherichia coli K-12 [Суходолец В.В., 1991]. Данная дупликация была получена как результат рекомбинации двойных мутантов по генам deo-оперона: deoA deoB::Tn5 и deoC deoD с образованием стабильных гетерозигот типа deoA deoB::Tn5/deoC deoD в конъюгационных скрещиваниях. Оперон deoСАВD расположен на 99.5 минуте генетической карты E.coli, в проксимальной области штамма HfrH (OriT – 97 мин). Гены этого оперона контролируют обратимые реакции катаболизма нуклеозидов: дезоксирибоальдолазу (deoC), тимидинфосфорилазу (deoA), фосфопентомутазу (deoB) и пуриннуклеозидфосфорилазу (deoD). Мутации deoB блокируют утилизацию нуклеозидов всех типов, тогда как мутации deoC - всех типов дезоксирибонуклеозидов. Мутации deoA – всех типов пиримидиновых дезоксирибонуклеозидов. Мутации deoD блокируют утилизацию всех типов пуриновых нуклеозидов. Дупликации, полученные в этих скрещиваниях, имели дикий фенотип по генам deoCAВ, и отличались от истинных рекомбинантов Deo+ сохранением антибиотикоустойчивости (наличие транспозонной вставки Тn5 в гене deoB). В тоже время все дупликации имели мутантный фенотип по гену deoD из-за нарушения транскрипции, связанной со вставкой транспозона в предшествующем по направлению транскрипции гене deoB. Другим доказательством образования гетерозиготных дупликаций была их способность к выщеплению сегрегантов родительского типа: deoC deoD и deoA deoB::Tn5.
Полученная таким путём дупликация до настоящего времени используется как модельная система для изучения гомологичной рекомбинации. Работа с данной модельной системой является удобной вследствие прямого соответствия изменений фенотипических и генотипических свойств штамма, что показано на таблице 1.
Таблица 1. Соответствия фенотепических маркёров генотипу исследуемых штаммов.
| Генотип | Фенотип | |||||
| Хоттингер Km | Tимин 3* Аденозин 300 | Глюкоза Тимин 25 | Глюкоза Тимидин 20 | Аденозин 1000 | Тимидин 1000 | |
| deoCdeoD | - | + | + | - | - | - |
| deoA deoB::Tn5 | + | - | - | + | - | - |
| deoCdeoD/deoA deoB::Tn5 | + | + | + | + | + | + |
| Deo+ | - | + | + | + | + | + |
*цифрами указаны количества мкг/мл добавляемого в среду вещества.
Цель и задачи исследования
Целью настоящей работы было изучение роли неравного кроссинговера в выщеплении сегрегантов из штаммов E. coli с тандемными дупликациями, гетерозиготными по генам deo-оперона. Определение основных путей рекомбинации в генетическом обмене в гетерозиготных тандемных дупликациях.
Для достижения цели были поставлены и решены следующие задачи:
- Определить роль неравного кроссинговера при гомологичной рекомбинации между повторами гетерозиготной дупликации, где гетерозиготность обусловлена вставкой транспозона Tn5 в гене deoB в одной из копий тандема. Определить вероятность образования сегрегантов с сохранением тандемного повтора и с образованием гаплоида.
- Определить соотношение частот внутрихромосомного или межсестринского обмена при гомологичной рекомбинации между повторами гетерозиготной дупликации с нарушением гомологии, связанной со вставкой транспозона Tn5 в deoB гене одной из копий тандема.
- Определить соотношение частот внутрихромосомного или межсестринского обмена при гомологичной рекомбинации между повторами гетерозиготной дупликации с нарушением гомологии, связанной с делецией 638 н.п. затрагивающей гены deoB и deoD одной из копий тандема.
- Выявить влияние генов RecBCD и RecF путей рекомбинации на генетический обмен между прямыми повторами ДНК в протяжённых тандемных дупликациях.
- Определение уровня экспрессии recA-промотора в исследуемых штаммах с гетерозиготными тандемными дупликациями.
- Определение причины конститутивного SOS-ответа в клетках мутантных по генам deoC deoD thyA.
Научная новизна и практическая ценность работы
Путём конъюгационного переноса гетерозиготной тандемной дупликации D4 (deoA deoB::Tn5/deoC deoD) в геном штамма JC7623, дефектного по генам recBC sbcBC, был получен штамм СМ1700. На основе штамма СМ1700, при помощи трансдукции, был получен штамм дефектный по гену recF (recF332::Tn3). Показано, что частоты образования сегрегантов DeoD+ у штаммов rec+, recBC sbcBC и recBC sbcBC recF существенно не отличаются. Это свидетельствует о том, что в исследуемой модели рекомбинационный обмен между прямыми повторами ДНК в протяжённых гетерозиготных тандемных дупликациях Escherichia coli является reсBC- и recF- независимым процессом.
Впервые показано, что в исследуемой тандемной дупликации, а также в одном из родительских штаммов (deoC deoD thyA) конститутивно активирован SOS-ответ. SOS-ответ определялся по превышению уровня экспрессии recA и colD промоторов в исследуемых штаммах по сравнению со штаммом дикого типа HfrH.
В работе показано, что при наличии вставки (Тn5) в одной из копий тандемного повтора в дупликациях типа deoA deoB::Tn5/deoC deoD, ведущим рекомбинационным механизмом при генетическом взаимодействии двух гомологичных повторов ДНК в тандемной дупликации является неравный кроссинговер, действующий на уровне сестринских хромосом, или «хроматид».
На дупликации типа 25 deoD-deoВ / deoC17 deoD8 thr::Tn9, не содержащей транспозонной вставки в deo-опероне, гетерозиготность которой обеспечивается делецией 638 н.п. затрагивающей гены deoB и deoD в одной из копии тандема показано, что частота образования сегрегантов DeoD+ сходна с частотой образования сегрегантов DeoD+ на модели deoA deoB::Tn5/deoC deoD. Рекомбинация между прямыми повторами в дупликациях 25 deoD-deoВ / deoC17 deoD8 thr::Tn9 происходит путём внутрихромосомного обмена.
Апробация работы и публикации
Основные результаты исследований по теме диссертации докладывались на 2 Всероссийских и Международных конференциях. Основные положения диссертации отражены в 5 публикациях, из которых 3 статьи и 2 материалов конференции. Диссертация была апробирована на заседании Секции Учёного Совета «Генетика микроорганизмов» от 22 марта 2007г, на семинаре «Неравный кроссинговер в гетерозиготных тандемных дупликациях» 25 сентября 2007г.
Структура и объём диссертации
Диссертационная работа состоит из введения, обзора литературы, описания объектов и методов исследований, результатов и обсуждения, заключения, выводов и списка литературы. Работа содержит страниц машинописного текста, 12 рисунков, 7 таблиц. Библиография включает 132 литературных источников отечественных и зарубежных авторов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования являлись 12 штаммов Escherichia coli К-12. Данные о происхождении и характеристика всех использованных в работе штаммов представлены в таблице 2. В работе так же был использован бактериофаг P1 vir полученный из ВКПМ (Всероссийская Коллекция Промышленных Микроорганизмов) ГосНИИгенетика.
Таблица 2. Характеристика штаммов Escherichia coli K-12, использованных в работе.
| Название | Hfr | Генотип | Происхождение |
| P-678 | F | thr leu rpsL lac gal mal xyl mtl thi | коллекция института (получен от д-ра Ф. Жакоба) |
| JC7623 | F | thr leu proA his argE rpsL thi recB21 recC22 sbcB15 sbcC | происходит из штамма д-ра А. Кларка. Данный штамм был получен при содействии д-ра С. Кулакаускаса (INRA, Франция). [Kushner S.R. et al., 1971] |
| JCD1310 | F | trp36 glyU (Sup) glySL xyl tsx tyrT (Sup) recF::Tn3 | CH1504 [Dimpfl J. et al., 1989] |
| CM1517 | HfrH | deoA28 deoB::Tn5 thi lac udp8 thyA | получен из штамма СМ1321. [Суходолец В.В., 1991] |
| CM1516 | HfrH | deoC17 deoD8 thi lac udp8 thyA | получен из штамма СВ780. [Суходолец В.В., 1991] |
| B310 | F’ | deoB thr leu his arg thyA thi recA13/F’ 25 deoB-deoD thr+ | штамм получен в ВКПМ - Всероссийская Коллекция Промышленных Микроорганизмов ФГУП ГосНИИгенетика |
| HfrH | HfrH | прототроф | из коллекции лаборатории (ГосНИИгенетика). |
| СМ1622 | HfrH | D4 [deoA28 deoB::Tn5/deoC17 deoD8] udp thyA lacY thi | CM1516CM1517 [Суходолец В.В. и др., 1996] |
| СМ1546 | HfrH | deoC17 deoD8 thr::Tn9 udp thyA lacY thi | получен в результате внесения трансдукцией (фаг Р1) транспозоного маркёра thr::Tn9 в штамм СМ1516. [Суходолец В.В., 1998] |
| CM1700 | F | D4 [deoB::Tn5/deoC17 deoD8] leu proA his argE rpsL thi recB21 recC22 sbcB15sbcC | СМ1622 JC7623 |
| CM1702 | F | Как СМ1700, но recF332::Tn3 | СМ1700 JCD1310 (P1) |
| CM1701 | HfrH | 25 deoB-deoD udp thyA lacA lacY thi | Получен введением в СМ1546 путём конъюгации делеции 25 от штамма В-310, несущего эту делецию на половом факторе |
Среды и условия культивирования бактерий. В качестве полноценной среды для роста клеток использовали бульон Хоттингера, изготовленный на основе мясного гидролизата в ГосНИИгенетика, агаризованный бульон Хоттингера, в который при приготовлении твердых сред добавляли агара 1.5%, также использовался L-бульон и агаризованный L-бульон. При работе с тиминовыми ауксотрофами в среду добавляли тимидин (5мкг/мл). В работе использовалась агаризованная минимальная среда M9 [Миллер Дж., 1976]. В качестве источника углерода использовали глюкозу (0.2%), а также тимидин или аденозин в составе селективных сред TdR1000 и AR1000, соответственно – по 1000 мкг/мл. В среду AR1000 в качестве источника тимидиловой кислоты добавляли тимидин (50 мкг/мл). Также использовали глюкозную среду с аденозином (300 мкг/мл) и тимином (3 мкг/мл) - GlART3. При изготовлении селективных сред добавки в минимальную среду вносили в следующих концентрациях (мкг/мл): тиамин (В1) – 1, гистидин – 40, аргинин – 25, пролин – 40, канамицин – 40, стрептомицин – 200, тимидин – 20, тимин – 25. Бактерии выращивались при 37°С в течение 24-72 часов и более (в зависимости от задачи эксперимента).
Генетические методы исследования.
Конъюгационное скрещивание типа HfrHfr проводили путём скрещивания культуры донора (~108 кл/мл) и реципиента(~109 кл/мл) в объёмном соотношении 1:2. Фенокопию штамма Hfr получали путём длительной (18 часов) инкубации при 37°С в условиях интенсивной аэрации. Конъюгационную смесь инкубировали в течение часа и высевали на селективные среды. Рекомбинационные клоны получали через 72 часа инкубации при 37°С.
Трансдукция. Суспензию бактерий реципиентного штамма в физ. растворе с СаСl2 заражали фагом Р1 vir, размноженном на донорном штамме при множественности заражения – 1. Через 20 минут инкубации при 37°С в смесь добавляли цитрат натрия и высевали на селективную среду.
Анализ генотипа рекомбинантов, полученных в конъюгационных и трансдукционных скрещиваниях, а также донорных свойств штаммов по неселектируемым маркёрам проводили метод реплик.
Получение клонов сегрегантов DeoD+ осуществляли путём высева суспензий бактериальных штаммов на среду AR1000 с последующей инкубацией чашек при 37С не менее 72 ч.
Определение свойства Hfr определяли по наличию рекомбинантов на среде со стрептомицином и газоном штамма Р678.
Определение чувствительности клеток к УФ-свету. Определение резистентности штамма к ультрафиолету проводили с применением эмпирически подобранной дозы (290 эрг/мм2), источником света УФ 254 нм служила лампа БУВ-15.
Молекулярно-биологические методы исследования.
Выделение и очистку хромосомной ДНК проводили при помощи метода экстракции щелочным фенолом [Маниатис и др., 1984].
Полимеразную цепную реакцию проводили с использованием реактивов фирмы «АмплиСенс», специально подобранных праймеров, синтезированных фирмой «Синтол», с помощью амплификатора Терцик МС-2 «ДНК технология».
Электрофорез фрагментов ДНК проводили в агарозном геле в ТАЕ-буфере с использованием агарозы «Sigma» [Маниатис и др., 1984], при напряжении электрического поля 15 В/см, с использованием ДНК-маркеров фирмы «Fermentas».
Выделение и очистку ДНК из арагозного геля проводили с использованием набора для очистки амплифицированной ДНК фирмы «Sigma» (США), согласно рекомендациям фирмы-производителя.
Секвенирование очищенных ПЦР-фрагментов ДНК проводили по методу Сенгера [Senger et al., 1977], используя автоматический секвенатор.
Компьютерный анализ подбора праймеров и анализ нуклеотидных последовательностей, полученных при секвенировании проводили при помощи компьютерных программ: NSBI Blast2, Oligo 6.31, Oligonucleotide Properties Calculator, Vector NTI suite 9.
Исследование уровня экспрессии recA гена в клетках проводилось при помощи сенсорных плазмид pDEWRecA и pDEWColD, несущих luxCDABE – гены Photorhabdus luminescens под контролем РrecA и РcolD промоторов соответственно. С помощью полученных биосенсоров по уровню люминисценции можно было судить об активности РrecA и РcolD промоторов.
Трансформация проводилась путём электропорации при 2500 В, и длинне импульса 10 мс. Электрокомпетентные клетки получали трёхкратным отмыванием культуры выращенной до OD 0,8 в бидистиллрованной воде.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Влияние основных путей рекомбинации RecBC и RecF на неравный генетический обмен в гетерозиготных тандемных дупликациях.
Не смотря на то, что в дупликациях типа deoA deoB::Tn5/deoC deoD присутствует аллель deoD+, он фенотипически не проявляется из-за полярного эффекта транспозонной вставки в предшествующем гене deoB. Но все дупликации данного типа с высокой частотой выщепляют сегреганты deoD+ (способные катаболизировать пуриновые нуклеозиды).
Для образования клонов deoD+, штаммы, содержащие тандемные дупликации, высевались на среду с аденозином (AR1000) в качестве единственного источника углерода. Отпечатки суспензий исследуемых штаммов, выросшие на такой среде, имеют характерную форму, отличающую их от прототрофных по гену deoD штаммов (рис 1).
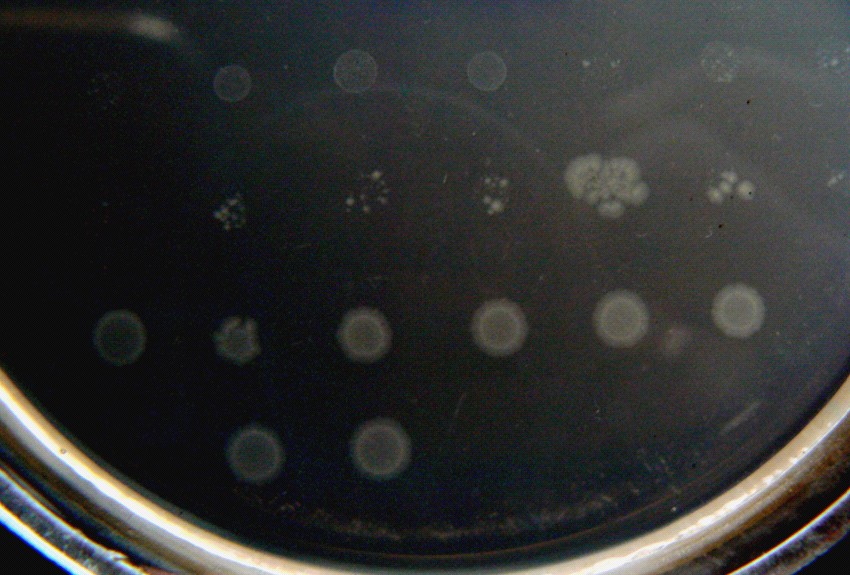
Рекомбинанты DeoD+
Прототрофы DeoD+
Рисунок 1. Морфология отпечатков суспензий, давших рекомбинантов на среде с аденозином.
В нашей работе была изучена относительно стабильная дупликация D4 в штамме СМ1622 размером ~46 тпн. Было показано, что среди выщепляемых ею сегрегантов DeoD+ диплоиды по генам deo-оперона составляют 72%. Для образования диплоидных и гаплоидных cегрегантов DeoD+, селектируемых на среде AR1000, требуется перекрёст в короткой области хромосомы - между генами deoB и deoD (рис. 2). В 28% случаев дупликация распадалась (рис. 2. сплошная линия)
Рисунок 2. Схематическое изображение неравного обмена между сестринскими хромосомами в дупликации D4 при образовании гаплоидных (сплошная линия) и диплоидных (пунктир) сегрегантов DeoD+.
Не смотря на это, выщепление сегрегантов происходит с очень высокой частотой, приближающейся к 100% при достаточно длительной инкубации чашек. Образование рекомбинантов DeoD+ растянуто во времени, что можно наблюдать при высеве на чашки с селективной средой AR1000 достаточно густых суспензий бактериальных клеток: в этом случае через 72 часа роста наблюдается появление только небольшого числа нормальных (крупных) колоний и большого числа мелких микроколоний, отстающих в росте. Это означает, что практически каждая клетка, несущая дупликацию имеет шанс выжить на селективной среде.
Для изучения влияния ReсF-пути и RecBCD – пути рекомбинации на межсестринскиий обмен, тандемная дупликация D4 (deoA deoB::Tn5 / deoC deoD), была перенесена из штамма СМ1622 в геном штамма JC7623 (recBC sbcBC) путём конъюгации. Полученный таким образом штамм получил название СМ1700. Путём трансдукции с использованием фага Р1 мутация recF была перенесена в СМ1700, полученный штамм назвали СМ1702. Полученные штаммы СМ1700 и СМ1702, а также исходный штамм СМ1622 были использованы для определения частоты образования сегрегантов DeoD+ на селективной среде AR1000, содержащей аденозин в качестве единственного источника углерода и энергии для роста. В таблице 3 представлены данные образования сегрегантов DeoD+ штаммами различного генотипа по генам rec, несущими дупликацию D4. Все штаммы образуют сегреганты DeoD+ с очень высокой частотой. Среди исследованных штаммов у СМ1622 была обнаружена высокая частота образования рекомбинантов, близкая к 0.9. Мутации recBC sbcBC recF снижают частоту рекомбинации незначительно. В то же время, частота образования сегрегантов DeoD+ в recA-мутантах значительно снижена и составляет менее 0.01.
Таблица 3. Частота образования сегрегантов DeoD+ штаммами различного генотипа по генам rec, несущими дупликацию D4.
| Штамм | Исследуемый генотип | Количество жизнеспособных клеток в 1 мл суспензии по результатам их тестирования на средах | Сегреганты DeoD+, % | |
| AR1000 | Хоттингера | |||
| СМ1622 | rec+ | 1.1 109 | 1.2 109 | 92 |
| СМ1625 | recA- | - | - | <1 |
| СМ1700 | recBC sbcBC | 7.4 108 | 1.1 109 | 67 |
| СМ1702 | recBC sbcBC recF | 7.1 108 | 1.0 109 | 71 |
Тот факт, что мутация recF в геноме, дефектном по основному пути рекомбинации ReсBCD, не влияет на способности бактерий к образованию рекомбинантов DeoD+, очевидно, свидетельствует в пользу того, что рекомбинационный обмен между прямыми повторами ДНК в гетерозиготных тандемных дупликациях на исследуемой модели является не только reсBC-, но и recF- независимым.
2. Определение уровня экспрессии recA-промотора в исследуемых штаммах с гетерозиготными тандемными дупликациями.
Высокая частота выщепления сегрегантов DeoD+ послужила поводом для исследования уровня экспрессии recA-промотора в штаммах несущих дупликацию D4. С помощью биосенсеров RecA::luxCDABЕ и ColD::luxCDABЕ, полученных транскрипционным слиянием промоторов recA и colD генов и lux-оперона Photorabdus luminenscens нами был проверен уровень транскрипции гена RecA в штамме СМ1622, штаммах СМ1516 (deoC deoD thyA) и СМ1517 (deoA deoB::Tn5 thyA), а также в штамме дикого типа HfrH (Рис 3). Было обнаружено, что уровень RecA в штаммах, несущих мутации deoC deoD на фоне тиминовой ауксотрофности (thyA) в 22 раза превышает уровень RecA, в штамме дикого типа и СМ1517(deoA deoB::Tn5 thyA). Причём, генотип deoC deoD thyA проявлял себя повышенным уровнем экспрессии recA-промотора как в штаммах несущих дупликации D4 так и в одном из родительских штаммов CM1516 (deoC deoD thyA). На рисунке 3 представлены данные люминисценции в штаммах СМ1516, CM1517 и HfrH несущих плазмиду pDWColD в зависимости от OD. Уровень люминисценции штаммов, несущих плазмиду pDWColD свидетельствует об уровне экспрессии промоторов, регулируемых RecA-LexA системой. Превышение люминисценции штамма СМ1516 (deoC deoD thyA), несущего плазмиду pDWColD, по сравнению с диким типом HfrH (pDWColD) на всех стадиях роста культуры указывает на то что, на фоне мутаций deoC deoD thyA наблюдается конститутивный SOS-ответ в клетках.
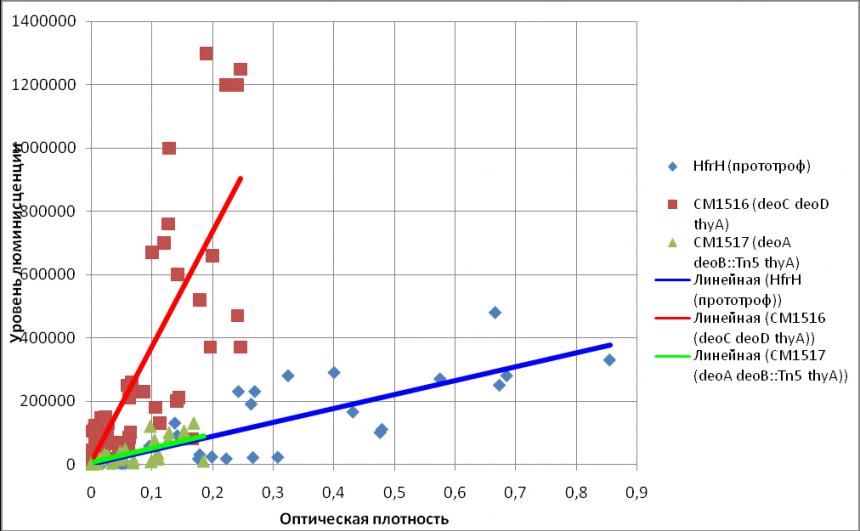
Рисунок 3. Уровень люминисценции в штаммах СМ1516, CM1517 и HfrH несущих плазмиду pDWColD в зависимости от OD.
Мутация по гену deoC, кодирующей дезоксирибоальдолазу приводит к накоплению в клетке дезоксирибозо-5-фосфата. Мутация по гену deoB, кодирующего фосфопентомутазу, на фоне мутации deoC приводит к блокированию накопления дезоксирибозо-5-фосфата. Нами было показано, что уровень люминисценции штаммов несущих двойную мутацию по генам deoC deoB трансформированных плазмидой pDWColD не превышал уровень люминисценции штаммов дикого типа. На основании этого можно предположить что повышенный уровень экспрессии экспрессии recA-промотора связан с накоплением в клетке дезоксирибозо-5-фосфата.
Таким образом, показано, что высокий уровень экспрессии RecA-LexA - индуцибельных промоторов связан с мутантным генотипом deoC deoD thyA, а не собственно с дупликацией D4.
2. Роль неравного кроссинговера при гомологичной рекомбинации между повторами гетерозиготной дупликации, со вставкой транспозона Tn5 в гене deoB в одной из копий тандема.
В результате изучения генетически маркированных дупликаций у Escherichia coli выяснилось, что часть рекомбинантов, выщепляемых дупликациями на селективных средах, сохраняют диплоидное состояние. Но у таких дупликаций обычно происходит огомозигочивание по некоторым генам тандема, что может быть следствием неравных генетических обменов между сестринскими хромосомами.
Неравный кроссинговер между сестринскими хромосомами в области дупликации должен приводить к образованию двух реципрокных продуктов – гаплоидных сегрегантов и трипликаций. Но трипликации обычно нестабильны и регистрируются в опыте в качестве вторичных сегрегантов.
В проведённой нами работе был сделан анализ 20 диплоидных сегрегантов DeoD+ KmR независимого происхождения, полученных у дупликации D4, описанной ранее.
Сегреганты DeoD+, у которых диплоидное состояние сохраняется, имеют полный фенотип DeoC+ DeoA+ DeoB+ DeoD+ KmR. Для получения независимых сегрегантов данного типа 20 отдельных колоний штамма СМ1622 из рассева на полноценной среде были взяты для получения 20 суспензий, из которых после посева образцов суспензий с помощью репликатора на среду AR1000 было отобрано по одному сегреганту DeoD+ KmR.
Образование диплоидных сегрегантов, способных расти на аденозине, возможно лишь при освобождении аллеля deoD+ из под влияния полярного эффекта транспозона Тn5 в результате перемещения рекомбинационным путём в копию не содержащую транспозона. Теоретически возможны два варианта такого перемещения. При внутрихромосомном обмене селектируемый рекомбинант DeoD+ KmR остаётся гетерозиготным по гену deoD, т.к. мутантная аллель гена deoD перемещается в зону полярного эффекта транспозона (Рис. 4а). В случае неравного обмена между сестринскими хромосомами рекомбинант DeoD+ KmR огомозигочивается по селектируемому аллелю deoD+ (Рис. 4б).
Таким образом, образование диплоидных сегрегантов DeoD+ KmR теоретически может произойти как в результате неравного сестринского обмена, так и в результате внутрихромосомного обмена.
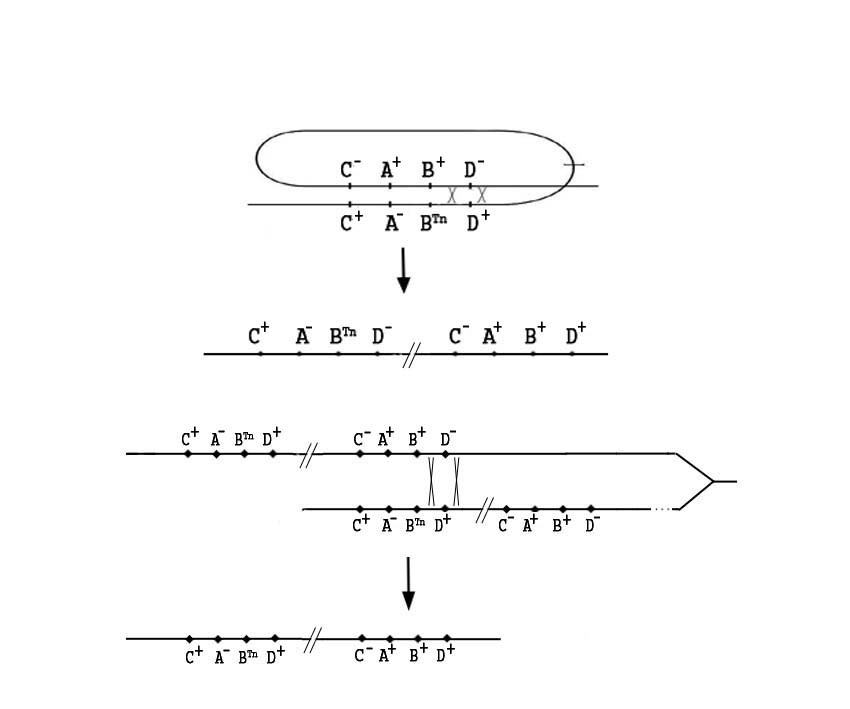
а.
б.
Рисунок 4. Схематическое изображение двух возможных путей образования диплоидных сегрегантов DeoD+ KmR у штаммов, несущих дупликации D4:
а – внутрихромосомный обмен;
б – неравный сестринский обмен.
Таким образом, задачей исследования было определение фенотипически неразличимых комбинаций аллелей – deoB::Tn5 deoD или deoB::Tn5 deoD+ содержащихся в полученных диплоидных сегрегантах. Для этого в рассеве каждого диплоидного рекомбинанта на полноценной среде был выделен спонтанный рекомбинант HfrH deoA deoB::Tn5 (фенотип DeoA DeoB DeoD KmR).
Для получения необходимого гаплоидного сегреганта в большинстве случаев было достаточно проверить 50 колоний исходного штамма. Частота образования сегрегантов HfrH deoA deoB::Tn5 по суммарным данным составляет 3.6% (49/1350), что приблизительно соответствует частоте образования гаплоидных сегрегантов другого типа deoC 4.5% (61/1350). Определение того, какой из аллелей гена deoD (мутантный или дикий) содержат полученные сегреганты HfrH deoA deoB::Tn5, проводили генетическим путём, а именно при помощи скрещивания полученных гаплоидов со штаммом СМ1516, несущим туже самую мутацию в гене deoD. Данная мутация, согласно полученным нами результатам секвенирования гена deoD в штамме СМ1516, представляет собой выпадение одного нуклеотида (С) в положении 563, что приводит к сдвигу рамки считывания.
Образование рекомбинантов deoD+ в конъюгационных скрещиваниях штамма СМ1516 и гаплоидов HfrH deoA deoB::Tn5, может происходить лишь в том случае, если последние несут аллель deoD дикого типа (Таб. 4). В качестве контрольного скрещивания производили отбор рекомбинантов DeoC+ DeoA+ DeoB+ на среде TdR1000.
Все рекомбинанты DeoD+ (DeoA+ DeoB+), полученные в проведённых скрещиваниях (проверено 320 колоний), наследовали аллель deoC донора, а рекомбинанты DeoC+ DeoA+ DeoB+ (проверено 320 колоний) – аллель deoD в соответствии со схемой представленной на рисунке 5.
Таблица 4. Результаты конъюгационных скрещиваний штамма СМ1516 (HfrH deoC deoD) и гаплоидных сегрегантов DeoD (HfrH deoA deoB::Tn5) полученных из штамма СМ1622 (D4).
| № клона* | Число рекомбинантов на селективных средах** | |
| TdR1000 | AR1000 | |
| 1 | 2 | 3 |
| 1 | 14 | 15 |
| 2 | 36 | 0*** |
| 3 | 18 | 36 |
| 4 | 14 | 37 |
| 5 | 15 | 9 |
| 6 | 36 | 42 |
| 7 | 104 | 48 |
| 8 | 124 | 56 |
| 9 | 23 | 10 |
| 10 | 31 | 39 |
| 11 | 131*** | 13 |
| 1 | 2 | 3 |
| 12 | 41 | 89 |
| 13 | 148 | 54 |
| 14 | 42 | 51 |
| 15 | 59 | 23 |
| 16 | 42 | 52 |
| 17 | 154 | 0*** |
| 18 | 20 | 0*** |
| 19 | 53 | 32 |
| 20 | 48 | 47 |
*Номера гаплоидов соответствуют номерам диплоидных штаммов DeoD+ - производных СМ1622;
** В 0,01 мл конъюгационной смеси;
*** В 0.1 мл конъюгационной смеси.
Согласно полученным данным 17 из 20 штаммов HfrH deoA deoB::Tn5, участвовавших в конъюгационном скрещивании на среде AR1000, стали DeoD+, т.е. они несли ген дикого типа. Три штамма, сохранившие фенотип DeoD были проанализированы на присутствие гена deoD в ПЦР, где в качестве контроля использовали 4 гаплоидных штамма, ставших DeoD+ в скрещивании с СМ1516, и штаммы дикого типа по генам deo-оперона HfrH.
Рисунок 5. Конъюгационная мерозигота скрещивания HfrH deoA deoB::Tn5 (реципиент) HfrH deoC deoD (донор). Рекомбинанты deoD+ deoC обозначены сплошной линией; сегреганты deoC+ deoA+ deoB+ deoD - пунктиром.
В результате проведения ПЦР было выяснено, что указанные штаммы не обнаруживали наработку ПЦР продукта гена deoD. Данный результат может быть объяснён образованием делеций в области гена deoD, примыкающей к району локализации транспозона Tn5 в соседнем гене deoB. В тоже время все контрольные штаммы, использованные в эксперименте, давали наработку ПЦР - продукта гена deoD. Делетирование гена deoD у некоторых гаплоидных сегрегантов может быть связано с транспозирующей активностью Tn5 в прилегающей к нему области хромосомы. Во всяком случае, ни один из исследованных нами 20 штаммов deoA deoB::Tn5 не наследовал мутантного аллеля гена deoD, что однозначно свидетельствовало о преимущественном участии неравного кроссинговера в рекомбинациях между тандемными повторами ДНК в дупликации типа deoA deoB::Tn5/deoC deoD при нарушении гомологии между тандемными повторами ДНК связанной со вставкой транспозона.
Таким образом, в 17 из 20 случаев при образовании рекомбинантов DeoD+ генетический обмен происходит путём неравного кроссинговера между сестринскими хроматидами.
3. Роль неравного кроссинговера при гомологичной рекомбинации между повторами гетерозиготной дупликации с нарушением гомологии, связанной с делецией 638 н.п. затрагивающей гены deoB и deoD одной из копий тандема.
В другой части нашей работе мы попытались выяснить, не зависит ли высокая частота образования рекомбинантов DeoD+ от присутствия транспозона Тn5 непосредственно в области рекомбинационных перекрёстов, приводящих к экспрессии аллеля deoD в дупликации. Для этой цели были получены дупликации, не содержащие транспозонной вставки в deo-опероне.
Для получения стабильных дупликаций данного типа нами был использован штамм СМ1546, несущий транспозонную вставку (Tn9) в треониновом гене (0/100 минута генетической карты Escherichia coli). Другим штаммом, использованным для получения дупликации был штамм СМ1701, несущий делецию 25, которая затрагивает гены deoD и deoВ deo-оперона. Было определено, что 25 имеет протяженность 638 п.н. (начинается с 947 п.н. гена deoВ и заканчивается 303 п.н. гена deoD).
В скрещиваниях СМ1546 (донор) СМ1701 на селективной среде содержащей тимин (25 мкг/мл), хлорамфеникол (10 мкг/мл), но не содержащей треонина производили отбор сегрегантов Thr+KmR, несущих дупликации 25 deoD-deoВ /deoC17 deoD8 thr::Tn9.
Как ожидалось, дупликации этого типа должны были выщеплять сегреганты DeoD+ в результате внутригенной рекомбинации между мутациями deoD8 и 25. Таким образом, для образования рекомбинантов DeoD+ перекрёст должен происходить в относительно короткой области хромосомы длиной в 260 п.н. (с 563 до 303 п.н.).
Нами показано, что частота образования сегрегантов DeoВ+ DeoD+ на селективной среде с аденозином в качестве единственного источника углевода составляет 10-20% от числа высеянных клеток с дупликациями. Однако в отличие от выщепления сегренантов DeoD+ дупликациями типа deoA deoB::Tn5/deoC deoD, где выщепление было растянуто во времени, количество сегрегантов DeoВ+ DeoD+, выщепляемых дупликацией 25 deoD-deoВ / deoC17 deoD8 thr::Tn9 не увеличивалось уже через 72 часа инкубации чашек. Это показывает, что в отсутствие выраженного нарушения гомологии между двумя повторами расстояние в 260 п.н. является достаточно большим для того, что бы рекомбинационный процесс завершился сравнительно быстро.
Ранее нами было показано, что в дупликациях типа deoA deoB::Tn5 / deoC deoD основной путь образования диплоидных рекомбинантов DeoD+ является неравный кроссинговер, что было показано на основании выщепления огомозигоченых сегрегантов, образование которых возможно лишь при неравном межсестринском обмене между копиями тандемной дупликации.
В тоже время проведённый нами анализ диплоидных сегрегантов DeoВ+ DeoD+, выщепляемых дупликацией 25 deoD-deoВ / deoC17 deoD8 thr::Tn9, не выявил присутствия среди них форм, огомозигоченых по сцепленному с deoD8 рецессивному гену deoC17. Это означает, что образование сегрегантов DeoD+ в данном случае протекало за счёт внутрихромосомного обмена, а не за счёт неравных межсестринских обменов.
По данным таблицы 5 видно, что дупликации №1, 2, исходя из преимущественного выщепления ими гаплоидов thr+deoC, должны иметь порядок копий указанный на рисунке 6а. Тогда как дупликации №3,4, выщепляющие как гаплойды thr+deoC, так и thrdeoC, противоположную последовательность, представленную на рисунке 6б.
Таблица 5. Генотип сегрегантов DeoD+, выщепляемых дупликациями типа 25 deoD-deoВ / deoC17 deoD8 thr::Tn9.
| № дупликации | Число сегрегантов DeoD+ | ||||||
| Диплоиды Thr+CmR | Гаплоиды* | Всего | |||||
| Thr+CmS | ThrCmR | ||||||
| DeoD+ | DeoC | DeoD+ | DeoC | DeoD+ | DeoC | ||
| 1 | 14 | 0 | 2 | 44 | 0 | 2 | 62 |
| 2 | 8 | 0 | 0 | 46 | 0 | 0 | 54 |
| 3 | 37 | 0 | 0 | 2 | 0 | 28 | 67 |
| 4 | 32 | 0 | 0 | 16 | 0 | 20 | 68 |
*Некоторые сегреганты данного типа могли представлять собой диплоиды огмозигоченные по гену thr+.
В случае варианта 6а. для образования гаплоидного сегреганта DeoВ+ DeoD+ достаточно одного перекрёста, в случае варианта 5б. необходимо три перекрёста. Данная закономерность имеет место независимо от того, происходит ли межсестринский неравный кроссинговер или внутрихромосомный обмен.
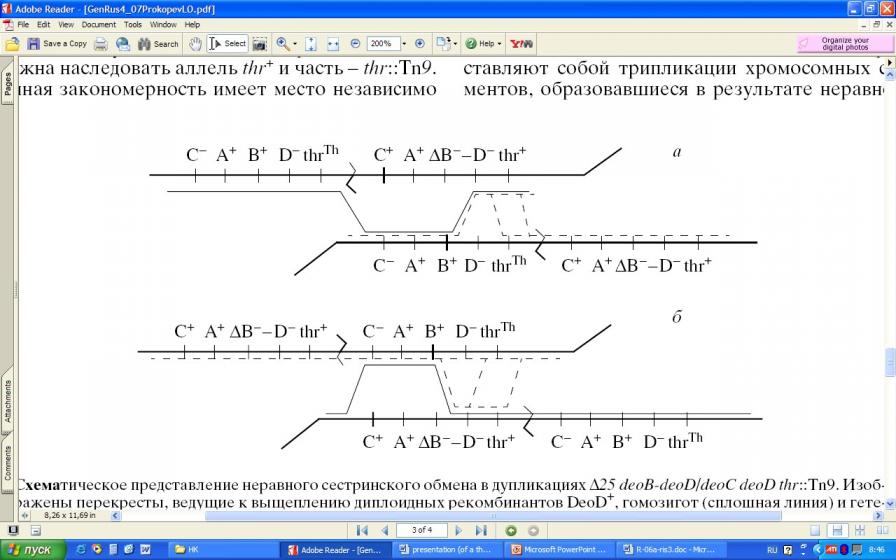

Рисунок 6. Образование диплоидных рекомбинантов DeoD+, гомозигот (сплошная линия) и гетерозигот (пунктир) по аллелю deoC дупликациями типа 25 deoD-deoВ /deoC17 deoD8 thr::Tn9. а, б – см. объяснения втексте.
Но если происходит неравный кроссинговер между сестринскими хромосомами, то дупликации всех типов должны выщеплять около половины диплоидных сегрегантов DeoD+ (thr+ CmR), огомозигоченные по аллелю deoC+. Как показано на рисунке 6 при любой последовательности копий в дупликации один из двух возможных вариантов диплоидов DeoD+ должен быть огомозигочен по аллелю deoC. В действительности диплоидных сегрегантов DeoD+ DeoC не обнаруживается. Отсюда следует, что диплоидные сегреганты DeoD+ образовались не путём сестринского обмена, а в результате внутрихромосомной рекомбинации.
Альтернативное объяснение полученных данных может состоять в том, что все сегреганты фенотипа DeoD+ Thr+ CmR на самом деле представляют собой трипликации хромосомных сегментов, образовавшихся в результате неравного сестринского обмена. И действительно, трипликации должны быть первичным продуктом такого обмена. Однако в норме трипликации протяжённых хромосомных сегментов нестабильны и их сохранение маловероятно. Поэтому вывод об участии внутрихромосомного обмена в образовании сегрегантов DeoD+ в отсутствии нарушения гомологии ДНК непосредственно в районе рекомбинации нам кажется наиболее вероятным.
ВЫВОДЫ
- Гомологичная рекомбинация между повторами гетерозиготной тандемной дупликации D4 (deoA deoB::Tn5/deoC deoD), происходит по пути неравного кроссинговера. Образование сегрегантов DeoD+ происходит преимущественно с сохранением тандемного повтора.
- Частота межсестринского обмена при гомологичной рекомбинации между повторами гетерозиготной дупликации D4 (deoA deoB::Tn5/deoC deoD) составляет не менее 85% при образовании сегрегантов DeoD+.
- При гомологичной рекомбинации между повторами гетерозиготной дупликации с нарушением гомологии, связанной с делецией 638 н.п. затрагивающей гены deoB и deoD одной из копий тандема рекомбинация происходит по пути внутрихрмосомного обмена.
- Влияния мутаций по генам recBCD sbcBC и recF на частоту генетического обмена между прямыми повторами ДНК в протяжённой тандемной дупликации D4 (deoA deoB::Tn5/deoC deoD) не обнаружено.
- В штаммах несущих мутации по генам deoC deoD thyA повышен уровень экспрессии recA-промотора, что свидетельствует о конститутивном SOS-ответе.
СПИСОК РАБОТ ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Суходолец В.В., Прокопьев В.В. Неравный генетический обмен в тандемных дупликациях у Escherichia coli может представлять особый путь гомологичной рекомбинации // Генетика. 2005. Т. 41. №3 С. 307-311. (Sukhodolets V.V., Prokop’ev V.V. Unequal genetic exchange in Escherichia coli tandem duplications may represent a special pathway of homologous recombination // Rus. J. Genetics. 2005. V. 41. №3. P. 233-236.)
- Прокопьев В.В., Суходолец В.В. Неравный кроссинговер – основной путь гомологичной рекомбинации в тандемных дупликациях у Escherichia coli // Генетика. 2005. Т. 41. №8. С. 1038-1044. (Prokop’ev V.V., Sukhodolets V.V. Unequal crossing over is the principal pathway of homologous recombination in tandem duplications of Escherichia coli // Rus. J. Genetics. 2005. V. 41. №8. P. 844-849.)
- Прокопьев В.В. Механизм неравного кроссинговера в гетерозиготных тандемных дупликациях у Escherichia coli (C. 52-53). / Материалы международной школы-конференции молодых учёных Системная биология и биоинженерия, Москва 28 ноября - 2 декабря 2005 г. - М..: МАКС Пресс, 2005. -252с.
- Прокопьев В.В., Суходолец В.В. Неравный кроссинговер у Escherichia coli, как механизм исправления генных повреждений в гетерозиготных тандемных дупликациях (V.75. C.208) / Биология – наука XXI века: 10-я Пущинская школа конференция молодых учёных, посвящённая 50-летию Пущинского научного центра РАН (Пущино 17-21 апреля 2006 года). Сборник тезисов.
- Прокопьев В.В., Суходолец В.В. Изучение рекомбинации в гетерозиготных тандемных дупликациях у Escherichia coli // Генетика. 2005. Т. 43. №4. С. 570-574. (Prokop’ev V.V., Sukhodolets V.V.† Studying recombination in heterozygous tandem duplications in Escherichia coli // Rus. J. Genetics. 2007. V. 43. №4. P. 570-574.)

