Выделение и характеристика гемолизина ii bacillus cereus
На правах рукописи
Ковалевская Жанна Ивановна
Выделение и характеристика гемолизина II Bacillus cereus
03.00.03 – Молекулярная биология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
г. Москва 2007
Работа выполнена в лаборатории молекулярной микробиологии Института биохимии и физиологии микроорганизмов имени Г.К. Скрябина РАН, г. Пущино, в лаборатории молекулярной физиологии клетки Института биофизики клетки РАН, г. Пущино.
Научные руководители: кандидат биологических наук, старший научный
сотрудник, Солонин Александр Сергеевич, ИБФМ РАН
кандидат биологических наук,
Терновский Вадим Игоревич, ИБК РАН
Официальные оппоненты: доктор физико-математических наук, профессор,
Харакоз Дмитрий Петрович, ИТЭБ РАН, г.Пущино
доктор биологических наук, профессор,
Азизбекян Рудольф Рубенович, ФГУП ГосНИИгенетика,
г. Москва
Ведущая организация: Институт биоорганической химии РАН им. академиков
М.М. Шемякина и Ю.А. Овчинникова, г. Москва
Защита диссертации состоится 13 ноября 2007г. в 14:00 часов на заседании Диссертационного Совета Д217.013.01 при ФГУП «ГосНИИ генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, 1. Факс: (495) 315-05-01.
С диссертацией можно ознакомиться в научной библиотеке ФГУП ГосНИИгенетика.
Автореферат разослан 11 октября 2007 г.
Ученый секретарь
Диссертационного совета,
кандидат биологических наук Заиграева Г. Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Одним из основных фундаментальных направлений современных микробиологии и медицины является изучение патогенности микроорганизмов. В настоящее время известно, что патогенные бактерии вырабатывают широкий спектр веществ, как непосредственно повреждающих или убивающих клетки макро- и микроорганизмов, так и способствующих проникновению бактерий в организм хозяина, вследствие преодоления его защитных систем. Эти соединения играют главную роль в развитии заболеваний, вызываемых бактериями (McDonel et al., 1986).
Среди многообразия таких веществ можно выделить цитолитические токсины, которые играют немаловажную роль в патогенезе. Характерными примерами токсинов являются такие цитолизины, как фосфолипаза С Clostridium perfringens - основной фактор, ответственный за развитие газовой гангрены, отёчный и летальный токсины Bacillus anthracis, обеспечивающие вирулентность, альфа-токсин Staphylococcus aureus, вызывающий целый ряд клинических эффектов при стафилококковых инфекциях и являющийся -складчатым каналообразующим цитолизином.
Интерес к исследованиям -складчатых каналообразующих токсинов не ограничивается лишь медицинской сферой. Изучение этих белков стимулируется и тем, что они стали ценными инструментами при исследовании клеточной физиологии и функционирования клеточных мембран и превосходными модельными объектами для выяснения связи между структурой и функцией белка. -Складчатые каналообразующие цитолизины являются хорошей моделью в изучении белок-мембранного взаимодействия. В последнее время они нашли своё применение и в биотехнологии, в создании клетко-подобных биореакторов, что позволяет значительно увеличить экспрессию белков (Noireaux, 2004), а также в конструкции нанопор (Merzlyak, 2005) и биосенсоров (Gu, 2001). К -складчатым каналообразующим токсинам относят ряд цитолизинов Staphylococcus aureus (-токсин, лейкоцидины, -гемолизин), -токсин Clostridium perfringens и CytK токсин B. cereus.
Изучение механизмов действия этих токсинов и их функции в патогенезе представляется одним из наиболее актуальных направлений в исследовании молекулярных основ патогенности и вирулентности микроорганизмов. Особый интерес вызывают токсины цереусной группы микроорганизмов рода Bacillus, в эту группу входят: B. anthracis, известный как опасный патоген, вызывающий сибирскую язву; B. thuringiensis – являющийся патогенным для насекомых и широко использующимся для производства инсектицидных препаратов, что ведет к широкомасштабному внесению и неконтролируемому распространению этого микроорганизма в окружающей среде; B. cereus, который относится к условно-патогенным для теплокровных, но является одним из основных бактериальных загрязнителей продуктов питания, лекарственных и косметических препаратов. Эти микроорганизмы продуцируют ряд цитолитических белков, рассматриваемых в качестве потенциальных факторов патогенности. В связи с выше изложенным, важно определить степень безопасности этих микроорганизмов для животных и человека и изучить участие отдельных токсинов, продуцируемых этими бактериями в патогенном процессе.
B. cereus может вызывать диаррейный и эметический синдромы, а также заболевания глаз, маститы и другие болезни. Ряд внеклеточных токсинов B. cereus, обладают гемолитической активностью и рассматриваются в качестве потенциальных факторов патогенности (Drobniewski, 1993). Один из цитолитических порообразующих токсинов B. cereus – гемолизин II (HlyII) представляет особый интерес, так как он является гомологом такого опасного токсина, как альфа-токсин Staphylococcus aureus. Более того, он широко распространен среди бацилл цереусной группы, так как его ген обнаружен также в клетках B. thuringiensis, B. weihenstephanensis и B. anthracis.
К настоящему времени ряд гемолизинов B.cereus получен в очищенном состоянии и активно изучаются в самых разнообразных аспектах, тогда как гемолизин II до сих пор практически не изучен, поскольку не удавалось получить высокоочищенный препарат белка. Благодаря высокой гомологии с альфа-токсином есть основания считать, что гемолизин может играть немаловажную роль в патогенезе и поэтому требуется его всестороннее изучение. Данное обстоятельство определяет актуальность разработки метода очистки, получения гомогенного препарата белка и исследования его свойств.
Цели и задачи исследования. Целью настоящей работы являлось проведение структурно-функционального анализа гемолизина II Bacillus cereus.
Для достижения указанной цели решались следующие задачи:
- Подобрать оптимальные условия для максимальной экспрессии гена гемолизина II Bacillus cereus в клетках E. coli.
- Разработать метод очистки препарата HlyII.
- Определить роль сигнальной пептидазы в процессинге HlyII.
- Изучить механизм действия гемолизина II с использованием искусственных и клеточных мембран.
- Изучить свойства пор, формируемых гемолизином II в естественных и искусственных мембранах, механизм и условия порообразования.
- Изучить цитолитическое действие и влияние на макроорганизмы гемолизина II.
Данная работа выполнена в лаборатории молекулярной микробиологии Института биохимии и физиологии микроорганизмов имени Г.К. Скрябина РАН.
Научная новизна работы. Впервые получен высокоочищенный препарат гемолизина II B. cereus, исследованы его свойства и определен механизм действия.
Практическое значение работы. Результаты работы могут быть использованы в медицине, биотехнологии, сельском хозяйстве. Получение чистого препарата гемолизина II и изучение его структурно-функциональных особенностей даёт возможность для выяснения возможности его участия в патогенезе и поиска подходов для нейтрализации действия токсина. Препарат гемолизина II может быть использован в создании клетко-подобных биореакторов, что позволяет значительно увеличить экспрессию белков, а также в конструкции нанопор. Полученные результаты можно применять в нанотехнологии, конструировании мембранных пор с определёнными свойствами (с разной проводимостью, селективностью и т.д.). Такие поры могут быть употреблены как компоненты фильтров, биосенсоров и других наноустройств. Тот факт, что гемолизин II широко распространен среди штаммов B. thuringiensis, применяемых как биологический инсектицид, заставляет усилить внимание к тщательному анализу используемых штаммов на предмет их безопасности для человека и животных, а также заостряет вопрос о правомочности использования данного микроорганизма в качестве инсектицидного препарата.
Публикации и апробация работы. По материалам диссертации опубликовано 2 статьи. Результаты работы были представлены на 7-ой Пущинской конференции молодых ученых (Пущино, апрель 2003), на конференции ИБФМ РАН (Пущино, декабрь 2003), на международной конференции Gordon Research Conference (Andover, USA, 2004), на 3-ей международной конференции из серии “Наука и бизнес” (Пущино, июнь 2006), на 106-ой конференции American Society for Microbiology (Orlando, 2006).
Структура и объем диссертации. Диссертационная работа изложена на 156 страницах машинописного текста и состоит из следующих разделов: введение, обзор литературы, материалы и методы, результаты и обсуждение, выводы и список цитируемой литературы. Список литературы включает 261 источников. Работа содержит 40 рисунков и 4 таблицы.
СОДЕРЖАНИЕ РАБОТЫ
1. Продукция зрелого гемолизина II при помощи секреционного аппарата E. coli
Гемолизин II был очищен из культуральной среды, выращенных при оптимальных условиях клеток E. coli Z85 (pUJ2) (Рис. 2А) с использованием эмпирической аффинной хроматографии. При подборе оптимальных условий бактериального роста и индукции (Табл.1) была обнаружена зависимость уровня продукции HlyII от температуры культивирования клеток E. coli Z85 трансформированных плазмидой pUJ2. Уровень продукции токсина определяли по гемолитической активности в культуральной среде и внутри клетки.
Табл. 1. Влияние условий культивирования на продукцию гемолизина II
рекомбинантными клетками E. coli Z85 (pUJ2)
| Условия культивирования | гемолитическая активность, ГЕ/мл | ||
| 18°C | 24°C | 37°C | |
| в присутствии ИПТГ | 20 | 120 | 1 |
| без ИПТГ | 10 | 40 | 1 |
Наибольшая продукция токсина была получена при 24°С. При 37°С ни значительная активность токсина в культуральной среде, ни накопление белка внутри клетки не были обнаружены, видимо из-за температурной инактивации гемолизина II. Также необходимыми факторами были сильная аэрация и повышение концентрации NaCl до 15-20 г/л, что приводит к умеренному увеличению гемолитической активности в культуральной среде. Полученная гемолитическая активность в культуральной среде составила 100-120 ГЕ/мл (ГЕ - гемолитическая единица), что в 4-5 раз выше активности в неочищенном экстракте разрушенных клеток. Это может указывать на то, что гемолизин II является секреторным белком.
Внеклеточный HlyII был очищен из культуральной среды по схеме представленной в таблице 2 (Рис. 1В). Аффинная хроматография проводилась на эмпирически подобранном аффинном сорбенте с золотисто-желтым лигандом (Рис. 1А), который является одним из 30-ти различных хлортриазиновых красителей, ковалентно связанных с гидрофильным носителем Sepharose 4В. Очищенный белок имел молекулярную массу равную 42 кДа меньшую молекулярной массы гемолизина II, вычисленного из нуклеотидной последовательности (45,6 кДа). Это может свидетельствовать о том, что HlyII синтезируется в форме предшественника, имеющего сигнальный пептид, который в ходе секреции отщепляется с образованием зрелого белка.
Табл. 2. Очистка гемолизина II из культуральной среды E. coli Z85 (pUJ2)
| Стадии очистки | Общее коли- чество белка, мкг | Общая гемолити- ческая активность, ГЕ | Удельная активность, ГЕ/мкг | Степень очистки |
| культуральный супернатант | 360000 | 100000 | 0.27 | 1 |
| ультрафильтрация | 352000 | 100000 | 0.28 | 1.02 |
| фосфоцеллюлоза Р-11 | 4700 | 93000 | 20 | 72.20 |
| аффинная хроматография | 1080 | 90000 | 83 | 299.64 |
| Superose-12 | 125 | 52000 | 416 | 1501.80 |
Оптимальная температура хранения HlyII -20°С. Гемолитическая активность HlyII при 4°С уменьшалась до 1% за 3 дня. Уменьшение активности после короткого хранения при такой температуре может быть из-за спонтанной агрегации гемолитически активных мономеров.

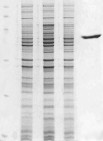
Для очистки внутриклеточного гемолизина II который включал периплазматическую фракцию была разработана совершенно иная схема выделения (Рис. 1С), N-концевой аминокислотный анализ внутриклеточного и внеклеточного гемолизина II, перенесенных с SDS-PAAG на мембрану, показал, что белки не содержат сигнального пептида и начинаются с 32 аминокислотного остатка (Рис. 2А, В). Скорее всего, внутриклеточный HlyII сразу транслоцируется через внутреннюю мембрану в периплазму и процессируется. Таким образом, гемолизин II синтезируется в форме предшественника, имеющего сигнальный пептид из 31 аминокислотного остатка, который в ходе секреции отщепляется с образованием зрелого белка.
Рис.1. Экспрессия и очистка гемолизина II. Химическая структура золотисто-желтого красителя (А). SDS-электрофоретическое разделение в 12% полиакриламидном геле белков при очистке внеклеточного гемолизина II (В), продуцируемых клетками E. coli Z85 (pUJ2) (дорожка 2), после хроматографии на фосфоцеллюлозе Р-11 (3), после аффинной хроматографии (4), после гельфильтрации на Superose-12 (5), смеси маркерных белков (дорожка 1); при очистке внутриклеточного гемолизина II (С) из клеточного экстракта (дорожка 1), после КМ-целлюлозы (2), после АсА-44 (3), после гельфильтрации на Superose-12 (4) и очищенного внеклеточного гемолизина II, в качестве маркера (5); белков клеток (D) E. coli BL21 (pET29-HlyII-His6) до индукции (дорожка 2), через 2 часа (3), 4 часа (4) и 6 часов (5) после индукции ИПТГ, гемолизина II (1). Экспрессия HlyII с сигнальным пептидом (Е). SDS-электрофоретическое разделение в 10% полиакриламидном геле белков, продуцируемых клетками E. coli LEPI(pUJ2) до индукции (дорожка 2), после индукции ИПТГ (3), после индукции клеток E. coli LEPI (4), очищенного HlyII, без сигнального пептида (5), смеси маркерных белков (дорожка 1).
Подтверждение участия сигнальной пептидазы в процессинге гемолизина II было получено при использовании бактериального штамма E. coli LEPI дефектного по сигнальной пептидазе. После индукции экспрессии гемолизина II в E. coli LEPI (pUJ2) была обнаружена экспрессия белкового продукта внутри клетки с более высоким молекулярным весом (~45,6 кДа), в отличие от зрелого гемолизина II (42 кДа) (Рис. 1E). Присутствие сигнального пептида в этом белке было подтверждено N-концевым анализом. Таким образом, процессинг гемолизина II в клетках E. coli обеспечивается сигнальной пептидазой.
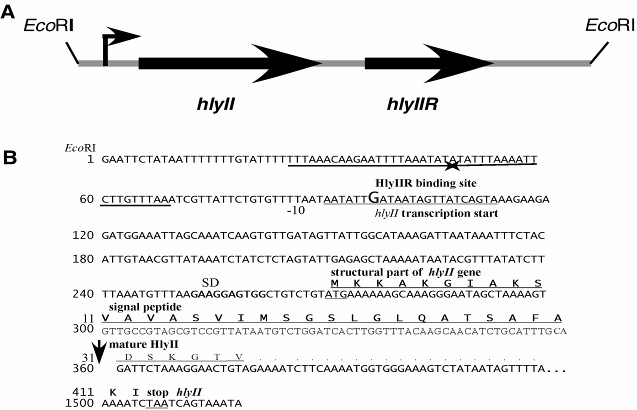
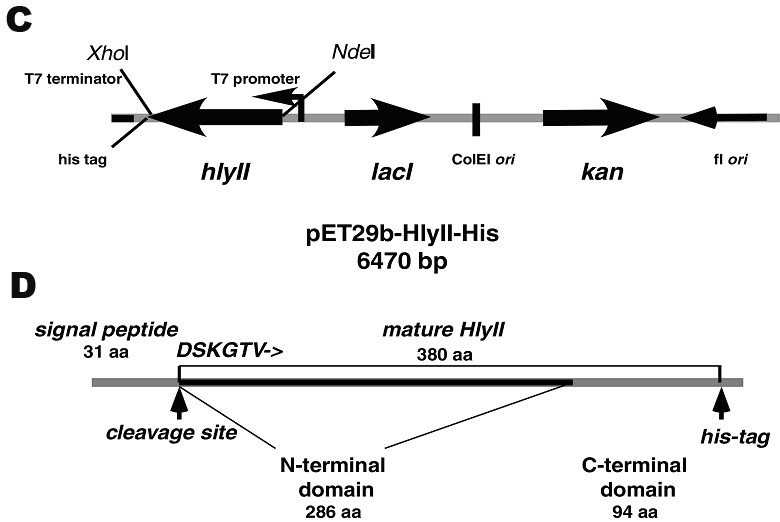
Рис.2. А: Схема EcoRI фрагмента хромосомальной ДНК B. cereus 771, содержащегося в плазмиде pUJ2. В: Нуклеотидная последовательность гена hlyII. Стартовая точка транскрипции hlyII обозначена крупным шрифтом. Последовательность Шайна-Дальгарно (SD) обозначена жирным шрифтом. Сигнальный пептид выделен жирным шрифтом и подчеркнут. Стартовый кодон обозначен одинарным подчеркиванием, терминирующий - двойным подчеркиванием. Сайт связывания для белка регулятора HlyIIR отмечен встречными стрелками. Сайт отщепления сигнального пептида указан вертикальной стрелкой. C: Схема рекомбинантной плазмиды pET29-HlyII-His6. D: Структура белка гемолизина II.
Секреция гемолизина II штаммом Bacillus subtilis BD170-EH2 (Bacillus subtilis subsp. subtilis 168 в хромосому которого в локус amyE интегрирована кассета, содержащая ген устойчивости к хлорамфениколу и часть 2,9 kb фрагмента ДНК от EcoRI до BssSI сайтов с геном hlyII) осуществляется сразу во внеклеточную среду, так как гемолитическая активность в культуральной среде была 2000 ГЕ/мл, а внутриклеточная гемолитическая активность равнялась нулю, что подтверждает секреторные свойства гемолизина II.
Штамм E. coli - продуцент гемолизина II был создан с использованием векторной плазмиды с регуляцией экспрессии чужеродных генов. Структурная часть данного гена, включая сигнальный пептид, амплифицирована посредством ПЦР и клонирована в экспрессирующий вектор pET-29b(+) под контроль промотора гена 10 фага Т7. Были сконструированы плазмиды pET29-HlyII и pET29-HlyII-His6, последняя обеспечивала продукцию гемолизина II с шестью гистидинами на С-конце (Рис. 2 С, D). Индукция синтеза HlyII-His6 показана на рис. 1D.
2. Моделирование структуры поры гемолизина II
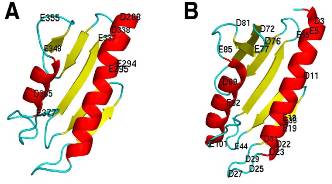
Аминокислотная последовательность HlyII (исключая 94 С-концевые аминокислоты) имеет высокую степень гомологии с последовательностью -токсина S. aureus (31% идентичности). Кристаллическая структура поры -токсина с разрешением 1.9, сформированная семью идентичными субъединицами, была использована для гомологичного моделирования поры HlyII. Полученная модель гептамерного комплекса HlyII, имеет грибовидную форму и состоит из кэп домена, стеблевого домена и семи краевых доменов (Рис.3А). Размер олигомера около 10 нм в диаметре с высотой 10 нм. Внутренний диаметр поры варьирует от 1 до 4 нм вдоль длины канала (2 нм при входе, максимальный – 4 нм внутри кэп домена, 1.2 нм в начале трансмембранного стебля и от 1 нм до 1.6 нм вдоль остального стебля) (Рис. 3С).
Стеблевой район HlyII длиннее на 3 аминокислоты, чем у -токсина и содержит внутри больше заряженных аминокислотных групп. Внутренняя поверхность стеблевого домена HlyII имеет четыре пояса заряженных аминокислотных остатков: K105 и D146 на верхушке стебля; E109 и K140; K119 и D130; D124 и K125 у основания стебля (Рис. 3 В, D, E), в отличие от -токсина, который имеет два пояса заряженных остатков. Примерное расстояние между С-атомами поясов 1.3, 2.5 и 1.5 нм (Рис. 3С). Сравнение с другими -складчатыми каналообразующими цитолизинами показало, что аминокислотные остатки, вовлеченные в протомер-протомер взаимодействие не консервативны, в то время как часть краевого домена HlyII (176-197, 250-259 аминокислоты), которая взаимодействуют с мембраной, более консервативна.
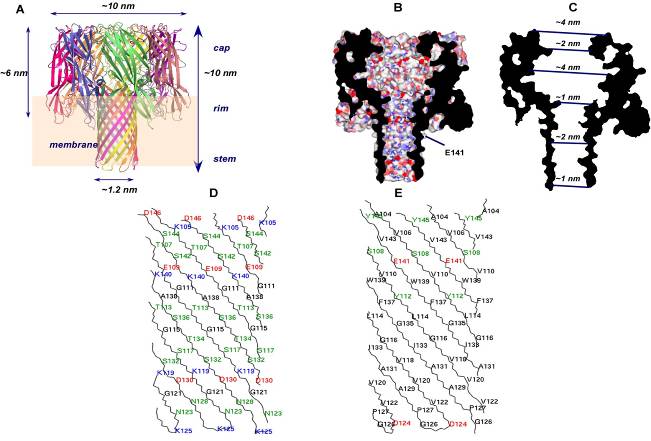
Моделирование HlyII мономера проводили с использованием кристаллических структур лейкоцидиновых мономеров 3LKF.pdb и 1PVL.pdb, которые при взаимодействии с мембранами формируют гексамеры и структур цитолизинов, образующих октамеры. Для проверки возможности формирования гекса- и октамеров было выполнено моделирование HlyII октамерных и гексамерных структур при помощи m-zdock программы (http://zlab.bu.edu/m-zdock/). Не было обнаружено никаких стерических ограничений, которые могли бы препятствовать формированию каналов с большим числом субъединиц (т.е. октамеров), но формирование гексамеров может быть затруднено, так как длинные боковые цепи заряженных аминокислот направлены внутрь канала (Рис.4). Моделирование разных олигомерных форм HlyII говорит о том, что в природе вероятнее всего может происходить формирование гекса-, гепта- и октамерных пор Hly II.

94 С-концевых аминокислотных остатка гемолизина II, отсутствует в HL. Мы предположили, что С-конец HlyII существует как независимый белковый домен, основываясь на его чувствительности к протеолитическому расщеплению. HlyII, лишенный С-концевого домена, сохранял способность формировать поры в мембранах, но с меньшей эффективностью. Мы употребили подход de novo моделирования совместно с поиском в белковом банке данных для распознавания дальних скрученных участков (Рис. 5А). Основываясь на наших моделях, мы предполагаем, что С-концевой домен располагается с внешней стороны поры, являясь дополнением к каждой субъединице гемолизина в районе кэп домена и не может блокировать частично или полностью вход в нее. Скорее всего, он участвует в протомер-протомер взаимодействии, поэтому его утрата ведет к снижению способности белка к олигомеризации. Интересно, что модельная структура С-концевого домена HlyII имеет укладку подобную фратаксинам (Рис. 5В), которые играют важную роль в связывание железа с помощью участков негативно заряженной поверхности в прокариотах и эукариотах. Маленькие, негативно заряженные участки были найдены и в С-концевом домене HlyII.
3. Размеры пор сформированных гемолизином II
Гидродинамический радиус поры определяли, используя в качестве осмотических протектантов ряд полиэтиленгликолей, имеющих молекулы различного и известного диаметра. Значительный эффект снижения уровня гемолиза (около 40%) наблюдали в присутствии ПЭГ 400 (радиус 0,68 нм). Гемолиза не было замечено, когда эритроциты инкубировали с HlyII в растворе с ПЭГ более высокого молекулярного веса (от 600 до 6000) (Рис.6А). Оцененный нами функциональный диаметр пор составил 12-16.
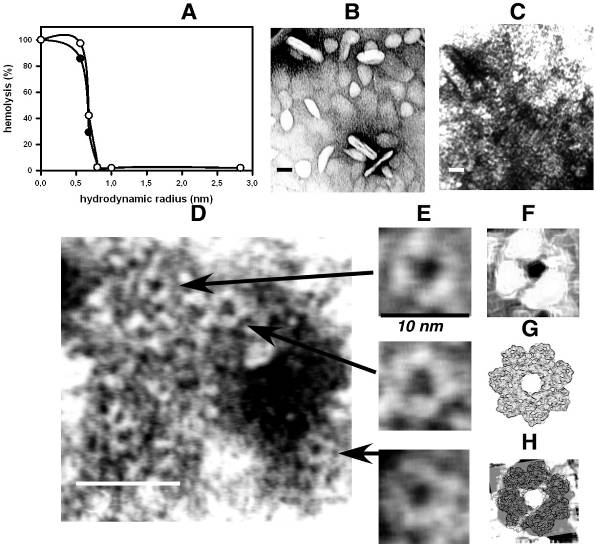
Анализ электронных микрофотографий негативно окрашенных липидных везикул в присутствии HlyII, полученных с помощью высокоразрешающей электронной микроскопии, показал многочисленные кольцеобразные ассамблеи собранные вместе (Рис. 6 В-Е). Мы провели анализ более ста мультипрофильных изображений молекул (т.е. ориентированных в поле зрения под различным углом) и на основании этого анализа сделали заключение, что поры могут иметь структуру, состоящую из разного количества субъединиц, возможно формирование гекса-, гепта- и октамеров, что подтверждается успешным моделированием этих структур.
Большинство этих ассамблей имели внутренний диаметр пор около 2 нм и внешний диаметр варьировал от 8 до 10 нм, что соответствует результатам, полученным при анализе трехмерной модели гептамерной поры HlyII (Рис. 6 А-Н). Таким образом, гемолизин II действует как пороформирующий токсин с функциональным диаметром пор около 1.5 нм. Результаты полученные с помощью осмотических протектантов соответствуют результатам моделирования. Также, при анализе электронно-микроскопических данных было обнаружено, что HlyII как и стафилококковый -гемолизин, образует многочисленные кластеры с разным количеством пор.
4. Свойства каналов, сформированных гемолизином II
Электрофизиологические свойства ионных каналов, сформированных гемолизином II, изучались методом фиксации потенциала на бислойных липидных мембранах (БЛМ). Добавление гемолизина II в мембраноомывающий раствор с одной стороны БЛМ вызывает ступенчатое нарастание тока через мембрану, по мере формирования ионных каналов (Рис. 10, 11). Были изучены основные свойства HlyII канала, такие как проводимость одиночного канала, вольтамперная характеристика одиночного канала, его ионная селективность и зависимость от потенциала в различных экспериментальных условиях. В присутствии 100 мМ KCl каналы находились преимущественно в открытом состоянии (Рис. 10 А). Проводимость канала определяли по высоте ступенек тока отображаемых на регистрирующем устройстве после добавления токсина (Рис. 10 А, D). Распределение амплитуд проводимостей одиночных каналов в этих условиях (100мМ KCl, 5мМ HEPES-KOH, pH 7.4) было достаточно широким (Рис. 10 В), однако анализ позволял выявить три пика амплитуд со значениями равными 18±6, 31±3 и 46±9 pS. Следует отметить, что для стафилококкового альфа-токсина, при сходных условиях регистрации, средняя амплитуда проводимости канала составляла 107±3.2 pS (Merzlyak, 1999). Эти различия, очевидно, не связаны с радиусом пор, который согласно экспериментам осмотической протекции и белкового моделирования близки по размеру как для HlyII так и для -токсина, но могут быть связаны с отличиями в проводящих структурах этих каналов и/или с их зарядовой конституцией. Более высокая концентрация заряженных остатков внутри поры HlyII, возможно, является ответственной за этот эффект. Вольтамперная характеристика одиночного канала (ВАХ) была симметричной и линейной во всем использованном диапазоне потенциалов от -100 мВ до +100 мВ при 100 мМ KCl (Рис.10С).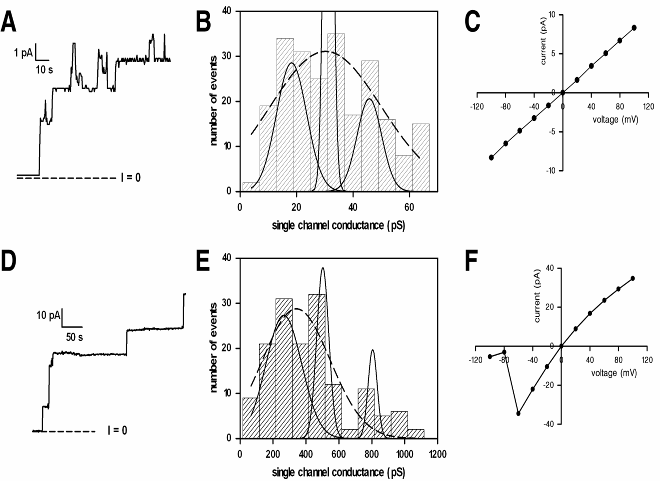
При увеличении в экспериментальной среде концентрации KCl до 1 М на гистограмме распределения амплитуд удавалось выявить три пика со средними величинами проводимости 266±80, 502±73 и 805±55 pS (Рис. 10 D, Е). Три пика на распределении амплитуд проводимости могут отражать проводимость пор с различной структурой. Вольтамперная характеристика канала претерпевала значительные изменения, она становилась гиперлинейной при отрицательных потенциалах и слабо гиполинейной при положительных (Рис. 10F). Такое изменение формы ВАХ (по сравнению с 0.1 М раствором) предположительно может быть вызвано появлением дополнительных барьеров на пути проходящих ионов за счет увеличения общей гидрофобности образующих канал молекул токсина. Повышение концентрации соли до 1 М вызывало также появление у ВАХ характерной N-образной формы (Рис. 10 F). Это интерпретируется как gating, потенциал-зависимый переход каналов в малопроводящее состояние.
Мы обнаружили, что вместе с большинством поринов и многими другими -складчатыми пороформирующими токсинами, HlyII проявляет потенциал-зависимый gating в 1 М KCl при относительно низких значениях напряжения (Рис. 11). Так при фиксации на мембране отрицательного потенциала -60 мВ и ниже, каналы переходили в малопроводящее отличное от нуля состояние. Реверсия потенциала по знаку мгновенно восстанавливало исходное значение проводимости (Рис. 11). Это указывает на то, что наблюдаемый gaiting не связан с вымыванием под действием электрического поля молекул токсина из мембраны и не обусловлен долговременными перестройками в структуре поры.
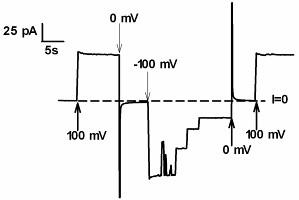
Рис.11. Регистрация проводимости канала токсина HlyII, зависимый от напряжения gating. gating был получен только в 1000 мМ KCl, в 100 мМ KCl каналы остаются открытыми большую часть времени. В начале к мембране были приложены 30 мВ. После добавления токсина (конечная концентрация 50 нг/мл) мы ждали открытия 3-4 единичных каналов и затем прикладывали импульсы напряжения. Стрелки показывают знак и величину импульсов приложенных к мембране. Фиксация напряжения 0 мВ была необходима для стандартизации начальных условий. При фиксации позитивных потенциалов каналы были в открытом состояние в течение всего времени регистрации. При негативном потенциале - 100 мB, был получен спонтанный переход каналов на более низкий (отличный от нуля) уровень проводимости. Только при приложении позитивных потенциалов значение первоначальной проводимости было восстановлено. Пунктирная линия соответствует уровню нулевой проводимости мембраны.
Широкое распределение амплитуд проводимости канала с тремя выраженными пиками говорит о том, что не все поры HlyII обладают идентичной структурой. Наблюдаемые три пика проводимости скорее всего соответствуют гекса-, гепта- и октамерным структурам канала. Для доказательства вероятности существования этих структур, с помощью молекулярного моделирования мы оценили, как изменение геометрического сечения канала во всех трех случаях могло бы повлиять на его амплитуду проводимости. При этом мы вынуждены допустить, что добавление или удаление из проводящей структуры одной субъединицы белка несущественно влияет на все свойства канала, кроме проводимости и тогда проводимость канала пропорциональна только площади его сечения. Полученные отношения проводимостей 1:1.7:2.6 (в 100 мМ KCl) и 1:1.9:3 (в 1000 мМ KCl) оказались близкими к отношению площадей сечений полученных из моделей различных олигомерных состояний 1:1.8:2.8, для гекса-, гепта-, октамеров (рис. 4). Проведенная нами оценка показывает, что сделанные нами предположения весьма вероятны. Такое хорошее совпадение результатов служит аргументом в пользу того, что мы наблюдаем гекса-, гепта- и октамеры HlyII.
Мембраны, модифицированные HlyII токсином, имели анионную селективность, которая уменьшалась с ростом концентрации электролита в экспериментальной среде. Трансмембранный потенциал в условиях градиента концентрации KCl через мембрану был измерен в ряде экспериментов. Трансмембранный потенциал, измеренный в трехкратном градиенте 0.12/0.04 М KCl, был равен -12.2 ± 0.82 мВ и в пятикратном градиенте 1.0/0.2 М KCl был равен -20.0 ± 0.84 мВ. Отношение коэффициентов проницаемостей, PK+/PCl-, при обоих этих градиентах было близко по значению: 0.36 и 0.30 соответственно. Увеличение ионной силы среды (использование градиента концентрации соли KCl 3/1 М) снизило селективность гемолизиновых каналов, в этих условиях трансмембранный потенциал был равен -2.75 ± 0.75 мВ и PK+/PCl- составило 0.81. Селективность поры HlyII, отличается от селективности HL канала (PK+/PCl- = 0.79 при условиях градиента 1.0/0.2 М KCl) (Gu, 2000). Различия в ионной селективности обусловлено различием в распределении зарядов внутри поры. Полость стебля HL поры нейтральна, потому что заряд компенсируется между остатками, такими как Glu111-Lys147 при входе и Asp127-Lys131 при выходе. Подобная компенсация может осуществляться и в HlyII, где присутствуют три пары остатков компенсированных по заряду, но при выходе из поры Lys125 не имеет ближайшего зарядового партнера. Таким образом, общий позитивный заряд в поре HlyII вероятно вносит вклад в наблюдаемую анионную селективность.
5. Влияние температуры на формирование пор гемолизином II
Механизм действия гемолизина изучали при помощи экспериментов поставленных на человеческих эритроцитах. Показали зависимость эффективности гемолиза от концентрации HlyII, температуры и времени. Кривые зависимости эффективности гемолиза от концентрации HlyII имели сигмоидальный вид при всех тестируемых температурах через 30 мин инкубации (Рис. 7В). Было установлено, что и общая эффективность гемолиза при добавлении различных концентраций гемолизина, и кинетика лизиса эритроцитов зависят от температуры. 100% гемолиз при 4°С наблюдали при концентрации гемолизина II от 4 ГЕ и выше, а при 15°С, 25°С и 37°С достигал 100% при более низких значениях (2 ГЕ) (Рис.7В). Всегда более высокие концентрации HlyII были необходимы для того чтобы получить уровень гемолиза при 4°С таким же, какой он был при более низкой концентрации при остальных температурах за тоже самое время инкубации. За 5 мин инкубации (Рис. 7А) уровень гемолиза был ниже, в отличие от значений, полученных при инкубации в течение 30 мин (Рис. 7В) при тех же температурах и концентрациях токсина. В течение этого времени гемолиз при 4°С вообще был незначительным при любых концентрациях гемолизина II. При концентрациях HlyII 5 ГЕ и выше, 100% гемолиз наблюдали через 5 мин при температуре 15°С, 25°С, 37°С, а при более низких концентрациях гемолиз достигал 100% только через 30 мин. Это же время инкубации необходимо для гемолиза при 4°С. Из полученных данных можно предположить, что лизис сопровождается кооперативными событиями между молекулами токсина, подтверждающими олигомерную природу пор HlyII, и процесс пороформирования является зависимым от температуры. При этом гемолизин II связывается с мембранами только как мономер и дальнейшая олигомеризация происходит на мембране. При высоких концентрациях белка, мономеры быстрее образуют олигомерные комплексы в плоскости мембраны.
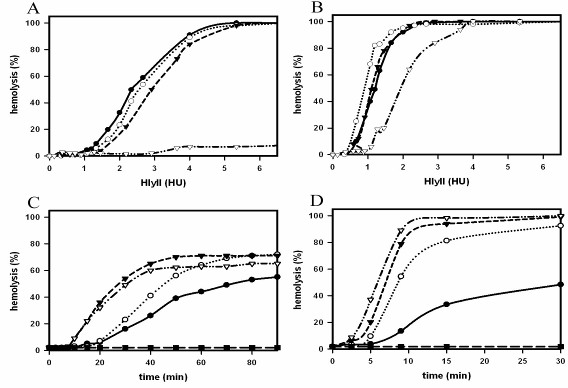

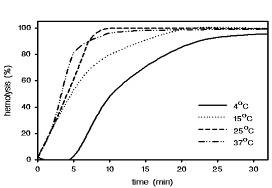
Рис.7. Пороформирующие свойства гемолизинаII. Зависимость степени гемолиза эритроцитов от концентрации HlyII при различных температурах. Различные концентрации токсина (0-6 ГЕ(HU)/мл) инкубировали в 1 мл смеси, содержащей 0.5% человеческих эритроцитов и ФСБ при 4°С (белые треугольники), 15°С (черные треугольники), 25°С (белые кружки) и 37°С (черные кружки) в течение 5 мин (А) и 30 мин (В) времени инкубации. Зависимость степени гемолиза от времени инкубации при 4°С (черные кружки, сплошная линия), 15°С (белые кружки, линия в виде точек), 25°С (черные треугольники, пунктирная линия) и 37°С (белые треугольники, линия из чередующихся пунктиров и точек). HlyII (1 ГЕ/мл) (С), (2 ГЕ/мл) (D) и (3,3 ГЕ/мл) (Е) в смеси, содержащей 0.5% человеческих эритроцитов и ФСБ, преинкубированной при 4°С, 15°С, 25°С, 37°С, инкубировали при тех же самых преинкубационных температурах. Спонтанный гемолиз был проверен в течение всего времени инкубации (черные квадраты). Каждая кривая представляет три-четыре независимых эксперимента, ошибки в пределах 5%.
Анализ зависимости уровня гемолиза от времени при температурах от 4°С, 15°С, 25°С и 37°С (Рис. 7 С-Е), и при действии на эритроциты высокими концентрациями HlyII (3,3 ГЕ/мл), показал что lag период в лизисе наблюдался только при 4°С (Рис.7Е). При менее высоких концентрациях гемолизина II (2 ГЕ/мл), и температурах 25°С и 37°С уровень гемолиза был идентичен. 100% гемолиз был получен в течение 20 мин, без какого-либо значительного lag периода в лизисе (Рис.7D). Уровень гемолиза был немного снижен при 15°С, хотя 100% гемолиз был получен за 30 мин тоже без значительного lag периода. При 4°С lag период был более длительным, это позволяет предположить, что скорость формирования поры более медленная, чем при более высоких температурах. Уровень гемолиза после lag периода менее зависим от температуры. При низких концентрациях HlyII (1 ГЕ/мл) в подобном эксперименте (Рис. 7С), lag период был около 10 мин при 25°С и 37°С, а при 4°С и 15°С lag период был длиннее.
Максимальный лизис эритроцитов наблюдался при +25°С. Быстрая температурная инактивация гемолизина II была при 37°С (гемолитическая активность падала на половину за 10 мин) и более медленная при 24°С (инактивировался за 12 часов) и 4°C (за 2 дня).
Для того чтобы узнать, чем вызван длительный lag период в гемолизе при низкой температуре (менее эффективным связыванием гемолизина с мембраной, более медленной олигомеризацией, конформационным изменением или открытием поры), мы провели следующие эксперименты. HlyII (1 ГЕ/мл) инкубировали с эритроцитами при 4°С в течение определенного времени 1,5 мин, 5 мин, 10 мин, т. е. в течение lag периода, затем осажденные эритроциты промывали (не более минуты) холодным ФСБ (фосфатно-солевой буфер), для того чтобы удалить не связавшийся токсин. Отмытые эритроциты продолжали инкубировать в снова добавленном ФСБ при 37°С в течение 30 мин. Измеряли уровень гемолиза в пробах после инкубации и сравнивали с уровнем гемолиза полученном в контрольных пробах, в которых эритроциты переносились на 37°С, и инкубировались так же в течение 30 мин, непосредственно с 4°С без отмывки от не связавшегося белка. Мы не обнаружили значительных различий между уровнем гемолиза в тестируемых и контрольных пробах. Значит, первый шаг, связывание HlyII с клеточными мембранами, не зависит от температуры и протекает быстро при любой температуре. Мы показали, что HlyII может связываться с мембраной в первую минуту lag периода при 4°С. Следовательно, при температуре 4°С длительный lag период может быть обусловлен медленной олигомеризацией и переходом поры в открытое состояние. Таким образом, олигомеризация на мембране и открытие поры являются самыми медленными стадиями в процессе пороформирования.
Эксперименты по формированию поры были проведены в присутствие осмотических протектантов. HlyII (2 ГЕ/мл) преинкубировали с 0.5% суспензией эритроцитов и с ПЭГ 600 (Рис. 8А) и ПЭГ 1000 (Рис. 8В) (их присутствие блокирует лизис эритроцитов) в течение 5 мин при разных температурах 4°С, 25°С и 37°С, затем отмывали от ПЭГ и продолжали инкубировать при температуре 25°С. Освобождение гемоглобина во всех пробах тестировали после 5 мин, 10 мин и 30 мин времени инкубации при 25°С. После преинкубации с ПЭГ 1000 (Рис. 8В) зависимость уровня гемолиза от времени при разных температурах была подобна зависимости наблюдаемой во время наших экспериментов описанных выше (Рис.7): более высокий начальный уровень гемолиза при высоких температурах и самый высокий полный гемолиз при 25°С и более низкий начальный уровень гемолиза при низкой температуре (4°С). Такая же зависимость в скорости гемолиза от времени была получена после преинкубации HlyII (1 ГЕ/мл) с эритроцитами без добавления ПЭГ при 4°С, 25°С и 37°С. Было выявлено уменьшение эффективности гемолиза в эксперименте с ПЭГ 600 при 37°С, не наблюдавшегося при других температурах и в экспериментах с ПЭГ c большими гидродинамическими радиусами. Гемолиз никогда не достигал 100% и был около 20%, однако, полный гемолиз этих проб можно легко получить с помощью детергентов или осмотического шока водой. Зависимость уровня гемолиза от времени при более низких температурах преинкубации (25°С и 4°С) была такой же, как и в присутствии ПЭГ 1000 и в отсутствие осмотических протектантов. Эти результаты означают то, что молекулы ПЭГ 600 способны проникать внутрь поры HlyII и оставаться там после отмывания эритроцитов, если поры сформированы при 37°С, но не могут этого, когда поры сформированы при 4°С и 25°С. Это может свидетельствовать о различиях в структуре пор образуемых при разных температурах. Более того, начальная температура пороформирования является решающей для скорости и общего уровня гемолиза.

Обобщая полученные результаты мы предполагаем, что в процессе сборки поры HlyII (Рис. 9), как и у -токсина и у стафилококкового -гемолизина существует несколько стадий. Первой стадией является связывание находящейся в растворе мономерной формы HlyII с мембраной за счет начального электростатического взаимодействия, возможно, нахождение в растворе не активных олигомеров из нескольких субъединиц. На второй стадии мономеры связанные с мембраной олигомеризуются и формируют нелитический интермедиат - препору, которая является по нашим данным зависимой от температуры. HlyII и гомологичный ему -токсин формируют гомогептамерные трансмембранные поры, что ясно из гомологичного моделирования. Hly II также может формировать гомогексамерные и гомооктамерные поры. На третьей стадии обогащенные глицином центральные районы семи (либо шести или восьми) субъединиц внедряются в липидный бислой, и формируют устойчивую к SDS, литическую пору (трансмембранный канал). Таков механизм сборки единичной активной поры. В конце концов, гемолизин II возможно формирует кластеры пор, так же как и -гемолизин. Формирование препоры и поры является в случае для HlyII зависимым от температуры, концентрации мономеров и возможно от типа мембран и, следовательно, может различаться. Возможно, формируются преимущественно гекса-, гепта- или октамерные поры в зависимости от разных условий.
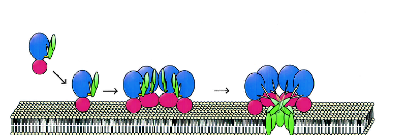
Рис.9. Процесс взаимодействия гемолизина II с мембраной.
6. Цитолитическое действие очищенного гемолизина II
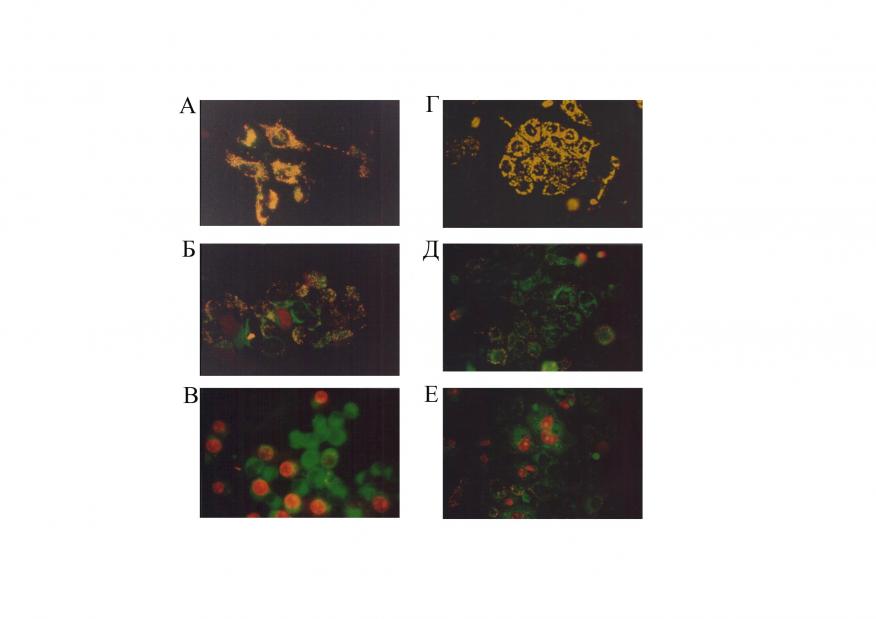
Одной из характеристик, обычно используемых при описании свойств гемолитических токсинов, является их действие на эритроциты различных видов животных. При идентичных условиях чувствительность эритроцитов к действию гемолизина II уменьшалась в ряду кроличьи:человеческие:бычьи:мышиные и соответствовало отношению 55:14:8:1. Чувствительность эритроцитов кролика к HlyII (10 пМ) более чем в 100 раз выше чем к -токсину. В экспериментах с человеческими клеточными линиями было изучено влияние HlyII на митохондриальный мембранный потенциал (m) и на целостность плазматической мембраны нервных (Paju) и карциномы ободочной кишки (Сасо-2) клеток. Обработка клеток HlyII вызывает полную потерю m и нарушение плазматической мембраны (красный цвет), т.е. гибель опухолевых клеток (Рис. 12). Таким образом,

гемолизин II способен лизировать различные эукариотические клетки.
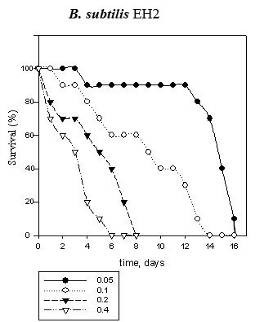

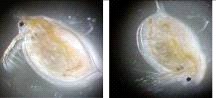


Также было проверено токсическое действие гемолизина II на макроорганизмы. Bacillus subtilis BD170 и Bacillus subtilis BD170-EH2 использовали в экспериментах по действию их на Daphnia magna, Drosophila melanogaster, Poecilia reticulata. Было показано летальное воздействие штамма B. subtilis BD170-EH2 на D. magna и рыб. ЛД50 D. magna равно 0,18 ОЕ (5х105 клеток в 1 мл) (Рис.13 А-D). B. subtilis BD170 и B. subtilis BD170-EH2R с геном регулятором hlyIIR не вызывали гибели D. magna и P. reticulata. Таким образом, цитолитическое патогенное действие HlyII на разные клетки и макроорганизмы обусловлено образованием ионпроводящих каналов в клеточных мембранах.
ВЫВОДЫ
- Впервые получен очищенный препарат внеклеточного гемолизина II B. cereus.
- Гемолизин II является секреторным белком и синтезируется в форме предшественника, имеющего сигнальный пептид из 31 аминокислотного остатка, который в ходе процессинга отщепляется сигнальной пептидазой с образованием зрелого белка.
- Зрелый гемолизин II образует анион-селективные и потенциал-зависимые каналы с функциональным диаметром пор 12-16 и с внешним диаметром 80-100. Возможно формирование гекса-, гепта- и октамерных комплексов HlyII.
- Полное связывание HlyII с мембраной в виде мономера происходит в течение первой минуты lag периода и не зависит от температуры. В дальнейшем, процесс формирования поры осуществляется в плоскости мембраны и является зависимым от температуры.
- Гемолизин II обладает цитолитическим патогенным действием.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Andreeva Zh. I., Nesterenko V. F., Yurkov I. V., Budarina Z. I., Sineva E. V., Solonin A. S. 2006. Purification and cytotoxic properties of Bacillus cereus hemolysin II. Protein Expression and Purification, v. 47, p. 186-193.
- Andreeva Zh. I., Nesterenko V. F., Fomkina M. G., Ternovsky V. I., Suzina N. E., Bakulina A. Y., Solonin A. S. and Sineva E. V. 2007. The properties of Bacillus cereus hemolysin II pores depend on environmental conditions. BBA-Biomembranes, v.1768, p.253-263.
- Андреева Ж.И., Нестеренко В.Ф., Солонин А.С. Получение очищенных препаратов гемолизина II. Материалы 7-ой Пущинской конференции молодых ученых: Биология – наука ХХI века, Пущино, 14-18 апреля, 2003, с. 302.
- Нестеренко В.Ф., Андреева Ж.И. Преимущества красителей в качестве лигандов для аффинной хроматографии и аналитический прибор для быстрого выбора таких сорбентов. Материалы 3-ей международной конференции из серии “Наука и бизнес”. Международное сотрудничество в биотехнологии: ожидания и реальность. Пущино, 19-21 июня, 2006, с. 51.
- Andreeva Zh.I., Bakulina A.Y., Nesterenko V.F., Fomkina M.G., Ternovsky V.I., Suzina N.E., Solonin A.S. and Sineva E.V. Pore-forming properties of B. cereus hemolysin II: experiments and modeling. American Society for Microbiology, 106th General Meeting, Orlando, 2006.

