Исследование структурных основ субстратной специфичности карбоксипептидазы т thermoactinomyces vulgaris
На правах рукописи
Гришин Андрей Михайлович
Исследование структурных основ субстратной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris
03.00.03 – Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2008
Работа выполнена в лаборатории химии белка им. В.М. Степанова в Федеральном государственном унитарном предприятии «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» (ФГУП «ГосНИИгенетика»).
| Научный руководитель | |
| кандидат химических наук | Акпаров Валерий Халильбекович |
| Официальные оппоненты: | |
| доктор биологических наук, профессор ФГУП «ГосНИИгенетика» | Вейко Владимир Петрович |
| доктор химических наук, профессор Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН | Румш Лев Давыдович |
| Ведущая организация | Кафедра химии природных соединений химического факультета Московского государственного университета им. М.В. Ломоносова |
Защита состоится 25 ноября 2008 года в 14 ч 00 мин на заседании диссертационного совета Д.217.013.01 при Федеральном государственном унитарном предприятии «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, Москва, 1-й Дорожный пр., д. 1.
С диссертацией можно ознакомиться в библиотеке ФГУП «ГосНИИгенетика».
Автореферат разослан «___» ___________ 2008 г.
| Ученый секретарь диссертационного совета, кандидат биологических наук | Заиграева Г.Г. |
Общая характеристика работы
Актуальность проблемы. В течение последних 20 лет происходило становление и развитие науки о конструировании ферментов с желаемыми характеристиками энзиматической инженерии. Своему развитию эта область знания обязана революционным переменам в генной инженерии, позволяющей теперь производить любые изменения первичной структуры белка, секвенированию геномов, проекту «функциональная геномика» и развитию структурных методов исследования, благодаря которым необыкновенно расширилась база данных первичных и третичных структур ферментов. Огромные возможности для визуализации и анализа структурной информации дает развитие компьютерной техники.
Получение ферментов с промышленно важными свойствами и, в частности, с измененной субстратной специфичностью стало одной из целей коммерческой энзимологии вследствие таких отличительных черт ферментативного катализа, как специфичность, работа в мягких условиях, способность катализировать реакции, которые невозможно осуществить методами классической химии, совместимость с окружающей средой. Однако успех создания таких ферментов напрямую зависит от глубины нашего понимания ферментативного катализа и, в частности, от адекватности теории, объясняющей субстратную специфичность.
На сегодняшний день существует большое число примеров успешного получения ферментов с измененной селективностью действия. Однако примеров неудач также много. Вследствие этого исследование ферментов, чью селективность сложно объяснить на основе имеющейся теории, представляет особый интерес, поскольку это способствует углублению наших знаний о взаимосвязи их структуры и специфичности. Такие фундаментальные исследования, в конечном счете, приведут к созданию эффективной технологии получения новых биокатализаторов. Настоящая работа относится к их числу.
Металлокарбоксипептидаза Т Thermoactinomyces vulgaris (КПТ), открытая в нашей лаборатории, отличается от других охарактеризованных металлокарбоксипептидаз (МКП), таких как карбоксипептидаза А (КПА), карбоксипептидаза В (КПВ) и карбоксипептидаза О (КПО), тем, что на основании имеющейся трехмерной структуры фермента ее субстратную селективность сложно объяснить с позиций теории специфичности МКП. Карманы первичной специфичности КПТ и КПВ устроены сходно: оба обладают отрицательно заряженным остатком Asp и достаточно полярны. Тем не менее, если КПВ обладает узкой селективностью к субстратам с С-концевыми положительно заряженными остатками, то КПТ наиболее активна по субстратам с С-концевыми гидрофобными остатками. Активность по положительно заряженным субстратам у КПТ на два порядка хуже, чем у КПВ. Несмотря на присутствие отрицательного заряда в S1’-субсайте, КПТ отщепляет С-концевую Glu лучше, чем С-концевой Arg. Наличие трехмерных структур для обоих ферментов делает возможным выявление структурных детерминант, ответственных за те или иные особенности субстратной селективности КПТ, что может открыть путь для направленного изменения КПТ и получения на ее основе микробного фермента со специфичностью промышленно важной карбоксипептидазы В. В связи с этим исследование структурных основ субстратной специфичности КПТ является актуальным.
Цель и задачи исследования. Целью настоящего исследования явилось изучение роли аминокислотных остатков S1’-субсайта КПТ в определении субстратной специфичности фермента и поиск новых, не известных до настоящего момента, детерминант субстратной специфичности КПТ.
В соответствии с этой целью решались следующие задачи: конструирование мутантов КПТ с предполагаемой измененной селективностью действия на основе компьютерного анализа структур КПТ, КПА и КПВ; получение мутантных генов КПТ; экспрессия, ренатурация, активация и очистка мутантных белков; сравнительный анализ энзиматических и структурных свойств вариантов КПТ.
Научная новизна и практическая значимость работы. В ходе работы было получено и исследовано 12 вариантов КПТ, несущих замены в активном центре фермента и непосредственной близости от него. Впервые получен вариант КПТ, состав сорбционного центра которого полностью воспроизводит сорбционный центр КПВ, и изучены его кинетические и другие физико-химические характеристики. Показано, что имплантация сорбционного центра КПВ в КПТ не изменяет селективности действия последней. В то же время имплантация в КПТ основных структурных детерминант субстратной специфичности КПА и КПО (варианты КПТ D253G/T255I, а также КПТ D253G/T255K и КПТ D253G/T255R) позволила приблизить кинетические характеристики КПТ к КПА и заставила КПТ D253G/T255R гидролизовать преимущественно субстраты с отрицательно заряженной С-концевой аминокислотой (специфичность КПО).
Впервые показана роль остатка Leu247 и структурного кальция как детерминант субстратной специфичности КПТ.
Практическая значимость работы. Данная работа закладывает основы для получения микробных металлокарбоксипептидаз с уникальными свойствами, важными для использования этих ферментов в биотехнологических процессах.
Апробация работы. Результаты исследований были представлены на 31-м Конгрессе Федерации европейских биохимических обществ (Стамбул, Турция, 2006), Международной школе-конференции для молодых ученых «Системная биология и биоинженерия» (Москва, Россия, 2005), XVIII Зимней молодежной научной школе «Перспективные направления физико-химической биологии и биотехнологии» (Москва, Россия, 2006), 10-й Пущинской школе-конференции молодых ученых «Биология – наука ХХI века» (Пущино, Московская обл., Россия, 2006), Третьей международной научно-практической школе-конференции МЕДБИОТЕК-2006 «Актуальные вопросы инновационной деятельности в биологии и медицине» (Москва, Россия, 2006), VI Симпозиуме «Химия протеолитических ферментов» (Москва, Россия, 2007), III Симпозиуме «Белки и пептиды» (Пущино, Московская обл., Россия, 2007), 11-й Пущинской школе-конференции молодых ученых «Биология – наука ХХI века» (Пущино, Московская обл., Россия, 2007).
Диссертационная работа была апробирована на заседании секции молекулярной биологии Ученого совета ФГУП «ГосНИИгенетика» 03 июня 2008 г.
Публикации. По материалам диссертации опубликовано 10 печатных работ, в том числе две статьи.
Структура и объем работы. Диссертация состоит из следующих разделов: введение, обзор литературы, материалы и методы, результаты, обсуждение, выводы и список литературы. Работа изложена на 224 страницах машинописного текста, включая 29 рисунков и девять таблиц. Список цитируемой литературы содержит 298 источников, в том числе девять на русском языке.
Основное содержание работы
1. Получение, очистка и определение кинетических характеристик КПТ дикого типа и ее мутантов
В работе исследуются кинетические характеристики 12 вариантов КПТ. Ген срТ, кодирующий прокарбоксипептидазу Т дикого типа, был выделен из Thermoactinomyces vulgaris ранее (Smulevitch et al., 1991). Для получения мутантов гена срТ был использован метод ПЦР-мутагенеза с удлинением перекрывающихся фрагментов. Мутантные гены КПТ, кодирующие желаемые замены аминокислотных остатков, были клонированы в вектор pet23a и поставлены под контроль T7-промотора. Экспрессию генов осуществляли в штамме E.coli BL21(pLysS)DE3 в виде телец включения в количестве около 50% от общего белка. Тела включения растворяли в 8М мочевине и ренатурировали 10-кратным разбавлением в буфере состава 50 мМ Трис-HCl рН 8,0, 30%-ный глицерин (V/V), 0,5 М NaCl, 10 мМ CaCl2. Проферменты активировали субтилизином 72, который по окончании реакции ингибировали диизопропилфторфосфатом. Активированные ферменты очищали аффинной хроматографией на CABS-сефарозе (табл. 1).
Таблица 1
Выход и чистота КПТ на различных стадиях процесса ренатурации, активации и очистки
| Стадия | Общий выход, % |
| Растворение в 8М мочевине | 100 |
| Ренатурация КПТ в буфере и Первое концентрирование | 14 |
| Обработка субтилизином | 7,5 |
| Второе концентрирование | 4,5 |
| Аффинная хроматография | 3 |
Выход ренатурированного, активированного и очищенного фермента составил около 3% от суммарного белка тел включения и около 9 мг на литр культуральной жидкости как для КПТ дикого типа, так и для всех ее мутантов. Конечная чистота вариантов была не менее 95% по данным ДСNа-ПААГ-электрофореза. Полученные таким образом препараты ферментов не содержали примеси субтилизина.
Рис. 1. Спектры кругового дихроизма КПТ дикого типа и ее вариантов. Молярная эллиптичность [] выражена в градсм2децимоль-1
Для определения кинетических характеристик КПТ использовали трипептидные субстраты ZAAL (активность фермента по А-типу), DnpAAR – (активность фермента по В-типу) и ZAAE. Последний позволяет детектировать активность глутамат-специфичных карбоксипептидаз. Кинетика гидролиза этих субстратов вариантами КПТ подчинялась уравнению Михаэлиса-Ментен за исключением гидролиза ZAAE мутантом КПТ L247N.
Все исследованные в работе варианты КПТ были ренатурированы с выходами, сравнимыми с выходом ренатурации фермента дикого типа, обладали устойчивостью к действию субтилизина, способностью связываться с аффинным сорбентом и характеризовались наличием высокой удельной энзиматической активности. Кроме того, спектры кругового дихроизма вариантов были весьма схожи с таковым КПТ дикого типа (рис. 1). Состав вторичной структуры, рассчитанный для КПТwt: 35-36% аминокислотных остатков в -конформации и 14-19% остатков в -конформации, хорошо согласовался с данными рентгеноструктурного анализа: 37 и 14% соответственно. Все эти данные предполагают правильный фолдинг вариантов.
2. Изучение роли аминокислотных остатков S1’-субсайта на субстратную специфичность КПТ
2.1. Роль Asp253
При связывании с металлокарбоксипептидазой боковой радикал С-концевого остатка субстрата погружается в полость, называемую S1’-субсайтом зоны связывания, или «карманом» первичной специфичности фермента. Взаимодействие семи остатков, выстилающих поверхность кармана первичной специфичности, с боковым радикалом С-концевого остатка субстрата определяет субстратную специфичность МКП: остатки 203, 207, 243, 250, 253, 255 и 268 (нумерация КПА). При этом остаток в положении 255, как полагают, является ключевым для дискриминации гидрофобных и заряженных субстратов (табл. 2).
Исследования КПВ, включающие рентгеноструктурный анализ и сайт-направленный мутагенез остатков кармана первичной специфичности, выявили ведущую роль Asp255 в связывании гуанидиновой группы С-концевого аргинина субстрата.
КПТ также способна связывать субстраты с С-концевым Arg, и в ее S1’-субсайте присутствует остаток Asp, хотя он расположен в отличном от 255 положении 253. Несмотря на различие в положении этих остатков у КПТ и КПВ предполагалось, что оба они функционируют одинаково.
Удаление отрицательного заряда из зоны связывания КПТ путем замены Asp253 на Gly (КПТ D253G) привело к ожидаемым изменениям кинетических параметров КПТ D253G (табл. 3 и табл. 4). Так, активность этого варианта на субстрате с С-концевым Arg упала примерно в 10 раз. В противоположность этому эффективность гидролиза отрицательно заряженного субстрата увеличилась в 6,5 раз. Это доказывает роль остатка Asp253 в связывании положительного и отталкивании отрицательного заряда аргининового и глутаматного субстратов соответственно.
Таблица 2
Аминокислотные остатки, определяющие субстратную специфичность МКП. Аминокислотные замены, внесенные в S1’-субсайт КПТ
| Аминокислотный остаток (нумерация КПА) | |||||||
| Фермент | 203 | 207 | 243 | 250 | 253 | 255 | 268 |
| КПА | Leu | Gly | Ile | Ala | Gly | Ile | Thr |
| КПВ | Leu | Ser | Gly | Ala | Gly | Asp | Thr |
| КПО | Leu | Gly | Ala | Thr | Gly | Arg | Thr |
| КПТ | Leu | Gly | Ala | Thr | Asp | Thr | Thr |
| КПТ D253G | Gly | ||||||
| КПТ D253G/T255I | Gly | Ile | |||||
| КПТ D253G/T255K | Gly | Lys | |||||
| КПТ D253G/T255R | Gly | Arg | |||||
| КПТ1 | Gly | ||||||
| КПТ2 | Gly | Asp | |||||
| КПТ3 | Gly | Gly | Asp | ||||
| КПТ4 | Ser | Gly | Gly | Asp | |||
| КПТ5 | Ser | Gly | Ala | Gly | Asp | ||
Примечание. Жирным шрифтом показаны аминокислотные остатки, которым приписывается ключевая роль в определении субстратной специфичности. Для мутантов КПТ показаны лишь замененные аминокислотные остатки.
Таким образом, Asp253 действительно функционирует и как позитивная, и как негативная детерминанта субстратной специфичности КПТ.
| DnpAAR | ZAAL | ZAAE | |||||||
| Фермент | Km, мМ | kcat, c–1 | kcat/Km, M-1c-1 | Km, мM | kcat, c–1 | kcat/Km, M-1c-1 | Km, мM | kcat, c–1 | kcat/Km, M-1c-1 |
| КПAg | ---c | ---c | ---c | 0,012 | 35 | 2900000 | ---c | ---c | ---c |
| КПВg | 0,07 | 35 | 500000 | ---c | ---c | ---c | ---c | ---c | ---c |
| КПTwt | 4,4±1,3 | 14,6 ± 3 | 3600±600 | 0,046±0,003 | 10,3±2,1 | 230000±65000 | ---b | ---b | 6100±2600 |
| КПT1 | 3,6 | 2 | 550 | 0,02 | 6,7 | 335000 | ---c | ---c | ---c |
| КПT2 | 3,6 | 4,3 | 1200 | 0,04 | 28 | 700000 | ---c | ---c | ---c |
| КПT3 | ---b | ---b | 840 | 0,03 | 11,1 | 370000 | ---c | ---c | ---c |
| КПT4 | ---b | ---b | 150 | 0,09 | 6,8 | 76000 | ---c | ---c | ---c |
| КПT5 | ---b | ---b | 1300±280d | 0,15±0,01 | 22,8±3,6 | 152000±21000 | ---b | ---b | 880±110 |
| КПT6 | ---b | ---b | 142 ±12d | 0,75±0,26 | 7,1±2,1 | 9700±730d | ---b | ---b | 37,5±11,4d |
| КПT D253G | ---b | ---b | 346±36d | 0,016±0,004 | 4,1±0,1 | 282000±80000 | 0,18±0,015 | 7,2±0,1 | 40000±2400d |
| КПT D253G/T255I | ---b | ---b | 132±8d | 0,03±0,006 | 5,2±0,3 | 184000±31000 | 0,3±0,03 | 8,5±0,5 | 28000±1500d |
| КПT D253G/T255K | 2,8±0,9 | 0,04±0,01 | 16,8±3,8d | 0,033±0,007 | 1,6±0,2 | 55000±19000e | 0,65±0,05 | 11,5±1,0 | 17800±1800d |
| КПT D253G/T255R | ---c | ---c | <5f | 0,45±0,08 | 5,6±1,0 | 12500±600d | 0,8±0,07 | 23,6±1,7 | 29600±1400d |
| КПT H68N | 5,9±0,1 | 17,5±1,1 | 2940±210 | 0,02±0,002 | 8,4±0,8 | 422000±39000 | ---b | ---b | 2300±200 |
| КПT L247N | 4±0,3 | 14,4±0,9 | 3600±130 | 0,063±0,003 | 5,6±0,5 | 87400±3700 | ---b | ---b | <213±50 |
Таблица 3
Кинетические параметры КПТ и ее вариантовa
Примечание.
а Процедуру экспрессии, ренатурации, активации, очистки и определения кинетических параметров проводили по три раза для вариантов с представленными значениями стандартной ошибки среднего и по одному разу – для остальных вариантов КПТ.
b Не было замечено насыщения субстратом в условиях эксперимента.
c Нет данных.
d p < 0,05 согласно Т-тесту Стьюдента. Параметр [kcat/Km] КПТ5 сравнивался с таковым КПТwt. Параметр КПТ6 сравнивался с таковым КПТ5. Параметр КПТ D253G сравнивался с таковым КПТwt. Параметры КПT D253G/T255I, КПT D253G/T255K, КПT D253G/T255R сравнивались с таковым КПТ D253G.
e p = 0,051 при сравнении параметра [kcat/Km] КПT D253G/T255K с таковым КПТ D253G.
f Активность варианта КПT D253G/T255R была ниже предела детекции, равного 5, M-1c-1.
g Данные согласно статье (Трачук и др., 2002).
Таблица 4
Субстратная специфичность КПТ и ее вариантов
| Специфичностьа | ||||||
| Фермент | Положение | Зарядb | Субстрат с С-концевым(ой) | |||
| 253 | 255 | Leu | Glu | Arg | ||
| КПTwt | Asp | Thr | -1 | 64 | 1,7 | 1 |
| КПT 5 | Gly | Asp | -1 | 172 | 1 | 1,5 |
| КПT 6 | Gly | Asp | -1 | 259 | 1 | 3,8 |
| КПT D253G | Gly | Thr | 0 | 815 | 115 | 1 |
| КПT D253G/T255I | Gly | Ile | 0 | 1390 | 212 | 1 |
| КПT D253G/T255K | Gly | Lys | +1 | 3270 | 1060 | 1 |
| КПT D253G/T255R | Gly | Arg | +1 | 1 | 2,4 | 0 |
| КПT H68N | 183 | 1 | 1,3 | |||
| КПT L254N | 24 | <0,06 | 1 | |||
Примечание.
а Специфичность - [kcat/Km]Leu/[kcat/Km]Glu/[kcat/Km]Arg.
b Заряд кармана первичной специфичности.
Активность КПТ D253G по обоим заряженным субстратам свидетельствует о наличии в кармане первичной специфичности достаточно полярных участков, с которыми взаимодействуют гуанидиновая и карбоксильная группы бокового радикала С-концевого остатка субстратов. Анализ компьютерных моделей КПТ D253G с тетрапептидами FFVR и FFVE показал, что данные зоны образованы ОН-группой Thr250 и двумя молекулами структурно связанной воды для субстрата с С-концевым Arg, а также Thr250, Arg145, Asn144 и молекулой воды для субстрата с С-концевой Glu.
2.2. Роль аминокислотного остатка в положении 255
2.2.1. Влияние гидрофобного остатка в 255 положении на селективность карбоксипептидазы Т
КПА, обладающая гидрофобным S1'- субсайтом, в состав которого входят Leu203, Ile243, Ala250 и Ile255 (см. табл. 2), отщепляет преимущественно гидрофобные С-концевые аминокислотные остатки. КПТ также обладает наибольшей активностью на гидрофобных субстратах, которые она гидролизует на два порядка активней, нежели заряженные, однако на порядок хуже, чем КПА. Несмотря на выраженную гидрофобную специфичность в состав S1’-субсайта КПТ в качестве гидрофобных остатков входят лишь Ala243 и консервативный для КПА, КПВ и КПТ Leu203 (см. табл. 2). Мы предположили, что постановка Ile в ключевое 255 положение в КПТ приведет к увеличению активности фермента по гидрофобным субстратам и падению эффективности гидролиза заряженных субстратов.
Замена Thr255 на Ile по аналогии с КПА (КПТ D253G/T255I), как и ожидалось, привела к ухудшению гидролиза заряженных субстратов, однако всего в 2,6 и 1,4 раза для DnpAAR и ZAAE соответственно. Скорость гидролиза гидрофобных субстратов осталась на прежнем уровне: kcat/Km *10-3 = 282, M-1c-1 для КПT D253G и 184, M-1c-1 для КПТ D253G/T255I, что на порядок ниже, чем у КПА, значение kcat/Km *10-3 которой равно 2900. Отметим, что КПА практически не гидролизует заряженные субстраты.
Анализ компьютерных моделей КПТ D253G/T255I c субстратами FFVR и FFVE показал, что гидрофобный Ile255 в одной из его конформаций вытесняет молекулу структурно связанной воды из контакта с заряженными группами субстратов и, тем самым, несколько ухудшает их связывание. Ввиду малого влияния на специфичность Ile255 в КПТ сам по себе не является ключевым остатком для дискриминации гидрофобных и заряженных субстратов. Это свидетельствует о том, что и в КПА остаток Ile255 не является главной детерминантой субстратной специфичности. На роль такого остатка претендует Ile243 в КПА в связи с тем, что КПТ D253G/T255I, несущий Ala243, в отличие от КПА может гидролизовать заряженные субстраты.
2.2.2. Влияние положительно заряженного остатка в 255 положении на селективность карбоксипептидазы Т
КПО, специфичная к субстратам с С-концевыми Glu и Asp, несет в ключевом 255 положении S1’-субсайта положительно заряженный остаток Arg. Кроме того, возможность обращения специфичности КПВ в сторону субстратов с С-концевыми остатками дикарбоновых аминокислот была показана заменой Asp255 на Arg или Lys. В случае общности механизмов субстратной специфичности МКП такой же эффект должен наблюдаться и для КПТ.
Действительно, постановка остатка Lys или Arg в 255 положение (КПТ D253G/T255K и КПT D253G/T255R) привела к ожидаемому результату. Было отмечено значительное падение эффективности гидролиза положительно заряженного субстрата: в 21 раз для КПТ D253G/T255K и более чем в 70 раз для КПT D253G/T255R. Эффективность гидролиза гидрофобного субстрата также упала для КПТ D253G/T255K и КПT D253G/T255R в 5 и 23 раза соответственно. Сродство вариантов к отрицательно заряженному субстрату не улучшилось.
При удалении отрицательного заряда из кармана первичной специфичности (КПТ D253G) значение [kcat/Km]Glu/[kcat/Km]Arg увеличилось в 68 раз, а при постановке туда положительно заряженного остатка (КПТ D253G/T255K и КПT D253G/T255R) различие скоростей гидролиза отрицательно и положительно заряженных субстратов изменилось в 620 и более 3000 раз для КПТ D253G/T255K и КПT D253G/T255R соответственно по сравнению с ферментом дикого типа. Это согласуется с данными исследований роли электростатических взаимодействий в определении субстратной специфичности других протеаз. Профиль селективности КПT D253G/T255R стал 1/2,4/0 для субстратов с С-концевыми Leu, Glu и Arg соответственно (см. табл. 4). Таким образом, на качественном уровне нам удалось воспроизвести аналогичный эксперимент по превращению КПВ в глутамат-специфичную карбоксипептидазу.
Кинетические параметры КПT D253G/T255K и КПT D253G/T255R могут быть объяснены на основании моделей этих вариантов с FFVF, FFVR и FFVE. Драматическое ухудшение гидролиза аргининового субстрата, по всей видимости, вызвано как отталкиванием одноименных зарядов, так и стерическими ограничениями карманов первичной специфичности вариантов. Ухудшение гидролиза гидрофобного субстрата также может быть объяснено отсутствием свободного пространства в S1’-субсайте для того, чтобы вместить объемные боковые радикалы Lys или Arg вариантов фермента и Phe субстрата. Вариант КПT D253G/T255R лучше гидролизовал отрицательно заряженный субстрат, чем КПT D253G/T255K, что, возможно, связано со способностью гуанидиновой группы образовывать большее количество водородных связей с субстратом, чем аминогруппа.
2.3. Реконструкция кармана первичной специфичности КПТ по аналогии с КПВ
Несмотря на структурное сходство зон связывания КПТ и КПВ субстратная специфичность этих ферментов существенно различается.
Среди семи остатков S1’-субсайта, которым приписывается роль детерминант субстратной специфичности, КПТ и КПВ отличаются пятью (см. табл. 2). В ходе работы шаг за шагом все эти пять остатков были заменены по аналогии с КПВ (варианты КПТ1-КПТ5) (см. табл. 2). Таким образом, было осуществлено воссоздание кармана первичной специфичности КПВ в КПТ. Несмотря на то, что кинетические характеристики вариантов КПТ1-КПТ5 обладали некоторыми отличиями от таковых фермента дикого типа, ни один из мутантов не приблизился по своим свойствам к КПВ. КПT1-КПT5, как и КПТwt, гидролизовали гидрофобные субстраты на два-три порядка активней, чем положительно заряженные (см. табл. 3).
Замена остатков Asp на Gly в 253 положении и Thr на Asp в ключевом 255 положении (КПТ2) не привела к увеличению активности варианта на субстрате с С-концевым Arg. Перенос отрицательного заряда в новое положение в противоположность ожидаемому не ухудшил, а даже улучшил гидролиз гидрофобных субстратов. По всей видимости, причиной этому является отдаление карбоксильной группы от входа в карман специфичности вследствие того, что остаток 255 располагается ближе ко дну S1’-субсайта на 1.
Расширение кармана первичной специфичности при замене Ala243 на Gly (варианты КПТ1 и КПТ3) привело к ослаблению связывания аргинина субстрата, в то время как скорость гидролиза гидрофобного субстрата изменилась незначительно.
Введение полярной OH-группы Ser207 (вариант КПТ4) привело к прогнозируемому ослаблению связывания субстрата с С-концевым Leu. Неожиданным оказалось ухудшение сродства варианта к субстрату с С-концевым Arg. Это можно объяснить тем, что при связывании боковой радикал субстрата вынужден вытеснять воду из контакта с Ser207 без компенсаторного формирования с ним водородной связи, как это наблюдалось в случае комплекса КПВ с аналогом аргининового субстрата.
Активность мутанта КПТ5, наиболее близкого по первичной структуре к КПВ, по субстрату DnpAAR была в 380 раз ниже, чем таковая КПВ и в 2,8 раза ниже по сравнению с КПТwt. Введение пяти мутаций практически не изменило kcat/Km гидролиза гидрофобного субстрата. Эти наблюдения идут в разрез с данными для КПВ, у которой возможность отщеплять гидрофобные С-концевые остатки была найдена лишь на качественном уровне. В то же время приближение к структуре КПВ привело к ожидаемому уменьшению эффективности гидролиза субстрата с С-концевой Glu в 7 раз.
Изучение селективности КПТ выявило противоречия с классической теорией субстратной специфичности МКП. Несмотря на наличие отрицательного заряда в S1’-субсайте КПТwt и ряда ее вариантов, как у КПВ, скорость гидролиза положительно заряженного субстрата обоими ферментами существенно различается. При этом КПТ в отличие от КПВ обладает способностью отщеплять С-концевой Glu субстрата. Необъясненной остается и высокая скорость гидролиза КПТ гидрофобных субстратов при общей полярности кармана первичной специфичности.
Отсутствие серьезных изменений кинетических параметров КПТ при воссоздании зоны связывания КПВ наводит на мысль о существовании других, помимо общепризнанных семи остатков S1’-субсайта, детерминант субстратной специфичности.
Другая возможность объяснения наблюдаемых фактов состоит в том, что введение этих замен приводит к искажению структуры S1'-субсайта КПТ. Подобные эффекты наблюдались в работах по имплантации зоны связывания химотрипсина в трипсин.
3. Поиск новых детерминант субстратной специфичности КПТ
3.1. Сравнение структуры КПВ и модели КПТ5
Модель КПТ5 была получена посредством введения в известную структуру КПТ соответствующих мутаций in silico и выбора конформаций боковых радикалов, наиболее близких к таковым в КПВ. Различия в составе и расположении зарядов в молекулах ферментов и строении их активных центров были проанализированы.
КПТ5 и КПВ отличались расположением и зарядами 30 заряженных остатков. Однако большинство из них локализовано на поверхности молекул, где в присутствии воды и противоионов их электростатическое поле значительно ослаблено. Тем не менее, ферменты отличались и остатками, расположенными в сердцевине белка. КПТ обладает His68, расположенном во втором слое остатков вокруг бокового радикала С-концевого остатка субстрата. В случае если His68 заряжен, взаимодействие с ним заряженных групп субстратов способно уменьшить энергию связывания DnpAAR КПТ в 7 раз и увеличить энергию связывания ZAAE в 6,5 раза.
Кроме того, КПТ, в отличие от КПВ, обладает четырьмя центрами связывания ионов Са2+. Несмотря на удаленное расположение (30 от активного центра фермента) суммарный заряд этих ионов велик (+8), что также позволяет предполагать их участие в определении специфичности КПТ. Расчет силы взаимодействия показывает, что улучшение связывания субстрата с С-концевым глутаматом и ухудшение связывания субстрата с С-концевым аргинином благодаря наличию ионов Са2+ может быть 10-кратным.
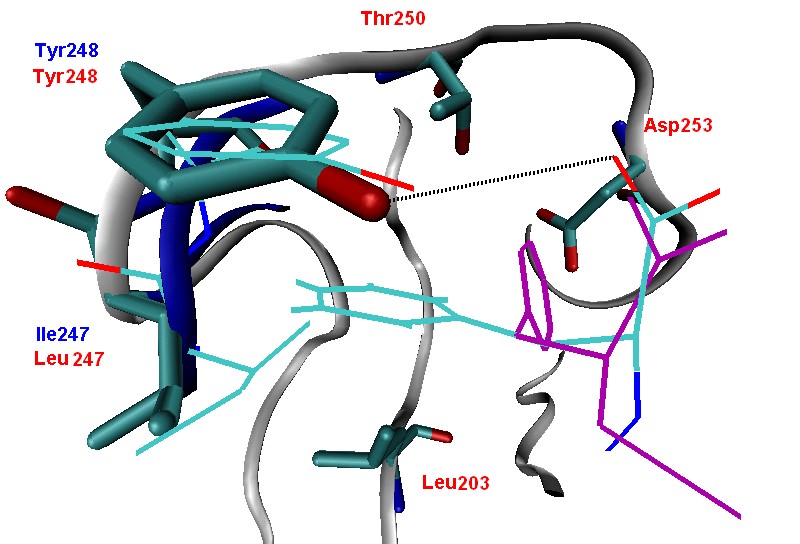
Рис. 2. Петли активных центров КПТ и КПВ
Сравнение строения активных центров выявило отличия в организации петли с Tyr248, распределении молекул структурно связанной воды, природе и положении остатков, образующих второй слой остатков вокруг субстрата. В фокус исследования попало лишь первое отличие. Это связано со сложностью манипулирования сайтами гидратации и отсутствием информации о роли остатков второго слоя в определении субстратной специфичности МКП.
Петля активного центра с Tyr248, участвующая в индуцированном соответствии, укорочена у КПТ на один остаток по сравнению с КПВ и с КПА (рис. 2).
На рис. 2 полипептидный хребет КПТ и КПВ показаны серой и синей лентами соответственно. Остатки КПТ изображены в проволочном виде и подписаны красным шрифтом. Остатки КПВ показаны в виде линий и подписаны синим шрифтом. Ингибитор, имитирующий С-концевой Phe субстрата в КПА, окрашен фиолетовым цветом. Предположенное для КПТ положение С-концевого Phe, в котором его боковой радикал обращен в гидрофобную зону кармана первичной специфичности, показано в виде линии, окрашенной по типу атомов. Водородная связь между Tyr248 и COO- группой субстрата показана пунктирной линией.
Вследствие этого боковой радикал Leu247 удален на 1-1.8 от алифатической части заряженных субстратов по сравнению с гомологичным Ile247 КПВ. Расчет Ван-дер-Ваальсовых взаимодействий с помощью потенциала Леннарда-Джонса показывает, что это приведет к падению энергии связывания субстратов с С-концевыми Arg и Glu в 5 и 15 раз соответственно.
Другое влияние данного отличия состоит в том, что гидрофобная зона кармана первичной специфичности пространственно объемнее в КПТ, чем в КПВ, что было доказано как визуальным анализом структур, так и методами молекулярной механики. Минимизацией энергии структур КПТ и КПВ с субстратом FFVF было показано, что объемный боковой радикал С-концевого Phe может быть расположен у входа в карман первичной специфичности КПТ рядом с Leu247 и Tyr248. Подобная конформация не может быть достигнута в КПВ вследствие того, что боковой радикал Ile247 смещает бензольное кольцо субстрата на 1,5 ко дну S1’-субсайта. Таким образом, данное различие объемов S1’-субсайтов КПТ и КПВ может объяснить высокую гидрофобную специфичность КПТ. В этом случае Leu247 должен быть одной из главных детерминант гидрофобной селективности КПТ.
3.2. Вариант КПТ H68N
Для проверки возможной роли His68 в качестве детерминанты субстратной специфичности КПТ этот остаток был заменен на незаряженный Asn (вариант КПТ H68N). Эффективность гидролиза КПТ H68N всех трех субстратов осталась на таком же уровне, как и у фермента дикого типа (см. табл. 3). Профиль субстратной специфичности КПТ H68N 183/1/1,3 остался таким же, как и у КПТwt 64/1,7/1 (табл. 4), демонстрируя наибольшее сродство к гидрофобным субстратам. Отсутствие влияния замены His68Asn на селективность КПТ по отношению к положительно и отрицательно заряженным субстратам означает, что His68 не заряжен.
3.3. Влияние ионов кальция
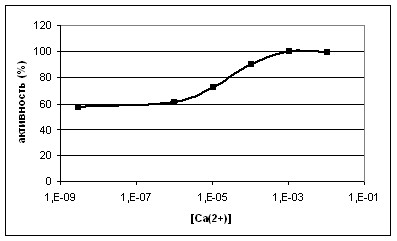
Рис. 3. Зависимость активности КПТ по субстрату DnpAAR от концентрации Ca2+. Значения стандартных отклонений менее 10%
Для уменьшения концентрации ионов кальция в реакционную смесь был добавлен хелатирующий агент ЭГТА. В этом случае концентрация кальция была на порядок меньше, чем концентрация фермента. Свидетельством удаления Са2+ из структуры фермента явилось падение термостабильности КПТ. Так, после предварительной инкубации в течение 15 мин при 70С фермент с Са2+ теряет около 30% активности, в то время как фермент без Са2+ полностью инактивируется.
Зависимость активности фермента по субстрату DnpAAR от концентрации Са2+ (рис. 3) имела сигмоидальный вид с перегибом в диапазоне концентраций CaCl2 10-100 мкМ. Зависимость подобного вида принято интерпретировать как доказательство роли структурно связанного кальция в селективности ферментов.
Изменение активности фермента при удалении из структуры КПТ ионов Са2+ было существенным (табл. 5). Активность фермента без Са2+ уменьшилась в 1,7 и 2,2 раза для заряженных субстратов DnpAAR и ZAAE соответственно. Напротив, активность фермента на гидрофобном субстрате ZAAL возросла в 1,5 раза. Таким образом, специфичность к гидрофобным субстратам у фермента без Са2+ увеличилась в 3 раза. Эффект Са2+ был полностью обратим.
Увеличение эффективности гидролиза гидрофобных субстратов и уменьшение эффективности гидролиза положительно заряженных субстратов заставляет предполагать, что влияние ионов кальция сводится к конформационным изменениям в районе сайтов связывания Са2+, которые передаются в район активного центра фермента. Таким образом, нами впервые обнаружено влияние структурно связанного кальция на субстратную специфичность КПТ. Этот эффект, описанный ранее для аминопептидазы Streptomyces griseus, для МКП ранее не описан.
Таблица 5
Активность КПТ в буфере с 1 мМ и 3 нМ Ca2+ a.
| Субстрат | Активность, % | |
| 1 мМ Ca2+. | 3 нМ Ca2+. | |
| DnpAAR | 100 ± 19 | 58 ± 11 b |
| ZAAL | 100 ± 6 | 147 ± 3 b |
| ZAAE | 100 ± 4 | 45 ± 6 b |
Примечание.
a Активность КПТ в буфере с 1 мМ CaCl2 принята за 100%. Приведены средние значения и стандартные отклонения среднего.
b p < 0,05 согласно Т-тесту Стьюдента.
3.4. Влияние длины петли активного центра с Tyr248
Вставка одного аминокислотного остатка (Thr 246) в петлю активного центра КПТ5 по аналогии с КПА и КПВ (вариант КПТ6) привела к падению каталитической эффективности варианта. Так, значения kcat/Km для субстратов с С-концевыми Arg, Leu и Glu упали соответственно в 9, 16 и 24 раза. Таким образом, эффективность гидролиза всех трех использованных в работе субстратов вариантом КПТ6 приблизительно на порядок меньше, чем КПТ5. Ухудшение катализа в нашем случае может быть результатом менее выгодного расположения Tyr248 в «закрытом» комплексе или увеличения энергии, которую необходимо затратить для осуществления индуцированного соответствия.
Профили субстратной специфичности КПТ5 и КПТ6 остались схожими с таковыми КПТ дикого типа: 172/1/1,5; 259/1/3,8; 64/1,7/1; для субстратов с С-концевыми Leu, Glu и Arg для КПT5, КПT6 и КПTwt соответственно (см. табл. 4). Все три фермента гидролизовали гидрофобные субстраты с эффективностью на два порядка большей, нежели заряженные.
Таким образом, отличия в строении петли активного центра с Tyr248 у КПТ и КПВ не являются причинами различной специфичности этих ферментов.
3.5. Вариант КПТ L247N
Для выяснения роли Leu247 КПТ в связывании гидрофобных субстратов мы заменили его изостеричным полярным Asn. При этом ожидалось уменьшение активности варианта по гидрофобным субстратам. Тем не менее, эффективность гидролиза субстрата с С-концевым Leu мутантом L247N осталась на прежнем уровне, как и в случае субстрата с С-концевым Arg. В то же время существенно изменились кинетические характеристики гидролиза отрицательно заряженного субстрата. Зависимость скорости реакции от концентрации субстрата не подчинялась уравнению Михаэлиса-Ментен из-за активации субстратом в использованном нами диапазоне концентраций ZAAE. В этом случае нам удалось определить лишь верхнюю границу параметра kcat/Km при минимальной использованной концентрации ZAAE. В этих условиях каталитическая активность варианта упала более чем в 28 раз. Таким образом, профиль специфичности фермента для субстратов с С-концевыми Leu, Glu и Arg изменился с 64/1,7/1 для КПТ дикого типа до 24/<0,06/1 для КПТ L247N.
Скорее всего, падение активности в отношении отрицательно заряженного субстрата объясняется тем, что при замене гидрофобного Leu на полярный Asn был удален гидрофобный контакт между Leu247 и алифатической частью Glu субстрата, доля которого в связывании этого субстрата велика по сравнению с взаимодействиями алифатических частей Leu и Arg. Боковые радикалы С-концевых Arg и Leu, в отличие от такового С-концевой Glu, обладают дополнительными одной СН2- и двумя СН3 – группами соответственно, которые могут образовывать гидрофобные контакты еще и с Leu203.
Таким образом, нами обнаружена структурная детерминанта селективности КПТ к отрицательно заряженным субстратам – Leu247.
Выводы
- Методом сайт-направленного мутагенеза показано, что природа остатка в 255 положении не играет ключевой роли в определении преимущественно гидрофобной специфичности карбоксипептидазы Т, что находится в противоречии с классической теорией субстратной специфичности пищеварительных металлокарбоксипептидаз.
- Подтверждена роль заряда в 253 или 255 положениях кармана первичной специфичности как детерминанты сродства карбоксипептидазы Т к заряженным субстратам.
- Показано, что воссоздание зоны связывания карбоксипептидазы В в карбоксипептидазе Т не приводит к изменению гидрофобной специфичности последней, что говорит о недостаточности классической теории. Высказано предположение о существовании дополнительных детерминант субстратной специфичности карбоксипептидазы Т.
- Найдены новые детерминанты селективности карбоксипептидазы Т: остаток Leu247, принадлежащий карману первичной специфичности, и структурные ионы кальция, удаленные от активного центра.
Список сокращений
CABS-сефароза - [N-(-аминокапроил)-p-аминобензил]сукцинил-Сефароза 4B
DnpAAR – 2,4-динитрофенил-аланил-аланил-аргинин
ZAAE – бензилоксикарбонил-аланил-аланил-глутаминовая кислота
ZAAL – бензилоксикарбонил-аланил-аланил-лейцин
ДСNа – додецилсульфат натрия
КП – карбоксипептидаза
КПТ и КПТwt – карбоксипептидаза Т дикого типа.
МКП – металлокарбоксипептидаза(ы)
ПААГ – полиакриламидный гель
Список публикаций по теме диссертации
- Акпаров, В.Х. Cтруктурные основы широкой субстратной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris. Воссоздание кармана первичной специфичности карбоксипептидазы В / Акпаров, В.Х., Гришин А.М., Юсупова М.П., Иванова Н.М., Честухина Г.Г. // Биохимия, -2007, -Т. 72, - №4. - С. 515-524.
- Grishin A.M. Structural principles of the broad substrate specificity of Thermoactinomyces vulgaris carboxypeptidase T - role of amino acid residues at positions 260 and 262 / Grishin A.M., Akparov V.Kh., Chestukhina G.G // Protein Engineering, Design and Selection. - 2008. - Vol. 21. - №9. - P.545-551.
- Гришин А.М. Дизайн карбоксипептидазы Т Thermoactinomyces vulgaris со специфичностью карбоксипептидазы В // Системная биология и биоинженерия: Материалы Международной школы-конференции для молодых ученых. Москва, 28 ноября – 02 декабря 2005 г. – М.: Изд-во Макс Пресс, 2005. - С. 21.
- Гришин А.М. Исследование субстратной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // Перспективные направления физико-химической биологии и биотехнологии: Материалы XVIII Зимней молодежной научной школы. Москва, 7-10 февраля 2006 г. – М.: Изд-во Учебно-научного центра института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, 2006. - С. 33.
- Гришин А.М. Исследование влияния отдельных аминокислотных замен в кармане первичной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris на субстратную специфичность этого фермента / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // Биология – наука ХХI века: Материалы 10-й Пущинской школы-конференции молодых ученых. Пущино, 17-21 апреля 2006 г. – М.: Изд-во Пущинского научного центра РАН, 2006. - С. 71.
- Grishin A.M. Carboxypeptidase T with the reconstructed primary specificity pocket of carboxypeptidase B / A.M. Grishin, V.Kh. Akparov, G.G. Chestukhina // Molecules in Health and Disease: 31st FEBS Congress. Istanbul, 24-29 june 2006. FEBS Journal. - 2006. - Vol.273, - №s1 - P. 309.
- Гришин А.М. Гипотеза о двух зонах связывания в кармане первичной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // МЕДБИОТЕК. Актуальные вопросы инновационной деятельности в биологии и медицине: Материалы Третьей международной научно-практической школы-конференции. Москва, 4-5 декабря 2006 г. – М.: Изд-во ОАО «Авиаиздат», 2006. - С. 28
- Гришин А.М. Исследование взаимосвязи между структурой и функцией в молекулах ферментов на примере карбоксипептидазы Т / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // Химия протеолитических ферментов: Материалы VI Симпозиума. Москва, 23-25 апреля 2007 г. – М.: Изд-во Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, 2007. - С. 20.
- Гришин А.М. Роль Asp253 в определении субстратной специфичности карбоксипептидазы Т Thermoactinomyces vulgaris / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // Белки и пептиды: Материалы III Симпозиума (16-21 сентября 2007 г., г. Пущино, Московская обл.), - М.: Изд-во Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, 2007. - С. 44.
- Гришин А.М. Влияет ли длина петли активного центра металлокарбоксипептидазы Т Thermoactinomyces vulgaris на субстратную специфичность этого фермента? / А.М. Гришин, В.Х. Акпаров, Г.Г. Честухина // Биология – наука ХХI века: Материалы 11-й Пущинской школы-конференции молодых ученых. Пущино, 29 октября – 2 ноября 2007 г. – М.: Изд-во Пущинского научного центра РАН, 2007. - С. 58.

