Сравнительная геномика дрожжей saccharomyces
На правах рукописи
Михайлова Юлия Владимировна
Сравнительная геномика дрожжей Saccharomyces
Специальность 03.00.15 – Генетика
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
МОСКВА – 2009
Работа выполнена в секторе молекулярной биологии дрожжей (зав. Е.С. Наумова) и лаборатории молекулярной генетики, таксономии и экологии дрожжей (зав. Г.И. Наумов) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов (ФГУП «ГосНИИ генетика», Москва), а также в Центре анализа биологических систем (зав. С. Оливер) факультета естественных наук Манчестерского университета (Англия).
Научный руководитель:
доктор биологических наук Наумова Елена Сергеевна
Официальные оппоненты:
доктор биологических наук, профессор Каменева Светлана Владимировна Московский Государственный
Университет
кандидат биологических наук Эльдаров Михаил Анатольевич
центр «Биоинженерия» РАН
Ведущая организация: Институт биологии гена РАН
Защита состоится « » декабря 2009 г. в 1400 часов на заседании Диссертационного совета Д217.013.01 при Государственном научно-исследовательском институте генетики и селекции промышленных микроорганизмов по адресу: 117545, г. Москва, 1-й Дорожный проезд, 1.
Факс: (495) 315 05 01
С диссертацией можно ознакомиться в научной библиотеке ФГУП «ГосНИИ генетика».
Автореферат разослан « » 2009 г.
Ученый секретарь
Диссертационного совета,
кандидат химических наук Воюшина Т. Л.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Биологические виды рода Saccharomyces являются хорошей моделью для изучения фундаментальных биологических процессов: видообразования и приспособляемости организмов к окружающей среде. В настоящее время род Saccharomyces четко очерчен и включает, помимо S. cerevisiae, биологические виды S. arboricolus, S. bayanus, S. cariocanus, S. kudriavzevii, S. mikatae и S. paradoxus (Naumov et al., 2000; Kurtzman, 2003; Wang, Bai, 2008; Наумов, 2009). Культурный генофонд дрожжей-сахаромицетов представлен видами S. cerevisiae и S. bayanus. Последние дрожжи ассоциированы с производством некоторых сладких вин, шампанского и сидра. Остальные пять видов не связаны с ферментационными процессами и обнаруживаются только в природе. Дрожжи S. cerevisiae – первый эукариотический организм, геном которого был секвенирован в рамках международного проекта (Goffeau et al., 1996). Позднее проведено секвенирование полных геномов видов S. bayanus, S. kudriavzevii, S. mikatae и S. paradoxus и частичное генома S. cariocanus (Kellis et al., 2003; Cliften et al., 2001). Данные сравнительного геномного анализа свидетельствуют о том, что род Saccharomyces в эволюционном плане сравнительно молодой и процесс формирования новых видов в нем, по-видимому, продолжается (Kellis et al., 2003). Подтверждением этому может служить существование географических популяций дрожжей S. paradoxus. Штаммы этого вида, изолированные в Европе, Северной Америке и на Дальнем Востоке, имеют частичную репродуктивную изоляцию, а также отличаются по спектру изоферментов и по нуклеотидным последовательностям теломерных районов хромосом (Naumov et al., 1997, 1998; Sniegowski et al., 2002; Liti et al., 2005, 2009).
Определение полных нуклеотидных последовательностей геномов биологических видов Saccharomyces позволило осуществить прорыв в области эволюционной генетики дрожжей, а детальный сравнительный анализ соответствующих геномов привел к установлению межвидового гибридного происхождения ряда промышленных штаммов Saccharomyces (Naumova et al., 2005; Bradbury et al., 2006; Gonzales et al., 2006, 2008).
Имеющиеся в литературе многочисленные исследования культурных дрожжей Saccharomyces, как правило, проводились на лабораторных дрожжах или генетически не охарактеризованных штаммах. Практически ничего не известно о природных популяциях дрожжей Saccharomyces и их генетической изменчивости. В международных проектах по секвенированию полных геномов было использовано только по одному штамму каждого биологического вида. Таким образом, была изучена только ограниченная часть генофонда дрожжей Saccharomyces, а природный внутривидовой полиморфизм этих дрожжей остался не исследованным.
Цель и задачи исследования. Целью данной работы является изучение молекулярного полиморфизма и эволюции геномов биологических видов Saccharomyces и их межвидовых гибридов на материале штаммов различного экологического и географического происхождения.
В этой связи в работе решались следующие задачи:
- Сравнение геномов биологических видов рода Saccharomyces (ДНК-ДНК реассоциация, секвенирование ядерных и митохондриальных генов).
- Молекулярно-генетический анализ природных популяций дрожжей S. bayanus, S. cerevisiae и S. paradoxus.
- Изучение распространения и особенностей плазмидных двунитевых РНК (днРНК) дрожжей Saccharomyces.
- Скрининг штаммов дрожжей Saccharomyces различного происхождения с целью обнаружения дивергентных изолятов и межвидовых гибридов.
- Сравнительная геномная гибридизация естественных межвидовых гибридов S. cerevisiae S. kudriavzevii и S. cerevisiae S. bayanus.
Научная новизна и практическая значимость работы. На материале штаммов различного экологического и географического происхождения изучено молекулярно-генетическое разнообразие дрожжей Saccharomyces. Впервые достоверно определены значения ДНК-ДНК-реассоциации дрожжей S. cariocanus, S. kudriavzevii и S. mikatae между собой и с типовыми культурами S. cerevisiae, S. bayanus, и S. paradoxus. Подтверждено близкое генетическое родство S. paradoxus и S. cariocanus. Результаты молекулярного анализа хорошо согласуются с ранее полученными генетическими данными (Naumov et al., 2000) и указывают на видовой статус дрожжей S. cariocanus. Установлено, что крупные хромосомные перестройки не играют определяющей роли в репродуктивной изоляции дрожжей Saccharomyces.
Впервые изучено распространение и особенности плазмидных днРНК у видов рода Saccharomyces. Все обнаруженные плазмидные М-днРНК не функциональны и, возможно, являются мутантными формами киллерных плазмид. С помощью ПЦР-анализа с микросателлитным праймером (GTG)5 изучен внутривидовой полиморфизм дрожжей S. bayanus и S. paradoxus.
Для дифференциации дрожжей S. cerevisiae, S. bayanus, S. kudriavzevii и обнаружения их межвидовых гибридов предложено использовать ПДРФ- анализ некодирующих участков рДНК (ITS1 и IGS2) и молекулярное кариотипирование. На основании предложенных методов впервые обнаружены гибридные штаммы S. cerevisiae S. kudriavzevii американского происхождения, а с помощью сравнительной геномной гибридизации на микрочипах изучена композиция их геномов. С помощью полногеномного анализа впервые установлена интрогрессия субтеломерных последовательностей S. bayanus в геном некоторых штаммов S. cerevisiae.
Создана большая коллекция генетически охарактеризованных штаммов S. cerevisiae, S. bayanus и S. paradoxus, которые могут быть использованы в фундаментальных и прикладных исследованиях.
Апробация работы. Основные положения работы были представлены на
2-м Международном конгрессе «Биотехнология – состояние и перспективы развития» (2003, Москва), 22-й Международной конференции по генетике и молекулярной биологии дрожжей (2005, Братислава, Словакия), 25-м Международном специализированном симпозиуме по дрожжам (2006, Хельсинки, Финляндия), 24-й международной конференции по генетике и молекулярной биологии дрожжей (2009, Манчестер, Англия). Диссертационная работа была апробирована на заседании секции генетики микроорганизмов Ученого совета ГосНИИгенетика 10 июня 2009 года.
Публикации. По теме диссертации опубликовано 8 статей и 4 тезисов.
Структура и объем диссертации. Диссертация включает введение, обзор литературы, материалы и методы, экспериментальную часть и обсуждение, заключение и выводы. Материалы диссертации изложены на 202 страницах машинописного текста, содержат 39 рисунков и 10 таблиц. Список литературы включает 372 источника.
Материалы и методы исследования
Объекты исследования. В работе было изучено более 270 штаммов дрожжей Saccharomyces, изолированных в разных регионах мира из природных источников и ферментационных процессов. Происхождение основных штаммов можно найти на следующих сайтах коллекций в интернете: CBS, www.cbs.knaw.nl; ATCC, www.lgcstandards-atcc.org; NCYC, www.ncyc.co.uk; NRRL, nrrl.ncaur.usda.gov; NBRC, www.nbrc.nite.go.jp; UCD, www.phaffcollection.org и ВКМ, www.vkm.ru.
Методы исследования. Культивирование дрожжей, отбор ауксотрофных мутаций и получение моноспоровых клонов проводили согласно стандартным методикам (Захаров и др., 1984; Guthrie, Fink, 1991). Выделение двунитевой РНК (днРНК) проводили по методу Fride и Fink (1978), с некоторыми модификациями. Киллерную активность штаммов дрожжей определяли согласно методике, описанной ранее (Наумов, Наумова, 1973). Анализ полиморфизма длин рестриктазных фрагментов (ПДРФ-анализ), клонирование и секвенирование ПЦР-продуктов проводили стандартными методами (Sambrook et al., 1989).
Приготовление препаратов хромосомных ДНК и их электрофоретическое разделение на аппарате CHEF-DR III фирмы “Bio-Rad” (США) проводили согласно Naumov et al. (1990). Перенос хромосомных ДНК на нитроцеллюлозную мембрану осуществляли капиллярным способом. Для мечения ДНК применяли нерадиоактивную метку с использованием UTP, меченного дигоксигенином (dig-II-dUTP) из набора “DIG High Prime DNA Labeling and Detection Starter Kit I” (“Roche”, Германия). Гибридизацию и проявление гибридизационных сигналов также проводили по инструкции фирмы-изготовителя (“Roche,” Германия). Филогенетический анализ исследуемых нуклеотидных последовательностей проводили с помощью алгоритмов Neighbour-Joining и UPGMA из пакетов компьютерных программ MEGA3 (Kumar et al., 2004) и TREECON (van der Peer, de Wachter, 1994). Индексы бутстрепа, определяющие статистическую достоверность выделения групп, подсчитывали для 1000 псевдореплик.
Для опытов по ДНК-ДНК реассоциации ДНК очищали методом хроматографии на гидроксилаппатитных колонках (Britten et al., 1970). Степень гомологии ДНК оценивали спектрофотометрическим методом путем определения кинетики ДНК-ДНК реассоциации, как описано Seidler и Mandel (1971) и модифицировано Kurtzman et al. (1980). Использовали спектрофотометр Gilford Response II и его программу термальной кинетики.
Выделение геномной ДНК для сравнительной геномной гибридизации на микрочипах проводили с использованием набора “Promega” Genomic DNA Purification Kit согласно протоколу фирмы изготовителя (Promega Corporation, США). Очищенную фрагментированную ДНК метили флуоресцентными красителями (зеленый цианин 3 (Cy3) и красный цианин 5 (Cy5)) с помощью метода рассеянной затравки (Maniatis et al., 1982). Для гибридизации использовали ДНК-микроматрицы разных типов: 1 - стеклянные ДНК-биочипы с ПЦР-продуктами, соответствующими каждой открытой рамке считывания секвенированного штамма дрожжей S. cerevisiae S288с (Hayes et al., 2002); 2 - олигонуклеотидные микрочипы высокой плотности фирмы Affymetrix (Affymetrix Gene Chip, США); 3 – микрочипы фирмы CombiMatrix с 3352 генами секвенированного генома S. bayanus и S. cerevisiae. Дизайн и печать этого микрочипа были осуществлены нами совместно с научной группой Манчестерского биоинформационного центра.
Нормализацию полученных данных сравнительной гибридизации на стеклянных биочипах и микрочипах фирмы Affymetrix проводили с помощью программы RMAExpress (http://rmaexpress.bmbolstad.com). Графическое изображение нормализованных данных для каждого анализируемого штамма было получено с помощью программы CGH Miner (http://www-stat.stanford.edu/~wp57/CGH-Miner). Результаты гибридизаций на биочипах CombiMatrix обрабатывали с помощью программ Microarray Imager (www.combimatrix.com) и CGH Miner (http://www-stat.stanford.edu/~wp57/CGH-Miner).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- Сравнительный анализ геномов дрожжей Saccharomyces: биологический вид S. cariocanus
Штаммы североамериканской популяции дрожжей S. paradoxus по некоторым молекулярным маркерам не отличаются от дрожжей биологического вида S. cariocanus и на этом основании было высказано предположение о конспецифичности указанных видов (Liti et al., 2005, 2006). Для выяснения таксономического статуса дрожжей S. cariocanus мы провели их детальное молекулярно-генетическое изучение с помощью ДНК-ДНК реассоциации, молекулярного кариотипирования, секвенирования генов рРНК и митохондриального гена ATP9.
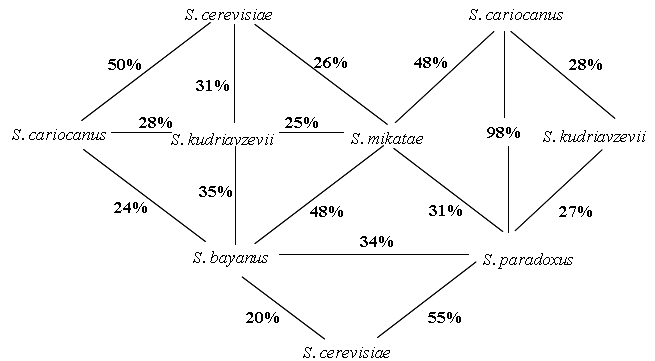
Рисунок 1. Значения гомологии ДНК типовых культур дрожжей Saccharomyces. Звездочкой обозначены данные по ДНК-ДНК реассоциации из работы Vaughan Martini (1989). Остальные значения ДНК-ДНК рессоциации получены нами.
Метод ДНК-ДНК реассоциации позволяет устанавливать достаточно протяженные районы генетической гомологии между молекулами ДНК различных организмов (Jahnke, 1987). С помощью этого метода мы изучили родство дрожжей S. cariocanus, S. kudriavzevii и S. mikatae между собой и с типовыми культурами S. cerevisiae, S. bayanus, и S. paradoxusПолученные нами значения ДНК-ДНК реассоциации представлены на рисунке 1. Уровень ДНК-реаасоциации штаммов одного вида был высоким: 88–100%, а в межвидовых комбинациях низким: от 23 до 50%. Исключением является 98%-ная ДНК-ДНК реассоциация между S. cariocanus и S. paradoxus.
Согласно проведенному нами филогенетическому анализу, дрожжи S. cariocanus не отличаются по последовательностям ITS1 и D1/D2 участков рРНК и митохондриального гена ATP9 от штаммов североамериканской популяции S. paradoxus. В то же время у S. cariocanus имеется (рис. 2) уникальная нуклеотидная замена в более консервативном гене 18S рРНК (позиция 191, согласно нумерации последовательности этого гена дрожжей S. cerevisiae). Следует отметить, что штаммы S. paradoxus разного географического происхождения не отличаются по последовательностям этого гена друг от друга и от дрожжей S. cerevisiae. Виды S. kudriavzevii и S. mikatae также имеют идентичные последовательности гена 18S рРНК, а S. arboricolus отличается от остальных видов 2–4 нуклеотидными заменами (рис. 2).
Несмотря на одинаковые базовые кариотипические характеристики (гаплоидное число хромосом равное 16 и одинаковый диапазон размеров хромосомных полос от 250 до 2200 т.п.н.), биологические виды Saccharomyces значительно отличаются на молекулярном и хромосомном уровнях (Fischer et al., 2000; Naumov et al., 2000).

Дрожжи S. bayanus, S. cariocanus и S. mikatae имеют видоспецифичные молекулярные кариотипы, тогда как остальные биологические виды не отличаются по кариотипическим паттернам от S. cerevisiae. Уникальный кариотипический профиль дрожжей S. cariocanus связан с наличием четырех реципрокных транслокаций между хромосомами IX/XV, II/XVI, XI/IV и XII/XIV (Fischer et al., 2000). Мы сравнили молекулярные кариотипы S. cariocanus с кариотипами штаммов S. paradoxus из европейской, дальневосточной и североамериканской популяций (рис. 3). Обнаружено, что штаммы S. paradoxus из различных регионов имеют практически идентичные кариотипы (рис. 3, дорожки 12, 13, 15–25). Сходные кариотипические профили имеют дрожжи S. cerevisiae, S. arboricolus и S. kudriavzevii (рис. 3, дорожки 1–3, 6 и 7). Штаммы S. cariocanus отличаются по молекулярным кариотипам от всех остальных дрожжей Saccharomyces, включая географические популяции S. paradoxus (рис. 3, дорожки 10 и 11).
Несмотря на 98%-ную ДНК-ДНК-реассоциацию S. cariocanus образует стерильные гибриды со штаммами S. paradoxus различного географического происхождения, включая североамериканские изоляты (Naumov et al., 2000). Стерильность межвидовых гибридов с участием S. cariocanus нельзя объяснить только наличием в его кариотипе реципрокных транслокаций, затрагивающих 8 из 16 хромосом. Принимая во внимание 50%-ную максимальную гибель гибридных аскоспор при наличии у одного из родительских штаммов одной реципрокной транслокации (Loidl et al., 1998), теоретически ожидаемая выживаемость аскоспор гибридов S. cariocanus S. paradoxus, отличающихся четырьмя реципрокными транслокациями, должна составлять около 6.25% (100/24). В то же время в скрещиваниях с участием дрожжей S. cariocanus жизнеспособность гибридных аскоспор составляла 0-1% (Naumov et al., 2000; Fischer et al., 2000). Такая же жизнеспособность аскоспор отмечена в межвидовых скрещиваниях S. cerevisiae S. paradoxus, имеющих 50%-ную ДНК-ДНК-реассоциацию (Naumov et al., 1993, 1996, 1998).
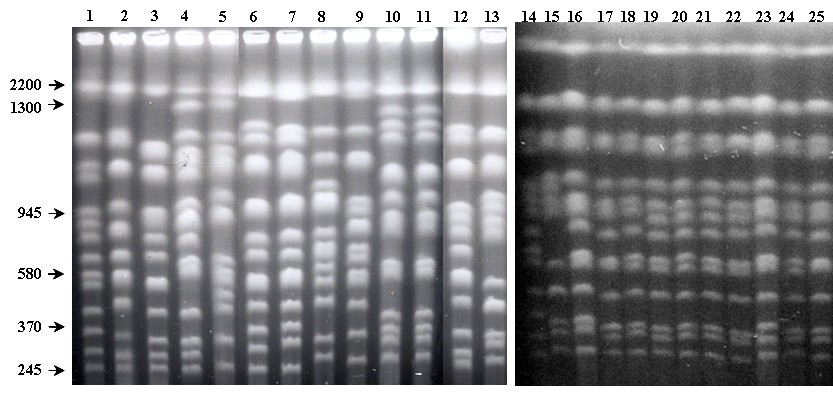
Рисунок 3. Молекулярные кариотипы дрожжей Saccharomyces
Дорожки: S. cerevisiae: 1, 14 – YNN 295 (хромосомный стандарт); 2 – ВКМ Y-502; S. arboricolus: 3 – 2.3317; S. bayanus var. bayanus : 4 – CBS 380 (Т); S. bayanus var. uvarum: 5 – MCYC 623; S. kudriavzevii: 6 - NBRC 1802 (Т); 7 – NBRC 1803; S. mikatae: 8 - NBRC 1815 (Т); 9 - NBRC 1816; S. cariocanus: 10 – UFRJ 50791; 11 – UFRJ 50816 (Т); S. paradoxus: (Европа) 12, 16 – CBS 432; 13, 15 – CBS 5829; 17 – CECT 10308; 18 – N7; 19 – N11; (Северная Америка) 20 - UCD-FST 52-153; 21 - UCD-FST 61-359; 22 – 95-1; (Дальний Восток) 23 – N 42; 24 – N 44; 25 – NBRC 1805. Т – типовая культура.
Для изучения влияния хромосомных перестроек на репродуктивную изоляцию дрожжей Saccharomyces, мы скрестили штаммы S. paradoxus европейского происхождения со штаммами из дальневосточной и североамериканской популяций. Проведенный нами гибридологический анализ и литературные данные указывают на то, что крупные хромосомные перестройки не играют определяющей роли в репродуктивной изоляции дрожжей Saccharomyces. Так, в наших опытах гибрид между европейским (N15) и дальневосточным (N42) штаммами, не имеющими крупных хромосомных перестроек, характеризовался 40%-ной выживаемостью аскосор. Жизнеспособность аскоспор гибрида между дальневосточным (N43) и европейским (CBS 5829) штаммами, имеющими хромосомные перестройки, была даже несколько выше – 45% (Naumov et al., 1993). По-видимому, на фертильность как внутри- так и межвидовых гибридов более существенное влияние оказывает конкретная комбинация скрещиваемых штаммов.
Таким образом, с генетической точки зрения дрожжи S. cariocanus являются самостоятельным биологическим видом рода Saccharomyces. В то же время сходство по многим молекулярным маркерам дрожжей S. cariocanus и S. paradoxus указывает на их недавнюю дивергенцию.
2. Внутривидовой полиморфизм дрожжей S. paradoxus и S. bayanus
Для изучения роли географических и гибридизационных факторов в эволюции дрожжей Saccharomyces мы провели анализ природного внутривидового полиморфизма дрожжей S. paradoxus и S. bayanus. Видовую идентификацию штаммов проводили с помощью ПДРФ-анализа некодирующих участков рДНК: 5.8S-ITS-фрагмента и межгенного спейсера IGS2, соответственно эндонуклеазами HaeIII/HpaII и AluI/BanI.
Внутривидовой полиморфизм изучали с помощью ПЦР с микросателлитным праймером (GTG)5, имеющим множественную локализацию в геноме дрожжей Saccharomyces. С помощью этого молекулярного маркера можно дифференцировать дрожжи S. cerevisiae, S. bayanus и S. paradoxus, а также идентифицировать отдельные штаммы указанных видов. Совместно с кафедрой биологии почв Почвенного факультета МГУ мы провели изучение дрожжей S. paradoxus, выделенных из филосферы различных видов растений в Московской области. Впервые выявлено доминирование этих дрожжей в природных субстратах с низким содержанием сахаров.
Мы сравнили (GTG)5-паттерны дрожжей Подмосковной популяции (MGU) и 6 штаммов S. paradoxus (CBS 432, CECT 10178, N8, 9, 12 и 17), выделенных в разных регионах Европы и отличающихся по ПЦР-профилям. На основании сходства паттернов с микросателлитным праймером (GTG)5 была построена дендрограмма, представленная на рисунке 4.
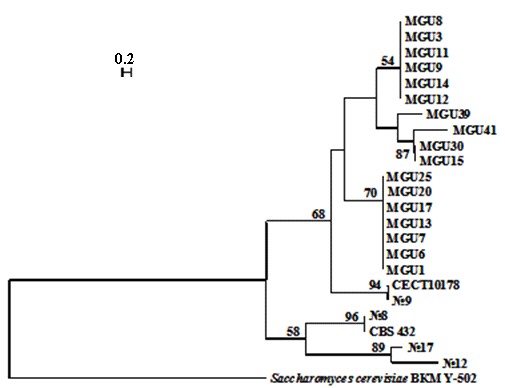
Штаммы S. paradoxus, изолированные в разных регионах Европы, в целом, более гетерогенны по ПЦР-профилям. Филогенетический анализ свидетельствуют о генетической однородности Подмосковной популяции дрожжей S. paradoxus.
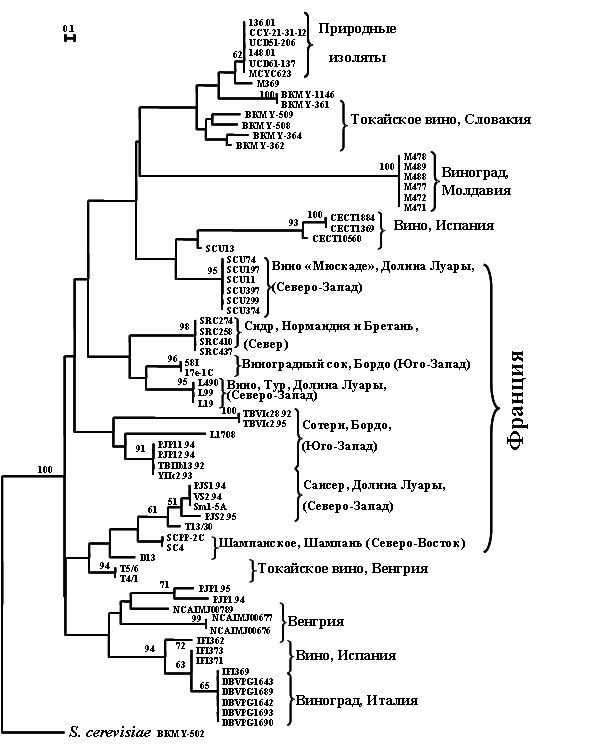
Рисунок 5. Дендрограмма родства штаммов Saccharomyces bayanus, основанная на матрице различий по ПЦР-профилям с микросателлитным праймером (GTG)5. В качестве внешней группы использован штамм S. cerevisiae ВКМ Y-502. Данные обработаны по программе Simple Matching из компьютерного пакета TREECON. Приводятся значения бутстрепов >50%.
На материале штаммов различного экологического и географического происхождения нами изучен внутривидовой полиморфизм дрожжей S. bayanus. На основании сходства (GTG)5-профилей была построена дендрограмма, представленная на рисунке 5.
Обнаружена корреляция между микросателлитными маркерами штаммов и их происхождением. Штаммы, выделенные из природных источников и ферментационных процессов, отличались по ПЦР-профилям. На дендрограмме, построенной на основании сходства (GTG)5-паттернов, винные штаммы сгруппированы в зависимости от источника и места выделения: типа вина и конкретного винодельческого региона.
Двунитевая РНК (дн-РНК) биологических видов Saccharomyces. Одной из форм проявления конкурентных отношений дрожжей-сахаромицетов является способность убивать чувствительные клетки под влиянием видоспецифичных токсинов. Этот феномен широко распространен среди культурных, в основном, винных штаммов S. cerevisiae (Наумов и др., 1973; Schmitt, Breinig, 2002). Штаммы-убийцы содержат два типа вирусных плазмидных днРНК – M и L. Первая отвечает за синтез токсина и устойчивость к нему, вторая – за образование белковых капсул, в которых находятся отдельно M- и L-фракции днРНК. Мы изучили распространение и особенности плазмидных днРНК у разных видов Saccharomyces (рис. 6).
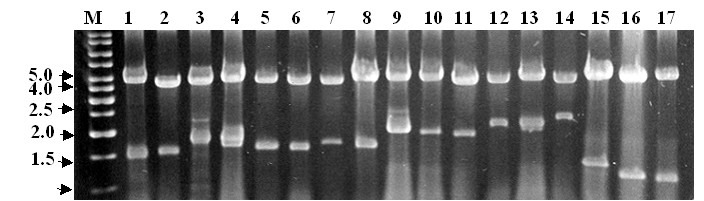
Рисунок 6. Плазмидные днРНК дрожжей Saccharomyces.
S. cerevisiae: 1 – М 437 (М2), 3 – K7 (M1); S. bayanus: 8 – IFI373 (M3), 15 - Sµ1 (M8), 16 – DDI4.95 (M10), 17 – SCU397 (M11); S. kudriavzevii: 4 – NBRC 10990 (M1), 9 – NBRC 10991 (M4); S. mikatae: 2 – NBRC 11001 (M2), 5 – NBRC 10999 (M3), 6 – NBRC 10995 (M3), 10 – NBRC 10993 (M4); S. paradoxus: 7 – №22 (M3), 11 – №16 (M4), 12 – №15 (M5), 13 – ВКМ Y-2472 (M6), 14 – DBVPG 1373 (M7); М – маркер молекулярных масс (т. п. н.) “1 kb DNA Ladder” (“Fermentas”, Литва). В скобках приведен тип М-днРНК.
Плазмидные днРНК отсутствуют только у S. cariocanus. У S. kudriavzevii обнаружено два типа М-днРНК: М1 и М4, тогда как дрожжи S. mikatae характеризуются тремя типами плазмид: М2–М4. У дрожжей S. paradoxus и S. bayanus наряду со стандартной L-фракцией выявлено по 7 различных М-днРНК, соответственно М1–М7 и М1–М3, М8–М11 (рис. 6, дорожки 7, 11, 13-15). Таким образом, у дрожжей Saccharomyces всего идентифицировано 11 различных М-днРНК. Несмотря на то, что ряд штаммов S. paradoxus различного географического происхождения вообще не имеют днРНК (например, Подмосковная популяция) или имеют только L фракцию, большинство штаммов этого вида обладают L- и M-днРНК. По крайней мере, некоторые из M-фракций, например, M6, определяют синтез токсинов (Наумов, 1985). Как правило, штаммы S. bayanus не имеют днРНК. М-фракция обнаружена только у 11 из 68 изученных нами штаммов. Фенотипический анализ показал, что все обнаруженные плазмидные М-днРНК не функциональны и, возможно, являются мутантными формами киллерных плазмид.
3. Дифференциация гибридных штаммов Saccharomyces
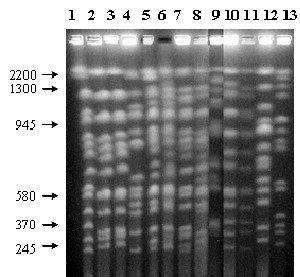
С целью обнаружения естественных межвидовых гибридов мы провели молекулярно-генетическое изучение 55 штаммов Saccharomyces из различных дрожжевых коллекций. С помощью ПДРФ-анализа некодирующих участков рДНК (5.8S-ITS-фрагмента и межгенного спейсера IGS2), молекулярного кариотипирования и множественной ПЦР удалось не только дифференцировать дрожжи S. cerevisiae, S. bayanus и S. kudriavzevii, но и обнаружить три межвидовых гибрида S. cerevisiae S. kudriavzevii UCD 40-9, NRRL Y-53 и NRRL Y-1912. Молекулярный кариотип указанных гибридных штаммов приведен на рисунке 7. Штаммы NRRL Y-53 и NRRL Y-1912 имеют в своем кариотипе более 16 хромосомных полос, тогда как кариотип штамма UCD 40-9 менее сложный (рис. 7, дорожки 7–9). Следует отметить, что указанные три штамма выделены в США, тогда как все ранее описанные гибриды S. cerevisiae S. kudriavzevii имеют европейское происхождение.
4. Межвидовые гибриды S. cerevisiae S. kudriavzevii
Для изучения геномной композиции штаммов UCD 40-9, NRRL Y-53 и NRRL Y-1912 использовали следующие молекулярные методы: 1) ПДРФ-анализ нескольких ядерных и митохондриальных генов и их секвенирование; 2) Саузерн-гибридизацию с зондами S. cerevisiae и S. kudriavzevii; 3) сравнительную геномную гибридизацию на микрочипах. С помощью cравнительного ПДРФ-анализа контрольных и гибридных штаммов по 13 ядерным генам нам удалось определить генотипы изучаемых штаммов (Таблица 1). Согласно секвенированию митохондриального гена ATP9 штаммы NRRL Y-53 и NRRL Y-1912 имеют мтДНК S. kudriavzevii, тогда как UCD 40-9 содержит мтДНК S. cerevisiae. Молекулярный анализ свидетельствует о более сложной геномной композиции гибридов NRRL Y-53 и NRRL Y-1912 по сравнению со штаммом UCD 40-9. Для сравнительной геномной гибридизации на микрочипах мы выбрали первые два штамма, имеющие различное происхождение: NRRL Y-53 выделен из пчелы, а NRRL Y-1912 – из вина.
Сравнительная геномная гибридизация штаммов NRRL Y-53, NRRL Y-1912 и их сегрегантов. Контрольный и анализируемый образцы, меченные различными флуоресцентными красителями, смешивали и конкурентно гибридизировали к микрочипам S. cerevisiae, на которые нанесены все полноразмерные ОРС штамма S288c. Полученные после гибридизации соотношения интенсивности флуоресцентных сигналов Cy3/Cy5 контрольного и гибридного штаммов нормализировали и визуализировали в программе RMA Express и CGH-Miner, соответственно. Гибридизационные соотношения для каждого гена картируются соответственно хромосомной локализации этого гена у контрольного штамма S288c. Участки повышенной копийности, по сравнению с S288c, на диаграмме обозначены красным цветом и расположены выше оси, а низкокопийные участки окрашены зеленым цветом и расположены ниже оси. В первом случае такой хромосомный район или отдельный ген называют амплифицированным, а во втором, учитывая гибридную природу изучаемых штаммов, корректнее обозначать такой участок как дивергировавший вместо делетированного. Высота каждого красного или зеленого столбика пропорциональна двоичному логарифму (log2) соотношения интенсивности сигналов Cy3/Cy5 для каждого гена. Резкие изменения гибридизационных сигналов, так называемые «скачки» (от английского «jumps») отражают присутствие химерных рекомбинантных хромосом, образовавшихся в результате нереципрокной рекомбинации гомеологичных хромосом.
С помощью программы CGH-Miner для каждого штамма и его сегрегантов были получены совмещенные кариоскопические диаграммы (от английского consensus plot), представленые на рисунке 8. Согласно CGH-профилям определены общие и специфические районы хромосом, которые подвергались изменениям у штаммов NRRL Y-53 и NRRL Y-1912.
Таблица 1. Генотипы межвидовых гибридов Saccharomyces и штаммов S. kudriavzevii
| Хромо cома | Ген | Гибрид S6U* | Гибрид CID1* | Гибриды S. cerevisiae S. kudriavzevii | S. kudriavzevii | ||||||
| UCD 40-9 | NRRL Y-53 | NRRL Y-1912 | W27 | 441 | 1802 | 1803 | ZP542 | ||||
| I | CYC3 | нд | нд | C1 | C1K1 | C1K1 | C1K2 | C1 | K1 | K2 | К1 |
| II | APM3 | нд | нд | C1 | C1K2 | C1K3 | C1K1 | C1K1 | K1 | K3 | K3 |
| III | KIN82 | нд | нд | C1 | C1K1 | C1K1 | C1K1 | C1K1 | K1 | K1 | К1 |
| III | MRC1 | нд | нд | C1 | C1K1 | C1K1 | C1K1 | C1K1 | K1 | K1 | К1 |
| V | MET6 | C1B1 | C1B1K2 | C1K1 | C1K1 | C1K1 | C2K2 | C2K2 | K1 | K1 | K2 |
| VI | ACTI | C1B1 | C1B1K1 | C1 | C1K1 | C1K1 | нд | нд | K1 | K2 | К1 |
| VI | GSY1 | C1B1 | C1B1K1 | C1K1 | C1K1 | C1K1 | C1K1 | C1K1 | K1 | K1 | К1 |
| X | CYR1 | C1B1 | C1B1K2 | C1K2 | C1K2 | C1K2 | C1K2 | C1K2 | K1 | K2 | K2 |
| X | PEX2 | нд | нд | C1K1 | C1K1 | C1K1 | C1K1 | C1K1 | K1 | K1 | К1 |
| XI | BAS1 | C1B1 | C1B1K2 | C1 | C1K2 | C1K2 | C1K2 | C1K2 | K1 | K2 | К2 |
| XI | CBT1 | нд | нд | C1K2 | K2 | C1K2 | C1K2 | C1K2 | K1 | K2 | К2 |
| XIII | CAT8 | C1B1 | C1B1K1 | C1 | C1K1 | C1K1 | C1K1 | C1K1 | K1 | K2 | К1 |
| XIV | MET2 | C1B1 | C1B1 | C1 | C1C2 | C1C2 | нд | нд | K1 | K1 | К1 |
Примечание: нд – нет данных.
* - Контрольные гибридные штаммы: аллотетраплоид S6U - S.cerevisiae S. bayanus; аллотриплоид CID1 - S.cerevisiae S. bayanus S. kudriavzevii.
Штамм NRRL Y-1912 обладает двумя разными аллелями 12 из 13 изученных генов, происходящих от S. cerevisiae и S. kudriavzevii. Причем, этот штамм имеет ранее не известную аллель гена APM3 S. kudriavzevii-типа: К3. Этот аллель обнаружен у контрольного штамма S. kudriavzevii ZP542, изолированного в Португалии. Выделенный из пчелы штамм NRRL Y-53 имеет по два разных аллеля 11 из 13 изученных генов. Ген CBT1 представлен только S. kudriavzevii-аллелем K2-типа. Совсем другую композицию генома имеет штамм UCD 40-9, у которого обнаружено по два разных аллеля генов MET6, GSY1, CYR1, PEX2 и CBT1 и по одному аллелю S. cerevisiae-типа остальных 8 проанализированных генов.
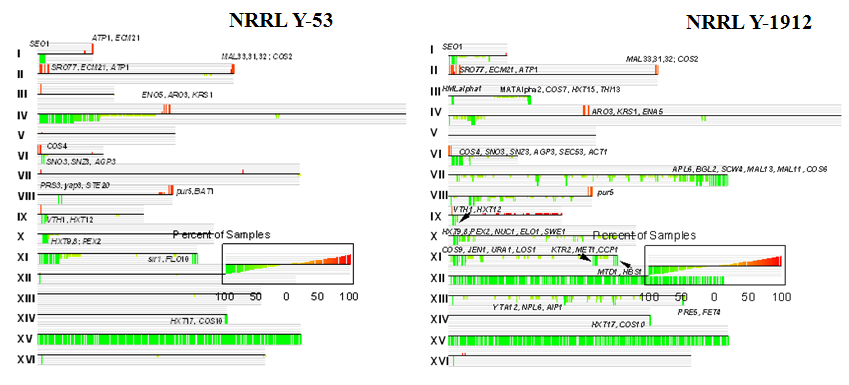
Рисунок 8. Консенсусные кариоскопические диаграммы штаммов NRRL Y-53 и NRRL Y-1912. Римскими цифрами обозначены номера хромосом. Функционально значимые гены указаны для небольших участков хромосом, число копий которых отличается от контроля. Диаграмма в прямоугольнике слева показывает количество образцов в процентах, характеризующихся той или иной копийностью гена (каждая серая линия соответствует 20%).
Большинство участков хромосом, как амплифицированных, так и низкокопийных располагаются в субтеломерных областях. Имеются небольшие участки хромосом, число копий которых повышено (хромосомы II, IV, VI, VIII) (рис. 8). Исключение составляет достаточно протяженный амплифицированный район хромосомы IX у штамма NRRL Y-1912 размером более чем 150 т.п.н. У штамма NRRL Y-53 хромосомы IV и XI характеризуются достаточно протяженными участками пониженной копийности. В случае хромосомы IV этот участок прослеживается вдоль всего левого плеча. Размер низкокопийного района хромосомы XI составляет 171 т.п.н. Такие протяженные участки с измененным числом копий представляют собой области, в которых гомеологичные хромосомы гибрида подверглись внутри- или межхромосомным рекомбинациям (Bond et al., 2004). В целом, CGH-профиль штамма NRRL Y-1912 более сложный, чем у NRRL Y-53. Большинство протяженных (от 80 до 250 т.п.н.) низкокопийных участков хромосом у этого штамма располагаются в субтеломерных областях (хромосомы III, VI, VII, и XI), а отдельные низкокопийные гены хромосом VII, VIII, X и XI, как правило, локализованы рядом с Ty-элементами (рис. 8).
На основании данных CGH-гибридизации и ПДРФ-анализа 13 ядерных генов была определена структура хромосом изученных штаммов (рис. 9). Четыре хромосомы у NRRL Y-53 и восемь у NRRL Y-1912 обнаружены в трех копиях. Причем, хромосома XV у обоих штаммов, а также хромосома XII штамма NRRL Y-1912 представлены только S. kudriavzevii-копиями. Саузерн-гибридизация с зондами Arg1 и ERR1, расположенными на левом и правом плечах хромосомы XV, подтвердила, что изучаемые штаммы обладают тремя копиями хромосомы XV только S. kudriavzevii-типа. Многие хромосомы являются химерными. Следует отметить, что обе копии хромосом I и VI –химерные. Измененные участки хромосом расположены, в основном, в субтеломерных областях или в тандеме с Ty-элементами.
Межвидовые гибриды S. cerevisiae S. kudriavzevii европейского происхождения обладают полным геномом S. cerevisiae и частичным S. kudriavzevii (Gonzales et al., 2006, 2008). Гибридные штаммы американского происхождения, наоборот, имеют более полный геном S. kudriavzevii и частичный S. cerevisiae. У обоих штаммов полностью отсутствует хромосома XV S. cerevisiae-типа, а у NRRL Y-1912 также хромосома XII S. cerevisiae-типа.
- Межвидовые гибриды S. cerevisiae S. bayanus var. uvarum
Для изучения геномной композиции изолированных с ягод черной смородины в Белоруссии штаммов ГСЧ-5, ГСЧ-8, ГСЧ-11 и пекарского штамма Л-80-4 сначала был проведен ПДРФ-анализ, секвенирование некоторых ядерных и митохондриальных генов. Согласно молекулярному анализу эти штаммы содержат более полный геном дрожжей S. cerevisiae, включая митохондриальную ДНК и частичный геном S. bayanus.
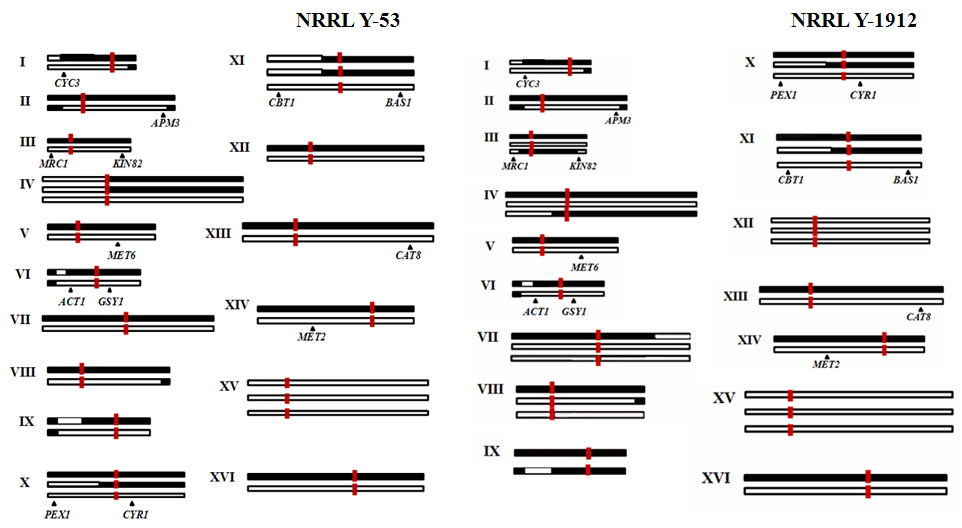
Рисунок 9. Структура хромосом штаммов NRRL Y-53 и NRRL Y-1912, составленная на основании данных CGH-гибридизации, ПДРФ-анализа 13 ядерных генов и Саузерн-гибридизации. Римскими цифрами обозначены номера хромосом. Черным цветом обозначены хромосомы S. cerevisiae-типа, белым – S. kudriavzevii-типа. Красным прямоугольником отмечены центромеры. Стрелками указана примерная хромосомная локализация генов, которые изучены с помощью ПДРФ-анализа.
Сравнительная геномная гибридизация. Для полногеномного анализа мы выбрали штаммы ГСЧ-11, Л-80 и экспериментально полученный в нашей лаборатории гибридный штамм Шампанская 11/12 (Наумова и др., 1993).
Геномная композиция штамма Л-80-4. Согласно полученной диаграмме геном гибрида Л-80-4 характеризуется небольшими амплифицированными и низкокопийными участками хромосом (рис. 10). Хромосомы I, II, X, XI, XV и XVI имеют участки с измененной копийностью генов исключительно в субтеломерных областях. Большинство низкокопийных генов расположены рядом с Ty-элементами. Отсутствие достаточно протяженных районов хромосом с измененным числом копий свидетельствует о том, что геном гибрида Л-80-4 не подвергся крупным хромосомным перестройкам. По-видимому, большинство хромосом этого штамма представлено только S. cerevisiae-копиями. Хромосомы IV, X, XII, XIII и XIV представлены двумя разными копиями: S. cerevisiae-типа и S. bayanus-типа. Одна из копий хромосомы XVI – S. cerevisiae-типа, а вторая – химерная. Обе копии хромосомы I – химерные.
Геномная композиция штамма ГСЧ-11. По результатам сравнительной геномной гибридизации четырех сегрегантов одной полной тетрады данного штамма получены кариоскопические диаграммы двух типов, отличающиеся только по амплифицированному участку хромосомы III (рис. 10). У штамма ГСЧ-11 только две хромосомы (XI и XIII) не имеют изменений в копийности генов. Остальные характеризуются наличием амплифицированых и низкокопийных участков генома. Данные области относительно небольшие, что говорит об отсутствии каких-либо крупных хромосомных перестроек. У 11 хромосом (I, II, V–X, XII, XV и XVI) большинство низкокопийных генов расположено в субтеломерных областях. Небольшие амплифицированные участки локализованы в теломерных районах хромосом I и VIII. У двух сегрегантов одной тетрады хромосома III характеризуется наличием одного небольшого амплифицированного района, содержащего гены LEU2 и NFS1. Два других сегреганта этой же тетрады имеют дополнительный достаточно протяженный (около 100 т.п.н.) участок, копийность генов которого увеличена по сравнению с контролем. Данная область генома содержит многие гены, отвечающие за метаболизм ДНК, РНК и липидов, биогенез рибосом, транскрипцию, клеточный цикл, реакцию на стрессовые факторы. Очевидно, в изучаемой тетраде наблюдается расщепление 2:2 по генам, обуславливающим вышеперечисленные функции. Принимая во внимание 50%-ную выживаемость аскоспор, можно заключить, что штамм ГСЧ-11 содержит полный геном S. cerevisiae и только отдельные последовательности S. bayanus, преимущественно в субтеломерных районах хромосом.
Геномная композиция экспериментального гибрида Шампанская 11/12. У этого штамма только три хромосомы (II, III и XI) не имеют изменений в
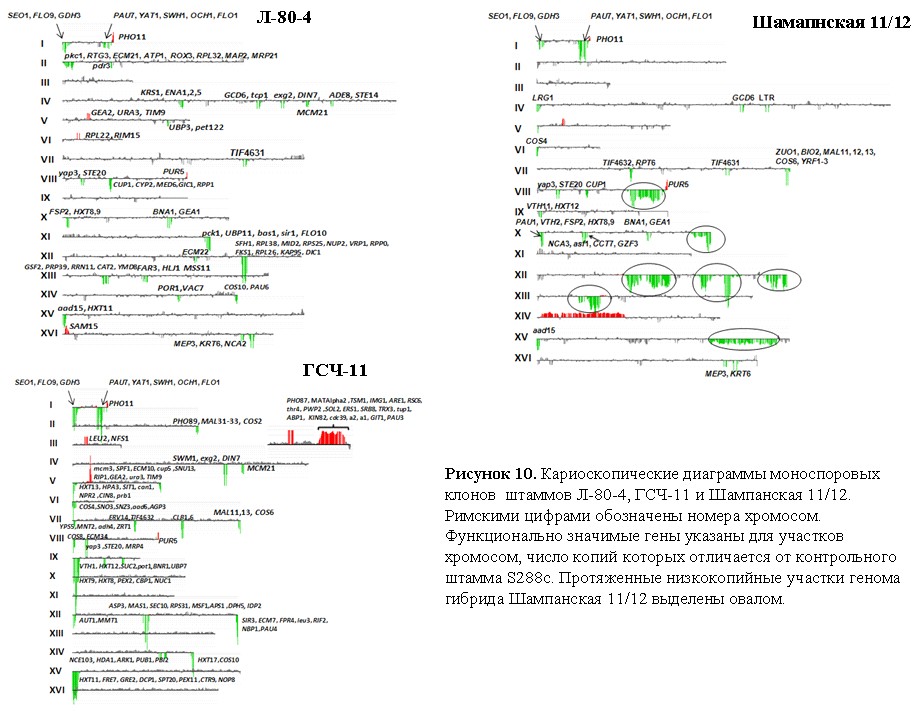
копийности генов. Остальные характеризуются наличием амплифицированных и низкокопийных участков. Данные области в хромосомах I, IV, VI, VII, IX и XVI небольшие и ограничиваются максимум 10 генами (рис. 10). Обращает на себя внимание амплифицированный участок хромосомы XIV, размером около 400 т.п.н., затрагивающий 2/3 ее левого плеча. По-видимому, эта хромосома присутствует в двух копиях: S. cerevisiae-типа и химерная. На это указывает и отсутствие MET2 гена S. bayanus-типа, локализованного в левом плече XIV хромосомы. Такой же протяженной, но низкокопийной областью характеризуется правое плечо хромосомы XV. Согласно Саузерн-гибридизации хромосома XV штамма Шампанская 11/12 представлена двумя копиями только S. bayanus-типа, одна из которых обладает дополнительной нереципрокной транслокацией. Три участка пониженной копийности обнаружены в правом плече хромосомы XII. На основании проведенного анализа можно предположить, что вся область правого плеча хромосомы XII, включающая эти три района, является низкокопийной.
Сравнительная геномная гибридизация на микрочипе CombiMatrix. Результаты CGH-гибридизации геномной ДНК сегрегантов всех трех штаммов на микрочип, содержащий геномы дрожжей S. cerevisiae и S. bayanus были проанализировали с помощью метода главных компонент (рис. 11).
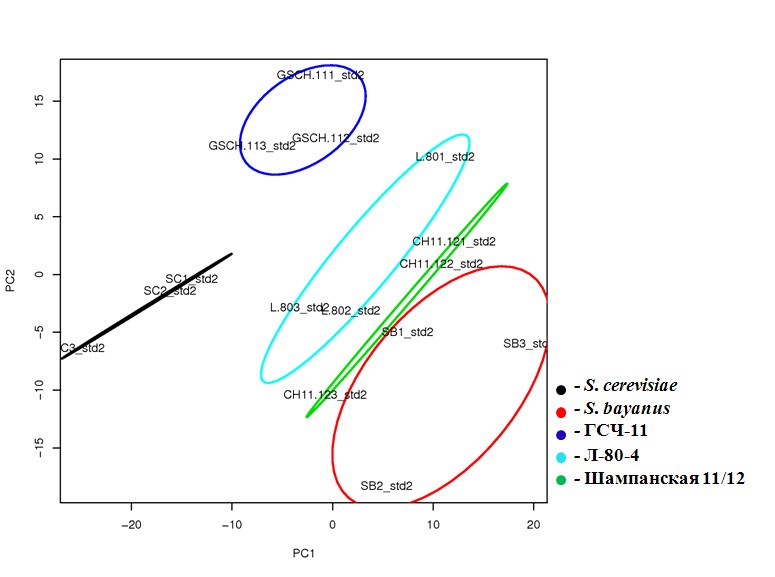
Согласно полученным данным в геноме штамма Шампанская 11/12 в большей степени представлена ДНК S. bayanus, тогда как геном ГСЧ-11 содержит в основном ДНК S. cerevisiae. Пекарский штамм Л-80-4 содержит геномы обоих видов.
Таким образом, проведенный молекулярный анализ выявил различную генетическую конституцию изученных штаммов. Штамм ГСЧ-11 содержит полный геном S. cerevisiae, включая мтДНК, и только отдельные последовательности S. bayanus, преимущественно в субтеломерных районах хромосом. В этом случае, по-видимому, более правильно говорить о проникновении путем интрогрессии отдельных генов S. bayanus в геном S. cerevisiae. Известное, главным образом у растений, явление интрогрессии обнаружено также у дрожжей Saccharomyces. Молекулярные данные указывают на интрогрессию субтеломерных последовательностей S. cerevisiae в геном некоторых штаммов S. bayanus и S. paradoxus, а также протяженных участков ДНК S. paradoxus в геномы отдельных штаммов S. cerevisiae (Naumova et al., 2005; Liti et al., 2006; Muller, McCusker, 2009).
Пекарский штамм Л-80-4, по-видимому, обладает полным набором хромосом S. cerevisiae и экстра-хромосомами S. bayanus. Так, хромосомы IV, X, XII, XIII и XIV представлены двумя разными копиями: S. cerevisiae-типа и S. bayanus-типа. Одна из копий хромосомы XVI – химерная, а хромосома I данного штамма представлена двумя химерными копиями. Экспериментально полученный гибрид Шампанская 11/12, наоборот, содержит более полный геном S. bayanus и частичный геном S. cerevisiae. По кариотипу этот штамм напоминает гибридные дрожжи S. pastorianus, в геноме у которых также преобладают хромосомы S. bayanus-типа (Dunn, Sherlock, 2008). Процесс производства шампанского, также как и пивоварение низового типа, происходит при пониженных температурах (7–12°С). Таким образом, создаются селективные условия для сохранения у гибридных штаммов более полного генома криофильных дрожжей S. bayanus.
Заключение
Проведенный в данной работе молекулярный анализ, включая ДНК-ДНК реассоциацию, установил близкое генетическое родство дрожжей S. paradoxus и S. cariocanus. Несмотря на 98%-ную ДНК-ДНК реассоциацию этих видов и сходство по многим молекулярным маркерам штаммов S. cariocanus и североамериканских изолятов S. paradoxus, образуемые ими гибриды полностью стерильны (Naumov et al., 2000). С генетической точки зрения S. cariocanus является самостоятельным биологическим видом. Дрожжи S. cerevisiae дивергировали от предка S. paradoxus/S. cariocanus около 5–10 миллионов лет назад (Kellis et al., 2003). Последние два вида разошлись значительно позднее, и, при этом, могло иметь место симпатрическое видообразование. На растениях показано, что при симпатрическом видообразовании отбор обычно направлен на расхождение видов и их изоляцию за счет формирования значительных различий по небольшому числу генетических локусов (Savolainen et al., 2006). В отличие от остальных видов Saccharomyces, дрожжи S. cariocanus характеризуются специфичным молекулярным кариотипом с наибольшим числом реципрокных транслокаций, затрагивающих 8 из 16 хромосом (IX/XV, II/XVI, XI/IV и XII/XIV), и обладают уникальной нуклеотидной заменой в 191 позиции консервативного гена 18S рРНК. В то же время по многим локусам S. cariocanus не отличается от штаммов S. paradoxus североамериканского происхождения. В свою очередь штаммы S. paradoxus различного географического происхождения имеют идентичные последовательности гена 18S рРНК и сходные молекулярные кариотипы. Обнаруженные нами различия между европейской, дальневосточной и североамериканской популяциями S. paradoxus затрагивают более вариабельные районы рРНК (домен D1/D2 и ITS1 участок), а также митохондриальный ген ATP9. Дрожжи S. paradoxus из трех географически отдаленных регионов мира частично генетически изолированы и, по-видимому, находятся на ранних стадиях аллопатрического видообразования (Naumov et al., 1997, 2000). При аллопатрическом видообразовании различия накапливаются равномерно по всему геному, так как «специальный» отбор на расхождение отсутствует (Savolainen et al., 2006). Гибридологический анализ штаммов S. paradoxus различного происхождения подтвердил их частичную репродуктивную изоляцию и выявил достаточно условную роль крупных хромосомных перестроек в репродуктивной изоляции биологических видов Saccharomyces.
Молекулярный анализ штаммов S. bayanus, S. cerevisiae и S. paradoxus различного происхождения свидетельствует о значительном внутривидовом полиморфизме этих дрожжей. У дрожжей S. cerevisiae и S. bayanus обнаружена корреляция между микросателлитными маркерами штаммов и их происхождением (местом и источником выделения). Дрожжи S. paradoxus характеризуются менее полиморфными (GTG)5-профилями.
Впервые изучено распространение и особенности плазмидных днРНК у видов рода Saccharomyces. Всего идентифицировано 11 типов М-днРНК, включая фракции М5–М7 и М8–М11, специфичные, соответственно для S. paradoxus и S. bayanus. Плазмидные днРНК не обнаружены только у S. cariocanus. Фракция М1 встречается у 4 видов Saccharomyces: S. bayanus, S. cerevisiae, S. paradoxus и S. kudriavzevii, а фракция М2 не обнаружена только у S. cariocanus и S. kudriavzevii. Известно, что у дрожжей S. cerevisiae различные по размеру фракции М1 и М2 детерминируют образование разных токсинов и разную устойчивость к ним (Wickner, 1996). Все обнаруженные плазмидные М-днРНК не функциональны и, возможно, являются мутантными формами киллерных плазмид. На примере дрожжей S. cerevisiae хорошо известно, что под влиянием различных физических и химических факторов (повышенная температура, УФ облучение, акридиновые красители и циклогексимид) может происходить элиминация киллерных плазмид (Наумова, Наумов, 1974). Очевидно, что и в природе у дрожжей Saccharomyces происходят мутации в плазмидных днРНК или их полная элиминация под воздействием различных факторов окружающей среды.
Последним достижением сравнительной геномики дрожжей Saccharomyces является обнаружение среди культурных штаммов естественных межвидовых гибридов различного типа: S. cerevisiae S. bayanus, S. cerevisiae S. kudriavzevii и S. cerevisiae S. bayanus S. kudriavzevii. Формирование межвидовых гибридов является одним из механизмов адаптации дрожжей в промышленных ферментациях, так как гибриды лучше приспособлены к изменяющимся условиям окружающей среды, чем родительские штаммы. Проведенный нами молекулярный анализ штаммов Saccharomyces различного происхождения позволил обнаружить межвидовые гибриды S. cerevisiae S. kudriavzevii американского происхождения. Согласно сравнительной геномной гибридизации на микрочипах обнаруженные нами гибриды имеют другую композицию генома, чем межвидовые гибриды этого типа европейского происхождения. Для европейских гибридов характерно сохранение полного генома дрожжей S. cerevisiae и частичного S. kudriavzevii (Gonzales et al., 2006, 2008). Изученные нами гибридные штаммы NRRL Y-53 и NRRL Y-1912, наоборот, обладают более полным геномом S. kudriavzevii и частичным S. cerevisiae. Несмотря на различное происхождение этих штаммов, у них обнаружены общие участки амплификации и пониженной копийности. Следует отметить, что гибридный штамм NRRL Y-53 выделен из пчелы. Известно, что насекомые, особенно Drosophila, могут служить вектором распространения дрожжей (Gilbert, 1980; Begon, 1986). До этого из дрозофилы были выделены дрожжи S. cerevisiae, S. bayanus, S. paradoxus и S. cariocanus, однако, межвидовой гибрид обнаружен впервые. В пищеварительном тракте насекомых происходит переваривание оболочек асков и высвобождение спор дрожжей, что может способствовать гибридизации спор и образованию как внутри- так и межвидовых гибридов Saccharomyces (Reuter et al., 2007).
С помощью сравнительной геномной гибридизации обнаружена интрогрессия субтеломерных последовательностей S. bayanus в геном штаммов S. cerevisiae, изолированных с ягод черной смородины в Белоруссии. В случае интрогрессии, при межвидовой гибридизации образуются гибриды F1, способные к возвратным скрещиваниям с одним из родителей. По-видимому, предок штаммов ГСЧ-5, ГСЧ-8 и ГСЧ-11 возник путем редких выживших аскоспор гибрида S. cerevisiae S. bayanus и, возможно, имел более полный геном S. cerevisiae. Затем он подвергся возвратным скрещиваниям с S. cerevisiae, сохранив в своем геноме только отдельные последовательности S. bayanus.
Полученные результаты показали, что с помощью рестриктазного анализа некодирующих участков рДНК (ITS1 и IGS2) и молекулярного кариотипирования можно не только дифференцировать дрожжи S. cerevisiae, S. bayanus и S. kudriavzevii, но и обнаруживать их межвидовые гибриды. В свою очередь с помощью сравнительной геномной гибридизации можно определять соотношение родительских геномов у гибридных штаммов и выявлять интрогрессивные последовательности ДНК в геномах биологических видов Saccharomyces.
Выводы
- Впервые достоверно определены значения ДНК-ДНК-реассоциации дрожжей S. cariocanus, S. kudriavzevii, S. mikatae между собой и с типовыми культурами S. cerevisiae, S. bayanus и S. paradoxus.
- Подтверждено близкое генетическое родство дрожжей S. paradoxus и S. cariocanus. Результаты молекулярного анализа хорошо согласуются с ранее полученными генетическими данными (Naumov et al., 2000) и указывают на видовой статус дрожжей S. cariocanus.
- Гибридологический анализ штаммов S. paradoxus различного географического происхождения, не имеющих хромосомных транслокаций, выявил достаточно условную роль крупных хромосомных перестроек в постзиготической изоляции биологических видов Saccharomyces. Подтвержден сложный состав вида S. paradoxus, включающего частично изолированные географические популяции.
- Выявлен значительный внутривидовой полиморфизм дрожжей S. cerevisiae, S. bayanus и S. paradoxus. Обнаружена корреляция между (GTG)5-профилями и происхождением штаммов.
- Впервые проведен скрининг вирусных днРНК и изучен их полиморфизм у дрожжей биологических видов S. bayanus, S. cariocanus, S. kudriavzevii, S. mikatae и S. paradoxus. Всего идентифицировано 11 различных типов М-днРНК. Все описанные плазмидные М-днРНК не функциональны и, возможно, являются мутантными формами киллерных плазмид.
- Впервые обнаружены три межвидовых гибрида S. cerevisiae S. kudriavzevii американского происхождения и изучена композиция их геномов с помощью сравнительной геномной гибридизации на микрочипах разного типа.
- Установлено, что у гибридных геномов произошли значительные хромосомные перестройки: дупликации отдельных генов и участков хромосом, образование химерных хромосом за счет нереципрокной рекомбинации гомеологичных хромосом.
- Значительные изменения у гибридных штаммов обнаружены в теломерных участках хромосом, наиболее пластичной части генома, обеспечивающей приспособляемость дрожжей к различным условиям среды.
Список работ, опубликованных по теме диссертации
- Наумов Г.И., Иванникова (Михайлова) Ю.В., Наумова Е.С. 2005. Молекулярный полиморфизм вирусных dsРНК дрожжей Saccharomyces paradoxus // Молекулярная генетика, микробиология и вирусология. №1. С. 38 – 40.
- Иванникова (Михайлова) Ю.В., Наумова Е.С., Наумов Г.И. 2006. Обнаружение вирусных dsРНК у дрожжей Saccharomyces bayanus // Доклады Академии Наук. Т. 406. №5. С. 709 – 711.
- Иванникова (Михайлова) Ю.В., Кондратьева В.И., Наумов Г.И. 2007. Гибридизационный анализ географических популяций Saccharomyces paradoxus // Микология и фитопатология. Т. 41. Вып. 2. С. 130 – 133.
- Ivannikova (Mikhailova) Yu.V., Naumova E.S., Naumov G.I. 2007. Viral dsRNA in the wine yeast Saccharomyces bayanus var. uvarum // Research in Microbiology. V. 168. P. 638 – 643.
- Иванникова (Михайлова) Ю.В., Наумова Е.С., Мартыненко Н.Н., Наумов Г.И. 2007. Характеристика генома дрожжей Saccharomyces плодово-ягодного виноделия // Микробиология. Т. 76. №2. С. 225 – 235.
- Глушакова А.М., Иванникова (Михайлова) Ю.В., Наумова Е.С., Чернов И.Ю., Наумов Г.И. 2007. Массовое выделение и идентификация дрожжей Saccharomyces paradoxus из филосферы растений // Микробиология. Т. 76. №2. С. 236 – 242.
- Наумов Г.И., Иванникова (Михайлова) Ю.В., Чернов И.Ю., Наумова Е.С. 2009. Природный полиморфизм плазмидных двунитевых РНК дрожжей Saccharomyces // Микробиология. Т. 78. №1. С. 253 – 257.
- Михайлова Ю.В., Кастелло С., Наумов Г.И., Наумова Е.С. 2009. Алло- и симпатрические виды-двойники Saccharomyces cerevisiae: ДНК-ДНК гомология. // Экологическая генетика. Т. 7. Вып. 4. (в печати).
- Наумова Е.С., Иванникова (Михайлова) Ю.В., Наумов Г.И. Материалы 2-го Международного Конгресса «Биотехнология – состояние и перспективы развития». 10 – 14 ноября 2003. Москва. Россия. С. 276.
- Naumova E.S., Ivannikova (Mikhailova) Yu.V., Martynenko N.N., Naumov G.I. Comparative analysis of genomes of cultured Saccharomyces yeasts // Abstracts of the XXIInd Int. Conf. on Yeast Genetics and Molecular Biology, 7-12 August 2005, Bratislava. Yeast, 22 (S1): S33.
- Ivannikova (Mikhailova) Yu. V., Serpova E.V. Comparative genomics of species Saccharomyces // Abstracts of International Specialized Symposium on Yeasts (ISSY 25) “Systems Biology of Yeasts – from models to Applications.” June 18 – 21. 2006. Hanasaari. Espoo. Finland. P. 83.
- Naumova E.S., Ivannikova (Mikhailova) Yu.V., Hayes A., Oliver S.G., Naumov G.I. Comparative genomics of natural interspecific Saccharomyces hybrids // Abstracts of the 24th International Conference on Yeast Genetics and Molecular Biology, Manchester, UK, 19-24 July 2009. Yeast, 26 (S) 1. P. 80.

