Разработка молекулярно-генетических подходов для оптимизации промышленно-важных характеристик фитазы citrobacter freundii
На правах рукописи
Гордеева Татьяна Леонидовна
РАЗРАБОТКА МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПОДХОДОВ ДЛЯ ОПТИМИЗАЦИИ ПРОМЫШЛЕННО-ВАЖНЫХ ХАРАКТЕРИСТИК ФИТАЗЫ CITROBACTER FREUNDII
03.02.07 – Генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва
2010
Работа выполнена в лаборатории ВКПМ Федерального государственного унитарного предприятия Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов (ФГУП «ГосНИИ генетика»)
Научный руководитель:
доктор биологических наук, профессор С.П. Синеокий
ФГУП «ГосНИИ генетика»
Официальные оппоненты:
доктор биологических наук, профессор Ю.Д. Цыганков
ФГУП «ГосНИИ генетика»
кандидат химических наук, доцент Л.Р. Птицын
ЗАО «Научно-исследовательский институт
Аджиномото-Генетика»
Ведущая организация:
Институт Молекулярной Генетики РАН
Защита состоится «__1__»_февраля___2011 года в 1400 часов
на заседании Диссертационного совета Д 217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов»
по адресу: 117545, г. Москва, 1-й Дорожный проезд, д.1
С диссертацией можно ознакомиться в библиотеке
ФГУП «ГосНИИгенетика»
Автореферат разослан «_28_»_декабря__2010 года
Ученый секретарь диссертационного совета
кандидат химических наук Т.Л. Воюшина
ВВЕДЕНИЕ
Актуальность темы. В последнее время для улучшения питательных свойств растительных кормов широко применяются ферменты – фитазы микробного происхождения, катализирующие гидролиз фитатов с отщеплением неорганического фосфата.
Фитаты (мио-инозитол гексакисфосфаты), в виде которых растения запасают фосфор, практически не усваиваются организмом животных с однокамерным желудком и домашней птицей. Значительная доля неусвоенного фосфора выводится с экскрементами из организма и загрязняет окружающую среду. Кроме того, фитаты являются хелатирующими агентами и способны образовывать комплексы с дивалентными катионами, а также с белками. Фитазы – ценные пищевые добавки. Введение их в растительные корма повышает усвоение фосфора, кальция, микроэлементов, белков и аминокислот желудочно-кишечным трактом животных.
Дефицит и высокая стоимость рыбной муки (в качестве источника фосфора) привели к тому, что всё чаще при выращивании животных и птицы стали использовать рационы растительного типа (зерно, семена масличных культур, бобовые). Таким образом, возникает повышенная потребность кормопроизводства в пищевых добавках, содержащих фитазы.
Для практического использования фитазы должны обладать следующими характеристиками:
- быть устойчивыми к кратковременному (5-10 мин.) действию высоких температур (70С – 80С) в ходе гранулирования комбикормов;
- обладать высокой удельной активностью;
- способностью работать в физиологических условиях желудочно-кишечного тракта (температурный оптимум около 42С, рабочий профиль в интервале рН 3-5);
- способностью выдерживать действие среды желудка животных (стабильность при низких значениях pH 1,5-2,5 и устойчивость к протеолитическим ферментам).
Все известные фитазы имеют разные характеристики, причем у каждого фермента есть свои преимущества и недостатки. Недостатком бактериальных фитаз, принадлежащих к семейству кислых гистидиновых фосфатаз, является их низкая термостабильность. Однако, они весьма перспективны из-за высокой удельной активности, устойчивости к протеолитическим ферментам, способности работать в кислых условиях и выдерживать низкие значения рН.
Известны различные молекулярно-генетические подходы, позволяющие значительно повысить термостабильность белков. Однако они не всегда могут быть применимы к исследуемым ферментам, а так же имеют ряд недостатков. Так, увеличение термостабильности часто влечёт за собой смещение температурного оптимума фермента и значительное уменьшение его удельной активности. Таким образом, разработка молекулярно-генетических подходов для получения мутантных генов, кодирующих фитазы с оптимизированными промышленными характеристиками, является актуальной задачей. Кроме того, на Российском рынке препараты фитаз представлены только зарубежными производителями, поэтому получение отечественных конкурентно-способных ферментов также актуально.
Цели и задачи работы. Целью данной работы явилась разработка молекулярно-генетического подхода к конструированию мутантного гена, кодирующего фитазу с повышенной термостабильностью, высокой удельной активностью и неизменённым температурным оптимумом, а так же его эффективная экспрессия в системе, пригодной для промышленности.
В связи с этим ставились следующие задачи:
- Оценить эффективность различных молекулярно-генетических подходов с целью получения мутантных генов бактериальных фитаз с повышенной термостабильностью.
- Разработать наиболее эффективный молекулярно-генетический подход и на его основе сконструировать, клонировать и экспрессировать мутантный ген фитазы с оптимизированными свойствами.
- Охарактеризовать свойства полученного мутантного варианта фитазы с оптимизированными свойствами.
- Показать возможность эффективной экспрессии сконструированного мутантного гена и оценить потенциальную возможность применения полученной на его основе фитазы в кормопроизводстве.
Научная новизна. Методами сайт-направленного мутагенеза и error-prone ПЦР были получены, различные мутантные гены, кодирующие фитазы с повышенной термостабильностью. Разработана система для клонирования, экспрессии и отбора мутантных генов. Показано, что некоторые аминокислотные замены в консервативных областях фитазы AppA E. coli, приводящие к увеличению её термостабильности, аналогичным образом влияют на термостабильность фитаз Citrobacter freundii и Obesumbacterium proteus, несмотря на низкую аминокислотную гомологию. Так, впервые были получены мутантные фитазы остаточные фитазные активности которых (после 10 минутного прогрева при 80°С) составили 45% и 60%, соответственно. Таким образом, термостабильность мутантных фитаз при указанных условиях возросла в 15 и 10 раз, соответственно.
Для получения мутантных генов фитаз с повышенной термостабильностью был разработан полурациональный подход, основанный на сфокусированном мутагенезе. В нём впервые в качестве сайтов-мишеней для проведения случайного мутагенеза были предложены области (аминокислотной последовательности) с высокой консервативностью. Так, в результате случайного мутагенеза областей гена, соответствующих аминокислотным участкам K29-G74 и Q104-Q131, методом error-prone ПЦР был получен мутантный ген, кодирующий оптимизированную по свойствам фитазу. После 10 минутного прогрева при 70°С и 80°С остаточная фитазная активность которой составила 50% и 35%, соответственно. Таким образом, термостабильность при указанных условиях возросла в 5 и 11 раз, соответственно. Удельная активность уменьшилась незначительно и составила 2215 ед/мг белка. Температурный оптимум полученного фермента не сместился, а эффективность работы при 40°С увеличилась на 20%.
Для увеличения экспрессии гена оптимизированной фитазы в дрожжах P. pastoris была разработана синтетическая нуклеотидная последовательность (депонирована в ГенБанк) с учётом правила оптимальности кодонов, а также предложен усовершенствованный ПЦР-метод для её синтеза. Ген фитазы с оптимизированной нуклеотидной последовательностью был синтезирован, трансформирован в клетки P. pastoris и отобран клон с активностью 650 ед/мл (при культивировании в лабораторных условиях), что показывает 50%-ое увеличение продуктивности полученного штамма.
Практическая значимость. Разработанный молекулярно-генетический подход, основанный на сфокусированном случайном мутагенезе высоко-консервативных областей, может быть полезен для получения новых мутантных генов фитаз с повышенной термостабильностью.
Предложенный ПЦР-метод для синтеза ДНК последовательностей из олигонуклеотидов является простым и удобным инструментарием для генетической инженерии.
В ходе работы были обнаружены высокие показатели кормовых качеств фитазы PhyA-Cf, а также схожесть её свойств с мутантной термостабильной фитазой PhyA-CfМ3, что даёт возможность перспективно использовать последнюю в процессе приготовления комбикормов при повышенных температурах.
Для продукции промышленных ферментов необходимо создание высокоэффективных продуцентов. В данной работе показана возможность эффективной экспрессии полученного мутантного гена термостабильной фитазы PhyA-CfМ3 в широко используемых в промышленности дрожжах P. pastoris.
Структура работы. Диссертация изложена на 117 листах машинописного текста, включая 26 рисунков и 9 таблиц. Работа состоит из введения, обзора литературы, описания материалов и методов, изложения и обсуждения результатов, выводов и списка используемой литературы. Список литературы включает 150 работ отечественных и зарубежных авторов.
Апробация работы. Материалы исследования по теме диссертации опубликованы в двух статьях, двух заявках на патент. Диссертационная работа была доложена на конференции «Микробные биокатализаторы и их роль в нано - и биотехнологиях» и семинаре секции «Генетика микроорганизмов» Учёного Совета ФГУП «ГосНИИгенетика» 24 ноября 2010 года.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы, плазмиды, среды и условия культивирования.
Использованные в работе штаммы и плазмиды, а также их генетические характеристики представлены в Таблице 1.
Таблица 1. Использованные в работе штаммы и плазмиды
| Штаммы | Генетическая характеристика | Происхождение |
| E.coli K12: | Генотип | |
| XL1 Blue | supE44 hsdR17 recA1 endA1 gyrA46 thi metB1 trpR55 relA1 lac, F traD36 proAB+ lacIq lacZM15 Tn10 | ВКПМ |
| С600 | supE44 hsdR thi1 thr1 leuB6 lacY1 tonA21 | ВКПМ |
| BL21 (DE3) | ompT hsdSB (rBmB) dcm gal | ВКПМ |
| BLP (варианты) | Как BL21 (DE3), но содержит pGEM-Сmut (варианты) | Данная работа |
| Pichia pastoris: | ||
| GS115 | his4- | ВКПМ |
| GS115(варианты) | phyA-С,Cmod/ или phyA-O/ или phyA-СM(1-3, 3mod)/ или рhyA-OМ1/ или phyA-С№2/ или phyA-С(1-6), HIS4+ | Данная работа |
| Плазмидные вектора: | Характеристика | |
| pGEM-3Zf(+) | lacZ, bla | ВКПМ |
| pP10 | HIS4, bla, (интегративный шаттл вектор) | Л.Н. Борщевская |
| Плазмиды: | ||
| pGEM-С/Сmut (варианты) | pGEM-3Zf(+)/ phyA-С/Сmut(варианты), присутствует SD последовательность | Данная работа |
| pP10-C,Cmod (вар.) | pP10/ phyA-С, Cmod (варианты) | » |
| pP10-O | pP10/ phyA-O | » |
| рР10-СМ1,2,3,3mod (варианты) | pP10/рhyA-СМ1, 2, 3, 3mod (варианты) | » |
| рР10-OМ1 | pP10/рhyA-OМ1 | » |
| рР10-С№2 | pP10/ phyA-С№2 | » |
| pP10-C1,2,3,4,5,6 (варианты) | pP10/ phyA-С1, 2,3, 4, 5,6 (варианты) | » |
| pUC-OP1m | pUC19/ phyA-O, bla | Н.В. Зинин |
| pUC-CF1 | pUC19/ phyA-C, bla | Н.В. Зинин |
Для выращивания культуры бактерий E. coli использовали среду LB, для культуры дрожжей P. pastoris – среды YPD, М9 [Маниатис Т., 1984] и YNB (DIFCO). Выращивание бактерий E. coli проводили при 37°С, дрожжей P. pastoris – при 28°С.
Манипуляции с ДНК.
Выделение плазмидной ДНК, клонирование, трансформацию и анализ рекомбинантных плазмид проводили стандартными методами, изложенными в [Sambrook J. et al., 1989].
Errore-prone ПЦР, конструирование библиотеки мутантных генов.
В качестве матрицы для амплификации генов методом error-prone ПЦР использовали плазмиду pGEM-С. Состав реакционной смеси указан в [Kim M. et al., 2008]. Прямой праймер содержал в своём составе SD последовательность. Полученные ДНК последовательности лигировали с ДНК вектора pGEM-3Zf(+) по сайтам EcoRI и HindIII. Полученными рекомбинантными плазмидами pGEM-Сmut трансформировали штамм E. coli BL21 (DE3). Трансформанты растили на среде LB с добавлением ампициллина в концентрации 50 мкг/мл. Экспрессию фитаз активировали добавлением в LB среду IPTG.
Отбор фитаз с повышенной термостабильностью.
Трансформанты выращивали в 96-луночных планшетах в течение суток, из каждой лунки отбирали аликвоты и переносили в другие 96-луночные планшеты, подходящие для прогрева в приборе Mastercycler gradient 5331 (Eppendorf). Прогретые планшеты охлаждали при 4°С в течение 30 мин. Далее реплики из прогретых и соответствующих непрогретых планшетов переносили на квадратные чашки, содержащие твёрдую агаризованную среду с фитатом кальция. Термостабильность фитаз оценивали, исходя из сравнения интенсивности и размера зоны просветления вокруг мест нанесения прогретой и непрогретой культуральной жидкости, содержащей фитазы.
Конструирование плазмид для экспрессии генов фитаз в дрожжах P. pastoris. ДНК последовательности генов фитаз phyA-С/ или phyA-O (или их мутантных вариантов) амплифицировали в ходе ПЦР, лигировали с ДНК интегративного вектора рР10 по сайтам EcoRI и NotI. Полученные рекомбинантные плазмиды pP10-C/ или pP10-O (или их варианты) расщепляли эндонуклеазой рестрикции BglII и трансформировали в клетки P. pastoris согласно протоколу Kit #28662 (Invitrogen). Трансформанты отбирали по способности расти на минимальной среде М9 без источника гистидина.
Сайт-направленный и сайт-направленный насыщающий мутагенез.
Мутации в генах, кодирующих фитазы бактерий C. freundii и O. proteus, получали методом сайт-направленного [Angelaccio S. et. al., 2002] или сайт-направленного насыщающего мутагенеза [David E. et. al., 1987] с помощью ПЦР, используя специфические праймеры. Условия проведения ПЦР подбирали, исходя из длины амплифицируемых фрагментов, длины и состава используемых праймеров. Выделение и очистку ПЦР продуктов проводили с использованием набора DNA Extraction Kit #KO513 (Fermentas). Присутствие соответствующих мутаций проверяли секвенированием по методу Сэнгера [Sanger F. et al., 1977].
Метод синтеза гена phyA-Cfmod из олигонуклеотидов.
Ген phyA-Cfmod синтезировали из олигонуклеотидов как описано в [Gordeeva T. et. al., 2010].
Мутагенез областей K29-G74 и Q104-Q131, конструирование библиотеки мутантных генов.
Мутагенез областей гена, соответствующих участкам аминокислотной последовательности K29-G74 и Q104-Q131, проводили методом error-prone ПЦР. Оставшиеся два участка гена амплифицировали стандартным методом ПЦР. В качестве матрицы использовали плазмиду рР10-С3. Целые ДНК последовательности генов синтезировали из получившихся частично комплементарных фрагментов методом ПЦР, лигировали с ДНК вектора рР10 по сайтам EcoRI и NotI и трансформировали в клетки P. pastoris.
Определение фитазной активности.
Фитазную активность определяли по накоплению в реакционной смеси свободного фосфат-иона, детектируемого методом Фиске-Субарроу [Fiske et al.,1925]. За единицу фитазной активности принимали количество фермента, способного высвободить 1 моль неорганического фосфата из фитата натрия в минуту при 37°С и рН 4.
Определение свойств фитаз.
Для определения удельной активности фитазы PhyA-Cf и PhyA-CfМ3 очищали с помощью гель-хроматографии на колонках Superdex 75-HR и Superdex 200-HR, соответственно. Количество белка определяли по методу Бредфорда согласно инструкции к Bradford Reagent B 6916 (Sigma). Молекулярную массу белков определяли методом SDS-PAGE электрофореза как описано в [Sambrook J. et al., 1989]. Для определения термостабильности культуральную жидкость, содержащую фитазу, прогревали при различных температурах в течение 10 мин. и затем охлаждали 30 минут. Далее фитазную активность измеряли при 37°С. Дегликозилирование фитаз проводили при помощи Эндогликозидазы Н и согласно протоколу к Endo H A 0810 (Sigma). Измерение кинетических характеристик проводили как описано в [Юркевич В., 1979].
Анализ аминокислотных последовательностей и мутаций.
Поиск гомологичных последовательностей проведён с помощью программы BLAST [http://www.ncbi.nlm.nih.gov/BLAST/]. Множественное выравнивание белковых последовательностей было проведено с помощью ClustalW [http://www.ebi.ac.uk/clustalw/]. Последовательности вторичных структур белков определены при помощи программы SOPHMA [http://npsa-pbil.ibcp.fr]. Пространственное положение аминокислот, подвергшихся замене, определяли с помощью программы RasMol 2.7.5 [http://rasmol.org/], взаимодействие аминокислот – с помощью программы Swiss-PdbViewer [http://spdbv.vital-it.ch/]. Аминокислотные замены предсказывались с помощью программы I-Mutant 2.0. [http://gpcr2.biocomp.unibo.it/cgi/predictors/I-Mutant2.0/I-Mutant2.0.cgi].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Применение стратегии случайного мутагенеза целой ДНК последовательности для получения генов фитаз C. freundii с повышенной термостабильностью
Основа данной стратегии заключается в проведении повторных циклов случайного мутагенеза всей последовательности определенного гена с отбором наилучших мутантов для их участия в дальнейших раундах мутагенеза.
1.1 Получение генов, кодирующих фитазы C. freundii с повышенной термостабильностью, методом error-prone ПЦР
Случайные мутации вводились в ген фитазы phyA-С в ходе полимеразной цепной реакции, благодаря уменьшению точности в работе ДНК-полимеразы, что достигалось посредством добавления ионов Mn2+ в состав реакционной смеси и варьированием концентрации различных дезоксирибонуклеотидтрифосфатов. В ходе ПЦР амплифицировалось большое количество копий гена phyA-С с различными мутациями (phyA-Сmut). Для создания библиотеки их клонировали в вектор pGEM-3Zf(+) непосредственно после Т7 промотора. Данный вектор не является экспрессионным, так как в нём отсутствует SD-последовательность. Необходимым условием успешной экспрессии генов под Т7 промотором в данном векторе является встраивание SD-последовательности между Т7 промотором и кодирующей областью гена, что было учтено при конструировании прямого праймера для амплификации гена фитазы. Полученными рекомбинантными плазмидами pGEM-Сmut трансформировали клетки E. coli. Транскрипция фитаз в данной системе индуцируется при помощи лактозы или IPTG, поскольку в штамме E. coli (DE3) Т7 полимераза находится под lac промотором.
1.2. Разработка метода отбора фитаз с повышенной термостабильностью
Слабым местом выбранной стратегии является необходимость скрининга огромных библиотек мутантных генов. Поэтому требуется разработка наиболее упрощённых схем отбора трансформантов с заданными свойствами. Для отбора термостабильных вариантов фитаз был упрощён стандартный метод. Фитазная активность тестировалась по зонам просветления вокруг реплик на агаризованной среде с фитатом кальция. Такой подход экономит время и расход реактивов. Для обнаружения фитаз с повышенной термостабильностью мы подобрали условия прогрева и концентрацию фитата кальция таким образом, что фитаза C. freundii после прогрева при 60°C в течение 10 минут, не образовывала зон просветления на среде с фитатом кальция. Чувствительность метода составила 3 ед/мл культуральной жидкости.
1.3. Отбор фитазы с повышенной термостабильностью
Из 2000 клонов был отобран один, экспрессирующий ген фитазы с повышенной термостабильностью. Секвенирование показало, что единичная мутация в нуклеотидной последовательности, привела к замене Asp275Asn. Активность полученного штамма составила 13 ед/мл, контрольного штамма – 15 ед/мл. Выяснилось, что после прогрева при 60°С в течение 10 мин. мутантный фермент сохранял 23% от исходной фитазной активности, в то время как контрольная фитаза 15%. Однако остаточная фитазная активность после прогрева при 70°C в течение 10 минут для мутантного штамма составила 5%.
Участие отобранного гена в дальнейших раундах мутагенеза не привело к получению генов мутантных фитаз со значительно улучшенной термостабильностью.
1.4 Оценка эффективности метода
Столь малую эффективность метода можно отчасти объяснить тем, что из-за вырожденности кодонов множество мутаций являются нейтральными по отношению к аминокислотной последовательности. Обычно частота ошибок в ходе такого мутагенеза составляет 3-4 мутации на 1000 п.н. Для того, чтобы сменить аминокислоту иногда требуется замена двух нуклеотидов в кодоне. Однако при проведении error-prone ПЦР аминокислоту в данной позиции вероятно заменить приблизительно на одну из шести, а не двадцати возможных аминокислот [Neylon C. et. al., 2004]. Мутагенезу подвергается вся нуклеотидная последовательность, а не только функциональные участки, поэтому некоторые мутации являются дестабилизирующими или влияют на другие свойства фермента. На низкую эффективность метода могли повлиять: недостаточно большой размер библиотеки, нечувствительность метода отбора к термостабильным вариантам с пониженной удельной активностью.
Все перечисленные факторы резко снижают вероятность получения генов фитаз с повышенной термостабильностью.
2. Применение стратегии сфокусированного мутагенеза для создания генов фитаз с повышенной термостабильностью и высокой удельной активностью
2.1 Выбор реципиента и системы экспрессии
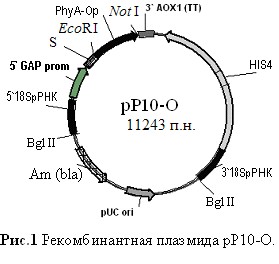
Стратегия сфокусированного мутагенеза не требует создания больших библиотек мутантных генов и, следовательно, высокой частоты трансформации. Поэтому в качестве реципиента были выбраны дрожжи P. pastoris, широко используемые в промышленности. Для эффективной экспрессии генов фитаз выбрали интегративный шаттл вектор рР10 [Борщевская Л., 2010] и на его основе сконструировали рекомбинантные плазмиды pP10-C и pP10-O (рис.1).
Экспрессионная кассета содержала в своём составе сайты интеграции 18S рРНК, селективный маркер HIS4, сигнальный пептид (S) альфа-амилазы из S. cerevisiae, непосредственно экспрессируемый ген, конститутивный промотор GAP и терминатор транскрипции.
2.2 Разработка полурационального подхода для получения генов термостабильных фитаз
Известно [Liu Y., et. al., 2007], что белки, принадлежащие к одному и тому же семейству, часто имеют очень похожие пространственные структуры, несмотря на низкую гомологию аминокислотных последовательностей. Были получены вторичные структуры последовательностей фитаз АррА E. coli, PhyA-Сf и PhyA-Op, используя программу SOPHMA, и проведено их выравнивание при помощи программы ClustalW. Последовательности элементов вторичной структуры исследуемых фитаз почти идентичны и совпадают примерно на 85%. Для предсказания возможных замен в аминокислотной последовательности фитазы PhyA-Сf, которые могут увеличить её термостабильность, предположили, что замены, найденные для одного гомолога бактериальных фитаз, будут значимы, в определённой степени, и для другого. Из литературных данных [Kim M., 2008] известны аминокислотные замены К46Е, D144N, V227A и G344D, приводящие к увеличению термостабильности фитазы АррА E. coli. С помощью программы ClustalW мы выровняли аминокислотные последовательности фитаз и нашли аналогичные аминокислоты в тех же позициях для фитаз PhyA-Сf и PhyA-Op (рис. 2). Гомология аминокислотных последовательностей фитаз C. freundii и O. proteus с AppA E. coli составила 48% и 61%, соответственно.
EcoliAppA ------MKAILIPFLSLLIPLTPKSAFAQSEPELKLESVVIVSRHGVRAPTKATQLMQD 53
Cfreundii ------MSTFIIRLLFFSLLCGSFSIHAEEQNGMKLERVVIVSRHGVRAPTKFTPIMKD 53
O proteus ---------MPLAFIAASMLTTASYASETEPSGYQLEKVVILSRHGVRAPTKMTQTMRD 50
** ***:********** * * *
EcoliAppA RTRKTGEAFAAGLAPDCAITVHTQADTSSPDPLFNPLKTGVCQLDNANVTDAILSRAGGS 173
Cfreundii RTRKTGEAFLAGLAPKCQIQVHYQKDEEKTDPLFNPVKMGTCSFNTLKVKNAILERAGGN 173
O proteus RTRKTGEAFLAGLAPECHLSIHHQQDIKQADPLFHPVKAGVCTMEKTQVQQAVEQQAGMP 170
*********:***** * :* * * ****:* * *: * *:: :**:
EcoliAppA IADFTGHRQTAFRELERVLNFPQSNLCLNREKQDESCSLTQALPSELKVSADN--VSLTG 231
Cfreundii IELYTQRYQSSFRTLENVLNFSQSETCKTTEKS-TKCTLPEALPSELKVTPDN--VSLPG 230
O proteus IDQLNQHYRPALALMSSVLNFPKSTYCQQHS-ADQTCDLAQAMPSKLSIKDNGNKVALDG 229
* :: : :: ****::* *. * :*:**:*:: :: *:* *
EcoliAppA ATPLLDLIMAALTPHPSQKQAYGVTLPTSVLFIAGHDTNLANLGGALELNWTLPGQ 345
Cfreundii ATPLLDMIDTALLTNGTTENRYGIKLPVSLLFIAGHDTNLANLSGALDLNWSLPGQ 344
O proteus GTPLLQTIVSAINSQPSSRELPELSADNKILFPAGHDTNIANIAGMFGMSWALPGQ 343
:****: * *: :: **:******:**: *:: ::* ****
Рис. 2 Фрагменты выравнивания аминокислотных последовательностей фитаз AppA E. coli, PhyA-Сf C. freundii и PhyA-Op O. proteus. На рисунке выделены: остатки цистеина С, остатки активного центра жирным шрифтом и сверху значком , консервативный мотив RHGVRAP подчеркнут. Сигнальные пептиды выделены серым цветом текста. Аминокислотные остатки, подлежащие замене, выделены прямоугольником. Обозначения - названия штаммов и номера последовательностей в ГенБанке: EcoliAppA - E. coli CFT073, AE016758; Cfreundii - C. freundii B4090, AY390262; Oproteus - O. proteus B6898, AY378096.
2.3 Получение генов рhyA-СМ1, рhyA-OМ1, phyA-C1 и их экспрессия в P.pastoris
Получение генов рhyA-СМ1, рhyA-OМ1, кодирующих фитазы с тремя аминокислотными заменами D144N, V227A и G344D, и phyA-C1, кодирующего фитазу с одной заменой K46E, осуществляли путём замены необходимых нуклеотидов в кодонах, используя специфические праймеры. Четыре перекрывающихся фрагмента с необходимыми мутациями (для каждого гена) синтезировали в ходе ПЦР. Далее из получившихся частично комплементарных фрагментов методом ПЦР собирали целые последовательности генов, которые были клонированы в вектор рР10 и секвенированы. Полученными рекомбинантными плазмидами рР10-СМ1, рР10-OМ1 и рР10-С1 трансформировали клетки P. pastoris. Клоны, продуцирующие фитазы PhyA-СfМ1, PhyA-OpМ1, и PhyA-Сf1, были отобраны для дальнейшей характеристики.
2.4 Свойства фитаз PhyA-СfМ1, PhyA-OpМ1, и PhyA-Сf1
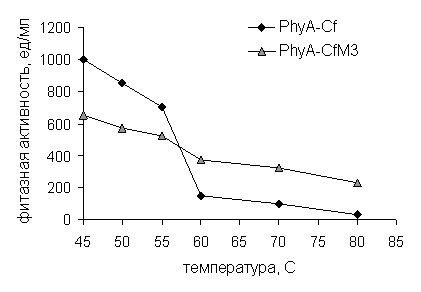
Результат проведения SDS-PAGE электрофореза неочищенных образцов фитаз из культуральной жидкости показал, что белки фитаз PhyA-Сf, PhyA-Сf1 и PhyA-СfМ1 имеют большую молекулярную массу (53 кДа) по сравнению с экспрессированными в E. coli (43 кДа). Такое увеличение молекулярной массы произошло из-за гликозилирования. Фитазы PhyA-Oр и PhyA-OрМ1 сохранили свою молекулярную массу 43 кДа и, очевидно, не гликозилированы.
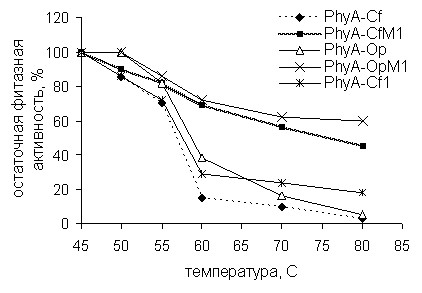
Устойчивость ферментов к прогреванию при 40, 45, 50, 55, 60, 70 и 80°С в течение 10 мин показана на рис. 3. Относительную остаточную активность измеряли при 37°С. Как видно из графиков, термостабильность ферментов значительно возросла. Остаточные фитазные активности PhyA-CfM1, PhyA-OpM1 и PhyA-Cf1 (после 10 минутного прогрева при 80°С) составили 45%, 60% и 18%, соответственно. Таким образом, термостабильность при данных условиях возросла в 15, 10 и 6 раз, соответственно. С помощью программы Swiss-Pdb viewer, определили, что замещение D144N может вносить дополнительную водородную связь с Gln137, что оказывает стабилизирующее действие на формирование третичной структуры белка. Замещение G344D вносит дополнительную водородную связь с Leu379, который находится на соседней -спирали. Такое взаимодействие может вносить вклад в стабилизацию региона между петлёй и -спиралю. Замена V227А убирает стерические препятствия и может облегчать взаимодействие с Val222 расположенным на -шпилечной структуре. Интересно отметить, что все аминокислоты, определённые программой, консервативны и находятся в идентичных позициях фитаз C. freundii, O. proteus и E. coli.
Удельную активность ферментов оценивали опосредованно по средней активности десяти наиболее активных клонов из 400 (табл. 2). Исходя из приведенных данных, был сделан вывод, что удельные активности ферментов значительно уменьшились.
Таблица 2. Сравнение фитазной активности штаммов
| Название фитазы | PhyA-Сf | PhyA-CfM1 | PhyA-Сf1 | PhyA-Oр | PhyA-OpM1 |
| Средняя активность штаммов, ед/мл КЖ | 600 | 80 | 285 | 300 | 30 |
В результате выбранного подхода была показана возможность применения мутаций, найденных с целью увеличения термостабильности, для одного белка к другим из этого же семейства при достаточно низкой аминокислотной гомологии (минимум 48%). Однако основной задачей дальнейшей работы явилась разработка подходов, позволяющих получать варианты термостабильных фитаз с высокой удельной активностью.
2.5 Получение генов, кодирующих термостабильные фитазы с увеличенной удельной активностью
Для получения генов на основе мутагенеза ДНК последовательности рhyA-CM1 использовали два подхода: элиминирование нуклеотидных замен в кодоне, соответствующем D344, и проведение сайт-насыщающего мутагенеза аминокислотной позиции 344, а также одновременно позиций 144, 227 и 344. Особое внимание уделяли позиции 344, так как она влияет на активность фитазы AppA E. coli. Был синтезирован, клонирован и экспрессирован новый ген phyA-CM2, кодирующий фитазу с двумя заменами D144N и V227А. Её относительная остаточная фитазная активность составила 30% после 10 мин. прогрева при 80°С. Средняя активность полученных штаммов составила 200 ед/мл. Сайт-насыщающий мутагенез выбранных позиций существенно не увеличил активность получаемых штаммов.
Для получения генов термостабильных фитаз с увеличенной удельной активностью использовали подход, основанный на компьютерном моделировании. Выбор аминокислот для замещения K46 осуществляли с помощью программы I-Mutant2.0, основанной на расчёте двойного изменения энергии Гиббса (G). Стабильность белка увеличивается, если G>0, и уменьшается, если G<0.
Методом сайт-направленного мутагенеза были получены гены phyA-C(2-6), клонированы в вектор рР10 и экспрессированы в дрожжах P. pastoris. Данные, предсказанные программой I-Mutant2.0, а также свойства полученных вариантов фитаз, приведены в таблице 3.
Таблица 3. Аминокислотные замены и их влияние на термостабильность фитазы
| Мутантный вариант гена | Мутантный вариант фитазы | Аминокислота в 46 позиции | G, кДж/моль | Относительная остаточная фитазная активность*, % | Средняя активность штаммов**, ед/мл |
| phyA-C2 | PhyA-Cf2 | I | 1,09 | 5 | 100 |
| phyA-C3 | PhyA-Cf3 | M | 0,78 | 15 | 450 |
| phyA-C4 | PhyA-Cf4 | S | 0,69 | 8 | 500 |
| phyA-C5 | PhyA-Cf5 | R | 0,58 | 9 | 520 |
| phyA-C6 | PhyA-Cf6 | D | 0,25 | 25 | 238 |
| phyA-C*** | PhyA-Cf | K | – | 3 | 600 |
* – фитазную активность измеряли при 37°С после 10 минутного прогрева при 80°С.
** – активность измерена у десяти самых активных клонов из 400.
*** – контроль, ген фитазы C. freundii.
Наиболее удачной заменой является аминокислота метионин. Поэтому ген phyA-C3 был выбран для участия в дальнейших раундах мутагенеза.
3. Разработка эффективного подхода для получения гена, кодирующего мутантный вариант фитазы с оптимизированными свойствами
Применение подходов случайного мутагенеза целой последовательности гена и сфокусированного мутагенеза показало наибольшую эффективность последнего. Однако с его помощью не удалось достигнуть оптимального соотношения между удельной активностью фермента и его значением термостабильности. Для промышленного применения требуется большая термостабильность при максимальном сохранении удельной активности.
3.1 Разработка подхода и теоретическое обоснование его эффективности
Для того чтобы улучшить свойства выбранной мутантной фитазы PhyA-Cf3, мы разработали подход, основанный на стратегии полу-рациональной инженерии и дизайна. В последнее время [Bottcher D., et. al.,2010; Lutz S., et. al., 2010] нарастает необходимость поиска участков аминокислотной последовательности ферментов, мутации в которых с наибольшей вероятностью приведут к направленному изменению свойств исследуемого белка. Кроме того, выбор небольших участков для случайного мутагенеза поможет существенно снизить количество получаемых мутантных вариантов. Тем самым решится основная проблема направленной эволюции – уменьшение библиотеки мутантных генов.
Исходя из результатов экспериментов, предположили, что регионы с высокой консервативностью могут служить удачной мишенью для направленного мутагенеза с целью получения термостабильных фитаз. Выравнивание 21 гомолога, принадлежащих к семейству кислых гистидиновых фосфатаз (данные не показаны), показало высокую степень консервативности аминокислот, подвергшихся мутагенезу в данной работе. Кроме того, известно [Querol E., et. al., 1996], что из изученных 195 мутаций, влияющих на термостабильность белков, 146 консервативны. -спирали содержат не чувствительные к мутагенезу области и обеднены консервативными участками [Wiederstein M., et. al., 2005], в то время как -складки и петли содержат большое количество консервативных участков [Sitbon E., et. al., 2007], а мутации в них часто приводят к повышению термостабильности белков. Также отмечается, что консервативные регионы важны как для функционирования ферментов, так и для их стабильности [He M., et al., 2004]. Консенсусная концепция [Lehmann M., et. al., 2002] так же доказывает, что существенный вклад в стабильность белка вносит наиболее часто встречающаяся (наиболее консервативная) аминокислота в данной позиции при выравнивании последовательностей гомологов.
Таким образом, был разработан следующий подход:
- Провести выравнивание гомологичных аминокислотных последовательностей.
- Оценить возможность применения мутаций, известных для одного гомологичного белка к другому. Выбрать ген, кодирующий вариант фермента с оптимальными свойствами, для участия в дальнейших раундах мутагенеза.
- Подвергать случайному мутагенезу не всю область гена, а только участки, соответствующие консервативным аминокислотным областям.
- Первейшее внимание уделить участкам, расположенным на поверхности белка.
- Проводить одновременный случайный мутагенез нескольких областей, что повышает вероятность отбора мутанта с необходимыми свойствами.
3.2 Получение гена рhyA-СМ3 в результате применения разработанного подхода
Для проведения error-prone ПЦР мутагенеза мы выбрали два участка гена phyA-C3, соответствующих высоко консервативным областям K29-G74 и Q104-Q131 аминокислотной последовательности фитазы PhyA-Cf3 (частично находящимся на поверхности белка). Два фрагмента гена, выбранные для мутагенеза, были синтезированы в ходе error-prone ПЦР, остальные два – амплифицированы стандартным методом ПЦР. Целые гены собирали методом мегапраймер ПЦР, лигировали в вектор рР10 и трансформировали в клетки P. pastoris. Отбор мутантов проводили, как описано в п. 1.2, только без добавления лизоцима. Из 500 клонов удалось отобрать мутантный штамм с активностью 450 ед/мл, который сохранял 35% относительной остаточной фитазной активности после прогрева при 80°С в течение 10 минут. Из него выделяли хромосому, методом ПЦР нарабатывали ген рhyA-СМ3 и секвенировали его последовательность. В результате обнаружились дополнительные мутации, приведшие к заменам V41D и P128S.
3.3 Анализ аминокислотных замен
Полученную мутантную фитазу, содержащую три замены в аминокислотной последовательности V41D, К46М и P128S, назвали PhyA-CfМ3. Для выявления консервативности замен, были выровнены 14 аминокислотных последовательностей гомологичных белков, относящихся к классу кислых гистидиновых фосфатаз (данные не показаны). Обнаружена высокая степень консервативности замещённых аминокислот.
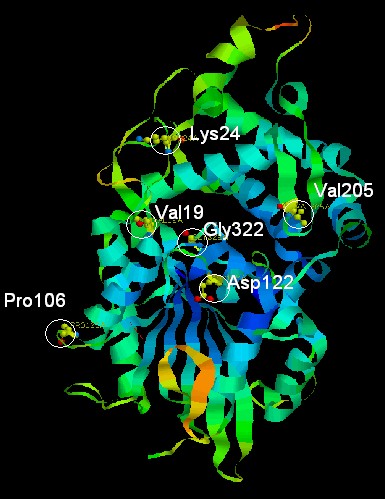
Пространственное расположение выявленных мутаций определяли на основе пространственной структуры фитазы AppA E. coli и с помощью программы RasMol 2.7.5 (рис. 4). Нумерация указана без учёта лидерного пептида, состоящего из 22 аминокислот. Мутация V41D расположена на границе -спирали и участка с нерегулярной структурой. Остаток аспарагиновой кислоты несёт на себе избыточный отрицательный заряд и способен образовывать солевые мостики, играющие важную роль в увеличении термостабильности белков. Удивительно влияние на термостабильность замены P128S, расположенной в области петли. Однако, известна [Zhang W., et al., 2007] замена P65S, находящаяся в регионе петли фитазы A. niger, и приводящая к увеличению её термостабильности. Таким образом, выявлено, что полученные мутации затрагивают высоко консервативные аминокислоты, находящиеся на (или близко к) поверхности белка, и не входящие в состав -спиралей.
4. Изучение свойств фитазы PhyA-CfМ3
4.1 Анализ термостабильности
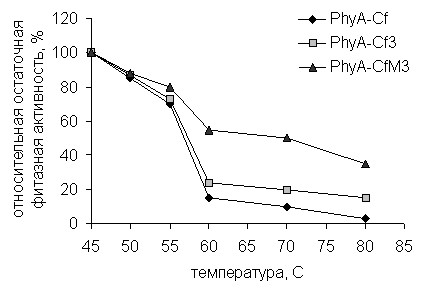
Относительная остаточная фитазная активность штаммов, экспрессирующих фитазы PhyA-Cf, PhyA-Cf3и PhyA-CfМ3, приведена на рис. 5. Остаточная фитазная активность PhyA-CfМ3 составила 54%, 50% и 35% после прогрева при 60°С, 70°С и 80°С, соответственно. Таким образом, термостабильность полученного мутанта по сравнению с PhyA-Сf и PhyA-Cf3 возросла в 3,6; 5; 11 и 2; 2,5; 2,3 раза, соответственно, при указанных температурах.
4.2 Определение молекулярной массы и удельной активности
Молекулярную массу фитазы PhyA-CfМ3 определяли по данным SDS-PAGE электрофореза (рис. 6). Молекулярная масса фитазы PhyA-CfМ3 возросла до 116 к Да.
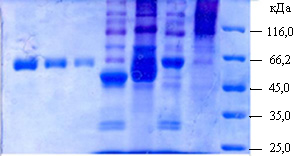
Рис. 6 SDS-PAGE электрофорез неочищенных образцов фитаз из КЖ, где М – маркер, 1 – BSA 2 мкг/проба, 2 – BSA 1 мкг/проба, 3 – BSA 0,5 мкг/проба, 4 – дегликозилированная PhyA-Cf (обработанная Endo H1), 5 – фитаза PhyA-Cf, 6 – дегликозилированная PhyA-CfМ3, (обработанная Endo H1), 7 – фитаза PhyA-CfМ3. А. Окрашивание реактивом Шиффа. Б. Окрашивание реактивом Кумасси.
Было проведено дегликозилирование мутантной и исходной фитаз при помощи эндогликозидазы Н1 и окрашивание олигосахаридов реактивом Шиффа.. Видно, что молекулярная масса фитаз PhyA-Cf и PhyA-CfМ3 уменьшилась, и составила 45 кДа и 60 кДа, соответственно. Разница в молекулярной массе может быть связана с недоступностью всех сайтов для дегликозилирования в фитазе PhyA-CfМ3. Окрашивание по Шиффу (Рис.6 А., дорожка 7) подтверждает, что PhyA-CfМ3 действительно сильно гликозилирована. Столь сильное увеличение гликозилирования, возможно, произошло из-за изменения пространственной конфигурации мутантного белка, которое и дало возможность гликозилировать не доступные ранее для этого процесса сайты.
Удельную активность мутантного фермента определяли при помощи гель-хроматоргафии. После очистки и выделения белков на колонках фитазная активность PhyA-Cf составила 2770 ед/мг белка, а фитазы PhyA-CfМ3 – 2215 ед/мг белка. Таким образом, удельная активность мутантного фермента уменьшилась незначительно (на 20%), что даёт возможность его использования в промышленном производстве.
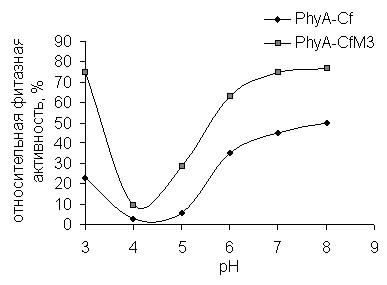
4.3 Определение оптимальной рабочей температуры и рН профиля
Температурный и рН профили фитаз представлены на рис. 7 (А., Б.).
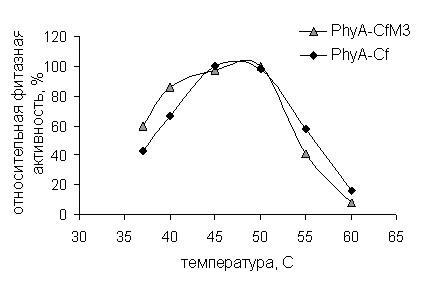
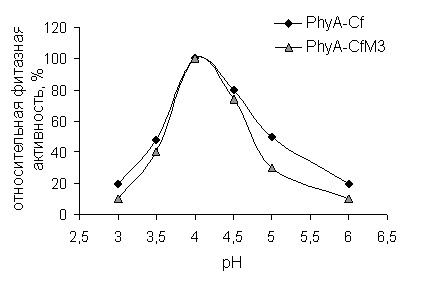
Видно, что температурный оптимум мутантной фитазы не изменился, однако, она на 20% активнее при 40°С, что очень важно для эффективности её работы в желудочно-кишечном тракте сельскохозяйственных животных. Оптимальное значение рН для мутантной фитазы не изменилось Уменьшение фитазной активности мутантной фитазы при 55°С и 60°С, а также сужение рабочего интервала рН, по-видимому, связано с увеличением компактности и жесткости её структуры.
4.4 Влияние гликозилирования и рН на термостабильность и фитазную активность
Было изучено влияние гликозилирования на термостабильность мутантной фитазы PhyA-CfМ3. Дегликозилированный белок уменьшил свою термостабильность на 25% после прогрева при 70°С в течение 10 мин. Таким образом, без гликозилирования, остаточная относительная фитазная активность PhyA-CfМ3 возросла на 15% и 10% по сравнению с PhyA-Cf и PhyA-Cf3. Гликозилирование обычно не влияет на термостабильность, а помогает белку принимать выгодную для термоустойчивости конформацию. Активность дегликозилированной фитазы возросла на 14%. Мы изучили влияние значения рН на фитазную активность PhyA-Cf и PhyA-CfМ3 (рис. 8). Фитазы помещали в буферные растворы с различными значениями рН и прогревали при 70°С в течение 10 минут, затем измеряли эффективность их работы при оптимальном рН 4,0 и 37°С. Интересно, что графики на рис. 8 представляют полную противоположность графикам рН-профилей, представленным на рис. 7 (Б.). Это может быть связано с тем, что фермент в оптимальных для его работы условиях принимает достаточно подвижную конформацию, если можно так выразиться – развёрнутую, что уменьшает его стабильность. В то время как в остальных условиях, он максимально свёрнут и компактен, что и вызывает увеличение его термостабильности.
4.5 Определение кинетических характеристик
Кинетические характеристики фитаз PhyA-Cf и PhyA-CfМ3 приведены в таблице 3.
Таблица 3 Сравнение кинетических характеристик
| Фитаза | Km (M) | kкат (min-1) | kкат /Km (min-1M) |
| PhyA-Cf | 254,77 ± 14,53 | 99,7 ± 3,52 | 391 ± 24 |
| PhyA-CfМ3 | 225,49 ± 18,17 | 112,4 ± 4,31 | 498 ± 32 |
Константа Михаэлиса для мутантного фермента практически не изменилась. Однако, эффективность катализа (kкат /Km) для PhyA-CfМ3 возросла на 21%. Это может быть связано с тем, что измерения фитазной активности проводили при 37°С, а активность мутантной фитазы при этой температуре на 20% выше, чем у PhyA-Cf.
4.6 Оценка кормовых качеств фитазы РhyA-СfМ3
Исследование кормовых качеств и физиологического действия фитазы РhyA-Сf при использовании её в рационах кормления сельскохозяйственной птицы проводилось на базе ВНИТИП. Как показали зоотехнические результаты выращивания, использование фитазы РhyA-Сf позволило увеличить уровень доступного фосфора на 0,2% против 0,1%, рекомендуемого для большинства фитазных препаратов, использующихся в настоящее время на отечественном рынке. Проведённые балансовые исследования по определению перевариваемости и доступности питательных веществ корма показали превосходство опытной группы по многим показателям: перевариваемости сухого вещества корма, жира, использованию азота, кальция и фосфора. Близость значений промышленно-важных характеристик фитазы РhyA-Сf и её термостабильного варианта РhyA-СfМ3 даёт основание полагать успешное применение последнего в кормопроизводстве.
5. Эффективная экспрессия гена phyA-CM3mod в дрожжах P. pastoris
Эффективная экспрессия генов позволяет получать штаммы с высокой продуктивностью, потенциально пригодные для использования в промышленности. Снижение удельной активности фермента можно компенсировать получением штаммов с высокой продуктивностью. Поэтому задачей явилось увеличение экспрессии гена фитазы РhyA-СfМ3 и возможность получения штамма с высокой продуктивностью, потенциально пригодного для использования в промышленности.
5.1. Разработка синтетической последовательности phyA-Cmod и метода для её синтеза
Частоты встречаемости разных тРНК в клетках различных организмов неодинаковы. Причём, эти частоты положительно коррелируют с частотами использования кодонов в клетках тех же организмов. Это обстоятельство является определённым препятствием для трансляции в случае гетерологичной экспрессии. Предпочтительно используемые (оптимальные) кодоны были выявлены для клеток многих видов. Таким образом, применяя правило оптимальности кодонов, был разработан синтетический ген phyA-Cmod и его нуклеотидная последовательность депонирована в ГенБанк (№ GU 197387).
Трансляционная инженерия в сочетании с технологиями синтетической биологии (синтез генов) дают возможность изменять кинетику трансляции генов без изменения аминокислотной последовательности. Существуют различные подходы к синтезу генов [Gao X., et al., 2003; Xiong A., et al., 2006]. Основной проблемой остаются высокая цена синтеза и большое количество ошибок в конечном продукте. В данной работе был предложен усовершенствованный ПЦР метод синтеза гена phyA-Cmod с низкой частотой ошибок и себестоимостью. Метод состоит из двух стадий:
1. ПЦР-синтез фрагментов (F), размером 300-400 п.н., из (5-3) олигонуклеотидов (Р), размером 60 н.о., и обратных 30 н.о. праймеров (z) с перекрыванием в 15 п.н. (рис. 9,10).
2. Сборка целого гена из перекрывающихся фрагментов (F1-F4) методом ПЦР (рис. 11).
Рис. 9 Схематическая диаграмма олигонуклеотидного дизайна. P1-P21 – прямые праймеры длиной 60 н.о. без перекрываний и промежутков между собой (встык). z1-z21 – антисмысловые праймеры длиной 30 н.о., комплементарные двум соседним прямым праймерам и перекрывающие их как с 3`-конца, так и с 5`-конца на 15 п.н. P1-P5/z1-z5 использовались для синтеза главного фрагмента F1 и т.д.
ПЦР амплификация фрагментов с использованием пар праймеров (P/z) проводилась отдельно друг от друга с последующим объединением и ПЦР синтезом до конечного фрагмента F1 (рис.10).
Целый ген phyA-Cmod синтезировали из четырёх главных фрагментов (F1-F4) методом ПЦР, используя внешние праймеры P1, z21 (рис.11).
Преимущества такого метода синтеза гена заключаются в следующем:
- Отсутствие промежутков между смысловыми праймерами (Р) нивелирует ошибки, связанные с работой ДНК-полимеразы в ходе ПЦР.
- Снижение величины перекрывания с антисмысловыми праймерами (z) (15 п.н. вместо 20 п.н.) позволяет уменьшить их длину и, как следствие, общую стоимость синтеза. Кроме того, с уменьшением длины олигонуклеотидов снижается вероятность ошибок, внесённых в ходе их химического синтеза. Последовательное проведение ПЦР синтеза (рис. 10) помогает снизить количество неспецифики (рис. 12).

Рис. 12 А. Четыре главных фрагмента (F), амплифицированных в ходе 20 циклов ПЦР. M, 100 п.н. ДНК маркер; линии 1-4, фрагменты F4, F3, F2 and F1, соответственно. Б. Целый phyA-Cmod ген, амплифицированный с помощью четырёх главных фрагментов (F) M, 6000 п.н. ДНК маркер; линия 1, целый phyA-Cmod ген.
- Разработанный дизайн олигонуклеотидов позволяет использовать их в качестве праймеров для секвенирования и удаления ошибок, что снижает стоимость синтеза гена.
Частота ошибок метода составляет 1-2 на 1000 п.н. Такое значение сравнимо с наилучшими показателями [Xiong A., et al., 2006] и даже превосходит их, если учитывать, что в результате секвенирования не обнаружено ни одной нуклеотидной замены, а только две делеции Т429 и С915. Делеции обычно связывают с ошибками при химическом синтезе олигонуклеотидов, а не ДНК полимеразы в ходе ПЦР. Для исправления ошибок использовали метод OE-ПЦР [Xiong A., et al., 2006]. Однако, дополнительные праймеры не синтезировали, как это принято, а предположили, что последовательности большинства олигонуклеотидов корректны. Для элиминирования делеций T429 и C915 (отмечены крестиками, рис.13) было синтезировано три перекрывающихся фрагмента (1,2 и 3), используя пары праймеров: P1/z7, P8/z16, and P17/z21, соответственно. ДНК-фрагменты 1, 2, и 3 были использованы в качестве мегапраймеров для синтеза гена phyA-Сmod с корректной последовательностью.
Используя данный подход, мы с успехом элиминировали ошибки и получили ген phyA-Cmod с корректной последовательностью.
5.2 Влияние оптимизации кодонов на эффективность экспрессии гена phyA-Сmod
Эффективность экспрессии генов phyA-С и phyA-Сmod оценивали, сравнивая активности штаммов (10 лучших из 400), получаемых при трансформации клеток P. pastoris. Оптимизация кодонов вызвала 50%ое увеличение экспрессии гена phyA-Сmod.
5.3 Получение штамма P. pastoris с повышенной экспрессией гена phyA-CМ3mod
Мутации V41D, К46М и P128S вводили в аминокислотную последовательность фитазы РhyA-Сf путём замены соответствующих нуклеотидов в кодонах, находящихся в последовательности гена phyA-Сmod. Целый ген phyA-CМ3mod синтезировали из перекрывающихся фрагментов методом ПЦР. В качестве вектора для лигирования использовали рР10. После трансформации клеток дрожжей P. pastoris рекомбинантной плазмидой рР10-СМ3mod, отобрали клон, продуцирующий фитазу РhyA-СfМ3, с активностью 650 ед/мл КЖ, при культивировании в лабораторных условиях.
5.4 Сравнение фитазных активностей КЖ лучших штаммов после прогрева
Сравнение фитазных активностей КЖ лучших штаммов P. pastoris, продуцирующих фитазы РhyA-Сf и РhyA-СfМ3, представлено на рис. 14. Фитазная активность КЖ штамма, продуцирующего фитазу РhyA-СfМ3, после прогрева при 70°С составляет 325 ед/мл, при 80°С – 227 ед/мл. Полученные значения превышают таковые для КЖ штамма-продуцента фитазы РhyA-Сf в 3,25 и 7,5 раз, соответственно.
Высокая продуктивность штамма, экспрессирующего ген фитазы phyA-CМ3mod, показывает потенциальную возможность его использования в производстве.
ВЫВОДЫ
- Обнаружены одинаковые аминокислотные мутации, приводящие к увеличению термостабильности фитаз из одного и того же семейства, несмотря на низкую аминокислотную гомологию.
- Предложены области для проведения сфокусированного случайного мутагенеза с целью эффективного получения генов фитаз с повышенной термостабильностью.
- Получен, клонирован и экспрессирован мутантный вариант гена фитазы C. freundii с оптимизированными характеристиками
- Охарактеризован мутантный вариант фитазы C. freundii с оптимизированными промышленно-важными свойствами.
- Разработан усовершенствованный ПЦР метод, с помощью которого синтезировали новый синтетический ген термостабильной фитазы для эффективной экспрессии в дрожжах P. pastoris.
Результаты диссертации изложены в следующих публикациях:
1. Гордеева Т.Л., Борщевская Л.Н., Синеокий С.П., Гетерологичная экспрессия генов бактериальных фитаз PhyA-Cf Citrobacter freundii и PhyA-Op Obesumbacterium proteus в метилотрофных дрожжах P. pastoris. Материалы 4-ого московского международного научно-практического симпозиума «Микробные биокатализаторы и их роль в нано - и биотехнологиях». 2008. ВНИИПБТ и РАСХН, стр. 17-19.
2. Е. Андрианова, С. Синеокий, Л. Борщевская, Т. Гордеева, А. Кучумов. Ферментный препарат с фитазой. Корма. 2009. №6, стр. 85-86.
3. Гордеева Т.Л., Борщевская Л.Н., Синеокий С.П. Мутантная рекомбинантная термостабильная фитаза (варианты), фрагмент ДНК, кодирующий указанную фитазу (варианты), штамм Pichia pastoris - продуцент указанной фитазы (варианты). Заявка на патент № 2009146172, приоритет от 15.12.2009.
4. Борщевская Л.Н. Гордеева Т.Л., Бавыкина Н.Б., Синеокий С.П. Рекомбинантная плазмида для экспрессии в дрожжах Pichia pastoris гена фитазы (варианты), штамм дрожжей Pichia pastoris - продуцент фитазы (варианты). Заявка на патент № 2009126296, принято положительное решение о регистрации 16.08.2010.
5. T.L. Gordeeva, L.N. Borschevskaya, S.P. Sineoky. Improved PCR-based gene synthesis method and its application to the Citrobacter freundii phytase gene codon modification. Journal of Microbiological Methods. 2010, 81, 147-152.

