Поиск генетических и экспрессионных маркеров риска развития болезни паркинсона в российской популяции
На правах рукописи
Филатова Елена Владиславовна
Поиск генетических и экспрессионных маркеров риска развития болезни Паркинсона в российской популяции
03.01.03 – Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
МОСКВА - 2011
Работа выполнена в Отделе молекулярных основ генетики человека Учреждения Российской академии наук Института молекулярной генетики РАН (зав. отделом доктор биологических наук, профессор С. А. Лимборская).
Научный руководитель:
кандидат биологических наук Мария Игоревна Шадрина ИМГ РАН
Официальные оппоненты:
доктор биол. наук, профессор Валерий Вячеславович Носиков ФГУП «ГосНИИ генетика»
доктор биол. наук, профессор Александр Васильевич Карпухин Медико-генетический научный центр РАМН
Ведущая организация:
Учреждение Российской академии наук Институт биологии гена РАН
Защита диссертации состоится « » 2011 г. в 14 часов
на заседании Диссертационного совета Д.217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, Россия, Москва, 1-ый Дорожный проезд д.1. Тел: (495)315-3747.
С диссертацией можно ознакомиться в научной библиотеке ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов»
Автореферат разослан « » 2011 г.
Ученый секретарь
Диссертационного совета,
кандидат химических наук Т. Л. Воюшина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Стремительный прогресс в области технологий и накопление большого объема данных о строении и работе как отдельной клетки, так и всего организма в целом в последние десятилетия привели к активному развитию новых дисциплин в области молекулярной генетики, таких как геномика и протеомика. Одним из важнейших направлений геномики является медицинская геномика, которая занимается определением генных дефектов при наследственных и других болезнях, изучением экспрессии мутантных генов и разработкой новых методов диагностики, лечения и профилактики. Особый интерес в этом направлении представляет изучение молекулярно-генетических основ нейродегенеративных заболеваний. Это связано с тем, что изучение этой группы болезней позволяет выявить и охарактеризовать новые экспрессирующиеся в нервной системе гены, что существенно расширит генетическую базу, закладывающую основы изучения молекулярных принципов функционирования нервной системы.
К числу тяжелых неврологических патологий относится болезнь Паркинсона (БП), которая является вторым по распространенности (после болезни Альцгеймера) нейродегенеративным заболеванием человека. Это мультисистемное хроническое медленно прогрессирующее нейродегенеративное заболевание, связанное с нарушением деятельности базальных ганглиев головного мозга. В настоящее время полагают, что в основе БП лежит дегенерация или дисфункция дофаминергических нейронов в черной субстанции. Отличительной особенностью болезни Паркинсона является то, что характерные для заболевания клинические признаки проявляются при гибели приблизительно 60% дофаминергических нейронов компактной части черной субстанции и 80%-ном снижения уровня дофамина в полосатом теле.
С генетической точки зрения БП является гетерогенным заболеванием. В 10-15% случаев заболевание может наследоваться по моногенному аутосомному типу, но в большинстве случаев носит спорадический идиопатический характер и обусловлено сложным взаимодействием между генетическим строением организма и факторами окружающей среды. Активное изучение молекулярных основ развития моногенных форм БП позволил идентифицировать семь генов (PARK2, SNCA, PINK1, PARK7, LRRK2, UCHL1, ATP13A2), вовлеченных в их патогенез. Это позволило расширить представления об этиопатогенезе заболевания и начать более целенаправленную работу по изучению генетических факторов более частой спорадической формы БП. Так в настоящее время показано, что мутации в гене PARK2 вносят существенный вклад в развитие спорадической формы этого заболевания особенно с ранним началом его развития. Полученные данные говорят о необходимости продолжения такого рода работ и изучения мутаций и полиморфизмов генов моногенных форм заболевания у больных со спорадической формой болезни Паркинсона. Кроме того, выявлен ряд потенциальных кандидатных генов (SLC6A3, MAPT, ST13, GSK3B, GBA и др.), которые могут быть вовлечены вовлеченных в патогенез БП и влиять на риск его развития. Однако вклад этих генов, а также мутаций и полиморфизмов в них в патогенез спорадической формы БП изучен не до конца. В последнее годы также начаты работы по изучению транскриптома при БП в post mortem тканях мозга на поздних стадиях заболевания. Однако для выявления всех патогенетических процессов, протекающих при БП необходимо изучать изменения экспрессии генов-кандидатов на разных стадиях заболевания и в первую очередь на самых ранних (доклинических). Основная проблема при проведении таких исследований – недоступность тканей головного мозга человека на ранних стадиях заболевания. В то же время оценку относительных уровней мРНК исследуемых генов можно проводить в периферической крови, самой доступной ткани человека.
Проведение работ по анализу полиморфизмов и мутаций генов, вовлечённых в патогенез БП, а также изменения экспрессии генов-кандидатов позволит с одной стороны лучше понять причины и механизмы развития этого заболевания, а с другой стороны разработать молекулярно-генетические тесты для определения риска развития БП и её ранней диагностики. Возможность проведения доклинической диагностики этого заболевания позволит начать разработку принципов и подходов профилактического лечения в тот момент, когда дегенерация дофаминэргических нейронов находится на ранней стадии и затронула лишь ограниченное число нейронов этого типа. Осуществление этой работы позволит разработать в дальнейшем новые методы терапии, которые могли бы замедлить (если не остановить) развитие патологических процессов в нервной ткани и тем самым сдвинуть возраст клинического дебюта заболевания на более поздний срок и снизить его клиническую тяжесть.
Цель и задачи исследования
Целью настоящей работы являлись поиск и анализ генетических и экспрессионных маркеров риска развития болезни Паркинсона в российской популяции.
Для достижения данной цели были поставлены следующие задачи:
- Анализ точковых мутаций в генах, вовлечённых в патогенез БП, у пациентов с семейной и спорадической формами БП с ранним и поздним началом развития заболевания из России.
- Анализ однонуклеотидных полиморфизмов (ОНП) в генах, вовлечённых в патогенез БП, у пациентов с семейной и спорадической формами БП с ранним и поздним началом развития заболевания из России.
- Анализ относительных уровней мРНК генов GSK3B, SLC6A3, MAPT, PARK2, SNCA, ST13 в периферической крови пациентов с БП из России, находящихся на ранних стадиях заболевания, подвергавшихся и не подвергавшихся лечению, и в группах сравнения.
Научная новизна и практическая значимость работы
Впервые при анализе 68 известных точковых мутаций в генах моногенных форм БП было выявлено только три известных точковых мутаций (M1L, A82G и C253Y) в гетерозиготном состоянии в гене PARK2 у трёх различных пациентов со спорадической формой БП с ранним началом развития, что свидетельствует о малом вкладе известных мутаций в патогенез спорадической формы БП в России.
Впервые была показана ассоциация полиморфизма rs2736990 (C/T) в гене SNCA с риском развития спорадической формы болезни Паркинсона в российской популяции. Показано, что носительство аллеля С в ОНП rs2736990 в гене SNCA повышает риск развития болезни Паркинсона в 1,70 раза.
Впервые в России был проведён анализ относительных уровней экспрессии генов GSK3B, SLC6A3, MAPT, PARK2, SNCA, ST13, вовлечённых в патогенез БП, в периферической крови у пациентов, находящихся на ранних стадиях развития БП. Было показано, что уровень мРНК генов SLC6A3, MAPT, PARK2 крайне низок – это усложняет их использование для анализа транскриптома при БП в периферической крови. Обнаружено, что уровни мРНК генов GSK3B и ST13 в периферической крови пациентов с болезнью Паркинсона на ранних стадиях не отличаются от таковых у здоровых добровольцев. Впервые было выявлено значительное увеличение уровня мРНК гена SNCA в периферической крови у пациентов с болезнью Паркинсона на ранних стадиях заболевания более чем в 5 раз, у больных церебральным атеросклерозом более чем в 2 раза и у пациентов с различными неврологическими заболеваниями в 3 раза.
Установлено, что полиморфизм rs2736990 в гене SNCA ассоциирован с риском развития болезни Паркинсона и в дальнейшем может быть включён в панель маркеров для определения индивидуального риска развития БП. В будущем, результаты данного исследования могут быть использованы для создания единого комплексного генетического теста, выявляющего риск развития БП.
Установлен разный спектр направлений изменения экспрессии генов GSK3B, SNCA, ST13 у пациентов с БП и в группах сравнения. В дальнейшем эти гены могут быть включены в панель экспрессионных маркеров для диагностики БП и в первую очередь на ранних её стадиях.
Показано, что при изучении транскриптома при БП в периферической крови необходимо использовать в качестве групп сравнения больных с другими неврологическими заболеваниями и в первую очередь с церебральным атеросклерозом.
Публикации
По материалам диссертации опубликовано 6 печатных работ, из них 3 статьи и 3 материала симпозиумов и конференций.
Апробация диссертации
Результаты, полученные в данной работе, были представлены на Втором всемирном конгрессе по болезни Паркинсона (The Second World Parkinson Congress, Глазго, Шотландия), 2010 г., VI Съезде Российского общества медицинских генетиков (Ростов-на-Дону), 2010 г., XII научной конференции молодых учёных по физиологии высшей нервной деятельности и нейрофизиологии (Москва), 2008 г. Основные положения диссертационной работы доложены и обсуждены на заседании Ученого совета ИМГ РАН 21 марта 2011 г. и на заседании секции «Молекулярная биология» Ученого совета ФГУП «ГосНИИ генетики и селекции промышленных микроорганизмов» 21 марта 2011 г.
Структура и объем диссертации
Диссертация включает введение; обзор литературы, материалы и методы исследования, результаты исследования и их обсуждение; выводы; библиографический указатель. Список литературы состоит из 288-х источников, среди которых 6 источников отечественной и 282 источников зарубежной литературы. Материалы диссертации изложены на 155 страницах машинописного текста, содержат 10 таблиц и 8 рисунков.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В настоящей работе исследовали четыре группы пациентов с БП: 1) 346 пациентов со спорадической формой БП с ранним и поздним началом развития заболевания, 2) 21 пациент с ювенильной формой БП из семей с аутосомно-доминантным типом наследования, 3) 13 пациентов с недавно поставленным диагнозом БП и ещё не подвергавшихся лечению (1-2 стадия БП по шкале Хен и Яра), 4) 29 пациентов с недавно поставленным диагнозом БП, подвергавшихся лечению, (1-2 стадия БП по шкале Хен и Яра).
В качестве групп сравнения в настоящей работе исследовали следующих пациентов и здоровых добровольцев: 1) 18 больных с разными неврологическими заболеваниями (болезнь Вильсона-Коновалова, эссенциальный тремор, мозжечковая атаксия), 2) 59 пациентов с церебральным атеросклерозом, 3) в качестве контроля для анализа ТМ и ОНП была сформирована популяционная выборка в количестве 224 человек, для которых отбирались лица русского происхождения из Архангельской, Тверской и Ивановской областей, 4) в качестве контроля для анализа экспрессии генов были отобраны 56 неврологически здоровых добровольцев.
В группы пациентов с различными неврологическими патологиями и группы контроля отбирались лица обоих полов русского происхождения в возрасте от 30 до 70 лет. Все пациенты и неврологически здоровые добровольцы были отобраны в Научном центре неврологии Российской академии медицинских наук, г. Москва.
Все пациенты с БП для постановки диагноза были исследованы по международной унифицированной оценочной шкале болезни Паркинсона (Unified Parkinson’s Disease Rating Scale, UPDRS) и шкале Хен и Яра (Hoehn and Yahr scores) в Научном центре неврологии Российской академии медицинских наук, г. Москва. Все образцы крови были взяты с информированного согласия исследуемых лиц. Для анализа брали периферическую кровь, из которой геномную ДНК выделяли стандартным методом, а тотальную РНК – с помощью набора ZR Whole-Blood Total RNA Kit™ «Zymo Research Corp.» (Orange, USA).
Анализ точковых мутаций и ОНП в генах, вовлечённых в патогенез БП, у пациентов с семейной и спорадической формами БП с ранним и поздним началом развития заболевания из России проводили с помощью микрочиповой технологии удлинения праймера APEX (Arrayed primer extension), полимеразной цепной реакции в реальном времени и полиморфизма длин рестрикционных фрагментов. В работе использовали ДНК-чипы Genorama microarray slides (Sal-01, 30211) производства фирмы «Asper Biotech Ltd.» (Tartu, Estonia), а также реактивы фирм «Fermentas» (Vilnius, Lithuania), «BioAtlas» (Tartu, Estonia), «Genomed GmbH» (Lhne, Germany), «Invitrogen» (Carlsbad, USA), «Синтол» (Москва, Россия). Праймеры, зонды и рестрикционную эндодезоксирибонуклеазу подбирали с помощью программ Vector NTI Advance 10.0.1 «Invitrogen» (Carlsbad, USA), Beacon designer 7.0 «Premier Biosoft International» (Palo Alto, USA) и нуклеотидных последовательностей генов LRRK2, SNCA, PARK2, WNT3 (ссылки на последовательности в базе данных NCBI (Reference Sequence): NT_029419.12, NT_016354.19, NT_007422.13, NT_010783.15). Последовательности праймеров и зондов приведены в таблице 1.
Таблица 1. нуклеотидные последовательности праймеров и зондов для анализа ОНП в генах LRRK2, SNCA, PARK2, WNT3. FAM, ROX – флуоресцентные красители, RTQ-1, RTQ-2 – тушители флуоресценции.
| Ген, ОНП | Нуклеотидные последовательности |
| LRRK2, rs7966550 | Lrs79-f 5’-CCTATTAAAATTTCATGGTTCCTTCC Lrs79-r 5’-CATTAGGTAAATATATATGAAGATTATGTAAGATG |
| SNCA, rs2736990, | 273-SN-f 5’-GATAATGGCTTACAAGTTAATCTCCTC 273-SN-r 5’-GACTAGCAGATGATGAGCAGGC 273SN-C-probe 5’-FAM-TGTTACACACATATACACCTTCTTCCTAAACAGC-RTQ-1 273SNTprobe 5’ROXTGTTACACACATATACATCTTCTTCCTAAACAGCRTQ2 |
| PARK2, rs1801582 | P-V380L-f 5’-GGGAATGTAAAGAAGCGTACC P-V380L-r 5’-TGCTTGGAGGAATGAGTAGG V380L-C-probe 5’-ROX-AGTGCAGTGCCCTATTTGAAGCCTC-RTQ-2 V380L-G-probe 5’-FAM-AGTGCAGTGCCGTATTTGAAGCCTC-RTQ-1 |
| WNT3, rs415430 | MAPT-snp-f 5’-AGGAAGAGGGAATTAGACTAGACC MAPT-snp-r 5’-AAGGAGGGATGGTGCTTGC MWsnpT-probe 5’-FAM-CAGCCTTCAACTTTGCACCTAGAGCCC-RTQ-1 MWsnpC-probe 5’-ROX-CAGCCTTCAACTTСGCACCTAGAGCCC-RTQ-2 |
Для анализа полученных изображений после APEX-реакции использовали пакет программ GENORAMA Genotyping Software: Genorama BaseCaller и Genorama PicDB «Asper Biotech» (Tartu, Estonia).
Анализ относительной экспрессии генов SLC6A3, GSK3B, MAPT, PARK2, SNCA, ST13 проводили с помощью реакции обратной транскрипции и ПЦР в реальном времени. В работе использовали набор RevertAid™ H Minus Reverse Transcriptase kit «Fermentas» (Vilnius, Lithuania) и реактивы фирмы «Синтол» (Москва, Россия). Праймеры и зонды подбирали с помощью программы Beacon designer 7.0 «Premier Biosoft International» (Palo Alto, USA) и нуклеотидных последовательностей генов SLC6A3, GSK3B, MAPT, PARK2, SNCA (инвентарные номера в базе данных GenBank (Accession numbers): NM_001044.2, NM_002093.2, NM_001123066.2, NM_004562.1, NM_000345.2), кроме гена ST13 – последовательности праймеров и зонда были опубликованы ранее (Dong и др., 2005). В качестве внутренних генов сравнения мы использовали гены POLR2F и PSMB6 (инвентарные номера в базе данных GenBank (Accession numbers): NM_021974.3, NM_002798.1). Последовательности праймеров и зондов приведены в таблице 2.
Таблица 2. Нуклеотидные последовательности праймеров и зондов для анализа относительной экспрессии генов SLC6A3, GSK3B, MAPT, PARK2, SNCA, ST13.
| Ген | Нуклеотидные последовательности | |
| SLC6A3 | DAT-probe 5’-ROX-AGCAGCACGATGACCAGCACC-RTQ-2 DAT-for 5’-TTTTGGGACCACACCTGCTG DAT-rev 5’- GTCTTCACGCCCTTCCAGAG | |
| GSK3B | GSK3b-probe 5’-ROX-CCGGAAACAGTATACAGAGTTGCCAGACAC-RTQ-2 GSK3b-f 5’-GTCTATCTTAATCTGGTGCTGGAC GSK3b-r 5’-AGCTGATACATATACAACTTGACATAAATC | |
| MAPT | MAPT-probe 5’-ROX-CCTCCAAGTGTGGCTCATTAGGCAACATCC-RTQ2 MAPT-f 5’-TCTACAAACCAGTTGACCTGAGC MAPT-r 5’-CCAGGGACGTGGGTGATATTG | |
| PARK2 | PARK2-probe 5’-ROX-TTCACGACCCTCAACTTGGCTACTCCCTG-RTQ2 PARK2-For 5’-CTGTGTGACAAGACTCAATGATCG PARK2-Rev 5’-CCGGTTGTACTGCTCTTCTCC | |
| POLR2F | PolR2Fprobe 5’FAMCTTCATCCTCCTCCACATCATCAAAGTCGTCG-RTQ-1 PolR2F-f 5’-ATGTCAGACAACGAGGACAATTTTG PolR2F-r 5’-TCTTCGGCATTCTCCAAGTCATC | |
| PSMB6 | PSMB6-probe 5’-FAM-AGCCGAGAAGTTTCCACTGGGACCACTATC-RTQ-1 PSMB6-f 5’-CGGAGGCGTTCACTCCAG PSMB6-r 5’-TCGATTGGCGATGTAGGACC | |
| SNCA | NACPprobe 5’-ROX-TGTTCTCTATGTAGGCTCCAA-RTQ2 NACP-f 5’-AGCAGGAAAGACAAAAGAGG NACP-r 5’-TTGCTCTTTGGTCTTCTCAG | |
| ST13 | ST13probe 5’-ROX-CCAAGAGGGCCAGTGTCTTCGTCAAA-RTQ2 ST13-f 5’-CCTCGCTTGGCCATTTTGT ST13-r 5’-TGGCAGCATTTGGCTTCTG | |
Статистическая обработка полученных данных проводилась с использованием пакета программ “Statistica for Windows 8.0” (StatSoft, Inc. (2007). STATISTICA (data analysis software system), version 8.0. www.statsoft.com) и программного обеспечения MS Excel 2007 (Microsoft). Для расчета относительных шансов применяли программное обеспечение GraphPad InStat v3.06 (GraphPad Software, Inc.). Для расчёта соответствия распределения генотипов в популяционной выборке закону Харди-Вайнберга использовали программное обеспечение Hardy-Weinberg equilibrium calculator (http://www.oege.org/software/hwe-mr-calc.shtml).
Для оценки относительных уровней экспрессии генов использовали метод сравнения пороговых уровней амплификации. Данные анализировали с применением непараметрических тестов (U-тест Манна-Уитни, тест Колмогорова-Смирнова).
Результаты исследования.
Анализ точковых мутаций и однонуклеотидных полиморфизмов в генах при болезни Паркинсона.
ДНК-чиповые технологии являются весьма перспективным подходом для поиска и определения генетических маркеров риска развития самых разнообразных заболеваний, в том числе и БП. Основная задача, которую ставят перед собой учёные в таких исследованиях, как полногеномный анализ ассоциаций или более детальный анализ генов, основанных на ДНК-чиповых технологиях, заключается в поиске генетических маркеров, которые бы показали чёткую связь маркера и развития спорадической формы БП. Это позволило бы быстро, надёжно и с малыми затратами выявлять лиц с предрасположенностью к БП из всей популяции. В рамках поиска и анализа генетических маркеров БП мы также решили изучить распределение частот генотипов некоторых ТМ и ОНП в генах, так или иначе вовлечённых в патогенез БП.
Анализ ТМ и ОНП в настоящей работе проводили с помощью, так называемой, реакции удлинения праймера, Arrayed Primer Extension – APEX.
При создании этого чипа были выбраны наиболее часто (более чем в двух семьях) встречающиеся ТМ в генах моногенных форм БП и целый ряд ОНП, расположенных в генах, вовлечённых в патогенез данного заболевания. Таким образом, мы проанализировали 68 точковых мутаций и 31 ОНП в генах PARK2, PARK7, LRRK2, PINK1, STH/Tau haplotype, MAPT, UCHL1, NR4A2 (NURR1), PSEN1, SNCB, WFS1, POMC. Необходимо отметить, что большинство ТМ и ОНП, представленных на чипе, располагается в генах PARK2 и LRRK2, что составляет соответственно более 58% и 19% от всех ТМ и ОНП на чипе.
Данная часть работы проводилась на двух выборках пациентов с БП с ранним началом развития, поскольку считается, что именно у этой группы пациентов генетический фактор в развитии заболевания выражен сильнее. Именно поэтому в первую выборку вошёл 21 пациент с ювенильной формой БП, наследуемой по аутосомно-рецессивному типу. Выбор именно этих пациентов для анализа ТМ и ОНП объясняется большой представленностью на чипе ТМ в гене PARK2, которые приводят к развитию семейных форм БП с ранним началом развития и быстрым прогрессированием. Во вторую выборку вошёл 41 пациент со спорадической формой БП также с ранним началом развития, поскольку считают, что к данной форме БП могут приводить мутации в гене PARK2.
Из 68 изученных нами ТМ мы обнаружили только три различных ТМ в гетерозиготном состоянии в гене PARK2 у трёх различных пациентов со спорадической БП с ранним началом развития. Ранее было показано, что эти три ТМ (M1L, A82G и C253Y) в гене PARK2 приводят в гомозиготном состоянии к развитию БП с наследованием по аутосомно-рецессивному типу. Частоты генотипов по выявленным нами ТМ представлены в таблице 3. Частота встречаемости ТМ в гене PARK2 у пациентов с БП из российской популяции составила 0,05.
Таблица 3. Частоты генотипов выявленных точковых мутаций.
| Ген, ТМ | Впервые обнаружена | Пациенты со спорадической формой БП |
| PARK2 | ||
| M1L (AA/AT/TT) | (Rawal и др., 2003) | 0,976/0,024/0 |
| A82G (CC/CA/AA) | (Hedrich и др., 2001) | 0,976/0,024/0 |
| C253T (GG/GA/AA) | (Oliveira и др., 2003) | 0,976/0,024/0 |
Согласно литературным данным, различные ТМ в гене PARK2 в разных популяциях (Польша, Италия, Турция, Бразилия, Куба, Северо-Западная Индия, Северная Америка, Австралия) приводят к развитию БП с ранним началом развития реже, чем делеции и дупликации экзонов в этом гене. К тому же, авторы подчёркивают, что существует большое разнообразие ТМ в гене PARK2, каждая из которых сама по себе встречается довольно редко (Abbas и др., 1999, Bertoli-Avella и др., 2005, Koziorowski и др., 2010, Sun и др., 2006, Vinish и др., 2010). Таким образом, можно предположить, что для российской популяции также характерна крайне высокая микрогетерогенность исследованных нами ТМ.
Нам также удалось выявить 12 ОНП (из 31 представленного на чипе) в генах PARK2, NR4A2, LRRK2 и PARK7. Частоты генотипов выявленных ОНП отражены в таблице 4. Для оценки возможного вклада выявленных нами ОНП в развитие БП мы провели сравнительный анализ распределения генотипов по этим ОНП в центральной европейской популяции (данные по популяции CEU, central Europe, из проекта по картированию гаплотипов HapMap) (http://www.ncbi.nlm.nih.gov/snp/) с полученными нами результатами, что также отражено в таблице 4. Как видно из таблицы 4, частоты как аллелей, так и генотипов большинства выявленных нами ОНП для российских пациентов почти равны или совпадают с таковыми в центральной Европе (CEU).
Таблица 4. Частоты генотипов и аллелей выявленных ОНП.
| Ген, ОНП | Европейская популяция (численность) | Пациенты с ювенильной формой БП | Пациенты со спорадической формой БП |
| PARK2 | |||
| S167N (rs1801474) (GG/GA/AA) | 0,967/0,033/0 (120) | 0,952/0,048/0 | 0,951/0,049/0 |
| V380L (rs1801582) (CC/CG/GG) | 0,683/0,300/0,017 (90) | 0,81/0,19/0 | 0,927/0,073/0 |
| D394N (rs1801334) (CC/CT/TT) | 0,883/0,117/0 (90) | 1/0/0 | 0,902/0,098/0 |
| NR4A2 (NURR1) | |||
| N16PinsG (AA/AG/GG) | Нет данных | 0,524/0,476/0 | 0,634/0,366/0 |
| LRRK2 | |||
| N551K (rs7308720) (CC/CG/GG) | 0,883/0,117/0 (174) | 0,952/0,048/0 | 0,927/0,073/0 |
| P1542S (rs33958906) (CC/CT/TT) | Нет данных | 0,762/0,238/0 | 0,805/0,195/0 |
| L153L (rs10878245) (CC/CT/TT) | 0,367/0,467/0,167 (174) | 0,667/0,333/0 | 0,366/0,341/0,293 |
| I723V (rs10878307) (AA/AG/GG) | 0,833/0,150/0,017 (174) | 1/0/0 | 0,927/0,073/0 |
| rs7966550 (TT/TC/CC) | 0,750/0,200/0,050 (174) | 0,952/0,048/0 | 0,951/0,049/0 |
| R1514Q (rs35507033) (GG/GA/AA) | С = 0,980; Т = 0,020 (24) | С = 0; Т = 0 | С = 0,976; Т = 0,024 |
| S461S (rs35847451) (TT/TC/CC) | Нет данных | 0,952/0,048/0 | 0,976/0,024/0 |
| PARK7 (DJ-1) | |||
| R98Q (rs71653619) (GG/GA/AA) | G = 0,980; A = 0,020 (24) | G = 0,976; A = 0,024 | G = 0,988; A = 0,012 |
Однако необходимо отметить, что для двух ОНП в генах LRRK2 и PARK2 у пациентов с БП из России характерна большая встречаемость частых аллелей именно в гомозиготном состоянии. Так встречаемость генотипа ТТ ОНП rs7966550 в гене LRRK2 и генотипа СС ОНП rs1801582 (V380L) в гене PARK2 у российских пациентов была больше, чем в европейской выборке (см. таблицу 4).
Таким образом, на основе первых результатов, полученных в ходе APEX, можно было сделать предположение, что два ОНП в генах LRRK2 и PARK2 (rs7966550 и rs1801582 (V380L), соответственно) могут влиять на риск развития БП в российской популяции. Поэтому мы решили исследовать распределения генотипов по этим ОНП на более представительной выборке пациентов со спорадической формой БП и контрольной выборке из российской популяции. Анализ ОНП в гене PARK2 мы проводили с помощью ПЦР в реальном времени. Для этого нами была разработана система «праймеры-зонды» (с помощью программы Beacon designer 7.0) и подобраны условия амплификации. Для анализа ОНП в гене LRRK2 мы применили метод полиморфизма длин рестрикционных фрагментов.
Результаты более детального анализа ОНП rs1801582 и rs7966550 в генах LRRK2 и PARK2 с помощью ПЦР в реальном времени и анализа полиморфизма длин рестрикционных фрагментов представлены в таблице 5. Как видно из представленных данных, частоты и аллелей, и генотипов по обоим ОНП rs1801582 (PARK2) и rs7966550 (LRRK2) у пациентов со спорадической формой БП совпадают с таковыми в контрольной выборке. Таким образом, проведённый нами более детальный анализ не подтвердил наличие ассоциаций ОНП rs1801582 и rs7966550 в генах PARK2 и LRRK2 с БП.
Таблица 5. Частоты аллелей и генотипов ОНП в генах LRRK2 и PARK2.
| Аллели, N (f) | Генотипы, N (f) | Отношение рисков (95% доверительный интервал (CI)) | P value | ||||
| LRRK2 rs7966550 | T | C | TT | TC | CC | ||
| Пациенты со спорадической формой БП | 596 (0,89) | 72 (0,11) | 266 (0,80) | 64 (0,19) | 4 (0,01) | 1,16 (0,80 -1,69) | 0,44 |
| Контроль | 386 (0,88) | 54 (0,12) | 169 (0,77) | 48 (0,22) | 2 (0,01) | ||
| PARK2 rs1801582 | G | C | GG | GC | CC | ||
| Пациенты со спорадической формой БП | 578 (0,84) | 114 (0,16) | 238 (0,69) | 102 (0,29) | 6 (0,02) | 1,16 (0,85-1,58) | 0,38 |
| Контроль | 363 (0,81) | 83 (0,19) | 148 (0,66) | 67 (0,30) | 8 (0,04) | ||
N - количество
f - частота
Анализ дополнительных однонуклеотидных полиморфизмов в генах SNCA и MAPT.
Согласно последним данным полногеномных исследований ассоциаций, далеко не последнюю роль в развитии БП могут играть ОНП в генах SNCA и MAPT (Gandhi and Wood, 2010). Так неоднократно была показана ассоциация некоторых ОНП в гене SNCA и локусе MAPT с риском развития данного заболевания, тем более, что эти гены вовлечены в патогенез БП. Поэтому на основе анализа работ по полногеномному исследованию ассоциаций (Edwards и др., 2010, Simon-Sanchez и др., 2009, Simn-Snchez и др., 2009) мы выбрали ещё два ОНП в генах SNCA и WNT3, расположенном рядом с MAPT, – rs2736990 и rs415430 соответственно. Полиморфизм rs2736990 расположен в самом длинном интроне гена SNCA, и, вероятно, может влиять на регуляцию экспрессии этого гена. Функция гена WNT3 пока неизвестна, но белок, кодируемый этим геном, относят к семейству секретируемых сигнальных белков, принимающих участие в некоторых процессах при эмбриогенезе (Liu и др., 1999). Однако, несмотря на это, полиморфизм rs415430 ассоциируют с локусом гена MAPT.
ОНП rs2736990 и rs415430 были проанализированы на тех же выборках, что и предыдущие два в генах PARK2 и LRRK2, с помощью ПЦР в реальном времени. Результаты, полученные нами в ходе этого этапа работы, представлены в таблице 6.
Таблица 6. Частоты аллелей и генотипов ОНП в генах SNCA и MAPT/WNT3.
| Аллели, N (f) | Генотипы, N (f) | Отношение рисков (95% доверительный интервал (CI)) | P value | ||||
| SNCA rs2736990 | C | T | CC | CT | TT | (СС+СТ)/ТТ | |
| Пациенты со спорадической формой БП | 354 (0,52) | 332 (0,48) | 88 (0,26) | 178 (0,52) | 77 (0,22) | 1,70 (1,17-2,48) | 0,01 |
| Контроль | 198 (0,44) | 250 (0,56) | 48 (0,21) | 102 (0,46) | 74 (0,33) | ||
| MAPT/WNT3 rs415430 | A | G | AA | AG | GG | (AA+AG)/GG | |
| Пациенты со спорадической формой БП | 611 (0,88) | 83 (0,12) | 268 (0,77) | 75 (0,22) | 4 (0,01) | 0,17 (0,01-3,18) | 0,16 |
| Контроль | 402 (0,90) | 46 (0,10) | 178 (0,79) | 46 (0,21) | 0 | ||
N - количество
f - частота
Как видно из таблицы 6, присутствие аллеля С в ОНП rs2736990 в гене SNCA достоверно повышает риск развития БП. Таким образом, нам удалось показать чёткую ассоциацию полиморфизма rs2736990 в гене SNCA с риском развития спорадической формы БП в российской популяции. Мы получили соотношение шансов OR = 1,70 при доверительном интервале (95% CI) 1,172,48 и достоверности p = 0,01, что отражает повышение риска развития БП у носителей аллеля С почти в два раза. Распределение генотипов в популяционной выборке соответствует закону Харди-Вайнберга при Х2 = 1,32 и р = 0,25. Кроме того, наши данные также сопоставимы с результатами полногеномных исследований Simn-Snchez и др. и Edwards и др. (OR = 1,29 при p = 0,01, OR = 1,27 при р = 6,1710-13 и OR = 1,23 при р = 2,2410-16), полученных на больших выборках пациентов с БП (более 2000 и 1700 человек соответственно) (Edwards и др., 2010, Simon-Sanchez и др., 2009, Simn-Snchez и др., 2009), что свидетельствует о действительном влиянии данного ОНП на риск развития БП в российской популяции.
Разные группы исследователей сообщают, что различные полиморфизмы в локусе MAPT влияют на риск развития БП. Так в одной из недавних работ Simon-Sanchez и др. было показано, что ОНП rs415430 в гене WNT3, расположенном в локусе MAPT, может влиять на риск развития БП (отношение шансов 1,34 при р = 4,510-8) (Simon-Sanchez и др., 2009). Поэтому мы также решили сравнить распределение генотипов этого полиморфизма у русских пациентов со спорадической формой БП и в популяционном контроле. Тем не менее, несмотря на обнадёживающие результаты Simon-Sanchez и др. (Simon-Sanchez и др., 2009), нам не удалось показать ассоциации полиморфизма rs415430 в гене WNT3 с риском развития БП в российской популяции.
Анализ изменения экспрессии генов GSK3B, SLC6A3, MAPT, PARK2, SNCA, ST13.
Первые клинические симптомы БП появляются после гибели 60-80% ДА нейронов компактной части чёрной субстанции головного мозга и 80%ого уменьшения содержания ДА в скорлупе (Bernheimer и др., 1973, Cookson и др., 2008). Однако даже в настоящее время большинство современных методов диагностики БП на ранних стадиях, особенно на доклинической, не дают возможности однозначно поставить диагноз. В связи с этим, поиск и разработка новых доступных методов диагностики пресимптоматических стадий БП, в том числе биомаркеров в крови, позволят выявлять людей, находящихся в группе риска развития БП. Далее уже в этой группе будет возможно проводить более дорогостоящие уточняющие исследования. В частности, такими маркерами БП могут быть относительные уровни экспрессии генов-кандидатов в клетках периферической крови. Поэтому нами был проведён анализ относительной экспрессии генов-кандидатов GSK3B, SLC6A3, MAPT, PARK2, SNCA, ST13 в периферической крови в двух группах пациентов с БП на ранних стадиях, получавших лечение и не получавших его, и в трёх группах сравнения (пациенты с церебральным атеросклерозом, с различными неврологическими заболеваниями и контрольная группа здоровых добровольцев). Подбор групп сравнения осуществлялся таким образом, чтобы патогенез заболевания у пациентов из группы сравнения принципиально отличался от такового при БП, но затрагивал в основном ЦНС.
Для анализа экспрессии выбранных генов-кандидатов с помощью программы Beacon designer 7.0 нами были подобраны системы «праймеры-зонд» (кроме гена ST13 (Dong и др., 2005)) и условия амплификации, где в качестве матрицы использовали РНК, выделенную из мозжечка и гиппокампа мозга человека. Также для каждой пары «ген-кандидат – ген сравнения» были проведены эксперименты по проверке систем «праймеры-зонд» согласно руководству Applied Biosystems (Applied Biosystems, 2001).
Анализ изменения экспрессии генов SLC6A3, MAPT и PARK2.
Нам не удалось выявить стабильной и выраженной экспрессии генов SLC6A3, MAPT, PARK2 в крови, несмотря на то, что разные исследователи находят транскрипты генов SLC6A3 и PARK2 в крови (Frankhauser и др., 2006, Tan и др., 2005c). В некоторых образцах мы наблюдали экспрессию этих генов, хотя пороговые циклы амплификации были больше 35, что свидетельствует об очень малом количестве кДНК и, соответственно, РНК в образце.
В ходе предварительных экспериментов по подбору условий работы и проверке систем «праймеры-зонд» с помощью ПЦР в реальном времени с использованием тотальной РНК из мозжечка и гиппокампа человека было показано, что системы для всех трёх генов (SLC6A3, MAPT, PARK2) оказались рабочими. На рисунке 1 на примере анализа экспрессии гена PARK2 в головном мозге (мозжечке) человека (тёмная кривая) показана работоспособность этих систем. Для сравнения на рисунке 1 также представлена кинетическая кривая, полученная в ходе ПЦР в реальном времени, где матрицей служила РНК, выделенная из периферической крови одного из пациентов с БП (светлая кривая).

Рисунок 1. Кинетические кривые, полученные в ходе ПЦР с кДНК гена PARK2.
Тёмная кривая – в качестве матрицы использовали РНК из мозга человека
Светлая кривая – в качестве матрицы использовали РНК из периферической крови
И – относительная интенсивность флуоресценции
Ц – циклы амплификации
Таким образом, можно предположить, что гены SLC6A3, MAPT и PARK2 экспрессируются в крови незначительно, а количество их транскриптов находится ниже порога чувствительности используемого нами метода.
Анализ изменения экспрессии генов GSK3B, SNCA и ST13.
Как уже было сказано ранее, ген GSK3B может быть вовлечён в патогенез БП и, следовательно, отражать ход её развития. Поэтому мы провели анализ изменения экспрессии гена GSK3B в периферической крови. Результаты исследования относительной экспрессии этого гена представлены на рисунке 2.
Из представленных данных видно, что в крови пациентов с БП как получавших, так и не получавших лечение, практически не наблюдается изменения количества транскриптов гена GSK3B (медианы 1,03 и 0,91 соответственно) по сравнению с группой здоровых добровольцев.
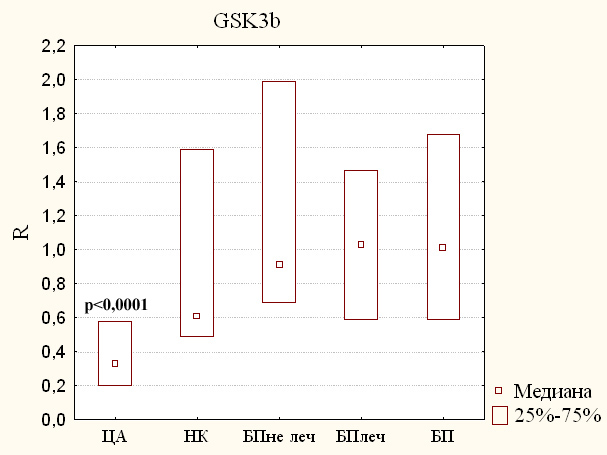
Рисунок 2. Относительные уровни экспрессии гена GSK3B у пациентов с БП, НК и ЦА по сравнению с контрольной группой.
ЦА – пациенты с церебральным атеросклерозом;
НК – пациенты с различными неврологическими заболеваниями (неврологический контроль)
БП(не леч) – пациенты с БП, не получавшие лечения;
БП(леч) – пациенты с БП, получавшие лечение;
БП – все пациенты с БП;
R – относительный уровень экспрессии гена GSK3B
За единицу принят уровень экспрессии гена GSK3B в группе неврологически здоровых добровольцев.
В тоже время в крови пациентов с ЦА было выявлено значительное снижение относительной экспрессии гена GSK3B (рисунок 2). При этом у данных больных наблюдалось статистически значимое уменьшение уровня мРНК гена GSK3B в три раза, и полученные результаты являются статистически значимыми (0,33, p < 0,001).
Уровень экспрессии этого гена в крови пациентов с различными неврологическими заболеваниями также оказался сниженным, однако, это изменение количества транскриптов гена GSK3B не было статистически значимым (0,61, р = 0,24).
Более того, изменения уровней экспрессии гена GSK3B могут носить неспецифический характер, так как мы обнаружили снижение экспрессии гена GSK3B у пациентов с церебральным атеросклерозом (рисунок 2). Эти изменения можно объяснить повреждением и гибелью нейронов вследствие нарушения кровообращения в головном мозге. Выбор именно этой группы сравнения объясняется тем, что патогенез церебрального атеросклероза принципиально отличается от такового при БП, но затрагивает в основном ЦНС.
Таким образом, на основании наших данных можно сделать вывод о том, что уровни экспрессии гена GSK3B не могут служить биомаркером пресимптоматической или ранних стадий БП.
Сейчас уже ни у кого не вызывает сомнения тот факт, что альфа-синуклеин вовлечён в патогенез БП. В связи с этим, изменение экспрессии гена SNCA может служить маркером данного заболевания. Поэтому мы исследовали количества транскриптов гена SNCA в периферической крови пациентов с БП и пациентов и здоровых добровольцев из групп сравнения.
Результаты исследования относительной экспрессии гена SNCA представлены на рисунке 3. Из представленных данных видно, что в крови всех пациентов с БП как подвергавшихся лечению, так и не подвергавшихся, наблюдается статистически значимое увеличение количества транскриптов гена SNCA почти в три и более раз. Для объединённой группы пациентов с БП медиана составила 5,57, для групп пациентов с БП, не подвергавшихся и подвергавшихся лечению, медианы составили 2,85 и 7,32 (р < 0,0005), соответственно, по сравнению с группой здоровых добровольцев.
В тоже время в крови пациентов с ЦА и НК также было выявлено статистически значимое увеличение относительной экспрессии гена SNCA по сравнению с контрольной группой (рисунок 3). При этом у данных больных наблюдалось увеличение уровня мРНК гена SNCA более чем в два раза (2,34 и 2,86 соответственно, p < 0,0001). Однако такое увеличение количества транскриптов в группах пациентов с неврологическими заболеваниями оказалось меньше, чем в группе пациентов с БП, особенно подвергавшихся лечению.
Мы также показали статистически значимое увеличение экспрессии гена альфа-синуклеина более чем в три раза в крови пациентов с БП, подвергавшихся и не подвергавшихся лечению (рисунок 3). Однако эти изменения не являются специфичными для БП. Количество транскриптов гена SNCA также увеличивалось и в группах пациентов с церебральным атеросклерозом и различными неврологическими заболеваниями (рисунок 3). Не исключено, что повышение экспрессии этого гена является реакцией на стресс и связано с шаперонной функцией альфа-синуклеина или какой-либо до сих пор неизвестной функцией этого белка.
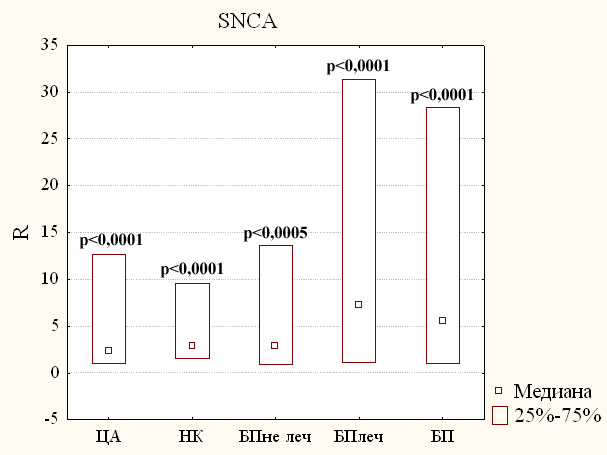
Рисунок 3. Относительные уровни экспрессии гена SNCA у пациентов с БП, НК и ЦА по сравнению с контрольной группой.
ЦА – пациенты с церебральным атеросклерозом;
НК – пациенты с различными неврологическими заболеваниями (неврологический контроль)
БП(не леч) – пациенты с БП, не получавшие лечения;
БП(леч) – пациенты с БП, получавшие лечение;
БП – все пациенты с БП;
R – относительный уровень экспрессии гена SNCA
За единицу принят уровень экспрессии гена SNCA в группе неврологически здоровых добровольцев.
Таким образом, можно заключить, что уровень экспрессии этого гена не может служить биомаркером ранних стадий БП.
Ген ST13 и, следовательно, белок ST13 также может играть роль в патогенезе БП, так как было показано его косвенное участие в сборке альфа-синуклеина (Scherzer и др., 2007). Более того, ранее также было показано уменьшение экспрессии гена ST13. В связи с этим, мы также исследовали изменения экспрессии гена ST13 в периферической крови пациентов с БП и с другими заболеваниями и здоровых добровольцев. Результаты исследования относительной экспрессии гена ST13 представлены на рисунке 4. Из представленных данных видно, что в крови пациентов с БП как получавших, так и не получавших лечение, не наблюдается статистически значимых изменений количества транскриптов гена ST13 (медианы 1,02 и 1,44 соответственно) по сравнению с группой здоровых добровольцев.
Однако в крови пациентов с ЦА было выявлено статистически значимое изменение относительной экспрессии гена ST13 (рисунок 4). При этом у данных больных наблюдалось уменьшение уровня мРНК гена ST13 в 2,63 раза (0,38, p < 0,0001). Количество транскриптов гена ST13 в группе пациентов с различными неврологическими заболеваниями также оказалось сниженным почти в 2 раза (0,60, р < 0,05).
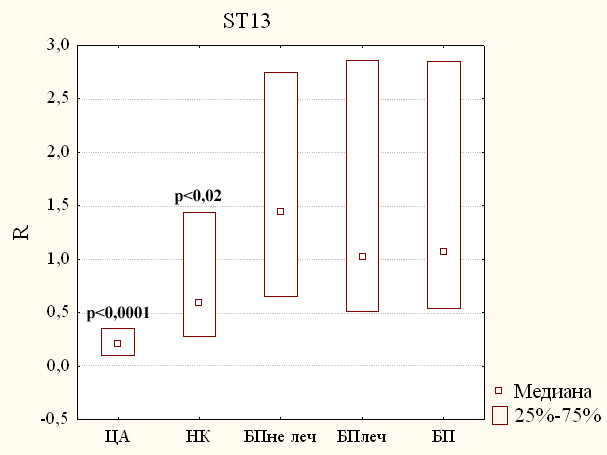
Рисунок 4. Относительные уровни экспрессии гена ST13 у пациентов с БП, НК и ЦА по сравнению с контрольной группой.
ЦА – пациенты с церебральным атеросклерозом;
НК – пациенты с различными неврологическими заболеваниями (неврологический контроль)
БП(не леч) – пациенты с БП, не получавшие лечения;
БП(леч) – пациенты с БП, получавшие лечение;
БП – все пациенты с БП;
R – относительный уровень экспрессии гена ST13
За единицу принят уровень экспрессии гена ST13 в группе неврологически здоровых добровольцев.
Как уже было сказано, ранее Scherzer и др. показали, что уровень транскриптов этого гена уменьшается у пациентов с БП (Scherzer и др., 2007). Однако в отличие от предыдущих исследователей мы не обнаружили значимых изменений в экспрессии этого гена у наших пациентов с БП, как подвергавшихся лечению, так и не подвергавшихся. Это можно объяснить тем фактом, что мы исследовали кровь пациентов, находящихся на более ранних стадиях заболевания. Большинству наших пациентов, не подвергавшихся лечению, диагноз БП был поставлен в то же время, когда производили забор крови. У всех наших de novo пациентов была первая или вторая стадия БП по шкале Хен и Яра. Более того, у русских пациентов с БП, подвергавшихся лечению, уровень экспрессии гена ST13 также не отличался от контроля (рисунок 4). Однако даже пациенты, подвергавшиеся лечению, находились не более чем на 2-й стадии болезни. Изменения же в экспрессии этого гена, наблюдаемые Scherzer и др., вероятно возникают на более поздних стадиях заболевания: 2,3 по шкале Хен и Яра (Scherzer и др., 2007).
К тому же, изменения количества транскриптов гена ST13 могут быть неспецифичными, так как мы обнаружили статистически значимое снижение экспрессии гена в группах пациентов с церебральным атеросклерозом и различными неврологическими заболеваниями (рисунок 4). Эти изменения можно объяснить повреждением и смертью нейронов вследствие нарушения микроциркуляции.
К сожалению, в мировой литературе практически нет никаких данных о том, влияет ли лечение на экспрессию гена ST13 или нет. Также нет и данных по изменению экспрессии этого гена при цереброваскулярной патологии.
Таким образом, на основании наших данных можно заключить, что уровни экспрессии гена ST13 также не могут служить биомаркером на досимптоматической и ранних стадиях БП.
ЗАКЛЮЧЕНИЕ
Болезнь Паркинсона – второе по распространённости нейродегенеративное заболевание после болезни Альцгеймера. В настоящее время БП неизлечима, однако сейчас разработаны методы коррекции симптомов БП, позволяющие существенно облегчать протекание заболевания и продлевать жизнь. Эффект такого лечения тем лучше, чем раньше начата терапия. В связи с этим актуальным становится вопрос о возможности ранней (доклинической) ДНК-диагностики этого заболевания с целью проведения профилактического лечения. Поэтому особенно актуальными являются задачи поиска и разработки биомаркеров для раннего и доклинического выявления данной патологии. Такого рода биомаркеры позволят выявлять лиц, находящихся в группе риска развития БП. Одним из возможных способов выявления групп риска является поиск и анализ генетических маркеров БП, например, ТМ и ОНП в генах, вовлечённых в патогенез данного заболевания. Также выявлять людей, находящихся в группе риска развития БП, возможно позволят и такие биомаркеры в периферической крови, как относительные уровни экспрессии генов, вовлечённых в патогенез БП.
В настоящей работе мы проанализировали распределение ТМ и различных генотипов ОНП в генах, связанных с развитием БП, в группе пациентов с БП и контрольной группе из российской популяции. Нам удалось выявить только три ТМ в гетерозиготном состоянии у трёх различных пациентов со спорадической формой БП, что свидетельствует о высокой микрогетерогенности ТМ в российской популяции и необходимости ресиквенса экзонов ключевых генов, принимающих участие в патогенезе БП. Кроме того, нам удалось показать ассоциацию ОНП rs2736990 в гене SNCA с риском развития спорадической формы БП в российской популяции: у носителей аллеля С риск развития БП повышен в 1,70 раза (95% CI: 1,17-2,48 при р = 0,01). В дальнейшем данный ОНП rs2736990 в гене SNCA может быть включён в панель маркеров для определения индивидуального риска развития БП.
В ходе анализа относительных уровней экспрессии генов GSK3B, SLC6A3, MAPT, PARK2, SNCA, ST13 было показано, что только транскрипты генов GSK3B, SNCA, ST13 присутствуют в крови в достаточном для анализа количестве. Изучение экспрессии этих генов позволило выявить разные паттерны уровней их мРНК у пациентов с БП и в группах сравнения, что отражено в таблице 10.
И хотя с одной стороны полученные нами данные по изменению экспрессии генов GSK3B, SNCA, ST13 не могут по отдельности служить биомаркерами БП, однако, с другой стороны эти данные позволяют предположить, что совместный анализ количества транскриптов генов GSK3B, SNCA, ST13, а также других генов, вовлечённых в патогенез БП, в дальнейшем послужит основой для создания панели маркеров для диагностики этого заболевания.
Таблица 10. Направления изменения экспрессии генов GSK3B, SNCA и ST13 у пациентов с БП и в группах сравнения.
| Изменение экспрессии гена | |||
| Заболевание | GSK3B | SNCA | ST13 |
| Болезнь Паркинсона | — | — | |
| Церебральный атеросклероз | |||
| Неврологические заболевания | ~ | ||
- увеличение количества мРНК по сравнению с уровнем мРНК у здоровых добровольцев.
- уменьшение количества мРНК по сравнению с уровнем мРНК у здоровых добровольцев.
— - отсутствие изменения количества мРНК по сравнению с уровнем мРНК у здоровых добровольцев.
Также анализ относительных уровней экспрессии генов GSK3B, SNCA, ST13 позволил высказать рекомендацию использовать в экспериментах по анализу экспрессии генов в периферической крови у пациентов с БП в качестве групп сравнения больных с церебральным атеросклерозом и другими неврологическими заболеваниями.
ВЫВОДЫ
- Анализ 68 известных точковых мутаций в генах моногенных форм болезни Паркинсона выявил в гене PARK2 три мутации (M1L, A82G и C253Y) в гетерозиготном состоянии у трёх различных пациентов со спорадической болезнью Паркинсона с ранним началом развития. Это свидетельствует о малом вкладе известных мутаций в патогенез спорадической формы болезни Паркинсона в России.
- Выявлена ассоциация полиморфизма rs2736990 (C/T) в гене SNCA с риском развития спорадической формы болезни Паркинсона в российской популяции. Показано, что носительство аллеля С по данному полиморфизму повышает риск развития болезни Паркинсона (OR=1,70 при доверительном интервале (95% CI) 1,17-2,48, p=0,01).
- Обнаружено, что уровни мРНК гена ST13 в периферической крови пациентов с болезнью Паркинсона на ранних стадиях и здоровых добровольцев не отличаются. Установлено снижение уровня мРНК данного гена в 2,63 раза (p<0,0001) в периферической крови больных церебральным атеросклерозом.
- Выявлен одинаковый уровень мРНК гена GSK3b в периферической крови пациентов с болезнью Паркинсона на ранних стадиях и здоровых добровольцев. Показано снижение уровня мРНК данного гена в 3 раза (p<0,001) в периферической крови больных церебральным атеросклерозом.
- Обнаружено значительное увеличение уровня мРНК гена SNCA в периферической крови у пациентов с болезнью Паркинсона на ранних стадиях заболевания в 5,57 раза (р<0,0005), у больных церебральным атеросклерозом в 2,34 раза (p<0,0001) и у пациентов с различными неврологическими заболеваниями в 2,86 раза (p<0,0001).
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Shadrina Maria I., Filatova Elena V., Karabanov Aleksey V., Slominsky Peter A., Illarioshkin Sergey N., Ivanova-Smolenskaya Irina A., Limborska Svetlana A., «Expression analysis of Suppression of Tumorigenicity 13 gene in patients with Parkinson Disease». Neuroscience Letters, 473, 2010, pp. 257–259, doi:10.1016/j.neulet.2010.02.061.
2. Е. В. Филатова, М. И. Шадрина, А. В. Карабанов, П. А. Сломинский, С. Н. Иллариошкин, И. А. Иванова-Смоленская, С. А. Лимборская, «Экспрессия гена GSK3B в периферической крови пациентов с болезнью Паркинсона». Молекулярная биология, 45 (3), 2011, с. 461-465.
3. Е.В. Филатова, М.И. Шадрина, Е.Ю. Федотова, П.А. Сломинский, С.Н. Иллариошкин, И.А. Иванова-Смоленская, С.А. Лимборская, Анализ однонуклеотидного полиморфизма rs415430 в гене WNT3 в российской популяции при болезни Паркинсона. Молекулярная генетика, микробиология и вирусология, № 2, 2011, с. 3-4.
4. E.V. Filatova, M.I. Shadrina, A.V. Karabanov, P.A. Slominsky, S.N. Illarioshkin, S.A. Limborska, «Analysis of point mutations and single nucleotide polymorphisms effects on risk of development of Parkinson’s disease in Russia». Abstracts of The Second World Parkinson Congress, Movement Disorders, 25(3), 2010, pp. S616.
5. Филатова Е.В., Шадрина М.И., Карабанов А.В., Сломинский П.А., Иллариошкин С.Н., Лимборская С.А. «Анализ изменения экспрессии кандидатных генов в крови пациентов с болезнью Паркинсона». Материалы VI Съезда Российского общества медицинских генетиков, Медицинская генетика, 2010, стр. 185.
6. Филатова Е.В., Шадрина М.И., Карабанов А.В., Сломинский П.А. «Анализ изменения экспрессии генов NACP и ST13 при болезни Паркинсона». Материалы XII научной конференции молодых учёных по физиологии высшей нервной деятельности и нейрофизиологии, 2008 год, стр. 58.

