Психрофильные морские светящиеся бактерии aliivibrio logei: структура lux-оперона и регуляция типа quorum sensing
На правах рукописи
ХРУЛЬНОВА СВЕТЛАНА АЛЕКСЕЕВНА
Психрофильные морские светящиеся бактерии Aliivibrio logei:
структура lux-оперона и регуляция типа «Quorum sensing»
03.02.07 - Генетика
АВТОРЕФЕРАТ
диссертация на соискание ученой степени
кандидата биологических наук
Москва – 2011
Работа выполнена в лаборатории генетики бактерий ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» (ФГУП «ГосНИИгенетика»).
Научный руководитель:
кандидат биологических наук Манухов Илья Владимирович
ФГУП «ГосНИИгенетика»
Официальные оппоненты:
доктор биологических наук, профессор Хмель Инесса Александровна
Институт молекулярной генетики РАН
доктор биологических наук, профессор Миронов Александр Сергеевич
ФГУП «ГосНИИгенетика»
Ведущая организация:
Учреждение РАН Институт микробиологии им. С.Н. Виноградского РАН
Защита состоится « 22 » ноября ________2011 г. в 14 часов на заседании Диссертационного совета Д 217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г.Москва, 1-й Дорожный проезд, д.1.
С диссертацией можно ознакомиться в библиотеке ФГУП «ГосНИИгенетика».
Автореферат разослан «_20__» октября 2011 г.
Ученый секретарь Диссертационного Совета,
кандидат химических наук Т.Л. Воюшина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы.
В настоящее время представляет интерес исследование обширного семейства психрофильных бактерий. Оптимальная температура роста для психрофильных бактерий 10-150С. Психрофильные бактерии способны расти при 40С, но не растут при температуре выше 300С, в отличие от мезофильных бактерий, которые не растут при 40С и растут при 300С и выше. Среда обитания психрофильных бактерий, как правило, холодные воды морей Арктики и Антарктики.
В настоящей работе в качестве психрофильных бактерий используются морские светящиеся бактерии вида Aliivibrio logei. Бактерии данного вида были нами изолированы в акваториях Белого, Охотского и Берингова морей.
Психрофильные бактерии вида A. logei уникальны, так как помимо основных свойств, характерных для психрофилов, они содержат в своем геноме гены lux-оперона, определяющие способность бактерий люминесцировать. Предполагается, что регуляция экспрессии lux-генов определяется системой типа “Quorum Sensing”(QS), являющейся основной регуляторной системой для многих мезофильных бактерий, в том числе патогенных для человека, животных и растений.
QS– система регуляции, определяет экспрессию группы генов в ответ на увеличение плотности популяции клеток. Различные виды бактерий используют QS для скоординированного ответа, согласованного с плотностью их популяции. Системы регуляции генов типа QS играют ключевую роль во взаимодействии бактерий с высшими организмами, животными и растениями, как при патогенезе, так и при симбиозе. Впервые феномен регуляции генов по типу QS был обнаружен в 1970-е годы у морских бактерий Aliivibrio (ранее Vibrio) fischeri для группы lux-генов, ответственных за биолюминесценцию клеток (Nealson & Hastings, 1979). Однако термин QS был впервые введен в обиход значительно позже, в 1994 г (Fuqua W.C., et al 1994).
Lux-оперон морских бактерий A. fischeri является базовым в исследованиях QS систем, а по обозначению белка LuxR, активатора транскрипции генов lux-оперона, было определено семейство LuxR-гомологичных белков – регуляторов QS систем первого типа. В настоящее время остаются открытыми ряд вопросов: 1) об эволюционном происхождении феномена биолюминесценции бактерий; 2) о механизмах стабилизирующего отбора lux-оперонов у свободноживущих видов бактерий. Продолжаются поиски новых вариантов QS систем у бактерий, а также исследования факторов, модулирующих QS ответ бактерий в зависимости от состояния клетки.
В настоящей работе проведено исследование регуляции экспрессии lux–генов у изолированных штаммов A. logei. Впервые показано, что экспрессия lux-генов у этих бактерий осуществляется системой QS.
Кодируемые генами бактериальных lux-оперонов люциферазы в настоящее время широко используются в работах по молекулярной генетике (гены - репортеры), при биохимических анализах, в генно-инженерных работах (селекция) и ряде других. Большое распространение приобрели работы по экологическому мониторингу, тестированию токсических веществ в окружающей среде и в пищевых продуктах, а также разработке и тестированию новых медицинских препаратов с помощью цельноклеточных биосенсоров, которые основаны на транскрипционных слияниях генов бактериальных люцифераз с индуцируемыми стрессовыми промоторами.
Цель и задачи исследований.
Целью данной работы являлось изучение структуры lux-оперона и механизмов регуляции экспрессии генов lux-оперонов морских люминесцирующих психрофильных бактерий A. logei.
Для достижения поставленной цели было необходимо решить следующие задачи:
- Изолировать штаммы психрофильных люминесцирующих бактерий,
- Определить видовую принадлежность изолированных штаммов.
- Клонировать и секвенировать lux-опероны бактерий.
- Провести сравнение механизмов регуляции экспрессии lux-оперонов психрофильных и мезофильных бактерий рода Aliivibrio.
- Проверить влияние генов «холодового шока» на экспрессию lux-генов A. logei в клетках E. coli
Научная новизна работы.
Анализ видовой принадлежности люминесцирующих штаммов бактерий изолированных в акваториях северных морей, показал широкое распространение морских психрофильных бактерий вида A. logei в акватории северных морей (Белое, Охотское, Берингово моря).
Впервые определена структура lux-оперона у психрофильных светящихся морских бактерий A. logei. В отличие от lux-оперонов мезофильных морских бактерий, содержащих в своём составе одну копию гена luxR, в lux-оперонах психрофильных бактерий содержится две копии гена luxR, причём белки LuxR1 и LuxR2 различаются как по аминокислотной последовательности, так и по активности по отношению к регулируемому ими промотору.
Доказано, что криптическая люминесценция патогенных для лососевых рыб морских бактерий Aliivibrio salmonicida (бактерии люминесцируют лишь при добавлении в среду субстрата люциферазы длинноцепочечного альдегида) связана с дефектом в гене luxD, кодирующем одну из субъединиц редуктазы.
Показано, что для эффективной экспрессии luxCD генов A. logei в клетках E. coli необходим ген «холодового шока» cspA, отвечающий за синтез РНК-шаперона.
Практическая значимость исследования.
Практически значимым результатом работ по изучению люцифераз, различающихся по термостабильности, явилось создание высокочувствительных lux-биосенсоров для определения интегральной токсичности. В работе впервые было проведено сравнение различающихся по термостабильности люцифераз из lux-оперонов морских светящихся бактерий Photobacterium leiognathi, A. logei KCh1 и наземных энтомопатогенных бактерий Photorhabdus luminescens ZM1 с точки зрения возможностей определения общей (интегральной) токсичности.
Использование транскрипционных слияний индуцируемых промоторов (чувствительных к аутоиндукторам (АИ) первого типа) психрофильных бактерий, с генами термостабильных бактериальных люцифераз, в качестве репортерных, позволило создать высокочувствительные, специфически реагирующие на АИ первого типа биосенсоры. Данные биосенсоры в настоящее время применяются для работ по экологическому мониторингу, определению интегральной токсичности наноматериалов. Разрабатываются методики диагностики инфекций, обладающих системами регуляции типа QS в биологических образцах, и в образцах, собранных с потенциально-инфекционных поверхностей, в частности, с медицинского оборудования, посуды и других потенциальных распространителях внутрибольничных инфекций.
Структура работы.
Диссертация изложена на 95 листах машинописного текста, включая 25 рисунков и 6 таблиц. Работа состоит из введения, обзора литературы, экспериментальной части, включающей описание материалов и методов, изложения и обсуждения результатов, выводов и списка используемой литературы. Список литературы включает 120 работ отечественных и зарубежных авторов.
Апробация работы.
Материалы исследования по теме диссертации докладывались на Международной школе-конференции «Генетика микроорганизмов и биотехнология» в 2008 г, на V съезде Вавиловского общества генетиков и селекционеров в 2009 г, на XVII международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов 2010» в 2010г, на 16-м Международном симпозиуме по биолюминесценции и хемилюминесценции в 2010г, Лион, Франция.
Диссертационная работа была апробирована на семинаре секции «Генетика микроорганизмов» Ученого Совета ФГУП «ГосНИИгенетика» 06 октября 2011 г.
Публикации.
По теме диссертации опубликовано четыре печатные работы в ведущих рецензируемых журналах, определенных ВАК.
Содержание работы
1. Идентификация психрофильных морских светящихся бактерий, изолированных в акваториях Белого, Охотского и Берингова морей.
В ходе данной работы были изолированы штаммы морских психрофильных светящихся бактерий: два штамма (BM1, BM2) в акватории Белого моря в районе Ругозерской губы, один штамм (KCh1) в акватории Охотского моря (западное побережье Камчатки) и один штамм (KCh2) в акватории Берингова моря в районе оз. Калагирь (восточное побережье Камчатки). Для идентификации данных штаммов до вида проводили биохимическое тестирование и секвенирование вариабельного участка гена 16S рРНК. Изолированные штаммы фенотипически очень близки бактериям вида A. fischeri, однако, в отличие от бактерий A. fischeri, являются ярко выраженными психрофилами.
В таб. 1 приведены данные по оптимальной температуре роста и биохимическим параметрам (способность к декарбоксилированию лизина, восстановлению нитрата, ферментации D-галактозы и мальтозы) исследуемых штаммов, а также контрольных штаммов A. fischeri MJ-1, МГУ-6, A. logei ATCC2985T и A. salmonicida NCIMB2262т. Все исследуемые штаммы являются психрофильными, т.к. способны к росту при 40С. Биохимические характеристики исследуемых штаммов совпадают с таковыми штаммов A. fischeri и отличаются от таковых штамма A. salmonicida NCIMB2262T
Таблица 1. Температурная зависимость роста и биохимические характеристики изолированных и контрольных штаммов рода Aliivibrio.
| KCh1 | KCh2 | BM1 | BM2 | A. logei ATCC2985T | A.fischeri MJ-1 | A.fischeri МГУ-6 | A.salmonicida NCIMB2262т | |
| рост при: 4°С | + | + | + | + | + | - | - | + |
| 30°С | - | - | - | - | - | + | + | - |
| декарбоксилирование лизина | + | + | + | + | + | + | + | - |
| восстановление нитрата | + | + | + | + | + | + | + | - |
| ферментация: D-галактозы | + | + | + | + | + | + | + | - |
| мальтозы | + | + | + | + | + | + | + | - |
Проведён мульти-генный анализ штаммов BM1, BM2, KCh1, KCh2 с использованием пяти локусов (pyrH, gyrB, rpoA, gapA и recA), области luxAB и 16S рРНК, нуклеотидные последовательности которых сравнивались с гомологичными последовательностями стандартных (референсных) штаммов A. logei ATCC2985T, A. fischeri ATCC7744T и A. salmonicida NCIMB2265T. ПЦР-амплификацию и секвенирование генов проводили с помощью праймеров, указанных в таб. 2.
Таблица 2. Праймеры, использованные в работе, для мульти-генного анализа.
| ген | название праймера | последовательность праймера 5’3’ |
| gapA | gapAfor1 | AAGAGCGCAATGATATTGAAGTTG |
| gapArev1 | TAGCATCGAATACTGAAGTTTGAG | |
| gyrB | 22fVf | GAAGTTATCATGACGGTACTTC |
| 1240rVf | AGCGTACGAATGTGAGAACC | |
| gyrB557f | CAACGHGATGGTGGTACNCACTTAG | |
| gyrB670r | CCTTCACGNGCATCATCACCAGASG | |
| pyrH | pyrH-04-FW | ATGASNACBAAYCCWAAACC |
| PBPRB2966R | GAATCGGCATTTTATGGTCACG | |
| recA | recAforfisc | TCAAATTGAAAAACAATTTGGTAAAGG |
| recArevfisc | ATCTTATCACCATTGTAGCTGTACC | |
| rpoA | rpoA-01-F | ATGCAGGGTTCTGTDACAG |
| rpoA-03-R | GHGGCCARTTTTCHARRCGC | |
| 16S рРНК | REV16S salm | AGCCGGTTTTGTTTCTGCCCTC |
| Dir16S salm | CAACCTTGGCAATCTGTGTGAACA | |
| Lux16SD | CGAGCGGCGGACGGGTGAGTAATG | |
| Lux15SR | TGCAGCCCACTCCCATGGTGTGAC |
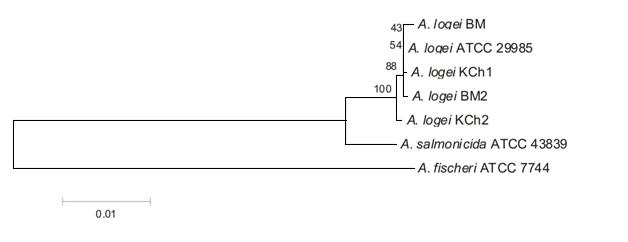
Сравнение результатов секвенирования и дифференциациию до вида проводили с помощью BLAST (http://blast.ncbi.nlm.nih.gov/). Для построения филогенетических деревьев использовали программу MEGA4.0. Филогенетические деревья строились по методу Neighbor-Joining. На рис. 1А представлено филогенетическое дерево, основанное на определении нуклеотидной последовательности четырёх локусов, области luxAB и 16S рРНК гена. Как видно, все четыре исследуемых штамма принадлежат к виду A. logei. Однако необходимо отметить, что при введении в систему мульти-генного анализа последовательности пятого локуса (гена recA) штамм BM2 выпадает из кластера A. logei (рис. 1Б). Наличие больших отличий в последовательности гена recA у разных штаммов A. logei указывает на возможность горизонтального (межвидового) переноса данного гена и необходимость проведения биохимического тестирования при определении видовой принадлежности штаммов рода Aliivibrio.
А
Б
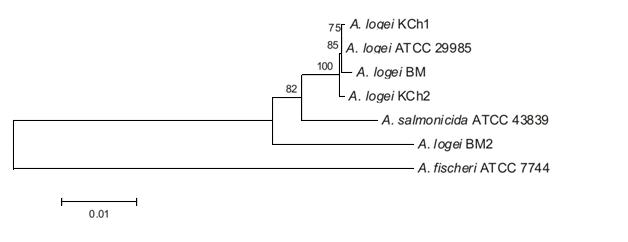
Рисунок 1. Филогенетическое дерево исследуемых штаммов, составленное: А) на основе нуклеотидных последовательностей: четырех локусов (pyrH, gyrB, rpoA, gapA), области luxAB и 16S рРНК гена, Б) на основе нуклеотидных последовательностей: пяти локусов (pyrH, gyrB, rpoA, gapA и recA) области luxAB и 16S рРНК гена.
В данной работе также проведен анализ чувствительности к антибиотикам изолированных штаммов. Чувствительность к антибиотикам обычно рассматривается как вспомогательный признак в систематике бактерий, а их антибиотикограммы можно использовать в таксономии видов бактерий, позволяющие судить о фенотипическом сходстве. Хранящиеся в нашей коллекции бактерии A. fischeri и изолят A. logei KCh1 имеют, в основном, сходный характерный профиль специфической устойчивости к антибиотикам, хотя отмечены и некоторые отличия. Штамм A. logei KCh1 устойчив к аминогликозидным антибиотикам (стрептомицину, неомицину, мономицину) и слабо чувствителен к канамицину и гентамицину, в отличие от бактерий A. fischeri, которые более чувствительны ко многим антибиотикам этого класса.
Анализ биолюминесцентных, биохимических характеристик, а также мульти-генный анализ психрофильных светящихся бактерий штаммов BM1, BM2, KCh1, KCh2 рода показали, что эти штаммы принадлежат виду A. logei. Отметим, что в акваториях Белого, Охотского и Берингова морей бактерии данного вида изолированы впервые.
2. Анализ системы QS регуляции экспрессии lux-генов A. logei.
Бактерии A. fischeri обладают системой QS регуляции, что позволяет давать скоординированный ответ, согласованный с плотностью их популяции. Изолированные штаммы фенотипически очень похожи на бактерии A. fischeri, поэтому мы предположили возможность существования QS регуляции и у бактерий A. logei.
Для детекции системы QS в штаммах BM1, BM2, KCh1, KCh2 использовали следующую методику.
Чтобы зафиксировать наличие гена, кодирующего белок LuxR, активатор транскрипции lux-оперона, в среду с бактериями A. logei (штаммы BM1, BM2, KCh1, KCh2), выросшими до ранней экспоненциальной фазы (ОD = 0,2) при 160С, вносили АИ и продолжали инкубацию клеток c аэрацией, измеряя через определенные интервалы времени интенсивность биолюминесценции клеточной суспензии. На рис. 3А представлены зависимости интенсивности биолюминесценции клеток четырёх штаммов A. logei от времени инкубации (с момента добавления АИ). Как видим, в присутствии АИ бактерии через некоторое время начинают люминесцировать, в то время как контрольные клетки (без добавления АИ) остаются несветящимися. Контрольные образцы не люминесцируют до тех пор, пока не достигнут OD = 0,6-0,8, при которой накопление собственного АИ станет достаточным для активации QS системы.
Чтобы зафиксировать биосинтез АИ клетками A. logei, мы использовали сконструированный ранее lux-биосенсор, специфически реагирующий на АИ: клетки штамма E. coli MC1061, содержащие гибридную плазмиду pVFR1 с генами luxR и luxCDABE. Клетки этого lux-биосенсора начинают люминесцировать лишь при наличии в среде соответствующего АИ. Как видно из рис. 3Б, данный lux-биосенсор начинает люминесцировать как при добавлении в среду N-3-оксо-гексаноил-лактона L-гомосерина, являющегося специфическим АИ для A. fischeri (контроль), так и надосадочной жидкости, полученной в результате центрифугирования суспензии клеток исследуемых штаммов A. logei, выросших до стационарной фазы и характеризующихся высоким уровнем биолюминесценции.
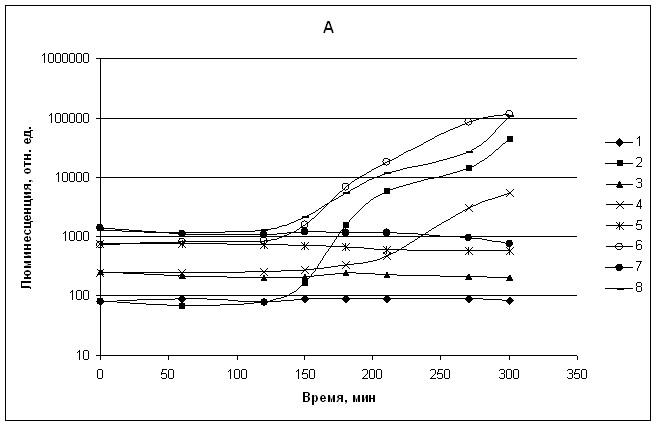
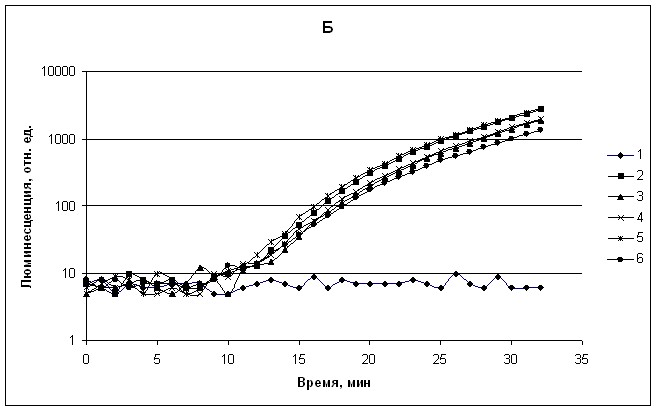
Рис. 3. А) Зависимость интенсивности биолюминесценции клеток четырёх штаммов A. logei от времени (с момента добавления АИ 10-6М) при температуре инкубации 160С: 1 - KCh1, 2 - KCh1 с добавлением АИ, 3 - KCh2, 4 - KCh2 с добавлением АИ, 5 - BM1, 6 - BM1 с добавлением АИ, 7 - BM2, 8 - BM2 с добавлением АИ.
Б) Зависимость интенсивности биолюминесценции клеток E. coli MC1061 (pVFR1) от времени инкубации с момента добавления надосадочной жидкости (получена в результате центрифугирования и фильтрования через 0.22 мкм стационарной культуры исследуемых штаммов). Клетки E. coli росли при 370С до OD 0,3-0,4, после добавления надосадочной жидкости образцы инкубировали при 300C без перемешивания. 1 - без добавления АИ (контроль), 2 – с добавлением АИ, 10–6 М (контроль), 3 – с добавлением надосадочной жидкости от KCh1, 4 - с добавлением надосадочной жидкости от KCh2, 5 - с добавлением надосадочной жидкости от BM1, 6 - с добавлением надосадочной жидкости от BM2.
Отметим, что различие последовательностей в области lux-бокса и промотора, а также в генах luxR у KCh1, KCh2 и A. fischeri не влияет на эффективность действия АИ при индукции экспрессии lux-генов. На рис. 4 приведены зависимости интенсивности биолюминесценции бактерий E. coli MC1061, содержащих плазмиды pVFR1 (регуляторная область lux-оперона A. fischeri), pSV16 (регуляторная область lux-оперона KCh1) и pSV17 (регуляторная область lux-оперона KCh2) от времени инкубации. Как видим, время и амплитуда индукции экспрессии генов lux-оперонов A. fischeri (pVFR1), A. logei, штаммы KCh1 и KСh2 ( pSV16 и pSV17 соответственно) при добавлении АИ в концентрации 10-6 М практически совпадают.
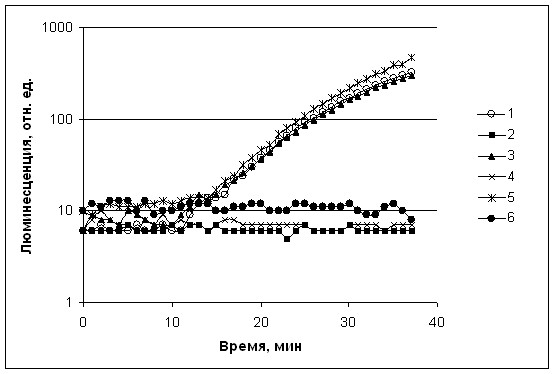
Рисунок 4. Зависимость интенсивности люминесценции от времени инкубации клеток E. coli MC1061, содержащих гибридные плазмиды pSV16 (кривые 1 и 2), pSV17 (кривые 3 и 4) и pVFR1 (кривые 5 и 6). Кривые с номерами 1, 3 и 5 - с добавлением АИ 10-6М, кривые 2, 4 и 6 - без добавления АИ. Клетки инкубировали при температуре 220С
Анализ последовательностей, гомологичных генам luxR и luxI в lux-оперонах штаммов KCh1, KСh2, BM1 и BM2 в совокупности со способностью клеток A. logei к активации биолюминесценции при добавлении в среду АИ (рис 3) доказывает наличие в геноме A. logei генов luxR и luxI, кодирующих активные белки LuxR и LuxI, ответственные за QS регуляцию.
3. Структура и нуклеотидная последовательность lux-оперона A. logei.
На рис. 5 представлены структуры lux-оперонов штаммов BM1 и KCh1 (последовательность lux-оперона GenBank: HQ450520.1), полученные согласно данным секвенирования клонированных фрагментов ДНК, размер которых 11-тпн (плазмиды pSV20 и pSV10.4). Сравнение lux-оперонов этих штаммов с lux-оперонами бактерий видов A. fischeri и A. salmonicida показывает полное сходство структур lux-оперонов A. logei и A. salmonicida и значительные отличия структур этих lux-оперонов от структуры lux-оперона A. fischeri. В отличие от lux-оперона A. fischeri в lux-опероне A. logei присутствуют два гена luxR, ответственных за синтез регуляторного белка LuxR (LuxR1 и LuxR2).
Также в структуре lux-оперона A. logei после первого гена luxR1 отсутствует ген luxI, ответственный за синтез регуляторного белка LuxI. Но непосредственно за геном luxG расположен фрагмент с генами luxR2–luxI.
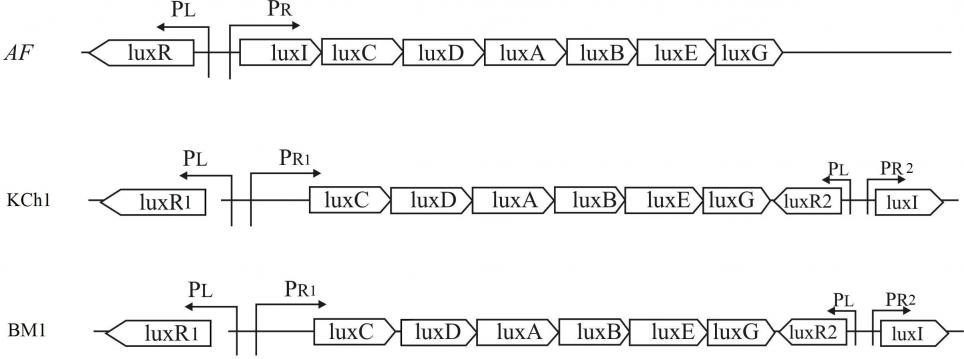
Рисунок 5. Структура lux-оперонов штаммов A. logei KCh1 (KCh1), A. logei BM1 (BM1) and A. fischeri (AF). Гены luxA и luxB кодируют - и -субъединицы люциферазы, гены luxC, luxD и luxE кодируют субъединицы редуктазы; luxR кодирует активатор транскрипции LuxR, luxI кодирует синтетазу, ответственную за синтез АИ.
В нуклеотидной последовательности регуляторной области, содержащей lux-бокс и промотор Pr lux-оперонов A. logei KCh1, A. logei BM1, и A. fischeri, имеет место значительное отличие последовательности A. logei от таковой A. fischeri. Отметим, что в последовательностях A. logei KCh1, A. logei BM1, а также A. logei BM2, A. logei KCh2, вскоре после кодона-инициатора ATG (начальный кодон белка LuxI) расположен стоп-кодон TАA, блокирующий трансляцию полипептида LuxI в клетках этих штаммов (рис.6).
lux-box -10
AF AAGCACCTGTAGGATCGTACAGGTTT-ACGCAAGAAAATGGTTTGTTATAGTCGAATAAA
KCh1 R1 GATACTCTGTAAAGTTATACAGGTTT-ACCTAAATAATTACCCTGCTATAGTTTTCTAAA
KCh1 R2 TCATTCCTGTAATATTGTACAGGTTATAAGGAGGAAATTTGCCTGCTATAGTCAGTTAAA
BM1 R1 GATACTCTGTAAAGTTATACAGGTTT-ACCTAAATAATTACCCTGCTATAGTTTTCTAAA
BM1 R2 TCATTCCTGTAATATTGTACAGGTTATAAGGAGGAAATTTGCCTGCTATAGTCAGTTAAA
RBS luxI stop
AF CG--CAAGGGAGGTTGGTATGACTATAATGATAAAAAAATCGGATTTTTTGGCAATTCCAT
KCh1 R1 ATA--AGGAAGCAGAGTGATGACAATG--ACTTAAAAAGTAGGTTATAAATATTCTCCATC
KCh1 R2 AGATTAAAGGGGGTCAGGATGACAATAATGATAAGAAAATCCGAGTTTACTACTATTCCTA
BM1 R1 ATA--AGGAAGCAGAGTGATGACAATG--ACTTAAAAAGTAGGTTATAAATATTCTCCATC
BM1 R2 AGATTAAAGGGGGTCAGGATGACAATAATGATAAGAAAATCCGAGTTTACTACTATTCCTA
Рисунок 6. Нуклеотидные последовательности регуляторных областей lux-оперонов штаммов A. logei KCh1, A. logei BM1 и A. fischeri (AF R1). Идентичные нуклеотиды отмечены серым цветом. Lux-box, -10, RBS, ATG-кодоны и stop-кодоны подчеркнуты.
4. Сравнительный анализ структур lux-оперонов A. logei и A. salmonicida: природа криптической люминесценции у бактерии A. salmonicida.
Сравнение нуклеотидной последовательности lux-оперона A. logei высоко гомологична таковой lux-оперона A. salmonicida. Как и у A. salmonicida, в структуре lux-оперона у A. logei отсутствует ген luxI перед геном luxC, но непосредственно за геном luxG расположен фрагмент с генами luxR2–luxI (рис.7).

Рисунок 7. Структуры lux-оперонов A. logei, штаммы Kch1 и BM1 (AL), и A. salmonicida (AS)
Однако, в отличие от бактерий A. logei бактерии A. salmonicida характеризуются криптической люминесценцией, т.е. не светят в нормальном состоянии, а начинают светить лишь при добавлении в среду субстрата люциферазы.
Мы предположили, что разница в требовании n-деканаля для индукции биолюминесценции у бактерий KCh1 A. logei и A. salmonicida в основном определяется дефектом в гене luxD у A. salmonicida (рис.8). Как видим, у A. salmonicida в области между генами luxC и luxD делетировано 11 нуклеотидов, в том числе нуклеотиды A и T из кодона-инициатора ATG гена luxC. В результате в белке LuxD делетированы первые 47 а.о., так как новый кодон–инициатор ATG расположен лишь через 141 нуклеотид. У бактерий KCh1 подобная делеция отсутствует и имеет место синтез полноценного белка LuxD.


Рисунок 8. Сравнение нуклеотидной последовательности между luxC и luxD генами в A. fischeri (AF), A. logei (AL KCh1) и A. salmonicida (AS). Идентичные нуклеотиды отмечены серым цветом. ATG-и stop- кодоны подчёркнуты.
Было проведено сравнение активностей белков LuxD A. salmonicida и KCh1. Для этой цели фрагменты ДНК с генами luxCD A. salmonicida и KCh1 были встроены в вектор pUC19 под lac-промотор. Затем гибридные плазмиды были введены в штамм E. coli, содержащий плазмиду pF6 (вектор pACYC184 с генами luxABE A. fischeri).
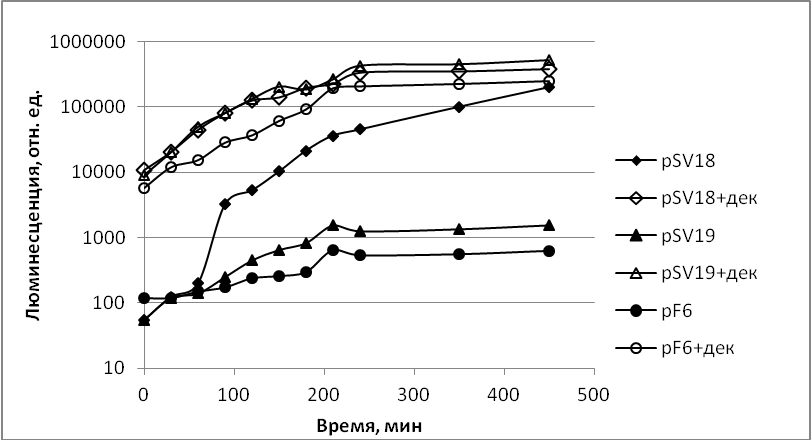
Рисунок 9. Комплементация генов luxABE A. fischeri генами luxCD из A. logei KCh1 и A. salmonicida. Клетки E. coli TG-1 с гибридными плазмидами растили до OD 0,2 при 370C с качанием, затем инкубировали при температуре 160С и измеряли люминесценцию. Кружки - E. coli TG-1 (pF6), Треугольники - E. coli TG-1 (pF6, pSV18), Квадраты - E. coli TG-1 (pF6, pSV19). Полые знаки – без добавления n-деканаля, заполненные – с добавлением. Плазмиды: pF6 – luxABE гены A. fischeri на ori p15, pSV18 – luxCD гены A. logei KCh1, pSV19 – luxCD гены A. salmonicida.
На рис. 9 представлены результаты данного эксперимента. Если клетки E. coli (pF6) в качестве вспомогательной плазмиды содержали плазмиду pSV18 (с генами luxCD KCh1), то наблюдается высокий уровень биолюминесценции, не требующий добавления экзогенного n-деканаля. Если же в клетках E. coli (pF6) в качестве вспомогательной плазмиды содержится pSV19 (с генами luxCD A. salmonicida), то свечение клеток имеет место лишь после добавления в среду n-деканаля. Таким образом, можно сделать вывод, что белок LuxD KCh1 активен, в то время как белок LuxD A. salmonicida неактивен или слабо активен.
Следует отметить, что в данных экспериментах экспрессия luxCD генов A. logei в клетках E. coli наблюдается только при температуре инкубации 10-150С. Подобная температура является оптимальной для роста психрофильных бактерий A. logei, однако клетки E. coli не растут при температуре ниже 200С, хотя и синтезируют ряд белков холодового шока. Была проведена оценка влияния белков холодового шока на экспрессию luxCD генов A. logei в клетках E. coli.
5. Влияние мутации cspA на экспрессию luxCD генов A. logei в клетках E. coli.
Для проверки влияния генов холодового шока на экспрессию luxCD генов A. logei в клетках E. coli было решено использовать мутацию в гене cspA, ответственном за синтез основного белка РНК-шаперона холодового шока.
Для определения влияния мутации cspA на экспрессию luxCD генов A. logei в клетках E. сoli культуры E. coli MG1655 и E.coli MG1655 cspA, содержащие плазмиды pF6 и pSV18, растили при 300С до OD = 0.2-0.3, затем переносили на 150С и инкубировали в течение нескольких часов.
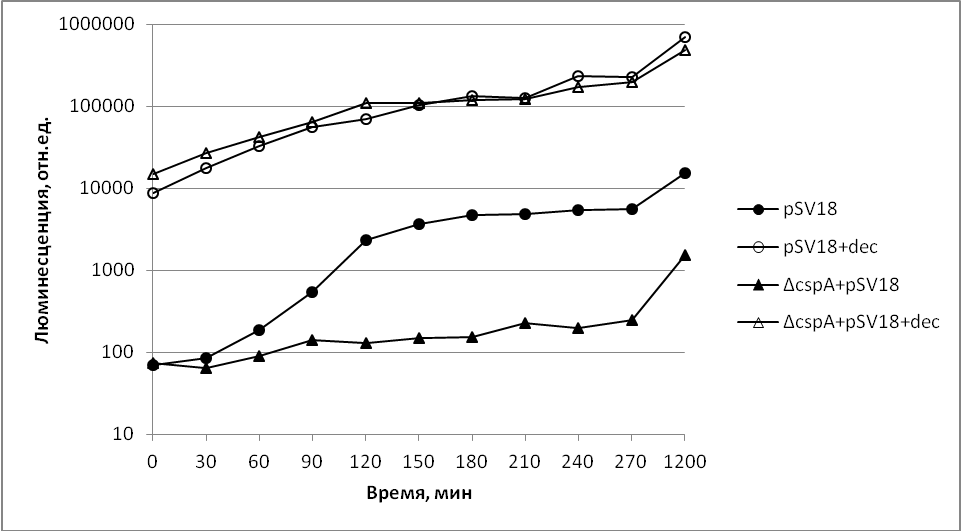
Рисунок 10. Влияние мутации cspA на экспрессию luxCD генов A. logei в клетках E. coli. Кружки - E. coli MG1655 (pSV18), треугольники - E. coli MG1655 cspA (pSV18). Заполненные знаки – без добавления n-деканаля, полые – с добавлением. Плазмида pSV18 – luxCD гены A. logei KCh1, pF6 –luxABE гены A. fischeri.
Как видно на рис.10 в штамме дикого типа E. coli MG1655, содержащем вспомогательную плазмиду pSV18 (с генами luxCD KCh1), имеет место высокое свечение без добавления экзогенного n-деканаля в то время как в клетках штамма-мутанта E. coli MG1655 по гену cspA, ответственному за синтез главного РНК-шаперона в клетках E. coli, уровень биолюминесценции ниже и поднимается при инкубации на 150С на несколько часов позже, чем в штамме дикого типа. Следовательно, можно сделать вывод, что для экспрессии генов luxCD A. logei необходимы холодовой шаперон СspA.
6. Lux-биосенсоры для определения интегральной токсичности и детекции АИ в среде.
В работе впервые было проведено сравнение различающихся по термостабильности люцифераз из lux-оперонов морских светящихся бактерий P. leiognathi, A. logei KCh1 и наземных энтомопатогенных бактерий P. luminescens ZM1 с точки зрения возможностей определения общей (интегральной токсичности). Для этого в штамм E. coli вводились плазмиды, содержащие гены lux-оперонов P. leiognathi, P. luminescens и A. logei. Полученные клетки являются цельноклеточными биосенсорами. Интегральную токсичность соединений с помощью подобных биосенсоров определяют по падению биолюминесценции. Известно, что падение биолюминесценции коррелирует с падением титра клеток. Проводилось сравнение биосенсоров с генами люцифераз из P. leiognathi, P. luminescens и A. logei по чувствительности к токсикантам различной природы. Рекомендовано использовать штамм E. coli MC1061 с плазмидой pSV2, кодирующей гены люциферазы из A. logei для определения токсичности соединений, денатурирующих клеточные белки (Нормативно-методическое обеспечение и средства контроля содержания наночастиц на объектах производственной сферы (ГК № 01.648.12.3010)). На рисунке 11 приведен пример определения токсичности этанола биосенсорами, содержащими люциферазы из P. leiognathi, P. luminescens и A. logei.
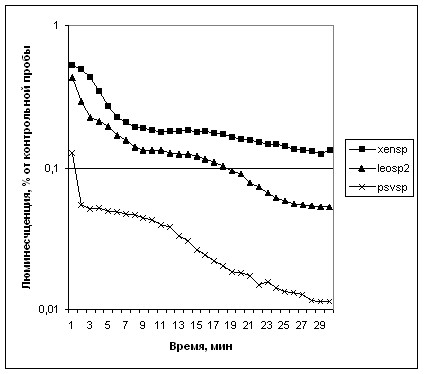
Рисунок 11. Зависимость интенсивности биолюминесценции клеток E. coli MC1061 с плазмидами pLeo1 (с генами люциферазы из P. leiognathi), pXen7 (с генами люциферазы из P. luminescens) и pSV2 (с генами люциферазы из A. logei) от времени инкубации в присутствии этанола (8%).
Ночную культуру растили на 370С с аэрацией, засевали в пробирки 1/50 V и подращивали при 220С без аэрации до OD=0,2. Далее разливали по виалам и после добавления этанола измеряли биолюминесценцию при комнатной температуре в течение 30 мин. Сравнение кинетики падения биолюминесценции биосенсоров с люциферазой из бактерий P. luminescens, A. logei и P. leiognathi показывает, что кинетические характеристики данных биосенсоров в целом совпадают. Однако сравнение амплитуды падения люминесценции для различных токсикантов на вышеуказанных биосенсорах, приведённое на рисунке 11, показывает большую чувствительность lux-биосенсора на основе люциферазы A. logei к токсическим агентам, повреждающим белки клетки. Как видим, в течение 30 минут добавление этанола снижает биолюминесценцию штамма, содержащего lux-гены из A. logei, примерно на два порядка, в то время как люминесценция штамма с lux-генами P. leiognathi снижается лишь в 20, а с lux-генами из P. luminescens в 7 раз.
Для определения АИ в среде были использованы плазмиды, содержащие гены luxCDABE из P. luminescens и регуляторную область с геном luxR в одном случае из A. fischeri (pVFR), в другом из A. logei (pSV16). Данные плазмиды вводились в клетки E. coli MG1655, вследствие чего штамм становился чувствительными к добавлению АИ в среду.
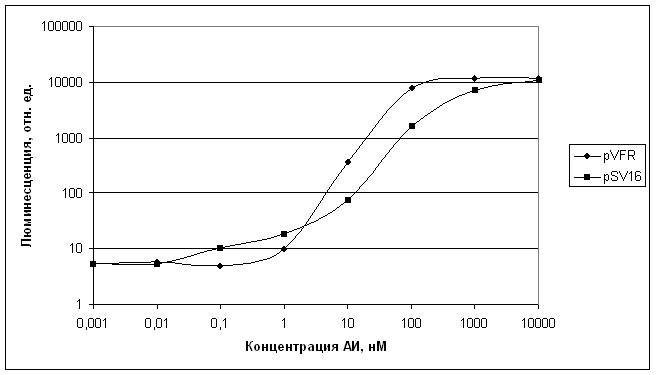
Рисунок 12. Зависимость уровня биолюминесценции биосенсоров от концентрации АИ при выдерживании культур в течение 30 мин с момента добавления АИ. pVFR – клетки E.coli MG1655, содержащие плазмиду с регуляторной областью из A. fischeri, pSV16 – клетки E.coli MG1655, содержащие плазмиду с регуляторной областью из A. logei.
Ночную культуру растили на 370С с аэрацией. Затем засевали в пробирки 1/100 V и подращивали при 370С с аэрации до OD=0,2. Далее разливали по виалам и после добавления АИ измеряли биолюминесценцию при комнатной температуре в течение 30 мин. На рисунке 12 представлены данные зависимости уровня биолюминесценции биосенсоров E.coli MG1655 pVFR и E.coli MG1655 pSV16 от концентрации АИ в среде (30 мин после добавления). Как видим, биосенсор, содержащий регуляторную область и ген luxR из психрофильных бактерий A. logei, характеризуется более высокой амплитудой ответа к малым концентрациям АИ (10-9–10-10М) по сравнению с биосенсором, содержащим регуляторную область из мезофильных бактерий A. fischeri.
Обсуждение результатов
Анализ биолюминесцентных, биохимических характеристик, а также мульти-генный анализ психрофильных светящихся бактерий штаммов BM1, BM2, KCh1, KCh2 рода Aliivibrio (изоляты акваторий Белого, Берингова и Охотского морей) показали, что эти штаммы принадлежат виду A. logei. Отметим, что в акваториях Белого, Охотского и Берингова морей бактерии данного вида изолированы впервые.
Фенотипически бактерии вида A. logei очень близки бактериям вида A. fischeri, однако, в отличие от бактерий A. fischeri, являются ярко выраженными психрофилами, так как растут при 40С и не растут при 300С, что первоначально и послужило выделению этих бактерий в отдельный вид. При исследовании регуляции экспрессии lux–генов у изолированных штаммов A. logei было показано, что экспрессия lux-генов у этих бактерий осуществляется системой QS первого типа как и у бактерий A. fischeri. Стоит отметить, что в структуре lux-оперона A. logei присутствуют две копии гена luxR в отличие от lux-оперона A. fischeri, в котором присутствует только один ген luxR, ответственный за синтез белка LuxR, активатора транскрипции генов lux-оперона. При сравнении нуклеотидных последовательностей в области lux-бокса и промотора, а также в генах luxR у A. logei и A. fischeri было выявлено различие, которое не влияло на эффективность действия АИ при индукции экспрессии lux-генов.
К группе психрофильных, растущих при 40С, морских бактерий относятся также бактерии вида A. salmonicida. Бактерии этого вида привлекают особое внимание исследователей, так как являются патогенными для промыслового атлантического лосося. Длительное время эти бактерии относили к группе несветящихся, и, следовательно, не имеющих в составе генома генов, кодирующих люциферазу. Однако, в работе (Ruby, et.al 1997) было показано, что люциферазные гены luxAB в клетках данного вида присутствуют, так как при добавлении в среду субстрата люциферазы алифатического альдегида суспензия бактерий сильно люминесцировала. В ходе работы показано, что структура lux-оперона в геномах бактерий штаммов A. logei практически идентична (за исключением небольших модификаций в нуклеотидной последовательности) структуре lux-оперона A. salmonicida. Однако, бактерии вида A. logei, как и A. fischeri, в норме ярко люминесцируют, в то время как патогенные бактерии вида A. salmonicida относятся к группе криптически люминесцирующих бактерий, т.е. светящихся лишь при добавлении к клеткам субстрата люциферазы алифатического альдегида.
В работе (Ruby, et.al 1997) высказано предположение о природе криптической люминесценции A. salmonicida. Оно заключается в том, что в транскрипционной модели с правонаправленной транскрипцией от гена luxC к гену luxE синтезируется антисмысловая мРНК по отношению к гену luxR2. И наоборот, левонаправленная транскрипция гена luxR2 продуцирует антисмысловую мРНК по отношению к гену luxE. По нашим данным, такое расположение генов luxE-luxR2 играет роль в способности бактерий A. salmonicida люминесцировать, но не является главной причиной криптической люминесценции. Основную роль в данном процессе играет дефект в гене luxD lux-оперона A. salmonicida, ответственного за синтез одной из субъединиц редуктазы жирной кислоты.
Как известно, для нормальной экспрессии генов психрофильных бактерий требуются РНК-шапероны, необходимые для раскрутки мРНК, которая при низких температурах образует множество биспиральных участков, запрещающих ей инициировать трансляцию. У бактерий E. coli также имеются гены «холодового шока». Эти гены открываются при 15°С. В ходе работы показано, что главный РНК-шаперон E. сoli CspA необходим для трансляции генов lux-оперона психрофильных бактерий A. logei.
Результаты данной работы позволили получить высокочувствительные специфические lux-биосенсоры, основанные как на определении интегральной токсичности образцов, так и на специфической детекции биологически активных молекул. В работе впервые было проведено сравнение термостабильности люцифераз из lux-оперонов морских светящихся бактерий P. leiognathi, A. logei KCh1 и наземных энтомопатогенных бактерий P. luminescens ZM1. Более высокая чувствительность биосенсора, основанного на генах A. logei к агентам, повреждающим клеточные белки, определяется высокой чувствительностью к денатурирующим агентам люциферазы из A. logei. Чувствительность биосенсора, основанного на генах A. logei, к токсическим агентам другой природы сходна с чувствительностью стандартных биосенсорных штаммов, применяемых для определения токсичности соединений по снижению люминесценции.
Использование транскрипционных слияний индуцируемых промоторов (чувствительных к аутоиндукторам первого типа) психрофильных бактерий, с генами термостабильных бактериальных люцифераз из P. luminescens, в качестве репортерных, позволило создать высокочувствительный биосенсор, специфически реагирующий на аутоиндукторы первого типа. Данные биосенсоры характеризуется более высокой амплитудой ответа при добавлении малых концентраций АИ по сравнению с биосенсором, содержащим регуляторную область из мезофильных бактерий A. fischeri.
В настоящее время полученные биосенсорные штаммы применяются в работах по экологическому мониторингу и определению интегральной токсичности наноматериалов. Разрабатываются методики диагностики инфекционных бактерий, обладающих системами регуляции типа QS.
ВЫВОДЫ:
- Показано широкое распространение морских психрофильных бактерий вида A. logei в акватории северных морей (Белое, Охотское, Берингово моря);
- Определена структура lux-оперона A. logei (штаммы Kch1 и BM1);
- Показано наличие системы типа QS первого типа у бактерий A. logei;
- Показано, что различие последовательностей в области lux-бокса и промотора, а также в генах luxR у A. logei и A. fischeri не влияет на эффективность действия АИ при индукции экспрессии lux-генов;
- Показано, что природа криптической люминесценции A. salmonicida обусловлена дефектом в гене luxD.
- Показано, что РНК-шаперон CspA необходим для трансляции генов lux-оперона психрофильных бактерий A. logei.
Список работ, опубликованных по теме диссертации:
- Манухов И.В., Балабанов В.П., Котова В.Ю., Хрульнова С.А., Мелькина О.Е., Крайнов А.А., Пустовойт К.С., Кречетов П.П., Королёва Т.В., Шатров Т.Я., Чалкин С.Ф., Завильгельский Г. Б. Использование lux-биосенсоров для детекции НДМГ в почве. // Двойные технологии 2008, 44(3): с. 50-56
- Хрульнова С.А., Манухов И.В., Зарубина А.П., Завильгельский Г.Б. Aliivibrio logei, штамм KCh1 (изолят Камчатка): биохимические и люминесцентные характеристики, клонирование lux-оперона. // Микробиология. 2010, №. 79, С 349–355.
- Manukhov IV, Khrul'nova SA, Baranova A, Zavilgelsky GB. Comparative analysis of the lux operons in Aliivibrio logei KCh1 (Kamchatka isolate) and Aliivibrio salmonicida. // J Bacteriol. 2011, 193(15):3998-4001.
- Хрульнова С.А., Манухов И.В., Завильгельский Г.Б. “QUORUM SENSING” регуляция экспрессии lux-генов и структура lux-оперона у морских бактерий Aliivibrio logei. // Генетика 2011, т.47, с. 1596–1603.
Материалы конференций:
- Хрульнова С.А., Манухов И.В., Завильгельский Г.Б. Характеристика нового биолюминесцентного штамма рода Vibrio. Материалы международной школы-конференции «генетика микроорганизмов и биотехнология», Пущино, 2008, с.181.
- Хрульнова С.А., Манухов И.В., Зарубина А.П. Структура lux-оперона и основные характеристики нового штамма светящихся морских бактерий рода Aliivibrio. Материалы V съезда Вавиловского общества генетиков и селекционеров, Москва, 2009, с.56.
- Khrul’nova S.A., Manukhov I.V., Zarubina A. P., and Zavilgelsky G. B. Aliivibrio logei strain KCh1 (a isolate of Kamchatka): biochemical and luminescence characteristics, structure features of the lux-operon. //Luminescence 2010; 25: 191
- Хрульнова С.А. Aliivibrio logei, штамм KCh1 (изолят Камчатка): биохимические и люминесцентные характеристики, клонирование lux-оперона. Материалы XVII международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов 2010», Москва, 2010г, с.189

