Гидроксилирование свободных l-аминокислот в бактериях.
На правах рукописи

СОКОЛОВ ПАВЕЛ МИХАЙЛОВИЧ
Гидроксилирование свободных L-аминокислот в бактериях.
03.01.03 – Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2012
Работа выполнена в Лаборатории №3 Закрытого Акционерного Общества «научно-исследовательский институт Аджиномото-Генетика» (ЗАО «АГРИ»)
Научный руководитель:
кандидат биологических наук, С.В. Смирнов
зав. лаб. №3, ЗАО «АГРИ»
Официальные оппоненты:
доктор биологических наук, профессор, Л.И. Патрушев
Институт биоорганической химии РАН
кандидат биологических наук, Л.В. Генинг
Учреждение Российской академии наук
Институт молекулярной генетики РАН
Ведущая организация:
Учреждение Российской академии наук
Центр “Биоинженерия” РАН
Защита диссертации состоится «18» декабря 2012 года в 1400 на заседании Диссертационного совета Д.217.013.01. при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, д.1.
С диссертацией можно ознакомиться в библиотеке ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов».
Автореферат диссертации разослан «15» ноября 2012 года.
Ученый секретарь
Диссертационного Совета, Т.Л. Воюшина
Кандидат химический наук, доцент
Общая характеристика работы.
Актуальность проблемы.
Среди многочисленных природных источников биологически активных молекул, царство бактерий занимают особое место. Вторичный метаболизм этих вездесущих обитателей нашей планеты является практически неиссякаемым источником новых химических соединений, находящих широкое применение в органической химии, агрохимии и медицине. Являясь “системообразующими элементами” сложных биоценозов, бактерии обладают индивидуальным паттерном взаимодействия с окружающим биотическим компонентом, посредством синтеза и передачи “химических эффекторов”, конечными акцепторами которых являются как про- так и эукариотические клетки. Именно среди таких “эффекторных” вторичных метаболитов бактерий были найдены разнообразные антибиотики (включая фунгициды и инсектициды), иммунодепрессанты, антиоксиданты, противоопухолевые цитостатики и антидиабетические препараты (Strobel & Daisy, 2003, Uzair, et al., 2012).
В отличие от биологически активных веществ растений, единственным способом промышленного производства которых в большинстве случаев является их экстракция с последующей дорогостоящей очисткой, аналогичные соединения бактериального происхождения могут быть эффективно синтезированы с помощью современных методов генной/метаболической инженерии непосредственно в клетках бактерии-источника и/или других микроорганизмов, широко используемых в биотехнологии: E. coli, B. subtilis, C. glutamicum (Xu, et al., Adkins, et al., 2012, Jiang, et al., 2012, Yang & Cao, 2012, Ye & Bhatia, 2012).
Одним из примеров такой биотехнологической “редукции” является создание штамма E. coli, способного к эффективной биотрансформации L-изолейцина в 4-гидроксиизолейцин (4-HIL) (Smirnov, et al., 2010). 4-HIL является биологически активным веществом растительного происхождения, которое обладает свойствами регулятора синтеза глюкозы в адипоцитах, секретагога и сенсибилизатора действия инсулина, а также, инсулиномиметика (Broca, et al., 2000, Jette, et al., 2009, Jaiswal, et al., 2012). Ключевым этапом данной работы было клонирование гена L-изолейцин-4-гидроксилазы (IDO) из природного изолята Bacillus thuringiensis (Kodera, et al., 2009). В ходе дальнейших исследований выяснилось, что в отличие от фенугрека (Trigonella foenum-graecum L.), клетки которого накапливают 4-HIL, в Ваcillus thuringiensis 4-HIL является промежуточным соединением в синтезе вторичного метаболита 2-амино-4-кето-3-метил-пентановой кислоты (АМКП), проявляющей свойства антибиотика (Perlman, et al., 1974, Ogawa, et al., 2011).
IDO является членом Pfam-семейства белков PF10014 (другое свое название - BsmA, семейство получило от одноименного фактора формирования биопленок и стрессоустойчивости из E. coli), насчитывающим около 200 известных гомологов IDO в диапазоне изменения величины E (параметр BLAST) от 710-179 до 1. Белки семейства PF10014 широко распространены среди бактерий, занимающих разные экологических ниши и обладающих различными типами метаболизма: от метилотрофных морских анаэробных бактерий, до агрохимически значимых фитопатогенов. Этот факт позволил нам предположить, что диоксигеназы семейства PF10014 обладают не менее широким диапазоном регио/субстратной специфичности, включая способность гидроксилировать свободные канонические L-аминокислоты.
Актуальность проблемы поиска новых гидроксилаз свободных L-аминокислот определяется следующими основными факторами.
Во-первых, учитывая уникальные свойства 4-HIL, можно предположить, что и другие гидроксилированные L-аминокислоты могут проявлять агрохимически значимую антибиотическую активность и/или обладать уникальными фармакологическими свойствами.
Во-вторых, гидроксилированные по метильным и метиленовым группам свободные L-аминокислоты могут быть использованы в тонкой химической технологии/нанотехнологии в качестве новых биогенных синтонов для органического синтеза (Blaskovich, et al., 1998).
В-третьих, предложенная нами ранее биотехнология гидроксилирования L-изолейцина методом динамической биотрансформации, позволяет существенно упростить синтез целевых продуктов при наличии соответствующих Fe(II)/-кетоглутарат-зависимых диоксигеназ (Smirnov, et al., 2010). Таким образом, любая новая диоксигеназа, синтезирующая новую, биологически активную гидроксилированную аминокислоту, может быть непосредственно использована для ее промышленного синтеза с помощью указанного выше метода.
И, наконец, учитывая, что 65–85% патогенных микроорганизмов образуют устойчивые биопленки резистентные ко многим антибактериальным препаратам и/или физическим факторам воздействия, представляется актуальным поиск новых биогенных “факторов разрушения” этих опасных бактериальных агломератов. Кроме того, изучение белков, участвующих в работе биоценотической сигнальной и/или эффекторной цепи, может привести к неожиданным открытиям и гипотезам в области молекулярной биологии взаимодействия между разными биологическими доменами: например, бактериями и растениями, или бактериями и насекомыми.
Цели и задачи работы.
Целью данной диссертационной работы являлся поиск новых Fe(II)/-кетоглутарат-зависимых диоксигеназ свободных L-аминокислот.
В ходе работы решались следующие задачи:
- Эвристический поиск вероятных Fe(II)/-кетоглутарат-зависимых диоксигеназ свободных L-аминокислот среди белков Pfam семейств PF10014 и PF13640 методами современной биоинформатики; клонирование и экспрессия селектированных генов в E. coli, очистка соответствующих ферментов.
- Биохимический анализ активности очищенных белков: определение их субстратной специфичности и кинетических параметров; очистка и идентификация продуктов реакций.
Научная новизна и практическая значимость работы.
На основании эвристического анализа семейства белков PF10014 были найдены и охарактеризованы новые Fe(II)/-кетоглутарат-зависимые диоксигеназы, катализирующие С-4-гидроксилирование L-изолейцина, L-лейцина, L-треонина, С-5 гидроксилирование L-лейцина и окисление L-метионина до сульфоксида L-метионина. Кинетические параметры найденных диоксигеназ теоретически позволяют использовать эти ферменты для синтеза соответствующих гидроксиаминокислот по методу, описанному в работе (Smirnov, et al., 2010).
Было показано, что экспрессия гена L-треонин-4-гидроксилазы из фитопатогена Agrobacterium vitis S4 в штамме E. coli c инактивированным геном дегидрогеназы 4-фософоэритроновой кислоты (pdxB) восстанавливает рост клеток на минимальной солевой среде, без добавления витамина B6. Было установлено, что данный эффект строго зависит от способности штамма E. coli (pdxB) синтезировать эндогенный L-треонин. Данный результат позволяет предположить существование нового, эритрозо-4-фосфат-независимого пути биосинтеза витамина B6.
На основании анализа генетической организации оперонов, включающих гены белков семейства PF10014 из фитопатогенных бактерий родов Pantoea и Pseudomonas, было предсказано и экспериментально доказано существование новой L-изолейцин-4’-гидроксилазы, принадлежащей к не охарактеризованному до сих пор Pfam семейству белков PF13640 и новой L-4’-гидроксиизолейцин-4-гидроксилазы из семейства BsmA. Было показано, что оба фермента образуют уникальный окислительный каскад, приводящий последовательно к синтезу L-4’-гидроксиизолейцина и L-4’,4-дигидроксиизолейцина - новых биогенных гидроксилированных форм L-изолейцина.
На основании полученных результатов выдвинут ряд гипотез о физиологической роли С-4-гидроксилирования свободных L-аминокислот в бактериях, экспериментальное подтверждение которых будет иметь большое практическое и теоретическое значение.
Публикации и апробация работы.
По теме диссертации опубликовано 5 печатных работ в научных журналах, входящих в перечень ВАК РФ, оформлена 1 патентная заявка РФ №2011144625, с решением о выдаче патента от 4 июля 2012 г. Материалы, вошедшие в диссертацию докладывались автором на конкурсе работ молодых сотрудников ЗАО «АГРИ» (июль 2010, июнь 2012) и были представлены им на двух конференциях (Москва, Россия, 2009; Daegu, Republic of Korea, 2012).
Диссертационная работа была апробирована на совместном семинаре секции «Молекулярная биология» Ученого совета ФГУП ГосНИИгенетика и НТС ЗАО «АГРИ» 9 октября 2012 года.
Структура и объем работы.
Диссертация состоит из 6 разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждения», «Выводы» и «Список цитируемой литературы». Работа изложена на 110 страницах, включая 40 рисунков и 11 таблиц. Список цитируемой литературы содержит 150 источников.
Основное содержание работы.
1. Эвристический поиск вероятных Fe(II)/-кетоглутарат-зависимых диоксигеназ свободных L-аминокислот среди белков Pfam семейства PF10014.
На первом этапе работы перед нами стояла задача структурирования множества гомологов IDO на вероятные изофункциональные подмножества с их последующей аннотацией для окончательного выбора генов-кандидатов. Очевидно, что в такой постановке, эта задача не может быть эффективно решена (с минимальными время- и трудозатратами) только методами, основанными на выравнивании аминокислотных последовательностей. Данное утверждение основано на многочисленных исследованиях подобного рода, проведенных ранее в нашей лаборатории. Однако, чтобы убедиться в этом на конкретном примере данной работы, попробуем провести следующий “ретроспективный” анализ.
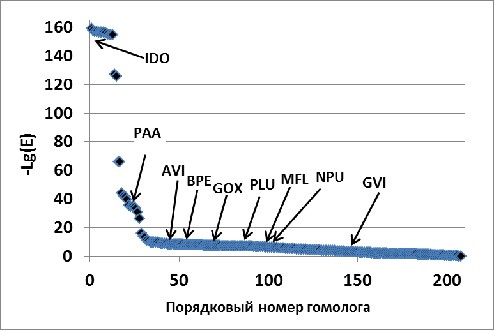
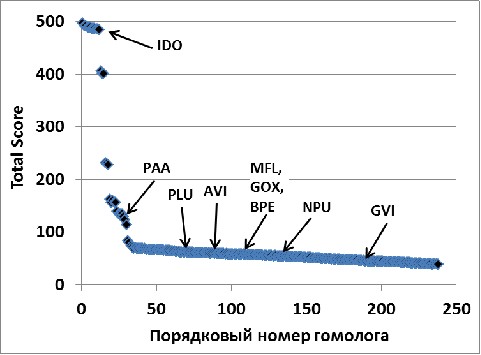
На рисунке 1 представлены результаты “апостериорного” распределения исследованных в работе диоксигеназ среди рядов гомологов IDO, полученных с помощью BLAST, PSI-BLAST (Altschul, et al., 1997) и HMMER (Finn, et al., 2011). Хорошо видно, что ВLAST и HMMER дают практически одинаковые результаты, “равномерно распределяя” все диоксигеназы L- аминокислот, отличных от L-изолейцина, (MFL, GOX, AVI, BPE, NPU) в “cлаборазрешимую” по параметрам Total Score (TS) или E value область ряда гомологов IDO (Рис. 1, А, Б). Таким образом, чтобы “случайно” обнаружить все указанные выше ферменты, мы должны были бы последовательно исследовать порядка 200 белков.
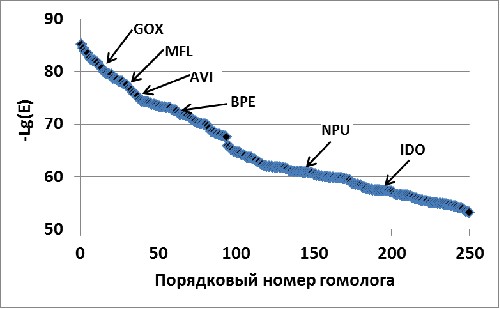
Анализ с помощью PSI-BLAST (10 итераций) примерно в два раза сокращает область поиска диоксигеназ свободных L-аминокислот (MFL, GOX, AVI, BPE, NPU) и позволяет выделить гомологи с отличной субстратной специфичностью (GVI, PLU, PAA; Рис. 1, В; более подробно см. ниже). Однако, и в этом случае, необходимо было бы экспериментально исследовать активность и субстратную специфичность около 100 белков, что практически трудновыполнимо.
Поэтому, в качестве дополнительного инструмента стратификации семейства PF10014 мы использовали сравнительный функциональный анализ генетической организации оперонов, включающих гены гомологов IDO из PF10014. В основе данного подхода лежит вероятностная аннотация субстратной специфичности белка (в нашем случае диоксигеназы), на основе функциональной аннотации целого оперона, которая, в свою очередь, базируется на аналогичном анализе составляющих его генов. Последняя информация, как правило, черпается из аннотаций соответствующих геномов и/или известных литературных данных.
Вся аналитическая работа была проведена нами с помощью научного интернет-ресурса MicrobesOnline (Dehal, et al., 2009) в рамках которого, для всех секвенированных бактериальных геномов графически представлены структуры вероятных оперонов и даны интерактивные ссылки на функциональную аннотацию входящих в них генов.


Отправной точкой нашего поиска стал функциональный анализ оперона из Bacillus thuringiensis, в состав которого входит ген IDO (Рис. 2,  1). Вся совокупность экспериментальных данных полученных нами ранее (Kodera, et al., 2009, Ogawa, et al., 2011), а также анализ научной литературы (Perlman, et al., 1977, Livshits, et al., 2003) свидетельствовали о том, что данный оперон отвечает за индуцибельный синтез и экскрецию AMKП клетками Bacillus thuringiensis. АМКП (предположительно - “химический эффектор”) синтезируется из L-изолейцина в две стадии за счет активности IDO и АМКП-редуктазы (AR), после чего, экскретируется из клетки с помощью транспортера RhtA (Livshits, et al., 2003) (Рис. 2, 1). Опероны с аналогичной структурой были обнаружены нами также в геномах Bacillus cereus AH603 и Bacillus weihenstephanensis KBAB4 и ряда других бактерий рода Bacillus. Идентичность гомологов IDO из этих микроорганизмов достаточно высока и составляет порядка 98% (см. Рис. 1, А, В). Интересно отметить наличие трансляционного сопряжения генов IDO и AR, дополнительно свидетельствующее о координации синтеза двух белков. Таким образом, мы отнесли все гомологи IDO, входящие в опероны с подобной структурой к первой группе I.
1). Вся совокупность экспериментальных данных полученных нами ранее (Kodera, et al., 2009, Ogawa, et al., 2011), а также анализ научной литературы (Perlman, et al., 1977, Livshits, et al., 2003) свидетельствовали о том, что данный оперон отвечает за индуцибельный синтез и экскрецию AMKП клетками Bacillus thuringiensis. АМКП (предположительно - “химический эффектор”) синтезируется из L-изолейцина в две стадии за счет активности IDO и АМКП-редуктазы (AR), после чего, экскретируется из клетки с помощью транспортера RhtA (Livshits, et al., 2003) (Рис. 2, 1). Опероны с аналогичной структурой были обнаружены нами также в геномах Bacillus cereus AH603 и Bacillus weihenstephanensis KBAB4 и ряда других бактерий рода Bacillus. Идентичность гомологов IDO из этих микроорганизмов достаточно высока и составляет порядка 98% (см. Рис. 1, А, В). Интересно отметить наличие трансляционного сопряжения генов IDO и AR, дополнительно свидетельствующее о координации синтеза двух белков. Таким образом, мы отнесли все гомологи IDO, входящие в опероны с подобной структурой к первой группе I.
Следующие по степени гомологии с IDO белки (идентичность порядка 40%) формируют отдельную группу вероятных диоксигеназ из грамотрицательных фитопатогенов родов Pantoea, Pseudomonas, и Rahnella (см. Рис. 1, А, Б). В геномах этих бактерий мы обнаружили аналогичное сопряжение экспрессии генов IDO и AR. В клетках Pseudomonas, трансляционно-сопряженный тандем IDO-AR экспрессируется вместе с транспортером RhtA и другими синтетическими генами (более подробно см. далее пункт 3) под контролем LysR подобного регулятора транскрипции (Schell, 1993) (Рис. 2, 3). Опероны из Pantoea и Rahnella структурированы аналогично, однако, эволюционно утратили ген RhtA (Рис. 2, 2). Гомологи IDO из этих микроорганизмов мы отнесли ко второй группе.
Абстрагируясь от второстепенных деталей, можно отметить принципиальное сходство функционально-структурной организации оперонов из групп I и II. В каждом случае, мы имеем дело с индуцибельным синтезом гомологов IDO, биосинтетических ферментов (включая AR) и специфического транспортера, обеспечивающего экскрецию низкомолекулярных метаболитов (аминокислот или их близких аналогов). Таким образом, мы предположили, что опероны из II группы могут быть вовлечены в процесс синтеза и секреции “химических эффекторов”, являющихся производными гидроксилированных L-аминокислот, которые синтезируются с помощью гомологов IDO.
Данное обобщение дало нам ключ к поиску вероятных диоксигеназ аминокислот в “слаборазрешенной” области рядов гомологов IDO, полученных с помощью BLAST и HMMER. Мы предположили, что в процессе параллельного переноса генов с их последующей эволюционной адаптацией к физиологии конкретного микроорганизма данные опероны сохранили общее функциональное свойство: синтез экскретируемых “химических эффекторов”, одним из этапов которого, является гидроксилирование L-аминокислоты. Если это так, то структура таких оперонов из других бактерий должна была сохранить свои “главные фамильные черты”: наличие генов биосинтетических ферментов, включая IDO и гена белка-экспортера.
Действительно, дальнейший поиск выявил ряд оперонов из Agrobacterium vitis S4, Bordetella petrii DSM 12804, Vibrio vulnificus YJ016 и Sideroxydans lithotrophicus ES-1, в которых гены гомологов IDO и специфических транспортеров, принадлежащих семействам RhtA и RhtB (Kutukova, et al., 2005) под контролем LysR. Ген AR при этом был, по-видимому, утрачен (Рис. 2, 4-6). Эти белки были отнесены нами к третьей группе.
Гомологи IDO из Gluconacetobacter diazotrophicus PAl 5 и Pseudomonas fluorescens Pf0-1, отнесенные нами к четвертой группе, экспрессируются в составе оперонов, предположительно участвующих в многостадийном синтетическом процессе вторичного метаболизма, одной стадией которого, может быть гидроксилирование L-аминокислоты (Рис. 2, 7-8; группа 4).
Гомологи IDO из Burkholderia oklahomensis EO147, Burkholderia pseudomallei 668, Photorhabdus luminescens subsp. laumondii TTO1, Nostoc punctiforme PCC 73102 и Photorhabdus asymbiotica ATCC 43949, отнесенные нами к пятой группе, экспрессируются вместе с белками нерибосомального синтеза полипептидов (Рис. 2, 9; группа V). Хорошо известно, что многие антибиотики/токсины пептидной природы содержат гидроксилированные остатки L-аминокислот или их производных. Более того, анализ литературных данных позволил нам предположить, что гомолог IDO NPU из Nostoc punctiforme PCC 73102 гидроксилирует L-лейцин и участвует в синтезе циклического полипептида (Becker, et al., 2004).
К сожалению, остальные проанализированные нами геномы (например, Gluconobacter oxydans 621H и Methylobacillus flagellatus KT) содержали гены гомологов IDO, не входящие в состав каких-либо оперонов. Мы включили эти белки в шестую группу (Рис. 2, 10). В этом случае, у нас опять не было дополнительного критерия для выбора генов-кандидатов. Однако, сравнительный анализ рядов гомологов IDO, полученных с помощью PSI-BLAST (на основе последовательности IDO) и JACKHMMER (на основе выравнивание IDO и наиболее вероятных гидроксилаз свободных аминокислот: PAA, группа II; AVI, BPE, группа III, NPU, группа V). (Рис. 1, В и Г), выявил группу белков (включавшую GOX и MFL), которые принадлежали к определенной нами выше группе VI и оказались среди первых членов обоих рядов “выше” всех гомологов IDO, на которых было построено выравнивание для JACKHMMER. Полученный результат свидетельствовал, что эти белки также могут гидроксилировать L-аминокислоты.
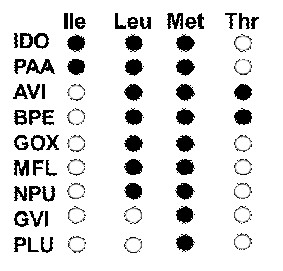
Таким образом, руководствуясь предложенной выше системой классификации гомологов IDO, мы выбрали восемь ферментов для дальнейшего анализа: IDO (группа I); PAA (группа II); AVI, BPE (группа III); PLU, NPU (группа V); MFL, GOX, и GVI (группа VI). (Таблица 1). Выбор конкретных белков из групп II (PAA), и VI (GOX, MFL) был обусловлен биотехнологической значимостью соответствующих микроорганизмов: Pantoea ananatis (Hara, et al., 2011), Gluconobacter oxydanse (Deppenmeier & Ehrenreich, 2009), и Methylobacillus flagellatus KT (Chistoserdova, et al., 2007). Гомологи GVI и PLU были выбраны случайным образом.
| Таблица 1. Гомологи IDO из PF10014, отобранные для исследования их субстратной специфичности. | ||||
| Абрев. | Ссылка 1) | Организм | E value 2) | Идентичность, % 2) |
| IDO | ADJ94127.1 | Bacillus thuringiensis 2-e-2 | 7e-179 | 100 |
| PAA | BAK13117.1 | Pantoea ananatis AJ13355 | 7e-36 | 37 |
| AVI | ABG82019.1 | Agrobacterium vitis S4 | 4e-09 | 24 |
| PLU | NP_929149.1 | Photorhabdus luminescens subsp. laumondii TTO1 | 1e-08 | 25 |
| BPE | YP_001629976.1 | Bordetella petrii DSM 12804 | 2e-07 | 25 |
| GOX | YP_192070.1 | Gluconobacter oxydans 621H | 4e-07 | 25 |
| MFL | YP_546733.1 | Methylobacillus flagellatus KT | 8e-07 | 23 |
| NPU | YP_001866034.1 | Nostoc punctiforme PCC 73102 | 5e-06 | 26 |
| GVI | NP_925548.1 | Gloeobacter violaceus PCC 7421 | 2e-03 | 22 |
| 1) Номер в GenBank или в NCBI RefSeq; 2) Параметры BLAST. | ||||
2. Клонирование генов-кандидатов, их экспрессия в E. coli и очистка соответствующих рекомбинантных белков.
Гены, кодирующие IDO, PAA, GOX, MFL и NPU были получены путем ПЦР-амплификации соответствующих участков геномов Bacillus thuringiensis 2-e-2, Pantoea ananatis AJ13355, Gluconobacter oxydans 621H и Methylobacillus flagellatus KT, Nostoc punctiforme PCC 73102 соответственно.
Фрагменты ДНК, содержащие структурные части генов AVI, BPE, GVI, и PLU, были химически синтезированы фирмой SlonoGene™ и получены нами в составе плазмид pSlo-X (X=AVI, BPE, GVI, и PLU).
Все полученные гены были клонированы в составе экспрессионного вектора pET15(b+) (Novagen, США) или pQE80L (Qiagen, Германия) таким образом, чтобы обеспечить трансляцию соответствующих белков, слитых с N-концевой гексагистидиновой аффинной меткой (His6Tag). Сконструированные таким образом плазмиды pET15-HT-X(X=IDO, PAA, GOX, MFL, AVI, BPE, GVI, и PLU) и pQE80L-HT-NPU были введены в штаммы E. coli BL21(DE3) и JM109 соответственно. Во всех случаях, нами наблюдался эффективный синтез растворимых His6Tag-меченых белков, которые были очищены до видимой гомогенности из грубых клеточных лизатов соответствующих плазмидных штаммов с помощью IMAC (метал-аффинной хроматографии).
3. Определение субстратной специфичности гомологов IDO.
Этот этап нашей работы начался с анализа субстратной специфичности гомологов IDO. С этой целью, каждый из девяти отобранных нами белков был исследован на способность гидроксилировать 20 канонических L-аминокислот методом анализа продуктов реакций с помощью тонкослойной хроматографии на силикагеле. В результате мы обнаружили, что новые соединения, содержащие аминогруппу, образуются в реакциях гидроксилирования с L-изолейцином (PAA), L-лейцином (все ферменты за исключением GVI и PLU), L-метионином (все ферменты, однако активность PLU была незначительна) и L-треонином (BPE, AVI) (Рис. 3).
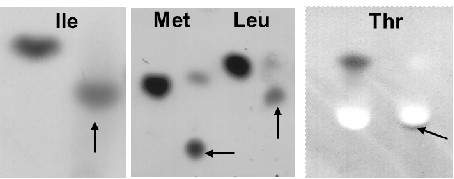

Предварительный анализ новых гидроксилированных соединений методами ТСХ и ВЭЖХ показал, что продукты окисления L-изолейцина, L-лейцина и L-метионина всеми гомологами за исключением NPU, были идентичны продуктам аналогичных реакций с IDO. В случае IDO, эти продукты были идентифицированы нами ранее как L-4-гидроксиизолейцин, L-4-гидроксилейцин и сульфоксид L-метионина (Hibi, et al., 2011). Для проведения более тщательного анализа, гидроксилированные продукты реакций MFL, GOX, и NPU с L-лейцином были очищены и исследованы методами ВЭЖХ / ЭСИ-МС и 1H-ЯМР. Оба анализа показали, что продуктом реакций с MFL и GOX является L-4-гидроксилейцин а с NPU – L-5-гидроксилейцин (Таблица 2, Рис. 4).
Аналогичным способом было показано, что все ферменты окисляют L-метионин с образованием соответствующего сульфоксида. К сожалению, в силу объективных трудностей, с которыми мы столкнулись в процессе препаративного синтеза и очистки продукта реакции BPE с L-треонином, нам удалось получить только частично очищенный препарат. Его анализ с помощью ЭСИ-МС дал значение (m/z= +136 [M+H]), что соответствовало брутто формуле гидрокситреонина. Кроме того, 1H-ЯМР анализ показал отсутствие C-4-метильной группы в молекуле продукта, что указывало на модификацию L-треонина по С-4 положению. С учетом структуры молекулы L-треонина, все полученные данные указывали на то, что продуктом реакции BPE и AVI с L-треонином является L-4-гидрокситреонин (см. также пункт 5).

| Таблица 2. Идентификация гидроксилированных L-аминокислот с помощью 1H-ЯМР и ЭСИ-МС. | ||
| Вещество | 1H-ЯМР | ЭСИ-МС m/z [M+H] |
| L-4-гидрокситреонин | - | 136 |
| L-4-гидроксилейцин | 1.33(3H, s)<1>, 1.34 (3H, s) <2>, 1.93 (1H, dd, J=15.3, 10.1Hz)<>, 2.11(1H, dd, J=15.3, 3.3Hz)<2>, 3.94 (1H,dd, J=10.1, 3.3Hz)<> | 148 |
| L-5-гидроксилейцин | = 0.88 (3H, d, J = 6.29), 1.54-1.75 (3H, m), 3.33-3.36 (2H, m), 3.57 (1H, dd, J = 3.93, 4.28) | 148 |
| сульфоксид L-метионина | 2.31-2.36(2H, m)<>, 2.75 (3H, s) <>, 2.99-3.12 (2H, m)<>, 3.90 (1H, t, J=6.3)<> | 166 |
4. Определение кинетических параметров ферментативных реакций, катализируемых гомологами IDO.
Все описанные выше эксперименты по гидроксилированию L-аминокислот гомологами IDO были оптимизированы для “препаративного” синтеза продуктов реакций в количестве, достаточном для проведения идентификационного анализа. Поэтому реакции проводились при насыщающих концентрациях субстратов и вне диапазона линейной зависимости выхода продукта от времени реакции. В этих условиях, мы получали информацию только о качественном профиле субстратной специфичности диоксигеназ. Для того чтобы количественно оценить относительное предпочтение фермента к разным субстратам, необходимо знаний их основных кинетических параметров для соответствующих реакций, прежде всего KM и kcat.
| Таблица 3. Кинетические параметры гомологов IDO для реакций гидроксилирования свободных L-аминокислот. | ||||||||
| Субстрат | Гомолог | |||||||
| IDO | PAA | NPU | MFL | GOX | AVI | BPE | ||
| L-Mет | KM 1 | 3.2 ± 0.3 | 1.3 ± 0.5 | ND | 45 ± 9 | 11 ± 2 | 30 ± 6 | 23 ± 6 |
| kcat | 33 ± 1 | 2.9 ± 0.3 | 86 ± 11 | 94 ± 9 | 43 ± 5 | 38 ± 5 | ||
| kcat/KM | 10 ± 1 | 2.3 ± 0.7 | 1.9 ± 0.1 | 8.5 ± 0.7 | 1.4 ± 0.1 | 1.6 ± 0.2 | ||
| L-Лей | KM | 2.3 ± 0.4 | 1.1 ± 0.3 | 0.15 | < 0.3 2 | 0.4 ± 0.1 | 3.7 ± 0.4 | 1.4 ± 0.6 |
| kcat | 7.5 ± 0.3 | 5.2 ± 0.4 | 4.9 | 12 | 26 ± 3 | 24 ± 1 | 14 ± 1 | |
| kcat/KM | 3.2 ± 0.4 | 4.7 ± 0.9 | 32.7 | > 39 | 66 ± 9 | 6.4 ± 0.5 | 10 ± 4 | |
| L-Иле | KM | < 0.3 | 5.1 ± 1.8 | ND 3 | ||||
| kcat | 6 | 4.0 ± 0.4 | ||||||
| kcat/KM | > 19 | 0.8 ± 0.2 | ||||||
| L-Tре | KM | ND | < 0.3 | |||||
| kcat | 5 | |||||||
| kcat/KM | > 17 | |||||||
| 1) Кинетические параметры KM, kcat, и kcat/KM выражены в мМ, мин-1, и мМ-1 мин-1 соответственно; 2) В силу специфики метода измерения активности, мы не могли достоверно определять значения KM если начальная концентрация субстрата была менее 0.3 мМ. Поэтому значение KM < 0.3 мМ означает, что скорость реакции не достигала Vmax/2 при этой концентрации субстрата. 3) ND – не определялось. | ||||||||
С этой целью, следуя методу, изложенному в работе (Luo, et al., 2006), мы провели подробное исследование кинетических параметров гомологов IDO для реакций гидроксилирования свободных L-аминокислот (Таблица 3).
Полученные нами результаты показали, что каждая группа ферментов, определенная нами с помощью эвристического анализа имеет выраженную субстратную специфичность к определенной аминокислоте. Диоксигеназы из 1-ой группы (IDO), преимущественно окисляют L-изолейцин, из 3-й группы (AVI, BPE) - L-треонин, а из 6-ой группы (GOX, BPE) - L-лейцин. Гомолог PAA, представляющий 2-ю группу, продемонстрировал примерно одинаковую кинетику для всех исследованных субстратов. Таким образом, можно предположить, что внутри PF10014 существует подсемейство Fe(II)/-кетоглутарат зависимых диоксигеназ свободных L-аминокислот с тремя “эволюционными аттракторами” субстратной специфичности: L-изолейцин, L-лейцин, L-треонин.
5. Гидроксилирование L-треонина в бактериях как альтернативный путь биосинтеза витамина B6.
В настоящее время известно два метаболических пути синтеза витамина B6. Первый, деоксиксилулозо-5-фосфат-независимый путь обнаружен у большинства известных бактерий, грибов и растений. В этом случае, молекула пиридоксальфосфата синтезируется из рибозо(рибулозо)-5-фосфата, глицеральдегид-3-фосфата(дигидроксиацетона) и амидной группы L-глутамина за счет активности комплекса пиридоксальфосфат синтазы Pdx1/Pdx2 (Рис. 5). Второй, деоксиксилулозо-5-фосфат/эритрозо-4-фосфат-зависимый путь был найден у небольшой группы гамма-протеобактерий, включая E. coli (Fitzpatrick, et al., 2007). В этом случае, пиридоксин синтезируется за счет конденсации деоксиксилулозо-5-фосфата (одного из первых метаболитов MEP-пути синтеза изопреноидов) и аминогидроксиацетон-фосфата, синтезирующегося из эритрозо-4-фосфата (Рис. 5). Одним из промежуточных метаболитов синтеза аминогидроксиацетон-фосфата является 4-фосфогидрокси-L-треонин – фософорилированная форма L-4-гидрокситреонина, синтезируемого диоксигеназами AVI и BPE из Agrobacterium vitis S4 и Bordetella petrii, соответственно.
Считается, что второй путь является метаболической адаптацией к условиям дефицита B6 у бактерий, эволюционно утративших гены пиридоксальфосфат синтазы (Fitzpatrick, et al., 2007). Из рисунка 5 видно, что “стратегия” построения нового деоксиксилулозо-5-фосфат/эритрозо-4-фосфат-зависимого пути синтеза B6 состояла в эволюционной “экзаптации” ферментов GapB, SerC, PdxA, PdxB для синтеза аминогидроксиацетон- фосфата и фермента PdxJ для его конденсации с деоксиксилулозо-5-фосфатом.
Учитывая все вышесказанное, мы предположили, что в Agrobacterium vitis S4 и Bordetella petrii в процессе эволюции появился альтернативный деоксиксилулозо-5-фосфат/L-треонин-зависимый путь синтеза аминогидроксиацетон-фосфата (Рис. 5). В этом случае, 4-фософгидрокси-L-треонин синтезируется не из эритрозо-4-фосфата а напрямую из L-треонина путем его гидроксилирования и фосфорилирования. Необходимо отметить, что рассмотренные нами выше опероны, отнесенные к группе III, помимо L-треонин-4-гидроксилазы (AVI, BPE) содержат гены гомологов фосфосерин/гомосерин-фосфотрансферазы (SerB), теоретически способной фосфорилировать L-4-гидрокситреонин (Рис. 2). Кроме того, из литературы известно, что гомосерин киназа (ThrB) способна фосфорилировать L-4-гидрокситреонин (Kim, et al., 2010). И наконец, анализ геномов обоих микроорганизмов показал отсутствие генов, кодирующие ферменты двух известных путей синтеза B6.

С целью проверки гипотезы существования альтернативного деоксиксилулозо-5-фосфат/L-треонин-зависимого пути синтеза B6, мы сконструировали штаммы E. coli pdxB, E. coli pdxB thrC, и E. coli pdxB thrB с инактивированными генами эритронат-4-фосфат-дегидрогеназы (pdxB), треонин синтетазы (thrC) и гомосерин киназы (thrB). Затем, в каждый штамм были введены: 1) контрольный вектор pET15b и 2) плазмида pELAC-AVI, в составе которой, ген L-треонин-4-гидроксилазы из Agrobacterium vitis S4 экспрессировался под контролем PLacUV5 промотора. Полученные таким образом 6 плазмидных штаммов, культивировались на минимальной солевой агаризованной среде M9 c добавлением различных ростовых факторов (Таблица 4).
| Таблица 4. Комплиментация ауксотрофии по витамину B6 в плазмидных штаммах-производных E.coli pdxB. | ||||||
| Экзогенные ростовые факторы 1) | Штамм/ плазмида | |||||
| pdxB/ | pdxB thrC/ | pdxB thrB/ | ||||
| K 2) | AVI | K | AVI | K | AVI | |
| – | --- 3) | +++ | --- | --- | --- | --- |
| Пиридоксин | +++ | +++ | --- | --- | --- | --- |
| L-треонин | --- | +++ | --- | +++ | --- | --- |
| Пиридоксин, L-треонин | +++ | +++ | +++ | +++ | +++ | +++ |
| 1) Штаммы культивировались на агаризованной M9 среде (0.4% глюкозы) с добавлением пиридоксина (0.2 мМ), L-треонина (0.2 мМ), или их смеси (0.2 мМ каждого). 2) Обозначения плазмид: K - вектор pET15(b); AVI - pELAC-AVI 3) +++ - рост колоний на агаризованной среде; --- - отсутствие роста. | ||||||
Из данных, приведенных в таблице видно, что экспрессия гена L-треонин-4-гидроксилазы из Agrobacterium vitis S4 в штамме E. coli c инактиврованным геном дегидрогеназы 4-фософоэритроновой кислоты (pdxB) восстанавливает рост клеток на минимальной среде, без добавления витамина B6. Кроме того, данный эффект строго зависит от способности штамма E. coli (pdxB) синтезировать эндогенный L-треонин. Оба независимых “блока” синтеза L-треонина в этом штамме (thrC) и (thrB) дезавуируют эффект комплиментации. Из того факта, что рост клеток штамма E. coli pdxB thrB/AVI (в отличие от E. coli pdxB thrС/AVI) не восстанавливается в присутствии экзогенного L-треонина следует, что именно гомосерин киназа (ThrB) фосфорилирует L-4-гидрокситреонин, синтезированный AVI.
Таким образом, полученные результаты позволяют предположить существование нового, деоксиксилулозо-5-фосфат/L-треонин–зависимого пути синтеза B6, ключевым шагом которого, является реакция С-4-гидроксилирования L-треонина.
6. Уникальный окислительный каскад из Pantoea ananatis AJ13355.
Как нами уже было отмечено выше, в отличие от других гомологов IDO, диоксигеназа PAA, отнесенная нами ко второй функциональной группе, не имела ярко выраженной субстратной специфичности. Сравнение кинетических параметров IDO и PAA показало, что имея сравнимые параметры KM и kcat в реакциях с L-лейцином и L-метионином, эти ферменты существенно отличаются по кинетике гидроксилирования L-изолейцина (см. Таблицу 3).
Кроме того, сравнение относительного расположения PAA и диоксигеназ свободных аминокислот (IDO, AVI, BPE, GOX, MFL) в рядах гомологов IDO, полученных с помощью BLAST и PSI-BLAST показало, что будучи ближайшим “соседом” IDO в ряду BLAST, PAA существенно удален от него в ряду PSI-BLAST. При этом для остальных гомологов наблюдается обратная тенденция к “локализации” вокруг IDO в ряду PSI-BLAST (Рис. 1).

И наконец, более подробное изучение структуры Hil оперонов (от английского hydroxylation of isoleucine), отнесенных нами ко второй группе, выявило одну их уникальную особенность – наличие тандема генов hilA и hilB (далее в этом разделе все гомологи IDO из второй группы, включая PAA, будут называться HilB) кодирующих гипотетические диоксигеназы, относящиеся к PF13640 и PF10014 Pfam семействам соответственно (Рис. 6, сравн. с Рис. 2). Более того, в некоторых случаях наблюдается трансляционное сопряжение соответствующих генов, что указывает на то, что обе диоксигеназы могут образовывать комплекс для катализа последовательных реакций гидроксилирования.
Все эти наблюдения навели нас на мысль о том, что HilA и HilB образуют комплекс, катализирующий последовательное гидроксилирование L-изолейцина, и что субстратом гидроксилирования для HilB, является продукт реакции, катализируемой HilA.
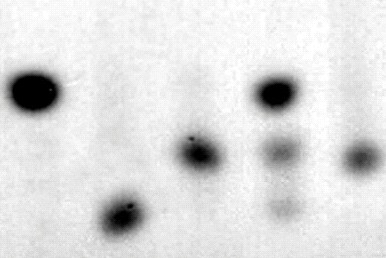
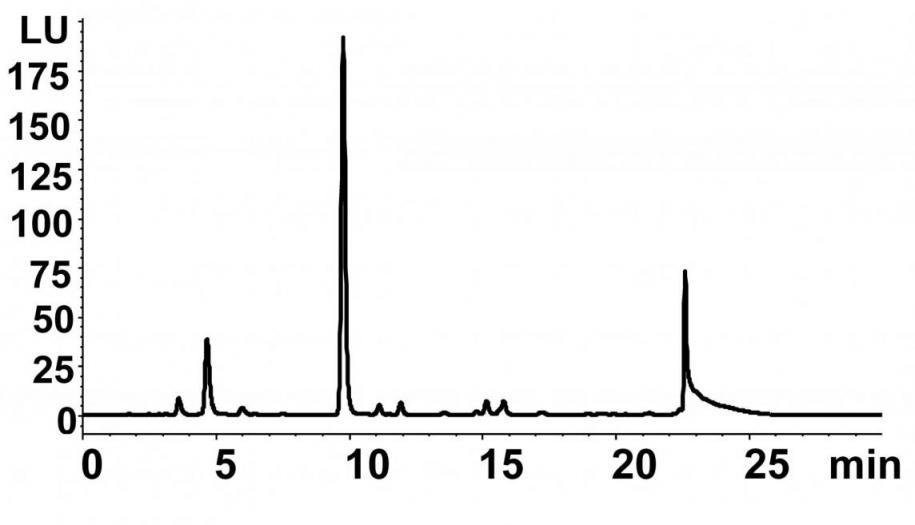
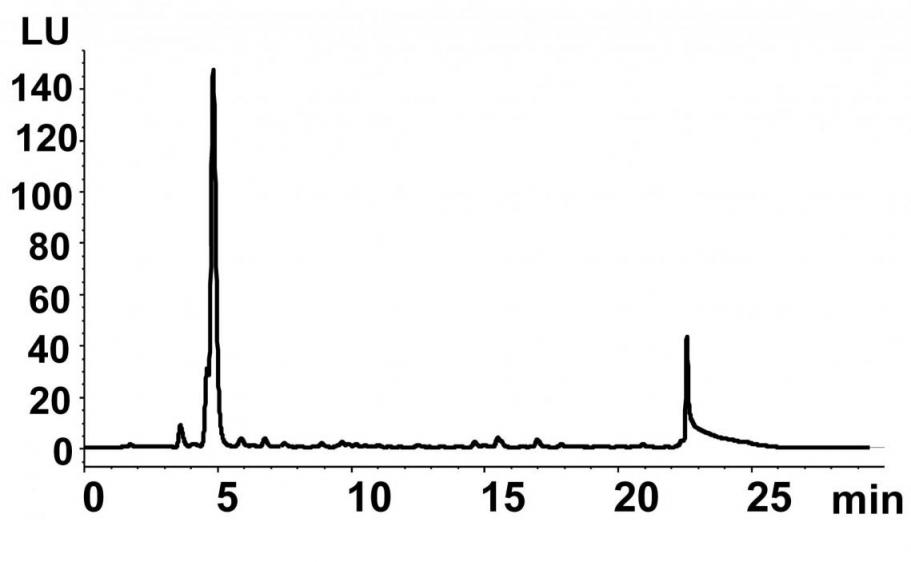

Для подтверждения этой гипотезы, мы сначала исследовали активность HilA с L-изолейцином in vivo. С этой целью, соответствующий ген hilA из Pantoea ananatis AJ13355 был клонирован в составе плазмидного вектора под контролем Ptac промотора. Сконструированная таким образом плазмида была введена в E. coli TG1, после чего, полученный плазмидный штамм TG1-HilA и контрольный штамм TG1-К (содержащий вектор pUC19) культивировались в минимальной солевой среде M9 с добавлением L-изолейцина. Состав финальной культуральной жидкости (КЖ) для каждого штамма был проанализирован с помощью ТСХ и ВЭЖХ. В результате мы обнаружили, что в КЖ штамма TG1-К концентрация L-изолейцина практически не изменилась (Рис. 7, A1, Б). В КЖ штамма TG1-HilA L-изолейцин не детектировался, однако было обнаружено новое соединение C3 (Рис. 7, A3, Д). Полученные данные указывали на то, что L-изолейцин превращается в С3 вследствие каталитической активности HilA. С целью доказать это мы исследовали L-изолейцин диоксигеназную активность в грубом лизате штамма TG1-HilA. Было установлено, что образование соединения С3 наблюдается только в присутствие HilA, L-изолейцина, -кетоглутарата, и Fe2+ (Таблица 5).
| Таблица 5. Зависимость синтеза C2 и C3 in vitro от компонентов диоксигеназной реакции. | |||||
| Фермент 1) | Реакция 2) | ||||
| A | B | C | D | E | |
| HilA | C3 | nd 3) | nd | C3 | nd |
| HilAB | C2 | nd | nd | C3, C2 | nd |
| 1 HilA и HilAB - клеточные лизаты штаммов TG1-HilA и TG1-HilAB соответственно. 2 Реакционная смесь содержала: A-все компоненты; B, C, D, E – такой же состав, что и реакция А, но без L-изолейцина, -кетоглутарата, L- аскорбата и FeSO4 соответственно. 3 не детектировался | |||||
Для определения химической структуры С3, это соединение было очищено и проанализировано с помощью 1H-ЯМР, 13C-ЯМР и ЭСИ-МС (Таблица 6). В результате было установлено, что соединение С3 это L-4’-гидроксиизолейцин (4’-HIl; cм. Таблицу 6 и далее рис. 8). Таким образом, было установлено, что HilA гидроксилирует L-изолейцин по С-4’ положению. C целью определения спектра его субстратной специфичности, HilA был очищен и исследован в реакциях гидроксилирования 20 канонических L-аминокислот. В результате, нами была обнаружена только слабая активность HilA c L-валином и с L-метионином, в результате которой синтезировались L-4-гидроксивалин и сульфоксид L-метионина (Таблица 6).
| Таблица 6. Идентификация соединений С2, С3 и L-4-гидроксивалина с помощью 1H-ЯМР, 13С-ЯМР, и ЭСИ-МС. | |||
| Вещество | Спектр | ЭСИ-МС m/z [M+H] | |
| 1H-ЯМР | 13C-ЯМР | ||
| С3 (4’-HIL) | 0.97(3H, t, J=7.5Hz)<>, 1.36-1.43 (2H, m) <>, 2.05-2.15 (1H, m)<>, 3.71(1H, dd, J=11.6, 6.8hz)<A1>, 3.81 (1H, dd, J=11.6,4.2Hz),A2>, 3.94 (1H, d, J=2.8 Hz)<> | 176.9 (C-1); 64.8 (C-2); 60.1(C-4’); 45.05 (C-3); 21.4 (C-4); 14.0 (C-5) | 148 |
| С2 (4, 4’-DIHIL) | 1.30(3H, d, J=6.4Hz)<>, 2.19-2.24 (1H, m) <>, 3.73 (1H, dd, J=11.5, 7.6Hz)<A1>, 3.82(1H, dd, J=11.5, 4.8Hz)<A1>, 3.99-4.06 (1H, m)<>, 4.07 (1H, d, J=2.7 Hz)<> | 176.7 (C-1); 68.8 (C-4); 64.1 (C-2); 57.5(C-4’); 50.1 (C-3); 24.0 (C-5) | 164 |
| L-4-гидроксивалин | 0.92 (3H, d, J=7.0Hz)<A>, 2.22-2.33 (1H, m)<>, 3.53-3.72 (3H, m)<,> | - | 134 |

Аналогичные эксперименты со штаммом TG1-HilAB, в котором экспрессировался тандем генов hilA-hilB из Pantoea ananatis AJ13355 показали, что совместная активность HilA-HilB превращает L-изолейцин в новое соединение C2 (Рис. 7, A2, B). В грубом лизате штамма TG1-HilAB, в присутствии эквимолярных количеств L-изолейцина и -кетоглутарата наблюдался синтеза обоих соединений C2 и С3, в то время как при двукратном избытке -кетоглутарата, наблюдался синтез только C2.
Очистка с последующим 1H-ЯМР, 13C-ЯМР и ЭСИ-МС-анализом позволили идентифицировать С2 как 4’,4-дигидроксиизолейцин (4’,4-DIHIL; cм. Таблицу 6 и рис. 8).
Таким образом, HilA-HilB действительно образуют каскад из двух окислительных реакций приводящий последовательно к синтезу L-4’-гидроксиизолейцина и L-4’,4-дигидроксиизолейцина.
7. Перспективы дальнейших исследований гидроксилирования свободных L-аминокислот: гипотезы о его физиологической роли в бактериях.
В заключение нам хотелось бы отметить одну существенную особенность изученных нами диоксигеназ. Все они, за исключением NPU, гидроксилируют свободные аминокислоты по С-4 положению. Теоретически, такая региоспецифичность гидроксилирования может приводить к синтезу двух различных классов сигнальных молекул: 2(5H)-фуранонов (Colin Slaughter, 1999, de Nys, et al., 2006) и аналогов N-ацил-гомосерин лактона (AHL) (Williams, et al., 2007) (Рис. 9).
Например, было показано, что образование лактона 4-HIL и его последующее окислительное дезаминирование приводит к образованию 3-гидрокси-4,5-диметил-2(5H)-фуранона (сотолона) (Blank, et al., 1996) (Рис. 9). Очевидно, что аналогичные молекулы могут быть получены и из всех описанных нами выше С-4-гидроксилированных аминокислот.

Зачем фураноны могут быть нужны бактериям? Перед тем, как сформулировать гипотетический ответ на этот вопрос следует упомянуть следующие известные факты. Фураноны, например сотолон, это летучие и обладающие сильным запахом соединения. Хорошо известно, что насекомые могут выполнять роль переносчиков бактерий из одного “места обитания” в другое (Nadarasah & Stavrinides, 2011).
Таким образом, можно предположить, что индуцируемый синтез фуранонов-производных C-4-гидроксилированных L-аминокислот привлекает насекомых к месту локализации бактерий, например, в случае истощения пищевых ресурсов за счет их активного роста (“чувство кворума”, англ. Quorum sensing, далее - просто QS). В этом случае, прослеживается полная аналогия с явлением, QS-зависимой биолюминесценции морской бактерии Photobacterium leiognathi, привлекающей таким образом рыб (Dunlap, et al., 2004). Только в первом случае в качестве аттрактанта “билогического транспорта” служит фуранон, а во втором - свет.
Хорошо известно, что аналоги N-ацил-гомосерин лактона могут принимать участие в регуляции QS (Galloway, et al., 2011). Из рисунка 9 видно, что образование амидной связи между лактоном С-4-гидроксилированной аминокислоты и произвольным гидроксилатом приводит к синтезу аналога N-ацил-гомосерин лактона. В этой связи интересно отметить, что Hil оперон из Pantoea ananatis содержит ген hilD, предположительно кодирующий ATФ-зависимую карбоксилат-амино лигазу, которая может образовывать амидную связь между 4’-HIL (или 4, 4’-DIHIL) с неизвестным карбоксилатом (см. Рис. 6 и Рис. 9).
Таким образом, очевидно, что дальнейшее изучение явления C-4-гидроксилирования может привести к открытиям, имеющим важное научное и хозяйственное значение.
ВЫВОДЫ.
1. Пять новых функциональных групп Fe(II)/-кетоглутарат-зависимых диоксигеназ свободных L-аминокислот были выделены in silico из не охарактеризованного семейства белков PF10014.
2. На основе экспериментального изучения 8 представителей семейства PF10014: IDO из Bacillus thuringiensis (группа 1); AVI из Agrobacterium vitis S4 и BPE из Bordetella petrii DSM 12804 (группа 3); NPU из Nostoc punctiforme PCC 73102 (группа 4); GOX из Gluconobacter oxydans 621H и MFL из Methylobacillus flagellatus KT (группа 6) установлено следующее групповое распределение субстратной специфичности (в порядке следования групп): 1) L-изолейцин-4-гидроксилазы, 3) L-треонин-4-гидроксилазы, 4) L-лейцин-5-гидроксилазы, 6) L-лейцин-4-гидроксилазы.
3. С помощью аналитических методов, с привлечением масс-спектрометрии и ЯМР, установлена структура гидроксилированных продуктов реакций с ферментами из каждой группы (в порядке следования групп): 1) L-4-гидроксиизолейцин, 3) L-4-гидрокситреонин, 4) L-5-гидроксилейцин, 6) L-4-гидроксилейцин.
4. На основании данных экспериментов по комплиментации ауксотрофии штамма E. coli (pdxB) по витамину B6, был обнаружен новый, эритрозо-4-фосфат-независимый путь биосинтеза B6 в клетках бактерий, ключевой реакцией которого является С-4-гидроксилирование L-треонина.
5. В геномах фитопатогенных бактерий, относящихся к родам Pantoea, Pseudomonas, и Rahnella были обнаружены новые Fe(II)/-кетоглутарат-зависимые диоксигеназы: L-изолейцин-4’-гидроксилаза HilA, принадлежащая к не охарактеризованному семейству PF13640 и L-4’-гидроксиизолейцин-4-гидроксилаза HilB, отнесенная нами ко второй функциональной группе семейства PF10014.
6. Показано, что in vivo, HilA и HilB образуют уникальный гидроксилирующий каскад, в результате которого происходит последовательное гидроксилирование L-изолейцина по С-4’ и C-4 положениям. Определена структура двух новых биогенных гидроксилированных L-аминокислот: L-4’-гидроксиизолейцина и L-4’,4-дигидроксиизолейцина.
Список работ, опубликованных по теме диссертации:
1. Smirnov SV, Sokolov PM, Kodera T, Sugiyama M, Hibi M, Shimizu S, Yokozeki K, Ogawa J. A novel family of bacterial dioxygenases that catalyse the hydroxylation of free L-amino acids. FEMS Microbiol Lett. 2012 Jun;331(2):97-104.
2. Hibi M, Kawashima T, Kodera T, Smirnov SV, Sokolov PM, Sugiyama M, Shimizu S, Yokozeki K, Ogawa J. Characterization of Bacillus thuringiensis L-isoleucine dioxygenase for production of useful amino acids. Appl Environ Microbiol. 2011 Oct;77(19):6926-30.
3. Smirnov SV, Sokolov PM, Kodera T, Sugiyama M, Hibi M, Shimizu S, Yokozeki K, Ogawa J. A novel family of bacterial dioxygenases that catalyse the hydroxylation of free L-amino acids. // 15th International Biotechnology Symposium and Exhibition. September 16 – 21, 2012. EXCO, Daegu, Republic of Korea.
4. Smirnov SV, Kodera T, Samsonova NN, Kotlyarova VA, Rushkevich NY, Kivero AD, Sokolov PM, Hibi M, Ogawa J, Shimizu S. Metabolic engineering of Escherichia coli to produce (2S, 3R, 4S)-4-hydroxyisoleucine. Appl Microbiol Biotechnol. 2010 Oct;88(3):719-26.
5. Смирнов С.В., Соколов П.М., Рушкевич Н.Ю. Способ получения гидроксилированных L-аминокислот, в частности, гидроксилированного L-лейцина. // Патентная заявка РФ 2011 144625, решение о выдаче патента от 04 июля 2012.
6. Соколов П.М., Смирнов С.В. Поиск новых гидроксилаз аминокислот. // Научная сессия МИФИ. 26-30 января, 2009. МИФИ, Москва, Россия. Т. 2, С.225.
7. Hibi M, Kawashima T, Sokolov PM, Smirnov SV, Kodera T, Sugiyama M, Shimizu S, Yokozeki K, Ogawa J. L-Leucine 5-hydroxylase of Nostoc punctiforme is a novel type of Fe(II)/-ketoglutarate-dependent dioxygenase that is useful as a biocatalyst. Appl Microbiol Biotechnol. 2012 May 16.
8. Hibi M, Kawashima T, Kasahara T, Sokolov PM, Smirnov SV, Kodera T, Sugiyama M, Shimizu S, Yokozeki K, Ogawa J. A novel Fe(II)/-ketoglutarate-dependent dioxygenase from Burkholderia ambifaria has -hydroxylating activity of N-succinyl L-leucine. Lett Appl Microbiol. 2012 Sep 12.

