Исследование метаболизма цистеина у escherichia coli
На правах рукописи
Зиятдинов Михаил Харисович
«Исследование метаболизма цистеина
у Escherichia coli»
03.01.03 - Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
- Москва 2013 -
Работа выполнена в лаборатории №1 Закрытого Акционерного общества «Научно-исследовательский институт Аджиномото-Генетика» (ЗАО «АГРИ»).
Научный руководитель:
кандидат биологических наук, доцент М.М.Гусятинер ЗАО «АГРИ»
Официальные оппоненты:
Доктор биологических наук, профессор В.В.Носиков
ФГУП ГосНИИгенетика
Доктор биологических наук, Г.И.Каратаев
ГУ НИИ эпидемиологии и микробиологии
имени Н.Ф. Гамалеи.
Ведущая организация: Федеральное государственное бюджетное учреждение науки Институт общей генетики им. Н.И. Вавилова РАН
Защита диссертации состоится «___» ________ 2013 года в 1400 на заседании Диссертационного совета Д 217.013.01 при ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» по адресу: 117545, г. Москва, 1-й Дорожный проезд, д. 1.
С диссертацией можно ознакомиться в библиотеке ФГУП «ГосНИИгенетика»
Автореферат разослан «___» апреля 2013 г.
Ученый секретарь диссертационного совета,
кандидат химических наук, доцент Т. Л. Воюшина
Общая характеристика работы
Актуальность проблемы. Аминокислота L-цистеин (далее цистеин) является одной из двух канонических аминокислот, содержащих в своем составе атом восстановленной серы (S -2), который включается в предшественник цистеина, О-ацетилсерин, превращая его в цистеин, а эта аминокислота уже служит донором серы для синтеза второй серусодержащей амикислоты, L-метионина. Биосинтез цистеина, включая восстановление атома серы сульфат-иона до S-2, осуществляют микроорганизмы и растения, тогда как животные и, в том числе человек, не способны к сульфат-редукции и нуждаются поэтому в том или ином источнике восстановленной серы. Такими источниками может быть и цистеин, и метионин, а также некоторые другие серусодержащие биологические молекулы.
Роль цистеина в составе белков уникальна в связи со свойствами тиоловой (-SH) функциональной группы. Окисляясь, она образует ковалентную связь с тиоловой группой другого остатка цистеина, находящегося в той же полипептидной цепи или в составе другой, образуя дисульфидный мостик. Остатки цистеина в составе белков отличается наряду с разветвленными аминокислотами, метионином и тирозином гидрофобностью и поэтому участвуют в гидрофобных взаимодействиях между белковыми молекулами, сообщая белкам волокнистую структуру. С этим связано обилие цистеина в белках типа кератина в волосе, перьях и когтях. Кроме структурной функции цистеиновые остатки часто входят в состав каталитических центров ферментов, поскольку тиоловая группа может служить нуклеофилом в различных биохимических реакциях.
Потребность в цистеине постоянно растет. Он используется в пищевой промышленности, например, в хлебопечении, улучшая качество выпечки. Его добавка к мясным продуктам усиливает характерный мясной аромат, который обусловлен реакцией между цистеином и сахарами. Эффективна добавка цистеина в корм овец с точки зрения получения шерсти, которая очень богата этой аминокислотой. Интересно, что сейчас получены трансгенные овцы, в геном которых введены гены, обеспечивающие эндогенный синтез цистеина. Применение цистеина в медицине обусловлено высокой реакционной способностью его тиоловой группы. Он применяется для детоксикации при отравлении тяжелыми металлами, образуя прочные связи с последними. Цистеин ускоряет метаболизацию уксусного альдегида, токсичного продукта окисления этанола в организме, ответственного за похмельный синдром. Производное цистени N-ацетилцистеин широко используется в качестве лекарственного средства для борьбы с легочными явлениями, так как способствует разжижению мокроты, а также для детоксикации при некоторых отравлениях, что связывают с увеличением образования глутатиона, в состав которого входит цистеин.
В настоящее время цистеин получают в основном путем гидролиза перьев птиц и человеческих волос с последующим выделением его из смеси продуктов гидролиза. Полученный таким способом цистеин не является достаточно приемлемым продуктом на мировом рынке в силу несоответствия религиозным и культурным традициям ряда народов. Некоторое количество цистеина получают путем микробиологической конверсией 2-амино-2-тиазолин-4-карбоновой кислоты, которую получают органическим синтезом. Цистеин можно также получать и биосинтезом без использования его предшественников с помощью продуцирующих эту аминокислоту микроорганизмов, созданных транснациональной компанией "Вакер Хеми АГ", которой принадлежат патенты на соответствующий способ получения цистеина; есть также научные публикации, основанные на этих патентах. Этот способ основан на применение штаммов Escherichia coli, с мутацией в гене cysE, освобождающей соответствующий фермент от ретроингибирования цистеином. Кроме того, в штаммах супер-экспрессирован ген ydeD, кодирующий белок-экспортер цистеина, что снижает токсическое действие цистеина на клетки кишечной палочки.
Данная работа посвящена изучению некоторых аспектов метаболизма цистеина у Escherichia coli, результаты которого могут быть использованы для дальнейшего развития микробиологического метода получения цистеина ферментацией без использования каких-либо его предшественников.
Цели и задачи работы.
1) Для создания эффективных бактериальных продуцентов цистеина необходимо десенсибилизировать ключевой фермент биосинтеза цистеина, серин-О-ацетилтрансферазы (САТ), к ингибированию этой аминокислотой. В известных штаммах-продуцента цистеина эта задача решена лишь частично. Ее решение осложняется тем, что ингибиторная молекула цистеина отличается от молекулы субстрата, серина, лишь заменой атома кислорода на атом серы. Обе эти молекулы конкурируют за один и тот же центр связывания, образуя практически одинаковые водородные связи с аминокислотными остатками САТ. Для достижения этой цели были поставлены следующие задачи:
- На основании ранее опубликованных данных о структуре САТ, содержащей цистеин в каталитическом центре, построить трехмерную компьютерную модель центра связывания серина, в который поместить серин.
- Сравнить трехмерные структуры центра, связанного с цистеином и серином, с целью определения тех аминокислотных остатков САТ, которые более важны для связывания цистеина.
- С помощью рандомизированного мутагенеза участков гена cysE (кодирующего САТ) изменить пространственное положение аминокислотных остатков, взаимодейтсвующих с цистеином, но не с серином.
- Отобрать мутанты с рандомизированными участками гена cysE и изучить каталитические свойства мутантных САТ, сравнив их со свойствами известных.
2) После получения мутантов по гену cysE с высокой степенью устойчивости к ингибированию цистеином выяснилось, что такие мутантны экскретируют О-ацетилсерин (ОАС), продукт реакции, катализируемой мутантной САТ, что, вероятно, связано с недостаточностью последующей реакции биосинтеза цистеина. Представляет научный и практический интерес обнаружение транспортных систем, участвующих в поглощение ОАС из внешней среды и возвращение его в клетки.
В связи с этим решались следующие задачи:
- Индуцировать мутации, приводящие к неспособности усвоения ОАС.
- Используя плазмидные банки хромосомы E.coli, выявить плазмиды, комплементирующие эти мутации, и путем определения нуклеотидных последовательностей вставок в плазмиды идентифицировать гены, контролирующие процесс транспорта.
3) Целью нашей работы являлось изучение также превращения одного из продуктов реакции последнего этапа биосинтеза цистеина, S-сульфоцистеина, в цистеин. Это вещество образуется вместо цистеина при использовании тиосульфата в качестве источника серы и может накаливаться в среде роста. Были поставлены следующие задачи:
- Определить, является ли процесс превращения S-сульфоцистеина в цистеин чисто химическим или зависимым от белковых факторов и идентифицировать их.
- Найти транспортные системы, перемещающие S-сульфоцистеин из среды внутрь клеток.
Научная новизна и практическая ценность работы.
На основании компьютерного моделирования центра связывания САТ с конкурирующими лигандами (серин и цистеин) сделаны предсказания, касающиеся модификации первичной структуры этого центра. В соответствии с этими предсказаниями методом рандомизированного мутагенеза удалось отобрать мутантные формы САТ со сниженным сродством к ингибитору при сохранении каталитической активности. Полученные мутации использовались для создания продуцентов цистеина, которые защищены российским и зарубежными патентами, и нашли применение в промышленном производстве цистеина.
Изучен ранее не известный генетический контроль поглощения предшественника цистеина, О-ацетилсерина, клетками кишечной палочки. Показано участие ряда помп, предположительно относящихся к группе факторов множественной лекарственной устойчивости (МarC, YchE, YhgN и SdsRQP) в транспорте О-ацетилсерина. Обнаружена также способность ранее известного транспортера олигопептидов YdgR транспортировать О-ацетилсерин.
Установлены белковые факторы, участвующие в восстановлении S-сульфоцистеина до цистеина. Обнаружен ген ydjN, кодирующий белок-импортер S-сульфоцистеина. Полученные данные могут быть использованы при разработке способов микробиологического получения серусодержащих веществ.
На основе природного промотора гена nlpD cконструирован методом рандомизированного мутагенеза эффективный промотор для экспрессии генов, функция которых важна в ходе длительных процессов. Промотор нашел применение в данном и последующих исследованиях.
Публикации и апробация работы. По теме диссертации опубликовано 5 печатных работы (2 статьи в научных журналах, входящих в перечень ВАК РФ, 2 патента РФ и одна заявка на патент РФ). Материалы диссертации докладывались на конкурсе работ молодых сотрудников ЗАО «АГРИ» (июнь 2008). Диссертационная работа была апробирована на совместном семинаре секции «Молекулярная биология» Ученого совета ФГУП ГосНИИгенетика и НТС ЗАО "АГРИ" 8 апреля 2013 года.
Структура и объем работы. Диссертация состоит из 6 разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждение», «Выводы» и «Список цитируемой литературы». Работа изложена на страницах, включая рисунков и таблицы. Список цитируемой литературы содержит источника.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальные штаммы и среды. Большинство штаммов E. coli, использованных в работе, были получены на основе штамма MG1655 (F-, -, rph-1). Для получения мутаций в гене cysE использовался штамм E.coli LE392 (Sambrook and Russell, 2001). Штаммы выращивали на средах известного состава (Sambrook and Russell, 2001): LB, минимальной среде М9 с глюкозой (0.4 и добавлением при необходимости L-аминокислот. Для плотных сред использовали агар (1.5%). Антибиотики добавляли в концентрациях (мкг/мл): хлорамфеникол (Cm) – 25, ампициллин (Ap) – 100, тетрациклин (Tc) – 12.5.
Конструирование штаммов. Все модификации (делеции, инсерции, замены) хромосомы были выполнены прецизионно с помощью Red системы фага (Datsenko and Wanner, 2000) и удаляемого in vivo маркера CmR (ген cat), находящегося в составе фрагмента attL-cat-attR (Doroshenko et al., 2007). Для объединения генетических мутаций (делеций) в хромосоме одного штамма соответствующие модификации, маркированные геном устойчивости к антибиотикам, переносили с помощью метода общей трансдукции бактериофагом Р1.
Определение активности глутатионредуктазы проводилось спектрофотометрическим методом (340 нм) по изменению концентрации ко-фактора, NADPH (Carlberg, Mannervik, 1985).
Определение активности S-сульфоцистеин редуктазы (глутатнон-зависимой). Этот фермент восстанавливает S-сульфоцистеин до цистеина и сульфита, окисляя глутатион (образование цистеина подтверждали c помощью HPLC) Количество продукта реакции (окисленного глутатиона) определяли по расходу NADPH на его восстановление, которое катализировалось ферментным препаратом глутатионредуктазы фирмы Sigma. Количество израсходованного NADPH в реакционной смеси регистрировалось по уменьшению светопоглощения (340 нм).
Определение активности L-серин-О-ацетилтрансферазы (САТ) и ее каталитические свойства определяли по методу описанному ранее (Kredich, Tomkins, 1966) c некоторыми модификациями. Реакционная смесь (1 мл) содержала 50 мМ Трис-НСl (рН 7,5), 5 мМ L-серин, 0,1 мМ ацетил-КоА и частично очищенный ферментный препарат.
Начальную скорость реакции определяли по уменьшению светопоглощения при 232 нм, вызванного разрывом тиоэфирной связи в ацетил-КоА. Расчет скорости реакции производили, основываясь на разнице в коэффициентах экстинкции (3,2 ммоль/литр/см) между ацетил-КоА и КоА. Единицей активности принимали такое количество ферментного препарата, которое катализирует образование 1 мкмоля КоА в мин. Белок определяли с помощью набора Bio Rad, при использовании бычьего сывороточного альбумина в качестве стандарта.
Компьютерное моделирование каталитического сайта САТ. Cайт связывания цистеина находится в кармане, образованным двумя субъединицами САТ при образовании триммера. Цистеин, связывается в том же сайте, где происходит связывание одного из субстратов, серина, как это показали Pye et al (2004), изучив кристаллическую структуру САТ с разрешением 2,2 ангстрема. Нами в качестве основы была использована трехмерная структура центра связывания, содержащая цистеин. С помощью компьютерной программы InsightII (Moltcular simulations Inc., США), предназначенной для “причаливания” лигандов к рецепторным структурам, была получена 3D модель центра связывания серина, путем удаления связанного там цистеина. Далее была получена модель 3D структуры серина с помощью специального раздела той же программы. Структура серина была предварительно (ручное моделирование) помещена на место цистеина. Затем были взяты в расчет аминокислотные остатки САТ на расстоянии меньшем 6 ангстрем от молекулы серина; при этом считалось, что остальная часть САТ неподвижна. Сравнивали энергии десяти структур в зависимости от размещения лиганда (серина) и выбрали структуру, отвечающая наименьшей энергии. Для принятия решения о предполагаемой модификации данного сайта связывания полученная 3D структура, содержащая серин, была наложена на соответствующую структуру, содержащую цистеин (подробнее см. патент России 2279477, http://www.freepatent.ru/patents/2279477).
Получение мутаций в гене cysE методом рандомизации фрагментов. Вначале на основе векторной плазмиды pMW118 (Nippon Gene, Япония) были созданы плазмиды pMW-PompC и pMW-PnlpD в рестрикционные сайты которых были включены фрагменты хромосомы штамма E.coli MG1655, содержащие промоторные последовательности генов ompC и nlpD, соответственно.
Далее ген cysE был получен путем ПЦР амплификации и включен в состав указанных плазмид, что привело к получению плазмид pMW-PompC-cysE и pMW-PnlpD-cysE. Для создания набора мутантных генов cysE с рандомизированной с 285 по 291 нуклеотид областью, в первом раунде был амплифицирован с помощью ПЦР фрагмент cysE гена, кодирующий последовательность с 1 по 102 аминокислотный остаток SAT. ПЦР осуществлялась с использованием плазмиды pMW-PompC-cysE в качестве матрицы и праймеров, содержащих по 6 рандомизированных нуклеотидов (см. рис.1).
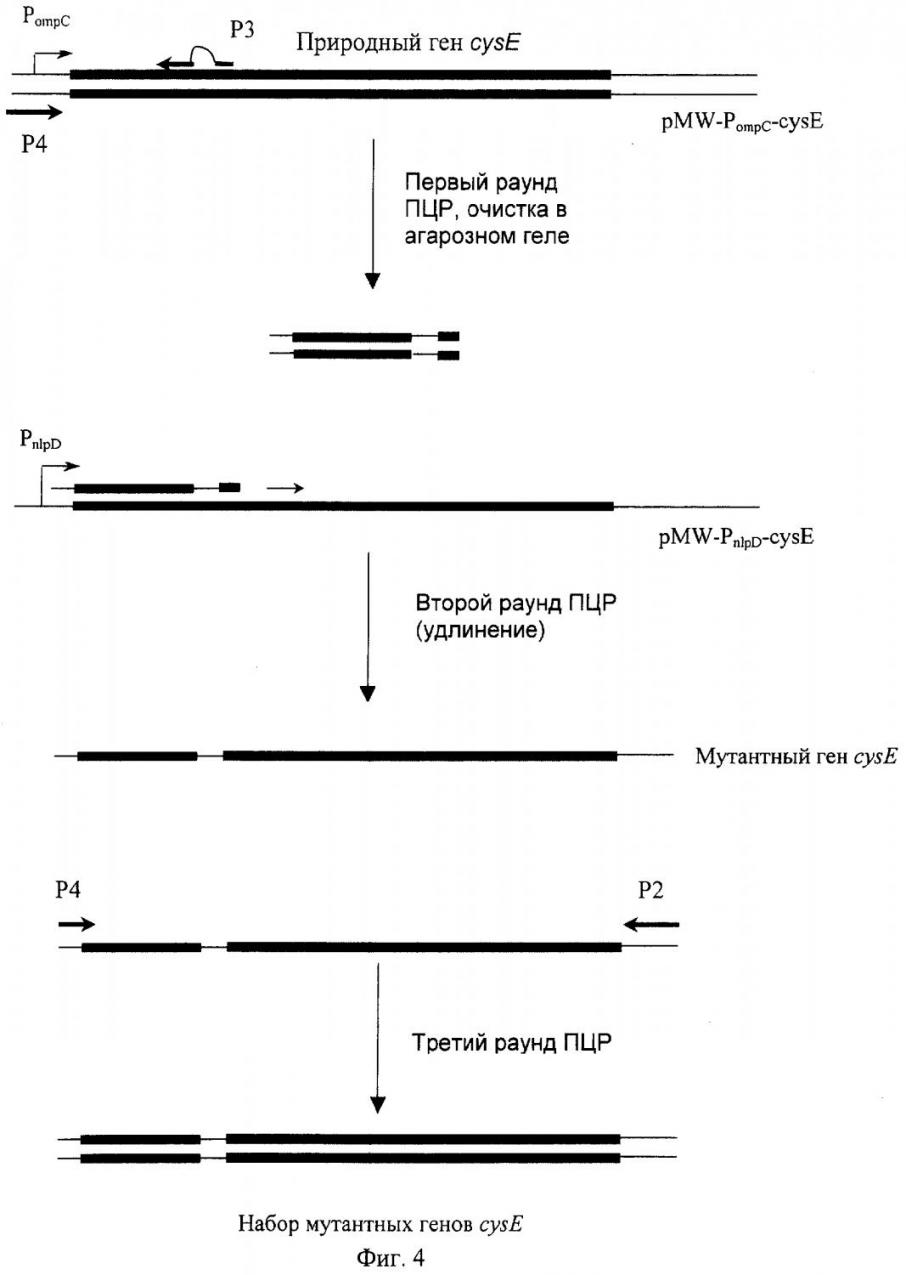
Рис. 1. Рандомизация фрагмента гена cysE (нуклеотидные позиции 285 – 291).
В результате был амплифицированы фрагменты гена cysE длиной 0,3 т.п..н. Во втором раунде амплификации (рис.1) эти фрагмент ДНК были очищены методом электрофореза в агарозном геле и использованы в качестве затравки для того, чтобы нарастить этот фрагмент до полной последовательности гена cysE (10 циклов ПЦР) В третьем раунде ПЦР к полученному фрагменту был добавлен праймер, гомологичный промоторной области гена ompC (рис.1), и проведены дополнительные 15 циклов реакции. Фрагменты ДНК длиной 0,83 т.п.н., кодирующие набор мутантных вариантов гена cysE, были очищены и расщеплены рестриктазами, после чего лигированы в вектор pMW-PompC; предварительно расщепленный теми же рестриктазами. Полученные плазмиды pMW-PompC-cysE (рандомизированный) были использованы для трансформации клеток - реципиентов Е.coli.
В дальнейших экспериментах в качестве штамма-реципиента использовали штамм Е.coli LE392 cysE::K.mR, полученный из штамма Е.coli LE392 в результате инсерции гена устойчивости к канамицину с использванием штамма JC7623 ( Kushner et al. 1972).
Штамм Е.coli LE392 cysE::KmR трансформировали смесью рекомбинантных плазмид pMW-PompC-cysE (рандомизированный). Мугантные гены cysE, кодирующие активную SAT, были отобраны по комплементации хромосомной мутации cysE в штамме Е.coli LE392 cysE::KmR на чашках с агаризованной М9, не содержащей цистеин. Полученные клоны были проверены на способность к кормлению цистеиновых ауксотрофов, в результате было отобрано 15 вариантов. Из них были выделены плазмиды и в них были определены последовательности ДНК структурной части гена cysE. Для определения уровня активности SAT цистеиновый ауксотроф LE392 cysE::KmR повторно трансформировали этими плазмидами.
Мутантный ген cysE (cysE256) с точечной нуклеотидной заменой в позиции 767, выражающийся в замене метионина 256 на изолейцин (Denk and Bock, 1987) был получен с помощью стандартной методики сайт-направленного мутагенеза.
Результаты исследований
1. Получение и изучение мутантых вариантов серинацетилтрансферазы (CAT), устойчивых к ингибированию цистеином
Биосинтез цистеина бактериями состоит из реакций восстановления сульфат-иона до сульфида с последующим включением атома восстановленной серы в углеродный скелет серина. При этом сначала гидроксил серина ацетилируется (серинацетилтрансфераза, далее САТ, ген cysE), затем восстановленная сера вытесняет ацетат из молекулы О-ацетилсерина с образованием цистеина (изоферментные О-ацетилсеринсульфгидрилаза, гены cysK и cysM):
Ser + ацетил-СоА = О-ацетилсерин + СоАSH
О-ацетилсерин + S2- = Cys + ацетат.
Гены, контролирующие сульфатредукцию, находятся под регуляторным контролем на уровне их экспрессии (Cys-регулон), тогда как превращение серина в О-ацетилсерин регулируются только путем ингибирования активности САТ цистеином. САТ чрезвычайно чувствительна к присутствию цистеина в клетке (Kredich и др.1966): концентрация 0.8 мкМ цистеина ингибирует активность САТ на 50%, что важно также для предотвращения расходования клеточной энергии для восстановления серы, так как при подавлении САТ цистеином не происходит синтеза О-ацетилсерина, который, спонтанно изомеризуясь, превращается в N-ацетилсерин – сигнальную молекулу, включающую экспрессию генов Cys-регулона.
Для создания бактериальных продуцентов цистеина необходимо:
1) максимально дерепрессировать синтез ферментов сульфатредукции (Cys-регулон);2) освободить от ретроингибирования серином синтез серина из метаболита гликолитического пути 3-фосфоглицерата (десенсибилизировать 3-фосфоглицератдегидрогеназу (ген serА) в отношении ингибирования серином); 3) десенсибилизировать САТ к ингибированию цистеином.
Подходы к решению третьей задачи составляли предмет нашего исследования. Как отмечено выше уже в 60-х годах была обнаружена высокая чувствительность САТ к ингибированию конечным продуктом – цистеином, причем САТ обладает гораздо большим сродством к своему ингибитору, чем к обоим субстратам : Км для серина и ацетил-СоА равны 0, 77 мМ и 0,1 мМ, а Ki для цистеина – около 0.001 мМ. Предполагалось, что цистеин связывается специальным аллостерическим сайтом, и в результате того связывания снижается сродство САТ ко второму субстрату, ацетил-СоА (Cook, Wedding, 1978). Позднее, уже после ренгеноструктурного анализа фермента, это предположение было отвергнуто. Как оказалось, цистеин связывается в центре, предназначенным для связывания серина - одного из субстратов, однако гораздо прочнее. Сообщалось об отборе мутантов с частично десенсибилизрованной к ингибированию цистеином САТ в бактериях (Nakamori et al., 1998) и растениях (Takagi et al., 1999; Noji et al., 1998) однако эти варианты САТ обладали либо низкой степенью устойчивости к ингибированию цистеином, либо их энзиматическая активность была крайне низкой, т.е. мутации, снижающие сродство к ингибитору, приводили одновременно к снижению сродства к субстрату (серину), а также снижали эффективность катализа. Описанные варианты могут считаться малоэффективными в плане решения проблемы достижения высокого уровня производства L-цистеина из глюкозы.
К моменту начала нашей работы уже была опубликована трехмерная структура САТ Escherichia coli, основанная на рентгеноструктурных исследованиях САТ с разрешением 2,2 ангстрема (Pye et al, 2004), которую мы использовали в настоящей работе по получению мутантов методом рандомизированного мутагенеза. Как показано в указанной работе, мономер САТ (рис. 2a, верхний - вид сверху, нижний - вид сбоку) состоит из двух доменов: остатки 1-140 образуют альфа-спиральный домен из 8-ми альфа-спиралей, а остатки 141-262 – бета-спиральный.
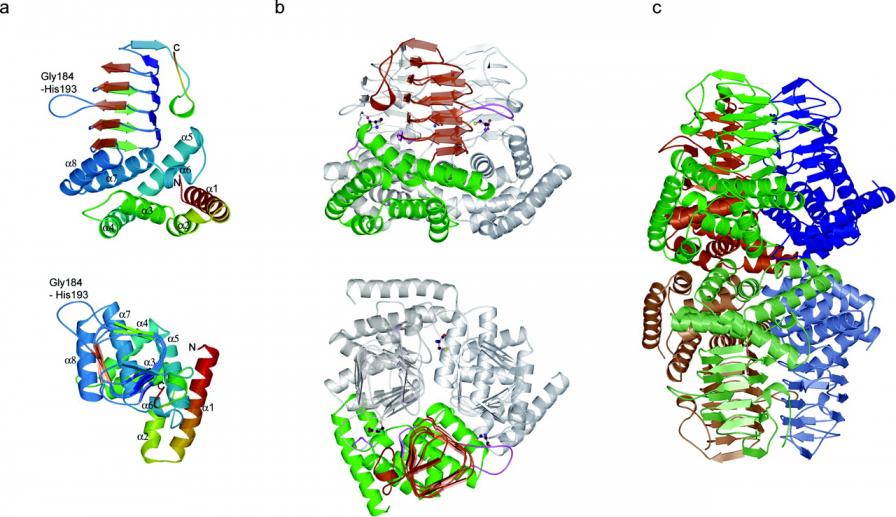
Рис.2. Ленточная модель САТ E.coli (по Pye et al, 2004)
Три мономера соединены своими N-концами «голова к голове», образуя трехгранную пирамиду (рис. 2b, вид сверху и сбоку) за счет взаимодействий гидрофобной природы. Более того, оказалось, что два тримера взаимодействуют между собой опять же за счет N-концевой последовательности, образуя структуру из 6-ти мономеров, отвечающую формуле 3х2, то есть, димер тримеров.(с на рис. 2). В результате образуется структура из двух пирамид, соединенных N-концевыми частями, а С-концы каждого тримера направлены в противоположные стороны. Было установлено, что ингибирующая молекула цистеина связывается с серин-связывающим сайтом, который находится между мономерами САТ и образуется при образовании тримера.
Нашей задачей было снизить прочность связывания цистеина этим сайтом, не изменив связывания серина. Для этого с помощью компьютерного моделирования (см. Материалы и методы) были построены пространственные модели этого сайта (Рис. 3), связанного как с серином (Рис. 3 B) так и с цистеином (Рис. 3А). Как видно (Рис.3 В), атом серы cближен и образует водородные связи с His158 и His193, атом кислорода – с Arg192, а атом азота – с Asp92 и Asp157. Причем Asp92, Asp157 и His158, принадлежат одному мономеру САТ, а Arg192 и His 193 - другому. Если в этом кармане находится серин (Рис.3 В), то атом кислорода приближен к Arg192, а азота - к Asp92. Последний аминокислотный (Asp92) остаток был наиболее подвижен при смене лигандов (цистеина на серин), то есть проявлял специфичность по отношению к цистеину.
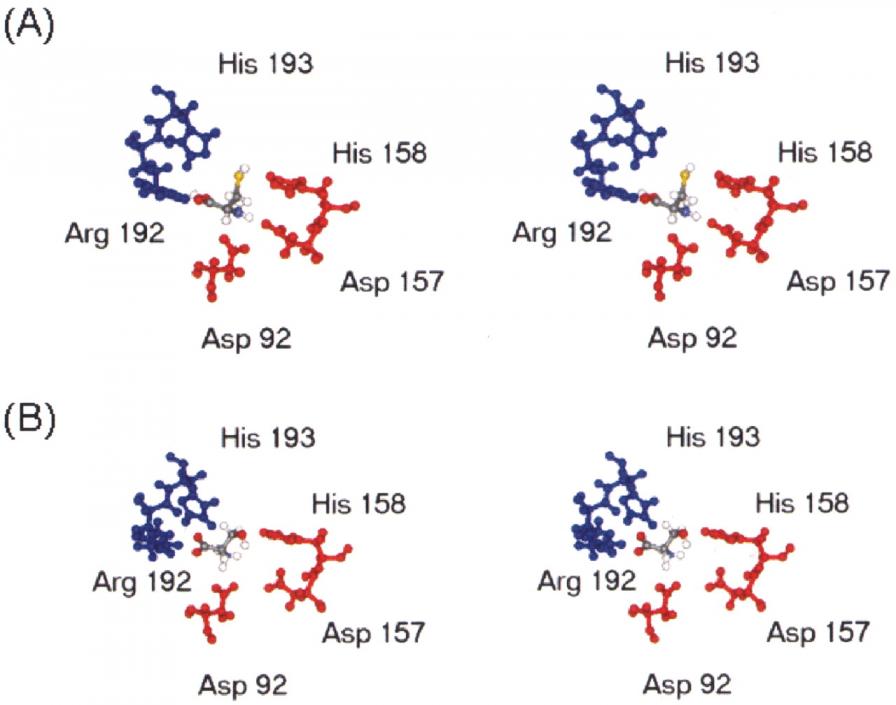
Рис. 3. Пространственные модели сайта связывания серина в присутствии в нем серина (А) и цистеина (В).
Поскольку незначительное изменение позиции Asp92 могло бы сказаться на эффективности связывания цистеина (но не серина), мы предприняли попытку слегка сместить его путем замены аминокислотных остатков в петле, в которой он находится, т.е. от Arg89 до Asp96. Соответствующий указанным аминокислотным остаткам фрагмент гена cysE был рандомизирован с использованием соответствующих ДНК-праймеров, которые использовались при ПЦР амплификации. В результате на плазмидах был получен набор случайных замен нуклеотидов в интересующей нас области, и этими плазмидами был трансформирован дефектный по гену cysE штамм кишечной палочки MG1655. На минимальной среде, лишенной цистеина, были получены колонии CysE+, которые должны были обладать функциональной (но мутантной) САТ. Далее, среди цистеин-независимых клонов были найдены такие, которые выделяли цистеин в минимальный агар и обеспечивали рост штамма E.colicysE, посеянного газоном. Клоны, экскретирующие цистеин, были отобраны для дальнейшего изучения.
Одновременно была получена с помощью сайт-специфического мутагенеза известная мутации в гене cysE, которая сообщает устойчивость САТ к ингибированию цистеином (в качестве контроля). Это - мутации cysE256, имеющие замену Met256Ile (Denk, Bock, 1987).
Среди полученных мутантов, содержащих рандомизированные участки в гене cysE, после измерения активности САТ были обнаружены клоны с достаточно высоким уровнем ферментативной активности. Кроме того, среди них были обнаружены такие клоны, у которых САТ приобрела устойчивость к ингибирования цистеином (Таблица 1). Некоторые из полученных мутаций (cys5, cysE15), вызывали значительную десенсибилизацию САТ к ретроингибированию и при этом сохраняли достаточно высокий уровень
Таблица 1. Сравнение активности мутантных САТ и чувствительности к ингибированию цистеином
| Аллели гена cysE | Происхождение | Удельная активность, мкмоль/мин/ мг белка бесклеточного экстракта | IC50,*мкМ | Ki,**мкМ |
| CysE | Дикий тип | 1680 | 0.8 | 0.6 |
| CysE 256 | (Denk, Bock,1987) | 1067 | 18.1 | 14.5 |
| CysE 1 | Данная работа. Рандомизация позиций 89 - 96 | 1220 | 20.0 | 15.0 |
| CysE 142 | 1600 | 460.0 | 420.0 | |
| CysE 5 | 715 | 1100.0 | 950.0 | |
| CysE 12 | 1440 | 125.0 | 114.0 | |
| CysE 15 | 1470 | 550.0 | 510.0 | |
| CysE 10 | 2692 | 4.7 | 3.4 | |
| CysE 11-2 | 1900 | 410.0 | 395.0 | |
| CysE 15-2 | 1100 | 6.0 | 4.5 |
IC50* - Концентрация цистеина в, вызывающая ингибирования активности на 50%;Ki,**- константа ингибирования САТ цистеином.
каталитической активности. Наибольшая степень десенсибилизации к ингибированию цистеином вызывалась мутацией cysE5 (концентрация цистеина, снижающая ферментативную активность на 50% (IC50) составляла 1100 мкМ, что превышает соответствующую величину для штамма дикого типа на 3 порядка. Эта десенсибилизация сопровождалась все же некоторым снижением каталитической активности.
Определение нуклеотидной последовательности области гена, соответствующей аминокислотным позициям с 89 по 96 показало, что она содержит мутации, приводящие к заменам аминокислот (Таблица 2). Позиции этих замен отличаются от позиций ранее известных мутаций. Характерно, что у более эффективных мутантов (cysE5, cysE15 и cysE12) в рандомизированной последовательности появляются аминокислотные остатки пролина и глицина, что должно влиять на пространственное расположение Asp92 в каталитическом центре относительно лигандов (серин, цистеин).
Таблица 2. Нуклеотидные и аминокислотные последовательности, соответствующие позициям 89 – 96 структуры САТ, полученные в результате рандомизированного мутагенеза, у наиболее эффективных мутантов по гену CysE.
| Мутация | Происхождение | Нуклеотидная и аминокислотная последовательность (позиции САТ 89-96), подвергшаяся рандомизации (по 6 соседних нуклеотидов близ позиции Asp92) |
| CysE | Дикий тип | cgt acc cgc gac ccg gca gtc gat Arg Thr Arg Asp Pro Ala Val Asp |
| CysE1 | Данная работа. Рандомизация позиций 89 - 96 | ссс acc cgc gac ccg gca gtc gat Pro Thr Arg Asp Pro Ala Val Asp |
| CysE142 | agt cta cgc gac ccg gca gtc gat Ser Leu Arg Asp Pro Ala Val Asp | |
| CysE5 | cgt acc cgc gac ccg gca aga ccc Arg Thr Arg Asp Pro Ala Arg Pro | |
| CysE12 | cgt acc cgc gac ccg gca ggt ggt Arg Thr Arg Asp Pro Ala Gly Gly | |
| CysE15 | cgt acc cgc gac ccg gca cta cca Arg Thr Arg Asp Pro Ala Leu Pro | |
| CysE10 | cgt acc cgc gat ccc aca gtc gat Arg Thr Arg Asp Pro Thr Val Asp | |
| CysE11-2* | cat gta cgc gac gct aca gta gat His Val Arg Asp Ala Thr Val Asp | |
| CysE15-2 | acc cgc cgc gac ccg gca gtc gat Thr Arg Arg Asp Pro Ala Val Asp |
*Объединение двух рандомизированных фрагментов (89-90 и 93-94).
Данные таблицы 3 дают представление о возможном практическом применении полученных мутантов для создания продуцентов цистеина. При концентрации цистеина 0,1 мМ, то есть при концентрации намного превышающей обычную внутриклеточную концентрацию цистеина, полученные в данной работе мутанты практически полностью сохраняют ферментативную активность, тогда как лучшая ранее известная мутация cysE256 в 5 - 6 раз менее эффективна. Что касается САТ из растений Arabidopsis, то хотя такой фермент по своей природе и не чувствителен к ингибированию цистеином, но в связи с низкой активностью и необходимостью специальной адаптации соответствующего гена для его экспрессии в бактериях, а также принимая во внимание ограничения в применении генно-модифицированных организмов практическое использование его для бактериальной продукции цистеина представляется проблематичным.
Таблица 3. Сравнение активности и устойчивости к ретроингибированию цистеином полученных мутантов
| Аллели гена cysE | Происхождение | Относительная активность САТ, % (за 100% принята активность САТ в штамме дикого типа) | Остаточная активность в присутствии 0.1 мM цистеина |
| Arabidopsis thaliana SAT-m | (Takagi et al., 1999) | 1.2 | 100 |
| cysE256 | (Denk, Bock, 1987) | 50.1 | 18.6 |
| CysE1 | Данная работа, рандомизация | 95.2 | 87.5 |
| CysE142 | 72.6 | 31.6 | |
| CysE5 | 42.5 | 100 | |
| CysE12 | 85.7 | 54.4 | |
| CysE15 | 87.5 | 89.3 | |
| CysE10 | 160.2 | <10 | |
| CysE11-2 | 113.1 | 92.1 | |
| CysE15-2 | 65.5 | <10 |
На основе полученных в данной работе мутантов по САТ разработан метод получения цистеина ферментацией, на который получены патенты в России (Патент на изобретение 2279477) и за рубежом (EP1650296, US patent 7,312,058, ).
2. Изучение процессов транспорта предшественника цистеина,
O-ацетилсерина
В процессе создания штамма, способного к продукции цистеина на глюкозе, мы обратили внимание на то, что системы экспорта цистеина из клетки, очевидно, мало специфичны и одновременно с цистеином транспортируют в окружающую среду его предшественник - О-ацетилсерин (ОАС). Было интересно найти транспортеры, которые бы возвращали выброшенный наружу О-ацетилсерин обратно внутрь бактериальной клетки для последующего превращения в цистеин под действием цистеинсинтаз (гены cysK, cysM).
С этой целью были отобраны мутанты, утратившие способность усваивать О-ацетилсерин вместо цистеина. Для этого культуру цистеин-недостаточно штамма MG1655cysE подвергали процедуре мутагенеза (транспозон Tn5). Затем двукратно проводили пенициллиновое обогащение на жидкой среде, содежащей ОАС в качестве источника цистеина. Из 1200 полученных клонов было отобрано 26, которые не росли на среде с ОАС и сульфидом (присутсвие сульфида необходимо, чтобы исключить отбор мутантов с нарушенной сульфатредукцией). Место интеграции транспозона Tn5 в каждом из этих 26-и клонов было определено путем проведения ПЦР с хромосомы мутантов с использованием праймеров на последовательности транспозона Tn-5 с последующим анализом полученных фрагментов путем определения нуклеотидных последовательностей. В результате было установлено, что из 26-и отобранных клонов 22 несли инсерции транспозона Tn5 в гене cysB, кодирующем позитивные регулятор транскрипции цистеинового регулона, а оставшиеся 4 имели двойную вставку транспозона: первая копия транспозона был найдена в гене cysK (кодирующем O-ацетил-L-серин тиоллиазу А), а вторая в гене cysМ (кодирующем O-ацетил-L-серинтиоллиазу B). Инактивация гена cysB, который необходим для экспрессии всех генов цистеинового регулона и в том числе генов, кодирующих цистеинсинтазы, вполне естественна при данном отборе, тогда как вероятность блокирования одновременно двух генов, кодирующих две изоферментные цистеинсинтазы, очень мала. Эти данные с очевидностью указывают на существование значительного количества транспортирующих ОАС белков. Как минимум, таких систем больше двух, иначе они были бы обнаружены при использованной нами методике.
Для дальнейшего поиска мы воспользовались нашим наблюдением, что штамм MG1655cysE не растет на минимальной среде, содержащей все канонические аминокислоты (кроме цистеина) несмотря на присутствие ОАС. Очевидно, что аминокислоты, присутствующие в смеси, каким-то образом препятствуют усвоению ОАС. Для идентификации ингибирующих аминокислот они были распределены по группам, указанным в Таблице 4, и изучалось влияние этих групп на рост цистеин-недостаточного штамма MG1655cysE в присутствии ОАС в качестве заменителя цистеина.
Таблица 4. Рост штамма МG1655cysE на агаре М9 в присутствии ОАС и аминокислотных смесей (20 мг/л каждой)
| Группа аминокислот | Рост | Группа аминокислот | Рост | Группа аминокислот | Рост |
| A+B+C+D | - | A+B+C | ++ | A+B+C+D-asp | - |
| A | ++ | A+B+D | ++ | A+B+C+D-asn | - |
| B | ++ | A+C+D | + | A+B+C+D-lys | - |
| C | ++ | B+C+D | ++ | A+B+C+D-arg | - |
| D | ++ | A+B+C+D -ile | - | A+B+C+D-ser | - |
| A+B | ++ | A+B+C+D-leu | + | A+B+C+D-pro | - |
| A+C | ++ | A+B+C+D-val | - | A+B+C+D-his | - |
| A+D | ++ | A+B+C+D-ala | - | A+B+C+D-gly | - |
| B+C | ++ | A+B+C+D-thr | - | A+B+C+D-tyr | - |
| B+D | ++ | A+B+C+D-glu | - | A+B+C+D-phe | - |
| C+D | ++ | A+B+C+D-gln | + | A+B+C+D-met | ++ |
| A: ile+leu+val+thr+ala; B: glu+asp+gln+asn; C : phe+tyr+trp+pro+his; D : lys+arg+met+gly+ser | |||||
Как оказалось (Таблица 4), рост штамма наблюдался лишь при исключение из смесей метионина, лейцина и глутамина. Присутствие любой из этих трех аминокислот в смесях и особенно лейцина препятствовало усвоению АОС. Надо отметить, что каждая из этих аминокислот в отдельности лишь незначительно подавляла рост на ОАС, т.е. для этого требуется некоторое сочетание аминокислот в среде. По-видимому, обнаруженное нами ингибирование усвоения ОАС может быть связано как с ингибированием транспорта ОАС или сульфида внутрь клеток, так и с ингибированием внутриклеточной цитеинсинтетазной реакции.
Для поиска генетических факторов, обусловливающих усвоение ОАС в присутствии смеси аминокислот, ингибирующих этот процесс, культуру штамма MG1655cysE трансформировали плазмидным банком генов, полученным от этого же штамма на основе плазмидного вектора pSTV24, и отбирали трансформанты, способные расти в присутствии ингибирующей аминокислотной смеси (A+B+C+D, Таблица 4), на среде М9, в которой цистеин заменен на ОАС. Из отобранных трансформантов выднляли плазмидную ДНК и определяли нуклеотидную последовательность хромосомных вставок в отобранных плазмидах. В результате оказалось, что вставки содержат гены marC, ychE, yhgN и sdsRQP.
Известно, что MarC, YchE, YhgN - паралоги, являющиеся белками внутренней мембраны с 6-ю трансмембранными участками. Их структура указывает на родство с помпами множественной лекарственной устойчивости, однако показано, что их функция не связана с устойчивостью к антибиотикам. Считается, что все три гена предположительно кодируют экспортеры из группы детерминантов множественной лекарственной устойчивости (McDermott, 2008).
Белок, кодируемый генами sdsRQP, также является предполагаемой помпой множественной лекарственной устойчивости. В подтверждение этому показано, что инактивация оперона sdsRQP повышает чувствительность к серусодержащим лекарственным средствам (Shimada, 2009). Наши данные не позволяют исключить возможность того, что эти белки являются не помпами-экспортерами, а импортерами ОАС, однако, учитывая их сходство с помпами множественной лекарственной устойчивости, мы все же полагаем, что они таковыми и являются.
Для проведения дальнейшего исследования гены marC, ychE, yhgN и sdsRQP были удалены из хромосомы штамма MG1655cysE. Полученный штамм с делециями этих генов (MG16555), а также с делецией гена cysE, рост которого на ОАС также ингибировался смесями аминокислот, был использован для поиска возможных транспортеров ОАС. При этом культуру штамма MG16555 трансформировали плазмидным банком генов, полученных от исходного штамма MG16555 на основе плазмидного вектора pSTV24, и отбирались трансформанты, способные расти на АОС в присутсвии аминокислотной смеси (19 аминокислот), не содержащей цистеин. Из отобранных трансформантов с восстановленной способностью расти в данных условиях выделяли плазмидную ДНК, и хромосомные вставки на этих плазмидах были определены с помощью секвенирования. Так нам удалось отобрать вставку гена ydgR, который кодирует известный транспортер, относящийся к группе протон-зависимых транспортеров олигопептидов (Weitz et al., 2007).
Ген ydgR был помещен под специально сконструированный сильный промотер гена nlpD в составе вектора pMW118. Промотер гена nlpD, кодирующий один из белков внешней мембраны, был выбран на том основании, что его экспрессия эффективно продолжалась у ряда продуцентов аминокислот на протяжении всего периода выращивания в ферментерах (данные получены методом RNA-array). Под контроль этого промотора был поставлен репортерный ген cysM и -10 и -35 участки промотера были подвергнуты рандомизированному мутагенезу. В результате был получен промотер nlpD8, с которого наиболее эффективно экспрессировался репортерный ген cysM, о чем можно было судить по активности цистеинсинтазы. Полученный промотор использовался также для экспрессии других транспортных белков (Kutukova et al., 2005)
Плазмида pMIW-PnlpD8-ydjR была введена в штамм MG16555, и была подтверждена способность этого транспортера восстанавливать рост на ОАС в присутствии смеси 19 аминокислот. Дополнительно было показано, что клетки штамма MG16555, содержащего экспрессионную плазмиду pMIW-PnlpD8-ydjR, более эффективно потребляли ОАС из среды роста (Рис. 4), чем бесплазмидный штамм.
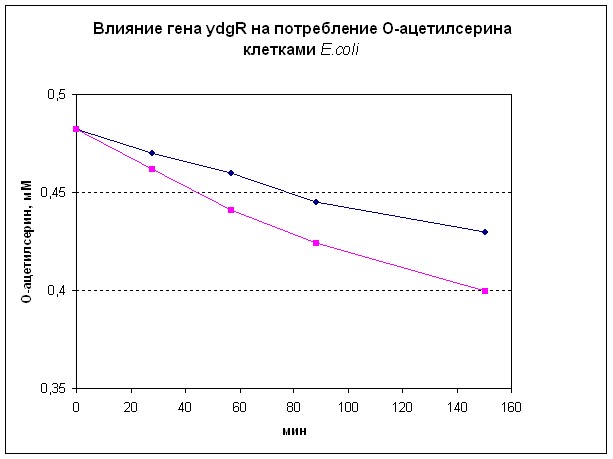
Рис. 4. Поглощение О-ацетилсерина клетками штамма MG16555 (верхняя кривая) и его плазмидного производного MG16555/ pMIW-PnlpD8-ydjR (нижняя кривая).
Проведенные нами исследования указывают на то, что в поглощении АОС из среды участвуют многие неспецифические транспортеры. Роль помп, относящихся к факторам множественной лекарственной устойчивости, может трактоваться двояко: 1) они могут транспортировать АОС внутрь клеток; 2) они не транспортируют АОС внутрь клеток, но под действием накопленных внутриклеточно ингибирующих аминокислот (метионина, лейцина, глутамина) начинают неспецифически выбрасывать из клетки эти аминокислоты, а также другие низкомолекулярные вещества. Это в свою очередь вызывает активацию (дерепрессию) генов, кодирующих целый ряд транспортеров, включая обнаруженный нами ген ydgR, которые способны поглощать из среды необходимые для роста вещества. Что касается гена ydgR, то к его функции относится не только поглощение из среды олигопептидов, но и поглощение ОАС, который структурно напоминает дипептиды.
3. Изучение восстановления S-сульфоцистеина до цистеина клетками кишечной палочки.
Нами был разработан способ получения цистеина ферментацией, осуществляемый сконструированным штаммом кишечной палочки, способным накапливать в ферментационной среде цистеин (Зиятдинов М.Х. и др. 2003. Патент России 2275425). В качестве источника серы использовался тиосульфат-ион, содержащий атом восстановленной серы, который включается в состав цистеина благодаря реакции тиосульфата с О-ацетил-L-серином, катализируемой O-ацетилсерин(тиол)-лиазой-В, кодируемой геном cysM, с образованием S-сульфоцистеина, который в дальнейшем восстанавливается до L-цистеина. Этот процесс протекал недостаточно эффективно, и в ферментационной среде обнаруживался не превращенный в цистеин S-сульфоцистеин.
В связи с отсутствием в литературе сведений о механизме восстановления S-сульфоцистеина до цистеина бактериями представлялось интересным и практически значимым изучить этот процесс. Для этого вначале от цистеин-недостаточного штамма LE392 cysE:: KмR с помощью мутагенеза (нитрозогуанидин) с последующим пенициллиновым обогащением были отобраны 800 мутантов, не способных усваивать S-сульфоцистеин в качестве источника цистеина, но только 18 из них росли на О-ацетилсерине (биосинтетический предшественник цистеина), и эти мутанты изучались далее. В каждый из отобранных мутантов вводился плазмидный (вектор pBR322) банк генов штамма E.coli K12 дикого типа, и отбирались клоны, приобретшие способность усваивать S-сульфоцистеин.
Анализ хромосомных вставок (определение нуклеотидной последовательности) в плазмидах показал следующее: 5 клонов содержали ген gshA (фермент глутамат-цистеин лигаза), 4 - gshB (глутатион синтаза), 9 - ген ydjN (неизвестный консервативный трансмембранный белок). Указанные гены были клонированы из хромосомы E.coli с помощью метода ПЦР и затем введены в соответствующие им мутанты, и полученные трансформанты действительно приобретали способности усваивать S-сульфоцистеин в качестве заменителя цистеина.
Инактивация генов, необходимых для синтеза глутатиона (gshA, gshB), у отобранных мутантов, утративших способность к усвоению S-сульфоцистеина, непосредственно указывало на участие глутатиона в восстановлении S-сульфоцистеина. Как оказалось, внесение в среду роста глутатиона позволяло расти на S-сульфоцистеине мутантам, недостаточным по цистеину, у которых были выявлены инактивации генов gshA или gshB. Оставалось неясным, является ли процесс восстановления с помощью глутатиона в качестве донора электронов неферментативным или он опосредован каким-либо дополнительным, вероятно, белковым фактором. Нами было показано (Таблица 5), что даже в присутствии глутатиона (универсальный восстановитель у бактерий) и фермента, регенерирующего окисленный глутаредоксин в его восстановленную форму в присутствии его кофактора, NADPH, не происходит восстановления S-сульфоцистеина. В тоже время, при добавлении бесклеточного экстракта штамма дикого типа E.coli MG1655 наблюдалось интенсивное восстановление S-сульфоцистеина, что означает обязательность участия какого-то дополнительного фактора из клеточного экстракта. При этом необходим был как глутатион, так и его регенерирующая система.
Table 5. Демонстрация энзиматического характера восстановления
S-сульфоцистеина
| Бесклеточный экстракт Е.coli K12 MG1655 (0, 1 мг белка на 1 мл | Глутатион, (12мМ) | Глутатион редуктаза (1 ед./мл) + NADPH (0.1мM) | Активность S-сульфоцистеин редуктазы (нмоль/мин/ мг белка) |
| - | - | - | <0.5 |
| - | - | + | <0.5 |
| - | + | - | <0.5 |
| - | + | + | <0.5 |
| + | - | - | 2,4 |
| + | + | - | 3.9 |
| + | - | + | 1.1 |
| + | + | + | 38 |
Тот факт, что при первичном отборе не усваивающих S-сульфоцистеин мутантов не удалось отобрать мутантов по белкам, катализирующих процесс восстановления S-сульфоцистеина, указывал на то, что таких белковых факторов может быть одновременно несколько. Они, по-видимому, относятся к какой-то одной группе. Мы предположили, что такими белками могут быть глутаредоксины, так как известно, что они способны восстанавливать дисульфидные мостики за счет энергии NADPH, кроме того, кишечная палочка содержит как минимум 3 вида глутаредоксинов (Aslund F. et al, 1994).
Чтобы проверить это предположение, делеции известных генов, кодирующих глутаредоксины grxA, grxВ и grxС, были перенесены в цистеин-недостаточный штамм LE392 cysE::KmR. Также были сконструированы штаммы с делециями по всем трем указанным генам. Как оказалось, все они не утратили способность расти на S-сульфоцистеине как единственном источнике серы. Кроме того гены grxA, grxВ и grxС были клонированы на плазмидный вектор pMW118, и полученные плазмиды были трансформированы в штамм, где были делетированы все три гена, кодирующих глутаредоксины. В полученных трансформантах, а также в исходном штамме с векторной плазмидой была измерена энзиматическая активность S-сульфоцистеин редуктазы. Оказалось (Таблица 6), что делеция гена grxC приводит к двукратному уменьшению активности S-сульфоцистеинредуктазы, тогда как делеции двух других генов, кодирующих глутаредоксины, grxА и grxВ, существенного влияния на активность S-сульфоцистеин редуктазы не оказали.
Таблица 6. Активность S-сульфоцистеин редуктазы в штаммах с инактивированными и амплифицированными генами для глутаредоксинов
| Штаммы | Плазмиды | Активность S-сульфо-цистеинредуктазы (нмоль/мин/мг белка) |
| MG1655 | pMW118 (вектор) | 26,1 |
| MG1655 grxA | pMW118 | 28,3 |
| MG1655 grxB | pMW118 | 20,1 |
| MG1655grxC | pMW118 | 13,7 |
| MG1655grxAgrxBgrxC | pMW118 | 11,2 |
| pMW-grxA | 12,1 | |
| pMIV-grxB | 39,2 | |
| pMIV-grxC | 201,9 |
Если амплификации гена grxA не сказывалась на способности клеток восстанавливать S-сульфоцистеин, то амплификация гена grxC повышала эту способность на порядок, а амплификация гена grxB увеличивала эту способность приблизительно на 40% (Таблица 6). Таким образом, GrxA в восстановлении S-сульфоцистеин участия не принимает, GrxB может восстанавливать S-сульфоцистеин, но его доля в общей клеточной S-сульфоцистеинредуктазной активности составляет не более 10%, в то время как доля GrxC в общей клеточной S-сульфоцистеинредуктазной активности можно оценить в 60%. Этим S-сульфоцистеинредуктазной активность не исчерпывается, остается еще примерно 35% активности, природа которой еще не ясна.
Способ получения цистеина с помощью штамма E.coli, в котором увеличена активность глутаредоксина, кодируемого геном grxC, защищен патентом России 2458981 ( Зиятдинов М.Х. и др., 2010).
4. Изучение функции продукта гена ydjN
Как сказано ранее, помимо мутаций в генах синтеза глутатиона, неспособность усваивать S-сульфоцистеин вызывает мутация в гене ydjN. Этот ген кодирует белок массой 42,7 кДа, в котором отчетливо фиксируются 10 трансмембранных доменов, что позволяет сделать предположение, что он может участвовать в транспорте S-сульфоцистеина в клетку. Для доказательства этой гипотезы, от цистеин-недостаточного штамма были получены производные с делециями либо генов, кодирующих ферменты, ответственные за синтез глутатиона, gshА (фермент глутамат-цистеин лигаза) и gshB (глутатионсинтаза), либо с делеций гена ydjN. Оказалось (Таблица 7), что все полученные производные утратили способность расти на S-сульфоцистеине, однако в отличие от делеции генов gshA или gshB делеция гена ydjN позволяла расти при добавлении смеси предшественника цистеина, О-ацетилсерина с тиосульфатом. То есть, функция гена ydjN не затрагивает внутриклеточного образования цистеина из S-сульфоцистеина, а очевидно связана с транспортом S-сульфоцистеина в клетку.
Таблица 7. Рост штаммов E.coli, не способных усваивать S-сульфоцистеин для синтеза цистеина на различных предшественниках цистеина.
| Штамм | Цистеин, 0,4 мМ | S-сульфоцистеин, 0.3 mM | О-ацетилсерин (1 mM) и сульфид(0.4 mM) | О-ацетилсерин (1 мM) И тиосульфат (0.4 mM) |
| LE392 cysE | + | + | + | + |
| LE392 cysE gshA | + | - | + | - |
| LE392 cysE gshB | + | - | + | - |
| LE392 cysE ydjN | + | - | + | + |
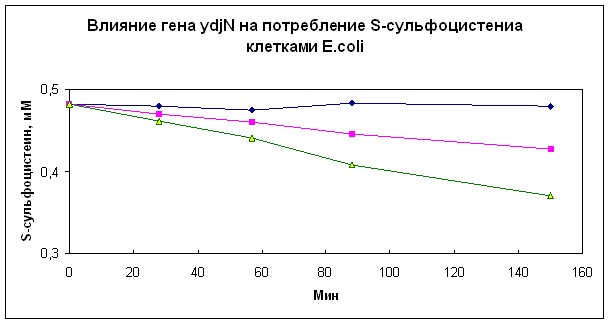
Для подтверждения этого вывода измеряли потребление S-сульфоцистеина из жидкой минимальной среды штаммами, различающимися присутствием гена ydjN. Как показано на рис. 4, клетки штамма с делецией гена ydjN, не потребляли S-сульфоцистеин из среды в отличие от штамма с интактным геном ydjN. Амплификация этого гена на плазмиде существенно ускоряла этот процесс (рис.5 А). Таким образом, несомненно, что белок YdjN является импортером S-сульфоцистеина, локализованным в мембране кишечной палочки, на что указывают результаты проведенных нами экспериментов, а также выявленные в его структуре транс-мембранные элементы.
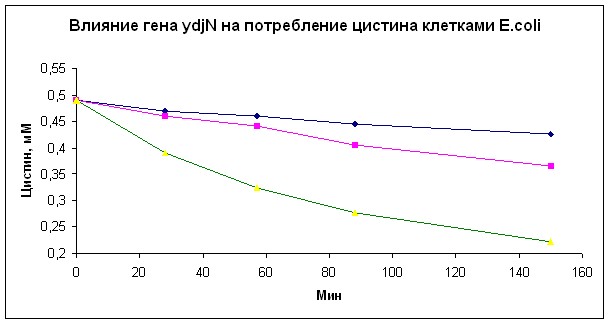
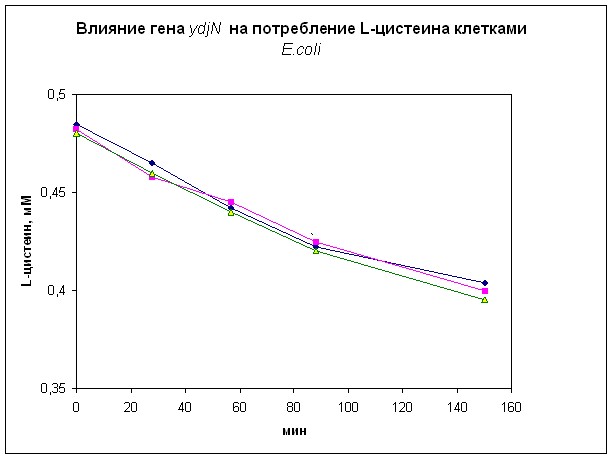
Как показали аналогичные эксперименты с этими же штаммами, белок YdjN может транспортировать в клетки цистин (рис. 5 В), но не цистеин (рис. 5 С).
Рис. 5. Влияние гена ydjN на потребление S-сульфоцистеина (А), цистина (В) и цистеина (С) клетками E.coli.
Выводы
- С помощью компьютерного моделирования построена трехмерная структура активного центра серин-О-ацетилтрансферазы кишечной палочки, содержащего связанный в нем L-серин (субстрат фермента). Сравнение полученной структуры с аналогичной структурой, содержащей цистеин, показало важность пространственного положения Asp92 для связывания цистеина. Сделан вывод о необходимости смещения положения Asp92 путем случайного подбора (рандомизации) ближайших аминокислотных остатков для ослабления связывания цистеина (ингибитор).
- Методом рандомизированного мутагенеза участка гена cysE, кодирующего соседние с Asp92 аминокислоты, получены мутации, вызывающие практически полную десенсибилизацию серин-О-ацетилтрансферазы к ингибированию цистеином без снижения каталитической активности.
- Показано, что для импорта предшественника цистеина О-ацетилсерина клетками необходима активность ряда генов, кодирующих помпы предположительно относящиеся к группе факторов множественной лекарственной устойчивости (МarC, YchE, YhgN и SdsRQP). Продемонстрирована способность ранее известного транспортера олигопептидов YdgR транспортировать О-ацетилсерин.
- Показано, что для превращения S-сульфоцистеина, который образуется вместо цистеина при усвоении клетками тиосульфата в качестве источника серы, необходимы белки группы глутаредоксинов. Наибольшее значение имеет GrxC, на долю которого приходится около 60% общей S-сульфоцистеинредуцирующей активности.
- Показано, что ген ydjN, кодирующий трансмембранный белок, необходим для импорта S-сульфоцистеина. YdjN участвует также в транспорте цистина, но не цистеина в клетки E.coli.
Список работ, опубликованных по теме диссертации
1) Kutukova EA, Livshits VA, Altman IP, Ptitsyn LR, Zyiatdinov MH, Tokmakova IL, Zakataeva NP. (2005) The yeaS (leuE) gene of Escherichia coli encodes an exporter of leucine, and the Lrp protein regulates its expression. FEBS Lett. 579 (21):4629-34.
2) Kai Y, Kashiwagi T, Ishikawa K, Ziyatdinov MK, Redkina EI, Kiriukhin MY, Gusyatiner MM, Kobayashi S, Takagi H, Suzuki E. (2006). Engineering of Escherichia coli L-serine O-acetyltransferase on the basis of crystal structure: desensitization to feedback inhibition by L-cysteine. Protein Eng Des Sel. 2006, 19(4):163-7.
3) Касиваги Т., Каи Ю., Исикава К., Сузуки Э., Такаги Х., Зиятдинов М.Х., Редькина Е.И., Гусятинер М.М (2003). Мутантная серинацетилтрансфераза…, Патент России 2279477,
Патент США US7312058, Mutant serine acetyltransferase.
Европейский патент EP1650296, Mutant serine acetyltransferase and process for producing L-cysteine.
4) Зиятдинов М.Х., Самсонов В.В., Гусятинер М.М. (2009). Способ получения L-цистеина, L-цистина, S-сульфоцистеина или тиазолидинового производного L-цистеина, или их смеси с использованием бактерии семейства Enterobacteriaceae. Патент России 2458982 (2012),
5) Зиятдинов М.Х., Самсонов В.В., Гусятинер М.М. (2010). Способ получения L-цистеина с использованием бактерий семейства Enterobacteriaceae. Патент России 2458981 (2012).
Заявка на патент в США 20120237986А1

