Изучение функционирования склонной к ошибкам днк-полимеразы йота в экстрактах нормальных и опухолевых клеток человека и мыши
На правах рукописи
ЛАХИН АНДРЕЙ ВАСИЛЬЕВИЧ
ИЗУЧЕНИЕ ФУНКЦИОНИРОВАНИЯ СКЛОННОЙ К ОШИБКАМ ДНК-ПОЛИМЕРАЗЫ ЙОТА В ЭКСТРАКТАХ НОРМАЛЬНЫХ И ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА И МЫШИ
Специальность: 03.01.03 – Молекулярная биология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2013

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Процессы репликации и репарации ДНК в клетках эукариот являются очень сложными и осуществляются большим набором ферментов и регуляторных белков. В норме процесс репликации обеспечивается группой специализированных репликативных ДНК-полимераз. Однако на поврежденной или модифицированной ДНК эти ДНК-полимеразы не способны эффективно функционировать, что вызывает блок репликации. Для решения этой проблемы в клетке активируются механизмы, задействующие специализированные репаративные ДНК-полимеразы, осуществляющие синтез ДНК через повреждение – TLS-ДНК-полимеразы. Одной из особенностей TLS-ДНК-полимераз является то, что они способны эффективно и во многих случаях корректно встраивать нуклеотиды напротив поврежденных оснований. Однако из-за структурных особенностей каталитических центров TLS-ДНК-полимеразы, по сравнению с репликативными ДНК-полимеразами, при синтезе ДНК на неповрежденных матрицах допускают ошибки намного чаще. Данный конфликт пользы (преодоление блока репликации и поддержание стабильности генома) и вреда (высокая частота ошибок синтеза, приводящая к мутациям, т.н. error-prone synthesis) в нормальных клетках разрешается жесткой регуляцией функционирования TLS-ДНК-полимераз как на уровне транскрипции, так и на посттрансляционном уровне. Тем не менее, некоторые двухвалентные катионы металлов способны не только провоцировать снижение точности синтеза ДНК, но и приводить к сильной активации отдельных TLS-ДНК-полимераз.
Изменение активности ДНК-полимераз в присутствии повышенных концентраций некоторых двухвалентных катионов металлов может негативно сказаться на многих ключевых процессах клетки. Так, около сорока лет назад была сформулирована мутационная гипотеза возникновения рака. Согласно этой гипотезе, ранние события канцерогенеза могут быть следствием генерации мутаций из-за снижения точности работы репликации и репарации. Было показано, что одним из механизмов увеличения уровня мутагенеза в клетках является дерегуляция активности репаративных ДНК-полимераз. В связи с этим, изучение биохимических свойств и особенностей регуляции репаративных ДНК-полимераз, в том числе и TLS-ДНК-полимераз, может лечь в основу понимания тех механизмов, которые происходят при злокачественной трансформации клетки. Одной из наиболее слабо изученных TLS-ДНК-полимераз является ДНК-полимераза йота (Рol ).
Рol относится к Y-семейству ДНК-полимераз и характеризуется крайне низкой точностью синтеза. К настоящему моменту биохимические свойства Рol описаны в значительном количестве работ, однако в большинстве из них изучались чистые препараты рекомбинантного фермента. В этом случае остается совершенно невыясненным то, как происходит функционирование Pol в живой клетке в присутствии содержащихся там разнообразных регуляторных факторов. Изучение активности Pol в экстрактах клеток может позволить в определенной мере решить эту проблему.
Цель и задачи работы.
Цель настоящей работы заключалась в изучении функционирования склонной к ошибкам ДНК-полимеразы йота в экстрактах нормальных и опухолевых клеток человека и мыши. Были поставлены следующие задачи:
- получение высокоаффинного и специфичного РНК аптамера к Pol ;
- изучение воздействия полученного аптамера на активность как гомогенного препарата Pol, так и на активность этого фермента в экстрактах нормальных и опухолевых клеток человека;
- изучение влияния 8 наиболее распространенных металлов в виде двухвалентных катионов на активность всего комплекса ДНК-синтезирующих ферментов;
- изучение влияния концентрации Mn2+ на синтез ДНК и на активность Pol в экстрактах нормальных и опухолевых клеток человека.
Научная новизна и практическая значимость работы.
Исследовано влияния 8 распространенных и биологически значимых металлов (в виде двухвалентных катионов) на функционирование всего комплекса ДНК-полимераз в экстрактах клеток эукариот. Охарактеризовано влияние двухвалентных катионов металлов на точность синтеза ДНК. В работе показано, что наибольшее снижение точности синтеза ДНК вызывает Mn2+. Установлено, что снижение точности синтеза ДНК в присутствии Mn2+ обусловлено активацией некорректной активности ДНК-полимеразы йота (Рol ). Впервые получен и охарактеризован РНК-аптамер к Рol. Установлено, что полученный аптамер эффективно подавляет активность как гомогенного препарата Рol, так и активность Рol в экстрактах клеток нормальных и опухолевых тканей человека. Потенциально данный аптамер может быть использован в терапии для снижения уровня мутагенеза, обусловленного повышенной активностью Рol.
Основные положения, выносимые на защиту.
- получение и характеристика РНК-аптамера к ДНК-полимеразе йота (Рol );
- полученный аптамер способен эффективно подавлять ДНК-полимеразную активность как гомогенного препарата Рol, так и активность Рol в экстрактах клеток нормальных и опухолевых тканей человека;
- охарактеризовано влияние 8 двухвалентных катионов металлов на точность синтеза ДНК (изучаемого в реакции элонгации радиоактивно меченого праймера) в экстрактах клеток млекопитающих;
- снижение точности синтеза ДНК в присутствии Mn2+ обусловлено активацией склонной к ошибкам ДНК-полимеразы йота.
Публикации и апробация работы.
По материалам диссертации опубликовано 7 работ, из них 3 статьи и 4 – материалы конференций.
Основные положения работы были представлены автором на 15-й Международной Пущинской школе-конференции молодых ученых «Биология – наука XXI века» (Пущино, Россия, 2011), на 4-й Международной конференции молодых ученых «Молекулярная биология: достижения и перспективы» (Киев, Украина, 2011), на 8-й Международной конференции “Молекулярная генетика соматических клеток” (Звенигород, Россия, 2011).
Диссертационная работа была апробирована на заседании Ученого совета ФГБУН ИМГ РАН 23 сентября 2013 года и на семинаре секции «Молекулярная биология» Ученого совета ФГУП «ГосНИИгенетика» 23 сентября 2013 года.
Структура и объем работы.
Диссертация состоит из 6 разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждение», «Выводы» и «Список литературы». Материалы диссертации изложены на 115 страницах, содержат 24 рисунка и 3 таблицы. Список цитируемой литературы содержит 246 источников.
основное содержание работы
1. Получение РНК-аптамеров к Pol .
Существующие на сегодняшний день данные о возможной биологической роли ДНК-полимеразы йота (Pol ) в клетке порой весьма противоречивы. Одним из подходов к решению этой проблемы могло бы стать использование аптамеров, специфически ингибирующих ДНК-полимеразную активность этого фермента. Анализ синтеза ДНК в экстрактах различных типов клеток в отсутствие функционирующей Pol позволил бы более детально выяснить ее роль в процессах репликации и репарации. Преимуществом использования для данных целей аптамеров по сравнению, например, с антителами, является низкий молекулярный вес, очень высокая специфичность и возможность экспрессии непосредственно в клетке.
Для селекции РНК-аптамеров к Pol человека использовали исходный олигонуклеотидный пул (ИОП), полученный в результате транскрипции in vitro химически синтезированной олигодезоксирибонуклеотидной библиотеки. Конечный обогащенный пул олигорибонуклеотидов был получен после проведения пяти раундов процедуры SELEX на нитроцеллюлозных фильтрах и пяти последующих раундов на глутатион-сефарозе. С каждым раундом минимальная концентрация Pol, при которой детектировалось связывание с радиоактивно мечеными олигорибонуклеотидами, понижалась вплоть до 9 раунда. Поскольку аффинность пула олигорибонкулеотидов 10 раунда не отличалась от аффинности пула олигорибонуклеотидов 9 раунда, в конечном итоге был клонирован пул кДНК 9 раунда.
С целью проанализировать наибольшее количество аптамеров, исключив при этом из исследования дублирующиеся аптамеры с идентичной нуклеотидной последовательность, был проведен SSCP-анализ олигорибонуклеотидов из 30 разных клонов E. coli. Для этой цели использовали метод РНК-SSCP, позволяющий с большой вероятностью различать олигорибонуклеотиды, отличающиеся даже по одному нуклеотиду. В результате проведения РНК-SSCP показано, что конформеры всех проанализированных аптамеров одинаковы. Полученный результат указывал на идентичность структур проанализированных аптамеров.
Следующий этап характеризования аптамеров заключался в выяснении их первичной структуры. Определение нуклеотидных последовательностей 5 случайных аптамеров, клонированных в E. coli после 9-ого раунда SELEX, показало их идентичность (Рис. 1 а). Это согласуется с результатами анализа РНК-SSCP и подтверждает их корректность.

Рис. 1. Структура аптамера IKL5. (а) Нуклеотидная последовательность IKL5. Нуклеотиды, которые соответствуют вариабельному участку библиотеки, подчеркнуты. (б) Вероятная вторичная структура аптамера IKL5, определенная с помощью программы RNAstructure (http://rna.urmc.rochester.edu/rnastructure.html).
Для дальнейших исследований был использован аптамер из клона 5, названный IKL5. С помощью программы RNAstructure была определена наиболее стабильная и, следовательно, наиболее вероятная вторичная структура аптамера (рис. 1 б). Для оценки аффинности аптамера IKL5 к Pol и определения его константы диссоциации были проведены эксперименты по связыванию радиоактивно меченого IKL5 с серией разведений Pol. На основании полученных результатов, обработанных в программе GraFit, определена константа диссоциации аптамера IKL5 к Pol, значение которой равняется 4,2±1,4 нМ.
Одним из этапов характеризования аптамера явилось также выяснение специфичности его связывания с Pol (Рис. 2). Для этого провели эксперимент по конкурентному связыванию аптамера IKL5 с Pol на нитроцеллюлозных фильтрах. В результате показано, что радиоактивно меченый аптамер IKL5 вытесняется из комплекса с Pol только самим «холодным» аптамером IKL5, в то время как ни избыток аптамера 32 (получен нами ранее к Pol ), ни избыток ИОП не влияли на стабильность комплекса IKL5-Pol. Полученные результаты позволяют заключить, что аптамер IKL5 специфически связывается с Pol.
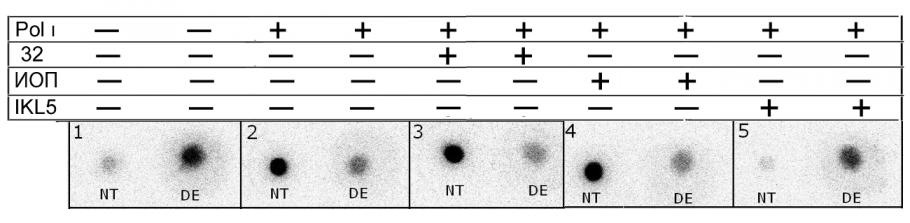
Рис. 2. Конкурентное связывание радиоактивно меченого аптамера IKL5 с Pol. Меченый аптамер IKL5 (50 нМ) инкубировали с 10 нМ Pol в присутствии 500 нМ «холодных» аптамера 32, ИОП или аптамера IKL5. Пробы пропускали через два фильтра: расположенный сверху нитроцеллюлозный фильтр (NT) связывал РНК в составе комплекса с Pol, нижний диэтиламиноэтил-целлюлозный фильтр (DE-фильтр) задерживал не связавшиеся с белком олигорибонуклеотиды.
2. Ингибирование ДНК-полимеразной активности гомогенного препарата Pol аптамером IKL5.
С целью изучения ингибирующего действия полученного аптамера на ДНК-полимеразную активность гомогенного препарата Pol человека проведены реакции синтеза ДНК, катализируемые этой ДНК-полимеразой, в присутствии аптамера IKL5 (1 мкМ). В качестве отрицательных контролей выступали ИОП (1 мкМ), аптамер 32 к Pol (1 мкМ) и р-р NaCl (10 мМ). При тестировании ДНК-полимеразной активности препарата Pol в области 18-членного продукта присутствовали две полосы (18А и 18G), являющиеся отличительной особенностью синтеза, осуществляемого Pol (Рис. 3).
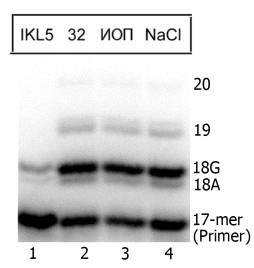
Рис. 3. Синтез ДНК, катализируемый гомогенным препаратом Pol, в присутствии аптамера IKL5 и ряда отрицательных контролей. В качестве кофактора синтеза ДНК в реакционной смеси присутствовал MgCl2 (1 мM).
Анализ полученных данных позволяет говорить о значительном подавлении ДНК-полимеразной активности Pol аптамером IKL5 (Рис. 3). Активность Pol при данных условиях проведения реакции составляла всего ~15% от активности фермента без добавления аптамера. В то же время в присутствии отрицательных контролей снижения ДНК-полимеразной активности Pol не наблюдалось (Рис. 3).
С целью выяснить величину IC50 для гомогенного препарата Pol проведено изучение зависимости ДНК-полимеразной активности Pol от концентрации аптамера IKL5. Проведенный анализ полученных результатов показал, что величина IC50 для гомогенного препарата Pol составляет 49±16 нМ.
3. Влияние аптамера IKL5 на интенсивность образования продуктов с некорректно встроенным G напротив T матрицы в экстрактах нормальных и опухолевых клеток человека.
Поставлены эксперименты по изучению влияния аптамера IKL5 на синтез ДНК в экстрактах различных клеток человека. Об активности Pol судили по количеству специфичного для фермента продукта синтеза ДНК с некорректно включенным G напротив T матрицы. Результаты синтеза ДНК в экстрактах клеток увеальной меланомы глаза человека представлены на Рис. 4.
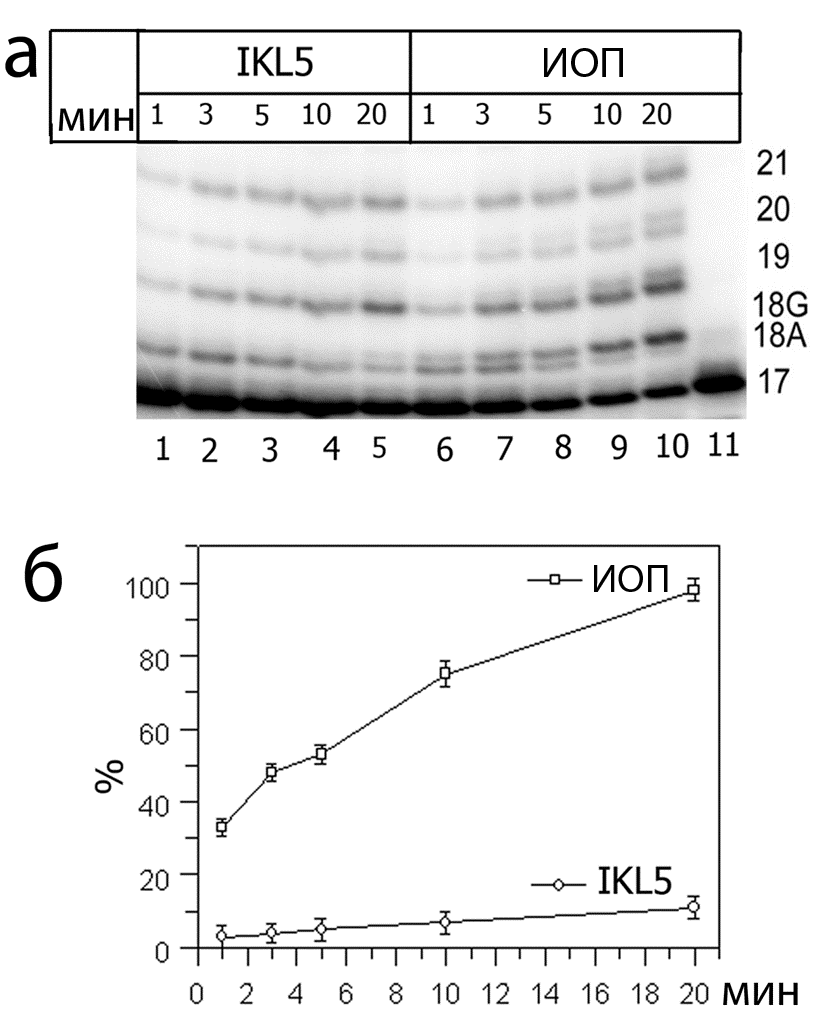
Рис. 4. Влияние аптамера IKL5 (1 мкМ) на синтез ДНК в экстрактах клеток увеальной меланомы человека. (а) Электрофореграмма продуктов синтеза. В качестве отрицательного контроля применен ИОП (1 мкМ). (б) График зависимости образования продуктов активности Pol от времени проведения реакции (вычислен на основании электрофореграммы (а)).
Видно, что добавление аптамера в реакционную смесь, содержащую экстракт клеток меланомы, приводит к значительному, почти полному, исчезновению продуктов с некомплиментарно встроенным G напротив T матрицы. Количество продуктов с некорректно встроенным G в присутствии аптамера даже на 20 мин реакции значительно меньше, чем количество данных продуктов в реакции без аптамера после 1 мин.
Также изучено влияние аптамера IKL5 на синтез ДНК в экстрактах клеток нормальной ткани (хориоидея) и в экстрактах клеток опухолевых линий (SKOV-3 и HL-60) (Рис. 5). Во всех этих экстрактах добавление аптамера IKL5 приводило к ингибированию образования продуктов с некорректно встроенными нуклеотидами, что на электрофореграмме вырожается в виде исчезновения верхних полос в районе 18, 19 и 20-членных продуктов элонгации праймера. В то же время стоит отметить, что интенсивность полос, соответствующих продуктам активности других ДНК-полимераз, остается неизменной.
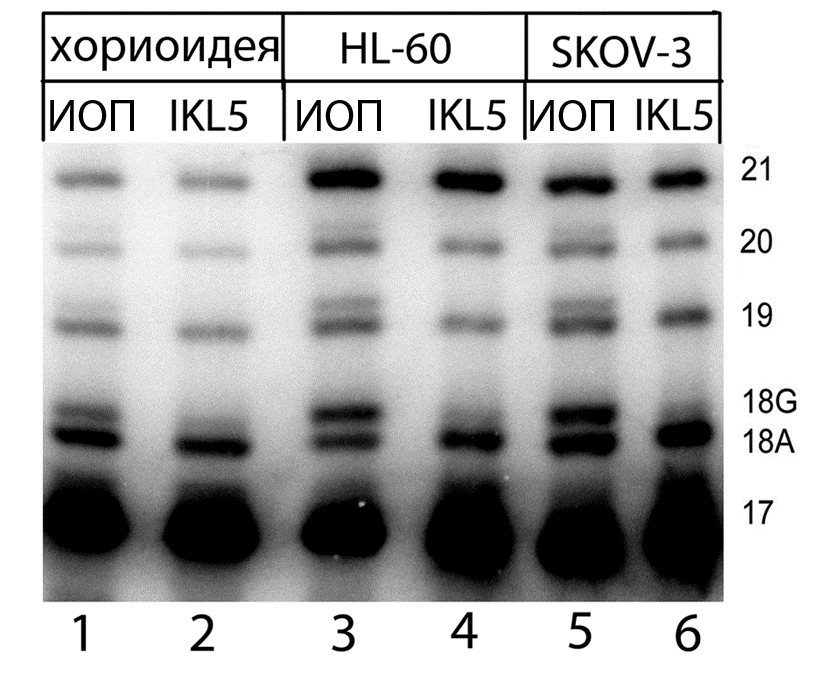
Рис. 5. Электрофореграмма продуктов синтеза, отображающая влияние аптамера IKL5 (1 мкМ) на синтез ДНК в экстрактах различных тканей. Время реакции – 20 мин. В качестве отрицательного контроля применен ИОП (1 мкМ).
Таким образом, продемонстрировано, что добавление аптамера IKL5 к экстрактам различных типов клеток приводит к полному или почти полному подавлению образования продуктов с некорректно встроенным G напротив T матрицы, обусловленных активностью Pol. В результате впервые разработана экспериментальная система, позволяющая как тестировать активность отдельно взятой ДНК-полимеразы в экстрактах клеток человека, так и специфически подавлять эту активность. Разработанная система может послужить основой для проведения дальнейших экспериментов по ингибированию Pol in vivo с целью выяснения ее функций.
Полученный в настоящей работе аптамер IKL5 может найти свое применение в широком круге исследований. Так, важнейшим этапом изучения механизмов регуляции работы Pol в клетке является идентификация белков, взаимодействующих с Pol in vivo. Благодаря специфичности взаимодействия полученного аптамера с Pol возможно выделение связавшихся с иммобилизованым аптамером белков из экстрактов клеток в мягких условиях без разрушения надмолекулярных комплексов. Подавление высокоошибочной активности Pol аптамером IKL5 в экстрактах как опухолевых, так и нормальных клеток позволяет надеяться на использование данного аптамера в качестве терапевтического средства. Подавление ошибочной ДНК-полимеразной активности Pol на ранних стадиях онкогенеза возможно снизило бы скорость мутагенеза и тем самым уменьшило вероятность приобретения одной клеткой необходимых для злокачественной трансформации мутаций. В свою очередь, подавление активности Pol уже в злокачественных опухолевых клетках могло бы привести к снижению адаптивности в ответ на воздействие терапевтических агентов.
4. Роль двухвалентных катионов металлов в функционировании всего комплекса ДНК-полимераз в экстрактах клеток.
Широко известно, что гомогенные препараты большинства ДНК-полимераз в реакциях синтеза ДНК in vitro в качестве основного активирующего кофактора преимущественно используют Mg2+. Однако ДНК-полимеразы могут функционировать в присутствии не только Mg2+, но и ряда других двухвалентных катионов металлов. Например, Mn2+, Co2+, Zn2+ и некоторые другие могут заменять Mg2+, но при этом снижается точность и процессивность синтеза ДНК. В данном аспекте изучение влияния различных двухвалентных катионов металлов на синтез ДНК в экстрактах клеток вызывает особый интерес.
В качестве модельного объекта использовали экстракты клеток головного мозга мышей линии C57Bl. Все металлы, добавляемые в качестве кофакторов синтеза ДНК, представляли собой соли хлора (MCl2). Чтобы оценить не только активирующее, но и ингибирующее воздействие металлов, все реакции синтеза ДНК проводили в присутствии 250 мкМ Mg2+, что приблизительно соответствует физиологической концентрации ионов этого металла в клетке. Такие условия создавали определенный базовый уровень синтеза ДНК. В результате, сравнение синтеза ДНК в отсутствие исследуемого металла (присутствует только 250 мкМ Mg2+) с синтезом ДНК в присутствии заданной концентрации исследуемого металла (250 мкМ Mg2+ и X мкМ исследуемого металла), дает адекватное представление обо всех вызванных изучаемым металлом изменениях в процессах синтеза ДНК.
Первоначально исследована зависимость синтеза ДНК от концентрации Mg2+ в реакционной среде. Анализ полученных данных показал, что с увеличением концентрации катионов этого металла происходит плавное повышение уровня ДНК-полимеразной активности (Рис. 6 а, г).
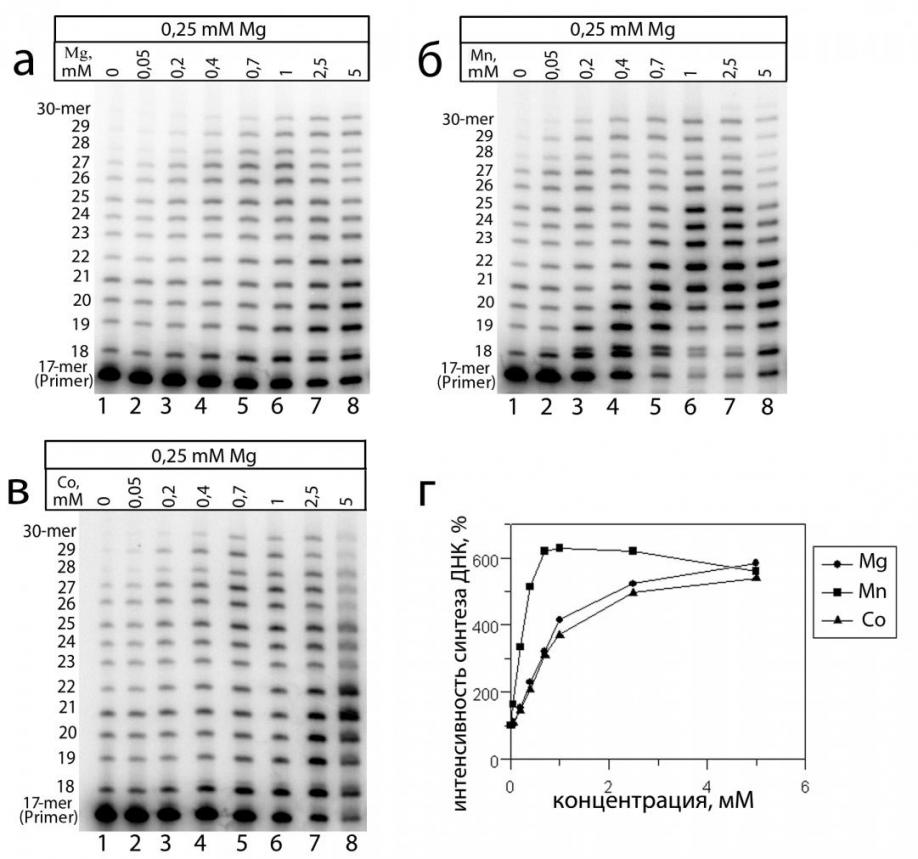
Рис. 6. Влияние Mg2+, Mn2+ и Co2+ на синтез ДНК в экстрактах клеток мозга мыши. Электрофореграмма продуктов синтеза ДНК в присутствии: (а) Mg2+, (б) Mn2+, (в) Co2+. (г) График, отображающий изменения интенсивности синтеза ДНК от концентрации двухвалентного катиона металла (вычислен на основании электрофореграмм (а), (б), (в); за 100% взята интенсивность синтеза на базовом уровне в присутствии только 250 мкМ Mg2+ - дорожка 1).
При максимальной концентрации Mg2+ (5 мМ) образуется приблизительно в 6 раз больше продуктов синтеза, чем при базовой концентрации (т.е. в присутствии 250 мкМ Mg2+). Следует отметить, что увеличение количества всего спектра продуктов синтеза ДНК (от 18 до 30-членного олигонуклеотида) происходит довольно равномерно. Это указывает на существование баланса между работой дистрибутивных и процессивных ДНК-полимераз в данных условиях. Кроме Mg2+ из всех проверенных катионов металлов способностью активировать образование всего спектра продуктов синтеза ДНК обладали еще два иона: Mn2+ и Co2+ (Рис. 6 б, в).
Иную ситуацию наблюдали при проведении реакции элонгации радиоактивно меченого праймера в присутствии Cd2+ и Zn2+ (Рис. 7).

Рис. 7. Влияние Cd2+ и Zn2+ на синтез ДНК в экстрактах клеток мозга мыши. Электрофореграмма продуктов синтеза ДНК в присутствии: (а) Cd2+, (б) Zn2+. (в) График, отображающий изменения интенсивности синтеза ДНК от концентрации двухвалентного катиона металла (вычислен на основании электрофореграмм (а) и (б); за 100% взята интенсивность синтеза на базовом уровне в присутствии только 250 мкМ Mg2+ - дорожка 1).
При увеличении концентраций ионов этих металлов до 1 мМ они значительно усиливали образование продуктов синтеза ДНК. Однако данное усиление синтеза ДНК обусловлено в основном образованием продуктов с включенными в праймер 1-2 нуклеотидами (Cd2+) или 1-4 нуклеотидами (Zn2+). В обоих случаях накопления продуктов с включенными 5-13 нуклеотидами почти не происходило. Данные факты свидетельствуют о том, что Cd2+ и Zn2+ способны к активации только дистрибутивного синтеза, не влияя на процессивный синтез, обеспечиваемый на базовом уровне Mg2+. Также стоит отметить, что большие концентрации Cd2+ и Zn2+ приводили к ослаблению и полному подавлению синтеза ДНК.
К третьей группе отнесены двухвалентные катионы металлов, присутствие которых в реакционной смеси не приводило к значительной активации синтеза ДНК (Рис. 8).
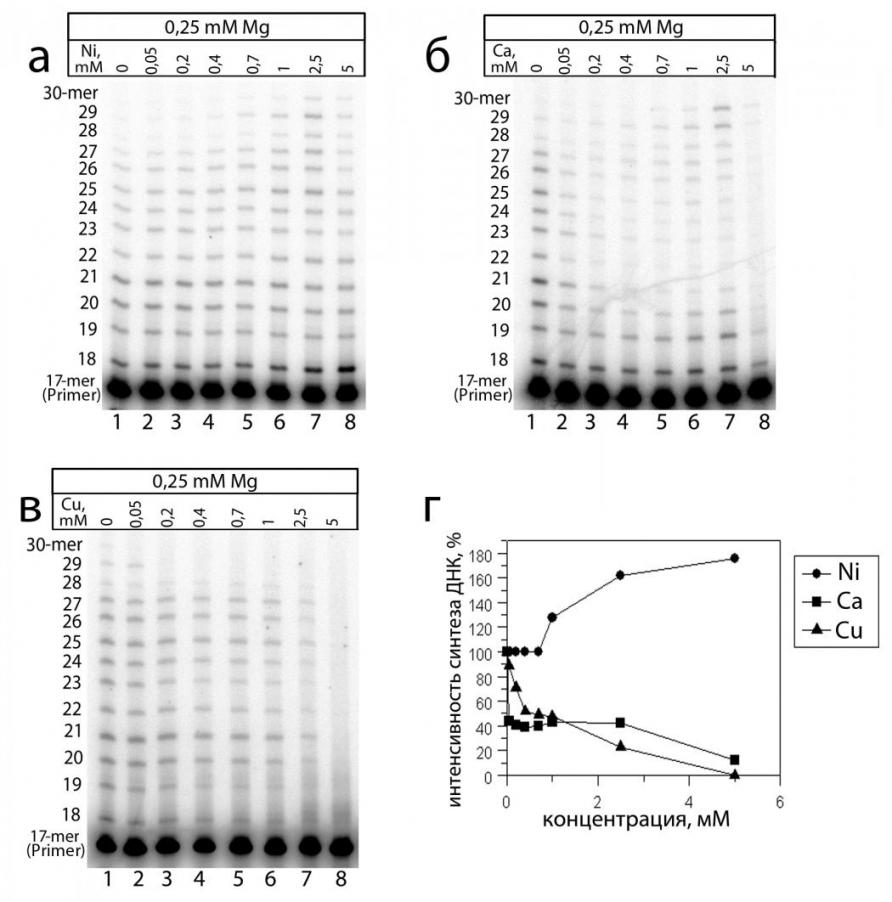
Рис. 8. Влияние Ni2+, Ca2+ и Cu2+ на синтез ДНК в экстрактах клеток мозга мыши. Электрофореграмма продуктов синтеза ДНК в присутствии: (а) Ni2+, (б) Ca2+, (в) Cu2+. (г) График, отображающий изменения интенсивности синтеза ДНК от концентрации двухвалентного катиона металла (вычислен на основании электрофореграмм (а), (б), (в); за 100% взята интенсивность синтеза на базовом уровне в присутствии только 250 мкМ Mg2+ - дорожка 1).
К ним принадлежит Ni2+, обуславливавший незначительное усиление ДНК-полимеразной активности, а также Ca2+ и Cu2+, приводившие к снижению образования продуктов синтеза ДНК приблизительно в 2-3 раза. Отсутствие существенной активации синтеза ДНК наряду с ингибирующим воздействием указывает на отсутствие ДНК-полимераз, способных эффективно использовать данные катионы металлов в качестве кофакторов.
5. Влияние двухвалентных катионов металлов на ошибочность синтеза ДНК.
В результате реакции элонгации радиоактивно меченого праймера образуется набор продуктов, различающихся по количеству включенных нуклеотидов. Эти продукты в ходе электрофореза разделяются на отдельные полосы. Наличие на электрофореграммах дополнительных минорных полос указывает на образование продуктов с некорректно включенными нуклеотидами. С помощью программы Image Quant нами были проанализированы все электрофореграммы с продуктами синтеза ДНК, осуществляемого в присутствии изучаемых двухвалентных катионов металлов. Полученные данные представлены в виде таблицы, отображающей влияние двухвалентных катионов металлов на образование продуктов синтеза ДНК с некорректно включенными нуклеотидами (Таблица 1).
По результатам анализа из всех проверенных металлов Mn2+ обладал наибольшей способностью снижать точность синтеза ДНК (активировать некорректный синтез ДНК). Кроме того, ионы этого металла вызывали наибольшее снижение точности синтеза при относительно низких концентрациях (200-700 мкМ), в то время как у Mg2+ наибольшее снижение точности синтеза ДНК проявлялось лишь при максимальных концентрациях (Таблица 1, Рис. 6). Из всех остальных изученных двухвалентных катионов металлов незначительной способностью активировать включение некорректных нуклеотидов обладал только Co2+.
Таблица 1. Влияние двухвалентных катионов металлов на образование продуктов синтеза ДНК с некорректно включенными нуклеотидами
| Ион | Продукты синтеза ДНК с некорректно включенными нуклеотидами, % | Концентрация иона, при которой отмечается наибольшее включение некорректных нуклеотидов, мМ |
| Mg2+ | 2,5±0,5 | 5 |
| Mn2+ | 9±0,5 | 0,4 |
| Co2+ | <1±0,3 | 0,7 |
| Cd2+ | <0,1 | - |
| Zn2+ | <0,1 | - |
| Ni2+ | <0,1 | - |
| Ca2+ | <0,1 | - |
| Cu2+ | <0,1 | - |
Примечательно, что обусловленный Mn2+ эффект активации некорректного синтеза достаточно четко проявляется уже при минимальной использованной концентрации этого металла (50 мкМ). Визуально данный некорректный синтез ДНК на электрофореграммах особенно четко проявляется в виде второй полосы, идущей чуть медленнее 18-членного продукта (Рис. 6 б). Основная (нижняя) полоса в области 18-членного продукта отражает продукт корректного включения А напротив Т матрицы. Минорная (верхняя) полоса отражает включение некорректного нуклеотида напротив Т матрицы, что и обуславливает более медленное движение образовавшегося продукта. Способностью предпочтительнее встраивать некорректный G напротив Т матрицы, создавая подобного рода включение, характеризуется одна из самых неточных ДНК-полимераз – ДНК-полимераза йота. Данный фермент способен избирательно встраивать G напротив Т даже в присутствии избытка комплиментарного dATP. Кроме того, известно, что ДНК-синтезирующая активность гомогенных препаратов Pol очень сильно увеличивается в присутствии Mn2+. Следует отметить, что Pol является единственной ДНК-полимеразой, чей оптимум активности (75 мкМ) находится близко к максимальному физиологическому содержанию Mn2+ в клетке (40-50 мкМ).
Далее необходимо было выяснить, обусловлено ли усиление некорректного синтеза ДНК в присутствии Mn2+ активацией именно Pol. Для этого были проведены реакции элонгации радиоактивно меченого праймера с экстрактами клеток мозга 129J линии мышей, характеризующейся нонсенс-мутацией в гене, кодирующем Pol. Активация синтеза ДНК в присутствии Mg2+ и Mn2+ в экстрактах клеток мозга 129J линии мышей была абсолютно такой же (Рис. 9), как и в экстрактах мышей линии C57Bl без мутации в гене Pol (Рис. 6). Единственным отличием было то, что в экстрактах клеток мозга 129J линии мышей некорректная ДНК-полимеразная активность практически полностью отсутствовала. На основании этих данных можно предположить, что основной точкой приложения Mn2+ в усилении некорректного синтеза ДНК в экстрактах клеток является повышение некорректной активности Pol.
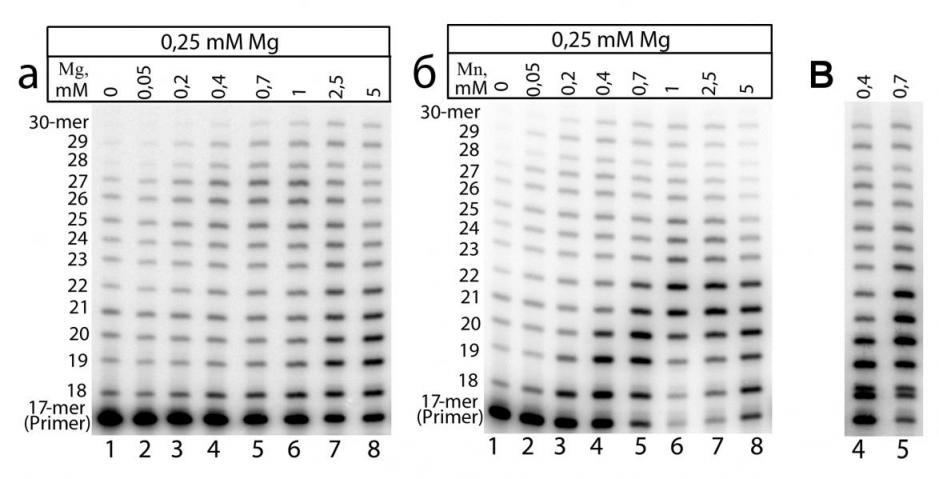
Рис. 9. Влияние концентрации (а) Mg2+ и (б) Mn2+ на синтез ДНК в экстрактах клеток мозга мыши 129J линии. Для сравнения приведены две дорожки, отражающие влияние Mn2+ на синтез ДНК в экстрактах клеток мозга мыши линии C57Bl (в).
Сравнение синтеза ДНК в экстрактах клеток мозга мышей линии 129J и линии C57Bl наглядно показывает ту значительную роль в активации некорректного синтеза, которую может обеспечить Pol при повышении концентрации ионов марганца в клетке. В силу мутагенных свойств, обусловленных некорректным синтезом ДНК, активность Pol в нормальных тканях, по-видимому, строго регулируется. Однако полученные результаты позволяют предположить, что повышенная концентрация Mn2+ в клетке дает возможность Pol преодолеть эту регуляцию, многократно увеличивая ее некорректную ДНК-синтезирующую активность. Учитывая, что в клетках концентрация Mn2+ в норме может находиться и так на достаточно высоком уровне (50 мкМ), можно предположить, что даже относительно небольшое повышение концентрации Mn2+ способно привести к значительному снижению точности синтеза ДНК за счёт активации Pol. Полученные данные позволяют сформулировать гипотезу, согласно которой хроническое воздействие марганца на организм человека может приводить к локальной активации Pol в клетках тканей, в которых происходит специфическое накопление этого металла. К таким тканям относятся области мозга globus pallidus и substantia nigra. Снижение точности синтеза ДНК в результате активации Pol ионами Mn2+, вероятно, способно провоцировать последующее повреждение и значительное снижение числа нейронов в этих областях мозга за счет дестабилизации генома. В свою очередь постепенное уменьшение числа нейронов в Mn-накапливающих областях мозга выражается в виде развития таких заболеваний как манганизм и Mn-индуцированный паркинсонизм.
6. Изменения в Mn-индуцированной некорректной активности Pol в экстрактах клеток под воздействием двухвалентных катионов металлов.
Наблюдавшееся в настоящей работе влияние двухвалентных катионов различных металлов на синтез ДНК в экстрактах клеток обусловлено изменениями в активности всего комплекса ДНК-синтезирующих ферментов. Изменения в активности отдельных ДНК-полимераз в экстрактах клеток изучить очень сложно, поскольку продукты синтеза ДНК почти у всех ДНК-полимераз идентичны. В качестве исключения можно выделить Pol, активность которой благодаря свойству предпочтительнее встраивать некомплиментарный G напротив T матрицы достаточно условно можно отличить от активностей других ДНК-полимераз. Это позволило изучить изменения в Mn-индуцированной активности Pol (детектируемая как продукт синтеза ДНК с некорректно включенным нуклеотидом напротив Т матрицы) в экстрактах клеток мозга мышей линии C57Bl в ответ на присутствие того или иного катиона металла. Реакцию элонгации радиоактивно меченого праймера проводили в присутствии 250 мкМ Mg2+, 200 мкМ Mn2+ и 200 мкМ одного из двухвалентных катионов металла (Рис. 10).
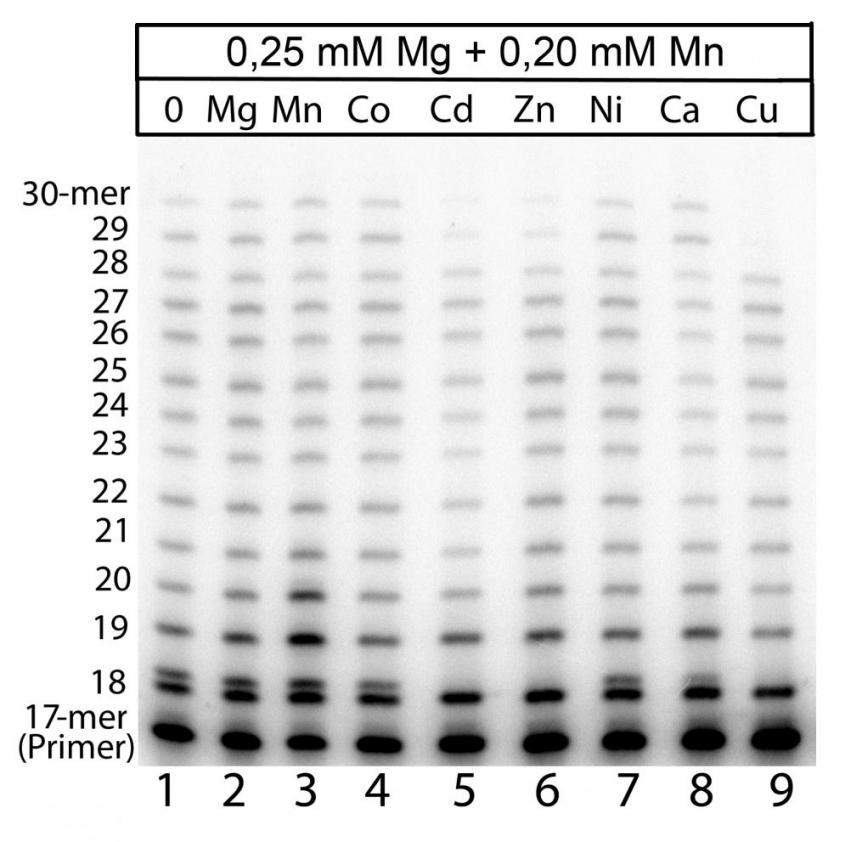
Рис. 10. Влияние различных двухвалентных катионов металлов на Mn-индуцированную некорректную активность Pol в экстрактах мозга мышей линии C57Bl. Реакционные смеси содержали 250 мкМ Mg2+, 200 мкМ Mn2+ и 200 мкМ изучаемого иона.
Используемые в реакции синтеза ДНК концентрации двухвалентных катионов металлов были взяты с учетом того, что физиологическое содержание Mg2+ в клетке составляет порядка 250 мкМ и эта концентрация обеспечивает определенный уровень активности ДНК-полимераз экстрактов клеток. В предварительных экспериментах нами было выяснено, что 200 мкМ Mn2+ обеспечивают образование наибольшего количества продуктов с некомплиментарно включенными нуклеотидами. Таким образом, изучение изменений в Mn2+-индуцированной некорректной активности Pol под воздействием различных двухвалентных катионов металлов в оптимальных условиях позволяет исключить ложноположительные результаты, которые могли бы возникнуть в результате действия неспецифических факторов на ферментативную активность (например, таких как изменения в интенсивности образования некорректных продуктов синтеза ДНК в ответ на изменение ионной силы раствора при добавлении дополнительного количества изучаемых катионов металлов).
Как видно из Рис. 10, все металлы, активирующие суммарный синтез ДНК, почти не влияли на активность Pol. Кроме того, металлы, активирующие дистрибутивный синтез ДНК (Cd2+ и Zn2+), полностью подавляли активность Pol, которая сама является крайне дистрибутивной ДНК-полимеразой. Среди металлов, не оказывающих существенного влияния на синтез ДНК, только Cu2+ ингибировал ферментативную активность Pol, а Ni2+ и Ca2+ почти не влияли на активность этого фермента.
7. Изменения в Mn-зависимом синтезе ДНК, происходящие при злокачественной трансформации клетки.
Еще около сорока лет назад была сформулирована мутационная гипотеза возникновения рака, согласно которой ранние события канцерогенеза могут быть следствием генерации мутаций из-за нарушения точности работы механизмов репликации и репарации. Было показано, что одним из механизмов запуска мутагенеза в клетках может являться дерегуляция и неконтролируемое увеличение активности репаративных ДНК-полимераз. В связи с этим особый интерес представляет изучение происходящих при злокачественной трансформации клеток изменений в синтезе ДНК: интенсивность включения нуклеотидов и точность их встраивания. На Рис. 11 представлена типичная картина синтеза ДНК в присутствии Mn (в реакционной среде содержалось 250 мкМ Mg2+ и 200 мкМ Mn2+), осуществляемая в экстрактах клеток хориоидеи (дорожка 1) и меланомы (дорожка 2), взятых от одного и того же пациента.
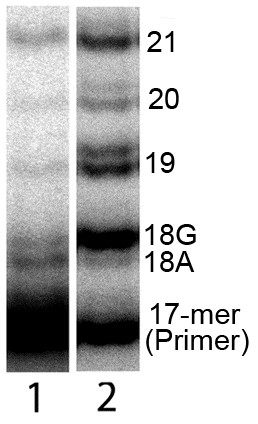
Рис. 11. Сравнение синтеза ДНК в присутствии Mn2+ в экстрактах клеток хориоидеи (дорожка 1) и увеальной меланомы глаза (дорожка 2) человека.
Количество белка в обоих экстрактах и условия проведения реакции были идентичны. Анализ электрофореграмм показал, что в экстрактах клеток меланомы происходит усиление общего синтеза ДНК в 6 раз по сравнению с синтезом в экстрактах клеток хориоидеи. Эти различия обусловлены в основном значительно возросшей активностью Pol. Количество ее специфических продуктов с некомплиментарно включенным нуклеотидом увеличивается в 10-12 раз, в то время как количество продуктов корректных ДНК-полимераз увеличивается лишь в 4 раза.
Как известно, увеальная меланома глаза образуется из клеток хориоидеи. В связи с этим сравнение синтеза ДНК в обоих типах тканей, взятых от одних и тех же людей, дает довольно адекватную картину тех количественных и качественных изменений в синтезе ДНК, которые осуществляются в клетке при злокачественной трансформации. Как показал анализ электрофореграмм, основными изменениями в синтезе ДНК при злокачественной трансформации являются сильно возросшая активность Pol и появление способности преодолевать Т-стоп (способность к элонгации продуктов синтеза ДНК с некорректно включенными нуклеотидами). Ранее нами была проведена оценка количества Pol методом Вестерн-блоттинга в экстрактах хориоидеи и увеальной меланомы. Было показано, что в экстрактах хориоидеи Pol не детектируется, а в экстрактах меланомы этот фермент четко выявляется. Это позволяет сделать вывод, что сильно возросшая активность Pol в экстрактах клеток меланом может быть отчасти обусловлена усилением экспрессии данного фермента, произошедшем при злокачественной трансформации клеток. С другой стороны, появление феномена преодоления Т-стопа может говорить о значительных изменениях в комплексе регуляторных факторов, что, по-видимому, приводит к ослаблению контроля над высокоошибочными репаративными ДНК-полимеразами и разбалансировке механизмов синтеза ДНК.
Выводы
1. Получен и охарактеризован РНК-аптамер к ДНК-полимеразе йота (Pol ) человека, осуществляющий специфическое ингибирование активности гомогенных препаратов этого фермента и при этом не влияющий на активность гомогенных препаратов ДНК-полимераз бета и каппа человека.
2. В экстрактах всех исследованных типов раковых и нормальных клеток человека ошибочный синтез ДНК, обусловленный функционированием Pol, эффективно подавляется с помощью полученного аптамера. При этом суммарная активность других ДНК-полимераз не изменяется.
3. С помощью разработанной экспериментальной модели охарактеризовано влияние 8 биологически значимых двухвалентных катионов металлов на активность всего комплекса ДНК-синтезирующих ферментов в экстрактах клеток млекопитающих. Показано, что в присутствии Mg2+, Mn2+ и Co2+ происходит детектируемое снижение точности синтеза ДНК, наиболее значимое снижение вызывают ионы марганца за счет активации Pol.
4. Установлено, что некорректная активность Pol, индуцированная добавлением ионов марганца к экстрактам клеток, эффективно ингибируется ионами кадмия и цинка.
5. Во всех изученных экстрактах тканей человека и мыши повышение концентрации Mn2+ приводит к значительной активации Pol. В исследованных экстрактах опухолей (увеальная меланома глаза человека) и в экстрактах клеток опухолевых линий человека (SKOV-3 и HL-60) повышение концентрации Mn2+ обуславливает также приобретение способности к элонгации продуктов синтеза ДНК с некорректно включенными нуклеотидами (преодоление Т-стопа).
Список работ, опубликованных по теме диссертации:
- Lakhin, A.V., Kazakov, A.A., Makarova, A.V. Pavlov, Y.I., Efremova, A.S., Shram, S.I., Tarantul, V.Z., Gening, L.V., 2012. Isolation and Characterization of High Affinity Aptamers Against DNA Polymerase Iota. Nucleic Acid Ther. 22, 49-57.
- А.В. Лахин, А.С. Ефремова, И.В. Макарова, Е.Е. Гришина, С.И. Шрам, В.З. Тарантул, Л.В. Генинг. 2013. Влияние Mn (II) на ошибочную активность ДНК-полимеразы йота в экстрактах нормальных и опухолевых клеток человека. Молекулярная генетика, микробиология и вирусология. №1, С. 14-20.
- Л.В. Генинг, А.В. Лахин, Е.В. Стельмашук, Н.К. Исаев, В.З. Тарантул. 2013. Ингибирование Mn2+-индуцированного некорректного синтеза ДНК с помощью Cd2+ и Zn2+. Биохимия. Т. 78, №10, С. 1452-1462.
- Лахин А.В., Казаков А.А., Макарова А.В., Тарантул В.З., Генинг Л.В. РНК-аптамеры к ДНК-полимеразе йота как перспективные агенты диагностики и терапии злокачественного перерождения. Доклад на 15-ой Международной Пущинской школе-конференции молодых ученых «Биология – наука XXI века». Пущино, 18 - 22 апреля 2011 года.
- Lakhin A.V., Tarantul V.Z., Efremova A.S., Schramm S.I., Gening L.V. Supression of error prone synthesis in cell extracts of cancer cell lines by an aptamer against DNA polymerase iota: a new perspective approach to fight cancer. Доклад на The 4th International IMBG conference for young scientists "MOLECULAR BIOLOGY: ADVANCES AND PERSPECTIVES". Киев, 14 - 17 сентября 2011 года.
- Лахин А.В., Тарантул В.З., Ефремова А.С., Шрам С.И., Генинг Л.В. Подавление ошибочного синтеза в экстрактах клеток опухолевых клеточных линий SCOV-3 и HL-60 аптамером IKL5 к ДНК-полимеразе йота. Доклад на VIII Международная конференция “Молекулярная генетика соматических клеток”. Звенигород, 6-9 декабря 2011 г.
- Лахин А.В., Генинг Л.В., Тарантул В.З. Выделение и характеристика аптамера к ДНК полимеразе йота человека, повышенно синтезирующейся в раковых клетках. Доклад на 2nd International Interdisciplinary Conference on "MODERN PROBLEMS IN SYSTEMIC REGULATION OF PHYSIOLOGICAL FUNCTIONS". Bodrum (Turkey), 22-29 июня 2012 года.

