Филогенетический анализ изолятов реовируса кур и изучение биологических свойств изолята arv04/02rus, выделенного на территории рф
На правах рукописи
Зиняков Николай Геннадьевич
ФИЛОГЕНЕТИЧЕСКИЙ АНАЛИЗ ИЗОЛЯТОВ РЕОВИРУСА КУР И ИЗУЧЕНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ ИЗОЛЯТА ARV04/02rus, ВЫДЕЛЕННОГО НА ТЕРРИТОРИИ РФ
03.02.02 «Вирусология»
Aвтореферат
диссертации на соискание ученой степени
кандидата биологических наук
Владимир – 2012
Работа выполнена в Федеральном государственном бюджетном учреждении «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), г. Владимир.
Научный руководитель – доктор биологических наук, профессор
Дрыгин Владимир Викторович
Официальные оппоненты:
Сухарев Олег Иванович
доктор ветеринарных наук, профессор,
профессор кафедры ветеринарной патологии Российского университета дружбы народов (РУДН), г. Москва
Балышева Вера Ивановна
доктор биологических наук, старший научный сотрудник,
ведущий научный сотрудник Государственного научного учреждения «Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии» (ГНУ ВНИИВВиМ Россельхозакадемии), г. Покров
Ведущая организация – Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»), г. Москва
Защита диссертации состоится 15 мая 2012 г. в «1200» часов на заседании совета по защите докторских и кандидатских диссертаций Д 220.015.01 при ФГБУ «Федеральный центр охраны здоровья животных» по адресу: 600901, г. Владимир, мкр. Юрьевец, ФГБУ «ВНИИЗЖ».
С диссертацией можно ознакомиться в библиотеке ФГБУ «Федеральный центр охраны здоровья животных»
Автореферат разослан «11» апреля 2012 г.
Ученый секретарь совета по защите
докторских и кандидатских диссертаций
ФГБУ «ВНИИЗЖ»
доктор биологических наук А.П. Пономарев
1. Общая характеристика работы
Актуальность темы. Реовирусная инфекция птиц – вирусное заболевание, характеризующееся поражением двигательного аппарата, развитием у птицы малабсорбционного синдрома. Возбудителем заболевания является реовирус птиц, принадлежащий к роду Orthoreovirus семейства Reoviridae.
Высоковирулентные штаммы реовируса кур (РК) вызывают поражение различных органов птицы, при этом гибель птиц при экспериментальном заражении в раннем возрасте может достигать 100% [14]. Экономический ущерб птицеводству, причиняемый реовирусом, не ограничивается прямыми потерями, значительные убытки могут быть вследствие снижения яйценоскости и прироста массы тела при хронически протекающем инфекционном процессе [11]. Необходимо отметить возможные осложнения и низкую эффективность вакцинации молодой птицы живыми вакцинами при скрытой инфекции [10].
Результаты исследований, проведенных в ФГБУ «ВНИИЗЖ», свидетельствуют о сохранении проблемы реовирусной инфекции на птицефабриках РФ [6]. Среди изолятов реовируса кур, выявленных на территории РФ, наблюдается значительное генетическое разнообразие, что требует усовершенствования существующих молекулярно-генетических методов выявления вирусного генома [1]. Использование современных методов молекулярной диагностики позволяет в кратчайшие сроки произвести идентификацию возбудителя, определить первичную структуру вариабельных участков вирусного генома для быстрой характеристики выявленных изолятов. Последующий анализ генома позволяет сделать предположение о возможных изменениях биологических свойств исследуемого изолята вследствие генетических изменений за счет инсерций, делеций, единичных замен, способных вызвать сдвиг рамки считывания. Однако качество и полнота филогенетического анализа зависят от наличия доступных баз данных для того или иного возбудителя, что определяет актуальность исследований структуры вирусного генома вновь выделяемых возбудителей. Поскольку маркеры патогенности для РК не установлены, секвенирование полного генома вирулентных изолятов способствует решению проблемы выявления генетических детерминант вирулентности.
Степень разработанности проблемы. Отечественными исследователями изучены биологические свойства ряда штаммов реовируса кур, исследованы антигенные свойства выделенных изолятов, показана возможность применения метода полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) для выявления реовируса кур [1, 4, 5].
Цель и задачи исследования. Цель данных исследований заключалась в изучении генетического разнообразия популяции реовируса кур на территории РФ, детальном изучении генетических особенностей и биологических свойств изолята ARV04/02rus. Для достижения поставленной цели было необходимо решить следующие задачи:
1. С помощью разработанных ранее методов, провести исследования на наличие реовируса кур в пробах патологического материала, полученных из птицеводческих хозяйств.
2. Провести сравнительный и филогенетический анализ нуклеотидных последовательностей участка гена S3 изолятов РК, выявленных в РФ в период с 2007 по 2011гг.
3. Изучить патогенные свойства изолята ARV04/02rus для цыплят и куриных эмбрионов (КЭ).
4. Определить нуклеотидную последовательность геномных сегментов изолята ARV04/02rus.
5. Провести анализ нуклеотидных последовательностей геномных сегментов изолята ARV04/02rus.
Научная новизна исследования. Определены нуклеотидные последовательности участка гена S3 117 изолятов РК, выявленных на территории РФ и стран ближнего зарубежья в период с 2007 по 2011гг. Выявлены изоляты из генетических групп, не зарегистрированных ранее на территории РФ.
Показана патогенность изолята ARV04/02rus для 11-суточных куриных эмбрионов и 3-суточных цыплят.
Расшифрована и проанализирована нуклеотидная последовательность транслируемых участков геномных сегментов изолята РК ARV04/02rus.
Практическая значимость исследования. В процессе научно-исследовательской работы по теме диссертации были разработаны методы для оценки антигенной активности вируссодержащего материала, предложен метод выявления реовируса кур на основе ОТ-ПЦР-РВ, проработаны технические моменты, связанные с исследованием вирусного генома методом секвенирования с применением коммерческих наборов и автоматизированных станций.
Соответствие содержания диссертации паспорту специальности 03.02.02 «Вирусология». В соответствии с формулой специальность 03.02.02 «Вирусология» представляет собой область науки, занимающуюся исследованием вирусов, их происхождения, состава, строения, генетики, морфологии, механизмов размножения, аспектов взаимоотношений с клеточными организмами, проблемами противовирусного иммунитета, патогенности вирусов, разработкой мер и средств предупреждения, диагностики и лечения вызываемых вирусами заболеваний. В диссертационной работе приведены исследования по разработке методов выявления реовируса кур и изучения вирусного генома. Представлены результаты анализа генетического разнообразия среди выявленных возбудителей, характеристика биологических и филогенетических свойств изолята реовируса кур ARV04/02rus.
Результаты научного исследования соответствуют 3, 4, 6, 8, 9 пунктам паспорта специальности.
Апробация работы. Результаты исследований по теме диссертации доложены и обсуждены на заседаниях учёного совета ФГБУ «ВНИИЗЖ» в 2007-2011 гг., представлены на Международном ветеринарном конгрессе по птицеводству в Марокко (Маракеш, 2009).
Публикация научных исследований. По теме диссертации опубликовано 5 научных работ, в т.ч. 3 статьи в журналах, включенных в Перечень ведущих рецензируемых научных журналов, рекомендованных ВАК Министерства образования и науки РФ.
Основные положения, выносимые на защиту:
1. Результаты анализа нуклеотидных последовательностей фрагментов гена S3 изолятов РК, выявленных в РФ в 2007-2011гг.
2. Результаты исследования патогенных свойств изолята РК ARV04/02rus для КЭ, 3-суточных цыплят.
3. Результаты анализа геномных сегментов изолята ARV04/02rus.
Структура и объем работы. Диссертация изложена на 147 страницах компьютерного текста и содержит следующие разделы: введение, обзор литературы, результаты собственных исследований и их обсуждение, заключение, выводы, приложения. Список литературы включает 186, источников из которых 162 - иностранные. Работа содержит 13 таблиц и иллюстрирована 46 рисунками.
Личный вклад автора в выполнение работы. Основной объем исследований проведен автором самостоятельно по месту работы в лаборатории диагностики болезней сельскохозяйственных животных ФГБУ «ВНИИЗЖ». Автор выражает искреннюю благодарность сотрудникам ФГБУ «ВНИИЗЖ» канд. биол. наук Андрейчуку Д.Б., канд. биол. наук Колосову С.Н., канд. вет. наук Чвала И.А. за помощь в проведении отдельных этапов работы.
2. Собственные исследования
2.1. Материалы
Для проведения экспериментов использовали:
- изолят ARV04/02rus, выделенный в ФГБУ «ВНИИЗЖ» от кур с патологией суставов в 2002 г;
- культуру клеток куриных фибробластов (культура КФ);
- 11-суточные эмбрионы кур свободных от патогенных факторов СПФ-кур “Lohmann” (Германия);
- клинически здоровых цыплят, не имеющих антител к реовирусу птиц;
- синтетические олигонуклеотиды, синтезированные НПО «Синтол» (Россия).
- реактивы фирм «Promega» (США), «Fermentas» (Литва), «Invitrogen» (США), «Applied Biosystems» (США), «Биоком» (Россия).
2.2. Методы
Выделение нуклеиновой кислоты. Для выделения нуклеиновой кислоты из проб патологического материала использовали коммерческий набор с суспензионным силикатным сорбентом NucleoS+ («Биоком», Россия) согласно инструкции производителя.
Выбор праймеров для обратной транскрипции и ПЦР. Расчет праймеров выполняли с помощью программы Oligo (v.3.3). Оценку эффективности подобранных пар проводили экспериментально.
Реакция обратной транскрипции. Смесь, содержащую 13 мкл выделенной нуклеиновой кислоты и 10 пмоль специфичных праймеров, денатурировали путем нагревания при 96оС в течение 1 мин с последующим резким охлаждением при 0оС и дальнейшей инкубацией в течение 15 мин на льду. После этого в смесь добавляли 5 мкл 5-кратного буфера для реверсии, 0,5 мкл 10 мМ р-ра дезоксинуклеотидтрифосфатов, 1 ед. AMV-ревертазы («Promega»). Наслаивали по 20 мкл минерального масла. Амплификацию проводили на многоканальном амплификаторе «Терцик» («ДНК-Технология», Россия) по программе: 53оС - 30мин.
Полимеразная цепная реакция. Амплификацию кДНК проводили с помощью метода гнездовой ПЦР, для этого в смесь с конечным объемом 25мкл добавляли буфер для Taq-полимеразы в объеме 5 мкл, 2,5 мкл 25 мМ MgCl2, 0,5 мкл 10 мМ р-ра дезоксинуклеотидтрифосфатов, 1 мкл специфичных праймеров в концентрации 10 пмоль и 3 мкл синтезированной кДНК. Реакция включала первоначальную денатурацию 95оС – 2 мин и 40 циклов амплификации по программе: 95оС – 30 сек, 56оС – 30 сек, 72оС – (40-140)сек. С целью повышения специфичности реакции и получения материала для секвенирования проводили дополнительную амплификацию, используя внутреннюю пару праймеров. Реакция включала 25 циклов по программе: 95оС – 30 сек, 56оС – 30 сек, 72оС – (30-90) сек.
Очистка продуктов ПЦР для секвенирования. Очистку продуктов реакции от остальных компонентов ПЦР-смеси проводили согласно ранее предложенному методу [3].
Реакция секвенирования. Секвенирование амплифицированных фрагментов генома изолятов реовируса осуществляли с использованием флюоресцентно-меченых терминирующих нуклеотидов на генетическом анализаторе 3130xl Genetic Analyzer («Applied Biosystems», США) согласно инструкции изготовителя.
Анализ последовательностей ПЦР-ампликонов реовируса кур. Сравнительный анализ последовательностей базы данных GenBank и полученных ПЦР-ампликонов проводили с использованием пакета программ BioEdit (v.5.0.6., 2001г., v.6.0.6., 2004г.) с программами: “Clustal W” (выравнивание последовательностей), “Identity matrix” (вычисление процента сходства последовательностей). Для построения дендрограмм использовали пакет программ Mega (v.1.01, 1999-2001 г.г.) со встроенным алгоритмом анализа.
Определение инфекционной активности. Титрование вируса проводили на культуре клеток куриных фибробластов (КФ) методом последовательных 10-кратных разведений. Титром вируса считали наивысшее его разведение, вызывающее цитопатическое действие (ЦПД) в 50% культуры клеток КФ. Титр вируса выражали в lg ТЦД50/мл и рассчитывали по методу Р. Кербера в модификации И.П. Ашмарина [2].
3. Результаты собственных исследований
3.1. Филогенетический анализ и группирование выявленных изолятов реовируса кур. С помощью реакции ОТ-ПЦР с выбранной системой праймеров на ген S3 в период с 2007 по 2011 гг. была исследована 351 проба патологического материала, поступившего из 62 птицеводческих хозяйств различных регионов РФ, Украины и Республики Беларусь. Фрагменты вирусного генома были выявлены в 117 пробах, что составило 33% от общего числа. По результатам анализа случаев выявления реовируса кур показано преимущественное протекание ассоциированной реовирусной инфекции с другими патологическими агентами (88% от общего числа выявленных случаев). При ассоциированной инфекции максимальный возраст птицы, у которой были выявлены фрагменты реовирусного генома, составил 12 недель. В то же время было отмечено, что реовирус без ассоциированных агентов выявлен лишь у 12% от общего числа исследованных проб, при этом максимальный возраст птицы, от которой были отобраны пробы, составил 45 дней.
На основе доступной информации, представленной в GenBank, и вновь полученных данных по первичной последовательности участка гена S3 все изоляты и штаммы РК были разделены на 11 генетических групп (рис.1).
При выделении генетических групп в качестве основного критерия использовали уровень нуклеотидных отличий равный 10%, предложенный ранее [9]. Мы посчитали целесообразным для анализа дендрограмм ввести термин генетической линии, который подразумевает совокупность генетических групп и отдельных изолятов, имеющих общее направление в развитии, которое выражается в накоплении сходных нуклеотидных и аминокислотных замен. Таким образом, 11 генетических групп, предложенных в результате анализа, можно объединить в 5 генетических линий. Первая генетическая линия состоит из трех групп: IA, IB, IC (рис.1). Группа IA представлена штаммами, выделенными на территории США, острова Тайвань и Японии (S1133USA, 176USA, 1733USA, 2408USA, 601SITaiwan, 750505Taiwan, T6Taiwan, 919Taiwan, ARV G-98, ARV C-98, ARV/GA/1/98, OS161Japan, ARV B-98). Специфические для группы аминокислотные замены отсутствуют. Уровень нуклеотидных отличий внутри группы не превышает 5%. Уровень отличий от представителей других групп варьирует от 9 до 19%. Принимая во внимание высокий уровень нуклеотидной идентичности среди представителей данной группы со штаммом S1133, предлагается обозначение для данной группы «S1133-подобные».
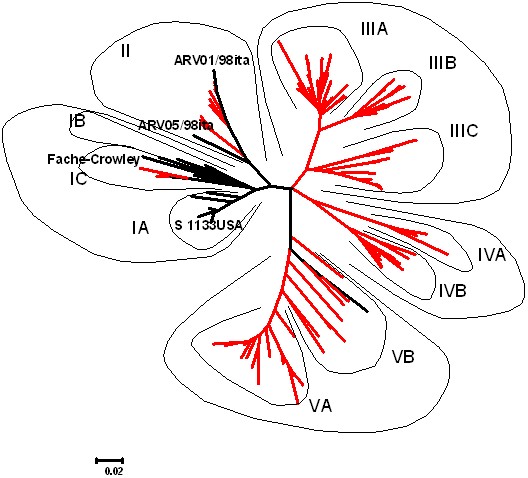
Рис. 1. Филогенетическое дерево, построенное методом NJ по нуклеотидным последовательностям участка гена S3 (645-857 п. н. последовательности штамма S1133 (U20642)) штаммов и изолятов реовируса кур, представленных в GenBank, а также выявленных на территории РФ (2007-2011)
![]() - выявленные на территории РФ 2007-2011
- выявленные на территории РФ 2007-2011
![]() - выделенные в других странах
- выделенные в других странах
Группа IB представлена штаммами, выделенными на острове Тайвань (601GTaiwan, 916Taiwan, 918Taiwan, R2/TWTaiwan, 1017-1Taiwan) (рис.1). Специфические аминокислотные замены отсутствуют. Уровень отличий от представителей других групп варьирует от 9 до 21%.
Группа IC представлена штаммами Fahey-Crowly, ARV/GA/2/98 и тремя выявленными на территории РФ изолятами (ARV06/08rus, ARV06/09rus, ARV12a/09rus). Аминокислоты Val266 и Asp277 выявлены также у представителей группы IIIC и не могут быть специфическими аминокислотными заменами данной группы. Отмечено, что до 2008 г. изолятов, генетически близких представителям IC группы, зарегистрировано не было.
Вторая генетическая линия включает одну группу (рис.1), которая представлена изолятами, выявленными на территории РФ и Украины (ARV16a/07rus, ARV16b/07rus, ARV16c/07rus, ARV16d/07rus, ARV16e/07rus, ARV18/07rus, ARV19/07rus, ARV02/09rus, ARV04a/09rus, ARV08/09rus, ARV13/09rus, ARV15a/09ukr), а также изолятами, любезно предоставленными
д-ром Tozzi J. (Институт зоопрофилактики, г.Брешия, Италия), условно обозначенные как 01/98ita, 02/98ita, 05/98ita. У всех представителей данной группы отмечена аминокислота Tre278, однако в этой позиции треонин отмечен также у представителей группы IVA. Уровень отличий от представителей других групп варьирует от 10 до 22%. Отмечено, что до 2007 г. изолятов, генетически близких представителям II группы, на территории РФ зафиксировано не было. Малое число птицефабрик, а также значительное географическое удаление между птицефабриками, на которых были выявлены данные изоляты, свидетельствует о спорадическом заносе на территорию РФ представителей данной генетической группы.
Наиболее распространенной на территории РФ является третья генетическая линия, состоящая из трех групп: IIIA, IIIB, IIIC. Характерной аминокислотной заменой данной линии является положительно заряженная аминокислота в позиции 230 (Arg или Hys). Для группы IIIA характерно наличие Arg230 и Ala229. У представителей группы IIIB в положении 230 находится гистидин и аланин в положении 229, дополнительно можно отметить наличие Gly218, Ile225, Phe228. У представителей группы IIIC в позиции 230 находится аргинин, Ala229 является скорее исключением, однако характерно наличие Asp277 или Gln277.
Четвертая генетическая линия представлена 2 группами: IVA, IVB (рис.1). Основным отличием изолятов этой генетической линии является Pro229. При этом у группы IVA присутствуют Ser232 и Tre278, тогда как у группы IVB в этих позициях находятся Asp232 и Met278. У группы IVA также можно отметить Ser239.
Для пятой генетической группы (рис.1) затруднительно выделение обособленных генетических групп. Наиболее целесообразным будет разделение на две группы: VA, VB. Из характерных аминокислотных замен можно отметить Asp245, Phe248, Gln277. При этом единственной аминокислотной заменой, не встречающейся у других генетических линий, является Phe248, однако эта замена встречается не у всех представителей группы. Значительное число изолятов, компактно располагающихся на филогенетическом дереве, указывает на происхождение от общего ранее занесенного предка. В то же время наличие промежуточных форм между группами VA и VB (изоляты ARV01/06rus, ARV03/07ukr, ARV03/09rus) свидетельствует о существовании дополнительного локуса образования новых изолятов внутри генетической линии.
3.2. Генетический анализ близкородственных изолятов, выявленных в одном птицеводческом хозяйстве. Имевшие место случаи выявления близкородственных изолятов на одной птицефабрике в разные периоды были использованы для вычисления скорости накопления изменений нуклеотидной последовательности (d) фрагмента гена S3.
d = D1,2/t1,2, где
D1,2 – процент отличий между нуклеотидными последовательностями в паре предок - потомок;
t1,2 – временной интервал между выявлением двух родственных изолятов.
Так, для пары ARV04/00rus и ARV10a/07rus показано, что скорость накопления изменений составила 210-3 замен на нуклеотид в год. Для пары ARV01/02rus и ARV05/07rus она оказалась равной 1110-3 замен на нуклеотид в год. Однако подобные расчеты можно проводить при условии, что ранние изоляты являются предковой формой (или максимально к ней приближенной) для поздних изолятов. Наиболее достоверные данные по вычислению скорости накопления замен можно получить при анализе изолятов ARV03/99rus (EF068269), ARV09/99rus (EF068271), ARV08/01rus (EF068291), ARV13/01rus (EF068296), ARV01/05rus (EF068315), ARV01/06rus, выявленных на одной птицефабрике в течение 8 лет. Все представители этой группы отличаются от изолятов, выявленных в других регионах, что может свидетельствовать об однократном заносе возбудителя и формировании изолированного очага инфекции. Для вычисления средней скорости накопления замен внутри данной группы с помощью программы Excel был произведен расчет коэффициента линейной регрессии, согласно которому скорость накопления замен составила 6,510-3 замен на нуклеотид в год относительно последовательности изолята ARV03/99rus и 5,910-3 замен на нуклеотид в год относительно последовательности изолята ARV09/99rus.
Принимая во внимание различия между последовательностями изолятов ARV03/99rus и ARV09/99rus (4.7%), можно предположить, что оба изолята 1999г. не являются предковой формой более поздних изолятов, а возможный занос возбудителя произошел раньше 1999г. В таком случае максимальная скорость накопления изменений в пределах этой обособленной группы по фрагменту гена S3 составит 6.010-3 замен на нуклеотид в год.
3.3. Изучение патогенных свойств изолята реовируса кур ARV04/02rus для 11-суточных эмбрионов СПФ-кур. Экстраэмбриональную жидкость (ЭЭЖ) с инфекционной активностью 5,0 lg ТЦД50/0,1мл инокулировали в аллантоисную полость экспериментальной группе 11-суточных эмбрионов СПФ-кур. По окончании эксперимента контрольные эмбрионы и живые эмбрионы опытных групп охлаждали при температуре +40С в течение 12 ч.
Гибель всех эмбрионов опытной группы зарегистрирована в интервале 96 - 144 часов после заражения. В процессе вскрытия погибших КЭ наблюдали выраженную гиперемию кожи зараженных эмбрионов и общее отставание в росте, а также обильные кровоизлияния в затылочной области головы. С помощью ОТ-ПЦР вирусный геном был выявлен в пробах аллантоисной жидкости, хориоаллантоисной оболочки (ХАО) и в пробах внутренних органов, отобранных от КЭ экспериментальной группы. Титрование вируссодержащего материала на культуре клеток КФ показало, что наибольший титр инфекционной активности был отмечен в суспензии, приготовленной из ХАО, и был равен 7,25 lg ТЦД50/мл, инфекционный титр хориоаллантоисной жидкости составил 5,25 lg ТЦД50/мл, минимальный был в суммарной суспензии внутренних органов - 3,75 lg ТЦД50/мл.
С целью установления влияния величины заражающей дозы на время гибели эмбрионов было проведено дополнительное экспериментальное заражение. В опыте было использовано 5 групп по 30 КЭ. Каждая группа была инфицирована ЭЭЖ с 10-кратным шагом разведения. Результаты эксперимента представлены в табл. 1.
При заражающей дозе 6-4 lg ТЦД50/мл гибель эмбрионов наступала через 5-6 суток. При заражающей дозе 3 lg ТЦД50/мл полная гибель КЭ экспериментальной группы отодвигалась на 1-2 дня (7-8 суток после инфицирования). При заражении в дозе 2 lg ТЦД50/мл была отмечена гибель лишь 5 КЭ из 30 в течение 6-7 суток после инфицирования.
Таблица 1
Результаты учета гибели эмбрионов СПФ-кур при использовании различных заражающих доз изолята реовируса кур ARV04/02rus
| Группа | Заражающая доза, lg ТЦД50/мл | Число погибших КЭ | |||||||
| 1сут | 2сут | 3сут | 4сут | 5сут | 6сут | 7сут | 8сут | ||
| 1 | 6,0 | 0 | 0 | 0 | 4 | 20 | 6 | - | - |
| 2 | 5,0 | 0 | 0 | 0 | 3 | 15 | 12 | - | - |
| 3 | 4,0 | 0 | 0 | 0 | 2 | 13 | 15 | - | - |
| 4 | 3,0 | 0 | 0 | 0 | 0 | 2 | 10 | 17 | 1 |
| 5 | 2,0 | 0 | 0 | 0 | 0 | 0 | 2 | 3 | 0 |
«-» - полная гибель опытной группы.
3.4. Изучение патогенных свойств изолята ARV04/02rus для 3-суточных цыплят. С целью изучения патогенного действия изолята ARV04/02rus для цыплят 3-суточного возраста, группа из 15 цыплят была инфицирована ЭЭЖ с инфекционной активностью 5,75 lg ТЦД50/мл. Каждому цыпленку в экспериментальной группе перорально было введено 0,1 мл ЭЭЖ. В течение семи суток после заражения было отмечено легкое угнетение птиц. В течение третьих и четвертых суток эксперимента была отмечена гибель двух цыплят. При вскрытии наблюдали обширные кровоизлияния в области скакательных суставов, увеличение почек. Изменений в респираторном и пищеварительном тракте обнаружено не было. Фрагменты вирусного генома были обнаружены у всех павших цыплят в отдельно исследованных пробах легких и трахеи, почек, скакательных суставов.
На седьмые сутки эксперимента были отобраны глоточные и клоакальные смывы. Результаты ПЦР-анализа взятых смывов показаны в табл. 2.
Таблица 2
Результаты выявления генома ARV в смывах
| Группа | Глоточный смыв | Клоакальный смыв |
| Экспериментальная | 7/13* | 10/13 |
| Контрольная | 0/5 | 0/5 |
*- в числителе количество проб, в которых были выявлены фрагменты вирусного генома, в знаменателе общее количество исследованных проб.
Выявление фрагментов вирусного генома в клоакальных смывах подтверждает литературные данные о том, что большое количество возбудителя находится в кишечнике и впоследствии выделяется с пометом, обеспечивая тем самым горизонтальное распространение инфекции [15].
В материале, отобранном через 10 суток после заражения, фрагменты вирусного генома были выявлены в пробах легких, трахеи, почек, тканей скакательного сустава. Пробы легких и трахеи инфицированных цыплят были использованы для вирусовыделения, по результатам которого было установлено наличие активного вируса в органах дыхательной системы. Полученные результаты демонстрируют возможность бессимптомного вирусоносительства и отсутствие поражений в респираторном тракте при заражении цыплят изолятом ARV04/02rus.
Малый процент гибели цыплят в экспериментальной группе (12%) согласуется с литературными данными о том, что пероральный способ заражения с использованием штамма высоковирулентного для суточных цыплят не вызывает 100% гибели у цыплят в возрасте 3-4 суток [13].
3.5. Анализ генома изолята ARV04/02rus. Для секвенирования генов изолята ARV04/02rus были использованы различные системы праймеров (рис.2), при этом зона перекрытия секвенированных фрагментов составляла не менее 100 п.н.
S1 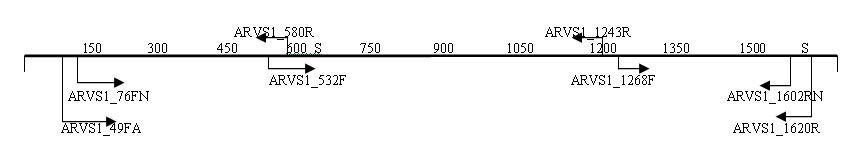
S2 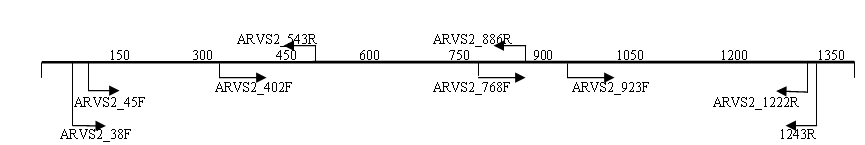
S3 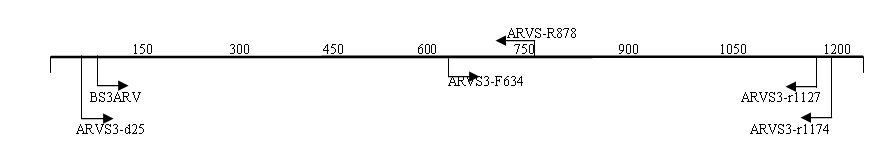
S4 
M1 
M2 
M3 
L1 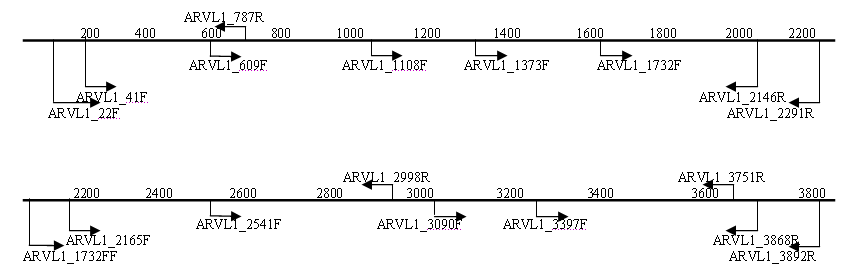
L2 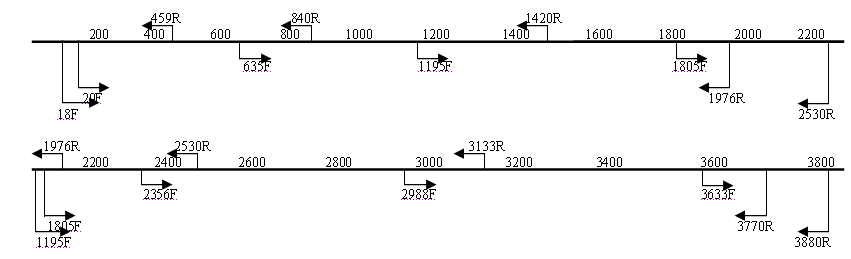
L3 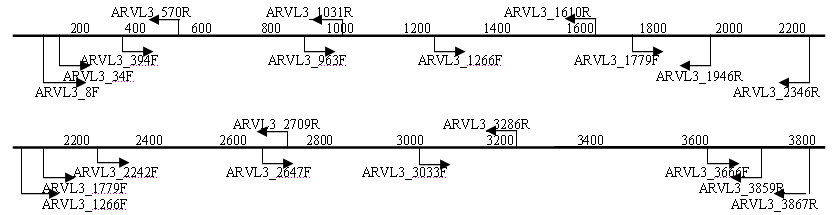
Рис. 2. Схема расположения праймеров на геномных сегментах изолята реовируса
C помощью ОТ-ПЦР с использованием различных систем праймеров были амплифицированы и секвенированы транслируемые участки нуклеотидной последовательности генов S1, S2, S3, S4, M1, M2, M3, L1, L2, L3. Сравнительный анализ нуклеотидных последовательностей показал генетическую вариабельность от 16 до 47% в зависимости от геномного сегмента (табл. 3).
Таблица 3
Уровень нуклеотидных отличий геномных сегментов изолята ARV04/02rus от представленных в GenBank
| Уровень отличий, % | Сегмент, используемый для сравнительного анализа | |||||||||
| S1 | S2 | S3 | S4 | M1 | M2 | M3 | L1 | L2 | L3 | |
| Минимальный | 31 | 19 | 10 | 17 | 15 | 11 | 10 | 17 | 14 | 13 |
| Максимальный | 46 | 20 | 16 | 22 | 17 | 25 | 22 | 18 | 16 | 25 |
В результате филогенетического анализа было установлено, что ближайшими родственниками изолята ARV04/02rus по гену S1 являются изоляты, выделенные на территории Германии и Нидерландов. Было отмечено, что все изоляты, использованные в работе [8] были патогенны для кур и вызывали как теносиновит, так и малабсорбционный синдром. Таким образом, наследование гена S1 от патогенных европейских штаммов может объяснить патогенные свойства данного изолята для цыплят и куриных эмбрионов.
В результате исследований было установлено, что сегменты S3 и М2 были унаследованы от предковой формы генетически, близкой с низковирулентным американским штаммом 138. Подобный обмен генами может объяснить различие в вирулентных свойствах изолята ARV04/02rus для суточных и 3-суточных цыплят. Данное предположение основано на результатах работы, в которой отмечено, что вирусное потомство, унаследовавшее ген М2 от штамма 138, обладало крайне слабым цитотоксическим действием для культуры макрофагов [7]. При этом ранее была показана зависимость тяжелого протекания инфекционного процесса в случае иммуносупрессии, возникающей при реовирусной инфекции [12].
По генам М3, L3 изолят ARV04/02rus наиболее близок с изолятами, выделенными на территории о.Тайвань. Высокий уровень нуклеотидных отличий по отдельным геномным сегментам (S2, S4, M1, L1) изолята ARV04/02rus от известных штаммов позволяет предположить наличие неизученных генетических линий в популяции реовируса кур. Уровень отличий изолята ARV04/02rus от известных штаммов по сегменту S2 составил 19%, по сегменту S4 - 17%, по сегменту M1 – 15%, по сегменту L1 – 17%. Таким образом, полученные результаты доказывают, что в формировании новых изолятов среди реовирусов кур реассортация геномных сегментов играет значительную роль. Механизм реассортации сегментов генома, по всей видимости, происходит в случайном порядке, и впоследствии под действием естественного отбора закрепляются наиболее удачные сочетания генов.
4. Выводы
1. В период с 2007 по 2011 гг. была исследована 351 проба патологического материала. Реовирус кур был выявлен в 117 пробах, что составило 33% от общего числа исследованных.
2. По результатам сравнительного и филогенетического анализа участка гена S3 установлено, что изоляты, выявленные на территории РФ, и штаммы, представленные в GenBank, формируют 11 генетических групп с уровнем межгрупповых отличий от 10 до 21%. Среди выявленных изолятов 15 относятся к группам IC и II, представители которых впервые выявлены на территории РФ. Определена скорость накопления нуклеотидных замен для сегмента S3, которая составила 6.010-3 замен на нуклеотид в год.
3. Установлена низкая вирулентность изолята ARV04/02rus для 3-суточных цыплят при пероральном заражении. Результаты вирусовыделения свидетельствуют о возможности скрытого течения инфекционного процесса без патологоанатомических изменений органов дыхательной системы. Изолят ARV04/02rus вызывает гибель развивающихся КЭ.
4. Определена нуклеотидная последовательность транслируемых участков всех геномных сегментов. Суммарная длина исследованных последовательностей геномных сегментов составила 20 244 п.н., что составляет 86% полного размера вирусного генома.
5. Сравнительный анализ нуклеотидных последовательностей показал генетическую вариабельность от 16 до 47% в зависимости от геномного сегмента. Установлено генетическое родство изолята ARV04/02rus по генам S3 и М2 со штаммом 138.
6. Выявлены новые генетические линии по геномным сегментам S2, S4, M1, L1 среди реовирусов кур. Уровень отличий изолята ARV04/02rus от известных штаммов по сегменту S2 составил 19%, по сегменту S4 - 17%, по сегменту M1 – 15%, по сегменту L1 – 17%.
5. Практические предложения
Для использования в лабораторной практике при проведении научно-исследовательских работ по обнаружению и изучению специфических вирусных компонентов предлагаются одобренные ученым советом и утвержденные директором ФГБУ «Федеральный центр охраны здоровья животных» следующие методические указания:
- «Методические указания по выявлению и количественному определению антигена реовируса птиц в непрямом жидкофазном блокирующем варианте иммуноферментного анализа» (утверждены 12. 12. 2008г.);
- «Методические указания по выявлению реовируса кур методом полимеразной цепной реакции в режиме реального времени» (утверждены 08. 02. 2012г.);
- «Методические указания по определению последовательности ДНК с помощью реакции секвенирования на генетических анализаторах Applied Biosystems 3130 и 3130xl при автоматизации пробоподготовки продуктов реакции секвенирования с использованием станции Freedom Evo-2 100Base» (утверждены 08. 02. 2012)
6. Список использованной литературы
1. Андрейчук Д.Б. Разработка молекулярно-биологических методов диагностики реовирусной инфекции кур и изучение изолятов, выявленных на территории Российской Федерации: дис. … канд. биол. наук. - Владимир, 2005. - 178с.
2. Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях.- Л.:Медгиз, 1962. -180с.
3. Использование Аэросила А-300 и фильтров GF/F (GF/C) для очистки ДНК- фрагментов, плазмидной ДНК и РНК // Грибанов О.Г., Щербаков А.В., Перевозчикова Н.А., Гусев A.A. -Биохимия.- 1996.- вып. 61(6). - С.1064-1070.
4. Коровина В.В. Изучение распространения и антигенных взаимоотношений штаммов реовируса теносиновита кур: дис. … канд. вет. наук. – СПб., 2001. – 122с.
5. Сарбаева Н.В. Сравнительная характеристика вакцинного и эпизоотического штаммов реовируса теносиновита кур: автореф. дис. канд. биол. наук. – М., 1997. – 23 с.
6. Серологический мониторинг птицехозяйств Российской Федерации по авиреовирусной инфекции и синовиальному микоплазмозу / А.И. Куприянов, И.А. Волкова, В.В. Шкиря [и др.] // Аграрная Россия.- 2002.- №2.- С.20-24.
7. Avian reovirus major mu-class outer capsid protein influences efficiency of productive macrophage infection in a virus strain-specific manner / D. O'Hara, M. Patrick, D. Cepica, [et al.] // J. Virol. – 2001. – Vol.75, N.11. – P.5027-5035.
8.>
9. Molecular evolution of avian reovirus: evidence for genetic diversity and reassortment of the S-class genome segments and multiple cocirculating lineages / Hung J. Liu, Long H. Lee, Hsiao W. Hsu [et al.] // Virology. – 2003. – Vol.314. – P.336-349.
10. Moradian A., Thorsen J., Julian R.J. Single and combined infections of specific-pathogen-free chickens with infectious bursal disease virus and an intestinal isolate of reovirus //Avian Dis. -1990. - Vol.34, N1. - P.63-72.
11. Rosenberger J.K., Olson N.O. Viral arthritis // Diseases of Poultry. - 10th ed. / ed. B.W. Calnek. - Mousby-Wolfe, London, 1997. – P.711-720.
12. Suppressor macrophages mediate depressed lymphoproliferation in chickens infected with avian reovirus / T.L. Pertile, K. Karaca, M.M. Walser, J.M. Sharma // Vet. Immunol. Immunopathol. – 1996. –Vol.53. – P.129-145.
13. Takase K., Nishikawa H., Yamada S. Pathogenic сharacteristics of highly virulent avian reovirus, strain 58-132, isolated from a chicken with tenosynovitis // Jpn. J. Vet. Sci. – 1985. – Vol.47, N4. – Р.567-574.
14. Van der Heide L., Kalbac M., Hall W.C. Infections tenosynovitis (viral arthritis): Influence of maternal antibodies on the development of tenosynovitis lesions after experimental infection by day-old chickens with tenosynovitis virus // Avian Dis. - 1976. - Vol.20, N4. - P.641-648.
15. Van der Heide L., Lutticken D., Horzinek M. Isolation of avian reovirus as a possible etiologic agent of osteoporosis ("brittle bone disease"; "femoral head necrosis") in broiler chickens //Avian Dis. - 1981. - Vol.25. - P.847-856.
7. Список работ, опубликованных по теме диссертации
1. Зиняков Н.Г., Андрейчук Д. Б., Дрыгин В. В. Анализ последовательности участка гена S3 изолятов реовируса кур, выявленных на птицефабриках РФ // Вопросы вирусологии. - 2010. - № 2. - С. 9-13.
2. Зиняков Н.Г., Чвала И.А. Изучение персистенции и тропизма изолята реовируса кур ARV04/02rus у цыплят // Ветеринария и кормление. – 2011. - №6. – С.21-22.
3. Митрофанова М.Н., Зиняков Н.Г. Изучение биологических свойств изолята 04/02 реовируса реовирусного теносиновита птиц // Ветеринария и кормление. – 2011. - №6. – С. 36-37.
4. Molecular variability of S3 and S1 gene sequences of avian reovirus in the Russian Federation / N.G. Zinyakov, D. B. Andreychuk, N.I. Gerasimova [et al.] // 16th World Vet. Poultry Assoc. Congr. Book and Abstr. – Marrakesh, Morocco 2009.
5. Выявление патогенных микоплазм и вирусов у кур с клиническими признаками респираторной инфекции и теносиновитом на птицефабриках России / А.В. Спрыгин, Е. Овчинникова, З.Б. Никонова, Н.Г. Зиняков [и др.] // БИО. - 2011. - №3. - С. 19-20.
____________________________________________________________
Подписано в печать 06.04.2012
Формат 6090 1/16. Усл. печ. л. 1.
Тираж 80 экз
Отпечатано на полиграфической базе ФГБУ «Федеральный центр охраны здоровья животных»

