Скрининг повторяющихся мутаций, ассоциированных с наследственными опухолевыми синдромами и другими моногенными заболеваниями
На правах рукописи
Цыбакова
Наталья Юрьевна
Скрининг «повторяющихся» мутаций, ассоциированных с наследственными ОПУХОЛЕВЫМИ СИНДРОМАМИ и другими МОНОГЕННЫМИ заболеваниями
Специальности:
14.01.12 – онкология
03.02.07 – генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2012
Работа выполнена в ГБОУ ВПО «Санкт-Петербургская Государственная педиатрическая медицинская академия» Минздрава Минздрава России
Научные руководители:
доктор медицинских наук, профессор Имянитов Евгений Наумович доктор биологических наук, профессор Горбунова Виктория Николаевна
Официальные оппоненты:
доктор медицинских наук, профессор Максимов Сергей Янович ФГБУ «Научно-исследовательский институт онкологии имени Н.Н. Петрова» Минздрава Минздравсоцразвития России, руководитель отделения онкогинекологии
доктор биологических наук, профессор Комов Вадим Петрович
ГБОУ ВПО «Санкт-Петербургская Государственная химико-фармацевтическая академия» Минздрава Минздравсоцразвития России, заведующий кафедрой биохимии
Ведущая организация:
ГБОУ ВПО «Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Минздравасоцразвития России
Защита диссертации состоится “____”_________________2012 г. в ___ часов на заседании диссертационного совета Д 208.052.01 при Федеральном государственном бюджетном учреждении «Научно-исследовательский институт онкологии имени Н.Н. Петрова» Министерства здравоохранения и социального развития Российской Федерации (197758, Санкт-Петербург, Песочный-2, ул. Ленинградская, д. 68)
С диссертацией можно ознакомиться в библиотеке ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России по адресу 197758, Санкт-Петербург, Песочный-2, ул. Ленинградская, д. 68.
Автореферат разослан «___»___________ 2012 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук Бахидзе Елена Вилльевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Профилактика наследственной патологии является актуальной проблемой и привлекает внимание многих специалистов. Принято выделять две группы превентивных мероприятий, а именно первичную профилактику, направленную на предотвращение рождения ребенка с наследственной патологией, а также вторичную профилактику, предусматривающую меры по минимизации клинических последствий патологических изменений генотипа. Основным методом вторичной профилактики является биохимический скрининг новорожденных. В России на протяжении 15 лет проводится неонатальный скрининг на фенилкетонурию и врожденный гипотиреоз, а с 2006 года в этот перечень включены адреногенитальный синдром, галактоземия и муковисцидоз. Основой первичной профилактики является медико-генетическое консультирование. Однако зачастую врачу приходится проводить ретроспективное консультирование в семье, уже имеющей больного ребенка. Безусловно, проспективное консультирование – наиболее эффективный метод профилактики, и молекулярно-генетический скрининг на носительство наследственных мутаций открывает такую возможность.
Для населения Российской Федерации характерна высокая частота повторяющихся (мажорных) мутаций, обусловленная так называемым «эффектом основателя». Например, единственная мутация в гене BRCA1 – 5382insC - составляет около 90% всех наследственных повреждений этого гена, приводящих к развитию рака молочной железы и яичников [Sokolenko et al., 2007; Grudinina et al., 2005; Suspitsin et al., 2009; Tereschenko et al., 2002]. У 90% пациентов с синдромом Неймегена выявлена делеция 5 пар оснований в экзоне 6 гена NBS1 [The International Nijmegen Breakage Syndrome Study Group, 2000]. Около 52% случаев врожденной и доречевой двусторонней тугоухости в России вызваны мутацией 35delG в гене GJB2, кодирующим коннексин 26 - Cх26 [Зинченко и др., 2007; Таварткиладзе и др., 2010; Журавский и др., 2004]. На сегодняшний день описано более 1700 мутаций в гене CFTR, приводящих к тяжелому наследственному заболеванию – муковисцидозу. Однако у пациентов Европейской части России относительная доля одной мутации - delF508 - составляет от 43% до 53%, а ее популяционная встречаемость находится в пределах от 0,5% до 0,8% [Потапова и др., 1994; Иващенко и др., 2002; Гурина и др., 2006; Зинченко и др., 2007]. Частота мутации R408W, приводящей к фенилкетонурии, у российских больных приближается к 60% [Зинченко и др., 2007; Аничкина и др., 2003]. В связи с этим, представляется весьма целесообразным уточнение частоты гетерозиготного носительства наиболее значимых мажорных мутаций в популяции Северо-Западного региона России.
Цели и задачи исследования
Цель настоящей работы – оценить целесообразность скринингового обследования здорового населения Северо-Западного региона России на гетерозиготное носительство повторяющихся мутаций, ассоциированных с наследственными раками и другими моногенными заболеваниями.
В связи с этим были поставлены следующие задачи:
- Проанализировать встречаемость наследственных опухолевых синдромов и других частых моногенных заболеваний в европейской популяции Российской Федерации и выбрать гены-кандидаты для молекулярно-генетического скрининга.
- Разработать скрининговые методы тестирования повторяющихся мутаций в генах, ассоциированных с наследственными опухолевыми синдромами и другими моногенными заболеваниями.
- Определить частоты гетерозиготного носительства мажорных мутаций в генах, ассоциированных с частыми наследственными заболеваниями, у здоровых жителей Санкт-Петербурга.
- Проанализировать спектры и частоты мутаций, определяющих развитие основных наследственных заболеваний в Санкт-Петербурге.
Научная новизна полученных результатов.
В настоящей работе впервые проведен комплексный анализ встречаемости повторяющихся мутаций, ассоциированных с наследственными опухолевыми синдромами и другими частыми генетическими заболеваниями (мутация 5382insC в гене BRCA1, мутация 1100delC в гене CHEK2, мутация 657del5 в гене NBS1, мутация delF508 в гене CFTR, мутация R408W в гене PAH и мутация 35delG в гене GJB2) у здоровых жителей Санкт-Петербурга.
Практическая значимость.
Результаты данной работы позволяют обозначить спектр молекулярно-генетических тестов для доклинической диагностики и своевременной профилактики злокачественных новообразований и частой наследственной патологии среди населения России.
Основные положения, выносимые на защиту:
- Проведение скрининга на гетерозиготное носительство мутаций delF508 в гене CFTR, мутации R408W в гене PAH и мутации 35delG в гене GJB2 среди супружеских пар, планирующих иметь ребенка, с целью профилактики тяжелых наследственных заболеваний, таких как муковисцидоз, фенилкетонурия и доречевая тугоухость является оправданным.
- Скрининг мутаций, ассоциированных с наследственным раком молочной железы, целесообразно ограничить группой риска.
- Аллель-специфическая полимеразная цепная реакция в режиме реального времени является эффективным скрининговым методом для выявления мутаций: delF508 в гене CFTR, R408W в гене PAH, 5382insC в гене BRCA1 и 1100delC в гене CHEK2.
Апробация работы.
Результаты работы были представлены на научно-практических конференциях молодых ученых ГБОУ ВПО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» «Актуальные вопросы клинической и экспериментальной медицины» (2010–2011 гг.), на заседаниях кафедры медицинской генетики ГБОУ ВПО «Санкт-Петербургская Государственная педиатрическая медицинская академия» Минздравсоцразвития России (2010 – 2012 гг.), а также использованы при разработке методических пособий для учебных курсов.
Публикации.
По материалам диссертации опубликовано 6 работ, из них 2 в журналах, рекомендованных ВАК РФ.
Внедрение в практику.
Результаты исследования внедрены в учебную работу кафедры медицинской генетики ГБОУ ВПО «Санкт-Петербургская Государственная педиатрическая медицинская академия» Минздравсоцразвития России, в практику научной и диагностической работы ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздравсоцразвития России.
Структура и объем диссертации
Основное содержание диссертации изложено на 108 страницах машинописного текста и состоит из введения, обзора литературы, главы материалов и методов, результатов и обсуждения полученных данных, выводов и списка использованной литературы. Работа иллюстрирована 6 рисунками и 10 таблицами. Библиографичекий указатель включает 186 источников, в том числе 54 отечественных и 132 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
Популяционная выборка
Для настоящей работы материал собирался у 400 здоровых неродственных женщин, проживающих в Санкт-Петербурге. Средний возраст составлял 39 лет (возрастной интервал: 18-55 лет). Источником ДНК были лейкоциты периферической крови.
Выделение ДНК
Забор крови осуществлялся в пробирки, содержащие 0,5M раствор ЭДТА из расчета 30 мкл на 1 мл крови. Выделение ДНК из лейкоцитов периферической крови проводилось посредством модифицированного соль - хлороформного метода [Mllenbach et al., 1989]. Раствор ДНК хранился при температуре -20 оС.
Детекция наследственных мутаций
В исследовании проводился анализ мутаций в генах CFTR, PAH, GJB2, BRCA1, CHEK2, NBS1.
Детекция мутаций delF508 в гене CFTR, R408W в гене PAH, 5382insC в гене BRCA1, 1100delC в гене CHEK2 методом аллель-специфической полимеразной цепной реакции в режиме реального времени (рис. 1)
Аллель-специфическая ПЦР в режиме реального времени проводилась на приборе "iQ5 iCycler" (Bio-Rad Laboratories, USA) и состояла из 45 циклов (денатурация: 15 с при 95C; отжиг: 30 с при 60C; синтез: 30 с при 72C). В состав ПЦР-смеси входили: 1 ед. “hot-start” Taq-полимеразы “Thermostar” («Синтол», Москва), однократный ПЦР буфер, 50 нг ДНК, 1,5 – 3,0 мМ MgCl2, по 200 мкМ каждого из дезоксинуклеотидтрифосфатов (дАТФ, дЦТФ, дГТФ, дТТФ), 100 нМ каждого олигонуклеотида и 20х раствор интеркалирующего красителя SYBR-Green I. Последовательности всех праймеров были подобраны самостоятельно с помощью Интернет-ресурса Gene Bank и программы Gene Runner (табл. 1). Концентрации MgCl2 и температура отжига праймеров определены эмпирически с целью увеличения специфичности и исключения ошибочных результатов. Специфичность контролировалась по известному нам значению температуры плавления амплифицированных фрагментов (рис. 2).
A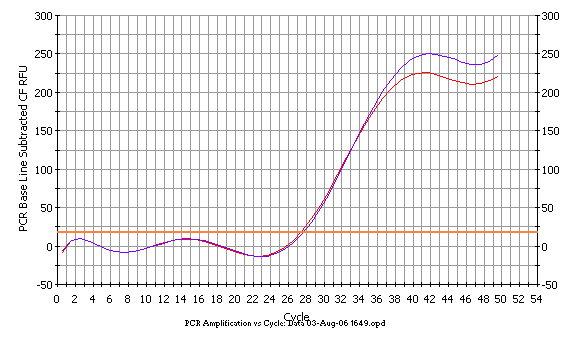 B
B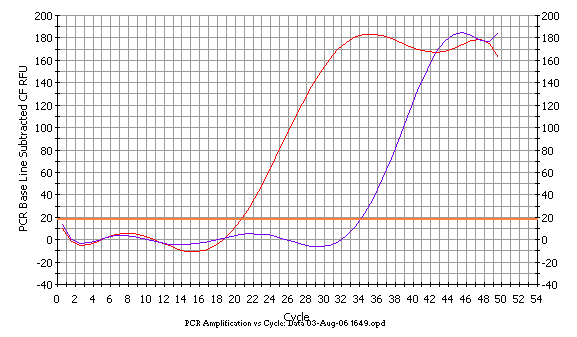
Рисунок 1. Пример детекции мутации BRCA1 5382insC. Красные кривые отражают амплификацию фрагмента с праймерами, специфичными к нормальной последовательности; фиолетовые - амплификацию фрагмента с праймерами, специфичными к мутантной последовательности. В случае гетерозиготы (А) амплификация фрагментов мутантного и нормального аллелей идет с равной эффективностью. В случае нормальной гомозиготы (Б) наблюдается четкое различие в кинетике амплификации между парами праймеров, специфичными к нормальной и мутантной последовательностям.
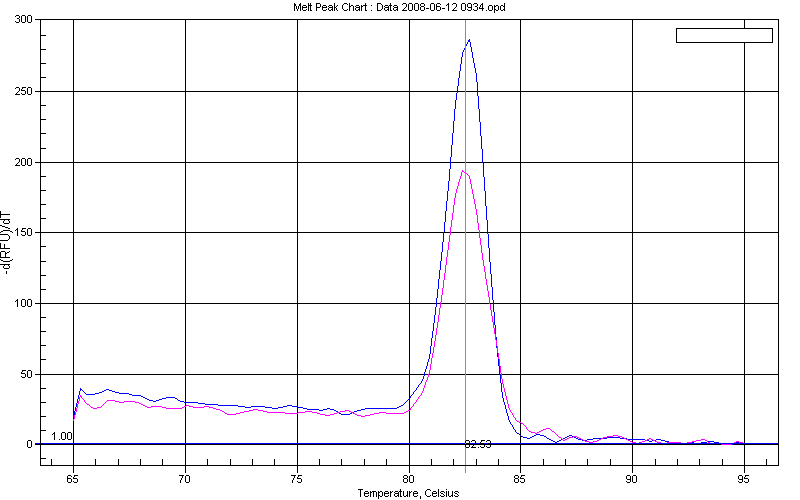
Рисунок 2. График кривой плавления амплифицированных фрагментов гена BRCA1 гетерозиготной носительницы мутации BRCA1 5382insC. Известно, что температура плавления специфического продукта 82.5 ± 0.3C.
Таблица 1.
Последовательности олигонуклеотидов (праймеров), использованных в ПЦР.
| Мутация | Праймер | Последовательность |
| CFTR delF508 | common | 5’-TTATGGGAGAACTGGAGCCT-3’ |
| wt | 5’-TCATCATAGGAAACACCAAAG-3’ | |
| mut | 5’-TTCATCATAGGAAACACCGAT-3’ | |
| PAH R408W | common | 5’-CTCTAGGGAGGTGTCCGTGT-3' |
| wt | 5’-TAGCGAACTGAGAAGGGCCG-3' | |
| mut | 5’-TAGCGAACTGAGAAGGGCCA-3' | |
| GJB 36delG | forward | ACCGCCCAGAGTAGAAGATG |
| reverse | TGAAGAGGACGGTGAGCCAG | |
| NBS1 657del5 | forward | 5’-TGATCTGTCAGGACGGCAG-3' |
| reverse | 5’-CATAATTACCTGTTTGGCATTC-3' | |
| CHEK 2 1100delC | common | 5’-CTGATCTAGCCTACGTGTCT-3’ |
| wt | 5’-TTGGAGTGCCCAAAATCAGT-3’ | |
| mut | 5’-CTTGGAGTGCCCAAAATCAT-3’ | |
| BRCA1 5382insC | common | 5’-AGAACCTGTGTGAAAGTATCTAGCACTG-3’ |
| wt | 5’-AAGCGAGCAAGAGAATTCCAG-3’ | |
| mut | 5’-AGCGAGCAAGAGAATTCCCA-3’ |
Детекция мутации 657del5 в гене NBS1 методом полимеразной цепной реакции
Состав смеси для полимеразной цепной реакции был таким же, как описано выше, без добавления флуоресцентных красителей. Для детекции использовалась одна пара праймеров (табл. 1). Условия реакции соответствовали описанным выше. Визуализация амплифицированных фрагментов осуществлялась путем гель–электрофореза в 12% полиакриламидном геле – по разнице длин нормального и мутантного фрагментов (рис. 3).
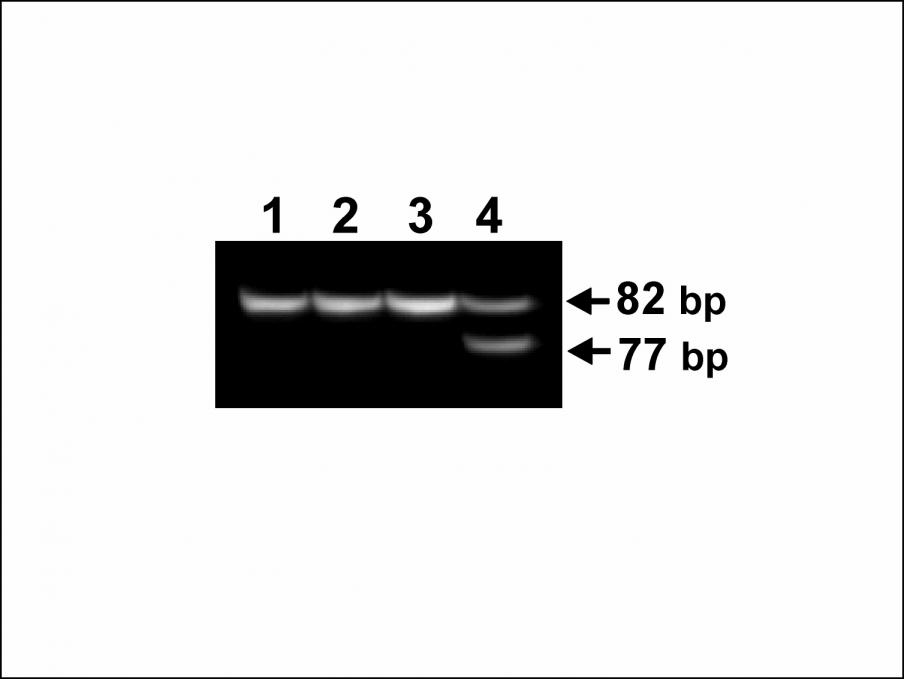
Рисунок 3. Пример детекции мутации NBS1 657del5.
Пробы 1,2,3 – нормальные гомозиготы, 4 – гетерозигота (мутантный аллель представлен фрагментом меньшей длины).
Детекция мутаций в гене GJB2 с использованием высокоточного анализа кинетики плавления ПЦР-продукта и секвенирования
Геномная ДНК, выделенная из лимфоцитов, была подвергнута амплификации с помощью пары праймеров, фланкирующих фрагмент с мутацией (табл. 1). Состав полимеразной цепной реакции соответствовал описанной выше, с использованием красителя LC Green в концентрации, рекомендованной производителем. Условия амплификации были стандартными, программа плавления заключалась в увеличении температуры на 0,10 с каждым циклом (продолжительностью 2 с) в интервале от 75 до 950. Анализ плавления выполнялся на приборе CFX-96 «REAL TIME» (Bio-Rad США). Мутации обнаруживали путем выявления температурного сдвига кривой плавления и изменения её формы. Достоверность определения генотипов контрольных образцов была подтверждена секвенированием на приборе CEQ 8000 Genetic Analysis System (Beckman Coulter, USA) по протоколам производителя. При секвенировании были использованы те же последовательности праймеров, что и для высокоразрешающего плавления.
Статистическая обработка результатов
Частота идентифицированных мутаций в популяционной выборке рассчитывалась по формуле:
p = n/N
где n - число хромосом с мутацией, N - общее число исследованных хромосом.
Частота гетерозиготного носительства мутаций рассчитывали по формуле:
Р = m/М
где m - число индивидов с мутацией, М - общее число обследуемых
Статистическая обработка полученных данных производилась с использованием пакета программ «STATISTICA 5.0» (StatSoft), программного обеспечения MS Office Excel 2003 (Microsoft). При попарном сравнении частот аллелей в популяционной выборке использовался критерий Фишера. Различия считались статистически значимыми при значении p0,05. Определение границ значения частоты мутаций (minmax) определялось точным методом Фишера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Спектр повторяющихся наследственных мутаций у здоровых жительниц Санкт-Петербурга
На основании анализа литературы и компьютерных баз данных были определены наиболее частые мутации, приводящие к наследственным заболеваниям в Северо-Западном регионе Российской Федерации. К ним относятся 6 мутаций: delF508 в гене CFTR, R408W в гене PAH, 657del5 в гене NBS1, 35delG в гене GJB2, 1100delC в гене CHEK2, 5382insC в гене BRCA1 (табл. 2). Нами была разработана методика их регистрации с помощью ПЦР в режиме реального времени (“real-time PCR”) и проведен скрининг среди 400 здоровых жительниц Санкт-Петербурга на носительство данных мутаций. Чаще других, у 9 из 400 женщин (2,25%), обнаруживалась мутация delF508 в гене CFTR. Встречаемость делеции 35delG в гене GJB2 составляла 1,5% (6 из 400 женщин), аллеля R408W в гене PAH – 0,75% (3 из 400), 657del5 в гене NBS1 – 0,5% (2 из 400), 1100delC в гене CHEK2 – 0,25% (1 из 400). Мутация 5382insC в гене BRCA1 не была выявлена ни в одном из проанализированных случаев. У 1 из 400 женщин было зарегистрировано одновременно две мутации – delF508 в гене CFTR и R408W в гене PAH. В целом анализируемые наследственные мутации определялись у 5% (20/400) здоровых жительниц Санкт-Петербурга.
При попарном сравнении частот мутаций delF508, R408W 35delG и 657del5 в изучаемой выборке статистически значимые различия не выявлены. В то время как значение частоты мутаций, ассоциированных с наследственным раком молочной железы и яичников (1100delC в гене CHEK2 и 5382insC в гене BRCA1), достоверно ниже, чем мутации delF508 в гене CFTR, приводящей к муковисцидозу. Также в популяции частота мутации 5382insC в гене BRCA1 достоверно ниже частоты мутации 35delG в GJB2.
Таблица 2
Встречаемость повторяющихся наследственных мутаций у здоровых жительниц Санкт-Петербурга
| Заболевание | Ген / Мутация | Частота гетерозиготных носительниц | Частота мутации | Границы значения частоты мутации (minmax) при 95%-ом доверительном интервале |
| Муковисцидоз | CFTR/ delF508 | 1/44 | 0,011 | 0,00310,0236 |
| Фенилкетонурия | RAH/ R408W | 1/133 | 0,0037 | 0,00010,012 |
| Нейросенсорная тугоухость | GJB2/ 35delG | 1/67 | 0,0075 | 0,00140,0183 |
| Синдром Неймеген; рак молочной железы | NBS1/ 657del5 | 1/200 | 0,0025 | 00,0098 |
| Рак молочной железы | CHEK2/ 1100delC | 1/400 | 0,001 | 0,00030,0065 |
| Рак молочной железы, рак яичников | BRCA1/ 5382insC | 0/400 | 0 | 00,0024 |
Оценка целесообразности проведения генетического тестирования на наличие мутации delF508 в гене CFTR среди жителей Санкт-Петербурга
Муковисцидоз — одно из самых частых аутосомно-рецессивных заболеваний среди представителей белой расы. Болезнь обусловлена мутациями в гене CFTR, кодирующим хлорный канал апикальных мембран эпителиальных клеток. Муковисцидоз характеризуется системным поражением экзокринных желез эпителия и сопровождается рекуррентными респираторными инфекциями, фиброзным перерастанием тканей поджелудочной железы, нарушением переваривания жира в кишечнике и отставанием в физическом развитии. Частота заболевания в России составляет в среднем 1:11000 [Петрова, 2009].
На международном уровне потенциал преконцепционного скринига для муковисцидоза широко изучен. Многочисленные исследования показали позитивное отношение к идее подобного тестирования со стороны широкой публики, медицинских работников, пациентов и их родственников. В США в марте 2001 года была рекомендована панель на 25 мутаций для скрининга на носительство мутаций в гене муковисцидоза [Grody et al., 2001]. Следует заметить, что данная панель содержала мутации с относительной частотой 0,1% и более, встречающиеся среди белого населения США. Для скрининга других расовых групп, например афроамериканцев или выходцев из стран Азии, более актуален другой набор мутаций [Khoury et al., 2003]. В выборке российских больных, согласно опубликованным данным, с частотой более 0,1% встречается 10 мажорных мутаций, а именно: delF508(50%), 394delTT(2%), G542X(2%), 2143delT (4%), 2184insA(3%), W1282X (2%), N1303K(2%), 3737delA(4%), CFTRdel21kb( 4%), 3849+10kb (2%). Минорные мутации (1366del5, R553X, 552insA, 1677delTA) в совокупности составляют 4%, неизвестные - 21%. Таким образом, в настоящее время общая выявляемость мутаций в России достигает 79%: delF508 - 50%, другие мутации - 29% (рис. 4). Для Санкт-Петербурга общая выявляемость мутаций составляет 76%: delF508 - 59%, другие мутации 17% [Иващенко и др., 2002].

Рисунок 4. Распределение мутаций в гене CFTR у больных муковисцидозом в России и Санкт-Петербурге.
Нами в тестируемую панель была включена мутация delF508, поскольку она является основной в нашей популяции, коррелирует с тяжелым течением муковисцидоза и может быть выявлена с использованием простого и недорогого теста.
Мутация delF508 в гене CFTR преобладала в изучаемой выборке – данный генетический дефект был выявлен у 9 (2,25%) из 400 здоровых женщин, соответственно частота мутации составила 0,011 (0,00310,0236 при 95%-ом доверительном интервале). При сравнении собственных и ранее опубликованных данных по Санкт-Петербургу [Потапова и др., 1994] и Москве [Петрова, 2009], а также выборке русских из Тверской, Ростовской и Кировской областей [Зинченко и др., 2007] статистически значимых различий не выявлено. Столь высокая популяционная частота мутации может является аргументом в пользу профилактического тестирования здоровых индивидуумов.
Оценка целесообразности проведения генетического тестирования на наличие мутации R408W в гене PAH среди жителей Санкт-Петербурга
Мутации в гене фенилаланингидроксилазы (PAH) приводят к тяжелому аутосомно-рецессивному заболеванию — фенилкетонурии (ФКУ), которое при отсутствии специфической диетотерапии проявляется нарушением психо-речевого и физического развития. По данным массового скрининга средняя частота ФКУ среди новорожденных в России составляет 1:8000 [Новиков, 2008].
К настоящему времени выявлено более 400 различных мутаций в гене PAH. На основании анализа данных о разнообразии и частоте мутаций, вызывающих ФКУ в 10 европейских популяциях, можно выделить повсеместное преобладание 5 следующих мутаций: R408W, R261Q, IVS10nt546, R158Q и IVS12ntl [Eisensmith et al.,1992]. Несмотря на существенные межпопуляционные различия в частоте мутаций в гене PAH, мажорной мутацией для жителей Европы является миссенс-мутация 12-го экзона гена PAH —R408W, приводящая к замене аргинина на триптофан [DiLella et al., 1986]. Мутация R408W вызывает тяжелую форму ФКУ и снижает активность фермента до 1—2,7%, так как замена аргинина-408 на более объемный триптофан изменяет водородосвязывающую сеть, удерживающую тетрамеризующий и каталитический домены вместе [DiLella et al., 1986].
Миссенс-мутация R408W является наиболее распространенной мутацией гена PAH в восточно-европейских популяциях (Польша, Россия, Чехия, Словакия, Венгрия, Болгария), а также в Греции, Ирландии, где она составляет более чем 50% всех мутантных аллелей.
Согласно литературным данным, частота мутации R408W среди больных ФКУ из Санкт-Петербурга достигает 72,1% [Барановская и др., 1996], у пациентов из Москвы - 56,4% [Чарикова и др., 1995]. Данная мутация широко распространена в Восточной Европе и странах Балтии, преобладая в Литве, Белоруссии (70%) [Tsukerman et al., 1996] и Эстонии (84%) [Lillevali et al., 1995]. Уменьшение с запада на восток градиента частоты мутации R408W свидетельствует о ее славянском или балто-славянском происхождении [Скрябин и др., 1990]. Более низкая частота мутации R408W в популяциях, расположенных восточнее и юго-восточнее (Самара — 58%, Казань — 51%), указывает на то, что данная мутация была «введена» в азиатские популяции относительно недавней миграцией славян на восток [Барановская и др., 1996]. Частота других мутаций в популяции Восточной Европы является относительно невысокой.
В обследованной нами выборке мутация R408W была выявлена в гетерозиготном состоянии у 3 из 400 здоровых женщин, соответственно частота гетерозиготного носительства составила 1/133 человека, частота мутации 0,0037 (0,00010,012 при 95%-ом доверительном интервале). При сравнении собственных результатов с данными, полученными Р.А. Зинченко в 2007 году на выборке русских из Тверской, Ростовской и Кировской областей, не установлено статистически значимых различий. Суммируя имеющиеся данные, можно сделать заключение о высокой частоте мутация R408W в популяции, что в совокупности с её клинической значимостью может быть аргументом в пользу включения данного генетического дефекта в скрининговый тест.
Оценка целесообразности проведения генетического тестирования на наличие мутации 35delG в гене GJB2 среди жителей Санкт-Петербурга
Распространенность врожденной глухоты составляет приблизительно 1 на 1000 новорожденных. Более 50% случаев заболевания в развитых странах обусловлены генетическими причинами, и их относительная пропорция увеличивается со временем [Рetersen et al., 2006]. В России 52% заболеваемости врожденной и доречевой двусторонней тугоухостью обусловлены мутацией 35delG в гене GJB2. В большинстве случаев (до 90%) глухонемые дети происходят из семей со здоровыми родителями, причём в этих семьях не отмечается других родственников с нарушением слуха [Блюмина и др., 1981]. В работе Н.Ю. Некрасовой 2002 года показана преимущественная роль мутации 35delG в этих семьях.
В нашей работе мутация 35delG в гене GJB2 была выявлена у 6 (1,5%) из 400 обследованных женщин, соответственно частота мутации составила 0,0075 (0,00140,0183 при 95%-ом доверительном интервале). Полученные данные соответствуют средней частоте носительства делеции по России, которая составляет 1/46,2 [Anichkina et al., 2001], что согласуется с частотой мутации в выборке русских из Тверской, Ростовской и Кировской областей, которая составила 0,0164 [Зинченко и др., 2007]. Однако в работе Журавского С.Г. и соавт. были представлены более высокие показатели встречаемости данного генетического дефекта в группе здоровых жителей Северо-Западного региона России. Вопрос, в какой мере эти различия, которые оказались статистически значимы, связаны с особенностями выборки, а в какой – с особенностями методических подходов – требует дополнительного изучения.
Учитывая установленную популяционную частоту мутации, вероятность встречи носителей измененного гена и рождения у нормально слышащих родителей глухих детей, гомозиготных по данной делеции, в Санкт-Петербурге достаточно высока. Это обстоятельство определяет целесообразность скрингового выявления мутации 35delG в гене GJB2 для профилактики врожденной тугоухости. Ранняя диагностика данного генетического дефекта позволит в ряде случаев своевременно выполнить кохлеарную имплантацию, направленную на предотвращение дальнейших осложнений и обеспечение нормального развития ребенка. Как следует из приведенных данных, анализ всего лишь одной мутации в гене GJB2 при рождении позволяет решить ряд проблем – выявить детей с патологическим генотипом и обеспечить им соответствующую помощь, кроме того, провести консультацию членам семьи в отношении риска повторения заболевания.
Оценка целесообразности проведения генетического тестирования на наличие мутации 657del5 в гене NBS1 среди жителей Санкт-Петербурга
Наряду с ранее рассмотренными заболеваниями, мы включили в панель встречающийся у славян синдром Неймегена (синдром хромосомных поломок Неймеген, Nijmegen breakage syndrome, NBS). Это заболевание характеризуется микроцефалией, комбинированным первичным иммунодефицитом, повышенной чувствительностью к радиоактивному излучению и высокой предрасположенностью к лимфоидным опухолям.
У 90% больных с данным синдромом выявлена делеция 5 пар оснований в 6 экзоне гена NBS1. Частота мутации 657del5 в гене NBS1 среди новорожденных составила 1:154 в Чешской Республике, 1:182 в Украине (Львовская область), 1:190 в Польше, со средней распространенностью 1:177 в славянской популяции Центральной Европы [Varon et al., 1999]. В ряде исследований были получены данные, свидетельствующие об ассоциации гетерозиготного носительства мутации 657del5 с увеличенным риском развития злокачественных новообразований (чаще рака молочной железы и лимфом) и повышенной чувствительностью к облучению [Hall et al., 1999; Masi et al., 2008; Resnick et al., 2003; Kostyuchenko et al., 2009; Cheung et al., 2006; Кременецкая и др., 2011]. Однако, как и в случае CHEK2, гетерозиготные дефекты NBS1 характеризуются относительно низкой пенетрантностью [Steffen et al., 2004; Buslov et al., 2005]. Как следует из приведенных данных, определение носительства мутации 657del5 позволит не только оценить риск болезни у потомства, но и обеспечить раннюю диагностику онкозаболеваний у обследуемого. К тому же, в случае онкологического заболевания носители мутации смогут избежать ионизирующего излучения и получать лечение по модифицированному протоколу.
В нашем исследовании у 2 (0,5%) из 400 женщин была обнаружена мутация 657del5 в гене NBS1, приводящая к синдрому Неймеген, что соответствует литературным данным по популяционной частоте делеции в Польше, Чехии и Украине. Однако достаточно низкая частота мутации 0,25% (00,98% при 95% доверительном интервале) определяет соответственно невысокий риск «гомозиготизации» этой патологии на популяционном уровне, особенно при отсутствии кровнородственных браков (при гетерозиготном носительстве 1/200 вероятность рождения больного ребенка 1/ 160000). Исходя из этого, мы рекомендуем определять данную мутацию только у лиц с онкологическим анамнезом.
Оценка целесообразности генетического тестирования на наличие мутаций 5382insC в гене BRCA1 и 1100delC в гене CHEK2 среди жителей Санкт-Петербурга
Наследственные мутации являются причиной 5-10% случаев рака молочной железы (РМЖ). В настоящее время к числу РМЖ-ассоциированных генов относят BRCA1, BRCA2, CHEK2, NBS1, p53, PALB2 и ATM. При формировании диагностических панелей принимаются во внимание: частота мутации, её пенетрантность, уровень доказательств о причастности к формированию онкологического риска. Наиболее подробно изучена связь наследственных форм РМЖ с мутациями в генах BRCA1 и BRCA2. Дефекты генов BRCA характеризуются высокой пенетрантностью (до 80%) и широкой географической распространенностью. Как в BRCA1, так и в BRCA2 обнаружено несколько сотен различных мутаций, затрагивающих различные участки этих генов. Во многих странах мира одной из наиболее частых среди больных РМЖ и раком яичника является мутация 5382insC в гене BRCA1. Помимо доказанной высокой пенетрантности [Antoniou et al., 2005], данная мутация характеризуется высокой встречаемостью как при наследственном раке (10%), так и в случайной выборке РМЖ (3.7%) [Sokolenko et al., 2006]. Инсерция одного нуклеотида приводит к сдвигу рамки считывания и преждевременному образованию стоп-кодона в позиции 1829, что повреждает структуру домена BRCT, делая белок более чувствительным к протеолитической деградации и нарушая его функцию как транскрипционного регулятора [Williams et al., 2003].
В отличие от BRCA1 и BRCA2, инактивация гена CHEK2 увеличивает риск возникновения РМЖ в несколько меньшей степени (кумулятивный риск возникновения опухоли к 70 годам варьирует от 26% до 57%). В этом гене описаны только наследственные мутации, ассоциированные с РМЖ. Аллель 1100delC в гене CHEK2 присутствует у 0,2-1,5% жителей Европы и Северной Америки. Мутация IVS2+1G>A в гене CHEK2 обнаружена в Польше, Белоруссии, Германии и Северной Америке, в то время как для других стран значимость этого генетического варианта остается неизвестной [Dong et al., 2003; CHEK2 Breast Cancer Case-Control Consortium, 2004; Bogdanova et al., 2005].
Значимость мутации 1100delC в гене CHEK2 в российской популяции также велика - несмотря на менее выраженную по сравнению с BRCA1 пенетрантность данного аллеля, его высокая встречаемость позволяет сделать вывод о целесообразности включения в диагностическую панель [CHEK2 Breast Cancer Case-Control Consortium, 2004; Chekmariova et al., 2006]. По некоторым данным, аллель 1100delC в гене CHEK2 может быть причастен к развитию рака в BRCA-негативных семьях с множественными случаями РМЖ, но не рака яичника [Oldenburg et al., 2003]. В крупномасштабных эпидемиологических исследованиях было показано 2,34-кратное увеличение риска развития монолатерального рака молочной железы и 6,43-кратное увеличение риска развития билатеральных карцином у носительниц данного аллеля по отношению к женщинам с нормальным генотипом CHEK2. [Fletcher et al, 2009; CHEK2 Breast Cancer Case-Control Consortium, 2004]. Другие мутации CHEK2, вероятно, не вносят существенного вклада в развитие рака молочной железы. [Соколенко и др., 2006; Szymanska-Pasternak et al., 2006].
Принимая во внимание очевидную роль данных мутаций в развитии наследственного рака молочной железы и яичников, нами были проведены исследования по оценке частоты данных мутаций в выборке здоровых женщин из Санкт-Петербурга.
Молекулярно-генетический анализ аллельного варианта 5382insC в гене BRCA1 в выборке здоровых женщин показал очень низкую популяционную частоту данного генетического дефекта. Мутация не была идентифицирована ни у одной из 400 женщин, частота мутации составила 00,0024 при 95%-ом доверительном интервале. Мутация 1100delC в гене CHEK2 была выявлена у 1 из 400 здоровых женщин в возрасте 40 лет. Соответственно, частота мутации в популяции составила 0,001 (0,00030,0065% при 95% доверительном интервале), частота гетерозиготного носительства 1/400. Тот факт, что среди здоровых женщин мутация 1100delC в гене CHEK2 встречается чаще, чем мутация 5382insC в гене BRCA1. В то время как в выборке больных РМЖ наблюдается обратное соотношение, по-видимому, объясняется менее выраженной пенетрантностью аллеля 1100delC в гене CHEK2 и у части носительниц мутации в гене CHEK2 РМЖ не развивается. Мы считаем нецелесообразным включать эту мутацию в панель для профилактического тестирования здоровых женщин.
Таким образом, поиск мутаций в генах наследственного РМЖ следует ограничивать прежде всего пациентками с клиническими характеристиками генетической природы онкологического заболевания (ранний возраст на момент диагноза, первично-множественный характер опухолевого процесса, случаи онкологического заболевания в семье). Выявление мутаций в генах BRCA1, BRCA2 и CHEK2 у самих больных и их родственников позволяет сформировать группы высокого онкологического риска до появления клинических проявлений заболевания. Кроме того, значимость подобного молекулярного тестирования обусловлена необходимостью модификации лечебных мероприятий, как хирургических, так и терапевтических, для больных с наследственными формами РМЖ и яичников. К настоящему времени накоплено немало данных о том, что BRCA1–ассоциированные опухоли резистентны к таксанам, но в то же время более чувствительны к препаратам платины и PARP–ингибиторам [Byrski et al., 2009; 2008; Kennedy et al., 2004; Fong et al., 2009; Imyanitov et al., 2009]. В первом случае эффект основан на том, что для митотической гибели клеток, вызываемой стабилизаторами микротрубочек (таксаны), необходим нормально функционирующий белок BRCA1. Во втором, напротив, действие ДНК–повреждающих агентов (платина) будет эффективнее в клетках с дефектами ДНК-репарации. Эти факты неоднократно подтверждены экспериментальными наблюдениями [Tasson et al., 2003; Lafarge et al., 2001; Fedier et al., 2003]. Установлено также, что риск ипси– и контралатеральных метахронных опухолей у носительниц мутаций в генах BRCA1/BRCA2 после органосохраняющих операций значительно выше, чем в случае спорадических опухолей, что необходимо учитывать при оперативном вмешательстве [Garcia-Etienne et al., 2009].
Таким образом, согласно результатам нашего исследования, каждая двадцатая женщина в Санкт-Петербурге является гетерозиготной носительницей мутаций в генах CFTR, PAH и GJB2, которые в гомозиготном состоянии могут стать причиной тяжелых наследственных заболеваний. Полученные данные служат основанием для проведения массового генетического скрининга среди здоровых лиц, вступающих в брак или планирующих беременность, с целью выявления перечисленных генетических дефектов и проведения соответствующих профилактических мероприятий. Напротив, анализ мутаций, ассоциированных с опухолями молочной железы и яичников, продемонстрировал их низкую популяционную частоту. Соответственно, профилактическое тестирование этих мутаций целесообразно ограничить группой онкологических больных и их родственников (рис. 5).
Рисунок 5. Рекомендуемый алгоритм скрининга «повторяющихся» мутаций.
ВЫВОДЫ
- Генами-кандидатами для проведения молекулярно-генетического скрининга в европейской популяции Российской Федерации являются CFTR, GJB2, PAH, BRCA1, CHEK2 и NBS1.
- Аллель-специфическая полимеразная цепная реакция представляется эффективным и доступным методом скрининга повторяющихся мутаций.
- У здоровых жительниц Санкт-Петербурга частота гетерозиготного носительства мажорных мутаций, ассоциированных с наиболее частыми наследственными заболеваниями и онкологическими синдромами, составляет: delF508 в гене CFTR - 2,25%, 35delG в гене GJB2 - 1,5%, R408W в гене PAH - 0,75%, 5382insC в гене BRCA1 - 0%, 1100delC в гене CHEK2 - 0,25% и 657del5 в гене NBS1 - 0,5%. Эти показатели соответствуют средним данным по России.
- В выборке здоровых женщин частота гетерозиготного носительства мутаций, ассоциированных с наследственным раком молочной железы и яичников, достоверно ниже, чем мутаций, приводящих к муковисцидозу и наследственной тугоухости (p < 0,05).
- Тестирование мутаций, ассоциированных с наследственным раком молочной железы (5382insC в гене BRCA1, 1100delC в гене CHEK2 и 657del5 в гене NBS1), целесообразно ограничить группами риска.
- Анализ мутаций delF508 в гене CFTR, 35delG в гене GJB2, R408W в гене PAH целесообразно рекомендовать здоровым лицам, вступающим в брак или планирующим беременность, с целью профилактики наследственной патологии у потомства.
Список работ, опубликованных по теме диссертации
- Цыбакова Н.Ю., Иевлева А.Г. Частота носительства мутации NBS1 657del5 среди здоровых женщин в Санкт-Петербурге // «Актуальные вопросы клинической и экспериментальной медицины» Сборник тезисов юбилейной научно-практической конференции молодых ученых - СПб, 2010. – C. 103.
- Цыбакова Н. Ю. Разработка тест-системы для экспресс-диагностики мутаций в генах CFTR и PAH методом реал-тайм ПЦР // Материалы II научно-практической конференции «Новые генетические технологии в медицине», Москва, 2010. – С. 10.
- Цыбакова Н. Ю., Иевлева А.Г., Соколенко А.П. Частота носительства мутаций del508F в гене CFTR и R408W в гене PAH среди здоровых женщин в Санкт-Петербурге // Мед. акад. журн. – 2010. – Т.10. №5. – С. 68.
- В.Г. Вахарловский,Т.Е. Гембицкая, И.В. Двораковская, В.С. Круглова, Н.Ю. Цыбакова, А.Г. Черменский, Е.Н. Имянитов. Муковисцидоз: генетика, клиника, патогенез, диагностика, лечение, профилактика // Методическое пособие для студентов. Издание СПбГПМА, 2011. – 32 с.
- Цыбакова Н.Ю., Шабанова Е.С., Ивлева А.Г. Частота носительства мутации 35delG в гене GJB2 среди здоровых женщин в Санкт-Петербурге // Актуальные вопросы клинической и экспериментальной медицины. Сборник тезисов научно-практической конференции молодых ученых. - СПб, 2011. – С.56.
- Цыбакова Н.Ю., Соколенко А.П., Иевлева А.Г., Суспицын Е.Н., Имянитов Е.Н. Анализ встречаемости повторяющихся мутаций в генах BRCA1, CHEK2, NBS1, CFTR, PAH и СX26 у здоровых жительниц Санкт-Петербурга // MEDLINE.Ru. – 2011. – Т. 12. – С. 1329-1341.
БЛАГОДАРНОСТИ
Выражаю огромную благодарность научным руководителям диссертационной работы проф. Е.Н. Имянитову и проф. В.Н. Горбуновой за постоянное внимание и ценные рекомендации.
Выражаю сердечную признательность сотрудникам кафедры медицинской генетики ГБОУ ВПО «СПбГПМА» Минздравсоцразвития России и коллективу лаборатории молекулярной онкологии ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздравсоцразвития России за помощь при проведении исследований и плодотворные обсуждения.
Отдельно благодарю сотрудников лаборатории молекулярной генетики ФГБУ «РосНИИГТ» ФМБА России за постоянную поддержку и понимание.

