Микробиологическая характеристика возбудителей внутрибольничных инфекций и разработка метода диагностики госпитальных штаммов
На правах рукописи
САМИКОВА ВЕРА НИКОЛАЕВНА
Микробиологическая характеристика возбудителей
внутрибольничных инфекций и разработка метода
диагностики госпитальных штаммов
03.00.07 – «Микробиология»
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Оренбург – 2009
Работа выполнена в ГОУ ВПО «Тюменская государственная медицинская академия» Росздрава
| Научный руководитель: доктор медицинских наук, профессор | Мефодьев Владимир Васильевич |
| Официальные оппоненты: доктор биологических наук, доцент ГУ Институт клеточного и внутриклеточного симбиоза УрО РАН | Карташова Ольга Львовна |
| доктор медицинских наук, ГОУ ВПО «Оренбургский государственный университет» | Брудастов Юрий Авенирович |
| Ведущая организация: ГОУ ВПО «Башкирский государственный медицинский университет» Росздрава | |
Защита диссертации состоится « » _____________ 2009 г. в ___ часов на заседании диссертационного Совета Д 208.066.03 при ГОУ ВПО «Оренбургская государственная медицинская академия» Росздрава в зале заседаний ученого совета по адресу 460014, г. Оренбург, ул. Советская, 6. Тел.: (3532) 77-59-95; факс: (3532) 77-24-59; e-mail: [email protected].
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Оренбургская государственная медицинская академия» Росздрава
Автореферат разослан « » _________________ 2009 г.
Ученый секретарь
диссертационного Совета,
доктор медицинских наук,
профессор Немцева Н.В.
ВВЕДЕНИЕ
Актуальность проблемы. Внутрибольничные инфекции (ВБИ) являются важнейшей проблемой российского здравоохранения и здравоохранения всего мирового сообщества (Е.П.Ковалева, Н.А.Семина, 2002). В Российской Федерации они ежегодно развиваются у 2–2,5 млн. человек, а длительность пребывания в больнице в результате их развития увеличивается в среднем на 6–8 дней.
Наслаиваясь на основную болезнь, увеличивая ее продолжительность, ВБИ порождают новые проблемы – послеоперационную летальность. Они являются частой причиной смертности новорожденных, влияя на детскую смертность в целом. Число заболеваний госпитальной инфекцией по данным различных исследований составило 10–70 % от числа госпитализированных и в 2% случаев заболевания заканчивались летальным исходом (В.И.Покровский, Г.Г.Онищенко, Б.Л.Черкасский, 2003, В.И. Сергевнин, Н.И. Маркович, С.В. Редько, 2006).
Эпидемическому распространению ВБИ способствует формирование и широкое распространение полирезистентных к современным антимикробным препаратам штаммов, отличающихся высокой вирулентностью и повышенной устойчивостью к воздействию факторов окружающей среды, в том числе к дезинфектантам. В результате возникновения ВБИ расходы на антибактериальные препараты составляют треть от всех отпускаемых лекарственных препаратов (Д.Д.Меньшиков и др., 2000). Ущерб от возникновения этих инфекций в России ежегодно составляет более 10 млрд. рублей (В.Г. Акимкин, 2003 г.).
Все вышеизложенное выдвигает проблему ВБИ в ряд важнейших общемедицинских и государственных задач (Н.А. Семина, Е.П. Ковалева, В.Г. Акимкин, 2006). Проблемами недостаточно изученными являются: региональные особенности этиологической структуры заболеваемости в стационарах разного профиля, отсутствие динамики мониторинга в ЛПУ и отсутствие оперативных методов индикации госпитальных штаммов.
Цель исследования. Установить этиологическую структуру микроорганизмов, выделенных при ВБИ региона, представить микробиологическую характеристику возбудителей внутрибольничных инфекций и разработать метод индикации госпитальных штаммов.
Задачи исследования
- Изучить динамику заболеваемости ВБИ на юге Тюменской области.
- Изучить этиологическую структуру возбудителей ВБИ в ЛПУ Тюменской области и представить их микробиологическую характеристику.
- Оценить роль биотопов организма человека в формировании госпитальных штаммов, выделенных как от больных, так и с объектов среды стационаров.
- Установить частоту распространения антибиотикорезистентных штаммов в этиологической структуре ВБИ.
- Разработать метод диагностики госпитальных штаммов.
Положения, выносимые на защиту
- Формирование госпитальных штаммов зависит от биотопа организма и определяется спецификой региона проживания людей.
- Идентичность антибиотикограмм микроорганизмов, выделенных от медицинского персонала, пациентов и с объектов больничной среды - объективный критерий в оценке госпитальных штаммов.
Научная новизна и теоретическая значимость. На основании многолетних наблюдений определены ведущие возбудители в этиологической структуре ВБИ в разных ЛПУ Тюменской области – S.aureus, S.epidermidis, E.coli. Выявлены различия в спектре микрофлоры из отдельных биотопов организма человека: в послеоперационных ранах доминировали P.aeruginosa, Enterobacter spp., S.аureus; при конъюнктивитах – S. epidermidis, Hafnia spp.; при инфекциях мочеполовых путей – P.aeruginosa, Citrobacter spp. и Proteus spp. Между частотой выделения возбудителей ВБИ у пациентов и микроорганизмов, изолированных из смывов объектов больничной среды, установлена прямая корреляционная связь (0,76+0,1).
Выделение определенного вида возбудителя из отдельных биотопов и видов исследуемого материала позволяет прогнозировать формирование госпитальных штаммов и проводить микробиологическую диагностику ВБИ.
Установлена частота (7 – 20 %) распространения антибиотикорезистентных штаммов в условиях многопрофильной клиники среди возбудителей ВБИ. Оксициллинрезистентные штаммы S.aureus, E.faecalis, E.faecium, K.pneumoniae, P.aeruginosa относились к полирезистентным. Антибиотикорезистентные штаммы выделялись из отделяемого зева и ран (S.aureus) и отделяемого наружного уха (P.aeruginosa).
На основе изучения антибиотикограмм микроорганизмов, выделенных от больных и с объектов окружающей среды, разработан способ экспресс-диагностики, позволяющий дифференцировать госпитальные и внебольничные штаммы (Патент РФ № 2245922).
Теоретическое значение работы. Получены данные, расширяющие представление о спектре микроорганизмов в этиологии ВБИ и дающие объективную информацию о распространении госпитальных штаммов в ЛПУ.
Практическая ценность. Разработан способ дифференциации госпитальных и внебольничных штаммов, что позволило уменьшить количество гнойно-септических осложнений и сократить пребывание больных в стационаре многопрофильной клиники.
Разработан метод определения плазмокоагулирующей активности патогенных стафилококков (Патент РФ № 2332461, 2008).
Разработанный метод выявления госпитальных штаммов (Патент РФ № 2245922, 2005) апробирован и внедрен в работу ЛПУ. Разработано пособие для врачей «Условия формирования госпитальных штаммов и оптимизация микробиологического мониторинга за внутрибольничными инфекциями», утвержденные Управлением Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Тюменской области (2007).
Апробация работы. Основные положения диссертационной работы доложены и обсуждены на конференциях: «Актуальные вопросы теоретической и клинической медицины» (Тюмень, 1985); «Факторы клеточного и гуморального иммунитета при различных физиологических и патологических состояниях» (Челябинск, 1986); «Актуальные вопросы микробиологии, эпидемиологии и иммунологии инфекционных болезней» (Харьков, 1987); «Актуальные вопросы теоретической и клинической медицины» (Тюмень, 1988); «Научная организация учебного процесса и элементов экологического образования в медицинском институте» (Тюмень, 1990); «Управление качеством образования в ВУЗе» (Материалы региональной научно-практической конференции. Тюмень, 2003); «VI Российский съезд врачей инфекционистов» (г. Санкт-Петербург, 2003); Международный симпозиум «Молекулярные механизмы регуляции функции клетки» (Тюмень, 2005).
Публикации. По теме диссертации опубликовано 9 печатных работ, в том числе 3 в изданиях списка ВАК, получены 2 патента РФ на изобретение, разработано и внедрено в практику пособие для врачей.
Объем и структура диссертации
Работа изложена на 149 страницах машинописного текста, содержит 24 таблицы и 26 рисунков. Диссертация состоит из введения, обзора литературы, главы «Материалы, объект и методы исследования», трёх глав собственных исследований, отражающих результаты эпидемиологических и экспериментальных исследований, их обсуждения, заключения, выводов и списка цитируемой литературы, включающего 203 литературных источника, из них 111 отечественных и 92 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследований. Для оценки динамики и тенденций многолетней заболеваемости проведен ретроспективный анализ данных Областного центра санэпиднадзора г. Тюмени за период с 1996 по 2005 гг.
Проанализирован информационный массив Центров гигиены и эпидемиологии в Тюменской области о регистрации заболеваемости ВБИ в ЛПУ разного типа за 10-летний период 1996–2005 гг. Этиологическая структура ВБИ изучалась по результатам микробиологических исследований клинического материала, полученного от родительниц, новорожденных, послеоперационных больных, исследования смывов с объектов внешней среды ЛПУ.
Кроме общепринятых микробиологических исследований разных выделений больных ЛПУ, в работе использовали оригинальный «Способ определения плазмокоагулирующей активности патогенных стафилококков» (Патент РФ № 2332461), включающий определение плазмокоагулирующей активности патогенных стафилококков на основании регистрации в процессе культивирования этих микроорганизмов показателей сопротивления жидкой питательной среды, содержащей плазму.
Определение электрического сопротивления взвеси бактерий в питательной среде производят в пределах 2000 кОм за период 3 - 5-го часа культивирования бактерий при температуре 37°С. При показателях электрического сопротивления раствора 64 - 84 кОм выделенную культуру бактерий относят к плазмокоагулирующей.
Видовую идентификацию бактерий семейства Enterobacteriaceae проводили на тест-системах РАПИД-Энтеро 200, производства НИИЭМ им. Пастера (г. Санкт-Петербург). У бактерий Staphуlococcus spp. определяли лецитиназную активность и пигментообразование на средах ЖСА, ферментацию сахаров и одноатомных спиртов оценивали в аэробных и анаэробных условиях на средах Гисса с маннитом, глюкозой; продукцию каталазы изучали в тесте с 1 % раствором перекиси водорода. Цитохромоксидазу регистрировали стандартным методом в Оху-тесте. Бактерии Pseudomonas spp. идентифицировали с помощью OF-теста, определения каталазы, цитохромоксидазы, гидролиза желатины и роста при 43°С.
Выявление госпитальных штаммов проводили по определению чувствительности штаммов к антибиотикам, составлению и сопоставлению антибиотикограмм культур бактерий, выделенных от больных и из объектов окружающей среды. К госпитальным штаммам относили бактерии, обладающие множественной антибиотикорезистентностью (к 3-м и более антибиотикам).
Статистическую и математическую обработку полученных данных осуществляли с использованием компьютерных программ Excel (Microsoft Inc.,2000), STATISTICA for Windows, v. 5.0 (Stat So1t Inc., 1995). Достоверность различий между средними величинами оценивали с использованием t-критерия Стьюдента (уровень значимости р<0,05).
Результаты исследований и их обсуждение. Многолетняя динамика заболеваемости ВБИ за 13-летний период в Тюменской области характеризовалась выраженной тенденцией к снижению (T сн = 6,09). В целом по Российской Федерации отмечается снижение заболеваемости ВБИ. Однако, по мнению ряда специалистов, ежегодное снижение заболеваемости этими инфекциями происходит, главным образом, за счет отсутствия регистрации или недоучета некоторых нозологических форм (Г.Г.Онищенко, 2004; В.В.Мефодьев с соавт., 2006).
Средний показатель заболеваемости ВБИ среди населения региона составил 0,81±0,09‰, причем среди городского населения он был в 1,4 раза выше (1,12±0,1‰) по сравнению с сельским. По-видимому, на селе в связи с дефектами их регистрации происходил недоучет ВБИ.
В структуре заболеваемости ВБИ на родовспомогательные учреждения приходилось в среднем 63,4% от общего числа заболеваний, тогда как по России аналогичный показатель на 2005 г. составил 34,3% (Г.Г.Онищенко, 2005). На долю хирургических стационаров приходилось 19,9% случаев ВБИ (по России – 28,5%), на детские стационары – 1,06% (по России – 11,2), на прочие – 3,6%. В амбулаторно-поликлинических учреждениях этот показатель составил 12,0%, тогда как по России он не превышал 8,1%. В родовспомогательных учреждениях показатель заболеваемости новорожденных ВБИ составил 27,4±1,54 на 1000 родившихся живыми детей, с выраженной тенденцией к снижению заболеваемости к концу срока наблюдения (Тсн=9,35%).
Среди клинических форм гнойно-септических инфекций у новорожденных ведущими были конъюнктивит (33,2±1,0%), заболевания кожи и подкожной клетчатки (10,5±0,6%), а также омфалит (6,8±0,5%).
По результатам исследований в структуре возбудителей ВБИ отмечено многообразие видов с преобладанием S.aureus (23,35±0,4%); S.epidermidis (16,6±0,4%); E.coli (14,0±0,4%); заметна роль грибов рода Candida (3,7±0,2%) (Рис. 1).
В микропейзаже при определенных патологических состояниях отмечены следующие изменения. Бактерии S.aureus выделялись чаще при послеоперационных инфекциях (17,1±0,3%) и конъюнктивитах (16,4±0,3%). S.epidermidis наиболее часто изолировали при конъюнктивитах (55,8±0,5%), урологических (16,9±0,4%) и гинекологических заболеваниях (14,9±0,4%). Напротив, S. saprophyticus обнаруживали, соответственно, в 58,0±4,8% и 36,0±4,8% случаев при урологических и гинекологических заболеваниях. При заболеваниях стрептококковой этиологии S. pyogenes изолировали при конъюнктивитах (14,6±0,4%), тогда как S.haemoliticus были более характерен для инфекций мочевыводящих путей (52,0±5,0%).
В изолятах при послеоперационных гнойных инфекциях P.aeruginosa регистрировали в 38,6±1,6%, а при инфекциях мочевыводящих путей в 20,2±1,3% случаев. При урологических заболеваниях на долю Acinetobacter spp. приходилось 16,2±1,5%, E.cоli - 71,6±0,5%, Klebsiella spp. - 27,9±1,0%, а Proteus spp. - (38,2±1,5%). При гинекологических заболеваниях в 99,4±0,2% случаев высевали бактерии, относящиеся к Moraxella spp.

Рис. 1. Этиологическая структура гнойно-септических инфекций в Тюменской области в 1996–2005 гг.(%)
При послеоперационных нагноениях из ран изолировали Enterobacter spp. (29,2±1,6%), Citrobacter spp. (29,8±1,4%). При конъюнктивитах Hafnia spp., доля которых составляла 24,0±2,2%, а также Haemophylus spp. – 26,6±0,6%. При гинекологических заболеваниях изолировали грибы рода Candida и Ureaplasma spp. в 11,0±0,6% и в 100% случаев, соответсвенно.
Между частотой выделения возбудителей при гнойно-септических инфекциях, циркулирующих в разных типах ЛПУ (в родовспомогательных учреждениях и в хирургических стационарах), обнаружена сильная прямая связь (r=0,76 ±0,1) (рис.2).
больные объекты внешней среды
Рис. 2. Динамика выделения возбудителей при ГСИ и из смывов из объектов больничной среды
При анализе этиологической принадлежности возбудителей гнойно-септических инфекций в Тюменской областной клинической больнице установлена принадлежность их к 18 родам.
Грамположительные бактерии выявлены у 51,3±4,6% больных, причем у двух третьих из них возбудитель был изолирован в монокультуре, и лишь у трети – в микробных ассоциациях.
Грамотрицательные бактерии, выявленные у 48,1±4,6% больных, практически в равной степени встречались как самостоятельно – в 51,8±6,6% случаев, так и в ассоциациях – в 48,3±6,6% случаев. В составе микробных ассоциаций грампозитивные бактерии встречались чаще в сочетании с грамотрицательными (60,3±12,4%), чем грампозитивными бактериями других видов (33,3±12,0%). Грамнегативные бактерии чаще были ассоциированы грам (-) бактериями других видов (в 46,4±9,6% случаев), а в 26,4±8,4% случаев – со смешанной микрофлорой.
Среди возбудителей ВБИ преобладали S. aureus (31,7±4,3%) и E. coli (22,6±3,8%). S. aureus встречен в составе ассоциаций в 10,7±5,0% случаев, а E. coli – в 46,7±9,7% случаев, соответственно.
При изучении микробного пейзажа выделенных возбудителей установлена прямая сильная корреляционная связь между местом локализации микроорганизмов и исследуемым материалом, из которого они были выделены (r=0,8±0,2). Так, S.aureus изолировали из любой ткани (чаще из мокроты, отделяемого зева, из мочи – в 37,7-57,8%). S. epidermidis (гем+), обладающий дерматотропными свойствами, чаще выявлялся в отделяемом половых органов, ран, ушей (55,6-68,9%). E.coli выделяли из мочи в 45,3% случаев. Грибы рода Candida изолировали из мокроты, отделяемого зева и наружного уха в 12,7-15,5%. Отмечено, что E.coli чаще служила причиной возникновения эндогенной инфекции, а S. aureus – экзогенной.
Формирование госпитальных штаммов чаще отмечено среди условно-патогенной микрофлоры. Под влиянием применения антимикробных препаратов широкого спектра действия, оказывающих бактерицидное и бактериостатическое влияние не только на патогенную, но и на условно-патогенную и сапрофитическую флору, выявлены изменения микробиоценоза кишечника пациентов, заключающиеся в селекции более устойчивых видов микроорганизмов, приводивших к развитию дисбактериоза кишечника. Диагноз дисбактериоза был подтвержден у детей до 1 года в 98,6±0,46%, и у больных старшего возраста – в 90,78±0,75%. При дисбактериозе в микропейзаже кишечной флоры детей до 1 года был более выражен дефицит бифидобактерий, тогда как у детей старших возрастных групп – лактобактерий, кишечной палочки и энтерококков. Это способствовало созданию экологической ниши, благоприятной для развития условно-патогенных и патогенных бактерий.
Среди возбудителей внутрибольничных инфекций S.aureus, E.coli, P. aeruginosa, K.pneumoniae, выделенных от пациентов Тюменской областной клинической больницы, отмечена высокая частота полирезистентных к антибиотикам штаммов микроорганизмов, сохраняющих чувствительность лишь к препаратам группы фторхинолонов. Среди условно-патогенных микроорганизмов часто встречались оксациллинрезистентные штаммы Staphylococcus spp. и полирезистентные штаммы E.faecalis, E.faecium, K.pneumoniae и P.aeruginosa. Отмечен большой удельный вес микстинфекций с участием E.coli и других условно-патогенных микроорганизмов, преимущественно высокоустойчивых к антибиотикам, применяемым в лечебно-профилактических учреждениях.
Высоко устойчивыми к ряду полусинтетических пенициллинов, цефалоспоринов и аминогликозидов были E.faecalis, E.faecium, E.coli и другие энтеробактерии, выделенные от больных. Штаммы, изолированные с объектов окружающей среды хирургических стационаров (S.aureus, K.pneumoniae), были устойчивыми к большинству антибиотиков, используемых для лечения больных, исключением являлись стрептомицин и гентамицин. Из выделенных штаммов оксациллинрезистентные S.aureus составили 9,7±4,9%, S.epidermidis – 28,6±10,8%. Складывается впечатление, что в хирургических и терапевтических отделениях среди больных и в объектах внешней среды циркулировали штаммы, обладающие одинаковым спектром антибиотикорезистентности.
Выявлены особенности в спектре антибиотикорезистентности среди грамположительной и грамнегативной микрофлоры (табл. 2).
Таблица 2
Доля штаммов микроорганизмов, резистентных к среднетерапевтическим дозам антимикробных препаратов (%±m), выделяемых от больных в Тюменской области
| Антимикробные препараты | Грамположительная флора | Грамотрицательная флора | ||||||
| S. aureus | S.epi-dermidis | E. fae-calis | E.fae-cium | E.coli | K.pneumoniae | P.aeru-ginosa | E.cloacae | |
| Бензилпени-циллин | 97,9± 2,4 | 91,4± 6,7 | 96,7± 6,6 | 80,8± 15,8 | - | - | - | - |
| Ампициллин | 98,0± 2,3 | 90,0± 7,2 | 73,3± 16,4 | 73,1± 17,7 | 92,2± 4,7 | 100,0 | 100,0 | 100,0 |
| Карбенициллин | 72,4± 7,4 | 46,0± 12,6 | 43,3± 18,4 | 57,7± 19,8 | 59,7± 8,6 | 97,1± 5,8 | 65,3± 13,6 | 75,0± 20,9 |
| Оксациллин | 9,7± 4,9 | 28,6± 10,8 | 100,0 | 84,6± 14,4 | - | - | - | - |
| Ампициллин+ сульбактам | 12,5± 7,4 | - | 41,2± 25,8 | 21,4± 25,0 | 11,3± 6,4 | 12,5± 7,9 | 90,5± 13,8 | 33,3± 38,3 |
| Цефазолин | 77,9± 6,9 | 55,7± 11,9 | 96,7±6,6 | 96,0± 8,4 | - | - | - | - |
| Цефотаксим | 89,7± 5,1 | 71,4± 11,4 | 92,9±9,9 | 73,1± 17,7 | 33,l± 8,4 | 61,8± 16,7 | 98,0± 3,9 | 55,0± 23,9 |
| Цефтазидим | 79,6± 7,0 | 49,1± 13,7 | 95,8±8,8 | 88,5± 12,8 | 18,3± 6,8 | 50,0± 17,2 | 49,0± 14,3 | 50,0± 24,1 |
| Цефтизоксим | 76,9± 7,3 | 60,4± 13,4 | 100,0 | 92,3± 10,7 | 22,1±7,5 | 50,0± 17,7 | 100,0 | 45,0± 23,9 |
| Полимиксин М | - | - | - | - | 6,2± 4,3 | 8,8± 9,7 | 12,0± 9,2 | 15,8± 18,1 |
| Эритромицин | 27,6± 7,4 | 52,9± 11,9 | 70,0±17,0 | 76,9± 16,9 | - | - | - | - |
| Линкомицин | 15,3± 6,0 | 45,2± 12,6 | 96,7±6,6 | 76,0± 18,3 | - | - | - | - |
| Фузидин | 1,4± 1,9 | 11,4± 7,6 | 60,0± 18,2 | 38,5± 19,5 | - | - | - | - |
| Гентамицин | 7,6± 4,4 | 34,9± 12,0 | 70,0± 17,0 | 69,2± 18,5 | 19,2± 6,9 | 58,8± 16,9 | 58,0± 13,9 | 35,0± 22,9 |
| Тобрамицин | 10,9± 8,0 | 20,0± 12,7 | 62,5± 26,3 | 70,8± 19,9 | 25,6± 9,2 | 78,6± 25,0 | 40,5± 16,1 | 26,3± 21,2 |
| Амикацин | 4,6± 3,7 | 0,0 | 84,0± 15,7 | 65,4± 19,0 | 3,2± 3,1 | 17,2± 14,3 | 6,0± 6,0 | 21,1± 20,2 |
| Тетрациклин | 40,8± 8,3 | 50,0± 11,9 | 71,4± 17,4 | 76,9± 16,5 | 63,6±8,5 | 64,7± 16,4 | 90,0± 8,5 | 60,0± 23,6 |
| Левомицетин | 35,6± 7,9 | 52,9± 11,9 | 46,7± 18,5 | 38,5± 19,5 | 34,1± 8,4 | 64,7± 16,4 | 86,0± 9,8 | 55,0± 23,9 |
| Ципрофлоксацин | 8,8± 4,8 | 3,6±5,25 | 14,3± 13,5 | 23,1± 16,9 | 16,1± 6,6 | 8,8± 8,8 | 20,0± 11,3 | 15,0± 15,0 |
| Нитроксолин | 14,5± 5,9 | 46,8± 12,7 | 93,3± 9,3 | 75,0± 18,9 | 6,5± 4,4 | 15,2± 12,5 | 93,9± 6,8 | 26,3± 21,2 |
| Фурагин | 23,8± 8,5 | 25,0± 13,7 | 40,9± 22,5 | 45,8± 21,8 | 33,0± 8,9 | 78,1± 14,6 | 95,7± 6,0 | 88,9± 16,0 |
| Диоксидин | 93,9± 4,8 | 85,1± 10,4 | 100,0 | 96,0±8,4 | 18,9±7,4 | 20,6± 13,9 | 67,3± 13,4 | 15,0± 15,0 |
| Бисептол | 56,2± 8,3 | 46,8± 12,7 | 89,3± 11,9 | 92,3± 10,7 | 54,3± 8,8 | 72,7± 15,5 | 59,2± 14,0 | 83,4± 18,9 |
Из представленных в таблице 2 данных следует, что по сравнению с грамотрицательной флорой практически все выделенные штаммы E.faecium и большинство E.faecalis оказались устойчивыми к оксациллину (100,0±2,5% и 84,6±1,6%, соответственно). Эти же микроорганизмы были высоко устойчивыми и к ряду полусинтетических пенициллинов, цефалоспоринов и аминогликозидов. Напротив, грамположительная флора проявляла чувствительность к фурагину, тогда как у некоторых грамотрицательных микроорганизмов в 33,0–95,7% случаев наблюдалась незначительная устойчивость к данному препарату. В ряде случаев среди штаммов S.aureus наблюдалась максимальная чувствительность к ампициллину в сочетании с сульбактамом (87,5 %), тогда как большинство штаммов P. aeruginosa (90,5%) были устойчивы к данной комбинации антибактериальных препаратов. Наибольшее количество штаммов P.aeruginosa были чувствительны к амикацину (94,0±16,7%), а также сочетанию амоксициллина с клавулановой кислотой (87,5%). Достаточно мала доля штаммов Staphylococcus spp., E.coli, K.pneumoniae, P.aeruginosa, устойчивых к амикацину. Диоксидин проявлял определенную активность в отношении грамотрицательных бактерий, за исключением P.aeruginosa, среди которых 67,3±13,4% штаммов оказались резистентны. То есть среди наиболее часто встречаемых изолятов S. aureus, E. coli, P. aeruginosa. K. pneumoniae отмечена большая частота выделения полирезистентных к АМП штаммов, сохранивших чувствительность только к препаратам группы фторхинолонов.
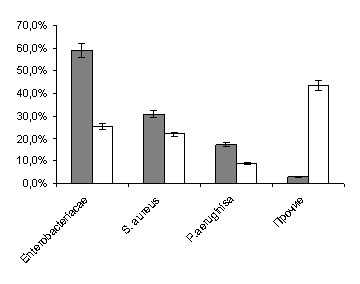
Антибиотикорезистентные штаммы возбудителей ВБИ в отличие от антибиотикочувствительных имели некоторые различия по культурально-биохимическим свойствам (рис. 3).
При анализе данных, представленных на рисунке 3 выявлено, что антибиотикорезистентные штаммы S.aureus в отличии от антибиотикочувствительных проявляли более низкую ферментацию маннита в анаэробных условиях в 1-е сутки по сравнению с антибиотикочувствительными штаммами (74±8,9 и 98±2,7 соответственно, р<0,05). Антибиотикорезистентные штаммы E.coli обладали более выраженной гемолитической активностью (45±9,5 и 25±8,8 соответственно, р<0,05); K.pneumoniae имели более низкую фаголизабельную активность (соответственно 56±10,8 и 75±9,2, р<0,05); P.aeruginosa обладали сниженными фаголизабельными свойствами (соответственно 61±9,0 и 86±6,4, р<0,05).
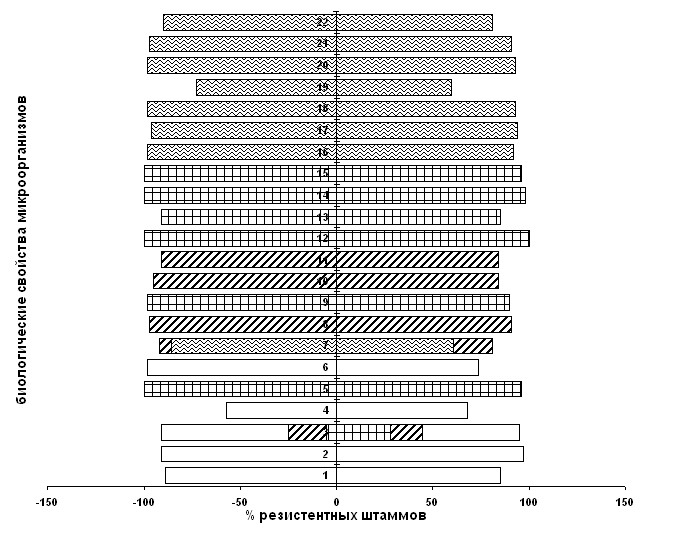
В последующем была предпринята попытка разработать новый метод выявления госпитальных штаммов микроорганизмов, упрощающий методику. Сущность предложенного метода заключается в представлении имеющихся в бактериологической лаборатории данных по чувствительности микроорганизмов к антимикробным препаратам в виде антибиотикограммы, и сравнении этих антибиотикограмм микроорганизмов, изолируемых от больных и с объектов внешней среды (рис. 4). На рисунке 4а и 4б представлены антибиотикограммы золотистых стафилококков, выделенных от больных и из объектов внешней среды.
- S. aureus, - E. coli, - K. pneumonia, - P. aeruginosa
Рис. 3. Сравнительная характеристика биологических свойств антибиотикорезистентных и антибиотикочувствительных штаммов
Условные обозначения: 1. - наличие кератиноидного пигмента; 2.- коагулаза; 3.- гемолитическая активность; 4. - уреаза; 5. - ацетоин: 6.- образование кислоты при ферментации маннита на 1-е сутки; 7.- фаголизабельность; 8.- индол; 9.- лизин; 10.- орнитин; 11.- сорбит; 12.- ферментация глюкозы (к/г); 13.- ферментация лактозы(к/г); 14.- мочевина; 15.- эскулин; 16.- пигмент; 17.- оксидаза, 18.- ОФ глюкоза; 19.- ОФ манит; 20.- нитратредуктаза; 21.- разжижение желатины; 22.- подвижность.

Рис. 4 Сравнительные спектры резистентности разных штаммов, выделенных от больных и с объектов внешней среды
S. aureus - от больных (A) и с объектов внешней среды (Б); P. aeruginosa – от больных
Обращает на себя внимание однотипность спектра резистентности исследуемых штаммов, отраженной в графической плоскости. Аналогичная закономерность прослеживается по результатам исследований изолятов псевдомонад, представленных на рисунках 4в и 4г.
В сравнительном плане классический и разработанный метод апробированы в бактериологической лаборатории многопрофильной клиники. Для исследования использованы известные штаммы бактерий, выделенные от больных и из объектов внешней среды, проведены их сероидентификация, фаготипирование, а также определена их чувствительность к антибиотикам.
В условиях лаборатории с использованием обычных методов тестирования, как правило, применение методов индикации госпитальных штаммов варьирует в зависимости от вида микроорганизмов. Госпитальный штамм P.aeruginosa диагностируется на основании определения его чувствительности к антибиотикам, фаготипа и серотипа, устойчивости к дезинфицирующим веществам, плазмидного профиля, а также коэффициента адгезии на поверхности эпителиальных клеток. Штамм относят к госпитальному на основании одинакового фагосеротипа, сходного плазмидного профиля, коэффициента адгезии 15 ± 0,2, а также при отсутствии его чувствительности к девяти и более антибиотикам, устойчивости к пяти дезинфицирующим веществам.
Известно, что у госпитальных штаммов в течение определённого промежутка времени сохраняется стабильность генотипических и фенотипических свойств, которые поддерживают способность микроорганизмов выделять ферменты, разрушающие антимикробные препараты. Штамм, выделенный с окружающих предметов, диагностируют как госпитальный при резистентности его к 3-м и более антибиотикам и соответствии типа антибиотикограмм микроорганизмов, выделенных от больных и с окружающих предметов.
Разработанные метод (Патент РФ № 2245922) позволяет экономить расход материальных средств на проведение 1 анализа более чем в 6 раз и сокращает расход рабочего времени врача-бактериолога приблизительно в 1,5 раза.
Выявление госпитальных штаммов является основанием для проведения профилактических мероприятий, направленных на предупреждение циркуляции госпитальных штаммов в больничных учреждениях.
Выводы
- Многолетняя динамика заболеваемости ВБИ за 13-летний период с момента ее регистрации на территории Тюменской области характеризовалась тенденцией к снижению (Т сн = 8,6), что совпадает с общей тенденцией в целом по России. Средний показатель заболеваемости ВБИ среди населения региона составил 0,81±0,09‰, преобладая среди городского населения по сравнению с сельским. Заболеваемость ВБИ за анализируемый период убывала в ряду родовспомогательные учреждения (63,4%), хирургические стационары (19,9%), амбулаторно-поликлинические учреждения (12%), детские стационары – 1,06%.
- В ЛПУ Тюменской области в структуре возбудителей ВБИ отмечено многообразие видового состава с преобладанием S.aureus (23,35±0,4%), S.epidermidis (16,6±0,4%), E.coli (14,0±0,4%). В этиологии послеоперационных гнойных инфекций ведущими были P.aeruginosa (30,6±1,6%), Enterobacter spp. (29,2±1,6%), S.aureus (17,1±0,3%), при конъюнктивитах – S.epidermidis (55,8±0,5%), Hafnia spp. (26,6±0,6%), при инфекциях мочевыводящих путей – P.aeruginosa (20,2±1,3%), Citrobacter spp. (29,8±1,4%), Proteus spp. (38,2±1,5%). На объектах больничных стационаров микробный пейзаж выделенных культур включал бактерии семейства Enterobacteriaceae (67,0±5,6%), S.aureus (22,0±1,8%), P.aeruginosa (9,0±0,6%), Klebsiella spp. (1,5±0,1%) и Proteus spp. (1,0±0,06%). Между частотой выделения возбудителей ВБИ, от больных, и из смывов с объектов больничной среды, установлена прямая корреляционная связь (r=0,76±0,1).
- Отмечена сильная прямая корреляционная связь между биотопом возбудителей ВБИ и исследуемым материалом, из которого они были выделены (r=0,8±0,2). S.aureus чаще выделялся из мокроты, отделяемого зева, мочи (37,7-57,8%), S.epidermidis (гем+) – из отделяемого половых органов, рта, ушей (55,6-68,9%); E.coli – из мочи (45,3%); грибы Candida spp. – из мокроты, отделяемого зева, наружного уха в 12,7-15,5%.
- Среди возбудителей ВБИ, выделенных от больных, штаммы S.aureus оказались в 20,5±0,9% антибиотикорезистентными и в 10,3±0,7% – умеренно устойчивыми к антибиотикам; штаммы P.aeruginosa – соответственно в 17,7±1,9 и 7,4±1,1%. У изолятов S.aureus, E.coli, P.aeruginosa, K.pneumoniae отмечена большая частота выделения полирезистентных к антибиотикам штаммов, сохранивших чувствительность только к препаратам группы фторхинолонов.
- Разработан метод индикации госпитальных штаммов, основанный на составлении антибиотикограмм микроорганизмов с внебольничными штаммами. Штаммы, изолированные из объектов больничной среды, относят к госпитальным на основании резистентности его не менее чем к 3-м антибиотикам и соответствии типа антибиотикограмм микроорганизмов, выделенных от больных и из внешней среды.
Список работ, опубликованных по теме диссертации
- Тимохина, Т.Х. Иммуногенность биоваров сальмонелл у жителей Тюменской области / Т.Х. Тимохина, В.Н. Самикова, Н.А. Курлович, Е.А.Тетерина // Научный вестник ТГМА. – Тюмень, 1999. – № 3 – 4. – С. 42.
- Тимохина, Т.Х. Этиология гнойных инфекций в больничном стационаре Тюменской области / Т.Х. Тимохина, … Л.Б. Козлов, В.В. Мефодьев, В.Н. Самикова и др. // Клиническая лабораторная диагностика. – 2003. – № 8. – С. 46–49.
- Молчанова, О.М. Этиологическая структура и антибиотикорезистентность возбудителей гнойно-септических инфекций, выделенных в стационаре г. Тюмени / О.М.Молчанова, Е.В. Сперанская, А.Н. Марченко, В.Н. Самикова // VI Российский съезд врачей инфекционистов. – Санкт-Петербург, 2003. – С. 257.
- Глинская, А.В. Анализ расхода материальных и временных затрат на проведение идентификации госпитальных штаммов /А.В. Глинская, В.Н.Самикова // Актуальные проблемы теоретической, экспериментальной и клинической медицины. – Тюмень. – 2003. – С. 71–72.
- Козлов, Л.Б. Способ выявления госпитальных штаммов. / Л.Б.Козлов, В.В.Мефодьев, В.Н. Самикова и др.) // Патент РФ на изобретение № 2245922. Опубликован 10.02.2005. – Бюл. № 4
- Самикова, В.Н. Анализ формирования антибиотикорезистентных штаммов по данным бактериологической лаборатории многопрофильной клиники ТГМА /В.Н. Самикова, Т.Н. Цокова, Л.Б. Козлов // Международный симпозиум «Молекулярные механизмы регуляции функции клетки». Тюмень, 2005. – С. 277-279.
- Самикова, В.Н. Влияние экологии бактерий на формирование госпитальных штаммов /В.Н. Самикова, Л.Б.Козлов, Т.Н.Цокова // Медицинская наука и образование Урала. – 2006. – № 1. – С. 55–57.
- Цокова, Т.Н. Влияние антибиотиков на экологию бактерий / Т.Н.Цокова, В.Н.Самикова, Л.Б.Козлов // Медицинская наука и образование Урала. – 2006. – № 1. – С. 70.
- Ананьев, В.Н. Способ определения патогенных стафилококков по плазмокоагулирующей активности / В.Н.Ананьев, Л.Б. Козлов, Е.В. Сперанская, В.Н. Мефодьев, В.Н. Самикова и др. // Патент РФ на изобретение 2332461. Опубликован 27.08.2008. – Бюл. № 24.
САМИКОВА ВЕРА НИКОЛАЕВНА
Микробиологическая характеристика возбудителей внутрибольничных инфекций и разработка метода диагностики госпитальных штаммов
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Оригинал макет подготовлен в программе Word for Windows 2003
Подписано в печать 26.01.2009 г.
Формат 60*84/16. Усл.-печ. л. 1,0. Печать оперативная.
Бумага офсетная. Гарнитура Times.
Тираж 100 экз.

