Сравнительная характеристика некоторых морфологических и биологических особенностей диссоциативных форм бактерий рода рroteus.
На правах рукописи
Гибазов
Нуршат Нургарифанович
Сравнительная характеристика некоторых морфологических и биологических особенностей диссоциативных форм бактерий рода Рroteus.
03.02.03 – микробиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Оренбург 2012
Работа выполнена на кафедре микробиологии, вирусологии и иммунологии ГБОУ ВПО «Башкирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации.
| Научный руководитель: | |
| Заслуженный деятель науки РФ и РБ, доктор медицинских наук, профессор. Башкирский государственный медицинский университет | Габидуллин Зайнулла Гайнулинович |
Официальные оппоненты:
| Доктор медицинских наук, Институт клеточного и внутри- клеточного симбиоза УрО РАН | Фадеев Сергей Борисович |
| Доктор медицинских наук, профессор Зам. главного врача клинического роддома № 4 г. Уфы | Амирова Виктория Радековна |
Ведущая организация: ГБОУ ВПО Челябинская государственная медицинская академия Министерства здравоохранения и социального развития Российской Федерации.
Защита диссертации состоится 16 февраля 2012 г. в _______ часов на заседании Диссертационного совета Д 208.066.03 при Оренбургской государственной медицинской академии по адресу: Россия 460000, г. Оренбург, ул. Советская, д.6, зал заседаний диссертационного совета.
Тел.: (3532) 77-59-95; факс: (3532) 77-24-59; e-mail: [email protected], официальный сайт: www.orgma.ru
С диссертацией можно ознакомиться в библиотеке ОрГМА
Автореферат разослан «____»_________________ 2012 г., автореферат и текст объявления размещен на официальном сайте ВАК Министерства образования и науки Российской Федерации.
Ученый секретарь
диссертационного совета,
д.н.к., профессор Немцева Наталия Вячеславовна
Общая характеристика работы
Актуальность проблемы.
Проблема гнойно-воспалительных процессов различной локализации, вызванных отдельными представителями условно-патогенных энтеробактерий, до настоящего времени остается весьма актуальной. Инфекционные процессы, вызываемые микроорганизмами условно-патогенной природы, создают трудности для микробиологов в диагностике и проведении комплексных мероприятий, направленных на профилактику и лечение этих инфекций, вызванных измененными формами микроорганизмов. Вот почему в настоящее время одной из проблем, стоящих перед исследователями, является решение вопросов диагностики заболеваний, вызванных условно-патогенными энтеробактериями, в частности, их диссоциативными формами, широко распространенными среди бактерий рода Рroteus.
Протей, обладая значительным арсеналом приспособительных механизмов, способен менять свойства продуцировать различных ферментов вирулентности, и вызывают энтеральные и парентеральные инфекции, число которых нарастает из года в год. Кроме того, протей в большом проценте случаев встречаются при смешанных гнойно-септических процессах, вызываемых в ассоциации со стафилококками, синегнойной палочкой и возбудителями анаэробных и аэробных инфекций, которые часто заканчиваются летально.
До настоящего времени роль различных форм диссоциаций условно-патогенных энтеробактерий, с измененными формами патогенности, остается не до конца изученной. Особенно не отработаны доступные подходы по определению их этиологической значимости в развитии инфекционных процессов различной локализации.
Исходя из вышеизложенного, проведение комплексных исследований, направленных на выявление различий в морфологических и ультраструктурных особенностей, факторов патогенности, определяющих патогенный потенциал, тесным образом связанной с диссоциацией бактерий рода Proteus является весьма актуальным.
Цель исследования.
Изучить особенности ряда морфологических и биологических (персистентных и патогенных) свойств диссоциативных форм бактерии рода Рroteus.
Для достижения этой цели были поставлены следующие задачи:
- Получить нестабильно и стабильно нероящиеся формы P. vulgaris и P. mirabilis и изучить их морфологические, культуральные и ультраструктурные особенности сравнительно с роящейся формой протея.
- Провести сравнительное изучение некоторых биологических свойств: в частности адгезивной, а-гемолитической, лецитиназной, ДНК-азной, антилизоцимной активностей, ЛТ-энтеротоксигенности и вирулентности роящихся и нероящихся форм бактерий рода Рroteus.
- Установить природу генетических детерминант адгезивной, а-гемолитической, ДНК-азной, лецитиназной, антилизоцимной активностей и ЛТ-энтеротоксигенности.
- Определить спектр антибиотикорезистентности диссоциативных форм бактерий рода Рroteus.
Новизна исследования.
Нестабильно нероящиеся формы бактерий рода Рroteus чаще обладали способностью к синтезу холероподобного термолабильного энтеротоксина, по сравнению с роящимися и стабильно нероящимися формами. В процессе перехода Н-формы протея в нестабильно нероящуюся О-форму обнаружена их более высокая способность к синтезу а-гемолизина, ДНК-азы, лецитиназы, ЛТ-энтеротоксигенности и вирулентности, в сравнении с роящимися и стабильно нероящимися мутантами.
Выявлены различия в профиле плазмидной ДНК между роящимися и стабильно нероящимися формами бактерий рода Рroteus. Установлено, что гемолитическая активность протеев обусловлена плазмидой массой 120 мДА, а ЛТ-энтеротоксигенность кодируется плазмидой массой 60 мДа. Не исключено, что адгезивная и антилизоцимная активности детерминируются и элементами хромосомной природы. В ассоциациях протеев с кишечной палочкой происходит коньюгативная передача плазмиды массы (60 МД), экспрессирующей термолабильный энтеротоксин, что сопровождается появлением ЛТ-энтеротоксигенности и вирулентности Е. соli.
Штаммы Escherichia coli №280 и Escherichia coli №281, выделенные из ассоциации с бактериями Рroteus vulgaris и Рroteus mirabilis, обладающие способностью продуцировать ЛТ- энтеротоксин высокой активности, в качестве эталонных штаммов депонированы в ГИСК им. Л.А. Тарасевича (Патенты РФ №2293764, №2293765).
Показано, что роящиеся и нестабильно нероящиеся формы обладали полиантибиотикорезистентностью в отличие от стабильно нероящихся форм.
Практическая ценность работы. Представленные данные по культуральным, биологическим особенностям, патогенном и персистентном потенциале, антибиотикорезистентноти диссоциантов протея, особенно нестабильно нероящихся форм, а также их токсигенности и плазмидного профиля расширяют представление о патогенетической роли диссоциативных форм бактерий рода Рroteus в развитии заболеваний, способствуя решению вопроса об этиологической значимости протеев.
Полученные результаты изучения биологических особенностей роящихся и нероящихся (стабильно и нестабильно) форм Рroteus spp. используются в учебном процессе кафедр микробиологии, вирусологии и иммунологии, биологии и медицинской генетики, патологической физиологии, общей гигиены Башкирского государственного медицинского университета, а так же в диагностических целях ЛПУ Республики Башкортостан.
Положения, выносимые на защиту:
1. В процессе перехода роящихся форм бактерий Рroteus vulgaris и Рroteus mirabilis в нестабильно и стабильно нероящиеся формы происходит изменение их культуральных, морфологических свойств и клеточной ультраструктуры.
2. Нестабильно нероящиеся диссоцианты протеев отличаются по культуральным, биологическим признаками и обладают высоким патогенным потенциалом, а также антибиотикорезистентнотью в сравнении со стабильными вариантами.
3. Генетический профиль протеев определяется плазмодий 120 мА, экспрессирующей а-гемолитический признак и плазмидой 60 мДа, кодирующей ЛТ-энтеротоксигенность протейных культур. В ассоциации протеев с кишечной палочкой происходит коньюгативная передача плазмиды (60 мДа), детерминирующей термолабильный энтеротоксин, что сопровождается появлением LT- токсигенности у Е.соli.
Апробация работы.
Основные положения работы доложены на: Всероссийской научной конференции с международным участием, посвященной 100-летию со дня основания филиала "Иммунопрепарат" ФГУП "НПО Микроген" МЗ и СР РФ (Уфа, 2005), V Российской научной конференции «Персистенция микроорганизмов» (Оренбург, 2006), совместном заседании кафедры микробиологии, вирусологии и иммунологии, инфекционных болезней, общей гигиены, биологии ГБОУ ВПО «Башкирский государственный медицинский университет» Минздравсоцразвития России, ведущих ученых филиала "Иммунопрепарат" ФГУП "НПО Микроген" МЗ и СР РФ, и Башкирского отделения Всероссийского общества эпидемиологов, микробиологов и паразитологов (Уфа, 2011).
Публикации
По теме диссертации опубликовано 6 печатных работ, из них 3 статьи в журналах, рекомендованных ВАК РФ и 2 патента.
Структура и объем диссертационной работы. Диссертация изложена на 163 страницах, состоит из введения, обзора литературы, главы с описанием материалов и методов, 4 глав собственных исследований, заключения, выводов, практических рекомендаций и указатель литературы, включающий списка литературы, 110 отечественных и 76 зарубежных источников, приложения. Работа иллюстрирована 23 рисунками, 11 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Материалом для исследований служили 100 штаммов бактерий рода Рroteus, из них 25 штаммов P. vulgaris и 75 - P. mirabilis, выделенных от 638 больных инфекционными процессами различной локализаций (157- кишечными, 205 - урологическими и 276 - гнойно-воспалительными заболеваниями), а так же по 10 штаммов P. vulgaris и P. mirabilis, выделенных от 648 здоровых людей.
В работе использованы штаммы Escherichia coli №280 и Escherichia coli №281, обладающие комплексом факторов патогенности, выделенные из ассоциации с бактериями Рroteus mirabilis и Рroteus vulgaris. В качестве эталонных культур использовали штаммы Р. vulgaris (ГИСК им. Тарасевича №132) и Р. mirabilis (ГИСК им. Тарасевича №236), Salmonella typhimurium №415 (несущую плазмиду массой 60 МД), Р. vulgaris Rts-1 (несущий плазмиды 120 МД) и Escherichia coli K12G62RifR.
Для получения негативно окрашенных препаратов бактериальные суспензии бактериологической петлей наносили на медные сетки, покрытые формфаровой пленкой. Для установления густоты микробных тел их наблюдали в оптический микроскоп (ув. х 900), высушивали в эксикаторе при комнатном температуре. Затем оттеняли в специальных вакуумных установках типа JJE-4. Напыление препаратов проводили нихромом. Колонии, предназначенные для просмотра в просвечивающем электронном микроскопе, фиксировали in situ 2,5% глутаровым альдегидом в течение 10 минут и покрывали тонким слоем расплавленного агара. Затем колонии вырезали вместе с надлежащим и подлежащим слоями агара и помещали в новую порцию 2,5% глутарового альдегида на 20 минут, дофиксировали 1% раствором четырехокиси осмия в течение 1 часа и после обезвоживания в возрастающих концентрациях этанола заключали в аралдит. Срезы получали на ультратоме Lkb-III (Швеция) и просматривали в электронном микроскопе JEM-СХ (Япония) при ускоряющем напряжении 80 кВт. Учет количества жгутиков в препаратах, изготовленных указанным способом, проводили на 100 контурах бактериальных клеток.
Идентификацию выделенных культур проводили по стандартной схеме («Об унификации микробиологических (бактериологических) методов исследования…», Приказ МЗ СССР №353, 1985) с использованием тест-систем «Enterotest» (LACHEMА, Чехия) и API (BioMeruiox, Франция).
Для получения стабильно нероящейся формы Proteus spp. роящиюся форму протея выращивали в бульоне Хоттингера, содержащего 5% додецилсульфат натрия, разливали в пробирки по 8 мл, кипятили трехкратно по 30 минут. Получение стабильных и нестабильных диссоциантов протея осуществляли по методу Габидуллина З.Г. (1989).
Адгезивную активность бактерий рода Proteus spp. изучали в реакции гемагглютинации с эритроцитами различных видов животных, птиц и цыпленка (Габидуллин З.Г. и соавт. 1987) с оценкой её количественной активности (Брилис В.И. и соавт, 1986). -гемолитическую активность бактерий рода Proteus spp. определяли путем посева уколом суточной агаровой культуры на 2% агар Хоттингера, содержащего 5% суспензию эритроцитов кролика.
У выделенных бактерий определяли лецитиназную активность (Чистович Г.Н., 1961; Нестерова Г.Н. с соавт., 1970), ДНК-азную активность (Jeffries C.D., 1957; Акатова З.Н., Хавкин Ю.А., 1972), антилизоцимную активность (АЛА) по методике О.В. Бухарина (1984). Чувствительность к антибиотикам определяли диско-диффузионным методом в соответствии с МУК 4.2.1890-04, 2004г. Плазмидную ДНК выделяли по методу Kado C.T., Liu S.T. (1981).
Объектом экспериментальных исследований являлись лабораторные животные: белые мыши и кролики, полученные из питомника лабораторных животных ГУП « Иммунопрепарат » г. Уфа, а так же кролики из питомника БГМУ. Животные содержались на стандартном рационе питания.
Вирулентность "in vivo" изучали методом интраназального заражения мышей массой 16-18г. “Легочную модель” воспроизводили по Н.К. Войно-Ясенецкому (1957). Изучение LT-энтеротоксигенности бактерий рода Proteus (тест “отека лап” мышей) определения по методу Ю.П. Вартанян с соавт. (1978). Экспериментальные исследования проведены в соответствии с этическими требованиями к работе с лабораторными животными («Правила проведения работ с использованием экспериментальных животных» [приказ МЗ СССР № 755 от 12.08.77] и Федерального закона «О защите животных от жестокого обращения» от 01.01.1997 г.).
Все результаты обработаны статистически с использованием лицензионного пакета прикладных статистических программ BIOSTAT, STATISTICA v.5.0, а также с помощью процессора электронных таблиц “Microsoft Excel 2000” в составе пакета программ “Microsoft Office 2000 for Windows ME”
Результаты исследований и их обсуждение.
При бактериоскопии методом раздавленной и висячей капли бактериальные клетки роящейся формы обладали выраженной подвижностью. При просвечивающей электронной микроскопии (увеличение в 20 тысяч раз), бактериальные клетки представляли собой палочки длиной 0,5-3,0 мкм и 0,5-0,6 мкм в поперечнике, с множеством перитрихиально расположенных жгутиков. Выделенная из клинического материала и полученная в экспериментальных условиях нестабильно нероящаяся форма на поверхности твердой питательной среды росла в виде округлых, выпуклых, блестящих колоний с ровными краями, а на мясопептонном бульоне давала диффузное помутнение с образованием слабого осадка к началу вторых суток культивирования. При посеве уколом в столбик полужидкого агара культуры при 21-23°C полностью диффундировали в среду в течение 12-14 часов. При электронной микроскопии у клеток выявлялись слаборазвитые жгутики. Только у молодых культур, исследуемых через 3-4 часа после нанесения на МПА, удавалось обнаружить морфологические различия между роящимися и нестабильно нероящимися формами протея. Для опыта брали роящиеся штаммы P. vulgaris ( №№- 29, 2731, 1419, 737) и P. mirabilis (№ №- 290, 1481, 34, 35). Результаты наших исследований показали, что культивирование роящейся формы протея в течение 28-30 дней в мясопептонном бульоне, содержащем 5% додецилсульфата натрия, приводит к селекции стабильных нероящихся форм протея. Выделенные и экспериментально полученные стабильно нероящиеся формы протеев на поверхности твердой питательной среды росли в виде мелких округлых, выпуклых, лишенных блеска колоний диаметром не более 2-3 мм. При осмотре методом косого освещения колонии имели голубоватый оттенок. Культура, посеянная в полужидкий агар, при 21-23оС диффундировала в среду только через 30-34 часа. В мясопептонном бульоне давали слабое помутнение с образованием осадка на дне пробирки.
При бактериоскопии методом раздавленной и висячей капли у бактериальных клеток фиксировали слабое спиралевидное, волнообразное движение. На окрашенных по Граму препаратах бактериальные клетки представляли собой мелкие грамотрицательные палочки, отличающиеся от роящейся формы выраженным полиморфизмом.
Далее изучали ультраструктуру роящихся и нероящихся изогенных пар штаммов различных видов протеев с помощью просвечивающей и сканирующей электронной микроскопии. В опыте были использованы роящиеся (P. vulgaris 2731, 29; P. mirabilis 290, 34, 35), нестабильно нероящиеся (2731а, 290а, 29а, 34а, 35а) и стабильно нероящиеся варианты (2731-41, 290-41, 29-41, 34-41, 35-41) штаммов протея.
При исследовании негативно окрашенных препаратов установлено, что у нестабильно нероящиеся мутантов P. vulgaris и P. mirabilis прослеживалась тенденция к уменьшению количества жгутиков в сравнении с роящимися формами. Среднее число жгутиков у роящихся форм колебалось в пределах от 8 до 60 и более, (рис. 1.) а у нестабильно нероящихся форм - от 5 до 50 формирующихся и сформированных жгутиков на контур бактериальной клетки (рис. 2.).
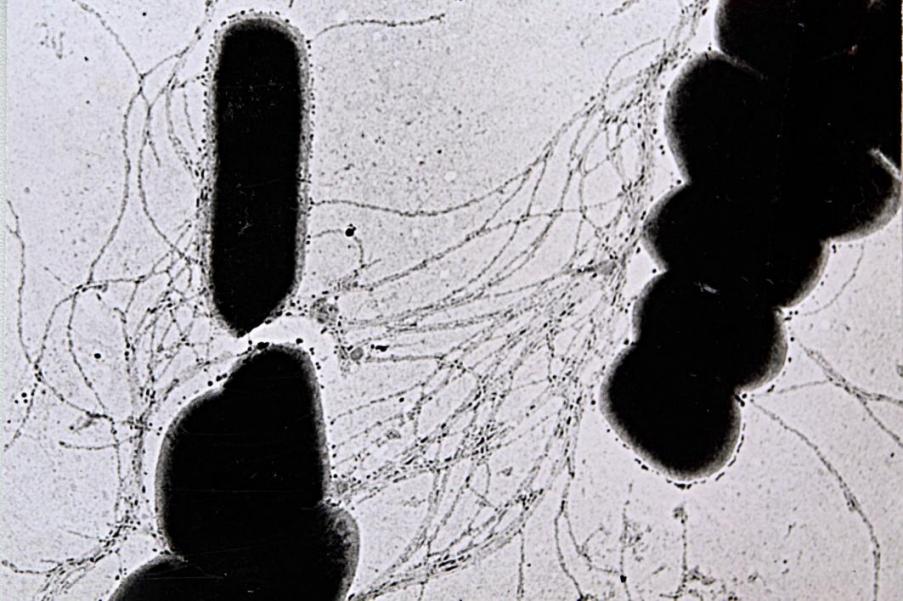
Рис. 1 - Микробные клетки роящейся формы протея под электронным микроскопом.
Перитрихиально расположенные жгутики (электронная микроскопия ув. х 20000)

Рис. 2 - Бактериальные клетки в нестабильно нероящейся (О) форме имеют
свежесформированные жгутики (электронная микроскопия ув. х 20000)
При этом необходимо отметить, что клетки различных штаммов имели разное количество жгутиков. Следует отметить, что на количество жгутиков определенное влияние оказывали используемые при приготовлении микропрепарата вещества. Так, при обработке микропрепарата раствором уранилацетата наблюдали большую ломкость жгутиков, соответственно резкое уменьшение их количества и жгутики часто располагались в межклеточном пространстве отдельно от поверхности бактерий. Как показали опыты, дикие стабильно нероящиеся штаммы, изолированные от больных, а также полученные диссоцианты (2731-41, 290-41, 29-41, 34-41, 35-41) в отличие от роящихся форм, имели не более 2-4 жгутиков, определяемых в негативно окрашенных препаратах, или не имели таковых (рис. 3.).

Рис. 3 – Клетки стабильно нероящейся формы протея
(электронная микроскопия ув. х 12000)
После обработки микробной суспензии методом Келенбергера, половину приготовленной суспензии исследовали с негативным окрашиванием 2 и 3% раствором ФВК. Для чего препараты фиксировали 3% раствором глутарового альдегида, дофиксировали 1% раствором четырехокиси осмия. Ультратонкие срезы полимеризировали по Рейннольду 3% раствором уронилацетата и просматривали при помощи просвечивающего электронного микроскопа (рис. 4).
Клетки роящихся форм оказались по размеру относительно однородными, имели овоидно-вытянутую форму, в цитоплазме ультратонких срезов клеток просматривалась четкая зернистость. Клетки имели относительно ровные клеточные стенки и между клеточной стенкой и цитоплазматической мембраной было четко выраженное пространство. В промежутках между клетками выявляли срезы густой сети жгутиков. Несколько иная структура была обнаружена у клеток стабильно нероящихся форм протеям (рис. 5).
Клетки оказались полиморфными, имели по сравнению с роящимися формами несколько вытянутую форму, неровную клеточную стенку с хорошо выраженными изгибами, которая плотно прилегала к цитоплазматической мембране. Жгутики были единичными или отсутствовали. Цитоплазма была лишена четкой зернистости. Некоторые различия в подвижности между роящимися и нестабильно нероящимися формами можно было обнаружить в первые 7-10 минут с момента приготовления бактериальной суспензии при микроскопии методом висячей и раздавленной капли.
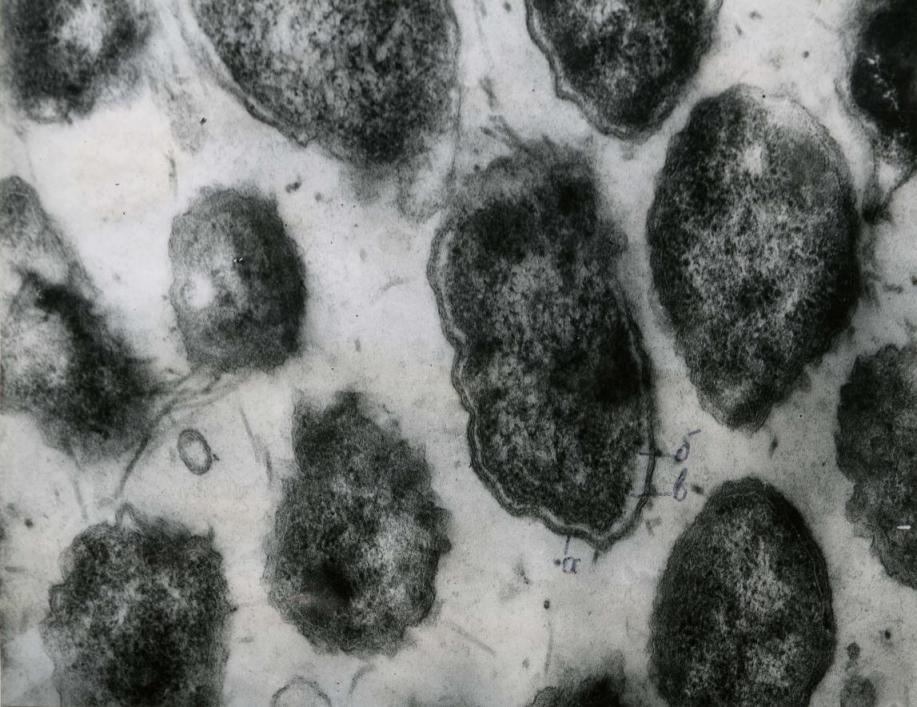
Рис. 4 - Ультратонкие срезы роящихся клеток под электронным микроскопом (электронная микроскопия ув. х 40000)
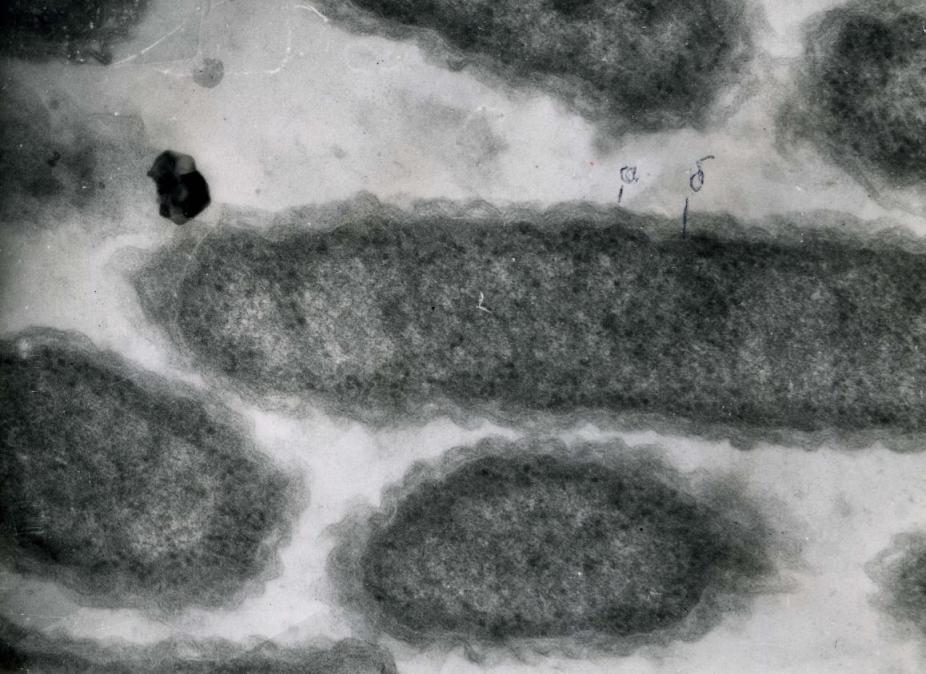
Рис. 5. Ультратонкие срезы клеток стабильно нероящихся форм протея
(электронная микроскопия ув. х 60000). Клеточная стенка с выраженными
изгибами (а), плотно прилегающая к цитоплазматической мембране (б).
Клетки стабильно нероящейся формы обладали слабым спиралевидным и волнообразным движением вокруг своей оси. Наиболее показательное и достоверное различие в подвижности роящихся и нероящихся форм протея были обнаружены при посеве культур методом укола в столбик полужидкого агара с последующей инкубацией при 21-22°C. Так, бактериальные клетки роящихся форм полностью диффундировали в полужидкий агар в течение 10-12 часов, тогда как нестабильно нероящиеся формы - в течение 12-14 часов, а устойчивые формы - только в течение 30-34 часов. Статистическая обработка показала достоверность различий в подвижности роящихся и стабильно нероящихся форм протея (р0,05).
На основании полученных результатов можно заключить, что у протеев в природе встречаются следующие 3 формы диссоциации:
а) исходная роящаяся
б) нестабильно нероящаяся
в) стабильно нероящаяся,
отличающиеся друг от друга по морфологическим, культуральным свойствам и ультраструктуре. Бактериальные клетки, находящиеся в нероящейся форме, имеющие незначительное количество жгутиков обладают в той или иной степени подвижностью, в связи с чем они не могут быть отнесены к так называемым неподвижным О-формам протея. Вероятно, феномен роения зависит не только от наличия жгутиков, но и от других структурных элементов или свойств бактериальной клетки протеев.
При изучении адгезивной активности протеев обнаружено, что штаммы с высокой гемагглютинирующей активностью были высокоадгезивными (более 10 бактерий на 1 эритроците), тогда как штаммы, не дающие гемагглютинацию, демонстрировали более низкий уровень адгезии (не более 2-3 бактерий на эритроцит).
В дальнейшем с целью выяснения природы структур, ответственных за адгезивность протея было проведено морфологическое исследование микробных клеток в электронном микроскопе. Электронно-микроскопическое исследование показало, что у клеток штаммов, способных вызывать реакцию гемагглютинации с эритроцитами цыпленка по периметру обнаруживали реснички длиной от 125 до 583 нм и шириной 8,3 нм, тогда как большинство клеток, не способных давать реакцию гемагглютинации, либо обладали ресничками в небольшом количестве, либо не имели их.
При постановке реакции гемагглютинации с эритроцитами цыпленка не было выявлено существенных различий между роящимися и нероящимися формами в их способности давать Д-маннозочувствительную и Д-маннозорезистентную реакции гемагглютинации, что дало нам основание поставить под сомнение позитивную роль свойства роения на адгезивную активность бактерий рода Proteus.
Многие исследователи относят а-гемолизин к числу важнейших белковых экзотоксинов условно-патогенных грамотрицательных энтеробактерий (Габидуллин З.Г., 2009; Бондаренко В.М., 2004). Проведенные исследования показали, что из 120 штаммов бактерий рода Proteus в той или иной степени а-гемолитической активностью обладали 95 (79,2%) штаммов, и не проявляли признак - 25 (20,8 %) культур. Сравнительное изучение гемолитической активности диссоциативных форм выявило более выраженную а-гемолитическую активность у нестабильно нероящихся форм (в среднем 76,4% гемолизированных эритроцитов) по сравнению с роящимися (53,4 %) и стабильно нероящимися формами (14,8%) (рис. 6).
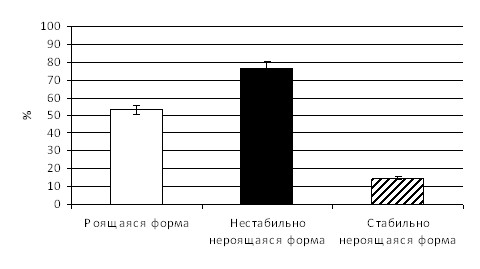
Рис. 6 – а-гемолитической активности диссоциативных форм протеев
( в процентах гемолизированных эритроцитов)
При изучении лецитиназной активности из 120 штаммов данное свойство было обнаружено у 100 (83,3%) и не обнаружено у 20 (16,7%) культур. Из 100 выявленных лецитиназопозитивных штаммов бактерий рода Proteus 27 (27%) обладали высокой степенью активности, 51 (51%) - средней и 22 (22%) - слабой. При этом максимальная выраженность лецитиназной активности отмечена у нестабильно нероящихся форм протеев (рис. 7).
Проведенные исследования по изучению ДНК-азной активности 5 суточной бульонной культуры показали, что из 120 штаммов бактерий рода Proteus 80 (66,7%) в той или иной степени проявляли указанную активность, и не проявляли 40 (33,3%). Среди ДНК-азапозитивных культур 12 (15%) проявляли высокую активность, 36 (45%) - среднюю, 32 (40%) - слабую. Сравнительное изучение ДНК-азной активности бактерий показало, что активность фермента была более выражена у нестабильно нероящейся формы по сравнению с роящейся (Н-) формой, а у стабильно нероящейся (О-) формы протеев этот признак не проявлялся или был слабо выражен.
Для сохранения от бактерицидных факторов сыворотки или фагоцитов микробная клетка располагает средствами дистанционного действия, направленными на инактивацию факторов врожденного иммунитета организма, среди которых наиболее изученным является антилизоцимный фактор бактерий. Проведенные исследования показали, что все 120 штаммов бактерий рода Proteus (не зависимо от источника выделения) обладали в той или иной степени антилизоцимной активностью.
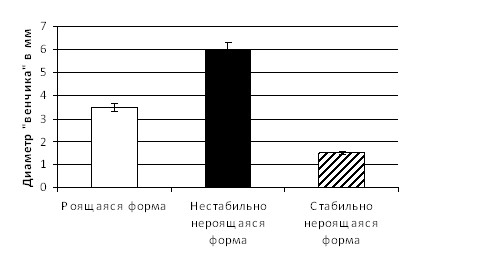
Рис. 7 – Лецитиназная активность диссоциативных форм протеев
(средний диаметр «венчика» на желточной среде в мм)
Сравнительное изучение показало, что нестабильно нероящиеся формы чаще проявляли более выраженную АЛА, чем роящиеся и стабильно нероящиеся формы. Экспрессивность признака у нестабильно нероящихся форм колебалась в пределах от 8 – 10 мкг/мл, тогда как у роящихся форм – от 4 до 7 мкг/мл, а у стабильно нероящихся форм – от 1 до 4 мкг/мл (рис. 8).
Многие исследователи при изучении вирулентности бактерий рекомендуют использовать метод интраназального заражения белых мышей, поскольку данный метод позволяет определить динамику размножения бактерий через различные интервалы времени
с момента введения возбудителя, а по времени гибели и количеству погибших животных - достаточно быстро установить степень вирулентности бактерий.
На «легочной модели» изучена вирулентность клинических изолятов, а так же диссоциативных форм рода Proteus. Из 120 штаммов бактерий рода Proteus 56 (46,7%) в той или иной степени проявляли вирулентность, остальные 64 (53,3%) оказались авирулентными. Сравнительное изучение этого свойства показало, что нестабильно нероящиеся формы бактерий рода Proteus чаще проявляли «бьющий эффект» (72 % животных) по сравнению с роящимися (40 % ) и стабильно нероящимися (отсутствие погибших животных) при интраназальном заражении мышей (р0,05).
Учитывая, что ЛТ-энтеротоксигенность условно-патогенных энтеробактерий является одним из ведущих факторов патогенности, тест «отек лап» мышей является простым и доступным способом при определении ЛТ-энтеротоксигенности бактерий кишечной группы (Вартанян Ю.Н. и др.,1978), мы использовали эту методику в своей работе.
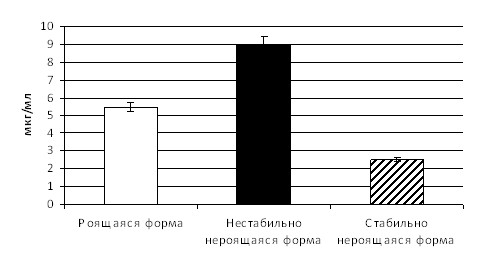
Рис. 8 - Антилизоцимная активность диссоциативных форм протея (в мкг/мл)
Результаты опытов показали, что из 120 штаммов бактерий рода Proteus способностью продуцировать ЛТ-энтеротоксин обладали 23 (19,2%) штамма и 97 (80,8%) культур не продуцировали ЛТ-энтеротоксин. Среди энтеротоксигенных культур 5 штаммов (21,8%) обладали высокой ЛТ-энтеротоксин продуцирующей активностью, 7 (30,4%) - средней и 11 (47,8%) - слабой. В доступной нам литературе мы не встретили данных сравнительного изучения ЛТ-энтеротоксиности диссоциативных форм бактерий рода Proteus. Анализ полученных материалов показал, что при переходе роящейся (Н-) формы протея в нестабильно нероящуюся форму отмечается тенденция повышения ЛТ-энтеротоксигенности, тогда как при переходе в стабильно не роящиеся формы ЛТ-энтеротоксигенность снижается или исчезает.
Принимая во внимание, что в настоящее время повсеместно наблюдается увеличение циркулирующих резистентных к антибиотикам штаммов, включая и протеи с образованием сложных плазмид множественной лекарственной устойчивости, несущих одновременно гены факторов патогенности (Булгаков А.К., 2000), мы определили антибиотикорезистентность 120 штаммов протеев дискодиффузионным методом к ряду антибиотиков: пенициллину, карбенициллину, ампициллину, оксациллину, левомицетину, тетрациклину, ристомицину, полимиксину, эритромицину, новобиоцину, стрептомицину, канамицину, мономицину, неомицину, гентамицину, рифампицину и налидиксовой кислоте.
Оказалось, что из 120 штаммов 70 обладали устойчивостью к 9 и более антибиотикам, 40- к 5-8 вышеперечисленным антибиотикам, остальные культуры были устойчивы к 3-4 антибиотикам, что свидетельствует о распространении среди штаммов бактерий рода Proteus полиантибиотикорезистентности.
В дальнейшем изучали возможность трансконьюгативной передачи множественной антибиотикоустойчивости между бактериями P. vulgaris и P. mirabilis и от бактерий рода Proteus к E. coli К12G62RifR. В качестве доноров использовали 28 штаммов P. mirabilis и 5 P. vulgaris. При этом у 4 (14,2%) штаммов P. mirabilis из 28 и у 2 штаммов P. vulgaris из 5 обнаружили коньюгационную передачу реципиентам устойчивости к левомицитину, ампициллину, стрептомицину, неомицину и мономицину. При этом частота передачи устойчивости к вышеперечисленным антибиотикам оказалась относительно низкой 5x10-8- 5x 10-9. Коньюгативная передача устойчивости к вышеперечисленным антибиотикам от доноров P. mirabilis и P. vulgaris к универсальному реципиенту E. coli К12G62RifR обнаружена у 3 (10,6%) штаммов P. mirabilis и у 1штамма P. vulgaris. При этом частота образования антибиотикоустойчивых трансконьюгантов между бактериями рода Proteus и E. coli К12G62RifR была ниже, по сравнению с бактериями рода Proteus, и составляла не более 2x10-9. Частота образования лекарственно-устойчивых трансконьюгантов зависела от времени контакта, условий культивирования. Полученные трансконьюганты были способны к передаче маркеров резистентности к реципиенту, не отличаясь по частоте передачи от родительских культур.
В следующей серии опытов мы проводили сравнительное изучение антибиотикорезистентности роящихся, нестабильно и стабильно нероящихся форм бактерий рода Proteus, к ряду антибиотиков (стрептомицин, левомицетин, тетрациклин, пенициллин, эритромицин, ампициллин, неомицин, карбенициллин, мономицин). Результаты исследования показали, что штаммы протеев в нестабильно нероящейся форме более часто демонстрировали полиантибиотикорезистентность (66,6 %) по сравнению с культурами в стабильно нероящейся форме, среди которых полиантибиотикорезистентных вариантов не найдено.
Учитывая, что бактерии рода Proteus относятся к условно-патогенным энтеробактериям, мы предприняли попытку выяснения природы генетического детерминанта факторов патогенности.
Для выяснения природы генетической детерминанты, контролирующей адгезивную активность бактерий рода Proteus, был изучен профиль плазмидной ДНК у 43 штаммов, обладающих положительной Д-маннозочувствительной и Д-маннозорезистентной реакцией гемагглютинации. При этом 20 штаммов оказались бесплазмидными, 5 - несли плазмиды мол. массы 40 и 60 мДа, 3 - плазмиды мол. массы 40 и 120 мДа и 15 - плазмиды мол. массы 120 мДа. На 14 штаммах, обладающих высокой адгезивной активностью (132, 183, 4701, 290, 2731, 2316, 2365, 2936, 6, 36, 1503, 1280, 1380, 1118) была исследована связь адгезии с наличием выявляемых плазмид. В качестве контроля использовали штамм Rts-1 P. vulgaris, несущий плазмиду массой 120 мДа, дающий положительную Д-маннозочувствительную и Д-маннозорезистентную реакцию гемагглютинации с эритроцитами цыпленка, а также его изогенные бесплазмидные клоны. Проведенные исследования не позволили выявить наличие какой-либо зависимости в способности культур протеев давать реакцию гемагглютинации с наличием плазмид.
В следующей серии опытов мы подбирали штаммы, несущие плазмиды мол. массой 40, 60 мДа, которые давали положительную реакцию гемагглютинации с эритроцитами цыпленка (МS и MR) и путем культивирования их, а бульоне Хоттингера, содержащем 5% додецилсудьфата натрия или 80-100 мкг/мл бромистого этидия проводили элиминирование плазмид. При этом изогенные пары штаммов в одинаковой степени проявляли Д-маннозочувствительную и Д-маннозорезистентную реакцию гемагглютинации с эритроцитами цыпленка. Также не было обнаружено каких-либо различий в адгезивной активности плазмидосодержащих и бесплазмидных клонов штамма P. vulgaris Rts1. Изучение роящихся (290, 2731, 29, 34, 35), нестабильно нероящиеся (290а, 2731а, 29а, 34а, 35а) форм, несущих плазмиду массой 120 мДа и их стабильно нероящихся бесплазмидных мутантов (290-41, 2731-41, 29-41) также не выявило существенных различий в их способности давать реакцию гемагглютинации с эритроцитами цыпленка.
Наши попытки в опытах прямой передачи плазмид и тройного скрещивания осуществить передачу между штаммами протеев детерминанта, контролирующего реакцию гемагглютинации с эритроцитами цыпленка не увенчались успехом. Полученные результаты дают нам основание полагать, что генетической детерминантой, контролирующей Д-маннозочувствительную и Д-маннозорезистентную реакцию гемагглютинации с эритроцитами цыпленка, вероятно, являются структурные элементы хромосомной природы.
В дальнейшем мы попытались выяснить генетическую природу признака, контролирующего у протеев продукцию LТ-энтеротоксина. У штаммов двух групп изучили профиль их плазмидной ДНК. Первую группу составляли штаммы - суперпродуценты LТ-энтеротоксина, вызывающие "отек лап" мышей до 95 мг и более, вторую - культуры, не продуцирующие LТ-энтеротоксин и вызывающие "отек лап" не более 35 мг. Из 5 штаммов первой группы (132, 183, 423, 151, 1284), три (132, 183, 423) оказались несущими 2 плазмиды мол. массой 60 и 120 мДа и 2 штамма (151, 1234) – 1 плазмиду мол. массой 120 мДа. Среди 7 штаммов второй группы (737, 73, 4477, 2779, 7, 35, 102) не было выявлено культур несущих плазмиду массой 60 мДа, и лишь у штаммов № 2779 и № 7 были обнаружены по 10 клонов, несущих плазмиду мол. массой 120 мДа (рис. 9).

В последующем были отобраны штаммы, обладающие плазмидами и продуцирующие высокоактивный LТ-энтеротоксин (132, 183, 423, 151, 1234). Путем культивирования в бульоне Хоттингера, содержащем 5% додецилсульфата натрия или 80-100 мкг/мл бромистого этидия, проводили элиминацию плазмид у клонов (не менее 50), утративших свойство продуцировать LТ-энтеротоксин, с последующим изучением профиля плазмидной ДНК. Из 50 клонов каждого штамма, утративших свойство продуцировать LТ-энтеротоксин, у двух на фореграмме просматривалась плазмида массой 60 мДа. С целью исключения роли других плазмид в продукции LТ-энтеротоксина отбирали штаммы, несущие плазмиды массой 120, 40 и 10 мДа и изучали способность центрифугата 18-20 часовой бульонной культуры вызывать "отек лап" мышей. Из взятых в опыт 15 штаммов 3 вызывали "отек лап" мышей до 45-65 мг, 5 - до 35-49 мг и 7 - не более 25 мг, что является дополнительным подтверждением роли плазмиды с мол. массой 60 мДа в продукции бактериями рода Proteus LТ-энтеротоксина.
В дальнейшем была изучена возможность коньюгативной передачи между бактериями рода Proteus, а также от протеев к E. coli G62RifR плазмиды, ответсвенной за LТ-энтеротоксигенность (Ent плазмиды). В качестве селективной среды использовали 4% мясопептонный агар, содержащий 100 мкг/мл рифампицина и, в зависимости от резистентности доноров, левомицитин, ампициллин или тетрациклин. Реципиент 290-41 (P. mirabilis) был чувствительным к левомицетину, ампициллину, тетрациклину и устойчивым к рифампицину в концентрации 100 мкг/мл. В качестве доноров использовали 11 штаммов P. mirabilis и 5 P. vulgaris. При этом из всех 16 штаммов лишь при скрещивании донорного штамма 423 (P. vulgaris) и реципиента 290-41 (P. mirabilis) обнаружили коньюгативную передачу Ent плазмиды. Анализ профиля плазмидной ДНК показал, что из 50 у 41 трансконьюгантов на фореграмме просматривалась плазмида мол. массой 60 мДа. При заражении животных эти трансконъюганты вызывали отек лапки 95 мг и более.
В результате культивирования в течение 20 часов при 28 °С из ассоциаций нестабильно нероящейся формы P. mirabilis 290а + E. coli К12G62 и P. vulgaris 2731+ E. coli К12G62 получали трансконьюганты. При этом у E. coli К12G62 появилась способность вызывать «отек лап» 75 мг и более, и при интраназальном заражении мышей вызывали гибель или болезненное состояние до 50% животных, что свидетельствовало о коньюгативной передаче плазмиды молекулярной массой 60 мДа от бактерий рода Proteus к E. coli. Анализ профиля плазмидной ДНК показал, что из 50 клонов, дающих «отек лап» 75 мг и более, у 10 трансконьюгантов на фореграмме просматривалась плазмида молекулярной массой 60 мДа.
Учитывая важную роль гемолизинов в патогенезе инфекции, мы попытались выяснить природу генетического детерминанта, контролирующего свойство продуцировать а-гемолизин. Результаты исследования показали, что среди 32 штаммов, обладающих а-гемолитической активностью, 27 обнаруживали плазмиду массой 120 мДа, что указывало на возможную роль данной плазмиды в продукции а-гемолизина.
В следующей серии опытов изучали профиль плазмидной ДНК у 31 штамма со средней гемолитической активностью и у 35 с низкой. При этом только у 19 штаммов со средней активностью на фореграмме обнаружили плазмиду массой 120 мДа. С целью конкретизации роли плазмиды мол. массой 120 мДа в а-гемолитической активности использовали изогенные пары штаммов. При этом у большинства гемолитически активных клонов культур 2731, 290, 29 (соответственно 30, 30, 29 из 50) на фореграмме наблюдали наличие плазмиды массой 120 МД, а у мутантов 290-41, 29-41, не проявляющих гемолитической активности, не было обнаружено плазмиды массой 120 МД. Тем не менее у части клонов (7 из 50) штамма 2731-41, проявляющих а-гемолитическую активность, аналогично с исходной формой просматривалась плазмида массой 120 МД. Проведенные нами опыты по изучению профиля плазмидной ДНК, элиминации и коньюгативной передаче плазмид не позволили выявить новых плазмид, контролирующих синтез ДНК-азы и лецитиназы.
Далее после культивирования при 37°С в течение 38 часов а-гемолитически активных штаммов в бульоне Хоттингера (pН 7,4-7,6) с 75 мкг/мл акридин оранжевого элиминировали плазмиду массой 120 мДа. Все наши попытки осуществить коньюгативную передачу плазмиды массой 120 мДа между бактериями рода Proteus, а также от протеев к универсальному реципиенту E. coli K12G62RifR не имели успеха. Оказалось, что 30 бесплазмидных штаммов, продолжали продуцировать а-гемолизин. По нашему мнению, полученные результаты свидетельствуют о вероятности существования у протеев генетическую детерминанту иной природы, контролирующую продукцию а-гемолизина. Выяснение этого вопроса является весьма актуальным, перспективным и вполне может быть предметом отдельного исследования.
В процессе диссоциации протея просматривалась тенденция повышения антилизоцимной активности при переходе в нестабильно нероящуюся форму и, напротив, понижение при переходе в стабильно нероящуюся (О-) форму. Однако, наши попытки выявить генетическую детерминанту антилизоцимной активности плазмидной природы не увенчались успехом.
Наличие у ряда клинических штаммов P. vulgaris и P. mirabilis генетических детерминант, контролирующих факторов патогенности (Д-маннозочувствительных и Д-маннозорезистэнтных гемагглютининов, LТ-энтеротоксина. а-гемолизина и других биологически активных веществ) свидетельствует о том, что среди культур протеев встречаются штаммы, которые следует рассматривать не как условно-патогенные, а как конкретные патовары бактерий рода Proteus.
Обобщая результаты наших исследований можно заключить, что данные по сравнительному изучению адгезивной, а-гемолитической, ДНК-ной, лецитиназной, антилизоцимной активностей, ЛТ-энтеротоксигенности и вирулентности, антибиотикоустойчивости диссоциативных форм бактерий рода Proteus в совокупности могут служить обоснованием для отнесения нестабильно нероящихся форм бактерий рода Proteus, к культурам обладающих более высоким патогенным и персистентным потенциалом, чем роящиеся и стабильно нероящиеся формы. Это указывает на этиологическую значимость нестабильно нероящихся форм протеев, что должно учитываться при разработке и апробации новых методов диагностики, профилактики и лечения заболеваний, вызванных диссоциативными формами бактерий рода Proteus.
Выводы:
1. Бактерии рода Proteus встречаются в виде трех диссоциативных форм: роящихся, нестабильно и стабильно нероящихся, которые отличаются по своим культурально-морфологическим, биологическим свойствам и ультраструктуре.
2. При сравнительном изучении биологических свойств диссоциативных форм бактерий рода Proteus выявлено, что нестабильно нероящиеся формы обладали более выраженными факторами патогенности и персистенции (а-гемолитической, лецитиназной, ДНК-азной, антилизоцимной активностью, ЛТ-энтеротоксигеннстью и вирулентностью) по сравнению с другими диссоциативными формами.
3. Показано, что роящиеся и нестабильно нероящиеся формы обладали более высокой полиантибиотикорезистентностью в отличие от стабильно нероящихся форм.
4. При изучении генетических детерминант установлено, что гемолитическая активность протеев обусловлена плазмидой массой 120 мДа, а ЛТ-энтеротоксигенность кодируется плазмидой массой 60 мДа. Однако, не исключено, что адгезивная и антилизоцимная активности детерминируются элементами хромосомной природы.
5. В ассоциации протеев с кишечной палочкой происходит коньюгативная передача плазмиды массы (60 мДа), эксперессирующей термолабильный энтеротоксин, что сопровождается появлением ЛТ-энтеротоксигенности у Е. соli.
Практические рекомендации:
- При оценке новых методов диагностики и лечения инфекций необходимо учитывать клинические варианты инфекционного процесса, вызванного различными диссоциативными формами бактерий рода Proteus.
- Материалы исследований, освещающие сравнительное изучение некоторых биологических свойств диссоциативных форм бактерий рода Proteus могут быть использованы в учебном процессе в ходе первичной и постдипломной подготовки специалистов бактериологов
- Штаммы Escherichia coli №280 и №281, выделенные из ассоциации с бактериями Рroteus mirabilis и Рroteus vulgaris, обладающих комплексом факторов патогенности (ГИСК им. Л.А. Тарасевича, Патенты РФ №2293765; №2293764), могут быть использованы в качестве эталонных культур при идентификации условно-патогенных энтеробактерий и в биотехнологии в качестве суперпродуцентов термолабильного энтеротоксина.
Список опубликованных работ по теме диссертации:
- Габидуллин Ю.З. Особенности патоморфологических изменений, вызванных моно- и ассоциированными бактериями семейства ENTEROBACTERIACEAE и STAPHYLOCOCCUS AUREUS в опытах «петля тонкого кишечника кролика» / Мамбетова Э.Ф., Габидуллин З.Г., Туйгунов М.М., Ахтариева А.А., Билалов Ф.С., Гибазов Н.Н., Саляхов Р.З., Насибуллин Н.Х., Габидуллин Ю.З. // Морфологические ведомости, приложение №1-2. Москва-Берлин, 2006.-С.155-156.
- Габидуллин З.Г. Характеристика свойств, определяющих персистенцию моно- и ассоциированных культур условно-патогенных энтеробактерий / З.Г. Габидуллин, Ю.З.Габидуллин, А.А.Ахтариева, М.М.Алсынбаев, Э.Ф.Мамбетова, М.М. Туйгунов, Д.Т. Гашимова, Ф.С. Билалов, Н.Н. Гибазов, Р.М. Ахмадеев, А.К. Булгаков // Журнал микробиологии, эпидемиологии и иммунологии.- 2006.-№4.-С. 62-64.
3. Суфияров Р.С. Комплексное лечение гнойно-воспалительных заболеваний, вызванных ассоциациями грамположительных и грамотрицательных бактерий (на примере St. Aureus с Pr. vulgaris, Morganella, Morganii и Enterobacter aggl.) / Р.С. Суфияров, М.В.Тимербулатов, З.Г. Габидуллин, С.И. Рахматуллин, А.А. Ахтариева, Р.Р. Суфияров, В.Г. Туйгунова, В.М. Изикаев, Г.А. Идиатуллина, Н.Н. Гибазов // Медицинский Вестник Башкортостана.-2010.-№3.-С.60-64.
4. Габидуллин З.Г. Морфологические, ультраструктурные и биологические особенности диссоциативных форм протея / З.Г. Габидуллин, В.М. Тимербулатов, Ю.З. Габидуллин, Н.Н. Гибазов, Р.С. Суфияров, М.М. Алсынбаев, Р.Р. Суфияров, А.А. Ахтариева, Г.А. Идиатуллина, В.М. Изикаев, Р.Ф. Насырова // Медицинский Вестник Башкортостана.-2011г. Т.6.-№1.-С.92-96.
Патенты на изобретение:
1. Штамм бактерий Escherichia coli ГИСК №281, обладающий способностью продуцировать термолабильный ЛТ-энтеротоксин. 2006. / Ф.С. Билалов, З.Г. Габидуллин, М.М. Алсынбаев, М.М. Туйгунов, А.К. Булгаков, Н.Н. Гибазов, Э.Ф Мамбетова, Д.Т. Гашимова, В.Г. Туйгунова, Ю.З. Габидуллин, А.А. Ахтареева, заявитель и патентообладатель ГОУ ВПО «Башкирский государственный медицинский университет» федерального агентства по здравоохранению и социальному развитию. - Патент РФ № 2293764. Опубл. 20.02.07, Бюл.№5.
2. Штамм бактерий Escherichia coli ГИСК №280, обладающий способностью продуцировать термолабильный ЛТ-энтеротоксин. 2006. / Ф.С. Билалов, З.Г. Габидуллин, М.М. Алсынбаев, М.М. Туйгунов, А.К. Булгаков, Н.Н. Гибазов, Э.Ф Мамбетова, Д.Т. Гашимова, В.Г. Туйгунова, Ю.З. Габидуллин, А.А. Ахтареева, заявитель и патентообладатель ГОУ ВПО «Башкирский государственный медицинский университет» федерального агентства по здравоохранению и социальному развитию. - Патент РФ № 2293765. опубл. 20.02.07, Бюл.№5.
Гибазов
Нуршат Нургарифанович
Сравнительная характеристика некоторых морфологических и биологических особенностей диссоциативных форм бактерии рода Рroteus.
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата медицинских наук
Подписано в печать 29.12.2011 г. Тираж 100 экз. Заказ № _____.
Оригинал макет изготовлен с помощью текстового редактора Microsoft Word 2003 for Windows. Гарнитура таймс. Печать офсетная. Усл. печ. листов – 1,0. Формат 64х84 1/16.
Отпечатано: _______________________________

