Роль внеклеточной днк и липидов матрикса во взаимодействии бактерий биопленок с антибиотиками
На правах рукописи
Тец
Георгий Викторович
Роль внеклеточной ДНК и липидов матрикса во взаимодействии бактерий биопленок с антибиотиками
03.00.07 – микробиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2007
Работа выполнена на кафедре микробиологии, вирусологии и иммунологии ГОУ ВПО «Санкт - Петербургский государственный медицинский университет имени академика И.П. Павлова Федерального агентства по здравоохранению и социальному развитию».
Научный руководитель: доктор биологических наук, профессор
| Аркадьева Галина Евгеньевна |
Официальные оппоненты:
доктор медицинских наук,
профессор Кветная Ася Степановна
доктор медицинских наук,
профессор Афиногенов Геннадий Евгеньевич
Ведущее учреждение ГОУДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию».
Защита диссертации состоится « » _____ 2007 г. в « » часов на заседании диссертационного Совета Д 208.086.03. при ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский пр.,д.47).
С диссертацией можно ознакомиться в библиотеке ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан « » апреля 2007 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Бойцов А.Г.
Актуальность темы. Последнее десятилетие ознаменовалось формированием новых представлений об организации жизни бактерий, особенностей их существования во внешней среде и организме человека. Основные открытия в этой области связаны с изучением бактериальных биопленок (Тец В.В. 1998; Amano A., et al., 1999; Сosterton J. W., et al., 1999; Watnic P., Kotler R., 2002). Накопившиеся данные свидетельствуют об особенностях свойств бактерий, находящихся в составе сообществ, наиболее актуальным из которых для практической медицины следует считать повышенную выживаемость микроорганизмов в биопленках (Anderl J.N., et al. 2000; Lewis K. 2001). Бактерии в составе сообществ выживают в присутствии антибиотиков, взятых в количествах, значительно превосходящих минимальную подавляющую концентрацию. Возможно, антибиотики, вообще, не могут полностью уничтожить бактерии биопленок, поскольку в последних обнаружены клетки, находящиеся в силу дифференцировки в состоянии полной устойчивости практически ко всем известным препаратам (Keren I., et al., 2004; Harrison J.J., et al., 2005; Lewis K. 2005). Несмотря на свою актуальность, биопленки остаются во многом слабо изученными. Очень мало известно о структуре, составе и функциях компонентов внеклеточного матрикса бактериальных сообществ. Среди различных молекул, обнаруженных в составе матрикса, особое внимание привлекают липиды и внеклеточная ДНК. Липиды входят в состав поверхностной оболочки, отграничивающей сообщество от внешней среды, формируя мембраноподобную структуру (Tetz V.V., et al., 1993; Zhou L., et al.,1998). Такая оболочка, предположительно, может служить преградой на пути антибиотиков в биопленку (Тец В.В. 1997). Большое внимание исследователей в последние годы привлекает ДНК, которую можно обнаружить за пределами клеток эукариот (Anker P., Stoun M., 2000; Bergsmedh A., et al., 2002 Anker P., et al., 2004). Внеклеточная ДНК бактерий остается мало изученной. Почти ничего не известно о её путях распространения и функциях. На сегодня, практически нет данных о путях экспорта ДНК в межклеточный матрикс микробных биопленок. Вместе с тем, внеклеточная ДНК в биопленках представляет особый интерес для понимания механизмов и путей горизонтального переноса генов между различными микроорганизмами. Можно предполагать, что исследование внеклеточной ДНК биопленок поможет в понимании особенностей их развития и изменчивости признаков, а также эффективности перераспределения генов, в особенности, контролирующих антибиотикоустойчивость и патогенность. Возможно, внеклеточная ДНК станет новой мишенью для воздействия на микроорганизмы.
Цель исследования - изучить состав фосфолипидов и содержание внеклеточной ДНК бактериальных биопленок, оценить возможность повышения эффективности антибиотикотерапии за счет воздействия на компоненты матрикса микробных сообществ.
Задачи исследования
- Изучить состав фосфолипидов матрикса и поверхностной оболочки биопленок неродственных представителей грамположительных и грамотрицательных бактерий.
- Произвести поиск и охарактеризовать внеклеточную ДНК в матриксе биопленок неродственных бактерий на различных стадиях развития сообщества.
- Оценить связь матриксной ДНК и изучить возможность воздействовать на неё с целью изменения свойств биопленки.
- Изучить влияние ДНКазы на активность передачи генов, интенсивность формирования и сохранение признака антибиотикоустойчивости в биопленках.
- Проверить эффективность воздействия на бактерии биопленок антибиотиков, способных преодолевать мембрану клеток эукариот.
- Оценить эффективность совместного действия ДНКазы и антибиотиков на биопленки разного возраста неродственных грамположительных и грамотрицательных бактерий.
Научная новизна.
Впервые проведено комплексное изучение состава внеклеточных фосфолипидов матрикса и поверхностной оболочки различных неродственных моно- и смешанных микробных сообществ. Выполнен поиск и идентификация внеклеточной ДНК микробных биопленок. Установлено, что в составе поверхностной оболочки биопленок и внеклеточном матриксе фосфолипиды по качественному составу аналогичны мембранным, но количественно в них преобладают стабильные фракции. Показано, что в матриксе различных, неродственных микроорганизмов присутствует внеклеточная ДНК, которая содержит гены бактериальной хромосомы и плазмид. Доказано, что антибиотики, способные проникать через мембрану клеток, действуют на бактерии, находящиеся в биопленках. Впервые установлено, что разрушение внеклеточной ДНК приводит к невосстановимым изменениям различных свойств биопленок неродственных бактерий, сопровождающимся снижением числа антибиотикоустойчивых клеток. Впервые доказана возможность усиления действия на биопленки неродственных микробов различных антибиотиков за счет воздействия на компонент матрикса - внеклеточную ДНК. Предложены новые способы борьбы с инфекционными заболеваниями (патенты РФ № 2267329, № 2269358, № 2269359).
Практическая ценность работы
На основании полученных данных стало возможным использовать новые критерии выбора антибиотиков для действия на бактерии, основанные на способности препарата проникать через липидную оболочку биопленок, что позволяет повысить эффективность антибиотикотерапии и уменьшить число осложнений.
Использование ДНКазы для воздействия на бактериальные биопленки позволяет уменьшить их биомассу, а также интенсивность образования и сохранения антибиотикоустойчивых клонов.
Выявлена новая мишень – внеклеточная ДНК матрикса биопленок для воздействия на бактерии с целью повышения эффективности антибиотикотерапии. Использование ДНК матрикса, как дополнительной мишени при терапии, позволяет повысить эффективность действия различных антибиотиков на неродственные микробы, находящиеся в биопленках, снизить вероятность возникновения, распространения и сохранения устойчивости к лечебному агенту, сократить общую продолжительность терапии, уменьшить сроки пребывания больных в стационаре и снизить частоту рецидивов заболевания.
Разработаны и внедрены в клиническую практику новые эффективные схемы антимикробной терапии, включающие воздействие на внеклеточную ДНК фермента ДНКазы у больных с абсцессами и флегмонами челюстно-лицевой локализации.
Внедрение в практику
Разработаны и внедрены в клиническую практику кафедры хирургической стоматологии и челюстно-лицевой хирургии Санкт-Петербургского государственного университеа им. академика И.П. Павлова новые эффективные схемы антимикробной терапии, включающие воздействие на внеклеточную ДНК матрикса ДНКазой у больных с абсцессами и флегмонами челюстно-лицевой локализации.
Получены патенты РФ: Тец В.В., Тец Г.В., Генкин Д.Д. Способ лечения заболеваний, сопровождающихся изменениями качественного и/или количественного состава внеклеточной ДНК крови // Патент РФ № 2267329 от 10 января 2006; Тец В.В., Тец Г.В., Генкин Д.Д. Способ лечения генерализованных инфекций, вызываемых бактериями, или заболеваний, вызываемых грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, обусловленных мутациями генов соматических клеток // Патент РФ № 2269358 от 10 февраля 2006; Тец В.В., Тец Г.В., Генкин Д.Д. Способ профилактики развития онкологических заболеваний, или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, развивающихся вследствие мутации генов соматических клеток // Патент РФ № 2269359 от 10 февраля 2006.
Материалы диссертации внедрены в лекционные курсы по общей и частной медицинской микробиологии для студентов и врачей в Санкт-Петербургском Государственном медицинском университете им. акад.И.П.Павлова.
Основные положения диссертации, выносимые на защиту
- Наличие фосфолипидов в поверхностной оболочке и матриксе бактериальных биопленок позволяет использовать новые принципы в выборе антибиотиков, активных против микробов, находящихся в составе сообществ.
- Добавление ДНКазы на разных стадиях существования бактериальных биопленок ведет к нарушению их образования, уменьшению биомассы, снижению эффективности формирования и сохранению антибиотикоустойчивых клонов.
- Совместное применение ДНКазы и антибиотиков ведет к усилению антибактериального эффекта при действии на биопленки неродственных бактерий разного возраста.
Апробация результатов исследования
Основные положения диссертации доложены и обсуждены на следующих конференциях симпозиумах и съездах:
Международная конференция «Актуальные вопросы экспериментальной и клинической медицины» Санкт-Петербургский Государственный Медицинский Университет им. акад. И.П. Павлова, 2006 г.
Научно-практическая конференция «Санкт-Петербургский научно-технический потенциал в решении проблем лабораторной медицины – Сделано в Санкт-Петербурге”, 2007 г.
1st European Congress of Microbiology June 29 – July 3, 2003. Ljubljana, Slovenia.
43rd Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) September 14–17, 2003. Chicago, Il, USA.
Fourth International Conference on Circulating Nucleic Acids in Plasma/Serum (CNAPS-IV)) (London, 2006),
Диссертация апробирована на заседании кафедры микробиологии, вирусологии и иммунологии/НИЦ отдела молекулярной биологии и генетики и на проблемной комиссии «микробиология и иммунология» СПбГМУ им. акад. И.П. Павлова (2007).
Личный вклад автора
Личное участие автора осуществлялось на всех этапах работы. Автор участвовал в определении идеи исследования. Лично автором выполнены микробиологические и молекулярно-генетические исследования, разработаны методы идентификации внеклеточной ДНК матрикса и созданы оригинальные праймеры. Произведены статистическая обработка результатов и анализ полученных данных.
Публикации
По теме диссертации опубликовано 9 научных работ, в том числе 4 статьи в ведущих рецензируемых изданиях РФ.
Структура и объем диссертации
Диссертация представлена в одном томе, состоит из введения, 3 глав, содержащих: обзор литературы, материалы и методы, результаты собственных исследований; заключения, выводов, практических рекомендаций и списка литературы. Работа изложена на 164 страницах машинописного текста, содержит 50 таблиц и 16 рисунков.
Материалы и методы
Объектом исследования служили стандартные штаммы грамположительных и грамотрицательных бактерий, полученные из международных коллекций и выделенные у больных в клиниках урологии, акушерства и гинекологии, госпитальной терапии, хирургической стоматологии и челюстно-лицевой хирургии Санкт-Петербургского Государственного медицинского университета им. И.П.Павлова: Acinetobacter baumanii VT-54; Enterobacter spp. VT1620; Enterobacter VT955; Escherichia coli АТСС 25922; E. coli K-12; E. coli XL-1 blue AmpR (плазмидная устойчивость к ампициллину и тетрациклину, плазмида pNF-kB-Luc); E. coli G-1 KmR; Haemophilus influenzae VT450-2006; Klebsiella pneumoniae VT-1367; Pseudomonas aeruginоsa VT592 Staphylococcus aureus АТСС 29213; S.aureus ATCC 25923; S.aureus VT 209; S. aureus VT-38, S. epidermidis VT-43; S. epidermidis VT-82; S.epidermidis VT 710; S.pyogenes VT 59.
Питательные среды. Мясопептонный бульон (МПБ), мясопептонный агар (МПА), минимальная синтетическая среда М9, бульон Мюллер-Хинтон (bioMerieux), агар Мюллер-Хинтон (bioMerieux), Шедлер агар (bioMerieux) и трипказосоевый агар (bioMerieux), среда LB (Sigma).
Антибиотики и ферменты. В работе использованы различные природные и синтетические антибиотики: азитромицин (Отечественные Лекарства, Россия), ампициллин (Hemofarm DD, Югославия), гентамицин (Lederle, США), канамицин (ICN, США) левофлоксацин (Отечественные Лекарства, Россия), линкомицин (ICN, США), цефотаксим (Lek DD, Словения), ципрофлоксацин (Bayer, Германия), рифампицин (ICN, США), тетрациклин (BioMerieux, Франция). Дезоксирибонуклеаза I – ДНКаза I (ООО «Самсон», Россия), папаин (Loba Chemie), протеиназа К (Sigma, США), лизоцим (Serva, Германия).
Жизнеспособность бактерий оценивали, определяя число колониеобразующих единиц (КОЕ) методом серийных разведений. Для этого готовили последовательные десятикратные разведения в физиологическом растворе и по 0,1 мл высевали на агаризованную среду, после чего инкубировали 24 часа при Т= 37OС и подсчитывали количество выросших колоний.
Минимальную подавляющую концентрацию (МПК) антибиотиков определяли на жидкой и плотной питательной средах, используя метод серийных разведений. Метод основан на последовательных двукратных разведениях антибиотика. Бактериальную суспензию вносили в количестве, соответствующем стандарту мутности 0,5 по McFarland, и инкубировали при Т= 37OС. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), при которой бактериальный рост визуально не определялся, принимали за МПК.
Получение биопленок. Во флаконах на дно помещали покровное стекло размером 1,5 см на 0,5 см, затем вносили 0,4 мл бульонной культуры (5х108 КОЕ), инкубировали 3 часа при Т= 370 С и после этого добавляли свежую среду до 2,0 мл. Флаконы выдерживали требуемое время при Т= 37OС. Образование биопленки оценивали микроскопически, для чего покровные стекла извлекали из флаконов, отмывали фосфатным буфером, фиксировали 96O этиловым спиртом и окрашивали раствором генцианвиолета. В чашках Петри (D= 40мм) вносили по 0,8 мл бактерий в конечной концентрации (5х108КОЕ), инкубировали 3 часа при Т=37OС и после этого добавляли по 2 мл свежей среды. Чашки выдерживали 24 часа при Т=37OС. В пластиковых планшетах (96–ти луночные планшеты Sarstedt, Германия) в лунки вносили по 0,1 мл бульонной культуры бактерий (5х107 КОЕ), выращивали в течение 24-х часов при Т= 37OС. Для оценки состояния биопленок удаляли содержимое лунок, промывали трехкратно фосфатным буфером, высушивали, окрашивали раствором генцианвиолета (50 мкл/лунку) в течении 10 минут, промывали фосфатным буфером, затем добавляли 96O этиловый спирт (200 мкл/лунку) и учитывали результаты на ридере (Stat-Fax-2100) при длине волны 560 нм.
Получения внеклеточного матрикса. Бактериальные сообщества смывали или соскабливали с поверхности в минимальном объеме дистиллированной воды или изотонического раствора хлорида натрия. Полученную суспензию центрифугировали для разделения на фракции клеток и внеклеточного матрикса.
Выявление мутантов антибиотикоустойчивости. Исходную микробную взвесь высевали на агаризованную среду, содержащую рифампицин в концентрации 25 мкг/мл. Количество мутантов, давших рост на среде с антибиотиком, определяли через 72 часа инкубации при Т= 37ОС. Антибиотикоустойчивыми считали клоны, которые росли после пересева на свежую среду содержащую рифампицин.
Выявление передачи генов антибиотикоустойчивости проводили при совместном культивировании Escherichia coli XL1-Blue KmR и Escherichia coli G1 AmpR на средах без антибиотика, содержащих раздельно канамицин или ампициллин, а также канамицин с ампициллином. Учет опыта проводили через 24 или 48 часов.
Выделение нуклеиновых кислот из внеклеточного матрикса сообществ выполняли методами фенол – хлороформной и гуанидин - тиоционатной экстракции, а так же при помощи стандартного набора для выделения ДНК “ДНК сорб-В” (Маниатис)
Электрофорез ДНК выполняли в 0,7-2,0% агарозном геле. В качестве буфера использовали 50 мМ трис-ацетатный буфер (0,04 М пятидесятикратного трис-ацетата, 0,002 М ЭДТА, вода остальное), рН 7,5. Фрагменты ДНК окрашивали бромистым этидием.
Определение количества и структуры ДНК. Содержание и структуру ДНК бактерий и матрикса определяли с использованием 4’,6-диамидино-2-фенилиндола (ДАФИ) (фирма “Serva”, Германия) в конечной концентрации 0,4 мкг/мл после лизиса образцов в условиях получения нуклеоида. Для изучения изменений структуры ДНК применяли двухпараметровый флуоресцентный анализ суперспиральной структуры полинуклеотида, включающий использование интеркалятора – этидий бромида (“Sigma”, США) и неинтеркалирующего ДНК-лиганда – ДАФИ, как описано ранее (Иванов С.Д., и др. 1999). Целостность клеточных мембран оценивали по изменению их проницаемости, для чего определяли величину флуоресценции пробы после обработки клеток ДНК-специфичным флуорохромом.Все измерения проводили на флуоресцентном спектрофотометре “Model-850” (фирма Hitachi, Япония). Для ДАФИ устанавливали возб = 350 нм, эм = 450 нм, для этидий бромида - возб = 510 нм, эм = 590 нм.
Выявление генов 16S рибосомальной ДНК в межклеточном матриксе проводили по следующей паре олигонуклеотидных праймеров: 5’-TCCTACGGGAGG- CAGCAGT-3' и 5’-GGACTACCAGGGTATCTAATCCTGTT-3' с длиной ампликона равной 466 нуклеотидов (NCBI-BLAST). Синтез праймеров проведен в ООО “Синтол”. Реакцию ставили в присутствии 0,2% mM каждого из дезоксинуклеотидтрифосфатов 2,5 mM MgCl2, 30 mM Трис-HCl (pH 8,5 при +25ОС), 16 mM (NH4)2SO4, 0,1% Nonidet P40 (“Sigma”), по 0,5 мкл олигонуклеотидных праймеров и 2,5 Ед Dia Taq ДНК полимеразы (ФГУН ЦНИИЭ Роспотребсоюза, Росси) на амплификаторе “Teche” (Англия). Условия проведения ПЦР: 95OС 3 мин 30 сек; затем 94ОС 15 сек, 58ОС 30 сек; 72ОС 45 сек – 37 циклов; затем 72ОС 7 минут 35 секунд. ПЦР фрагменты анализировали электрофорезом в 2% агарозном геле окрашиванием бромистым этидием. С помощью маркера молекулярной массы (100 bp DNA Ladder BioLabs 500 мкг/мл) подтверждали соответствующие размеры интересующего фрагмента искомого ампликона. В качестве положительного контроля использовали 2,5 мкл бактериальной культуры E.coli ATCC 25922 в концентрации 105 клеток/мл (Harris K.A., Hartley J.C., 2003). Негативный контроль отражал наличие контаминации ПЦР реактивов бактериальной ДНК. Для этого, вместо опытных образцов, к ПРЦ реактивам добавляли 2,5 мкл стерильной воды для инъекций (Микроген, Россия).
Изучение липидного состава бактериальных сообществ выполнено с использованием меченного фосфата - Na2H33PO4 (“Изотоп”, Россия) общей активностью 30 мкКюри. поверхностную оболочку биопленки для её отделения от слоя бактериальных клеток фиксировали 15 мл 0,25% раствора глутарового альдегида в 0,1М фосфатном буфере, рН 7,2. липидный состав определяли методом высокоэффективной тонкослойной хроматографии на пластинах “Sorbfil” фирмы “Сорбполимер” (Россия) с размером зерен сорбента 8-12 мкм. Проводили двумерное разделение в следующих системах растворителей - 1-е направление: хлороформ-метанол-аммиак (70 : 30 : 2, об/об); 2-е направление: хлороформ-метанол-вода (65 : 25 : 4, об/об). Объемы липидных экстрактов препаратов клеток и биопленок, наносимых на пластины, выравнивали по радиоактивности. Включение радиоактивной метки в фосфорсодержащие компоненты липидных экстрактов определяли авторадиографически наложением хроматограмм на пластины Biomax MR фирмы “Kodak” и экспонированием в течение 3 -7 суток при комнатной температуре. Зоны меченых соединений выявляли по процедуре, специально разработанной этой фирмой для авторадиографических пленок. Изготовление сканограмм проводили после просмотра готовых пленок на приборе DeskScan II фирмы HP. Соотношение отдельных липидных компонентов в препаратах рассчитывали путем оценки радиоактивности отдельных пятен хроматограмм. С этой целью сорбент с соответствующих зон пластинок аккуратно выскребали и количественно переносили в виалы, содержащие 10 мл сцинтилляционной жидкости “Ecolite” фирмы IСN.Уровень радиоактивности проб измеряли на установке “БЭТА-2”, СССР. Изучение фосфолипидного состава выполнено совместно с Лабораторией биохимии и развития микроорганизмов Института экологии и генетики микроорганизмов УрО РАН, за что автор выражает глубокую признательность руководителю, профессору В.Н Коробову и сотрудникам.
Статистическая обработка выполнена с использованием методов вариационной статистики. Наряду со средним арифметическим значением (М), вычисляли величины среднеквадратичной ошибки ( сигма), определяли доверительные границы выборочного параметра. При представлении количественных данных приводятся значения М+/-. Достоверность различий оценивали, используя t – критерий Стьюдента при пороге доверительной вероятности 0,97. (Монцевичуте-Эрингене Е.В. 1964)
Во всех таблицах суммированы данные трех и более независимых экспериментов. Для статистической обработки полученных результатов использовали пакет лицензированных прикладных программ «Stadia», версия 2; «Arcada», а также лицензированную программу для анализа данных биомедицинских исследований Primer for Biostatistics, Version 4.03 by Stanton A. Glantz 2000 г.
Результаты исследования
Все использованные штаммы обладали культуральными и тинкториальными свойствами, характерными для данного вида микроорганизмов. При выращивании на плотных питательных средах бактерии образовывали колонии, колониеподобные сообщества, смешанные сообщества и биопленки. Биопленки получали на дне лунок планшет, флаконов или поверхности стекол, помещенных на дно флаконов, чашках Петри. Биопленки изученных штаммов через 24 часа роста покрывали всю поверхность дна использованной посуды непрерывным “ковром”, с зонами утолщения, образованными многослойными скоплениями клеток и участками, в которых при световой микроскопии бактерии не выявляются. При спектрофотометрическом изучении матрикса биопленок, отделенного от клеток центрифугированием, при разных длинах волн выявлены пики поглощения, характерные для белков, полисахаридов и нуклеиновых кислот.
Липиды бактериальных биопленок. Согласно данным электронномикроскопического анализа (Tetz V.V., et al., 1993; Zhou L., et al.,1998) поверхностная оболочка имеет компонент по строению сходный с мембраной. В результаты выполненного исследования установлено, что поверхностная оболочка биопленок и матрикс содержат фософолипиды. Фосфолипидный состав мембран использованных штаммов грамотрицательных и грамположительных бактерий различается. Качественный состав фосфолипидов клеточных мембран каждого штамма и матрикса образуемых ими биопленок совпадает, но различается количеством отдельных компонентов (Табл. 1).
Таблица. 1
Содержание фосфолипидов в экстрактах мембран бактериальных клеток и внеклеточного матрикса
| Фракции фосфолипидов | Содержание фосфолипидов (%) | |||||
| E.coli | S.aureus | E.coli+S.aureus | ||||
| Клетки | Матрикс | Клетки | Матрикс | Клетки | Матрикс | |
| 1.Фосфатидилглицерол –PG | 10,0 | 13,4 | 71,6 | 32,2 | 14,0 | 3,2 |
| 2.Лизофосфатидилглицерол-LPG | 1,4 | - | 5,6 | 0,7 | 0,8 | 0,5 |
| 3.Фосфатидил-этаноламин -PEA | 80,3 | 70,4 | 2,7 | 0,9 | 65,8 | 62,6 |
| 4.Лизофосфатидил- этаноламин- LPEA | 1,8 | 1,2 | - | - | 0,5 | 0,8 |
| 5. Фосфатидная кислота –PA | 0,1 | 0,9 | - | - | <0,1 | 0,5 |
| 6. Кардиолипин -CL | 4,6 | 12,2 | 7,7 | 65,5 | 11,9 | 31,0 |
| Сумма лизофосфолипидов | 4,3 | 1,2 | 17,4 | 1,3 | 3,5 | 1,3 |
В экстрактах липидов клеток и матрикса, полученных из смешанной биопленки, образованной стафилококком и кишечной палочкой, обнаруживаются практически все основные компоненты фосфолипидов, характерные для каждого из составляющих газон видов бактерий. Обращает на себя внимание, что различия количеств фракций фофсолипидов мембран и матрикса в биопленках, образованных отдельными бактериями или их смесью, касаются, прежде всего, стабильных и нестабильных фракций. Так, мембраны всех бактерий по сравнению с матриксом содержат значительно больше нестабильных лизофосфолипидов. В то же время, матрикс несет значительно больше сравнительно стабильного кардиолипина. Повышенное содержание кардиолипина в липидах внеклеточного пространства биопленки, во-видимому, является важной предпосылкой стихийного образования мембраны или мембраноподобной структуры повышенной прочности, которая может функционировать в качестве защитного барьера между сообществом бактериальных клеток и окружающим пространством.
Сравнение свойств внеклеточной ДНК, полученной из биопленок разного типа грамположительных и грамотрицательных бактерий, показало, что во всех пробах матрикса, присутствует внеклеточная ДНК с молекулярной массой, примерно, 30 кДа (Рис. 1).
Рисунок 1. Электрофореграмма внеклеточной ДНК матрикса микробных сообществ E. coli ATCC 25922 и S.aureus 209.
Использованный метод электрофоретического разделения в агарозном геле с концентрациями от от 0,5 до 2,0 % не показал различий в величине фрагментов ДНК матрикса, полученной из различных сообществ неродственных бактерий (S.aureus VT209, E. coli АТСС 25922, P aeruginosa VT592, A. baumanii VT-54, S. pyogenes VT59.). Изучение внеклеточной ДНК, выделенной из смешанных микробных сообществ, образованных S.aureus VT209 и E. coli АТСС 25922, при электрофорезе идет единым, не разделенным фронтом, не отличимым от фрагментов, обнаруженных в сообществах сформированных бактериями одного типа. При исследовании внутриклеточной ДНК бактерий установлено, что кроме хромосомной ДНК в клетках биопленок, полученных на плотной и в жидких питательных средах, у грамположительных и грамотрицательных бактерий содержатся участки ДНК с молекулярной массой, примерно, 30 кДа. Полученные данные позволяют предположить, что фрагменты образуются внутри клеток.
Выявление генов хромосомной ДНК во внеклеточном матриксе биопленок выполнено с использованием разработанного нами праймера, (консервативный участок генома, кодирующий 16S рибосомальню РНК) выбранного в результате анализа сиквенированных геномов бактерий (NCBI BLAST- http://130.14.29.110/sutils/genom_table.cgi?organism=microb). В результате проведенных исследований, во внеклеточном матриксе биопленок, сформированных E.coli ATCC 25922 и S.aureus VT-209, обнаружены фрагменты хромосомной ДНК
Оценка появления внеклеточной ДНК матрикса микробных сообществ на различных этапах роста показала, что изменение количества ДНК внутри бактерий и свободной во внеклеточном матриксе биопленок зависит от сроков роста сообщества и проницаемости мембран. Установлено, что по мере старения культуры (с 24 до 72 часов), не происходит значимого увеличения количества свободной ДНК в матриксе, в то время как содержание внутриклеточной ДНК снижается. Одновременно наблюдалось достоверное повышение проницаемости клеточных мембран после 72 ч роста по сравнению с 24х - и 48ми часовыми культурами бактерий. Опережение уменьшения количества внутриклеточной ДНК по отношению к нарушениям проницаемости мембран у эукариот указывает на апоптоз. Это свидетельствует в пользу того, что попадание ДНК во внеклеточный матрикс в стационарной стадии роста бактерий может быть связано с апоптозо-подобной гибелью клеток, существование которой описано в ряде работ (Yarmolinsky M. B. 1995; Hochman A. 1997; Lewis K. 2000; Sat B., et al., 2001).
Влияния экзогенных ДНКаз на внеклеточную ДНК бактериальных сообществ исследовано у большинства использованных штаммов. Фермент - ДНКаза I в разных количествах добавляли одновременно с засевом бактерий. Установлено, что молекулярная масса ДНК, выделенной из биопленки, выращенной в присутствии ДНКазы, не отличалась от контрольной, однако ее количество было снижено. Полученные данные свидетельствуют, что во внеклеточном матриксе в присутствии ДНКазы происходит разрушение ДНК.
Формирование микробных сообществ в присутствии ДНКазы I и действие на уже образованные биопленки. Добавление ДНКазы в питательную среду одновременно с засевом бактерий для получения микробных сообществ у изученных штаммов неродственных грамположительных и грамотрицательных бактерий вызывало снижение оптической плотности биопленок. Использованные штаммы в присутствии ДНКазы образуют биопленки, по биомассе, определяемой на ридере, отличающиеся от обычных, полученных в тех же условиях, но без фермента. Одной из причин изменения свойств биопленки при добавлении ДНКазы, предположительно, могло быть образование токсических продуктов распада ДНК. Действие олиго-, моно- и динуклеотидов появляющиеся при добавлении ДНКазы, на бактериальные биопленки, оценивали, добавляя одновременно с засевом бактерий растворы, содержащие нуклеотиды в количестве 200 мкг/мл, 100 мкг/мл, 20 мкг/мл и 5 мкг/мл. Состояние биопленки определяли через 24 часа инкубации при 37ОС. Оптическая плотность биопленок, выращенных при добавлении перевара ДНК в количестве от 5 до 200 мкг/мл, не отличалась от контрольных. Таким образом, полученные данные указывают, что изменения свойств биопленки при действие ДНКазы не связано непосредственно с токсичностью нуклеотидов, образуемых при распаде ДНК. Степень снижения оптической плотности биопленки, образованной в присутствии различных концентраций ДНКазы, имеет дозозависимый характер, что указывает на специфичность зарегистрированного эффекта (Рис 2).
Рисунок 2. Угнетение формирования биопленки E.coli ATCC 25922 и S.aureus 209.
В присутствии ДНКазы в биопленке зарегистрировано также снижение числа КОЕ. Вместе с тем, имеется несоответствие в степени снижения оптической плотности биопленки и уменьшения в ней числа КОЕ. Так, ДНКаза, добавленная в концентрации от 0,007 до 0,5 мкг/мл, вызывает уменьшение оптической плотности биопленки более чем на 20%, не приводя к изменениям числа КОЕ. Максимальное снижение числа КОЕ в биопленках у грамотрицательных и грамположительных бактерий было схожим и наблюдалось при концентрации ДНКазы 5 мкг/мл. Дальнейшее увеличение концентрации фермента не приводило к дополнительному, существенному уменьшению числа КОЕ, однако оптическая плотность биопленки продолжала снижаться. При действии на сформированные биопленки, ДНКаза так же вызывает снижение их биомассы. Уменьшение оптической плотности 24х часовых сообществ грамотрицательных бактерий достигало 75% и зависело от концентрации фермента. При этом не наблюдалось значительной разницы между эффектами действия ДНКазы, добавленной в концентрациях от 5 мкг/мл, до 20 мкг/мл. Показано, что дозозависимость и усиление эффекта исчезают при увеличении концентрации выше определенного уровня. Предполагается, что лимитирующим фактором является проницаемость матрикса. При этом количество препарата, проникающего в биопленку, не нарастает параллельно увеличению его концентрации в окружающей среде.
Влияние ДНКазы на возникновение, сохранение и перераспределение признака антибиотикоустойчивости в биопленках. В присутствии ДНКазы, добавленной в количестве от 0,5 мкг/мл, наблюдается снижение частоты встречаемости в биопленках рифампицин устойчивых мутантов. Наименьшее число устойчивых клонов обнаружено при добавлении ДНКазы в количестве 5 мкг/мл. Влияния ДНКазы на передачу генов антибиотикоустойчивости в условиях планктонного роста и в биопленках изучали с использованием штаммов E.coli XL1 - Blue Kmr и E.coli G1 Ampr, имеющих плазмидную антибиотикоустойчивость к ампициллину или канамицину. Добавление ДНКазы в количестве 1 мкг/мл совместно с засевом бактерий при получении смешанного сообщества снижало число появляющихся антибиотикоустойчивых мутантов в 10 раз. Выживаемость антибиотикоустойчивого штамма E.coli XL-1 Blue при действии ДНКазы в условиях планктонного роста также снижалась, примерно, в 10 раз.
Действие на бактерии биопленок антибиотиков, способных проникать в клетки эукариот, было исследовано на примере левофлоксацина и азитромицина. Полученные результаты свидетельствуют, что данные антибиотики в количествах от 1 до 200 МПК, влияют на формирование, а также действуют на уже сформированные биопленки испытанных штаммов. Полного угнетения образования биопленок не происходит ни в одном случае. Для всех испытанных штаммов получены схожие по характеру результаты, пример которых по изучению азитромицина, приведен в табл. 2 и 3.
Таблица 2
Влияние азитромицина на сформированные биопленки S.aureus VT209
| Проба | Характеристика биопленки | |||||
| Биомасса биопленки в ЕД оптической плотности | Биомасса биопленки в % по отношению к контролю | |||||
| 1* | 2 | 3 | 1 | 2 | 3 | |
| Интактный контроль | 1,980 | 2,110 | 2,270 | 100 % | 100 % | 100 % |
| Азитромицин 1 МПК | 1,968 | 2,050 | 2,205 | 99,0% | 97,0% | 97,1% |
| Азитромицин 10 МПК | 1,666 | 1,840 | 1,950 | 84,0% | 87,0% | 85,9% |
| Азитромицин 100 МПК | 1,074 | 1,320 | 1,470 | 66,2% | 62,5% | 64,7% |
*- № эксперимента
Таблица 3
Влияние азитромицина на число КОЕ сформированных биопленок S.aureus
VT209
| Проба | Число КОЕ |
| Интактный контроль | (3,0±0,1)109 |
| Азитромицин 1 МПК | (2,5±0,1)109 |
| Азитромицин 10 МПК | (9,0±0,1)108 |
| Азитромицин 100 МПК | (6,4±0,1)108 |
** -среднее по результатам трех опытов
Таким образом, можно говорить, что левофлоксацин и азитромицин проникают через липидсодержащую поверхностную оболочку биопленок различных неродственных грамположительных и грамотрицательных бактерий. При этом регистрируется снижение биомассы и числа жизнеспособных бактерий.
Совместное действие ДНКазы и антибиотиков было изучено с использованием препаратов вне зависимости от способности последних проникать в интактные биопленки использованных штаммов бактерий. При формировании биопленок антибиотики использовали в субингибирующих концентрациях (ниже МПК в 5-10 раз), которые, добавленные при засеве, снижают биомассу образовавшейся биопленки, в среднем, на 20-25%. При совместном действии фермента и антибиотика зарегистрировано усиление угнетения формирования биопленок. Комплексы антибиотиков с ДНКазой снижали биомассу сообщества на 60-70%. Взаимное потенциирование действия нуклеазы и антибиотиков обнаружено у всех испытанных комплексов (Рис 3).
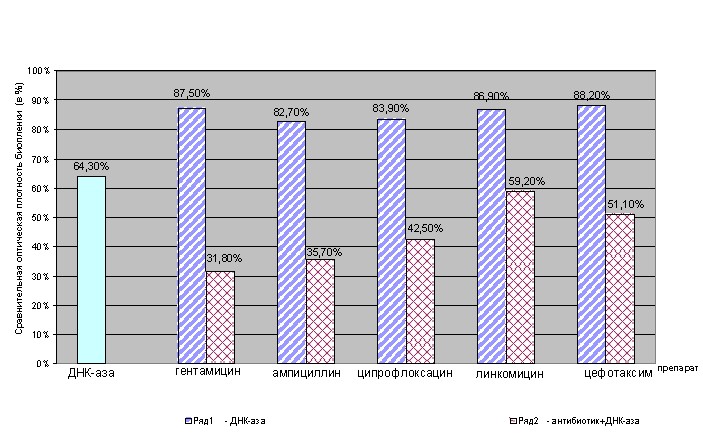
Рисунок 3. Совместное действие ДНК-азы и антибиотиков на формирование биопленки S. aureus VT – 38.
Уровень снижения оптической плотности, в присутствии различных антибиотиков, мало различался у исследованных штаммов неродственных грамположительных и грамотрицательных бактерий.
Антибиотики к 24 часовым биопленкам добавляли в количестве 100 мкг/мл. При этом препараты вызывали незначительное, на 15-20%, уменьшение их биомассы. Уровень снижения оптической плотности, в присутствии различных антибиотиков, мало различался у исследованных штаммов неродственных грамположительных и грамотрицательных бактерий. Фермент – ДНКаза, добавленная к 24 часовым биопленкам различных бактерий, вызывает однотипный эффект (как это видно, например, на рис 4), проявляющийся в снижении оптической плотности более чем на 40%.
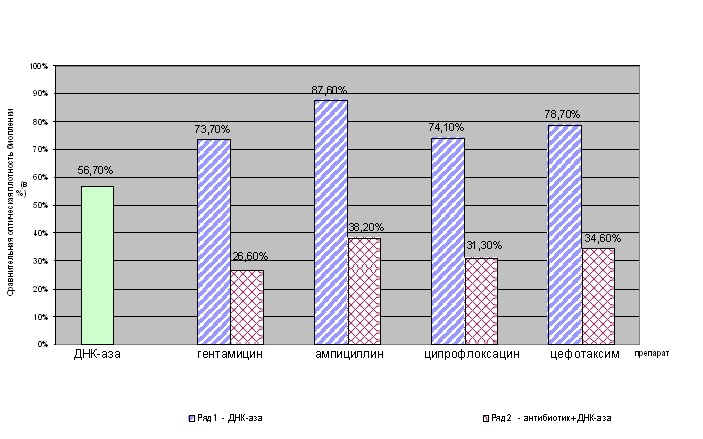
Рисунок 4. Совместное действие ДНК-азы и антибиотиков на 24-х часовую биопленку E.coli АТСС – 25922.
Анализ выживаемости бактерий в присутствии ДНКазы и антибиотиков в 24 часовой биопленке показал, что среди препаратов (ампициллин, гентамицин, ципрофлоксацин, линкомицин, цефотаксим), взятых в концентрациях 100 мкг/мл только гентамицин снижал число КОЕ в 24 ч биопленке. Например, если в контроле число КОЕ E.coli АТСС 25922 составляло (9,32±0,18)х 108, то после воздействия гентамицина - (2,29±0,13)х106. Нуклеаза в количестве 5 мкг/мл не изменяла число КОЕ в 24х часовых биопленках испытанных штаммов грамотрицательных и грамположительных бактерий. Установлено, что в присутствии ДНКазы и использованных антибиотиков регистрируется снижение числа КОЕ (Табл. 4) Поскольку сами по себе ферменты не влияли на жизнеспособность бактерий, выявленный феномен связан, скорее всего, с увеличением поступления антибиотиков внутрь биопленок.
Таблица 4.
Выживаемость E.coli АТСС 25922 в 24-х часовых биопленках в присутствии ДНК-азы и антибиотиков
| Препарат | Число КОЕ |
| Контроль | (9,32±0,18)* 108 |
| ДНК-аза | (8,91±0,29)* 108 |
| Ампициллин | (5,36±0,17)* 108 |
| Ампициллин + ДНК-аза | (1,81±0,23)* 107 |
| Ципрофлоксацин | (6,25±0,18)* 108 |
| Ципрофлоксацин +ДНК-аза | (3,57±0,24)* 107 |
| Гентамицин | (2,29±0,13)* 106 |
| Гентамицин+ ДНК-аза | (1,43±0,16)* 105 |
| Цефотаксим | (6,42±0,18)* 108 |
| Цефотаксим+ДНКаза | (5,94±0,29)* 107 |
Восстановление биопленки, после действия ДНКазы и антибиотиков имело индивидуальный характер. Через 168 часов после окончания действия ДНКазы биомасса биопленок не восстанавливалась и составляла у стафилококка 64,4%, а кишечной палочки – 38,6% от контрольного уровня. По отношению к E.coli были испытаны левофлоксацин (3 МПК-10 мкг/мл) и гентамицин (100 мкг/мл), при этом через 7 суток не наблюдалось восстановление биомассы биопленки по отношению к контролю. Через 168 часов биопленки S. aureus после воздействия левофлоксацина и азитромицина частично восстановились, и их биомасса составила по отношению к контролю около 78% и 98% соответственно. Восстановление не отмечено после удаления гентамицина, когда биомасса биопленок после 7 суток роста составляла, примерно, 56% от контроля. Таким образом, установлено, что изменения биопленки, вызванные однократным добавлением ДНКазы, сохраняются на протяжении всего эксперимента у использованных штаммов грамотрицательных и грамположительных бактерий. После применения антибиотиков снижается биомасса микробных сообществ всех испытанных бактерий, а их восстановление имеет индивидуальный характер, который зависит от природы препарата и микроба.
Выводы.
- Поверхностная оболочка и внеклеточный матрикс биопленок грамположительных и грамотрицательных бактерий изученных штаммов содержат большое количество липидов, аналогичных таковым у мембран микроорганизмов сообщества, причем среди фосфолипидов в минимальном количестве обнаружены нестабильные фракции и максимально представлен стабильный кардиолипин.
- Внеклеточный матрикс бактериальных биопленок неродственных микроорганизмов на всех исследованных сроках роста содержит фрагменты ДНК, несущие хромосомные гены, с молекулярной массой, равной приблизительно 30 кДА, которые играют важную роль в поддержании жизнедеятельности сообществ.
- Действие ДНКазы на этапе формирования и на уже сформированные микробные сообществ, ведет к нарушению их образования, уменьшению биомассы и снижению числа колониеобразующих единиц.
- Разрушение внеклеточной ДНК в присутствии ДНКазы в биопленках различных грамположительных и грамотрицательных бактерий ведет к нарушению передачи генетической информации между клетками, снижению числа образующихся рекомбинантов и мутантов антибиотикоустойчивости, а также уменьшению их выживаемости в сообществах.
- Антибиотики, проникающие в биопленки, снижают биомассу сообщества преимущественно за счет уменьшения количества внеклеточного матрикса и, в меньшей степени, за счет числа жизнеспособных бактерий, дающих рост на плотной среде.
- Матрикс микробных сообществ представляет собой новую мишень для действия лечебных препаратов, при этом применение ДНКазы увеличивает эффективность действия неродственных антибиотиков на бактерии в биопленках разного возраста.
Практические рекомендации
- Выбор антибиотикотерапии с учетом способности препарата проникать в биопленки при условии необходимости преодоления липидного барьера.
- Включение ДНКазы в сочетании с антибиотиками в схему лечения гнойно-воспалительных процессов для повышения эффективности терапии и профилактики возникновения и распространения антибиотикоустойчивости.
Список работ, опубликованных по теме диссертации
- Тец Г.В. Внеклеточная ДНК колониеподобных сообществ / Г.В. Тец // Ученые Записки Санкт-Петербургского государственного медицинского университета им. акад. И.П.Павлова.- 2003.-Т. Х, № 4.-С. 38-40.
- Тец Г.В. Влияние условий культивирования на содержание ДНК бактерий и проницаемость их мембран / В.В. Тец, С.Д. Иванов, Г.В. Тец, М.М. Писарева, В.А. Ямшанов // Вестник РАМН.- 2005.-№ 7.-C.15-18.
- Тец Г.В. Применение фермента дезоксирибонуклеаза у больных с абсцессами и флегмонами челюстно-лицевой области / М.М. Соловьев, В.В. Тец, А.П. Бобров, К.Л. Артеменко, И.Р. Мошкевич, Г.В. Тец // Стоматология.-2006. - Т.85, №6.- С.40-46.
- Тец Г.В. Совместное действие антибиотиков и дезоксирибонуклеазы на бактерии / Г.В. Тец, К.Л. Артеменко // Антибиотики и химиотерапия. – 2006.- Т.51, №6.-С.3-6.
- Тец Г.В. Совместное действие антибиотиков и дезоксирибонуклеазы. / Г.В. Тец, К.Л. Артеменко // Дезоксирибонуклеаза в терапии бактериальных и вирусных гепатитов / Под ред. Тец В.В., Генкин Д.Д. – СПб., 2006. - С.7-14.
- Tetz G.V. Extracellular phospholipids of isolated bacterial communities / V.V. Tetz, P. Korobov, N.K. Artemenko, L.M. Lemkina, N.V. Panjkova, G.V. Tetz // Biofilms.- 2004.- № 1.-P.149-155.
- Способ лечения заболеваний, сопровождающихся изменениями качественного и/или количественного состава внеклеточной ДНК крови / В.В. Тец, Г.В. Тец, Д.Д. Генкин // Патент РФ № 2267329 от 10 января 2006.
- Способ лечения генерализованных инфекций, вызываемых бактериями, или заболеваний, вызываемых грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, обусловленных мутациями генов соматических клеток / В.В. Тец, Г.В. Тец, Д.Д. Генкин // Патент РФ № 2269358 от 10 февраля 2006.
- Способ профилактики развития онкологических заболеваний, или инфекций, вызываемых бактериями, грибами и простейшими, или атеросклероза, или сахарного диабета, или заболеваний, связанных с реакцией гиперчувствительности замедленного типа, или заболеваний, развивающихся вследствие мутации генов соматических клеток / В.В. Тец, Г.В. Тец, Д.Д. Генкин // Патент РФ № 2269359 от 10 февраля 2006.

