Микробные биопленки при смешанных инфекциях
На правах рукописи
МОШКЕВИЧ
Ирина Рувимовна
МИКРОБНЫЕ БИОПЛЕНКИ ПРИ СМЕШАННЫХ ИНФЕКЦИЯХ
03.00.07 – микробиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2007
Работа выполнена на кафедре микробиологии, вирусологии и иммунологии ГОУ ВПО «Санкт - Петербургский государственный медицинский университет имени академика И.П. Павлова Федерального агентства по здравоохранению и социальному развитию».
Научный руководитель: доктор медицинских наук, профессор
Тец Виктор Вениаминович
Официальные оппоненты: доктор медицинских наук, профессор
Афиногенов Геннадий Евгеньевич
доктор медицинских наук, профеccор
Кветная Ася Степановна
Ведущее учреждение: ГОУДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится 6 ноября 2007 г. в « » часов на заседании диссертационного Совета Д 208.086.03. при ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский пр., д.47).
С диссертацией можно ознакомиться в библиотеке ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан « » октября 2007 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Бойцов А.Г
Актуальность. В последнее время наблюдается все более широкое распространение смешанных инфекций. Наиболее часто возбудители выделяются в виде устойчивых ассоциаций при интраабдоминальных инфекциях (Меньшиков Д.Д., Янискер Г.Я., 1990), инфекциях мягких тканей, абсцессах и флегмонах (Georgalas C. et al., 2002; Sakae F.A. et al., 2006), инфицировании ожоговых ран (Федоровская Е.А. и др., 1984; Алексеев А.А. и др., 1998). В этиологической структуре пневмонии на долю смешанных инфекций приходится от 2 до 48% случаев заболевания (Kauppinen M.T. et al., 1995; Bartlett J.G. et al., 1998; Вишнякова Л.А., Жоголев С.Д., Мошкевич И.Р., 2001; Lim W.S. et al., 2001). Для смешанных инфекций по сравнению с заболеваниями, вызванными одним микробом, характерно более тяжелое клиническое течение, которое трудно поддается лечению и часто сопровождается различными осложнениями. С одной стороны, это связано с тем, что смешанные инфекции возникают на фоне снижения иммунитета, причиной которого являются длительное применение антибиотиков, тяжелые травмы, хирургические вмешательства и т.д. С другой стороны, причиной неудач в лечении может быть широкое распространение резистентных штаммов и, что особенно важно, неспособность антибактериальных препаратов проникать в биопленки и оказывать непосредственное воздействие на формирующие их бактерии.
За прошедшее десятилетие была доказана роль биопленок в развитии целого ряда инфекций человека. По данным Центра по контролю заболеваемости (США) до 65% заболеваний человека может быть связанно с формированием биопленок (Potera C., 1999). Наиболее важной отличительной особенностью бактерий, находящихся в составе сообществ, является повышенная в 50-500 раз резистентность к антибактериальным препаратам (Adam B.,G. et al., 2002; Rice S.A. et al., 2005). Стандартная терапия способна справиться только с отдельно существующими планктонными клетками, в то время как бактерии внутри биопленки способны размножаться и вновь диссеминировать после завершения курса лечения, приводя к формированию хронических процессов и рецидивов заболевания.
Повышение эффективности терапии болезней микробной этиологии является чрезвычайно актуальной задачей. Современная стратегия и тактика терапии таких болезней в большинстве случаев предусматривает комплексное лечение больных. Вместе с тем, препараты, усиливающие действие антибиотиков на биопленки, образованные при моно- и смешанных инфекциях, практически отсутствуют. В большинстве работ, посвященных изучению толерантности биопленок, представлены данные о формировании сообществ одним видом микроорганизмов. Остаются недостаточно изученными свойства смешанных биопленок, сформированных неродственными бактериями. Данных о действии эндо- и экзогенных ферментов, а также о совместном влиянии ферментов и антимикробных препаратов на биопленки в доступной литературе обнаружить не удалось.
Цель исследования - оценить способность микроорганизмов, выделенных при смешанных инфекциях, образовывать общие биопленки и изучить чувствительность бактерий, входящих в состав сообществ, к действию антибиотиков и ферментных препаратов.
Задачи исследования
- Определить роль смешанных инфекций в этиологии гнойно-воспалительных процессов челюстно-лицевой области и неспецифических заболеваний легких.
- Оценить возможность получения смешанных биопленок, образованных бактериями, изолированными из материала больных с микст-инфекциями.
- Оценить действие антибактериальных препаратов на смешанные биопленки, образованные различными видами микроорганизмов in vitro.
- Изучить действие протеолитических ферментов и ДНКазы на биопленки бактерий.
- Оценить характер сочетанного действия антибиотиков и ферментов на смешанные биопленки.
Научная новизна
Установлено, что штаммы неродственных бактерий, выделенные из материала больных с одонтогенными абсцессами и флегмонами челюстно-лицевой области и неспецифическими заболеваниями легких смешанной этиологии, способны формировать общие биопленки.
Биопленки, образованные несколькими видами бактерий, обладают общими и индивидуальными свойствами по отношению к сообществам, сформированным одним видом микроорганизмов.
Бактерии в составе смешанных биопленок более защищены от действия антибактериальных препаратов, чем в сообществах, образованных каждым микроорганизмом в отдельности.
ДНКаза угнетает формирование биопленки и потенцирует действие антибиотиков на бактерии в составе смешанных биопленок.
Использование ДНКазы совместно с антибиотиками в комплексном лечении больных с абсцессами и флегмонами челюстно-лицевой области ускоряет снижение микробной обсемененности гнойной раны.
Практическая ценность работы
Разработаны и внедрены в клиническую практику новые эффективные схемы антимикробной терапии у больных с абсцессами и флегмонами челюстно-лицевой локализации, учитывающие свойства смешанных биопленок. На основании полученных данных доказана обоснованность сочетанного назначения ферментов и антибиотиков при лечении больных гнойно-воспалительными заболеваниями челюстно-лицевой области.
Основные положения диссертации, выносимые на защиту
- Штаммы бактерий, выделенные от больных с гнойно-воспалительными процессами челюстно-лицевой области и неспецифическими заболеваниями легких смешанной этиологии, формируют in vitro сложные микробные биопленки, отличающиеся повышенной устойчивостью к антибактериальным препаратам.
- Ферментные препараты задерживают формирование смешанных микробных биопленок, образованных неродственными аэробными и анаэробными бактериями, и способствуют снижению биомассы сообществ.
- Применение ДНК-азы в сочетании с антибиотиками в комплексном лечении смешанных инфекций у больных с одонтогенными абсцессами и флегмонами челюстно-лицевой локализации позволяет ускорить очищение гнойной раны и, следовательно, сократить общую продолжительность терапии, уменьшить сроки пребывания больных в стационаре и снизить частоту рецидивов заболевания.
Внедрение в практику
Результаты диссертационного исследования внедрены в диагностическую работу бактериальной лаборатории и в практическую деятельность клиники челюстно-лицевой хирургии СПбГМУ им. акад. И.П. Павлова, использованы в лекциях и семинарах для студентов и врачей СПбГМУ им. акад. И.П. Павлова.
Апробация результатов исследования
Основные положения диссертации доложены на X и XI национальных конгрессах по болезням органов дыхания (Санкт-Петербург, 2000; Москва, 2001), на XI и XIII конгрессах Европейского респираторного общества (Берлин, 2001; Вена, 2003), международной конференции челюстно-лицевых хирургов и стоматологов (СПб, 2004). Диссертация апробирована на заседании кафедры микробиологии, вирусологии и иммунологии СПбГМУ им. акад. И.П. Павлова и на проблемной комиссии «Микробиология и иммунология» СПбГМУ им. акад. И.П. Павлова (2007).
Личный вклад автора
Личное участие автора осуществлялось на всех этапах работы. Автор выполнил микробиологические исследования клинического материала пациентов, включенных в исследование и экспериментальной части работы, провел статистическую обработку и анализ полученных данных.
Публикации
По теме диссертации опубликовано 11 научных работ, в том числе 2 статьи в ведущих изданиях, рекомендованных ВАК РФ.
Объем и структура диссертации
Работа изложена на 127 страницах машинописного текста, состоит из введения, обзора литературы, 3 глав, заключения, выводов, практических рекомендаций и списка литературы, включающего работы отечественных и зарубежных авторов. Диссертация иллюстрирована 29 рисунками и 28 таблицами.
Материалы и методы исследования
Обследовано 128 больных с флегмонами и абсцессами челюстно-лицевой области, находившихся на лечении в клинике хирургической стоматологии и челюстно-лицевой хирургии Санкт-Петербургского государственного медицинского университета им. акад. И.П.Павлова в 2003-2005 гг. Сбор материала (раневое отделяемое) осуществляли стерильными тупферами (Sarstedt, Германия), которые помещали в транспортную среду Эймса и в течение 24 часов доставляли в лабораторию. Материалом для исследования у 102 больных с неспецифическими заболеваниями легких, госпитализированных в клиники СПбГМУ им. акад. И.П.Павлова в 1997-2000 гг. служила утренняя порция мокроты.
Микроорганизмы. Стандартные штаммы бактерий из международных коллекций: Staphylococcus aureus АТСС 29213, Escherichia coli АТСС 25922, Streptococcus pneumoniae АТСС 49619 и штаммы из коллекции кафедры микробиологии СПбГМУ им.акад. И.П.Павлова - Streptococcus pneumoniae ОК-104, ХИ-241 и Haemophilus influenzae ОК-104, ХИ-241, изолированные из мокроты больных с внебольничной пневмонией и хронической обструктивной болезнью легких, Acinetobacter baumanii VT – 54, Staphylococcus aureus VT-38, Staphylococcus epidermidis VT-43, Fusobacterium nucleatum БА-67, ИА-61 и Prevotella intermedia БА-67, ИА-61, выделенные от больных с абсцессами и флегмонами челюстно-лицевой локализации.
Питательные среды. Мясопептонный бульон (МПБ), мясопептонный агар (МПА), минимальная синтетическая среда М9, бульон Мюллер-Хинтон (bioMerieux, Франция), агар Мюллер-Хинтон (bioMerieux, Франция), Шедлер бульон (bioMerieux, Франция), Шедлер агар (bioMerieux, Франция) и трипказосоевый агар (bioMerieux, Франция). Для транспортировки материала от больных использовали транспортную среду Эймса (Sarstedt, Германия).
Антибиотики. В работе использованы различные природные и синтетические антибиотики: азитромицин (Отечественные Лекарства, Россия), ампициллин (Hemofarm DD, Югославия), гентамицин (Lederle, США), клиндамицин (Отечественные Лекарства, Россия), левофлоксацин (Отечественные Лекарства, Россия), линкомицин (ICN, США), метронидазол (Отечественные Лекарства, Россия), цефотаксим (Lek DD, Словения), ципрофлоксацин (Bayer, Германия).
Ферментные препараты. Дезоксирибонуклеаза–ДНКаза (ООО «Самсон», Россия), папаин (Loba Chemie).
Культивирование микроорганизмов. Аэробные и факультативно-анаэробные бактерии, за исключением S.pneumoniae и H.influenzae, выращивали на трипказосоевом агаре с добавлением 5% дефибринированной крови человека. Для культивирования S.pneumoniae использовали трипказосоевый агар с добавлением 10% лошадиной сыворотки и 5% дефибринированной крови человека, H.influenzae – шоколадный агар на основе 10% кровяного МПА c добавлением ростовых факторов PolyVitex (bioMerieux, Франция). Посевы инкубировали в течение 18-24 часов при температуре 35°С в атмосфере с повышенным содержанием СО2. Анаэробные микроорганизмы культивировали на 5% кровяном Шедлер агаре с инкубацией в течение 48 часов при температуре 35°С в газогенераторных пакетах GENbag anaer (bioMerieux, Франция). Количественное микробиологическое исследование раневого отделяемого выполняли методом секторных посевов. Для количественного микробиологического исследования мокроты из исследуемого материала готовили серию десятикратных разведений в изотоническом растворе хлорида натрия, высевали на чашки Петри с питательным агаром и по истечению срока инкубации подсчитывали число выросших колоний.
Идентификация выделенных микроорганизмов. Идентификацию выделенных культур осуществляли общепринятыми методами, с учетом морфологических, культуральных и биохимических свойств (Bergey, 1994). Для ориентировочной идентификации анаэробных бактерий использовали диагностические диски с антибиотиками, красками и желчью. Биохимическую идентификацию проводили с помощью тест-системы АНАЭРОтест (Lachema, Чехия).
Определение минимальной подавляющей концентрации антибиотиков. Минимальную подавляющую концентрацию (МПК) антибиотиков определяли на жидкой и плотной питательной средах, используя метод серийных разведений.
Получение биопленок в пластиковых планшетах. Для получения биопленок использовали пластиковые 96-ти луночные планшеты (Sarstedt, Германия). В лунки вносили по 0,1 мл бульонной культуры бактерий, разведенной до конечной концентрации 5х107 КОЕ/мл, выращивали в течении 24-48 часов при температуре 35°С в соответствии с условиями культивирования, а затем добавляли ферменты и/или антибиотики, и инкубировали в течение последующих 24 часов. Для получения смешанных микробных биопленок готовили смесь из равных количеств обоих штаммов. Для оценки состояния биопленок удаляли содержимое лунок, трехкратно промывали фосфатным буфером, высушивали, окрашивали раствором генциан-виолета (50 мкл/лунку) в течение 10 минут, промывали фосфатным буфером, затем добавляли 96о этиловый спирт (200 мкл/лунку) и учитывали результаты на ридере (Stat-Fax-2100) при длине волны 570 нм.
Статистические методы. Статистическую обработку полученных результатов проводили с помощью оценки среднего арифметического (М), средней ошибки среднего значения (m), t – критерия Стьюдента, U-критерия Уилкоксона-Манна-Уитни. Во всех таблицах суммированы данные трех и более независимых экспериментов. Для статистической обработки полученных результатов использовали лицензированную программу для анализа данных биомедицинских исследований Primer for Biostatistics, Version 4.03 by Stanton A. Glantz 2000 г.
Результаты
На основании данных микробиологического исследования у больных пульмонологического профиля смешанная микробная флора в диагностическом титре была выявлена у 27 пациентов (33%), наиболее часто у больных с хронической обструктивной болезнью легких в стадии обострения (до 50%) (рис.1). Основными ассоциантами были выявлены S.pneumoniae и H.influenzae. Среди больных с одонтогенными абсцессами и флегмонами челюстно-лицевой области в 54 и 78% случаев, соответственно, из раневого отделяемого были изолированы 2 и более микроорганизмов. С наибольшей частотой в материале высевались анаэробные микроорганизмы (Prevotella spp., Fusobacterium spp., Peptostreptococcus spp., Porphyromonas spp.) и Streptococcus группы viridans.
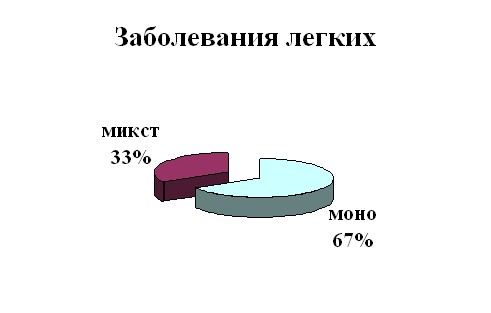 |  |
Рис. 1. Частота выявления смешанной микробной флоры в материале больных с заболеваниями легких и гнойно-воспалительными процессами челюстно-лицевой области (ЧЛО).
Для проведения экспериментальной части работы были выбраны пары микроорганизмов S.pneumoniae ОК-104, ХИ-241 и H.influenzae ОК-104, ХИ-241, выделенные от больных с внебольничной пневмонией и с хронической обструктивной болезнью легких и Fusobacterium nucleatum БА-67, ИА-61 и Prevotella intermedia БА-67, ИА-61, изолированные от больных с гнойно-воспалительными процессами челюстно-лицевой области. Все использованные штаммы обладали культуральными и тинкториальными свойствами, характерными для данного вида микроорганизмов. Клинические штаммы были характеризованы по способности образовывать смешанные биопленки в различных лабораторных условиях.
Биомасса микробных биопленок, полученных в 96-луночных планшетах, была изучена на протяжении 48-72 часов культивирования (рис.2,3). Жизнеспособность бактерий в биопленках определяли, подсчитывая число КОЕ/мл биомассы сообществ.
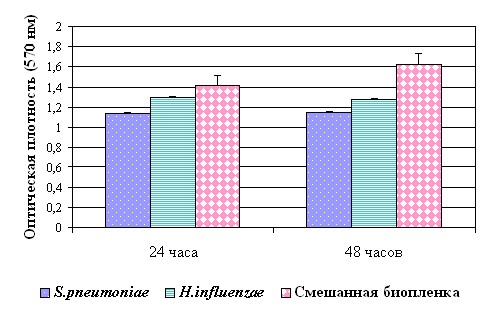
Рис. 2. Оптическая плотность биопленок, образованных H.influenzae ОК-104 и S.pneumoniae ОК-104 через 24-48 инкубации.
Исследуемые штаммы через 24-48 часов инкубации формировали моно- и смешанные биопленки. Максимальная величина биомассы моно-сообществ исследуемых штаммов была зарегистрирована через 24 часа для H.influenzae, S.pneumoniae и 48 часов для F.nucleatum и P.intermedia.
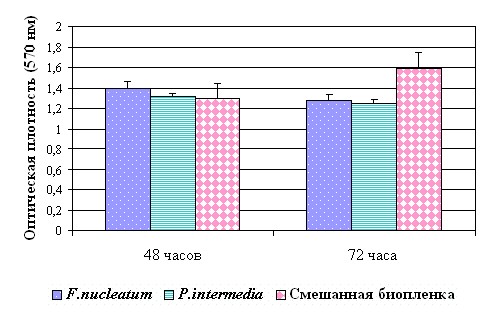
Рис. 3. Оптическая плотность биопленок, образованных F.nucleatum БА-67 и P.intermedia БА-67 через 48-72 часа инкубации.
В то же время оптическая плотность смешанных микробных сообществ увеличивалась на протяжении всего времени культивирования. Величина оптической плотности смешанных микробных сообществ по окончании времени инкубации (48 часов для H.influenzae, S.pneumoniae и 72 часа для F. nucleatum и P.intermedia) была достоверно выше, чем таковая у биопленок, образованных каждым ассоциантом в отдельности (р<0,05).
Действие ферментов на биопленки. Данные, полученные на контрольных штаммах S.aureus АТСС 29213 и E.coli АТСС 25922, свидетельствуют, что использованные ферменты (папаин и ДНКаза) не являются токсичными, влияют на формирование биопленки, а также действуют на уже сформированные микробные сообщества. Действие ДНКазы на смешанные биопленки, образованные H.influenzae-S.pneumoniae и F.nucleatum- P.intermedia, приводит к тем же изменениям, которые регистрируются в биопленках, образованных одним видом микроорганизма. При добавлении фермента одновременно с инокулятом наблюдается угнетение образования биомассы формирующихся биопленок в среднем на 25-35% (рис.4).
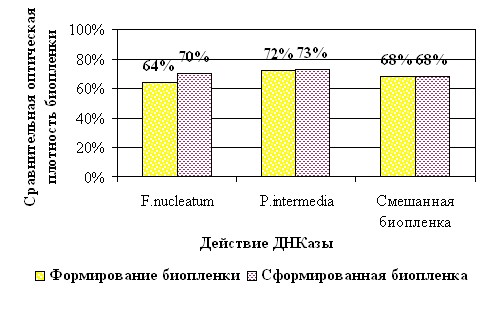
Рис. 4. Действие ДНКазы на биопленки, образованные F.nucleatum БА-67 и P.intermedia БА-67
Таблица 1
Выживаемость F.nucleatum БА-67 и P.intermedia БА-67 в составе моно- и смешанных 48 часовых биопленок в присутствии ДНКазы
| Вид биопленки | Вид бактерий | Число КОЕ/мл | |
| Контроль | ДНКаза* | ||
| Моно-биопленка | F.nucleatum | (7,7±0,1)х107 | (7,0±0,3)х107 |
| Моно-биопленка | P.intermedia | (9,6±0,5)х107 | (9,2±0,2)х107 |
| Смешанная биопленка | F.nucleatum | (1,8±0,6)х108 | (1,0±0,3)х108 |
| P.intermedia | (8,0±0,3)х107 | (6,9±0,3)х107 | |
*- ДНКазу добавляли одновременно с инокулятом
Численность жизнеспособных клеток в биопленках, сформированных H.influenzae-S.pneumoniae не изменялась и незначительно снижалась в сообществах, образованных F.nucleatum- P.intermedia (табл.1). Такой же характер изменений наблюдался при действии фермента на сформированные смешанные 24 часовые H.influenzae-S.pneumoniae и 48 часовые F.nucleatum- P.intermedia биопленки (рис.4., табл.2).
Таблица 2
Выживаемость F.nucleatum БА-67 и P.intermedia БА-67 в составе моно- и смешанных 72 часовых биопленок в присутствии ДНКазы
| Вид биопленки | Вид бактерий | Число КОЕ/мл | |
| Контроль | ДНКаза* | ||
| Моно-биопленка | F.nucleatum | (9,2±0,1)х107 | (9,0±0,4)х107 |
| Моно-биопленка | P.intermedia | (1,1±0,2)х108 | (9,8±0,2)х107 |
| Смешанная биопленка | F.nucleatum | (2,8±0,1)х108 | (1,0±0,3)х108 |
| P.intermedia | (1,0±0,3)х108 | (9,9±0,1)х107 | |
*- ДНКазу добавляли через 48 часов от начала формирования биопленки
Совместное действие ДНКазы и антибиотиков.
H.influenzae - S.pneumoniae. Ампициллин, добавленный в концентрации 50 мкг/мл (50 МПК для H.influenzae) не приводил к значительным изменениям оптической плотности моно-H.influenzae и смешанной 24 часовых биопленок (рис.5). Данная концентрация ампициллина (333 МПК для S.pneumoniae) резко угнетала формирование биомассы S.pneumoniae биопленки (52%). При сочетанном действии ампициллина и ДНКазы регистрировалось снижение оптической плотности H.influenzae и смешанной 24 часовых биопленок на 50%, S.pneumoniae биопленки – на 75%.Ампициллин в концентрации равной 50 МПК приводил к падению числа КОЕ в биопленке, образованной S.pneumoniae, и не влиял на число жизнеспособных клеток H.influenzae как в моно-, так и в смешанном микробном сообществе (табл.3). Величина КОЕ S.pneumoniae в смешанной биопленке под действием антибиотика снижалась, при этом выживаемость клеток S.pneumoniae была достоверно выше в смешанной биопленке, чем в моно-сообществе (р<0,05). Добавление ампициллина к 24 часовой биопленке совместно с ДНКазой приводило к значительному снижению КОЕ во всех видах биопленок.
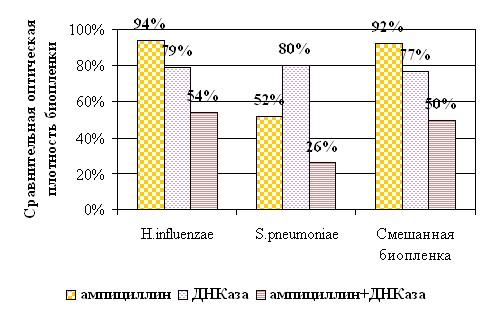
Рис. 5. Совместное действие ДНКазы и ампициллина на моно- и смешанную 24 часовые биопленки, сформированные H.influenzae ОК-104 и S.pneumoniae ОК-104
Потенцирующий эффект ДНКазы при сочетанном действие был отмечен и с другими антибактериальными препаратами. Азитромицин в концентрации 200 мкг/мл (50 МПК для H.influenzae) не влиял на число жизнеспособных клеток во всех видах биопленок. Совместное применение азитромицина в комплексе с ДНКазой приводило к статистически достоверному снижению числа КОЕ в моно- и смешанной биопленках (р<0,05). Левофлоксацин в концентрации 100 мкг/мл (50 МПК) оказывал выраженный антибактериальный эффект на бактерии в моно- и смешанных сообществах. Добавление ДНКазы взаимно потенцировало действие антибиотика и фермента.
Таблица 3
Выживаемость H.influenzae ОК-104 и S.pneumoniae ОК-104 в составе моно- и смешанных биопленок в присутствии ДНКазы и ампициллина
| Вид биопленки | Вид бактерий | Число КОЕ/мл | ||
| Интактный контроль | Ампициллин | Ампициллин +ДНКаза | ||
| Моно-биопленка | H.influenzae | (5,9±0,1)х108 | (5,7±0,1)х108 | (6,8±0,2)х107 |
| Моно-биопленка | S.pneumoniae | (9,5±0,3)х107 | (9,4±0,4)х104 | (7,5±0,3)х103 |
| Смешанная биопленка | H.influenzae | (4,1±0,2)х108 | (4,3±0,5)х108 | (7,5±0,2)х107 |
| S.pneumoniae | (1,2±0,5)х108 | (2,0±0,3)х105 | (3,0±0,5)х104 | |
Уменьшение числа КОЕ H.influenzae и S.pneumoniae было более выражено в биопленках, образованных одним видом микроорганизмов. Бактерии в сформированных смешанных сообществах оказались более устойчивыми к воздействию антибиотика, особенно при использовании ДНКазы и левофлоксацина.
F.nucleatum-P.intermedia. Антибиотики ампициллин, метронидазол и клиндамицин, в концентрациях, равных 50 МПК, у обоих штаммов приводили к незначительному (в среднем 10%) снижению оптической плотности моно- и смешанных сообществ, при неизменных значениях КОЕ (рис.6). Добавление ДНКазы с используемыми антибактериальными препаратами угнетало образование биомассы биопленки. Аналогичный взаимно потенцирующий эффект на выживаемость F.nucleatum и P.intermedia наблюдался при сочетанном применении ДНКазы и антибиотика по отношению к смешанным микробным сообществам. Количество жизнеспособных клеток F.nucleatum и P.intermedia в биопленках снижалось в результате совместного действия антибиотика и фермента. Следует отметить, что число КОЕ каждого микрорганизма в смешанной биопленке было выше, чем КОЕ в сообществе, образованном каждым штаммом в отдельности. Лучший антибактериальный эффект при сочетанном воздействии с ДНКазой был отмечен у ампициллина и метронидазола.
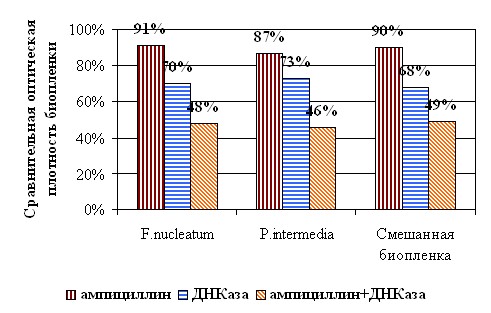
Рис. 6. Совместное действие ДНКазы и ампициллина на моно- и смешанные 48 часовые биопленки, сформированные F.nucleatum БА-67 и P.intermedia БА-67
Количественное микробиологическое исследование материала от больных с гнойно-воспалительными заболеваниями челюстно-лицевой области. Для оценки эффективности включения ДНКазы в комплексную антибактериальную терапию больных с одонтогенными процессами челюстно-лицевой области было выполнено количественное микробиологическое исследование раневого отделяемого в динамике (на 1 и 5-е сутки поступления больного в стационар). Под действием лечения, в ходе которого применялась ДНКаза в сочетании с антибиотиками (основная группа больных), у 84% больных с флегмонами, против 37% в контрольной группе отмечено улучшение микробиологических показателей. Частота выделения в этой группе основных ассоциантов (Streptococcus viridans, Prevotella spp., Fusobacterium spp.) во втором исследовании значительно снизилась (в 3-7 раз), а доминирующие при первичном посеве Peptostreptococcus spp., Porphyromonas spp., Staphylococcus aureus на 5-ые сутки вообще не высевались. У больных с абсцессами, в антибактериальном лечении которых применялась ДНКаза, также наблюдалась положительная микробиологическая динамика. Отсутствие признаков микробного роста или снижение концентрации микроорганизмов в раневом отделяемом при повторном обследовании было отмечено у 76% больных основной группы, получавших ДНК-азу, против 33% в контрольной группе. На фоне лечения у больных основной группы частота выделения Prevotella spp., Fusobacterium spp. снизилась в 2 раза, Peptostreptococcus spp., Porphyromonas spp. не выделялись.
Таким образом, можно отметить, что лучший антибактериальный эффект по данным микробиологического исследования (отсутствие признаков роста, снижение концентрации и частоты выделения высеваемых микроорганизмов) отмечен у больных, при лечении которых применялась ДНКаза в сочетании с антибиотиками.
Заключение
На основании проведенных исследований установлено, что из материала больных с гнойно-воспалительными заболеваниями различной локализации в более чем 30% случаев высевается смешанная микробная флора, что позволяет судить о распространенности смешанной инфекции в данной патологии. При флегмонах в 78% случаев и в 54 % при абсцессах челюстно-лицевой локализации в раневом отделяемом и в 33% из мокроты у больных пульмонологического профиля высевались ассоциации микроорганизмов в диагностических титрах. Чаще всего при смешанных инфекциях челюстно-лицевой области в патологическом материале больных встречались зеленящие стрептококки и грамотрицательные анаэробные палочки, при патологии органов дыхания - S.pneumoniae и H.influenzae. Исходя из современных представлений о существовании бактерий в природе и в организме хозяина в виде микробных сообществ, была оценена возможность штаммов, выделенных от больных формировать биопленки in vitro. Установлена возможность получать и изучать in vitro смешанные микробные биопленки, образованные штаммами F.nucleatum и P.intermedia, полученными из материала больных с гнойно-воспалительными заболеваниями челюстно-лицевой области, а также S.pneumoniae и H.influenzae, изолированными из мокроты больных с патологией легких. Изучено действие антибактериальных препаратов, применяемых при лечении соответствующей патологии, на моно- и смешанные сообщества. Установлено, что антибиотики имеют схожий характер действия на биопленки, образованные одним или несколькими видами бактерий. Показано, что 5-50 МПК различных антибиотиков, независимо от их природы и механизма, практически не оказывают действия на сформированные микробные биопленки. Выживаемость бактерий в биопленках в присутствии антибиотиков возрастала по мере формирования сообщества. При оценке сочетанного действия на моно- и смешанные биопленки in vitro антибиотиков и ферментных препаратов установлена потенцирующая роль последних, в особенности ДНКазы. На основании данных лабораторных исследований ДНКаза была использована в клинической практике в комплексной антибактериальной терапии, что привело к статистически достоверному сокращению сроков очищения гнойной раны, снижению частоты осложнений и рецидивов заболевания у больных с гнойно-воспалительными процессами челюстно-лицевой области. Эти данные были подтверждены результатами повторного количественного микробиологического исследования раневого отделяемого больных, выполненных на фоне комплексного лечения, включающего антибактериальную и ферментную терапию.
Выводы
- По данным микробиологического исследования смешанная микробная флора высевалась в 66% проб материала от пациентов с одонтогенными воспалительнымти заболеваниями челюстно-лицевой области и в 33 % образцов материала от пульмонологических больных.
- Микроорганизмы, выделенные из материала больных с микст-инфекциями способны in vitro образовывать смешанные микробные сообщества, пригодные для изучения их биологических свойств и оценки действия на них антимикробных препаратов.
- Антибиотики лучше действуют на бактерии в биопленках, образованных одним видом микроорганизма и менее эффективны по отношению к бактериям, находящимся в составе смешанных сообществ.
- Протеолитические ферменты и ДНКаза усиливают действие антибактериальных препаратов на биопленки бактерий, выделенных от больных с микст-инфекциями.
- При включении ДНКазы в схему комплексной терапии улучшение микробиологических показателей в ходе лечения (отсутствие микробного роста или снижение микробной обсемененности патологического материала) отмечено у 76% пациентов с абсцессами и 84% больных с флегмонами, против 33 и 37% в группе контроля соответственно.
Практические рекомендации
- При назначении антибактериальной терапии одонтогенных воспалительных заболеваний челюстно-лицевой области необходимо учитывать высокий процент ассоциаций возможных возбудителей. При выборе антибактериального средства необходимо оценивать их активность как в отношении аэробных, так и анаэробных микроорганизмов, а также их способность проникать в биопленки.
- Включение ДНКазы в схему комплексной терапии можно считать целесообразным для оптимизации лечения одонтогенных воспалительных заболеваний челюстно-лицевой области.
- Универсальность действия ДНКазы позволяет рекомендовать этот фермент для лечения инфекционных процессов смешанной этиологии в сочетании с любым антибактериальным препаратом, независимо от природы и механизма действия.
Список работ, опубликованных по теме диссертации.
- Мошкевич И.Р. Чувствительность штаммов H.influenzae, выделенных от пульмонологических больных в С-Петербурге / М.Е. Фаустова, Ю.В. Резцова, Т.С. Сологуб, И.Р. Мошкевич, Л.А. Вишнякова // 8-й Национальный конгресс по болезням органов дыхания: Сборник резюме. –Москва, 1998. – С. 180.
- Мошкевич И.Р. Вспышка внебольничной пневмонии неясной этиологии у детей Санкт-Петербурга / М.А. Никитина, С.И. Петрова, Л.А. Вишнякова, И.Р. Мошкевич, С.П. Выдумкина, Т.Ф. Умеркулова // 10-й Национальный конгресс по болезням органов дыхания: Сборник резюме. – Санкт-Петербург, 2000. – С.215.
- Мошкевич И.Р. Пневмококковая и хламидийная инфекции в закрытом коллективе / Л.А. Вишнякова, С.Д. Жоголев, И.Р. Мошкевич // Журнал микробиологии, эпидемиологии и иммунобиологии. –2001. – № 4. – С.60-64.
- Мошкевич И.Р. Этиологические особенности острой внебольничной пневмонии у детей / А.В. Папаян, Л.А. Вишнякова, М.А. Никитина, С.И. Петрова, И.Р. Мошкевич, С.П. Выдумкина, Н.Б. Румель, Т.В. Смольянинова // 11–й Национальный конгресс по болезням органов дыхания. – Москва, 2001. – С.202.
- Мошкевич И.Р. Характеристика возбудителей абсцессов и флегмон челюстно-лицевой локализации / К.Л. Артеменко, В.В. Тец, И.Р. Мошкевич // Х Международная конференция челюстно-лицевых хирургов: Сборник тезисов и докладов. – Санкт-Петербург, 2004. – С.23.
- Мошкевич И.Р. Комплексная оценка эффективности применения препарата «Цифран СТ» при обострении воспаления в пародонте / Л.Ю. Орехова, О.В. Прохорова, М.В. Осипова, И.Р. Мошкевич // Пародонтология. –2006. – №2 (39). – С.61-63.
- Мошкевич И.Р. Применение фермента дезоксирибонуклеазы у больных с абсцессами и флегмонами челюстно-лицевой области / М.М. Соловьев, В.В. Тец, А.П. Бобров, К.Л. Артеменко, И.Р. Мошкевич, Г.В. Тец // Стоматология. – 2006. – Т. 85, №6. – С.40–46.
- Moshkevich I. Sensitivity of H.influenzae strains isolated from pulmonary patients inhabitans of S-Petersburg / M. Faustova, Y. Reztsova, T. Sologub, I. Moshkevich, L. Vishniakova // 8th ERS Ann.Cong.: Abst. – Geneva, 1998. – P. 95.
- Moshkevich I. Sensitivity of Streptococcus pneumoniae and Haemophilus influenzae strains isolated from respiratory patients / M. Faustova, Y. Reztsova, T. Sologub, I. Moshkevich, L. Vishniakova // 9th Eur.Cong. of Clin. Microb. and Infect. Dis. : Abst. – Berlin, 1999. – P.274.
- Moshkevich I.R. Clinical and etiological features of community-acquired pneumonia (CAP) in pediatric population in St.Petersburg / I.R. Moshkevich, M.A. Nikitina, L.A. Vishniakova, S.P. Vydumkina, A.V. Papayan // 11th ERS Ann. Cong.: Abst. – Berlin, 2001. –P.291.
- Moshkevich I.R. Bacterial culture results in patients with interstitial lung diseases / I.R. Moshkevich, Y.V. Rezstova, M.E. Faustova, L.N. Novikova // 13th ERS Ann. Cong.: Abst. – Vienna, 2003. – P.183.

