Характеристика бактерий рода klebsiella, выделенных при дисбиозах кишечника
На правах рукописи
ЕГОРОВА
Светлана Александровна
ХАРАКТЕРИСТИКА БАКТЕРИЙ РОДА Klebsiella,
ВЫДЕЛЕННЫХ ПРИ ДИСБИОЗАХ КИШЕЧНИКА
03.00.07- микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2007
Работа выполнена в Федеральном государственном учреждении науки Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Научный руководитель: доктор медицинских наук Кафтырева Лидия Алексеевна
Официальные оппоненты:
доктор медицинских наук,
профессор Кветная Ася Степановна
доктор медицинских наук,
профессор Сбойчаков Виктор Борисович
Ведущее учреждение: Федеральное государственное учреждение науки Центральный научно-исследовательский институт эпидемиологии Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Защита состоится 6 ноября 2007 года, в часов на заседании диссертационного Совета Д.208.086.03 при ГОУ ВПО «Санкт-Петербургская государственная медицинская академия им. И. И. Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский пр., 47).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Санкт-Петербургская государственная медицинская академия им. И. И. Мечникова Федерального агентства по здравоохранению и социальному развитию».
Автореферат разослан «___»______________2007 года.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор А.Г. Бойцов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Условно патогенные микроорганизмы вызывают заболевания различной локализации. Вопрос об их этиологической значимости при возникновении патологических состояний желудочно-кишечного тракта (дисбиотических нарушений, острых кишечных заболеваний) остается спорным. Согласно существующим нормативным документам, диагностика заболеваний ЖКТ, вызванных условно патогенными энтеробактериями, основывается на клинических и лабораторных данных, включающих идентификацию и количественную характеристику выделенных микроорганизмов (МР, 1983; МУ № 11-33/6-40 1987; МР, 1990; ОСТ 91500.11.004-2003). По данным некоторых авторов, у детей раннего возраста без клинических проявлений острого кишечного заболевания в значительном количестве выделяют различные УПЭ, при этом длительность их выделения может продолжаться несколько лет, несмотря на проведение этиотропного лечения и применение пробиотиков (В.М. Коршунов, 2001; Л.А. Леванова, 2002). Поскольку эти микроорганизмы являются представителями факультативной микрофлоры толстого кишечника (допустимое содержание 104-105 КОЕ/г), обоснование их этиологической значимости при патологических состояниях ЖКТ даже при массивности выделения, является сложной задачей и требует разработки дополнительных критериев (МР № 10-11/31, 1986; ОСТ 91500.11.004-2003).
Важным направлением исследований в этой области является выявление ведущих факторов патогенности УПЭ (в том числе Klebsiella как лидирующего представителя этой группы), оценка их влияния на развитие патологического процесса и выраженность клинических проявлений, а также на формирование дисбиоза толстого кишечника. Показано, что условно патогенные энтеробактерии, относящиеся к факультативной микрофлоре кишечника, обладают различными факторами патогенности (В.М. Бондаренко, 1996; А.Р. Мавзютов и соавт., 2007; Н.Ю. Жеребцова и соавт., 2007).
Данные о распространенности лекарственной устойчивости среди УПЭ позволяют дать оценку представителям факультативной микрофлоры как резервуару генов резистентности. Для эффективного преодоления резистентности и разработки рациональной этиотропной терапии дисбиотических состояний необходимо располагать информацией о биологических свойствах микроорганизмов, включая структуру и ведущие механизмы устойчивости.
Цель исследования
Изучить биологические свойства и чувствительность к антимикробным препаратам бактерий рода Klebsiella, выявить ведущие факторы патогенности и оценить их влияние на формирование дисбиоза толстого кишечника.
Задачи исследования
- Дать количественную и качественную характеристику бактериального микробиоценоза толстого кишечника детей и взрослых.
- Определить видовой состав выделенных условно патогенных энтеробактерий, оценить клиническое значение колонизации кишечника клебсиеллами.
- Выявить ведущие факторы патогенности штаммов клебсиелл, выделенных при дисбиозах кишечника.
- Провести сравнительное изучение чувствительности к антибактериальным препаратам условно патогенных и патогенных энтеробактерий.
- Определить генетические механизмы резистентности энтеробактерий к цефалоспоринам расширенного спектра. Дать оценку представителям факультативной микрофлоры как резервуару генов резистентности.
Личный вклад автора.
Личное участие автора осуществлялось на всех этапах работы. Автор участвовал в бактериологическом обследовании пациентов, изучении штаммов микробиологическими, экспериментальными и молекулярно-генетическими методами, провел обобщение, анализ и статистическую обработку результатов.
Научная новизна работы
Впервые проведена оценка этиологической значимости условно патогенных энтеробактерий рода Klebsiella при формировании дисбиотических состояний кишечника в зависимости от выявленных факторов патогенности.
Показано наличие факторов патогенности, обеспечивающих персистенцию микроорганизма в кишечнике (полисахаридной капсулы и маннозорезистентных пилей 3 типа) у штаммов Klebsiella, выделенных от лиц с дисбиотическими состояниями ЖКТ, проживающих в Санкт-Петербурге.
Впервые дана серологическая характеристика штаммов клебсиелл на основе определения К-антигена молекулярно-генетическими методами. Выявлены национальные особенности серотиповой принадлежности Klebsiella, циркулирующих в Северо-Западном регионе РФ, которые дополнили международную базу данных K-серотипов клебсиелл.
Установлено, что резистентность к цефалоспоринам расширенного спектра у патогенных и условно патогенных энтеробактерий обусловлена одним механизмом - продукцией -лактамаз расширенного спектра, а также выявлено безусловное превалирование среди штаммов Klebsiella -лактамаз CTX-M типа. В ходе исследования получены новые данные о распространенности БЛРС типа CTX-M3 и СМУ-2 среди сальмонелл.
Практическая значимость работы
На основе проведенных микробиологических исследований представлена количественная и качественная характеристика микрофлоры кишечника лиц с дисбиотическими состояниями, принадлежащих к различным возрастным группам, проживающих в Санкт-Петербурге. Результаты могут быть использованы при разработке критериев содержания облигатной и факультативной микрофлоры.
Данные, полученные при оценке факторов патогенности Klebsiella, наряду с количественной характеристикой позволяют судить об их этиологической роли в возникновении дисбиотических состояний кишечника.
Результаты изучения чувствительности к АМП условно патогенных и патогенных энтеробактерий могут быть использованы для разработки рациональной терапии инфекций, вызванных энтеробактериями.
Показана необходимость тестирования налидиксовой кислоты при определении чувствительности к АМП у энтеробактерий, так как данный препарат является индикатором резистентности к хинолонам.
Установлена низкая активность цефалоспоринов IV поколения и ингибиторзащищенных –лактамов в отношении энтеробактерий, продуцирующих БЛРС.
Основные положения, выносимые на защиту
- Klebsiella spp. является доминирующим микроорганизмом среди условно патогенных энтеробактерий, выделяемых при дисбиозах желудочно-кишечного тракта. Присутствие Klebsiella spp. в микрофлоре не влияет на клинические проявления дисбиоза кишечника.
- Штаммы Klebsiella spp., выделенные из испражнений лиц с дисбиотическими состояниями, обладают факторами патогенности, обеспечивающими персистенцию микроорганизма в кишечнике.
- Резистентность к цефалоспоринам расширенного спектра у патогенных и условно патогенных энтеробактерий обусловлена единым механизмом: продукцией -лактамаз расширенного спектра. CTX-M--лактамазы являются превалирующим типом -лактамаз расширенного спектра среди клинических штаммов Klebsiella.
Апробация работы
Материалы диссертации доложены и обсуждены на Юбилейной научной конференции молодых ученых Северо-Западного региона (Санкт-Петербург, 2004); Всероссийской научной конференции молодых ученых с международным участием «Актуальные вопросы инфекционной патологии-2005» (Санкт-Петербург, 2005); международном молодежном медицинском конгрессе «Санкт-Петербургские научные чтения» (Санкт-Петербург, 2005); заседании отделения Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов в Санкт-Петербурге и Ленинградской области (Санкт-Петербург, 2005); международном симпозиуме «Актуальные проблемы антибиотикорезистентности и антибактериальной терапии инфекционных заболеваний» (Санкт-Петербург, 2006); 7 международном научном конгрессе по инфекционным заболеваниям Балтийских стран (Рига, 2006); IX международном Конгрессе МАКМАХ/BSAC по антимикробной терапии (Москва, 2007).
По материалам диссертации опубликовано 19 научных работ, из них 3 в изданиях, рекомендованных ВАК.
Материалы диссертации вошли в методические рекомендации «Микробиологический мониторинг и эпидемиологический анализ антибиотикорезистентности микроорганизмов с использованием программы WHONET» (СПб., 2005), утвержденные Комитетом по здравоохранению Правительства Санкт-Петербурга; используются в работе клинико-диагностических лабораторий Санкт-Петербурга; внедрены в учебный процесс кафедры микробиологии ГОУВПО СПбГМА имени И.И.Мечникова.
Структура и объем диссертации
Диссертация изложена на 155 страницах машинописного текста и включает введение, обзор литературы, материалы и методы исследования, три главы собственных исследований, заключение, выводы, практические рекомендации и список использованной литературы. Список литературы включает 202 источника, в том числе 108 - отечественных авторов и 94 - зарубежных. Работа иллюстрирована 23 таблицами и 27 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Работа выполнена в течение 1998 - 2007 гг. в лаборатории кишечных инфекций ФГУН Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера Роспотребнадзора. Проанализированы результаты бактериологического исследования испражнений, собранных от 2341 лиц разного возраста с клиническими проявлениями дисбиоза кишечника, без признаков ОКИ. Определение количественного и качественного состава кишечной микрофлоры проводили в соответствии с Методическими рекомендациями № 10-11/31, 1986 и информационным письмом «Совершенствование методов диагностики дисбактериоза толстого кишечника» (СПб. гос. мед. акад. им. И. И. Мечникова, 2002). Изучены биологические свойства и чувствительность к АМП у 500 штаммов Klebsiella spp. (378 штаммов K. pneumoniae и 122 штамма K. oxytoca), из них 386 штаммов были выделены при бактериологическом исследовании испражнений; 114 штаммов – из мочи и раневого отделяемого. У 562 штаммов Salmonella, относящихся к 31 серовару, изучена чувствительность к АМП.
Культурально-ферментативные свойства изучали согласно МУ 04-723/3 МЗ СССР от 17.12.84 г. и Приказу № 535 от 22.04.85 г. У 14 штаммов K. pneumoniae провели внутривидовое типирование с использованием тестов Biotype-100 (BioMrieux), а также серологическую идентификацию на основе определения К-антигена методом PCR-RFLP с рестриктазой HincII (S.Brisse, P.A.D.Grimont, 2004). Полученные паттерны сравнивали с международной базой данных, используя пакет программ Taxotron® (P.Grimont, 2000; R.Coimbra, J.Machado, 2000).
Чувствительность к АМП определяли диско-диффузионным методом и методом серийных разведений в агаре согласно МУК 4.2.1890-04.
Для изучения факторов патогенности 67 штаммов Klebsiella использовали лабораторные модели, бактериологические и молекулярно-генетические методы. Капсулу выявляли при микроскопии мазков, окрашенных по Бури-Гинсу. Гемолизирующую активность оценивали по характеру роста на ГМФ-агаре с добавлением 5% эритроцитов барана. Факторы адгезии выявляли в реакции гемагглютинации в присутствии D-маннозы с эритроцитами морской свинки (D.G. Evans, 1977). Способность штаммов к инвазии устанавливали в пробе Шереня (Sereny, 1955). Продукцию термостабильного энтеротоксина определяли в интрагастральной пробе на мышах-сосунках (A.G. Dean et al., 1972), термолабильного – в тесте отека лапы белой мыши (Ю.Л. Вартанян и соавт, 1978). Продукцию шига-подобных токсинов изучали с применением иммунохроматографических экспресс-тестов Duopath®-Verotoxins, Merck (МР №24ФЦ/976, 2004).
Детекцию генов, кодирующих факторы патогенности «классических» возбудителей ОКИ, а именно: способность к адгезии (pap, aaf I, sfa, afa, eae), инвазии (ipa, ial), токсинообразованию (hly, cnf1,2, elt, LT-II-ген, ST- I, II –гены, slt I-II-гены), персистенции (aer) у 67 штаммов Klebsiella провели методом ПЦР со специфическими праймерами (I.Muhldorfer, 1994; Y.Tamaki, 2005). Тотальную ДНК выделяли с использованием набора реагентов InstaGene matrix (BioRad), плазмидную ДНК - методом щелочного лизиса (S.Takahashi, Y. Nagano, 1984).
Механизмы резистентности к цефалоспоринам расширенного спектра изучили у 14 штаммов K. pneumoniae. Наличие генов -лактамаз, относящихся к CTX-M, AmpC и ТЕМ типам, а также мобильного генетического элемента ISEcp1 определяли методом ПЦР со специфическими праймерами (C. Mabilat, 1993; J. Koeck et al, 1997; FX.Weill et al, 2004). Секвенирование амплифицированных фрагментов проводили в ABI 100 DNA sequencer (Applied Biosystems, Foster City, CA). Нуклеотидные последовательности анализировали с помощью программ EditSeq и Megalign (Dnastar, Madison, WI).
Рестрикционный профиль плазмид изучали методом RFLP с рестриктазой Pst1. Перенос плазмидной ДНК в реципиентный штамм E. coli DH10B проводили путём трансформации на аппарате MicroPulser™ (Bio-Rad).
Молекулярно-генетические исследования выполнены совместно с FX. Weill в лаборатории биоразнообразия патогенов Парижского института Пастера, возглавляемой Patrick A.D.Grimont (Institut Pasteur, Paris, France).
Статистическая обработка результатов проводилась общепринятыми методами медицинской статистики с использованием программы Microsoft Excel–2000. Данные оценивали, используя выборочные параметры: М – среднее, m – ошибка среднего, p – уровень значимости. Статистически значимыми считали различия при доверительном интервале 95% (р <0,05).
Результаты исследования и их обсуждение
Характеристика бактериального микробиоценоза толстого кишечника
Микроорганизмы-представители облигатной микрофлоры толстого кишечника были обнаружены в количествах, соответствующих нормативным показателям: бифидобактерии - у 68 ± 1,0 %, лактобактерии - у 21,6 ± 0,9 %, энтерококки – у 46,6 ± 1,0 % обследованных лиц. С возрастом наблюдалась общая тенденция к снижению доли лиц с нормальным содержанием облигатной микрофлоры. По суммарным данным только у 6,0 ± 0,2 % обследованных отсутствовали отклонения в количественном составе облигатной микрофлоры кишечника (по совокупности всех ее представителей). При анализе нормофлоры в различных возрастных группах установлено, что среди детей 7-14 лет и взрослых старше 60 лет не было лиц с нормальным содержанием всех представителей облигатной микрофлоры.
E. coli с типичными ферментативными характеристиками присутствовала у 77,1 ± 0,9 % обследованных. По нашим данным, среди атипичных разновидностей эшерихий гемолитические E. coli встречались достоверно чаще лактозонегативных (25,9 ± 0,9 % и 16,1 ± 0,8 %, соответственно). С возрастом наблюдалась тенденция к снижению частоты выделения атипичных E. coli, а доля лиц с нормальным содержанием полноценной E. coli увеличивалась.
В микрофлоре кишечника 49,0 ± 1,0 % обследованных лиц присутствовали условно патогенные энтеробактерии: Klebsiella spp., Citrobacter spp., Enterobacter spp, Proteus spp., Morganella morganii. Максимальные показатели колонизации обнаружены у детей до 1 года (67,4 ± 1,3%). У лиц старше двух лет частота выделения УПЭ снижалась более чем в 2 раза (рис. 1).
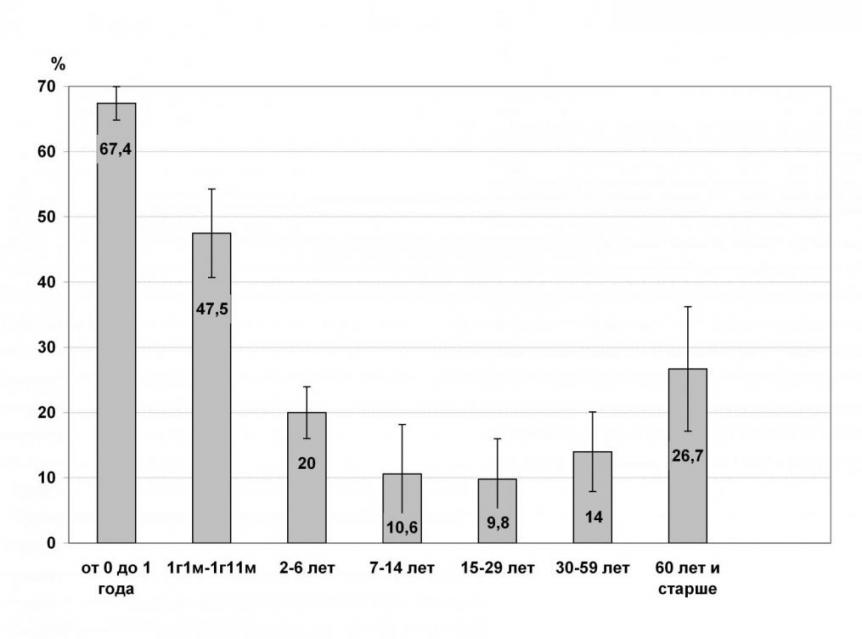
Рисунок 1. Частота выявления УПЭ при бактериологическом исследовании испражнений (n=2341).
Klebsiella spp. составляли 59,0 ± 1,4% от всех выделенных штаммов УПЭ (рис. 2), причем у детей до 2 лет доля этих микроорганизмов в 2-6 раз превышала доли других УПЭ. У 19,2 ± 0,8 % обследованных лиц они выделялись в ассоциации с S.aureus, причем чаще всего у детей до 1 года (30,2 ± 1,3 %).
При сравнении групп лиц, различающихся по наличию клебсиелл в микрофлоре кишечника, установлено, что присутствие клебсиелл не влияло на характер и частоту стула, наличие патологических примесей, болевой синдром. У детей второго года жизни оно достоверно чаще сопровождалось аллергическими проявлениями (61,7 ± 7,1 % и 42,6 ± 3,8 %, соответственно). В группе пациентов, у которых из испражнений были выделены клебсиеллы, достоверно чаще встречались лица, получавшие перед проведением исследования антимикробную терапию (18,9 ± 1,5 % и 10,1 ± 0,7 %, соответственно) и лица, в состав микрофлоры которых входил S.aureus (67,2 ± 1,8% и 45,9 ±1,2%, соответственно) (табл. 1).
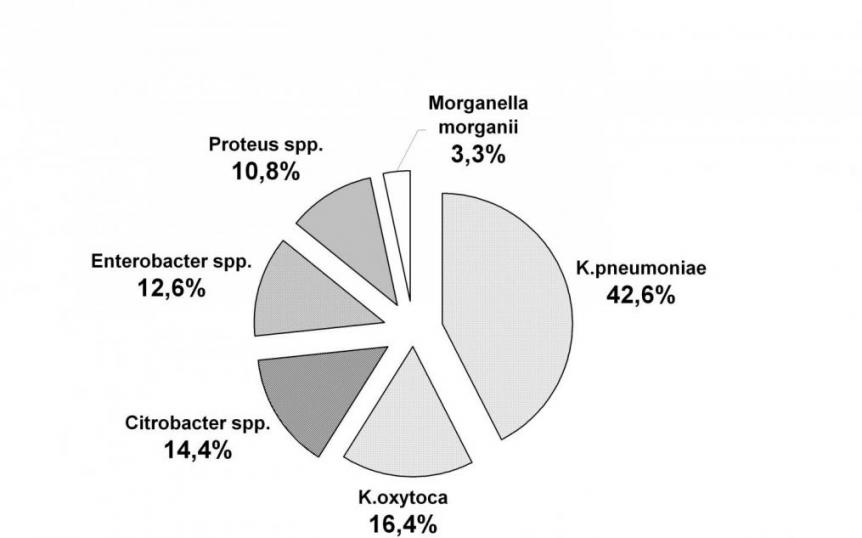
Рисунок 2. Условно патогенные энтеробактерии, выделенные при бактериологическом исследовании испражнений (n=1163).
Анализ полученных результатов показал, что качественные и количественные характеристики нормальной микрофлоры кишечника изменяются в различные периоды жизни. Нормы, представленные в рекомендациях по диагностике дисбактериоза, разнообразны и отчасти противоречивы. Мы придерживались критериев, приведенных в МР № 10-11/31, 1986 и Информационном письме СПбГМА им. И.И.Мечникова, 2002. Обращает на себя внимание тот факт, что только у 6 % обследованных лиц все показатели облигатной микрофлоры соответствовали нормам, приведенным в этих документах. Если облигатную микрофлору оценивать согласно ОСТ 91500.11.0004-2003, то в изученной группе населения отсутствуют лица с нормальным содержанием этих микроорганизмов.
На наш взгляд, при разработке норм содержания микрофлоры кишечника следует учитывать не только возрастные, но и региональные особенности климатогеографических и экологических условий проживания. Это находит подтверждение в работах многих авторов (Л.Э.Бахметова, 1997; В.М.Коршунов, 2001; Л.В.Крамарь, 2001; Л.А. Леванова, 2002). В этой связи, нормы, приведенные в МР № 10-11/31 (М., 1986) и информационном письме СПбГМА им. И.И.Мечникова (СПб., 2002) более объективно отражают количественное и качественное состояние кишечной микрофлоры жителей Санкт-Петербурга и Ленинградской области, чем нормы, регламентированные ОСТ 91500.11.0004-2003.
Таблица 1
Характеристика клинических симптомов и факультативной микрофлоры у пациентов различных возрастных групп
в зависимости от наличия Klebsiella в кишечнике
| Клинический симптом / признак | Возраст | ||||||||||||||||||
| Всего | 0 -1 г | 1г1мес-1г11мес | 2г-14 лет | Старше 14 лет | |||||||||||||||
| наличие Klebsiella | |||||||||||||||||||
| + (n=670) | - (n=1664) | + (n=576) | - (n=762) | + (n=47) | - (n=169) | + (n=29) | - (n=443) | + (n=18) | - (n=290) | ||||||||||
| Частота обнаружения симптома/признака, M±m% | |||||||||||||||||||
| Предшествующая антибактериальная терапия | 18,9±1,5* | 10,1±0,7* | 14,1±1,4 | 11,3±1,1 | 23,4±6,2* | 6,5±2,3* | 17,2±7,0 | 9,7±0,9 | 16,7±8,8 | 9,7±1,4 | |||||||||
| Аллергические проявления | 32,8±1,8 | 31,0±1,1 | 31,3±1,9 | 30,1±1,7 | 61,7±7,1* | 42,6±3,8* | 37,9±9,0 | 37,0±2,3 | 0±18,2 | 17,6±2,2 | |||||||||
| Боли в животе | 12,5±1,3 | 14,8±0,9 | 12,7±1,4 | 12,9±1,2 | 0±7,8 | 4,1±2,3 | 20,7±7,5 | 17,2±1,8 | 27,8±10,6 | 22,4±2,5 | |||||||||
| Повышенное газообразование | 6,3±0,6 | 7,2±0,2 | 6,6±0,7 | 5,9±0,5 | 2,1±7,8 | 3,0±2,3 | 0±12,1 | 2,3±0,8 | 16,7±8,8 | 20,7±2,4 | |||||||||
| Изменение характера и частоты стула | 33,9±1,8 | 33,8±1,2 | 34,0±2,0 | 35,2±1,7 | 38,3±7,1 | 27,2±3,4 | 24,1±8,0 | 30,8±2,2 | 55,6±11,7 | 40,0±2,9 | |||||||||
| Патологические примеси (слизь) | 10,7±1,2 | 8,5±0,2 | 12,0±1,4 | 15,9±1,3 | 4,3±7,8 | 3,0±2,3 | 0±12,1 | 0,9±0,9 | 5,6±18,2 | 4,1±1,4 | |||||||||
| Содержание факультативных микроорганизмов, превышающее допустимые значения | |||||||||||||||||||
| S.aureus | 67,2±1,8* | 45,9±1,2* | 70,5±1,9 | 65,9±1,7 | 68,1±6,8 | 51,5±3,8 | 24,1±7,9 | 31,2±2,2 | 27,8±10,6 | 12,8±2,0 | |||||||||
| УПЭ** | 48,1±1,9 | 48,6±1,2 | 48,1±2,1* | 63,0±1,7* | 59,6±7,2 | 49,1±3,8 | 37,9±9,0 | 35,0±2,3 | 33,3±11,1 | 31,0±2,7 | |||||||||
+ клебсиеллы присутствуют в микрофлоре кишечника;
– клебсиеллы отсутствуют в микрофлоре кишечника;
* - различия статистически достоверны, р<0,05
** - атипичные E.coli (гемолитические и лактозонегативные), Proteus spp, Citrobacter spp, Enterobacter spp, Morganella morganii
Биологические свойства и основные факторы патогенности штаммов Klebsiella spp., выделенных от лиц с дисбиозом кишечника.
Для оценки этиологической значимости условно патогенных энтеробактерий в возникновении дисбиотических состояний кишечника мы изучили биологические свойства и факторы патогенности штаммов Klebsiella., как наиболее часто выделяемого из испражнений рода УПЭ.
Все штаммы характеризовались типичными для рода Klebsiella ферментативными свойствами. При биотипировании K. pneumoniae установлено, что изученные штаммы относились к одному биотипу, независимо от материала и источника выделения. Мы оценили возможность применения для дифференциации штаммов K. pneumoniae метода серотипирования на основе определения К-антигена. Серотипирование с использованием специфических диагностических сывороток обладает рядом существенных ограничений (большое количество перекрестных реакций, недоступность сывороток). В последние годы разработан метод «молекулярного серотипирования» клебсиелл, позволяющий определить К-серотип в зависимости от строения гена, ответственного за продукцию К-антигена. С помощью этого метода у изученных штаммов выявлены антигенные различия, а также установлено, что в России циркулируют K. pneumoniae серотипов К17 и К64, широко распространенных в Европе, а также серотипов, обладающих не известными ранее К-антигенами, которые дополнили международную базу данных K-серотипов клебсиелл под номерами К182 и К183.
Известно, что многие УПЭ, в том числе и Klebsiella, имеют до 10 различных факторов патогенности (В.М. Бондаренко, 1996; Н.Ю. Жеребцова и соавт., 2007). У всех штаммов нашей коллекции обнаружена выраженная капсула, которая, по мнению многих исследователей, является главным фактором патогенности Klebsiella, обеспечивая микроорганизму устойчивость к различным защитным реакциям организма хозяина (R. Podschun, 1998; Favre-Bonte, 1999; Sahly et al. 2000).
Все штаммы, выделенные из испражнений, обладали пилями 3 типа, обеспечивающими адгезию микроорганизма к слизи и эпителию кишечного тракта, в меньшей степени мочевыводящих и дыхательных путей. Это способствует персистенции клебсиелл в кишечнике и развитию патологических процессов в биотопах, в норме не являющихся постоянным местом обитания Klebsiella.
Ни у одного из изученных штаммов не были обнаружены гены, кодирующие основные факторы патогенности «классических» возбудителей ОКИ, ответственные за адгезию (Р-пили, S-пили, аггрегативно-адгезивные фимбрии, белок интимин, афимбриальный адгезин), а также продукцию инвазинов, энтеротоксинов, шига-подобных токсинов, цитонекротического фактора, -гемолизина и аэробактина.
По данным отечественных исследователей штаммы Klebsiella могут обладать «островками патогенности», несущими следующие генетические детерминанты: sfa – у 8,0 % штаммов; hlyА - у 2,7 - 8,7 %; hly B – у 6,7 - 10,8 %; cnf1 – у 13,5 % (А.Р Мавзютов и соавт., 2002; Н.Ю. Жеребцова и соавт., 2007). Результаты наших исследований подтверждают тот факт, что генетические маркеры, ассоциируемые с патогенностью истинных возбудителей ОКИ, редко обнаруживают среди Klebsiella. Штаммы, выделенные из испражнений, обладали только факторами, способствующими адгезии микроорганизма на поверхности кишечного эпителия и обеспечивающими устойчивость к защитным реакциям макроорганизма. Наличием капсулы и пилей 3 типа можно объяснить персистенцию клебсиелл в кишечнике и их обнаружение у лиц с дисбиотическими нарушениями.
В первые годы жизни ребенка этот микроорганизм является одним из основных представителей энтеробактерий в кишечнике. За счет значительного количества, высокой адгезивной способности и способности формировать биопленки Klebsiella могут длительно персистировать в кишечнике. Как правило, у большинства людей колонизация кишечника протекает бессимптомно, однако при определенных условиях клебсиеллы способны реализовать свой разнообразный патогенный потенциал и вызвать в кишечнике нарушения, ограниченные генетическими детерминантами, которыми обладает штамм.
Изучение чувствительности к антибактериальным препаратам условно патогенных и патогенных энтеробактерий.
Проведен анализ чувствительности к АМП 500 штаммов Klebsiella (внебольничных и внутрибольничных) и 562 штаммов Salmonella, принадлежащих к 31 серовару. Резистентность к АМП, выявленная у внебольничных и внутрибольничных штаммов Klebsiella, имела выраженные отличия. Так, суммарная доля резистентных штаммов среди клебсиелл, выделенных из испражнений, практически не отличалась от этого показателя у изученных штаммов патогенных энтеробактерий (Salmonella) (13,5 ± 1,7% и 16,8 ± 1,1%); удельный вес штаммов, резистентных к отдельным АМП, не превышал 10% (табл. 2).
Таблица 2
Частота резистентности к отдельным АМП штаммов Klebsiella и Salmonella
| Антимикробный препарат | Klebsiella | Salmonella n=562 | |
| моча, раневое отделяемое n=114 | испражнения n=386 | ||
| -лактамы Ампициллин Цефалоспорины III пок. Меропенем | * 69,3 ± 4,3 0 | * 3,4 ± 1,0 0 | 9,2 ± 0,4 0,2 ± 0,4 0 |
| Хинолоны Налидиксовая кислота Ципрофлоксацин | 62,3 ± 4,5 53,5 ±4,7 | 2,8 ± 1,0 0,5 ± 1,0 | 5,8 ± 0,4 0 |
| Аминогликозиды Гентамицин Тобрамицин Амикацин | 63,2 ± 4,5 66,7 ± 4,4 41,2 ± 4,6 | 6,2 ± 1,0 3,9 ± 1,0 0,3 ± 1,0 | 0,4 ± 0,4 0,4 ± 0,4 0 |
| Ко-тримоксазол | 24,5 ± 4,0 | 0,8 ± 1,0 | 1,0 ± 0,4 |
| Левомицетин | 26,3 ± 4,1 | 4,9 ± 1,0 | 7,3 ± 0,4 |
| Тетрациклин | 58,8 ± 4,6 | 7,5 ± 1,0 | 9,6 ± 0,4 |
| Всего резистентных штаммов | 78,1 ±3,9 | 13,5 ± 1,7 | 16,8 ± 1,1 |
* Чувствительность не определяли, так как Klebsiella spp. обладают природной резистентностью к пенициллинам широкого спектра действия, обусловленной продукцией хромосомно кодируемых -лактамаз SHV-1и K1.
Среди клебсиелл не обнаружено штаммов, резистентных к карбапенемам. Все штаммы Salmonella оставались чувствительными не только к карбапенемам, но и к фторхинолонам и амикацину.
Среди резистентных культур Klebsiella и Salmonella, выделенных из испражнений, значительную долю составляли штаммы, резистентные к 1-2 антимикробным препаратам (75,0 ± 5,8% и 59,3 ± 3,6%, соответственно). Однако в структуре множественной резистентности отмечены выраженные отличия: среди полирезистентных клебсиелл большую часть составляли штаммы, продуцирующие БЛРС (23,2% из 25,0 %), тогда как, среди полирезистентных сальмонелл продуценты БЛРС были выявлены только в 1,1% из 40,8 % (рис. 3). Практически все полирезистентные штаммы ведущего серовара сальмонелл - S. Enteritidis обладали спектром резистентности к тетрациклину, левомицетину и налидиксовой кислоте.
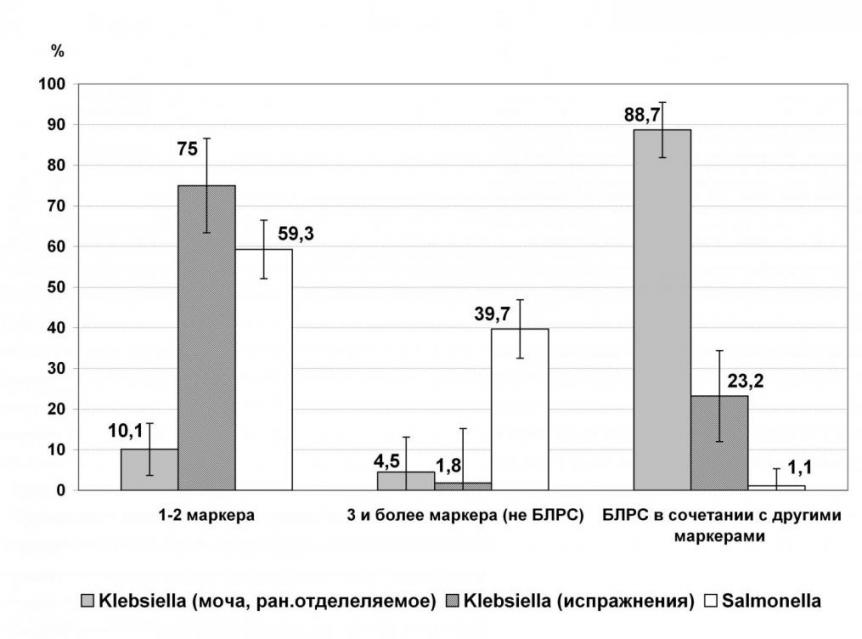
Рисунок 3. Структура резистентности к АМП (по числу маркеров) клебсиелл и сальмонелл, выделенных из различного клинического материала.
Среди внутрибольничных клебсиелл, выделенных из мочи и раневого отделяемого, общая доля резистентных штаммов достигала 78,1 ± 3,9%, а устойчивость к отдельным АМП колебалась от 24,5 ± 4,0% (ко-тримоксазол) до 69,3 ± 4,3% (цефалоспорины III поколения) (табл. 2). Основную часть полирезистентных штаммов составляли продуценты БЛРС (88,7 ± 3,4%).
Согласно МУК 4.2.1890-04 штаммы энтеробактерий следует рассматривать как подозрительные на продукцию БЛРС, если МПК цефотаксима составляет 2 мг/л и выше. У некоторых изученных штаммов, продуцирующих БЛРС (1,3%), МПК цефотаксима составляла 1 мг/л, то есть эти штаммы не попадали в категорию резистентных. Полученные данные подтверждают рекомендации об изменении критериев отбора штаммов: следует изучать продукцию БЛРС у тех энтеробактерий, для которых МПК цефалоспоринов III поколения составляет 1 мг/л и выше (М.В.Эйдельштейн, 2000; Л.П. Зуева и соавт., 2005).
Штаммы Klebsiella, продуцирующие БЛРС, характеризовались ко-резистентностью к нелактамным АМП. Ко-резистентность к аминогликозидам, хинолонам и тетрациклину была высокой независимо от клинического материала. В целом, клебсиеллы, выделенные из испражнений, характеризовались меньшей ко-резистентностью к амикацину и фторхинолонам, и меньшим разнообразием спектров ко-резистентности, чем штаммы из мочи и раневого отделяемого (8 и 24 спектра, соответственно).
Для клебсиелл, продуцирующих БЛРС, установлено отсутствие активности амоксициллина/клавулановой кислоты, крайне низкая активность цефалоспорина IV поколения цефепима (14,6 ± 5,1% чувствительных штаммов) и низкая активность цефоперазон/сульбактама (31,2 ± 6,3% чувствительных штаммов). Только карбапенемы (из всех –лактамных АМП) сохранили высокую активность.
В настоящее время для лечения бактериальных инфекций широко используют хинолоны. Развитие резистентности к этой группе АМП имеет ступенчатый характер и затрагивает в первую очередь налидиксовую кислоту. По нашим данным, штаммы, резистентные к этому препарату, характеризовались сниженной чувствительностью к ципрофлоксацину: МПК ципрофлоксацина в 4 - 33 раза превышали «фоновые» значения, полученные для чувствительных штаммов. Эти результаты свидетельствуют о возможности быстрого развития резистентности к фторхинолонам среди энтеробактерий.
При изучении природы генетического контроля резистентности к цефалоспоринам расширенного спектра обнаружено, что устойчивость к этой группе -лактамных препаратов у условно патогенных и патогенных энтеробактерий обусловлена одним механизмом – продукцией БЛРС. У изученных штаммов Klebsiella, независимо от материала и источника выделения, были обнаружены гены, кодирующие продукцию БЛРС, относящихся к СТХ-М-типу (группа СТХ-М1, –лактамазы СТХ-М3 и СТХ-М15). В России -лактамазы СТХ-М-типа описаны у внутрибольничных штаммов Klebsiella и S. Typhimurium (С.В. Сидоренко и соавт., 1998; М.В Эйдельштейн, 2004). В ходе исследования ген, кодирующий СТХ-М3-–лактамазу был обнаружен у штамма S. Virchow. У штамма S. Newport был выявлен ген, кодирующий -лактамазу молекулярного класса С – СМУ-2. Циркуляция S. Newport, обладающих такой -лактамазой, отмечена во многих странах, но в России описана впервые (P.L.Winokur et al., 2000; A.Gupta et al., 2003; M.Batchelor et al., 2005).
Полирезистентность изученных штаммов была обусловлена локализацией bla генов вместе с детерминантами резистентности к другим АМП на плазмидах. Плазмидная локализация кодирующих генов и их ассоциация с такими мобильными элементами, как ISEcp1, способствует эпидемическому внутри- и межвидовому распространению резистентности.
ВЫВОДЫ
- У обследованных лиц микроорганизмы–представители облигатной микрофлоры кишечника обнаружены в количествах, соответствующих нормативным показателям: бифидобактерии - у 68,0 %, лактобактерии - у 21,6 %, энтерококки – у 46,6 %. С возрастом наблюдалась общая тенденция к снижению доли лиц с нормальным содержанием облигатной микрофлоры. По суммарным данным только у 6,0 % лиц отклонения в количественном составе облигатной микрофлоры толстого кишечника отсутствовали.
- В микрофлоре кишечника у 49,0 % обследованных лиц обнаружены условно патогенные энтеробактерии. Микроорганизмы рода Klebsiella составляли 59,0 % от всех выделенных условно патогенных энтеробактерий и лидировали во всех возрастных группах.
- Не обнаружена зависимость клинических проявлений дисбиоза кишечника от наличия клебсиелл в составе микрофлоры. В группу лиц, из испражнений которых были выделены клебсиеллы, чаще входили пациенты, получавшие антибактериальную терапию, а у детей второго года жизни достоверно чаще встречались аллергические проявления.
- Клебсиеллы, выделенные при дисбиозах, обладали факторами патогенности, необходимыми для персистенции микроба в кишечнике, но ни один из изученных штаммов не имел генетических детерминант, присущих «классическим» возбудителям острых кишечных инфекций.
- Развитие резистентности к цефалоспоринам расширенного спектра у патогенных и условно патогенных энтеробактерий обусловлено одним механизмом - продукцией -лактамаз расширенного спектра. СТХ-М- -лактамазы занимают у Klebsiella лидирующее положение, независимо от эпидемиологической характеристики штаммов. Условно патогенные энтеробактерии можно рассматривать как резервуар генов резистентности.
- Штаммы клебсиелл - продуценты -лактамаз расширенного спектра характеризовались высокой ко-резистентностью ко всем изученным антимикробным препаратам. Единственной группой антибиотиков активной по отношению к таким штаммам остаются карбапенемы.
Практические рекомендации
- Обнаружение клебсиелл при бактериологическом исследовании испражнений нельзя рассматривать как несомненное показание для антибиотикотерапии. Для обоснования этиологической роли данных микроорганизмов при дисбиозах необходимо выявление факторов патогенности молекулярно-генетическими методами.
- С целью эпидемиологического надзора за клебсиеллезной инфекцией целесообразно ввести в практику метод «молекулярного серотипирования».
- Нецелесообразно применять цефепим и амоксиклав для эмпирической терапии инфекций, вызванных энтеробактериями, продуцирующими БЛРС. Использование цефоперазон/сульбактама возможно только после подтверждения чувствительности возбудителя. Высокий удельный вес продуцентов БЛРС требует пересмотра роли цефалоспоринов как препаратов выбора при лечении нозокомиальных инфекций, вызванных энтеробактериями, прежде всего клебсиеллами.
- В клинико-диагностических лабораториях необходимо определять чувствительность энтеробактерий к налидиксовой кислоте.
- Проводить мониторинг антибиотикорезистентности условно патогенных и патогенных энтеробактерий с учетом преобладающих механизмов резистентности.
- В Санкт-Петербурге при качественной и количественной оценке микрофлоры кишечника следует ориентироваться на нормы, приведенные в МР № 10-11/31 (М., 1986) и информационном письме СПбГМА им. И.И.Мечникова (СПб., 2002), объективно отражающие состояние кишечной микрофлоры жителей нашего региона.
Список работ, опубликованных по теме диссертации
- Егорова С.А. Частота обнаружения бактерий рода Klebsiella в составе кишечной микрофлоры детей / С.А. Егорова // Ликвидация и элиминация инфекц.болезней – прогресс и проблемы: мат. междунар. науч.-практ. конф. (СПб., 2003).– СПб., 2003. – С.107.
- Егорова С.А. Резистентность к антибиотикам бактерий рода Klebsiella–представителей кишечной микрофлоры детей / С.А Егорова, Л.А. Кафтырева // Ликвидация и элиминация инфекционных болезней – прогресс и проблемы: мат. междунар. науч.-практ. конф. (СПб., 2003). – СПб., 2003. – С.108
- Егорова С.А. Характеристика чувствительности к антибактериальным препаратам и продукции в-лактамаз расширенного спектра действия штаммов Klebsiella spp. различного происхождения / С.А. Егорова // Медицинский академический журнал. – 2004. –Т. 4, № 3. – Прил. 5. – С.40-41.
- Егорова С.А. Устойчивость штаммов Klebsiella spp. различного происхождения к антимикробным препаратам / С.А.Егорова // Медицинская микробиология – XXI век: мат. Рос. науч.-практ. конф.(Саратов, 2004). –Саратов, 2004.– С. 85-86.
- Егорова С.А. Резистентность к антибактериальным препаратам штаммов Shigella spp. и Salmonella spp., выделенных от больных острыми кишечными инфекциями с колитическим синдромом / Л.А. Кафтырева, Е.А. Кожухова, С.А.Егорова // Медицинская микробиология – XXI век: мат. Рос. науч.- практ. конф. (Саратов, 2004).– Саратов, 2004.- С. 112-114.
- Егорова С.А. Характеристика микрофлоры при дисбиозе кишечника и способы ее коррекции / С.А. Егорова, А.В.Забровская, Э.С. Лавренева // Современные средства иммунодиагностики, иммуно- и экстренной профилактики актуальных инфекций: мат. междунар. науч. конф.(СПб., 2004).–СПб.,2004.–С.179-181.
- Егорова С.А.Обнаружение клебсиелл при дисбактериозах кишечника / С.А. Егорова // Актуальные вопросы инфекционной патологии-2005: мат. Рос. науч. конф. молодых ученых с междунар. участием (СПб., 2005).– СПб.,2005. – С.58.
- .Егорова С.А. Возрастная динамика колонизации толстого кишечника условно-патогенными энтеробактериями / С.А. Егорова // СПб. научные чтения: мат. междунар. молодежного мед. конгр. (СПб., 2005). – СПб., 2005 – С. 72 – 73.
- Егорова C.А. Механизмы резистентности госпитальных штаммов Klebsiella pneumoniae к цефалоспоринам расширенного спектра / C.А Егорова, Е.П. Сиволодский, В.Г. Жуховицкий // мат. VIII междунар. конгр. МАКМАХ/ASM по антимикробной терапии. (М., 2006). – М., 2006.- С.19.
- Егорова C.А. Выявление механизмов резистентности у штаммов Salmonella к цефалоспоринам расширенного спектра / C.А. Егорова, Л.А. Кафтырева // Итоги и перспективы диагностики и лечения инфекционных больных: мат.VII Рос. съезда инфекционистов. (Н. Новгород, 2006). – Н. Новгород, 2006. – С. 80.
- Egorova S. The resistance mechanisms of Klebsiella pneumoniae nosocomial strains to extended-spectrum -lactams/ S.Egorova // мат. 7ого междунар. науч. конгр. по инф.заб. Балтийских стран (Рига, 2006). – Рига, 2006. – С. 46.
- Egorova S. Types of beta-lactamases in Salmonella and Shigella strains in St. Petersburg and Leningradsky region, Russia / L. Kaftyreva, N. Kozlova, S. Egorova // мат.7 междунар.науч.конгр. по инф.заб. Балтийских стран (Рига, 2006). – Рига, 2006. – С.20.
- Егорова C.А. Продукция -лактамаз расширенного спектра штаммами Salmonella, выделенными в Санкт- Петербурге в 2003-2005гг / C.А. Егорова, Л.А. Кафтырева, Е.А. Кожухова // мат.IX междунар. конгр. МАКМАХ/BSAC по антимикробной терапии (М., 2006).– М., 2007. – С.20.
- Егорова С.А.Чувствительность K.pneumoniae и E.coli к цефалоспоринам IV поколения, ингибиторзащищенным -лактамам и карбапенемам / С.А. Егорова., М.А. Макарова, Л.А.Кафтырева // мат.IX междунар.конг. МАКМАХ/BSAC по антимикробной терапии (М., 2006). – М., 2007.– С. 19-20.
- Егорова С.А. Некоторые аспекты дисбактериоза кишечника и чувствительности к антибактериальным препаратам представителей факультативной микрофлоры / С.А. Егорова, М.А. Макарова, Л.А. Кафтырева, З.Н. Матвеева, А.В. Забровская//Современные проблемы медицинской микробиологии: мат. ХХХХ Рос. науч. конф. «Хлопинские чтения» (СПб., 2007).–СПб.,2007.–С. 190-191.
- Егорова С.А. Возможности применения цефалоспоринов IV поколения, «защищенных» -лактамов и карбапенемов для лечения инфекций, вызванных штаммами энтеробактерий, продуцирующих -лактамазы расширенногоспектра(БЛРС) / С.А. Егорова, М.А. Макарова, Л.А. Кафтырева // Современные проблемы медицинской микробиологии: мат. ХХХХ Рос. науч. конф. «Хлопинские чтения» (СПб., 2007). – СПб., 2007. – С. 192-194.
- Егорова С.А. Резистентность к -лактамам среди энтеробактерий / С.А. Егорова, М.А. Макарова, Л.П. Зуева, Л.А. Кафтырева // мат.IX съезда Всерос.науч.-практ. общества эпидемиол., микробиол. и паразитол. (М., 2007). – М., 2007.– Т.2. – С. 231.
- Egorova S. Prevalence and characterization of 19 extended-spectrum cephalosporin-resistant nontyphoidal Salmonella isolates in adults in Saint Petersburg, Russia (2002-2005) / S. Egorova, L. Kaftyreva, P.A. Grimont, FX. Weill. // Microbial Drug Resistance. – 2007. – V. 13, N 2. – P. 102 -107.
- Егорова С.А. Изучение факторов патогенности клинических штаммов энтеробактерий. Обоснование этиологической роли Klebsiella pneumoniae при острых кишечных инфекциях и дисбиотических состояниях желудочно-кишечного тракта / С.А. Егорова [и др.] // Актуальные вопросы обеспечения санитарно-эпидемического благополучия Ленинградской области: мат. науч.-практ. конф., посвящ.85-летию Госуд.санит.эпид. службы (СПб., 2007). – СПб., 2007. – С.225-229.
Список сокращений
АМП – антимикробный препарат
БЛРС – бета-лактамазы расширенного спектра
ЖКТ – желудочно-кишечный тракт
КОЕ – колониеобразующая единица
МПК – минимальная подавляющая концентрация
ОКИ – острые кишечные инфекции
УПЭ – условно патогенные энтеробактерии
ЦРС – цефалоспорины расширенного спектра
RFLP – анализ полиморфизма длин фрагментов рестрикции участков генома
Отпечатано в ООО "АРКУШ",
Санкт-Петербург, ул. Рубинштейна, д.2/45
ИНН 7825442972 / КПП 78501001
усл. печат. листов 1.0
Подписано в печать 02.10.2007 г.
заказ №0210/1 от 02.10.2007 г., тир. 100 экз.

