Оптические свойства некоторых производных пиридина и бициклических соединений, содержащих карбонильную группу
На правах рукописи
НИКОНОВИЧ ОЛЬГА ЛЕОНИДОВНА
Оптические СВОЙСТВА некоторых ПРОИЗВОДНЫХ ПИРИДИНА И БИЦИКЛИЧЕСКИХ соединений, СОДЕРЖАЩИХ КАРБОНИЛЬНУЮ ГРУППУ
01.04.07 – физика конденсированного состояния
Автореферат диссертации на соискание ученой степени
кандидата физико-математических наук
Иркутск – 2013
Работа выполнена в Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Иркутский государственный университет путей сообщения»
Научный руководитель: доктор физико-математических наук,
профессор Илларионов Анатолий Ильич
Официальные оппоненты:
Зилов Сергей Анатольевич, доктор физико-математических наук, заведующий лабораторией фотофизики конденсированных сред Иркутского филиала Федерального государственного бюджетного учреждения науки «Институт лазерной физики» СО РАН
Сараев Виталий Васильевич, доктор химических наук, профессор, заведующий кафедрой физических методов анализа Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Иркутский государственный университет»
Ведущая организация: Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Дальневосточный федеральный университет»
Защита состоится « » июня 2013 г. в час. на заседании диссертационного совета при Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Иркутский государственный университет» по адресу:
г. Иркутск, ул. Гагарина, 20.
С диссертацией можно ознакомиться в библиотеке Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Иркутский государственный университет» по адресу: г. Иркутск, ул. Гагарина, 24.
Автореферат разослан «___» мая 2013 г.
Ученый секретарь
диссертационного совета Д 212.074.04,
кандидат физико-математических наук,
доцент Б.В. Мангазеев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Гетероциклические азотсодержащие конденсированные среды – один из самых многочисленных классов органических соединений. Они находят применение в различных областях науки и техники в качестве материалов электронной техники [1], для создания оптоэлектрических устройств [2], в качестве красителей [3-4], флуоресцентных зондов [5], сенсибилизаторов [6], люминофоров [7], сцинтилляторов [8], индикаторов полярности [9], а также как лекарственные и стимулирующие средства в медицине [10].
Использование органических молекул разной конфигурации открывает широкие возможности для модификации оптических свойств материала [11]. Так, в настоящее время в области нанотехнологий, связанных с разработкой и производством электронных устройств и приборов, используются органические соединения, состоящие в основном из углерода, водорода, кислорода и азота [12-13]. Они обладают такими преимуществами как небольшой размер, невысокая стоимость и возможность подстройки свойств [13].
В диссертационной работе объектами исследования являются органические соединения, производные пиридина, и бициклические производные, содержащие карбонильную группу. Гетероциклические азотсодержащие вещества, производные пиридина, находят широкое применение в различных отраслях прикладной физики, медицины, промышленности. Некоторые пиридины представляют собой важный класс противоопухолевых соединений [14-15]. Они также оказывают антибактериальное, противогрибковые и антидепрессантные действия [15]. Некоторые бифункциональные пиридины используются в качестве нелинейных оптических материалов [16], материалов, используемых для электронной техники [1], хелатообразователей металл-лиганд в химии [17] и в качестве флуоресцентных кристаллов [3,7]. Кроме того, пиридин является важным и полезным связующим звеном для синтеза различных гетероциклических соединений [18]. Наряду с органическими веществами, производными пиридина, в настоящее время в прикладной науке широко используются гетероциклические кислородсодержащие молекулярные материалы, которые применяются в качестве материалов для электронной техники, молекулярных элементов, красителей, флуоресцентных зондов, сенсибилизаторов, люминофоров, сцинтилляторов [19]. Большой интерес к бициклическим производным, содержащим карбонильную группу (C=O), связан с возможностью их использования в качестве лазерно-активных сред [19]. Кроме традиционного использования красителей некоторые вещества стали известны как материалы для электролюминесценции [20]. Исследования последних лет показали эффективность данных соединений как индикаторов полярности [19,21] и для комплексообразования щелочных и щелочноземельных металлов, в том числе в системах, моделирующих биологические объекты [21]. Молекулярные кристаллы, содержащие карбонильную группу, находят применение и в молекулярной электронике. В настоящее время разработаны молекулярные транзисторы и диоды, представляющие собой отдельные органические молекулы.
В настоящее время установлено существование связи между структурой вещества и различными физико-химическими характеристиками соединения [22]. Поэтому исследование конденсированных сред на основе гетероциклических соединений является актуальной задачей, которая, в первую очередь, связана с созданием точных бесконтактных неразрушающих методов количественного и качественного анализа веществ, составляющих сложные соединения. Для анализа лекарственных веществ часто используются оптические методы, такие как: электронная спектрометрия [23]; колебательная спектроскопия [24]; комбинационное рассеяние света [25]; люминесцентный анализ [26-27] и др. Эти методы, несмотря на их достоинства, требуют использования сложной дорогостоящей аппаратуры, и в связи с этим, не всегда доступны для аналитических лабораторий и мониторингового контроля.
Для количественного определения гетероциклических азотсодержащих веществ широко распространенным и доступным методом является метод стационарной абсорбционной спектроскопии [28] с использованием в качестве эталона того же самого вещества, но не содержащего специфических примесей (государственный стандартный образец (ГСО)). Изготовление ГСО является дорогостоящей и трудоемкой задачей. В последние годы авторами [29-31] был разработан и апробирован достоверный метод с применением оптических образцов сравнения, в котором в качестве внешнего стандарта используются вещества другой химической природы, но имеющие близкие полосы поглощения с исследуемым материалом. Данный метод не уступает по точности традиционным спектрофотометрическим методам [32], недорогостоящий, доступный по образцам сравнения, не является высокотоксичным.
Вместе с тем, ряд важнейших вопросов, касающихся физической природы оптических свойств органических соединений, определения электронных переходов в УФ и видимой областях спектра, в которых проводится спектрофотометрическое определение указанных гетероциклических азотсодержащих веществ, остается нерешенным.
В связи с актуальностью представленных выше проблем была поставлена задача раскрыть природу полос оптического поглощения исследуемых веществ и на этой основе разработать методики количественного определения данных веществ в лекарственных средствах спектрофотометрическим методом с использованием оптических образцов сравнения.
Целью диссертационной работы является экспериментальное исследование оптических свойств и установление физической природы спектральных полос поглощения электромагнитного излучения в УФ и видимой областях спектра органическими средами производными пиридина (пиридоксин гидрохлорида, этионамид, протионамид) и бициклических производных, содержащих карбонильную группу (ломефлоксацин, рифампицин).
Для достижения поставленной в работе цели были решены следующие задачи:
- Экспериментально исследованы оптические спектры поглощения в УФ и видимой областях спектра пиридоксин гидрохлорида, этионамида, протионамида, ломефлоксацина и рифампицина.
- Методом конфигурационного взаимодействия рассчитаны значения энергий основного и возбужденного состояний электрона и изучена природа электронных переходов в УФ области спектра в молекулах, являющихся производными пиридина.
- С помощью экспериментальных исследований полос поглощения и расчета методом конфигурационного взаимодействия собственных значений энергий электронов в молекулах ломефлоксацина и рифампицина, являющихся бициклическими производными, содержащими карбонильную группу, определена природа электронных переходов в ближней УФ и видимой областях спектра.
- Изучены люминесцентные свойства ломефлоксацина.
- Разработаны методики спектрофотометрического определения исследуемых гетероциклических азотсодержащих соединений, являющихся лекарственными средствами, с использованием оптических стандартных образцов.
Научная новизна работы:
- Произведена интерпретация спектров поглощения в УФ и видимой областях спектра в молекулах производных пиридина (пиридоксин гидрохлорида, этионамид и протионамид) с помощью исследования экспериментальных абсорбционных спектров и расчета волновых функций электронов в основном и возбужденном состояниях методом конфигурационного взаимодействия.
- Экспериментально и с помощью расчета волновых функций электронов методом конфигурационного взаимодействия исследована природа вынужденных электронных переходов в бициклических производных, содержащих карбонильную группу (ломефлоксацин, рифампицин).
- Исследована природа и механизм люминесцентных свойств фундаментальных полос поглощения ломефлоксацина на длине волны 324±1 нм.
Положения, выносимые на защиту:
- Полосы поглощения УФ излучения с максимумом на длине волны 292 нм молекул этионамида и протионамида в растворе 95% этилового спирта и на длинах волн 244 нм и 310 нм молекулы пиридоксин гидрохлорида в растворе гидроксида натрия обусловлены переходом электронов с p орбитали атомов, образующих связи C=N в пиридиновом кольце, на pz орбиталь атома азота
- Полосы поглощения УФ излучения с максимумом на длине волны 285 нм соединения ломефлоксацина в дистиллированной воде обусловлены переходом электронов на p орбиталях атома кислорода, образующих связи C=О.
- Переходы электронов с p орбитали атомов, образующих карбонильную группу, на pz орбиталь атома кислорода ответственны за полосы поглощения УФ излучения рифампицина в растворе 95% этилового спирта с максимумом на длине волны 342 нм, а переходы на p орбиталях атомов на pz орбиталь атома азота, образующих связь C=N, ответственны за полосу поглощения на длине волны 475 нм.
- Широкополосная малоинерционная валентная люминесценция при 390 нм соединений ломефлоксацина, возбуждаемая УФ лазерным излучением c длиной волны 337 нм, формируется в валентной зоне, образованной 2p состояниями O2- ионов кислорода при двухфотонной ионизации электронов с глубоких 2p O2- уровней и, как следствие, обусловлена излучательными электронными переходами с высоких 2р O2- состояний на образовавшиеся глубокие дырки.
Практическая значимость работы:
С использованием полученных результатов разработаны и апробированы методики спектрофотометрического анализа пиридоксин гидрохлорида, этионамида, протионамида, ломефлоксацина и рифампицина в субстанции методом внешнего (оптического) стандарта, две из которых защищены патентом РФ на изобретение. Методики являются доступными для контрольно-аналитических лабораторий, характеризуются хорошей воспроизводимостью и точностью.
Апробация работы была проведена на
– Международной конференции «Прикладная оптика – 2006» (Санкт-Петербург, 2006);
– X Международной школе-семинаре по люминесценции и лазерной физике (Иркутск, 2006);
– Международной конференции молодых ученых «Оптика – 2007» (Санкт-Петербург, 2007);
–XI Международной школе-семинаре по люминесценции и лазерной физике (Иркутск, 2008);
–Международной конференции «Оптика кристаллов и наноструктур» (Хабаровск, 2008);
–Научной конференции «Естествознание и гуманизм» (Томск, 2008);
–VI Международной конференции молодых ученых и специалистов «Оптика – 2009» (Санкт-Петербург, 2009);
–VII Международной конференции «Фундаментальные проблемы оптики – 2010» (Санкт-Петербург, 2010);
– XII Международной школе-семинаре по люминесценции и лазерной физике (Иркутск, 2010);
–VII Международной конференции «Оптика– 2011» (Санкт-Петербург, 2011);
–Международной молодежной конференции по люминесценции и лазерной физике (Иркутск, 2012).
Публикации. По теме диссертации опубликовано 17 работ, из них 5 – в журналах, рекомендованных ВАК РФ, 10 работ – в прочих журналах, сборниках трудов всероссийских и международных научных конференций, получено 2 Патента РФ на изобретения.
Личный вклад автора
Основные экспериментальные результаты исследования получены в соавторстве, теоретические исследования полученных результатов выполнены соискателем. Формулировка защищаемых положений и основных выводов диссертационной работы принадлежат автору.
Объем и структура диссертации
Диссертация изложена на 158 страницах, содержит введение, пять глав, заключение, приложения и список литературы. Работа иллюстрирована 28 рисунками и содержит 33 таблицы. Список использованной литературы содержит 102 наименования.
СОДЕРЖАНИЕ РАБОТЫ
Объекты исследования представляют собой гетероциклические азотсодержащие вещества, производные пиридина (пиридоксин гидрохлорида, этионамид, протионамид) и бициклические производные, содержащие карбонильную группу (ломефлоксацин, рифампицин). Их физические свойства, структурные и эмпирические формулы приведены в первой главе диссертации (на рис. 1,4,7 приведены структурные формулы исследуемых соединений).
Оптические свойства производных пиридина
(главы 1 и 2)
Спектры оптического поглощения этионамида, протионамида и пиридоксин гидрохлорида измерены в растворах с различными значениями рН (от 1,1 до 12,5) при 300 К в кварцевых кюветах с толщиной рабочего слоя 10 мм. Используя метод последовательного разбавления, описанного в первой главе, была получена оптимальная для получения спектров поглощения концентрация этионамида и протионамида в исследуемых растворах, которая составила 0,002 %.
Исследование оптических свойств этионамида и протионамида показало, что их спектры поглощения совпадают с точностью до инструментальной ошибки прибора, что объясняется схожестью их внутреннего строения (рис. 1, а,б).
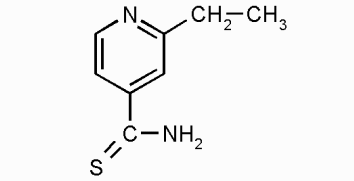 а) а) | 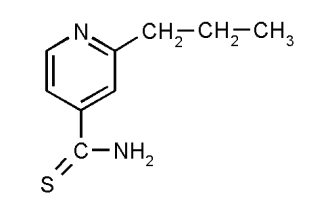 б) б) |
| Рис. 1 Структурные формулы: а) этионамида, б) протионамида | |
Экспериментальные исследования оптических спектров поглощения этионамида и протионамида показали, что данные спектры изменяются в зависимости от рН среды (рис. 2).
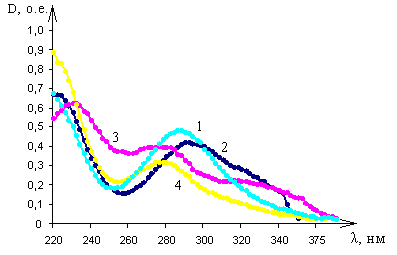 |
| Рис. 2. Спектры оптического поглощения этионамида и протионамида в: 1 – дистиллированной воде; 2 - 95% этиловом спирте; 3 - 0,1М растворе хлористоводородной кислоты; 4 - 0,1М растворе гидроксида натрия |
При рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты) спектр поглощения этионамида и протионамида характеризуется двумя полосами поглощения с максимумами на длинах волн 232±1 нм и 277 ±1 нм, а также наличием плеча в интервале длин волн 308 нм – 322 нм (рис. 2, кривая 3). При рН 6,4 (растворитель – дистиллированная вода) спектр характеризуется двумя полосами поглощения с максимумами на длинах волн 220±1 нм, 287±1 нм (рис. 2, кривая 1). При рН 7,2 (растворитель – этиловый спирт 95%) спектр имеет три максимума на длинах волн 222±1 нм, 292±1 нм и 324±1 нм (рис. 2, кривая 2). При рН 12,5 (растворитель 0,1М раствор гидроксида натрия) спектр этионамида и протионамида характеризуется одной полосой поглощения с максимумом на длине волны 280±1 нм (рис. 2, кривая 4).
Концентрация пиридоксин гидрохлорида в исследуемых растворах в различных растворителях составляла 0,001 %.
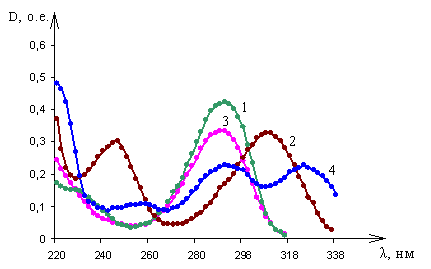 |
| Рис. 3. Спектры оптического поглощения пиридоксин гидрохлорида в: 1 – 0,1М растворе хлористоводородной кислоты; 2 - 0,1М растворе гидроксида натрия; 3 - этиловом спирте 95%; 4 – дистиллированной воде |
Исследования оптических спектров поглощения пиридоксин гидрохлорида показало следующее: спектр поглощения пиридоксин гидрохлорида при рН 4,1 и 1,1 (растворители – этиловый спирт 95% и 0,1М раствор хлористоводородной кислоты соответственно) характеризуется одной полосой поглощения с максимумом на длине волны 291±1 нм (рис. 3, кривые 1,3). При рН 4,2 (растворитель – дистиллированная вода) спектр имеет два максимума поглощения на длинах волн 291±1 нм и 324±1 нм (рис 3, кривая 4). При рН 12,5 (растворитель – 0,1М раствор гидроксида натрия) спектр характеризуется двумя полосами поглощения с максимумами на длинах волн 244±1 нм и 310±1 нм (рис. 3, кривая 2).
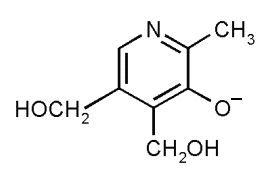
При исследовании спектров поглощения данных веществ установлено, что этионамид и протионамид не меняет своей структуры в растворителях с различными значениями pH, а пиридоксин гидрохлорида может иметь три формы в различных pH растворах: в 0,1М растворе хлористоводородной кислоты и растворе 95% этилового спирта находится в виде пиридиниевого иона (рис. 4,б), в 0,1М растворе гидроксида натрия – в виде основания (рис. 4,в) и фенолят-аниона (рис. 4,а), в дистиллированной воде – во всех трех формах (основание, пиридиниевый ион, фенолят-анион).
 а) а) | 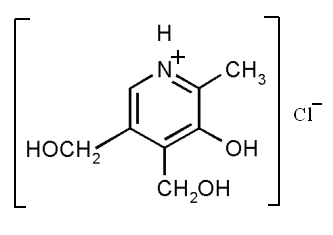 б) б) | 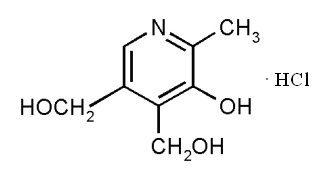 в) в) |
| Рис. 4. Структурная формула пиридоксин гидрохлорида [33]: а) в виде фенолят-аниона; б) в виде пиридиниевого иона; в) в виде основания | ||
Согласно литературным данным [34,35] производные пиридина в ближней ультрафиолетовой области абсорбционного спектра имеют три полосы поглощения с максимумами на длинах волн 195 нм, 251 нм и 270 нм, связанные с наличием в структуре вещества пиридинового кольца. Полосы поглощения с максимумами на длинах волн 195 нм и 251 нм в пиридине (растворитель – гексан) обусловлены переходами электронов с p-орбитали на вакантную p орбиталь ( - * переход). По классификации Клара данные полосы относятся к p-, -полосам поглощения соответственно.
p-, -полосы поглощения пиридина изменяют свое положение при введении в структуру его молекулы ауксохромных заместителей и смещаются в длинноволновую область спектра – происходит батохромный сдвиг. В растворах этионамида и протионамида p-полоса поглощения имеет максимумы на длинах волн 220±1 нм в дистиллированной воде, 222±1 нм – в этиловом спирте 95% и 0,1М растворе гидроксида натрия, 232±1 нм – в 0,1М растворе хлористоводородной кислоты. -полоса поглощения пиридина имеет максимум на длинах волн 277±1 нм в 0,1М растворе хлористоводородной кислоты, 280±1 нм – в 0,1М растворе гидроксида натрия, 287±1 нм – в дистиллированной воде и 292±1 нм – в 95% этиловом спирте.
p-, -полосы поглощения в растворах пиридоксин гидрохлорида сдвигаются в зависимости от формы молекулы пиридоксин гидрохлорида. Пиридоксин гидрохлорида в растворе хлористоводородной кислоты (pH 1,1) и этиловом спирте 95% (pH 4,1) существует в виде пиридиниевого иона. Максимум p-полосы поглощения в растворе хлористоводородной кислоты находится на длине волны, меньшей 220 нм (в коротковолновой области спектра), в экспериментальном спектре максимум данной полосы поглощения не выявляется. -полоса поглощения находится на длине волны 291±1 нм. В 0,1М растворе гидроксида натрия (pH 12,5) согласно полученным оптическим спектрам поглощения пиридоксин гидрохлорид существует в двух формах: в виде фенолят-аниона (рис. 2.6, а) и основания. Максимум p-полосы поглощения пиридоксин гидрохлорида в виде фенолят-аниона и основания в полученных оптических спектрах не зарегистрированы. В-полоса поглощения пиридоксин гидрохлорида в виде фенолят-аниона имеет максимум на длине волны 310±1 нм, а в виде основания – 244±1 нм. При исследовании спектров поглощения в дистиллированной воде (рН 4,15) обнаружено, что пиридоксин гидрохлорида находится в трех формах, вследствие чего -полоса поглощения пиридоксин гидрохлорида имеет максимумы поглощения в виде основания на длине волны 258±1 нм, в виде пиридиниевого иона – 291±1 нм, в виде фенолят-аниона – 324±1 нм.
В спектрах поглощения этионамида и протионамида также наблюдается t-полоса поглощения, связанная с n - * переходом неподеленной пары. Из полученных спектров поглощения этионамида и протионамида в 95% этиловом спирте видно, что максимум t-полосы поглощения пиридина находится на длине волны 324±1 нм. Данная полоса поглощения относится к переходу электрона неподеленной пары атома азота (n - * переход). В кислых средах происходит протонирование n – электронов неподеленной пары, в результате чего они теряют свой несвязующий характер, и n - * переход не наблюдается. Из спектров поглощения (рис. 2) видно, что в 0,1М растворе хлористоводородной кислоты в данной области спектра наблюдается плечо в интервале длин волн 308 нм – 322 нм.
Для подтверждения сделанных выводов был проведен расчет электронно-спектральных свойств основных и возбужденных состояний и спектральных характеристик в приближении ZINDO/S для молекул этионамида, протионамида и пиридоксин гидрохлорида. Геометрия молекул получена методом молекулярной механики ММ+. Оптимизация молекул данным методом показала хорошее соответствие между рассчитанными длинами волн и валентными углами и соответствующими экспериментальными данными [36,37]. Погрешность расчета длин связей и валентных углов не превышает 3%. Результаты рассчитанных спектральных характеристик приведены в табл. 1,2.
Таблица 1. Раcсчитанные и экспериментальные спектральные характеристики этионамида и протионамида
| Соединение | Рассчитанная длина волны, нм | Сила осциллятора Fосц, о.е. | Экспериментальная длина волны, нм | Оптическая плотность D, о.е. |
| Этионамид | 211,5 328,7 - | 0,59 0,21 - | 222 | 0,67 0,42 0,25 |
| Протионамид | 211 329,4 - | 0,52 0,20 - | 222 | 0,67 0,42 0,25 |
Таблица 2. Рассчитанные и экспериментальные спектральные характеристики пиридоксин гидрохлорида
| Форма пиридоксин гидрохлорида | Рассчитанная длина волны, нм | Сила осциллятора Fосц, о.е. |
| фенолят аниона | 296,3 | 0,123 |
| пиридиниевый ион | 307, 38 | 0,116 |
| основание | 237,39 269,07 | 0,121 0,134 |
Согласно расчету в приближении ZINDO/S определено, что линия поглощения этионамида на длине волны 328,7 нм обусловлена переходом электрона с 28 молекулярной орбитали (энергетический уровень соответствует -8,62 эВ) на вакантную 30 молекулярную орбиталь (энергетический уровень соответствует -1,20 эВ). Линия поглощения протионамида на длине волны 329,4 нм обусловлена переходом электрона с 30 молекулярной орбитали (энергетический уровень соответствует -8,64 эВ) на вакантную 33 молекулярную орбиталь (энергетический уровень соответствует -1,21 эВ). При детальном исследовании атомных орбиталей и их вкладов в занятую и вакантную молекулярные орбитали, соответствующие данному переходу, определено, что длина волны поглощения 328,7 нм в молекуле этионамида и длина волны 329,4 нм в молекуле протионамида обусловлены соответствующими переходами: с атомной орбитали pz атома углерода С(4) на pz атомную орбиталь атома углерода С(5), связанных двойной связью в пиридиновом кольце; с атомной орбитали pz атома углерода С(6) на атомную орбиталь pz атома азота N(1) в пиридиновом кольце молекул.
На основании вышеотмеченного установлено, что в экспериментальных спектрах поглощения в молекуле этионамида и протионамида полоса поглощения с максимумом на длине волны 292±1 нм и линия поглощения на длине волны 328,7 нм для этионамида и 329,4 для протионамида обусловлены переходом электрона связи С=N, либо связи С=С, входящих в структуру пиридина, с молекулярной р - орбитали на вакантную р - орбиталь молекулы ( - * переход).
Согласно расчету в приближении ZINDO/S получено, что линия поглощения пиридоксин гидрохлорида в виде основания на длине волны 269,07 нм обусловлена переходом электрона с 33 атомной орбитали (энергетический уровень соответствует -8,61 эВ) на вакантную 34 атомную орбиталь (энергетический уровень соответствует 0,55 эВ). Линия поглощения пиридоксин гидрохлорида в виде фенолят аниона на длине волны 296,3 нм обусловлена переходом электрона с 32 атомной орбитали (энергетический уровень соответствует -9,73 эВ) на вакантную 33 атомную орбиталь (энергетический уровень соответствует -5,87 эВ). Линия поглощения пиридоксин гидрохлорида в виде пиридиниевого иона на длине волны 307, 38 нм обусловлена переходом электрона с 33 атомной орбитали (энергетический уровень соответствует -8,45 эВ) на вакантную 34 атомную орбиталь (энергетический уровень соответствует -2,70 эВ).
При детальном исследовании атомных орбиталей и их вкладов в занятую и вакантную молекулярные орбитали молекулы пиридоксин гидрохлорида, соответствующие данному переходу, определено, что длина волны поглощения 269,07 нм в молекуле пиридоксин гидрохлорида обусловлена переходом с атомной орбитали pz атома углерода, входящего в пиридиновое кольцо, на атомную орбиталь pz атома азота N в пиридиновом кольце.
Таким образом, установлено, что полосы поглощения пиридоксин гидрохлорида на длинах волн 244±1 нм, 310±1 нм (растворитель – 0,1М раствор гидроксида натрия), 291±1 нм (растворитель – хлористоводородная кислота, этиловый спирт 95 %), 258±1 нм, 291±1 нм, 324±1 нм (растворитель – дистиллированная вода) в экспериментальных спектрах и соответствующие им линии поглощения в теоретических спектрах молекулы пиридоксин гидрохлорида в различных структурных формах обусловлены поглощением квантов света электроном связи С=N, входящей в структуру пиридина. Переход происходит с занятой молекулярной р -орбитали на вакантную р – орбиталь молекулы ( - * переход).
Оптические свойства бициклических производных, содержащих карбонильную группу (ломефлоксацин и рифампицин)
(глава 3)
Исследование спектральных характеристик ломефлоксацина и рифампицина проводилось в тех же условиях, что и спектры поглощения производных пиридина. Концентрация ломефлоксацина в исследуемых растворах составила 0,007 %.
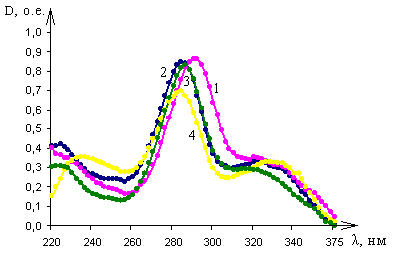 |
| Рис. 5. Спектры ломефлоксацина в: 1 - 95% этиловом спирте; 2 – дистиллированной воде; 3 - 0,1М растворе хлористоводородной кислоты; 4 - 0,1М растворе гидроксида натрия |
Исследования оптических спектров поглощения ломелоксацина показало следующее: спектр оптического поглощения ломефлоксацина при рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты) характеризуется тремя полосами поглощения с максимумами на длинах волн 224±1 нм, 286±1 нм и 315±1 нм (рис. 5, кривая 3). При рН 6,7 (растворитель – 95% этиловый спирт) спектр характеризуется двумя полосами поглощения с максимумами на длинах волн 292±1 нм и 320±1 нм (рис. 5, кривая 1). При рН 5,1 (растворитель – дистиллированная вода) спектр имеет три максимума поглощения на длинах волн 223±1 нм, 285±1 нм и 324±1 нм (рис. 5, кривая 2). При рН 12,5 (растворитель – 0,1М раствор гидроксида натрия) спектр ломефлоксацина характеризуется тремя полосами поглощения с максимумами на длинах волн 234±1 нм, 284±1 и 330±1 нм (рис. 5, кривая 4).
Концентрация рифампицина в исследуемых растворах составила 0,014%.
Исследования оптических спектров поглощения рифампицина показало следующее. В спектрах поглощения рифампицина при переходе от рН 12,5 к рН 1,1 происходит смещение максимумов и минимумов поглощения растворов как в длинноволновую, так и в коротковолновую области спектра (рис. 6). При рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты) спектр поглощения рифампицина характеризуется четырьмя полосами поглощения с максимумами на длинах волн 230±1 нм, 266±1 нм, 336±1 нм и 475±1
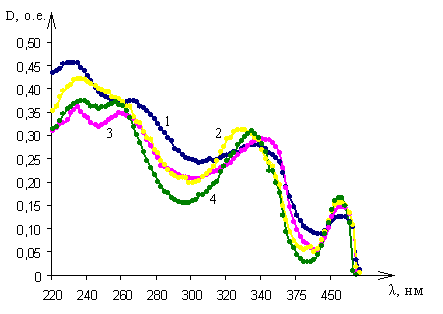 |
| Рис. 6. Спектры оптического поглощения рифампицина в: 1 – 0,1М растворе хлористоводородной кислоты; 2 - 0,1М растворе гидроксида натрия; 3 - этиловом спирте 95%; 4 – дистиллированной воде |
нм (рис. 6, кривая 1). При рН 6,9 (растворитель – этиловый спирт 95%) спектр характеризуется четырьмя полосами поглощения с максимумами на длинах волн 234±1 нм,260±1 нм, 342±1 нм и 475±1 нм (рис. 6, кривая 3). При рН 5,4 (растворитель – дистиллированная вода) спектр имеет четыре максимума на длинах волн 238±1 нм, 256±1 нм, 334±1 нм и 475±1 нм (рис. 6, кривая 4). При рН 12,1 (растворитель – 0,1М раствор гидроксида натрия) спектр характеризуется четырьмя полосами поглощения с максимумами 236±1 нм, 260±1 нм, 328±1 нм, и 475±1 нм (рис. 6, кривая 2).
Молекулы ломефлоксацина и рифампицина являются бициклическими производными (рис. 7). Оптические свойства бициклической структуры схожи со свойствами бензольного кольца. Согласно литературным данным [34,35] бензол дает -, p- и -полосы поглощения с максимумами на длинах волн 255 нм, 204 нм и 184 нм соответственно, увеличивающиеся по интенсивности по мере перехода к более коротким длинам волн. Алкильные заместители смещают максимумы в длинноволновую область спектра, но не меняют в заметней степени интенсивности поглощения. Однако, если с бензольным кольцом сопряжен еще один хромофор, то в спектре появляются новые полосы, поскольку в такой системе есть возможность поглощения, связанного с электронным переходом [35].
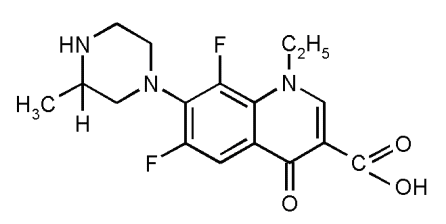 а) а) | 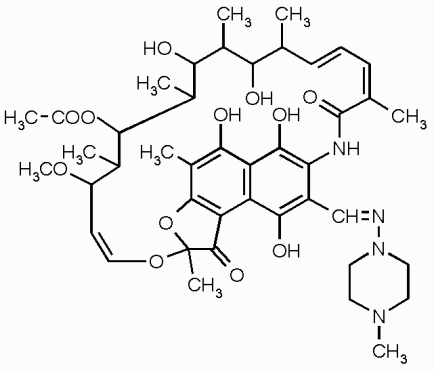 б) б) |
| Рис. 7 Структурные формулы: а) ломефлоксацина; б) рифампицина | |
Согласно экспериментально полученным спектрам поглощения максимумы p-полосы поглощения бициклической структуры ломефлоксацина наблюдаются на длинах волн 224±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1), 223±1 нм (растворитель – дистиллированная вода, рН 5.4), 234±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1). p-, - полосы поглощения в экспериментальных спектрах поглощения ломефлоксацина не зарегистрированы.
В спектрах поглощения рифампицина максимумы p-, - полос поглощения бициклической структуры рифампицина находятся на длинах волн 230±1 нм, 266±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1), 234±1 нм, 260±1 нм (растворитель – этиловый спирт 95 %, рН 6,9), 238±1 нм, 256±1 нм (растворитель – дистиллированная вода, рН 5.4), 236±1 нм, 260±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1).
В структуру ломефлоксацина и рифампицина входит карбонильная группа C=O (рис. 7), которая имеет полосу поглощения в области 270 - 290 нм [34]. В спектрах ломефлоксацина данная полоса поглощения находится на длине волны 286±1 нм при рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты), 292±1 нм при рН 6,7 (растворитель – этиловый спирт 95%), 285±1 нм при рН 5,1 (растворитель – дистиллированная вода) и 284±1 при рН 12,5 (растворитель – 0,1М раствор гидроксида натрия). Полоса поглощения карбонильной группы имеет высокую интенсивность, сдвигается батохромно при замене полярного растворителя неполярным. Все вышеотмеченное позволяет сделать вывод о том, что данная полоса поглощения характеризуется переходом с p-орбитали на вакантную p-орбиталь ( - * переход). Спектры поглощения ломефлоксацина характеризуются еще одной полосой поглощения с максимумом на длине волны 315±1 нм при рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты), 320±1 нм при рН 6,7 (растворитель – этиловый спирт 95%), 324±1 нм при рН 5,1 (растворитель – дистиллированная вода) и 330±1 при рН 12,5 (растворитель – 0,1М раствор гидроксида натрия). Данная полоса поглощения может относиться к карбонильной группе и являться t-полосой поглощения.
Согласно нашим предположениям полоса поглощения карбонильной группы в экспериментально полученных спектрах поглощения рифампицина находится в более длинноволновой области УФ спектра на длине волны 336±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1); 342±1 нм (растворитель – этиловый спирт 95 %, рН 6,9); 334±1 нм (растворитель – дистиллированная вода, рН 5.4); 328±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1).
Для подтверждения сделанных выводов был проведен расчет основных и возбужденных состояний и спектральных характеристик молекулы ломефлоксацина и ее бициклической структуры методом конфигурационного взаимодействия. Геометрия молекул получена методом молекулярной механики ММ+. Результаты рассчитанных оптических характеристик приведены в таблице 3.
Таблица 3. Рассчитанные и экспериментальные спектральные характеристики ломефлоксацина
| Соединение | Рассчитанная длина волны, нм | Сила осциллятора Fосц, о.е. | Экспериментальная длина волны, нм | Оптическая плотность I, о.е. |
| Бициклическая структура ломефлоксацина | 189,7 226,6 256,2 | 0,56 0,32 0,002 | - - - | - - - |
| Ломефлоксацин | 314 329,4 | 0,25 0,003 | 286 324 | 0,86 0,39 |
Для уточнения природы полос поглощения в молекуле рифампицина были проведены теоретические исследования спектров поглощения отдельно бициклической структуры (нафталина), бициклической структуры с пиперазиновым кольцом и бициклической структуры с карбонильной группой в газовой форме. Результаты рассчитанных оптических характеристик приведены в табл. 4-5:
Таблица 4. Рассчитанные и экспериментальные спектральные характеристики нафталина
| Рассчитанная длина волны, нм | Сила осциллятора Fосц, о.е. | Рассчитанная длина волны [38], нм | Сила осциллятора Fосц [38], о.е. | Экспериментальная длина волны, нм | Молярный коэф- фициент поглощения |
| 228,5 295,2 310,3 | 1,657 0,212 - | 225,8 279,5 300,3 | 1,404 0,179 0,002 | 222 286 320 | 19 3520 97500 |
Таблица 5. Рассчитанные и экспериментальные спектральные характеристики структурных фрагментов молекулы рифампицина
| Структурный фрагмент молекулы рифампицина | Рассчитанная длина волны, нм | Сила осциллятора Fосц, о.е. |
| содержащий бициклическую структуру и пиперазин | 220,96 277,92 313,45 402,76 | 0,529 0,891 0,219 0,202 |
| содержащий бициклическую структуру и карбонильную группу | 217,20 262,74 330,20 373,73 | 0,566 0,907 0,036 0,303 |
Согласно расчету в приближении ZINDO/S получено, что линия поглощения ломефлоксацина на длине волны 314 нм обусловлена переходом электрона с 66 атомной орбитали (энергетический уровень соответствует -8,71 эВ) на вакантную 68 атомную орбиталь (энергетический уровень соответствует -0,92 эВ). При детальном исследовании атомных орбиталей и их вкладов в занятую и вакантную молекулярные орбитали, соответствующие данному переходу, определено, что на длине волны поглощения 314 нм в молекуле ломефлоксацина может происходить два перехода: с атомной орбитали pz атома углерода С(6) входящего в бициклическую структуру молекулы ломефлоксацина на pz атомную орбиталь С(10); с атомной орбитали pz атома углерода С(4) на атомную орбиталь pz атома кислорода связи С=О.
На основании проведенных экспериментальных и теоретических исследований можно сделать следующие выводы:
- Полосы поглощения ломефлоксацина с максимумами на длинах волн 224±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1), 223±1 нм (растворитель – дистиллированная вода, рН 5.4), 234±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1) в экспериментальных спектрах и линия поглощения на длине волны 226,6 нм обусловлены переходами электрона, локализованного на атоме углерода в бициклической структуре ломефлоксацина.
- В экспериментальных спектрах полосы поглощения с максимумами на длинах волн 286±1 нм при рН 1,1 (растворитель – 0,1М раствор хлористоводородной кислоты), 292±1 нм при рН 6,7 (растворитель – этиловый спирт 95%), 285±1 нм при рН 5,1 (растворитель – дистиллированная вода), 284±1 при рН 12,5 (растворитель – 0,1М раствор гидроксида натрия) и линия поглощения на длине волны 314 нм в молекуле ломефлоксацина обусловлены переходами электронов, локализованными на атоме кислорода, входящего в карбонильную группу. Полосы поглощения соответствуют переходам электронов на атомной орбитали pz, образующих хромофор С=О. Полосы поглощения соответствуют переходам электронов связи С=О с занятой молекулярной p - орбитали на вакантную p - орбиталь молекулы (- * переход).
Согласно расчету в приближении ZINDO/S получено, что линия поглощения структурного фрагмента рифампицина, содержащего бициклическую структуру и пиперазин, на длине волны 402,76 нм обусловлена переходом электрона с 49 атомной орбитали (энергетический уровень соответствует -7,47 эВ) на вакантную 50 атомную орбиталь (энергетический уровень соответствует -0,51 эВ). При детальном исследовании атомных орбиталей и их вкладов в занятую и вакантную молекулярные орбитали, соответствующие данному переходу, определено, что длина волны поглощения 402,76 нм в молекуле рифампицина обусловлена следующими переходами: с атомной орбитали pz атома углерода С(3) входящего в бициклическую структуру молекулы рифампицина на pz атомную орбиталь атома углерода С(4); с атомной орбитали pz атома углерода С(11) на атомную орбиталь pz атома азота N(17) связи С=N.
Линия поглощения структурного фрагмента рифампицина, содержащего бициклическую структуру и карбонильную группу (приложение 5.3), на длине волны 373, 73 нм обусловлена переходом электрона с 52 молекулярной орбитали (энергетический уровень соответствует -7,58 эВ) на вакантную 53 молекулярную орбиталь (энергетический уровень соответствует -0,79 эВ). При детальном исследовании атомных орбиталей и их вкладов в занятую и вакантную молекулярные орбитали, соответствующие данному переходу, определено, что на длине волны поглощения 373,73 нм в молекуле рифампицина может происходить переходы: с атомной орбитали pz атома углерода С(1) входящего в бициклическую структуру молекулы рифампицина на pz атомную орбиталь атома углерода С(2); с атомной орбитали pz атома углерода С(6) входящего в бициклическую структуру молекулы рифампицина на pz атомную орбиталь атома углерода С(7); с атомной орбитали pz атома углерода на атомную орбиталь pz атома кислорода связи С=О.
Таким образом, согласно расчету спектральных характеристик методом конфигурационного взаимодействия и экспериментальным исследованиям можно сделать следующие выводы:
- Полосы поглощения рифампицина с максимумами на длинах волн 230±1 нм, 266±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1), 234±1 нм, 260±1 нм (растворитель – этиловый спирт 95 %, рН 6,9), 238±1 нм, 256±1 нм (растворитель – дистиллированная вода, рН 5.4), 236±1 нм, 260±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1) в экспериментальных спектрах и линии поглощения на длинах волны 228,5 нм и 295,2 нм относятся к переходам валентного электрона, локализованного на атоме углерода в бициклической структуре рифампицина (- * переход).
- Полосы поглощения рифампицина с максимумами на длинах волн 336±1 нм (растворитель – 0,1М раствор хлористоводородной кислоты, рН 1,1), 342±1 нм (растворитель – этиловый спирт 95%, рН 6,9), 334±1 нм (растворитель – дистиллированная вода, рН 5.4) и 328±1 нм (растворитель – 0,1М раствор гидроксида натрия, рН 12,1) в экспериментальных спектрах поглощения и линия поглощения на длине волны 373,73 нм в теоретическом спектре поглощения относятся к переходу электрона, локализованного на атоме кислорода в карбонильной группе с занятой p - орбитали на вакантную p - орбиталь (- * переход).
- Полоса поглощения рифампицина с максимумом на длине волны 475±1 нм в различных растворителях в экспериментальных спектрах и линия поглощения на длине волны 402,76 нм в теоретическом спектре поглощения обусловлены переходом валентного электрона в хромоформе C=N с занятой p -орбитали на вакантную p -орбиталь (- * переход).
Люминесцентные свойства ломефлоксацина
(глава 4)
В последние годы для исследования природы в однофотонном процессе переходов молекул, в том числе молекул содержащих кислород, в УФ и видимой областях спектра применяется метод многофотонного поглощения, который обладает высокой чувствительностью и селективностью.
Молекула ломефлоксацина имеет сложную структуру и для подтверждения интерпретации полос поглощения ломефлоксацина был проведен дополнительный опыт по спектрально кинетическим характеристикам катодо- и фотолюминесценции ломефлоксацина.
Технические характеристики и структурные схемы экспериментальных установок для исследования катодолюминесценции (КЛ) и фотолюминесценции (ФЛ) бициклических производных, содержащих карбонильную группу, приведены в первой главе диссертации. В качестве источника излучения для исследования катодолюминесценции применялся импульсный ускоритель «СЭМИТРОН» с энергией электронов 250-300 кэВ, имеющий плотность тока 0,05-2 кА\см2 и частоту следования импульсов 0,1-10 Гц, длительность импульса равнялась 1 нс. В качестве источника излучения для исследования фотолюминесценции применялся азотный лазер ЛГИ-21, длина волны генерации которого равна 337 нм, ширина линии = 0,01 нм, мощность импульса излучения - 1 кВт, длительность импульса – 7 нс.
Спектры катодо- и фотолюминесценции представлены на рис. 8.
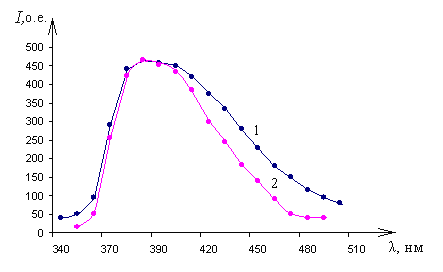 а) а) | 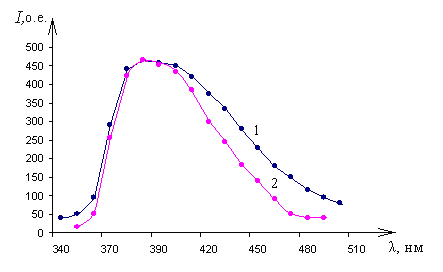 б) б) |
| Рис. 8 Спектры ломефлоксацина при температуре 78 К, 300 К и 600 К: а) катодолюминесценции; б) фотолюминесценции | |
Из представленных рисунков видно, что возбуждение конденсированного вещества ломефлоксацина сопровождается широкополосной люминесценцией с максимумом излучения на длине волны 390 нм. Осциллограммы затухания импульсов катодолюминесценции на длине волны 390 нм представлены на рис. 9.
Видно, что люминесценция в материале ломефлоксацин является малоинерционной ( < 12 нс), не зависит от температуры (78 – 300К) и обладает такими же спектральными и кинетическими параметрами как и широкополосная катодолюминесценция [85]. Выход этой КЛ так же, как и в средах Al2O3, CaCO3, SiO2, H2O, равен ~ 10-3 и не зависит от температуры ((78–300) К). При этом излучательное время КЛ тоже не изменяется. Кроме того, в ломефлоксацине спектральное положение полосы КЛ при 390 нм такое же, как и в указанных неорганических кристаллах.
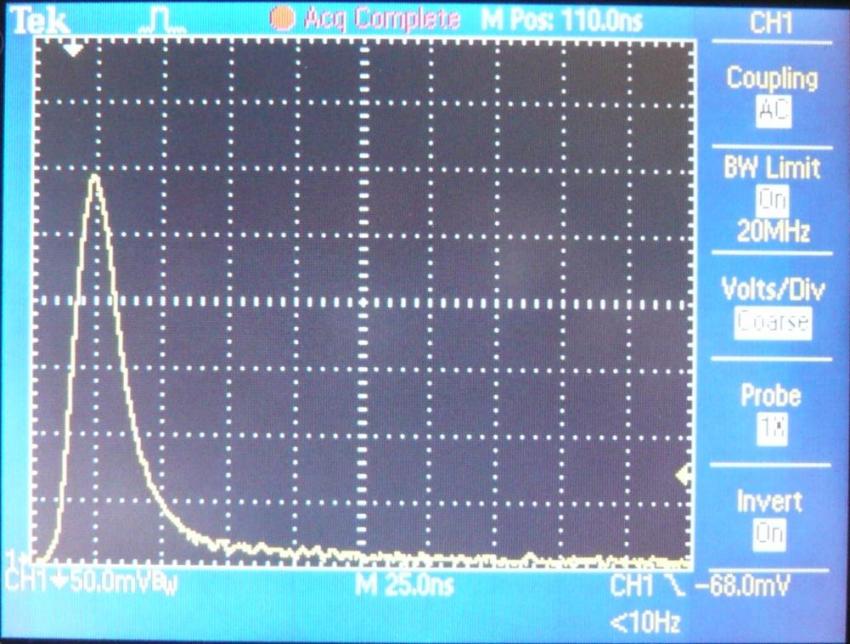 |
| Рис. 9 Осциллограмма затухания импульса катодолюминесценции ломефлоксацина при температуре 78, 300 К |
На основе данного анализа можно считать, что и в ломефлоксацине за катодо- и фотолюминесценцию на длине волны 390 нм ответственны излучательные переходы электронов в валентной зоне, образованной 2p состояниями O2-.
Ширина запрещенной зоны ломефлоксацина по нашим расчетам составляет Eg=3,3 эВ. Энергия фотона лазерного излучения при 337 нм – 3,7 эВ. Для того чтобы произвести ионизацию электрона с глубокого уровня валентной зоны необходимо реализовать режим двухфотонного поглощения.
Широкополосная малоинерционная ФЛ наблюдается при мощном лазерном (337 нм) воздействии. Поэтому очевидно, что в эксперименте реализовывался режим двухфотонной ионизации в процессе возбуждения электронов кислорода с p-орбитали валентной зоны. Для уточнения была снята зависимость выхода малоинерционной люминесценции от интенсивности лазерного воздействия. Исследование проводилось на установке, описанной в первой главе диссертации.
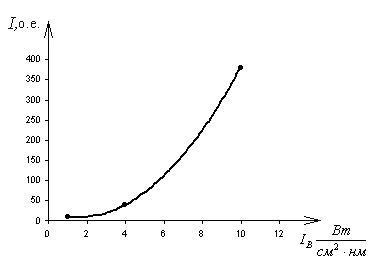 |
| Рис. 9 Зависимость интенсивности люминесценции ломефлоксацина от интенсивности лазерного возбуждения |
Полученная в эксперименте квадратичная зависимость (рис. 9) выхода малоинерционной люминесценции от плотности мощности лазерных импульсов подтверждает двухфотонный этап ионизации в процессе возбуждения 2p электронов, локализованных на атомах кислорода.
Все вышесказанное позволило установить, что возбуждение фотолюминесценции происходит по двухфотонному механизму. Под действием излучения 2h > Eg происходит переход электронов, локализованных на атоме кислорода, на вакантную p-орбиталь при поглощении энергии световой волны 2h, вследствие чего происходит излучательный переход электронов с максимумом на длине волны 390 нм.
На основе проведенных исследований оптических свойств производных пиридина и бициклических соединений, содержащих карбонильную группу, были разработаны и приведены в главе 5 оригинальные методики количественного определения методом оптического стандарта лекарственных веществ: этионамида, протионамида, пиридоксин гидрохлорида, ломефлоксацина, рифампицина. Данные методики отличаются доступностью, отсутствием экологически вредных растворителей, относительная погрешность определения не превышает 0,6 %. Разработанные методики количественного определения указанных веществ могут быть использованы для обнаружения в них специфических примесей, отличающихся по оптическим свойствам. Сравнение результатов количественного определения исследуемых органических соединений по разработанным методикам и методикам, рекомендованным нормативной документацией [10], показало их совпадение, но для некоторых веществ разработанные методики показали более достоверные результаты. Все методики были апробированы на фармацевтическом предприятии ОАО «Фармасинтез», методики количественного определения этионамида и рифампицина защищены патентом РФ на изобретение.
ЗАКЛЮЧЕНИЕ
На основании изучения оптических свойств пиридоксин гидрохлорида, этионамида, ломефлоксацина, рифампицина получены следующие результаты:
- Экспериментально установлено, что в растворах с различными значениями pH молекулы этионамида и протионамида не меняют своих структур, а молекула пиридоксин гидрохлорида принимает несколько форм в зависимости от pH раствора: в 0,1М растворе хлористоводородной кислоты и растворе 95% этилового спирта находится в виде пиридиниевого иона, в 0,1М растворе гидроксида натрия – в виде основания и фенолят-аниона, в дистиллированной воде – во всех трех формах (основание, пиридиниевый ион, фенолят-анион).
- Методом конфигурационного взаимодействия интерпретированы максимумы полос поглощения в молекуле этионамида на длине волны 292±1 нм в 95% этиловом спирте и в молекуле пиридоксин гидрохлорида на длинах волн при 244±1 нм и 310±1 нм в 0,1М растворе гидроксида натрия переходом электрона связи С=N, либо связи С=С, входящих в структуру пиридина, с молекулярной р - орбитали на вакантную р - орбиталь молекулы ( - * переход).
- Экспериментально установлено, что в растворах с различными значениями pH молекулы ломефлоксацина и рифампицина не меняют своих структур, а небольшое смещение максимумов полос поглощения происходит за счет влияния растворителей на атомы исследуемых молекул.
- Методом конфигурационного взаимодействия определено, что максимумы полос поглощения в молекулах ломефлоксацина на длине волны 285±1 нм в растворе дистиллированной воды и в молекуле рифампицина на длине волны 342±1 нм в 95% растворе этилового спирта обусловлены переходами электронов на атомной орбитали pz, образующих хромофор С=О. Полосы поглощения соответствуют переходам электронов связи С=О с занятой молекулярной p - орбитали на вакантную p - орбиталь молекулы (- * переход).
- Полосы поглощения с максимумами на длине волны 475±1 нм в различных растворителях в экспериментальных спектрах и линия поглощения на длине волны 402,76 нм в теоретическом спектре поглощения рифампицина обусловлены переходом валентного электрона в хромоформе C=N с занятой p -орбитали на вакантную p -орбиталь (- * переход).
- Установлено, что возбуждение в полосе поглощения ломефлоксацина с максимумом на длине волны 324±1 нм происходит вследствие двухфотонного поглощения и сопровождается катодо- и фотолюминесценцией на длине волны 390 нм, которая обусловлена излучательными переходами электронов, локализованных на атоме кислорода в 2p-состоянии валентной зоны.
- Разработаны методики спектрофотометрического определения пиридоксин гидрохлорида, этионамида, протионамида, ломефлоксацина и рифампицина с использованием оптических образцов сравнения, две из которых защищены патентом РФ на изобретение. Погрешность определения веществ разработанными методами не превышает 0,6 %.
ЦИТИРУЕМАЯ ЛИТЕРАТУРА
- Пасынков, В.В. Материалы электронной техники / В.В. Пасынков, В.С. Сорокин // СПб.:Лань, – 2003. – 368 с.
- Trukhanov, V. A. "Effect of doping on performance of organic solar cells" / V. A. Trukhanov, V. V. Bruevich, and D. Yu. Paraschuk // Phys. Rev. – 2011. – Bып. 84, N. 20.-P. 205318-205322.
- Теренин, А.Н. Фотоника молекул красителей и родственных органических соединений. / А.Н. Теренин // – Л.: Наука. – 1967. –616 с.
- Давиденко, И.Г. Природа электронных переходов в цианиновых красителях, производных 7,8-дигидробензо[c,d]фуро[2,3-f]индола / И.Г. Давиденко, А.Д. Качковский, Ю.Л. Сломинский, А.И. Толмачев // УКР. ХИМ. ЖУРН. – 2008. – Т. 74. – № 6. – С. 110-116.
- Haugland, R.P. Handbook of Fluorescent probes and Research Products. / R.P. Haugland // 7th Edition/ Molecular Probes. – 2002.
- Пат. № 2177487, Российская Федерация МПК C09B23/00, G03C1/08. Соли 3,3’-ди--сульфоалктлтиакарбоцианинбетаинов, в качестве спектральных сенсибилизаторов и способ спектральной сенсибилизации галогенсеребряных фотографических имульсий с их применением / Э.Б. Лифшиц; В.Н. Подлесных; М.Н. Ушомирский; Л.В. Формина; А.А. Фадеев; Заявитель и патентообладатель ЗАО Научно-производственное объединение "ФОМОС". - № 2000117088/04; заявл. 03.07.2000, опубл. 27.12.2001, Бюл. №14. – С. 6.
- Красовицкий, Б.М. Органические люминофоры. / Б.М. Красовицкий, Б.М. Болотин // М.: Химия. – 1984. – 336 с.
- Нурмухаметов, Р.Н. Связь между спектрами и строением молекул люминофоров, применяемых в сцинтилляторах / Р.Н. Нурмухаметов, Л.Л. Нагорная // Оптика и спектроскопия. – 1965. – Т. 18. – Вып. 1. – С. 109-114.
- Erceler, S Ultrasensitive fluorescent probe for the hydrophobic range of solvent polarities. / S. Erceler, A.S. Klymchenco, A.P. Demchenco. // Anal. Chim. Acta. – 2002. – V. 464. – P. 273-287.
- Яхонтов, Л.Н. Синтетические лекарственные средства / Л.Н. Яхонтов, Р.Г. Глушков // М.: Медицина. – 1983. –272 с.
- Romero, T. Synthesis, structural charaterization, and electrochemical and optical properties of ferrocene-triazole-pyridine triads. / T. Romero, R. A Orenes, A. Espinosa, A. Trraga, P. Molina // Inorg. Cryst. Chem. – 2011. – V. 5. – № 17. – P. 8214 – 8224.
- Разумов В.Ф. Прогресс в области исследования и разработок органических и гибридный материалов для нанофотоники. / В.Ф Разумов, Алфимов // Труды МФТИ. – 2011. – Т. 3. – № 4. – С. 22-32.
- Плотников, Г.С. Физические основы молекулярной электроники / Г.С. Плотников, В.Б. Зайцев // М: Физ. Фак. МГУ. – 2000. – С. 337.
- Преображенский, Н.А. Химия органических лекарственных веществ / Н.А. Преображенский, Э. И. Генкин // ГОСХИМИЗДАТ, 1953. – С 595.
- Машковский М.Д. Лекарства ХХ века / М.Д. Машковский //М.: ООО «Издательство Новая Волна». – 1998. – С. 320.
- Коренева, Л.Г. Нелинейная оптика молекулярных кристаллов / Л.Г. Коренева, В.Ф. Золин, Б.Л. Давыдов. – М.: Наука. – 1985. – 200 с.
- Ito, K. Asymmetric Allylic Alkylation Using a Palladium Complex of Chiral 2-(Phosphinoaryl)pyridine Ligands / K. Ito, R. Kashiwagi, K. Iwasaki, T. Katsuki // Synlett. – 1999. – №10. – P. 1563-1566.
- Пат. № 2442785, Российская Федерация МПК C07D471/04, A61K31/437, A61P19/00, A61P35/00, A61P25/00. Производные 2-бензоил-имидазо [1,2-а]пиридина, их получение и их применение в терапии / Жан-Франсуа Пэронель; Заявитель и патентообладатель Санофи-Авентис. - № 2010132243/04; заявл. 31.12.2008, опубл. 02.08.2010, Бюл. №14. – С. 6.
- Plotnikov, V.G. Intermolecular Interactions an Spectral and Luminescent Properties of Optical Molecular Sensors / V.G. Plotnikov, V.A. Sazhnikov M.V. Alfimov // High Energ Chemistry. – 2007. – V. 41. – № 5. – P. 299-311.
- Kao, К. Перенос электронов в твердых телах: Электрические свойства органических полупроводников. / К. Kao, Хуанг // М.: Мир. – 1984. – С. 720.
- Свечкарев, Д.А. Синтез и спектральные свойства новых люминесцентных соединений с реакцией внутримолекулярного фотопереноса протона – производных 2-(N-метилизохинолон-1(2H)-4-ил)- 3 – гидроксихромона / Д.А. Свечкарев, Г.В. карпушина, А.О. Дорошенко // Органическая химия и спектроскопия. – 2007. – Вып. 15 (38).– №770. – С.201-207.
- Григорович, А.В. Строение молекул и спектрально-флуоресцентные свойства структурно жестких аналогов 2,6-дистирилпиридина / А.В. Дорошенко, С.М. Москаленко, А.В. Невский, В.Г. Пивоваренко // Органическая химия и спектроскопия. Вестник Харьковского национального университета. – 2009. – Т. 42. – Вып. 17(40). – С. 125-137.
- Аниськов, А.А Определение строения карбо- и гетероциклических соединений спектральными методами / А.А. Аниськов, И.Э. Варшаломидзе, А.Г. Голиков, О.А. Григорьева, И.Н. Клочкова, А.П. Кривенько, А.Ю. Никишин, Н.В. Поплевина, В.В. Сорокин, О.В. Федотова, Ю.А.Фомина, М.П. Щекина // Саратов: ИЦ «Наука». – 2010. – 234 с.
- Малыхина, О.И. Идентификация анилина методом колебательной спектрофотометрии / О.И. Малыхина, В.К. Шорманов // Сб. раб. 69-й итог, науч. сес. КГМУ и отд-ния мед. биолог, наук Центр. - Чернозём, науч. центра РАМН. – Курск. – 2004. – С. 288-289.
- Vankeirsbilck, T. Applications of Raman spectroscopy in pharmaceutical analysis / T. Vankeirsbilck, A. Vercauteren, W. Baeyens, G. Van der Weken, F. Verpoort, G. Vergote, J.P. Remon // Trends in analytical chemistry. – 2002. –V. 21 – № 12 – P. 869-877.
- Warner, I.M. Multicomponent analysis in clinical chemistry by use of rapid scanning fluorescence spectroscopy. / I.M. Warner, J.B. Callis, E.R. Davidson, G.D. Christian // Clin. Chem. – 1976. – V. 22. – №. 9. – P. 1483-1486.
- Романовская, Г.И. Новые методы и подходы в люминесцентном анализе. / Г.И. Романовская // Журн. аналит. химии. – 1993. – Т. 48. – № 2. – С. 198-216.
- Драго, Р. Физические методы в химии. / Р. Драго // М.: Мир. – 1981. –424 с.
- Гризодуб, А.И. Спектрофотометрический анализ в контроле качества многокомпонентных лекарственных средств / А.И. Гризодуб, В.П. Георгиевский // Лекарственные средства. Экономика, технология и перспективы получения: Обзор. информ.– М.: ВНИИСЭНТИ. – 1988. – Вып. 9.– С. 52.
- Илларионова, Е.А. Спектрофотометрический анализ лекарственных средств производных ароматического и гетероциклического рядов / Е.А. Илларионова // Люминесценция и сопутствующие явления: (труды шк. - семинара) – Иркутск. –1997. – С.48-53
- Илларионова Е.А. Совершенствование спектрофотометрического и хроматографического методов анализа азотсодержащих лекарственных средств. / Е.А. Илларионова // Диссерт. : д-ра хим. наук. – 2005.
- Илларионов, А.И. Основные погрешности спектрофотометрического анализа лекарственных средств при использовании оптического эталона / И.А. Илларионов, Е.А. Илларионова, О.Л. Никонович // Сборник тезисов по материалам X международной школы - семинар «Люминесценция и лазерная физика - 2006» –, Иркутск: ИГУ. – 2006. – С. 45-47.
- Максютина, Н.П. Методы анализа лекарств. / Н.П. Максютина, Ф.Е. Каган, Л.А. Кириченко и др. / Киев: Здоровье. – 2004. – 222 с.
- Авраменко, В.И. Молекулярная спектроскопия и строение органических соединений / В.И. Авраменко, М.П.Хмель // Днепропетровск ДГУ. – 1986. – 88 с.
- Вайсбергер, А. Установление Структуры органических соединений физическими и химическими методами / А. Вайсбергер // М. : Химия, 1967. – 532 с.
- Alleaume, M. Structure Cristalline de Composes Antituberculeus. IV. Structure Cristalline de l’Ethyl-2 Thiocarbamoyl-4 Pyridine / M. Alleaume, F. Leroy, M. Gadret, M. Goursolle // Acta Cryst. – 1973. – V. 29. – P. 1994-2000.
- Colleter, C. Structure cristalline de composs antituberculeux. III. Structure cristalline de la propyl-2-thiocarbamoyl-4-pyridine / J. C. Colleter, M. Gadret et M. Coursolle // Acta Cryst. – 1970. – V. 26. – P. 1510-1518.
- Привалова, А.И. Спектрально-люминесцентные свойства 1-замещенных нафталина / А.И. Привалова, Ю.П. Морозова, Э.Р. Кашапова, В.Я. Артюхов // Журнал прикладной спектроскопии. – 2011. – Т. 78. –Вып. 3. – С. 333-341.
- Барышников, В.И. Широкополосное малоинерционное свечение оксидных монокристаллов, возбуждаемое мощными пучками электронов / В.И. Барышников, Л.И. Щепина, Т.А. Колесникова, Е.Ф. Мартынович // Физика твердого тела. – 1990. – Т. 32. – № 6. – С. 1888-1890.
ПУБЛИКАЦИИ ПО ТЕМЕ ДИССЕРТАЦИИ
- Пат. № 2389012, Российская Федерация МПК А61К 31/498. Способ
определения этионамида / А.И. Илларионов, Н.М. Пантелеева,
Е.А. Илларионова, О.Л. Никонович; Заявитель и патентообладатель ГОУ ВПО ИрГУПС (ИрИИТ). - №2008117552/15; заявл. 30.04.2008, опубл. 10.05.2010, Бюл. №13. – С. 6. - Пат. № 2390016, Российская Федерация МПК А61К 31/498. Способ
определения рифампицина / А.И. Илларионов, Н.М. Пантелеева,
Е.А. Илларионова, О.Л. Никонович; Заявитель и патентообладатель ГОУ ВПО ИрГУПС (ИрИИТ). - № 2008124574/15; заявл. 16.06.2008, опубл. 20.05.2010, Бюл. № 14. – С. 7. - Illarionov, A.I. Basic Errors of the Spectrophotometric Analysis of Medicinal Substances at Use of the Optical Snandart / A.I. Illarionov, E.A. Illarionova, O.L. Niconovich // Известия высших учебных заведений. Физика. – 2008. – Т. 51 – №10/2 – С. 169-173.
- Пантелеева, Н.М. Количественное определение 1-этил-6,8-дифтор-1,4 дигидро-7-(3 метил-1-пиперазинил)-4-оксохинолин-карбоновой кислоты спектрофотометрическим методом / Н.М. Пантелеева, Е.А. Илларионова, И. П. Сыроватский, О. Л. Никонович // Известия ВУЗов. Сер. Химия и химическая технология. – 2008. – Т. 51, вып. 12. – С. 6-9.
- Илларионов, А.И. Спектрофотометрическое определение 2-этил-4-тиокарбомоил-4пиридина по оптическому образцу сравнения диметиловому желтому / А.И. Илларионов, Н.М. Пантелеева, Е.А. Илларионова, О.Л. Никонович. // Известия высших учебных заведений. Физика. – 2009. – Т.52 – №12/3– С. 127-131.
- Никонович О.Л. Спектры поглощения и нелинейно-оптические свойства этионамида и его оптического образца сравнения / О.Л. Никонович, А.И. Илларионов, Е.А. Илларионова, А.А. Старченко. // Известия высших учебных заведений. Физика. – 2011. – Т.54 – №2/2 –С. 233–236.
- Никонович, О.Л. Спектрофотометрическое определение и оптические свойства 2-метил-3окси-4,5ди-(оксиметил)-пиридина гидрохлорида / О.Л. Никонович, Е.А. Илларионова, А.И. Илларионов, Н.М. Пантелеева, С.В. Бойченко. // Известия высших учебных заведений. Физика. – 2011. – Т.54 – №2/2 –С. 227–232.
- Илларионов, А.И. Основные погрешности спектрофотометрического анализа лекарственных средств при использовании оптического эталона / А.И. Илларионов, Е.А. Илларионова, О.Л. Никонович // Сборник тезисов лекций и докладов по материалам X международной школы - семинара по люминесценции и лазерной физике – Иркутск: ИГУ – 2006. – С. 45-46.
- Артасюк, Е.М. / Спектрофотометрический анализ вещества по оптическому эталону. Е.М. Артасюк, А.И. Илларионов, Е.А. Илларионова, О.Л. Никонович // Сборник трудов VII международной конференции «Прикладная оптика – 2006». – Санкт-Петербург. – Т. 2 - С. 250-254.
- Илларионов, А.И. Оптические эталоны для спектрофотометрического анализа лекарственных средств / А.И. Илларионов, Е.А. Илларионова, О.Л. Никонович, Н.М. Пантелеев // Труды X Международной школы-семинара «Люминесценция и лазерная физика». – Иркутск: ИГУ, 2007. – С. 149–156.
- Пантелеева, Н.М. Новый вариант спектрофотометрического определения этионамида / Н.М. Пантелеева, Е.А. Илларионова, О.Л. Никонович // Тезисы лекций и докладов ХI Международной школы-семинара по люминесценции и лазерной физике. – Иркутск: ИГУ, 2008. – С. 83–84.
- Пантелеева, Н.М. Исследование оптических свойств этионамида / Н.М. Пантелеева, Е.А. Илларионова, О.Л. Никонович // Межвузовский сборник научных трудов «Естествознание и гуманизм. Современный мир, природа и человек». – Томск, 2008. – Т. 5. – № 1. – С. 25-26.
- Илларионова, Е.А. Спектрофотометрическое определение 2-метил-3-окси-4,5ди-(оксиметил)-пиридина гидрохлорида по оптическому образцу сравнения калия феррицианиду / Е.А. Илларионова, Н.М. Пантелеева, О.Л. Никонович // Сб. материалов Международной научной конференции «Оптика кристаллов и наноструктур» – Хабаровск, 2008. – С. 121–125.
- Никонович, О.Л. Спектрофотометрическое определение и нелинейно-оптические свойства 2-метил-3окси-4,5ди-(оксиметил)-пиридина гидрохлорида / О.Л. Никонович, Н.М. Пантелеева, Е.А. Илларионова, А.И. Илларионов // Сборник тезисов лекций и докладов по материалам XII международной школы - семинара по люминесценции и лазерной физике – Иркутск: ИГУ, 2010. – С. 166-167.
- Никонович, О.Л. Нелинейно-оптические свойства производных пиридина и производных пиперазина / О.Л. Никонович, А.И. Илларионов // Сборник трудов VII Международной конференции молодых ученых и специалистов “Оптика – 2011”. – Санкт Петербург. –2011. – С. 192 - 193.
- Барышников, В.И. Малоинерционная люминесценция органических кислородсодержащих соединений / В.И. Барышников, А.И. Илларионов, О.Л. Никонович // Сборник тезисов лекций и докладов по материалам международной молодежной конференции по люминесценции и лазерной физике – Иркутск: ИГУ, –2012. – С. 118-119.
- Никонович, О.Л. Ультрафиолетовые спектры поглощения протионамида / О.Л. Никонович, А.И. Илларионов, Е.А. Илларионова // Сборник тезисов лекций и докладов по материалам международной молодежной конференции по люминесценции и лазерной физике – Иркутск: ИГУ, –2012. – С. 119-120.

