Синтез производных декагидро-клозо-декаборатного аниона и изучение их методом спектроскопии ямр
На правах рукописи
ПРИКАЗНОВ АЛЕКСАНДР ВЯЧЕСЛАВОВИЧ
СИНТЕЗ ПРОИЗВОДНЫХ
ДЕКАГИДРО-КЛОЗО-ДЕКАБОРАТНОГО АНИОНА
И ИЗУЧЕНИЕ ИХ МЕТОДОМ СПЕКТРОСКОПИИ ЯМР
02.00.08 – Химия элементоорганических соединений
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Москва-2013
Работа выполнена в Государственном научном центре Российской Федерации «Государственный ордена Трудового Красного Знамени научно-исследовательский институт химии и технологиии элементоорганических соединений» (ГНЦ РФ «ГНИИХТЭОС»), и в Федеральном государственном бюджетном учреждении науки Институте элементорганических соединений им. А.Н. Несмеянова Российской академии наук (ИНЭОС РАН).
Научный руководитель: Кандидат химических наук
Сиваев Игорь Борисович
ИНЭОС РАН, г. Москва
Официальные опоненты: доктор химических наук, профессор
Шелудяков Виктор Дмитриевич
ГНЦ РФ «ГНИИХТЭОС», г. Москва
доктор химических наук
Жижин Константин Юрьевич
ИОНХ РАН, г. Москва
Ведущая организация:
ФГБОУ ВПО «Московский Государственный университет тонких химических технологий им. М.В. Ломоносова», г. Москва
Защита диссертации состоится 2013 г. в на заседании Диссертационного совета Д 217.033.01 при Государственном научном центре Российской Федерации «Государственный ордена Трудового Красного Знамени научно-исследовательский институт химии и технологии элементоорганических соединений» (ГНЦ РФ «ГНИИХТЭОС») по адресу: 105118, г. Москва, шоссе Энтузиастов, 38.
С диссертацией можно ознакомиться в библиотеке ГНЦ РФ «ГНИИХТЭОС».
Ученый секретарь
Диссертационного совета Д 217.033.01 Сахаровская
Кандидат химических наук Галина Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Клозо-полиэдрические гидриды занимают особое место в химии бора и, наряду с фуллеренами, являются одними из немногих примеров кластеров, не содержащих атомов металла. Как само существование, так и химические свойства полиэдрических гидридов бора определяются наличием делокализованых электронов и пространственно-ароматическим характером химической связи в этих системах. С ароматической природой полиэдрических гидридов связаны особенности их свойств, отличающие их от большинства гидридных соединений бора: высокая устойчивость борного остова и ярко выраженная тенденция к реакциям замещения атомов водорода. Декагидро-клозо-декаборатный анион [B10H10]2-, синтез которого был впервые описан в 1959 году, является первым представителем семейства клозо-полиэдрических гидридов. Несмотря на то, что за последние пятьдесят лет производные декагидро-клозо-декаборатного аниона были предметом многочисленных исследований, его химия остается все еще недостаточно изученной по сравнению с другими представителями кластерных гидридов бора, такими как икосаэдрические карбораны C2B10H12, клозо-додекаборатный анион [B12H12]2-, карба-клозо-додекаборатный анион [CB11H12]- и бис(дикарболлид) кобальта [3,3’-Co(1,2-C2B9H11)2]-. Это диктует необходимость дальнейших как теоретических, так и экспериментальных исследований в этой области. Одной из возможных областей применения клозо-полиэдрических гидридов бора является ядерная медицина, в частности бор-нейтронозахватная терапия рака (БЗНТ) и радионуклидная диагностика, развитие которых требует разработки новых методов направленного синтеза соединений на основе клозо-декаборатного аниона, способных селективно накапливаться в клетках опухоли.
Целью настоящей работы является разработка новых методов получения функциональных производных декагидро-клозо-декаборатного аниона, пригодных для создания медицинских препаратов, в том числе, синтез и характеризация борсодержащих кислот и аминокислот на основе аниона [B10H10]2-.
Научная новизна и практическая ценность. В результате работы синтезирован широкий спектр новых производных на основе клозо-декаборатного аниона с заместителями различного типа.
Разработан новый препаративный способ синтеза 2-гидроксипроизводного клозо-декаборатного аниона [2-B10H9OH]2- в виде его калиевой соли, легко растворимой в воде и не содержащей примесей продуктов с более высокой степенью замещения. Изучены реакции алкилирования гидроксипроизводных клозо-декаборатного аниона [1-B10H9OH]2- и [2-B10H9OH]2- различными алкилгалогенидами и получен ряд соответствующих алкоксипроизводных [1-B10H9OR]2- и [2-B10H9OR]2-.
Изучено взаимодействие циклических оксониевых производных клозо-декаборатного аниона [2-B10H9O(CH2)4]- и [2-B10H9O(CH2CH2)2O]- с гидроксибензойными кислотами, выделены и охарактеризованы продукты раскрытия оксониевого цикла двумя различными нуклеофильными центрами. Реакцией циклических оксониевых производных с метиловыми эфирами гидроксибензойных кислот и последующим гидролизом сложных эфиров получен ряд бензойных кислот на основе клозо-декаборатного аниона. Методом спектроскопии ЯМР 1H установлено образование в растворе устойчивых протонированных форм эфиров [2-B10H9O(H)R]-, которые также могут быть выделены в твердом виде. Взаимодействием [2-B10H9O(CH2)4]- с цианид-ионом получен соответствующий нитрил, гидролиз которого приводит к образованию алифатической кислоты [2-B10H9O(CH2)4COOH]2-. Взаимодействием [2-B10H9O(CH2CH2)2O]- с эфирами -аминокислот H2N(CH2)nCOOEt с последующим гидролизом получены соответствующие кислоты [2-B10H9(OCH2CH2)2NH2(CH2)nCOOH]- (n = 1,3).
Раскрытием циклических оксониевых производных клозо-декаборатного аниона этиловым эфиром N-трифторацетил-L-тирозина с последующим снятием N-трифторацетильной и O-этильной защитных групп, получены соответствующие борсодержащие тирозины.
Реакцией диазониевого производного [1-B10H9N2]- c 1,4-диоксаном получено аксиально-замещенное циклическое оксониевое производное [1-B10H9O(CH2CH2)2O]-.
Рассмотрено использование спектроскопии ЯМР не только в качестве инструмента идентификации новых производных на основе клозо-декаборатного аниона, но и как самостоятельный инструмент изучения борных соединений. С помощью спектроскопии ЯМР 1H установлено, что 2-клозо-декаборанильная группа [2-B10H9-]2- проявляет более сильные донорные свойства, нежели 1-клозо-декаборанильная группа [1-B10H9-]2-. С помощью спектроскопии ЯМР 11B изучено влияние различных заместителей в производных аниона [B10H10]2- в процессе замещения протия на дейтерий, как модели простейшей реакции электрофильного замещения. Определена зависимость глубины и последовательности протекания дейтерообмена от электронных свойств и положения заместителя.
Полученные функциональные производные на основе декагидро-клозо-декаборатного аниона могут быть использованы для синтеза препаратов борнейтронозахватной терапии и радионуклидной диагностики рака.
Апробация работы. Результаты диссертационной работы были представлены на следующих международных и отечественных конференциях: IV Всеукраинской конференции молодых ученых и студентов по актуальным проблемам химии (Днепропетровск, 2006), V Всероссийской конференции по химии кластеров и полиядерных соединений “Кластеры-2006” (Астрахань, 2006), XV Международной конференции “Физические методы в координационной и супрамолекулярной химии ” (Кишинев, Молдова, 2006), IX научной школы-конференции по органической химии (Москва, 2006), IV Международной конференции по химии бора “EUROBORON 4” (Бремен, Германия, 2007), XIII Международной конференции по химии бора “IMEBORON” (Барселона, Испания, 2008), Конференции молодых ученых по БНЗТ (Майнц, Германия, 2009), Всероссийской конференции по органической химии, посвященной 75-летию со дня основания Института органической химии им. Н.Д.Зелинского (Москва, 2009), Всероссийской научной конференции, посвященной Международному году химии “Успехи синтеза и комплексообразования” (Москва, 2011), IV Конгрессе Европейской ассоциации химических и молекулярных наук EuCheMS (Прага, Чехия, 2012), XV Международном конгрессе по нейтронозахватной терапии рака ICNCT-15 (Цукуба, Япония, 2012).
Публикации. По теме диссертационной работы опубликовано 17 научных работ (в том числе 5 статей в научных журналах, рекомендованных ВАК, 12 тезисов в сборниках докладов научных коференций).
Структура работы. Диссертация состоит из оглавления, введения, литературного обзора, обсуждения результатов, выводов, экспериментальной части и списка используемой литературы. Работа изложена на 120 страницах машинописного текста, содержит 74 схемы, 32 рисунка и 3 таблицы. Библиография содержит 153 литературных ссылки.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Литературный обзор
В литературном обзоре рассмотрены свойства клозо-декаборатного аниона (рис.1) и способы его получения. Показаны основные методы синтеза производных аниона [B10H10]2- со связью бор-галоген, бор-углерод, бор-азот, бор-сера и бор-кислород. Обсуждаются возможные области применения различных функциональных производных клозо-декаборатного аниона.
Обсуждение результатов
Синтез алкоксипроизводных декагидро-клозо-декаборатного аниона
Изучены реакции алкилирования гидроксипроизводных [1-B10H9OH]2- (1) и [2-B10H9OH]2- (2), и синтезирован ряд алкоксипроизводных на их основе. Соединение 1 получали с использованием описанной в литературе методики[1]. Для синтеза соединения 2 была разработана новая препаративная методика, заключающаяся в щелочном гидролизе 2-(1-метил-1-пирролинио-2-илокси) производного клозо-декаборатного аниона (схема 1).
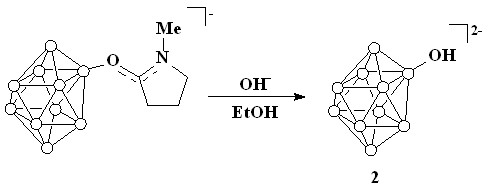
Схема 1
Продукт выделяли в виде хорошо растворимой в воде калиевой соли K2[2-B10H9OH], которая не содержит примесей продуктов с более высокой степенью замещения. Для получения алкоксипроизводных был использован метод, основанный на взаимодействии гидроксипроизводных 1 и 2 с алкилгалогенидами в диметилсульфоксиде в присутствии гидроксида калия (схема 2). В качестве алкилгалогенидов использовали этилбромид, н-пропилбромид, н-бутилбромид, изоамилбромид.
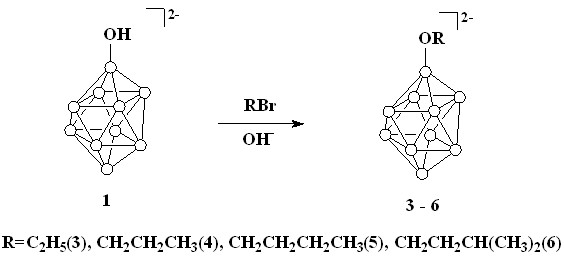
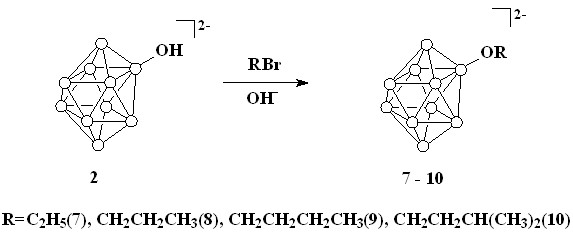
Схема 2
Раствор [Ph3PСН2Ph]2[1] ([Ph3PСН2Ph]2[2]) и десятикратного избытка соответствующего алкилгалогенида в ДМСО в присутствии КОН перемешивали при комнатной температуре в течение 48 часов. При отгонке растворителя происходила деградация катиона с образованием трифенилфосфиноксида. Образующиеся алкоксипроизводные (3-10) осаждали из воды в виде тетрафенилфосфониевых солей.
При анализе спектров ЯМР 1Н алкоксипроизводных клозо-декаборатного аниона было обнаружено существенное различие в химических сдвигах метильных групп заместителей в изомерах [1-B10H9OR]2- и [2-B10H9OR]2-.
Таблица 1. Химические сдвиги заместителей изомеров [Ph4P]2[1-B10H9OR] и [Ph4P]2[2-B10H9OR] в спектрах ЯМР 1Н в ДМСО-d6
| Анион, заместитель | Химические сдвиги, м.д. | ||||
| O-CH2 | O-CH2CH2 | O-CH2CH2CH2 | O-CH2CH2CH | -CH3 | |
| 1-OCH2CH3 | 3.80 | _____ | _____ | _____ | 1.15 |
| 2-OCH2CH3 | 3.01 | _____ | _____ | _____ | 0.76 |
| 1-OCH2CH2CH3 | 3.80 | 1.66 | _____ | _____ | 0.90 |
| 2-OCH2CH2CH3 | 2.9 | 1.15 | _____ | _____ | 0.62 |
| 1-OCH2CH2CH2CH3 | 3.83 | 1.63 | 1.38 | _____ | 0.92 |
| 2-OCH2CH2CH2CH3 | 2.92 | 1.12 | 1.12 | _____ | 0.76 |
| 1-OCH2CH2CH(CH3)2 | 3.86 | 1.54 | _____ | 1.77 | 0.91 |
| 2-OCH2CH2CH(CH3)2 | 2.96 | 1.04 | _____ | 1.42 | 0.73 |
Как видно из таблицы, сигнал метиленовой группы, связанной с атомом кислорода в случае алкоксипроизводных по первому положению смещен на 0.8-0.9 м.д. в область слабого поля по сравнению с изомерами по второму положению. В дальнейшем происходит затухание эффекта заместителя по длине цепи. Это свидетельствует о том, что 2-клозо-декаборанильная группа [2-B10H9-]2- является более сильным донором электронов, чем 1-клозо-декаборанильная группа [1-B10H9-]2-. Полученный результат хорошо согласуется с данными квантово-химических расчетов распределения электронной плотности в клозо-декаборатном анионе[2].
Разработанный метод получения алкоксипроизводных является достаточно эффективным, однако жесткие условия синтеза и выделения конечных продуктов делают затруднительным его использование для получения производных с кислотными и аминокислотными группами.
Синтез борсодержащих кислот через раскрытие циклических оксониевых производных клозо-декаборатного аниона
Раскрытие циклических оксониевых производных полиэдрических гидридов бора является удобным способом получения алкоксипроизводных, содержащих различные концевые функциональные группы. Это особенно привлекательно еще и тем, что разрыв связи бор-углерод в оксониевых производных позволяет получать соединения, в которых борный остов будет отделен от функциональной группы цепочкой из 5-6 атомов, что минимизирует влияние борного остова на свойства биомолекул[3].
В качестве исходных соединений для синтеза кислот были выбраны циклические оксониевые производные аниона [B10H10]2- на основе тетрагидрофурана и 1,4-диоксана. Для синтеза изомеров [2-B10H9OC4H8]- (11) и [2-B10H9O(CH2CH2)2O]- (12) по положению 2 использовали описанную в литературе методику[4], заключающуюся во взаимодействии клозо-декаборатного аниона с циклическими эфирами в присутствии трифторуксусной кислоты. Данная реакция протекает по механизму электрофильно-индуцируемого нуклеофильного замещения, который позволяет получать только экваториально-замещенные производные клозо-декаборатного аниона.
В связи с этим прямой синтез (через замещение атома водорода циклическими эфирами) оксониевых производных по положению 1 в клозо-декаборатном анионе невозможен. Наиболее распространенный способ синтеза аксиально-замещенных производных заключается в нуклеофильном замещении диазогруппы в [1-B10H9N2]-. Этот подход был использован для синтеза оксониевого производного 13 (схема 3). Кипячение тетрабутиламмониевой соли 1-диазонио-нонагидро-клозо-декабората[5] в 1,4-диоксане в течение 3 часов приводит к образованию целевого продукта реакции.
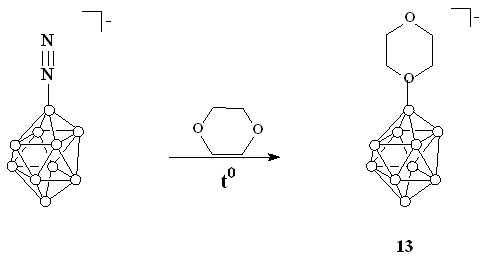
Схема 3
При анализе спектров ЯМР 1Н диоксановых производных клозо-декаборатного аниона также было обнаружено существенное различие в химических сдвигах соответствующих метиленовых протонов в изомерах [2-B10H9O(CH2CH2)O]- (12) и [1-B10H9O(CH2CH2)2O]- (13). Аналогичные различия наблюдаются и в случае алкоксипроизводных (3-10), что подтверждает предположение о более сильном донорном эффекте 2-клозо-декаборанильной группы.
Таблица 2. Химические сдвиги заместителей изомеров
[Bu4N][2-B10H9O(CH2CH2)2O] (12) и [Bu4N][1-B10H9O(CH2CH2)2O] (13)
в спектрах ЯМР 1Н в ацетоне-d6, м.д.
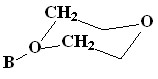 | 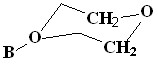 | |
| [1-B10H9O(CH2CH2)2O]- (13) | 5.08 | 4.26 |
| [2-B10H9O(CH2CH2)2O]- (12) | 4.21 | 3.79 |
В связи с большей доступностью экваториально-замещенных циклических оксониевых производных клозо-декаборатного аниона, реакции раскрытия оксониевого цикла изучали на соединениях 11 и 12.
С целью получения борсодержащих карбоновых кислот, было изучено взаимодействие гидроксибензойных кислот с оксониевыми производными клозо-декаборатного аниона. В качестве реагентов использовали соединение 11 и о-, п- и м-гидроксибензойные кислоты. Реакции проводили в кипящем безводном ацетонитриле в присутствии избытка карбоната калия. Конечные продукты были выделены в виде цезиевых солей осаждением фторидом цезия из спиртового раствора. В результате были получены соединения, представляющие собой продукты раскрытия оксониевого цикла двумя нуклеофильными центрами (схема 4).
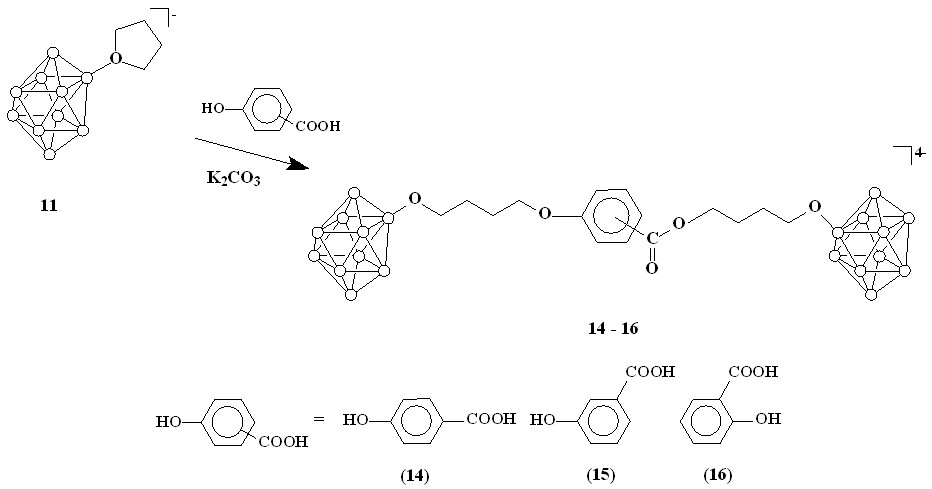
Схема 4
Для идентификации полученных производных была выделена натриевая соль соединения 14, пропусканием вещества через ионообменную колонку.
![Спектр ЯМР 1Н Na4[2-B10H9OC4H8-(4-OOCC6H4O)-2-C4H8OB10H9] в СD3OD -7](/images1/224256/spektr-yamr-1n-na4-2-b10h9oc4h8-4-o.jpg)
Рисунок 2. Спектр ЯМР 1Н Na4[2-B10H9OC4H8-(4-OOCC6H4O)-2-C4H8OB10H9] в СD3OD
Спектр ЯМР 1Н Na4[2-B10H9OC4H8-(4-OOCC6H4O)-2-C4H8OB10H9] содержит набор дублетов при 7.91 и 6.95 м.д., соответствующих сигналам протонов бензольного кольца, набор триплетов при 4.20 и 4.01 м.д., принадлежащих -метиленовым группам при фенольном и карбоксильном кислородах соответственно, триплет при 3.40 м.д., отвечающий -метиленовым группам при атомах кислорода, связанных с бором, а также два мультиплета при 1.70 и 1.60 м.д., представляющих собой сигналы -метиленовых протонов раскрытого тетрагидрофуранового цикла, с общим соотношением интегральных интенсивностей 2:2:2:2:4:4:4.
Реакция соединения 12 с м-гидроксибензойной кислотой также приводит к образованию продукта раскрытия двумя нуклеофильными центрами 17 (схема 5). Вещество было выделено в виде цезиевой соли.
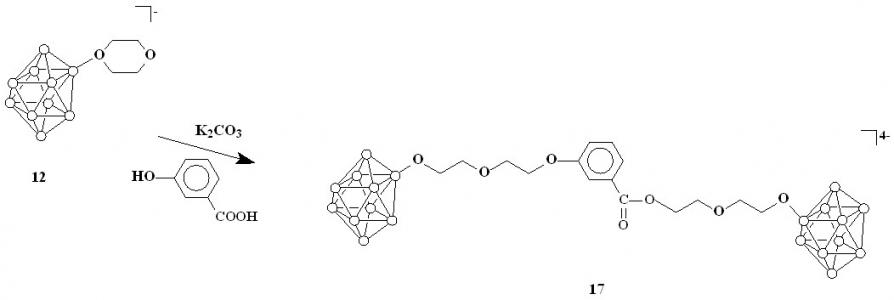
Схема 5
Во избежание раскрытия оксониевого цикла двумя различными нуклеофильными центрами, для синтеза борсодержащих кислот использовались метиловые эфиры гидроксибензойных кислот. Реакции соединения 11 с метиловыми эфирами о-, п- и м-гидроксибензойных кислот проводились в ацетонитриле в присутствии карбоната калия (схема 6). Конечные продукты выделяли в виде цезиевых солей добавлением фторида цезия к спиртовому раствору.
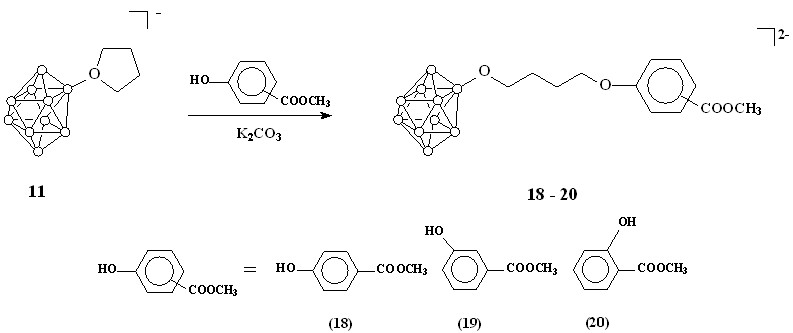
Схема 6
Аналогичные реакции были проведены с использованием соединения 12. В результате были получены соответствующие сложные эфиры 21-23 (схема 7). Конечные продукты выделяли также в виде цезиевых солей.
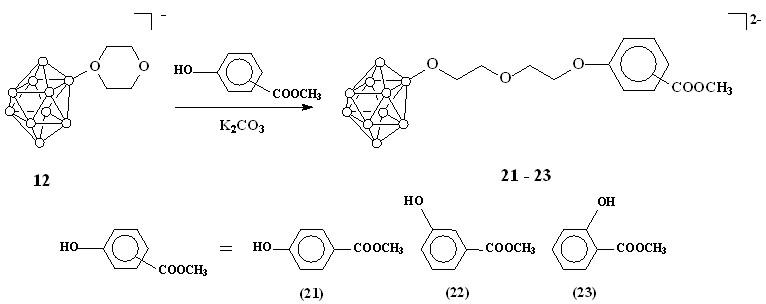
Схема 7
Кислотный гидролиз полученных сложных эфиров приводит к образованию соответствующих кислот (24-27), что подтверждается исчезновением сигналов метильной группы при 3.81 м.д. и при 51-53 м.д. в спекрах ЯМР 1Н и 13С продуктов гидролиза соответственно (схема 8).
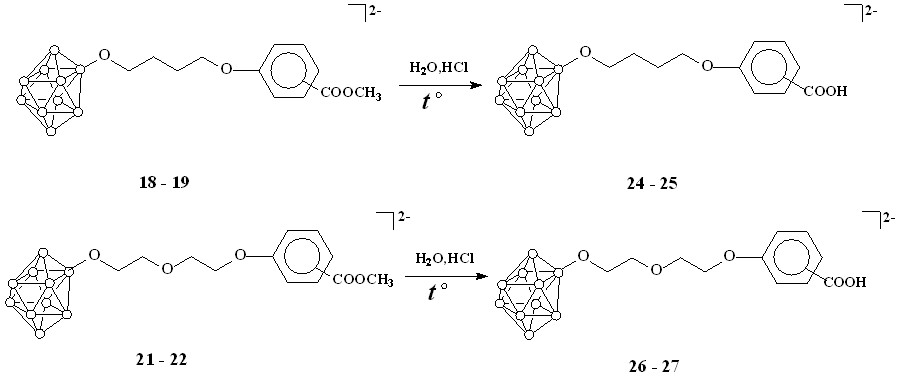
Схема 8
Более детальное изучение спектров ЯМР 1Н выявило существенное (до 0.5 м.д.) смещение в область слабого поля сигналов, соответствующих -OCH2CH2O-2-B10H9 и -OCH2CH2O-2-B10H9 метиленовым группам производных кислот 26 и 27 на основе 1,4-диоксанового производного по сравнению со сложноэфирными производными (рис. 3). Подобное смещение сигналов в область слабого поля -CH2O-2-B10H9 сигнала метиленой группы также было обнаружено в спектрах ЯМР 1Н кислот 24 и 25. Это свидетельствует об увеличении акцепторности заместителя, что может быть обусловлено образованием протонированной формы.
![Спектр ЯМР 1H Cs[2-B10H9O(H)(CH2CH2O)2C6H4-3-COOH] и -12](/images1/224256/spektr-yamr-1h-cs-2-b10h9ohch2ch2o2.jpg)
![Спектр ЯМР 1H Cs[2-B10H9O(H)(CH2CH2O)2C6H4-3-COOH] и -13](/images1/224256/13-spektr-yamr-1h-cs-2-b10h9ohch2ch2o2.jpg)
Рисунок 3. Спектр ЯМР 1H Cs[2-B10H9O(H)(CH2CH2O)2C6H4-3-COOH] и
Cs2[2-B10H9O(CH2CH2O)2C6H4-3-COOMe] в ДМСО-d6
Для того чтобы подтвердить предположение о том, что смещение сигнала метиленовой группы вызвано протонированием атома кислорода, непосредственно связанного с борным остовом, было изучено поведение сооветствующих сложных эфиров в присутствии кислоты. Оказалось, что добавление к образцам трифторуксусной кислоты приводит к аналогичному смещению в область слабого поля сигналов метиленовой группы по аналогии со спектрами ЯМР 1Н соответствующих кислот (рис. 4).
Рисунок 4. Спектр ЯМР 1H (ДМСО-d6) сложного эфира 21
до и после добавления трифторуксусной кислоты
Таким образом, кислотный гидролиз сложноэфирных производных в
водном растворе в присутствии соляной кислоты дает О-протонированные кислоты, которые были выделены в виде калиевых солей после перекристаллизации из ацетонитрила. Обработка водных растворов солей кислот хлоридом тетрафенилфосфония приводит к осаждению тетрафенилфосфониевых солей непротонированных форм (Ph4P)2[2-B10H9O(CH2)4OC6H4-4-COOH], (Ph4P)2[2-B10H9O(CH2)4OC6H4-3-COOH], (Ph4P)2[2-B10H9O(CH2CH2O)2C6H4-4-COOH], в то время как тетрафенилфосфониевая соль (Ph4P)[2-B10H9O(H)(CH2CH2O)2C6H4-3-COOH] была получена в виде О-протонированной формы. Причина такого явления до конца не ясна, но, вероятно, это связано с присутствием равновесия между протонированной и непротонированной формами и выпадением менее растворимой соли.
Помимо ароматических кислот, был проведен синтез ряда алифатических кислот. Реакция соединения 11 с цианидом натрия в смеси вода-дихлорметан при комнатной температуре приводит к образованию нитрила 28 (схема 9).
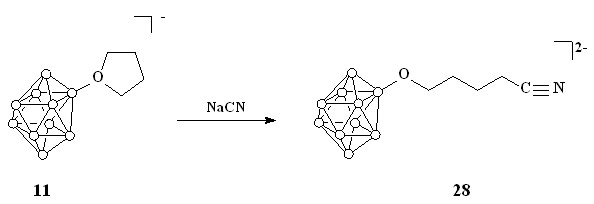
Схема 9
В дальнейшем соединение 28 подвергали щелочному гидролизу. В результате была получена соответствующая алифатическая кислота 29 (схема 10).
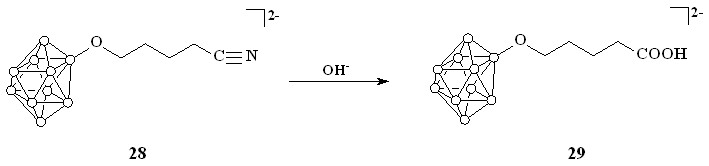
Схема 10
Полученное выше кислотное производное представляют собой двухзарядный анион. Известно, что заряд системы оказывает сильное влияние на биохимические свойства соединений, в особенности на их прохождение через клеточные мембраны. Поэтому было решено осуществить синтез однозарядных борсодержащих кислот, в которых частичная компенсация заряда достигается внедрением в алифатическую цепь атома азота. С этой целью проведено раскрытие оксониевых производных 11 и 12 аминогруппами этиловых эфиров -аминокислот: аминоуксусной и -аминомасляной кислоты.
Для предотвращения образования циклических имидов эфиры кислот генерировали из гидрохлоридов in situ в спиртовом растворе. После чего в реакционную смесь добавляли соединение 11 и полученный раствор кипятили в течение суток. Конечные продукты выделяли в виде цезиевых солей (схема 11).
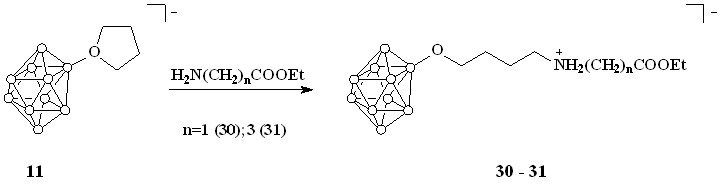
Схема 11
Аналогичные реакции были проведены с использованием соединения 12 с образованием соответствующих сложных эфиров 32 и 33 (схема 12).
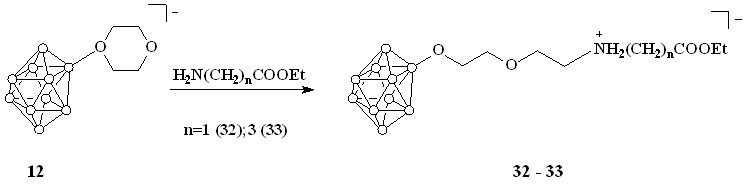
Схема 12
Полученные сложные эфиры 32 и 33 были подвергнуты кислотному гидролизу в водной среде в присутствии соляной кислоты. Реакционную смесь кипятили в течение 5 часов. В результате были получены соответствующие однозарядные борсодержащие кислоты 34 и 35 на основе клозо-декаборатного аниона (схема 13).

Схема 13
Синтез аминокислот на основе [2-B10H9C4H8O]- и [2-B10H9O(CH2CH2)2O]-
Описанный выше метод раскрытия оксониевых производных фенолят-ионами был использован для получения борсодержащих производных тирозина на основе соединения 11. В качестве реагента использовали этиловый эфир N-трифторацетил-L-тирозина. Реакцию проводили в ацетонитриле в присутствии избытка карбоната калия. Реакционную смесь кипятили в течение 8 часов. Конечный продукт выделяли в форме цезиевой соли, добавлением фторида цезия к спиртовому раствору соединения. В результате был получен этил-О-{4-[нонагидро-клозо-декаборато-2-окси]бутил}-N-(трифторацетил)-L-тирозинат цезия Cs2[2-(4-(С2Н5OOC)(СF3OCNH)CHCH2C6H4O)-C4H8O-B10H9] (36) (схема 14).
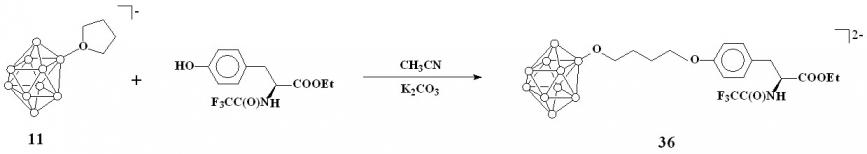
Схема 14
Реакция соединения 12 с защищенным тирозином в тех же условиях протекает аналогично соединению 11 с образованием этил-О-{2-[2-(нонагидро-клозо-декаборато-2-окси)этокси]этил}-N-(трифторацетил)-L-тирозината цезия Cs2[2-(4-(С2Н5OOC)(СF3OCNH)CHCH2C6H4O)-CH2CH2OCH2CH2O-B10H9] (37) (схема 15).
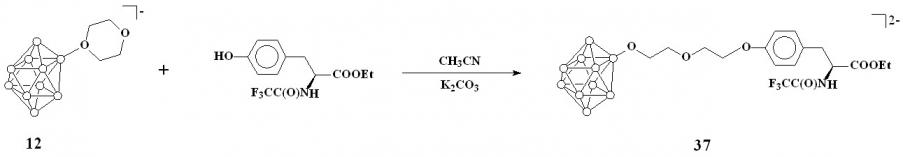
Схема 15
Кислотный гидролиз 36 и 37 приводит к одновременному удалению N-трифторацетильной и O-этильной защитных групп с образованием соответствующих борсодержащих тирозинов 38 и 39 на основе 1,4-диоксанового и тетрагидрофуранового производных клозо-декаборатного аниона (схема 16).
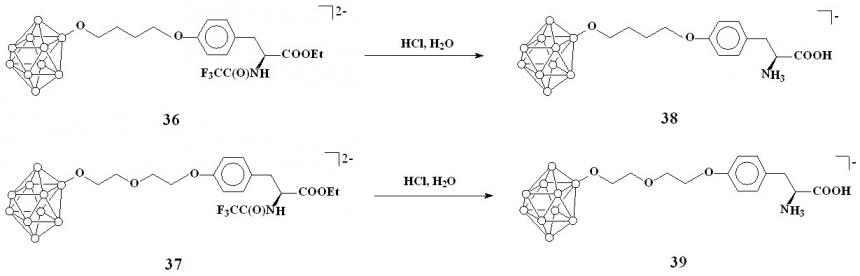
Схема 16
В спектрах ЯМР 1Н соединений 38 и 39 исчезают сигналы, соответствующие этильной группе сложного эфира, и наблюдается смещение сигнала -протона тирозина в область сильного поля на 0.4 м.д. В спектрах ЯМР 13С продуктов гидролиза отсутствуют сигналы трифторацетильной и этильной защитных групп. Выделение борсодержащих тирозинов на основе клозо-декаборатного аниона проводили в виде тетрафенилфосфониевых солей.
Дейтерирование производных клозо-декаборатного аниона
Отдельный интерес представляет синтез производных клозо-декаборатного аниона, содержащих два различных заместителя в борном остове. Для химии полиэдрических гидридов бора характерны два механизма замещения: электрофильное и электрофильно-индуцируемое нуклеофильное замещение[6]. В обоих случаях реакция протекает через атаку атома бора электрофильной частицей, простейшим примером которой является протон. Ранее было установлено селективное протекание дейтерообмена в клозо-декаборатном анионе при комнатной температуре в среде метанола-d4[7]. Для определения влияния различных заместителей в борном остове на последующее замещение был изучен дейтерообмен в полученных в ходе работы монозамещенных производных декагидро-клозо-декаборатного аниона, содержащих как электронодонорные, так и электронакцепторные заместители. Протекание процесса контролировали с помощью данных спектроскопии ЯМР 11В, которая является наиболее информативным методом, т.к. позволяет выявить как степень дейтерирования, так и положение, по которому происходит дейтерообмен. Отнесение сигналов в производных было выполнено с помощью двумерной COSY 11B-11B спектроскопии.
В ходе исследований соединений, содержащих электронодонорные заместители в апикальном положении [1-B10H9OR]2-, установлено, что дейтерообмен протекает с высокой скоростью (менее пяти минут) c образованием 1-OEt-10-D-производного (рис.5).
![Спектры ЯМР 11B [Ph4P]2[1-B10H9OEt] в DMSO-d6 и CD3OD. В случае-22](/images1/224256/spektri-yamr-11b-ph4p-2-1-b10h9oet.jpg)
Рисунок 5. Спектры ЯМР 11B [Ph4P]2[1-B10H9OEt] в DMSO-d6 и CD3OD.
В случае электроноакцепторного заместителя ([1-B10H9N2]-) никаких следов протекания дейтерообмена не обнаружено в течение одного месяца.
Дейтерообмен в экваториально-замещенных производных носит более сложный характер. В случае [2-B10H9OR]2- первоначальное замещение протия на дейтерий достаточно быстро протекает в положение 10, а затем в положение 1. Большее время реакции (1 неделя) приводит к образованию полностью дейтерированного производного [2-B10D9OR]2-. Для менее донорного заместителя (N-метилпирролидон) удалось зафиксировать ступенчатое замещение в экваториальном поясе. Как и в случае [2-B10H9OR]2- первоначальное замещение идет в положения 10 и 1, затем замещению подвергаются положения 7 и 8 и, наконец, положение 4. Далее дейтерообмен не протекает.
Электроноакцепторный заместитель (NR3+) значительно замедляет дейтерообмен и останавливает процесс на стадии замещения в положение 10 (рис.7).
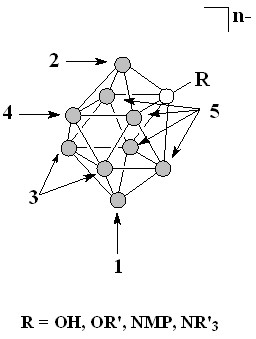
Рисунок 7. Последовательность дейтерообмена в экваториально-замещенных производных клозо-декаборатного аниона
Таким образом, была выявлена последовательность дейтерообмена в производных декагидро-клозо-декаборатного аниона и изучено влияние заместителей различной природы на скорость и глубину протекания процесса. Следует отметить значительное различие в скорости дейтерирования по апикальным и экваториальным положениям борного остова.
Выводы
- Разработан новый препаративный способ синтеза 2-гидроксипроизводного клозо-декаборатного аниона через его 2-(1-метил-1-пирролинио-2-илокси) производное.
- Взаимодействием гидроксипроизводных клозо-декаборатного аниона с различными алкилгалогенидами получен ряд алкоксипроизводных [1- и 2-B10H9OR]2-. Обнаружено существенное различие в химических сдвигах метильных групп заместителей в спектрах ЯМР 1Н изомеров [1-B10H9OR]2- и [2-B10H9OR]2-, что свидетельствует о более сильном донорном эффекте 2-клозо-декаборанильной группы.
- Реакцией диазониевого производного [1-B10H9N2]- c 1,4-диоксаном впервые получено аксиально-замещенное циклическое оксониевое производное [1-B10H9O(CH2CH2)2O]-.
- Взаимодействием циклических оксониевых производных клозо-декаборатного аниона со сложными эфирами гидроксибензойных кислот, а также с цианид-ионом получены соответствующие кислотные производные.
- Взаимодействием циклических оксониевых производных клозо-декаборатного аниона с эфирами -аминокислот получены соответствующие кислоты [2-B10H9(OCH2CH2)2NH2(CH2)nCOOH]-.
- Методом спектроскопии ЯМР 1H выявлено образование протонированной формы эфиров [2-B10H9O(H)R]-, которые также были выделены в твердом виде.
- Раскрытием циклических оксониевых производных аниона [B10H10]2- этиловым эфиром N-трифторацетил-L-тирозина с последующим снятием защитных групп получены соответсвующие аминокислоты.
- Изучен дейтерообмен в различных производных декагидро-клозо-декаборатного аниона, содержащих как электронодонорные, так и электроноакцепторные заместители, в метаноле-d4. Определена зависимость глубины и последовательности протекания дейтерообмена от свойств и положения заместителя.
Основные результаты диссертации изложены в следующих публикациях:
1. A.V. Prikaznov, V.I. Bragin, M.N. Davydova, I.B. Sivaev, V.I.Bregadze // Synthesis of Alkoxy Derivatives of Decahydro-closo-decaborate Anion // Collect. Czech. Chem. Commun., 2007, V.72, N.12, P.1689-1696
2. I.B. Sivaev, V.I. Bragin, A.V. Prikaznov, P.V. Petrovskii, V.I. Bregadze, O.A. Filippov, T.A. Teplinskaya, A.A. Titov, E.S. Shubina // Study of Proton–Deuterium Exchange in Ten-Vertex Boron Hydrides // Collect. Czech. Chem. Commun., 2007, V.72, N.12, P.1725-1739.
3. I.B. Sivaev, A.V. Prikaznov, D. Naoufal // Fifty Years of the closo-Decaborate Anion Chemistry // Collect. Czech. Chem. Commun., 2010, V.75, N.11, P.1149-1199.
4. A.V. Prikaznov, A.V. Shmal’ko, I.B. Sivaev, P.V. Petrovskii, V.I. Bragin, A.V. Kisin, V.I. Bregadze // Synthesis of Carboxylic Acids Based on Decahydro-closo-decaborate Anion // Polyhedron, 2011, V.30, N.9, P.1494-1501.
5. А.В. Приказнов, Ю.Н. Ласькова, А.А. Семиошкин, И.Б. Сиваев, А.В. Кисин, В.И. Брегадзе // Синтез борсодержащих производных тирозина на основе клозо-декаборатного и клозо-додекаборатного анионов // Изв. Акад. наук, Сер. хим., 2011, №12, С.2501-2505.
6. В.И. Брагин, А.В. Приказнов, И.Б. Сиваев, В.И. Брегадзе, Е.С. Шубина // Изучение дейтерообмена в производных десятивершинных полиэдрических гидридов бора // Тез. IV Всеукр. конф. мол. ученых студ. акт. пробл. химии, Днепропетровск, 2006, С.93
7. I.B. Sivaev, A.V. Prikaznov, V.I. Bragin, V.I. Bregadze // Study of Proton-Deuterium Exchange in Ten-Vertex Boron Clusters // Abstr. V Russ. Conf. Cluster Chem. Polynuclear Compounds “Clusters-2006”, Astrakhan, 2006, O15-16.
8. V.I. Bragin, P.V. Petrovskii, A.V. Prikaznov, I.B. Sivaev, V.I. Bregadze // Study of H-D Exchange in 10-Vertex Boron Clusters by NMR Spectroscopy // Abstr. XV-th Int. Conf. “Physical Methods Coord. Supramolecular Chem.”, Chisinau (Moldova), 2006, P.101.
9. A.V. Prikaznov, V.I. Bragin, P.V. Petrovskii, I.B. Sivaev, V.I. Bregadze // Proton-Deuterium Exchange in [B10H10]2- Derivatives: Effect of Various Substituents // Abstr. The XV-th Int. Conf. “Physical Methods Coord. Supramolecular Chem.”, Chisinau (Moldova), 2006, P.168.
10. А.В. Приказнов, В.И. Брагин, И.Б. Сиваев, М.Н. Давыдова, В.И. Брегадзе // Синтез алкокси- и алкиламинопроизводных декагидро-клозо-декаборатного аниона // Тез. IX научн. школы-конф. орган. химии, Москва, 2006, С.289.
11. A.V. Prikaznov, V.I. Bragin, M.N. Davydova, I.B. Sivaev, V.I. Bregadze // Synthesis of Alkoxy Derivatives of closo-Decaborate Anion [B10H10]2- // Abstr. IV Int. Conf. Boron Chem. “EUROBORON 4”, Bremen (Germany), 2007, P.114.
12. A. Prikaznov, I. Sivaev, V. Bregadze // Synthesis of Boron-Containing Acids Based on Decahydro-closo-decaborate anion // Abstr. XIII Int. Conf. Boron Chem. “IMEBORON”, Platia d’Aro (Spain), 2008, P095.
13. A.V. Prikaznov, I.B. Sivaev, V.I. Bregadze, A.V. Kisin // Synthesis of Functional Derivatives of Decahydro-closo-decaborate Anion // Abstr. Young Researchers BNCT Meet., Maintz (Germany), 2009.
14. И.Б. Сиваев, М.Я. Берзина, Ю.Н. Ласькова, А.В. Приказнов, М.Ю. Стогний, И.А. Лобанова, В.И. Брегадзе // Новый подход к синтезу аминокислот на основе полиэдрических гидридов бора // Тез. Всеросс. конф. орган. химии, посв. 75-летию основания Института органической химии им. Н.Д.Зелинского, Москва, 2009, С.385.
15. А.В. Приказнов, А.В. Шмалько, И.Б. Сиваев, А.В. Кисин, В.И. Брегадзе // Синтез кислот на основе декагидро-клозо-декаборатного аниона // Тез. Всеросс. научн. конф., посв. Международному году химии “Успехи синтеза и комплексообразования”, Москва, 2011, С.119.
16. I. Sivaev, M. Zakharova, M. Stogniy, M. Berzina, J. Laskova, A. Prikaznov, I. Lobanova, A. Semioshkin, V. Bregadze // New Boron-Containing Amino Acids Derived from Polyhedral Boron Hydrides // Abstr. 4th EuCheMS Chemistry Congress, Prague (Czech Republic), 2012. Chem. Listy, 2012, V.106, Suppl.1, P.s942.
17. J. Laskova, A. Semioshkin, A. Prikaznov, I. Sivaev, V. Bregadze // An Effective Apporoach to Tyrosine Derivatives of Polyhedral Boron Compounds // Abstr. 15th Int. Congress Neutron Capture Therapy, Tsukuba (Japan), 2012, P.118.
[1] V.I. Bragin, I.B. Sivaev, V.I. Bregadze, N.A. Votinova // Synthesis of the 1-Hydroxy-closo-decaborate Anion [1-B10H9OH]2- // J. Organomet. Chem., 2005, N.690, N.11, P.2847-2849.
[2] M.J.S. Dewar, M.L. McKee // Ground states of molecules. 47. MNDO Studies of Boron Hydrides and Boron Hydrides Anions // Inorg. Chem., 1978, V.17, N.6, P.1569-1581.
[3] A.A. Semioshkin, I.B. Sivaev, V.I. Bregadze // Cyclic Oxonium Derivatives of Polyhedral Boron Hydrides and Their Synthetic Applications // Dalton Trans., 2008, N.8, P.977-992.
[4] К.Ю. Жижин, В.Н. Мустяца, Е.А. Малинина, Н.А. Вотинова, Е.Ю. Матвеев, Л.В. Гоева, И.Н. Полякова, Н.Т. Кузнецов // Взаимодействие клозо-декаборатного аниона B10H102- с простыми циклическими эфирами // Журн. неорг. химии., 2004, Т.49, №2, С.221-230.
[5] L.L. Ng, B.K. Ng, K. Shelly, C.B. Knobler, M.F. Hawthorne // Structural Analysis of [Et3NH][Cu(1-B10H9N2)2] and [Et3NH][1-B10H9N2] // Inorg. Chem., 1991, V.30, N.22, P.4278-4280.
[6] В.И. Брегадзе, С.В. Тимофеев, И.Б. Сиваев, И.А. Лобанова // Реакции замещения при атомах бора в металлакарборанах // Успехи химии, 2004, Т.73, N.5, С.470-491.
[7] И.Б. Сиваев, П.В. Петровский, А.М. Филин, Е.С. Шубина, В.И. Брегадзе // Региоселективный обмен водород-дейтерий в анионе [B10H10]2-. Синтез [1,10-B10H8D2]2- и [2,3,4,5,6,7,8,9-B10H2D8]2- // Изв. Акад. наук. Сер. хим., 2001, №6, С.1065-1066.

