Кинетический метод оценки антиоксидантной активности и безреагентный медиаторный биосенсор

На правах рукописи
Вохмянина Дарья Владимировна
КИНЕТИЧЕСКИЙ МЕТОД ОЦЕНКИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ И БЕЗРЕАГЕНТНЫЙ МЕДИАТОРНЫЙ БИОСЕНСОР
02.00.02 – аналитическая химия
Автореферат диссертации на соискание ученой степени
кандидата химических наук
Москва 2013
Работа выполнена на Факультете наук о материалах и кафедре аналитической химии Химического факультета Московского государственного университета имени М.В. Ломоносова.
| Научный руководитель: | доктор химических наук, профессор Карякин Аркадий Аркадьевич |
| Официальные оппоненты: | доктор химических наук, профессор Бабкина Софья Сауловна Московский государственный открытый университет имени В.С.Черномырдина кандидат химических наук, в.н.с. Рубцова Майя Юрьевна кафедра химической энзимологии, Московский государственный университет имени М.В.Ломоносова |
| Ведущая организация: | Институт общей и неорганической химии имени Н.С.Курнакова РАН |
Защита состоится 10 апреля 2013 г. в 15 ч 00 мин на заседании диссертационного совета Д 501.001.88 по химическим наукам при Московском государственном университете имени М.В. Ломоносова по адресу: 119991, Москва, Ленинские горы, д. 1, стр. 3,
МГУ имени М.В. Ломоносова, Химический факультет, аудитория 446.
С диссертацией можно ознакомиться в библиотеке Химического факультета МГУ имени М.В. Ломоносова.
Автореферат разослан 7 марта 2013 года

Ученый секретарь диссертационного совета,
кандидат химических наук Торочешникова И.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Электрохимические методы как нельзя лучше удовлетворяют требованиям современного анализа, таким как чувствительность, избирательность, экспрессность, простота и невысокая стоимость. По сравнению с другими аналитическими методами они просты и удобны в применении, не требуют пробоподготовки, а также позволяют осуществлять непрерывный мониторинг анализируемого вещества. Эти преимущества обеспечивают широкое применение электрохимических сенсоров в клинической диагностике, пищевой промышленности и контроле состояния окружающей среды.
Сахарный диабет является тяжелым заболеванием, которым страдает не менее 10% населения Земли. Известно, что самостоятельное определение концентрации глюкозы пациентом является ключевым аспектом в контроле диабета. За год проводится более 6 миллиардов определений глюкозы в крови человека: фактически, определение глюкозы – это самый распространенный и часто используемый химический анализ.
В большинстве коммерческих тест-систем используются электрохимические биосенсоры на основе фермента (глюкозооксидазы или глюкозодегидрогеназы) и медиаторов (как правило, металлорганических соединений или комплексов переходных металлов). Медиатор – это низкомолекулярное редокс-активное соединение, переносящее электроны от активного центра фермента к поверхности индикаторного электрода.
Недостатком медиаторных биосенсоров можно считать то, что их нельзя использовать для многоразового анализа или для постоянного мониторинга концентрации аналита. Для этих целей подходят «безреагентные» биосенсоры. Для создания безреагентного медиаторного биосенсора необходимо совместно иммобилизовать на поверхности электрода фермент и медиатор. При этом, чтобы медиатор не утратил свою функцию «электронного шаттла», после иммобилизации в мембране он должен оставаться диффузионно-подвижным.
Большое внимание в медицине уделяется проблеме окислительного стресса, являющегося одним из главных факторов риска в развитии сердечно-сосудистых и неврологических осложнений некоторых заболеваний, таких как диабет и почечная недостаточность. Этот факт вызывает огромный интерес к антиоксидантам – веществам, способным снизить скорость окислительных реакций.
Современные методы оценки антиоксидантной активности можно разделить на две группы. Первая группа методов основана на определении окисляемого продукта, например, продукта окисления липидов. Однако такие методы требуют больших временных затрат и использования тканей животных, что негативно сказывается на воспроизводимости. Поэтому большой интерес вызывают методы, основанные на генерации радикалов в образце или добавлении окислителя и изучении их дальнейшего разложения. Но время жизни свободных радикалов пренебрежимо мало, а подавляющее большинство используемых окислителей не встречается в живых организмах, что снижает достоверность полученных таким образом данных. Таким образом, в качестве оксиданта необходимо использовать окислитель, который присутствует в живых организмах, такой, например, как пероксид водорода.
Цель работы состояла в разработке амперометрических биосенсоров на основе фермента (глюкозооксидазы) и медиаторов (азиновых красителей) для определения глюкозы в цельной крови, а также в разработке кинетического метода оценки антиоксидантной активности в биологических жидкостях и в водных растворах физиологически-активных веществ и наночастиц.
Достижение поставленной цели предусматривало решение следующих задач:
- выбор оптимального медиатора для фермента глюкозооксидазы по кинетическим параметрам взаимодействия с активным центром фермента, электрохимической активности и способности удерживаться в мембране полиэлектролита;
- осуществление совместной иммобилизации глюкозооксидазы и медиатора в мембрану перфторсульфонированного полимера на поверхности электрода;
- интеграция полученного биосенсора с тонкослойной ячейкой для создания системы электроанализа малых (1-1.5 мл) объемов образца;
- разработка способа оценки антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода с использованием электрохимического сенсора на основе берлинской лазури для контроля концентрации Н2О2;
- оценка антиоксидантной активности в реальных объектах: коллоидных растворах наночастиц диоксида церия и сыворотке крови спортсменов.
Научная новизна. Разработан новый способ совместной иммобилизации фермента и медиатора из водно-органических сред с высоким содержанием спиртов в мембрану на поверхности электрода. Достигнута совместная иммобилизация фермента и медиаторов в мембрану полиэлектролита без ковалентного сшивания. Найден новый медиатор для фермента глюкозооксидазы – фенотиазин, способный эффективно осуществлять транспорт электронов между активным центром фермента и электродом. Показано сохранение диффузионной подвижности медиатора после иммобилизации в ферментсодержащую мембрану.
Разработан амперометрический биосенсор на основе глюкозооксидазы и фенотиазина, иммобилизованных в мембрану перфторсульфонированного полимера без образования ковалентной связи. Биосенсор, интегрированный в тонкослойную ячейку для анализа малых (1-1.5 мкл) объемов анализируемого образца, применим для анализа неразбавленной крови.
Предложен новый способ оценки антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода. Возможность применения нового способа оценки антиоксидантной активности в водных растворах антиоксидантов доказана сравнением с классическим методом, основанным на регистрации максимума спектра поглощения тиобарбитурат-активных продуктов перекисного окисления липидов, на примере биологических добавок. Впервые оценена антиоксидантная активность наночастиц СеО2. Показано, что антиоксидантная активность наночастиц зависит от условий их синтеза. Показано, что антиоксидантная активность сыворотки крови спортсменов значимо меняется в процессе физической нагрузки, что открывает перспективы применения способа для оценки состояния гипоксии в клинической диагностике.
Практическая значимость. Разработан безреагентный медиаторный биосенсор на глюкозу, обладающий следующими аналитическими характеристиками в проточно-инжекционном режиме: диапазон определяемых концентраций глюкозы 0.5 – 20 мМ, коэффициент чувствительности (1.34±0.06) мА·М-1·см-2. Биосенсор интегрирован в тонкослойную ячейку для минимизации объема пробы, полученная система применима для определения глюкозы в цельной крови. Разработанный способ оценки антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода применим для оценки антиоксидантной активности пищевых продуктов и сыворотки крови в целях клинической диагностики. Кинетический способ оценки антиоксидантной активности позволяет определять активность коллоидных растворов наночастиц, что невозможно сделать другими методами.
Положения, выносимые на защиту:
- Новый способ совместной иммобилизации фермента и медиатора в мембрану без использования ковалентного связывания.
- Фенотиазин – новый медиатор для фермента глюкозооксидазы.
- Создание безреагентного медиаторного глюкозного биосенсора с диапазоном определяемых концентраций глюкозы 0.5 – 20 мМ и коэффициентом чувствительности (1.34±0.06) мА·М-1·см-2 путём совместной иммобилизации глюкозооксидазы и медиатора на поверхности электрода.
- Создание системы для анализа малых объемов (1-1.5 мкл) анализируемого образца путем интеграции биосенсора с тонкослойной ячейкой.
- Новый способ оценки общей антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода под действием антиоксидантов.
- Возможность оценки антиоксидантной активности наночастиц способом, основанным на изучении реакции разложения Н2О2. Зависимость антиоксидантной активности наночастиц от условий их синтеза.
- Способ оценки общего антиоксидантного статуса сыворотки крови на основе определения кинетических параметров реакции разложения пероксида водорода. Значимое возрастание антиоксидантной активности сыворотки крови спортсменов после физической нагрузки.
Апробация работы. Основные результаты диссертационной работы были опубликованы в 11 работах, в том числе в 2 статьях в зарубежных реферируемых научных журналах и тезисах 9 докладов, представленных на всероссийских и международных научных конференциях.
Структура и объем работы. Диссертация состоит из введения, трех основных разделов (обзор литературы, экспериментальная часть, результаты и их обсуждение), выводов и списка литературы (166 ссылок). Работа изложена на 154 страницах машинописного текста, включая 63 рисунка и 17 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Введение
Во введении обоснована актуальность выбранной темы, сформулирована цель исследований, показана научная новизна и практическая значимость работы.
Обзор литературы
В главе 1 систематизированы сведения о модифицированных электродах для определения пероксида водорода в жидких средах. Показано, что амперометрическое определение Н2О2 на электродах, модифицированных берлинской лазурью, имеет, по сравнению с использованием других электродов, следующие преимущества: низкий предел обнаружения, широкий диапазон линейности градуировочной зависимости, отсутствие необходимости предварительной пробоподготовки. В главе 2 систематизированы сведения о методах определения антиоксидантной активности, отмечены преимущества использования пероксида водорода в качестве оксиданта. В главе 3 рассмотрены принцип действия, история создания и классификация биосенсоров. В главе 4 описаны различные способы иммобилизации фермента. Сделанные на основании обзора литературы выводы подтверждают актуальность выбранной темы исследования.
Экспериментальная часть
В экспериментальной части описаны способы иммобилизации медиатора в мембрану полиэлектролита, изготовления и тестирования медиаторного биосенсора в проточно-инжекционной системе, изготовления микрокапиллярной системы и интегрирования в нее биосенсора, изготовления стабилизированных сенсоров на пероксид водорода, оценки антиоксидантной активности кинетическим методом и классическим методом по продуктам перекисного окисления липидов.
Результаты и обсуждение
Глава «Безреагентный биосенсор на основе глюкозооксидазы и медиатора» посвящена созданию безреагентного медиаторного биосенсора на глюкозу на основе фермента – глюкозооксидазы (ГОД) и медиатора (М) – азина, иммобилизованных в мембрану полиэлектролита. Азиновые красители были выбраны в качестве медиатора, так как они обладают достаточно высокими константами скоростей реакции окисления активного центра глюкозооксидазы и редокс-активностью, нетоксичны, могут удерживаться в мембранах полиэлектролита. Кроме того, в отличие от ферроценов и некоторых других медиаторов на основе комплексов переходных металлов, при потенциале разомкнутой цепи они находятся в окисленном состоянии, то есть в состоянии готовности к взаимодействию с активным центром фермента глюкозооксидазы. Это позволяет увеличить селективность определения глюкозы и понизить предел ее обнаружения.
Для выбора наиболее эффективного медиатора, исследовали кинетику взаимодействия различных азинов с активным центром фермента глюкозооксидазы. Самыми низкими константами скорости взаимодействия с глюкозооксидазой (порядка 102 M-1с-1) обладали соединения на основе феноксазина (бриллиантовый крезиловый голубой, галлоцианин). Производные фенотиазина имели более высокие константы скорости взаимодействия с активным центром ГОД (порядка 103 – 104 M-1с-1). Исключением являлся несимметричный оксазин мелдола голубая, бимолекулярная константа скорости взаимодействия с ферментом для которого достигает порядка 105 М-1с-1. Кроме того, заместители боковых ароматических колец оказывали существенное влияние на активность фенотиазинов. Первичный амин в качестве заместителя способствовал большей активности азина, нежели третичный амин. Так, в схожих по структуре тиазинах бимолекулярная константа скорости реакции с ГОД растет в ряду метиленовый голубой < азур а < тионин синхронно с заменой третичных аминогрупп на первичные. По результатам проведенных исследований изученные красители можно выстроить в ряд по снижению скорости реакции с активным центром глюкозооксидазы: мелдола голубая (1,2·105 M-1с-1) > метиленовый зеленый (4·104 M-1с-1) тионин (4,9·104 M-1с-1) > толуидиновый голубой (6·103 M-1с-1) > азур а (4,5·103 M-1с-1) > метиленовый голубой (1,8·103 M-1с-1) > бриллиантовый крезиловый голубой (3,7·102 M-1с-1) > галлоцианин (1,2·102 M-1с-1).
Благодаря высокой степени адгезии к поверхности графитового электрода, малого набухания в водных растворах и биосовместимости для создания мембраны на поверхности электродов был выбран перфторсульфонированный полимер (структурный аналог нафиона).
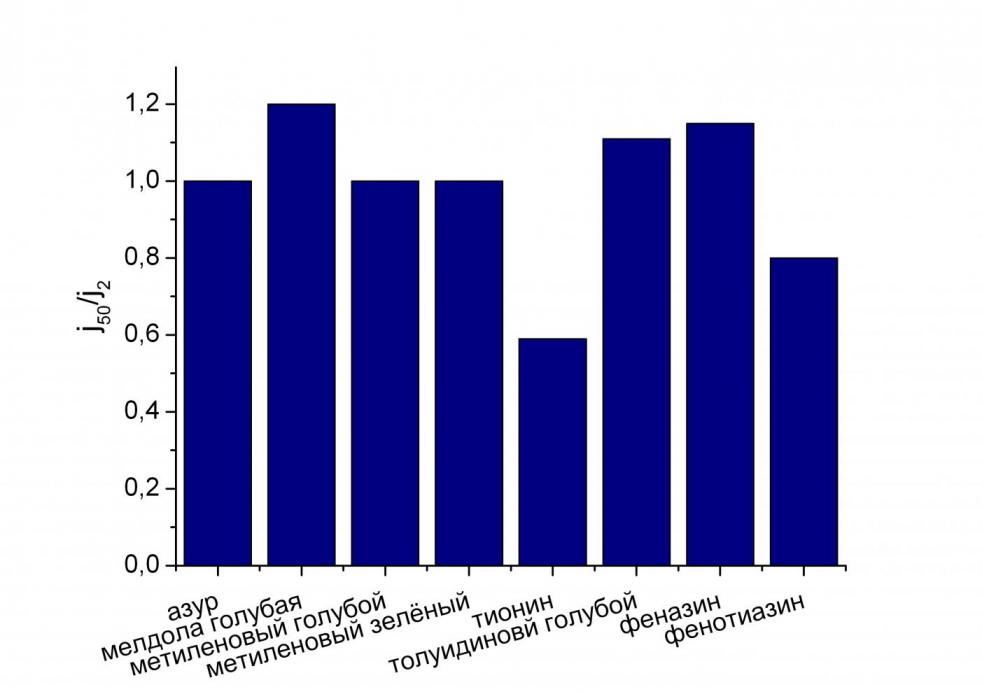 | 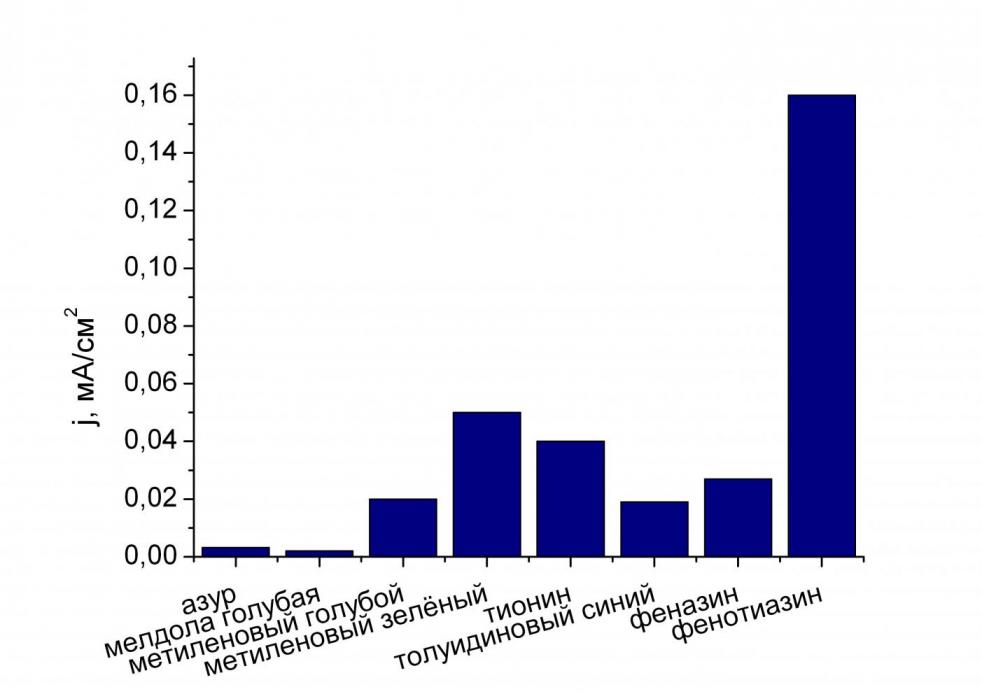 |
| Рис. 1. Стабильность мембран с иммоби-лизованным медиатором. | Рис. 2. Редокс-активность медиаторов в мембране. |
Кроме скорости взаимодействия с активным центром фермента, большую роль в выборе медиатора для создания биосенсора играют стабильность образующейся мембраны и редокс-активность иммобилизованного медиатора. Данные по стабильности и редокс-активности мембран для ряда изученных медиаторов приведены на рис. 1 и 2, соответственно.
Видно, что наибольшей стабильностью обладают мембраны с иммобилизованными мелдолой голубой, феназином и толуидиновым голубым, наименьшей – с фенотиазином и тионином (рис. 1). Наибольшей редокс-активностью обладали фенотиазин, метиленовый зеленый и тионин, наименьшей – мелдола голубая и азур.
Наилучшие медиаторы иммобилизовали совместно с ферментом в мембрану перфторсульфонированного полимера и изучали аналитические характеристики полученных сенсоров. Для решения данной задачи образцы биосенсоров использовали для амперометрического измерения глюкозы в буферном растворе в проточно-инжекционном режиме. Амперометрические измерения проводили при различных потенциалах. Диапазон потенциалов для каждого красителя выбирали исходя из значений потенциалов пиков его циклической вольтамперограммы.
Коэффициент чувствительности биосенсоров на основе мембран, содержащих метиленовый зелёный, азур, толуидиновый голубой, мелдолу голубую, феназин, метиленовый зелёный, оказался отличным от нуля только при потенциалах, меньших – 0,2 В (здесь и далее в работе все потенциалы приведены относительно хлорид-серебряного электрода). Отклики этих биосенсоров были отрицательными по величине тока. Только мембраны, содержащие тионин и фенотиазин, показали положительные по значению тока амперометрические отклики, то есть только для этих медиаторов на электроде протекает реакция реокисления медиатора:
глюкоза + ГОД(ox) глюконолактон +ГОД(red)
ГОД(red) + 2M(ox) ГОД(ox) + 2M(red) + 2H+
2M(red) 2M(ox) + 2e-
и, следовательно, только они подходят для создания глюкозного биосенсора второго поколения.
В биосенсорах с другими медиаторами, вероятнее всего, протекает конкурирующая реакция с кислородом воздуха с образованием пероксида водорода:
Глюкоза+О2 ГОД глюконолактон + H2O2
который восстанавливается на электроде, давая отрицательный амперометрический отклик.
Аналитические характеристики биосенсоров на основе тионина и фенотиазина были изучены в проточно-инжекционном режиме. Результаты суммированы в табл. 1.
Биосенсор на основе фенотиазина показал более высокие аналитические характеристики в стационарном режиме амперометрического определения глюкозы. Кроме того, значения откликов на глюкозу для биосенсоров на основе тионина отличались плохой воспроизводимостью, величина отклика изменялась в среднем на 39% за десять измерений одной и той же концентрации глюкозы. Причина такой плохой воспроизводимости – в низкой стабильности мембраны (рис. 1). По этим причинам для дальнейших исследований в качестве медиатора электронного переноса мы использовали фенотиазин.
Таблица 1. Аналитические характеристики биосенсоров на основе тионина и фенотиазина
| Медиатор | Оптимальный потенциал | Диапазон линейности, М | Величина отклика на 1 мМ глюкозу, мкА/cм2 (P=0.95, n=3) | Коэффициент чувствительности, мА/cм2 M (P=0.95, n=3) | sr (n=10) |
| тионин | 0 В | 10-3 – 3 · 10-3 | 0.24 ± 0.05 | 0.31 ± 0.07 | 0.3 |
| фенотиазин | 0.3 В | 10-3 – 3 · 10-3 | 1.42 ± 0.03 | 2.7 ± 0.3 | 0.05 |
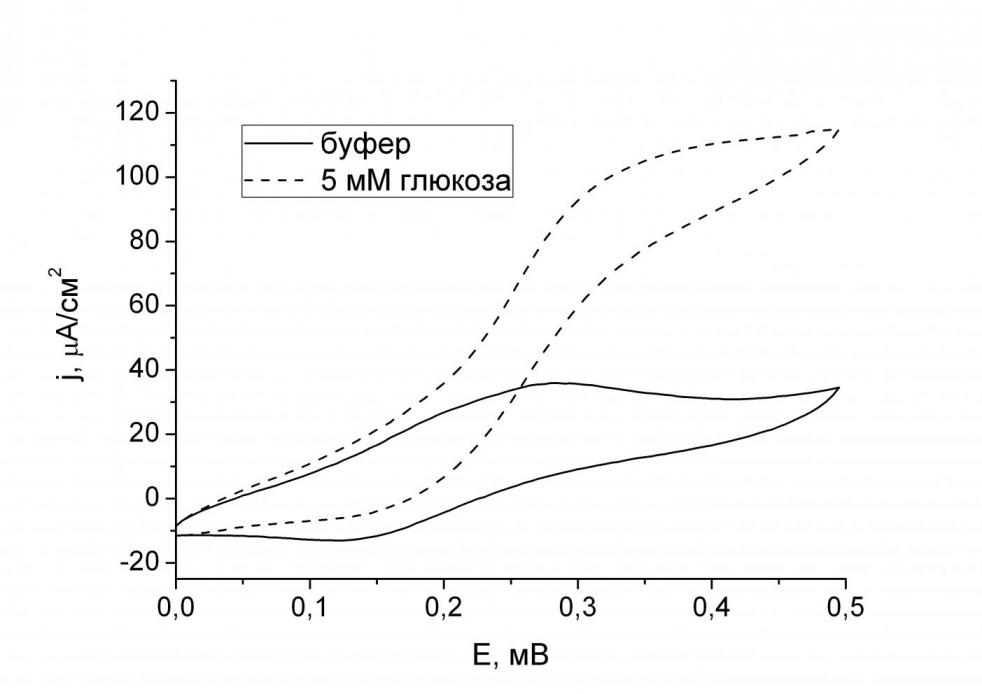 |
| Рис. 3. Циклическая вольтамперограмма электрода с фенотиазином и ГОД, иммобилизованными в мембрану на основе нафиона, скорость развертки 2мВ/с. Фоновый раствор буфера 0.01 M KH2PO4, 0.15 M NaCl, pH 7.0. |
Каталитические свойства мембран на основе перфторсульфонированного полимера с иммобилизованными ферментом – глюкозооксидазой и медиатором – фенотиазином изучали методом циклической вольтамперометрии (рис. 3). Циклические вольтамперограммы (ЦВА) электрода с иммобилизованными в полиэлектролитной мембране глюкозо-оксидазой и фенотиазином после добавления в раствор глюкозы принимают сигмоидный вид, то есть вид каталитической вольтамперограммы: сильное увеличение тока окисления при почти полном исчезновении тока восстановления. Катодный ток исчезает, так как восстановление окисленной формы медиатора (Mox) восстановленной формой ГОД (ГОДred) более эффективно, чем электровосстановление этой формы на электроде. Ток окисления увеличивается, поскольку восстановленная форма медиатора (Mred) регенирируется в каталитической реакции и затем реокисляется на электроде. Ранее подобное изменение формы вольтамперограмм наблюдалось только для свободного медиатора в растворе; подобное поведение для медиатора, иммобилизованного в ферментсодержащую мембрану, показано впервые.
Растворимость фенотиазина в воде пренебрежимо мала, что не позволяет использовать его в системах с медиатором, растворяемым в воде, поэтому в литературе не описано его применение в качестве медиатора глюкозооксидазы. Таким образом, иммобилизация фенотиазина из раствора с высоким содержанием изопропанола в матрицу на основе нафиона, в которой наблюдается его диффузионная подвижность, позволила применять его как новый медиатор глюкозооксидазы.
В дальнейших исследованиях вместо торцевых стеклоуглеродных электродов использовали планарные (screen-printed) электроды. Для этого провели сравнение различных планарных электродов для получения биосенсоров на глюкозу. Наилучшими характеристиками обладали электроды на основе углеродной пасты марки Gwent.
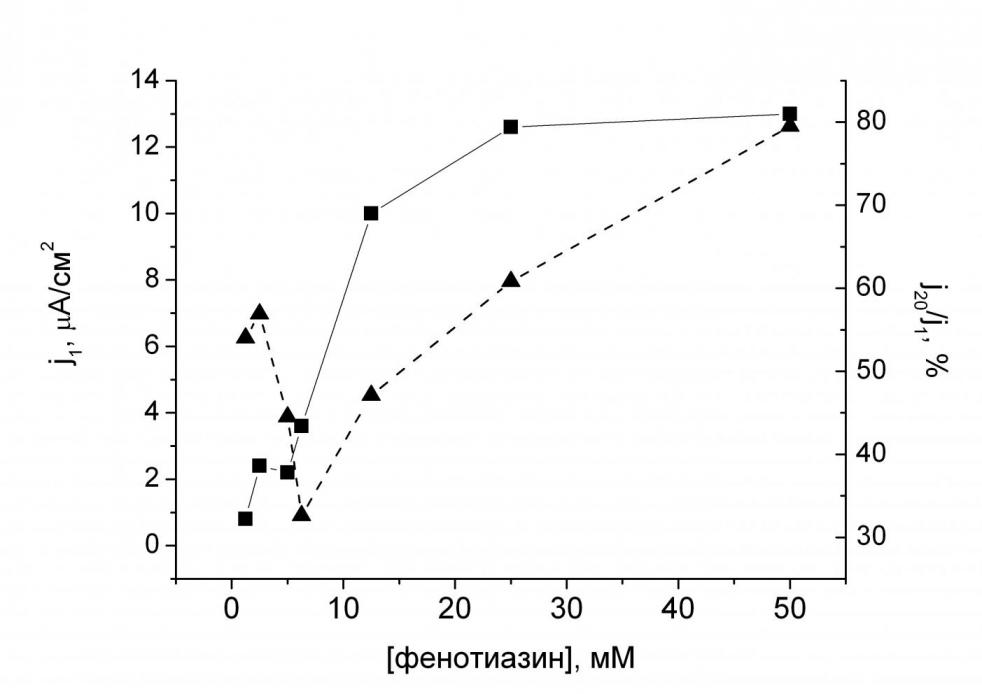 | 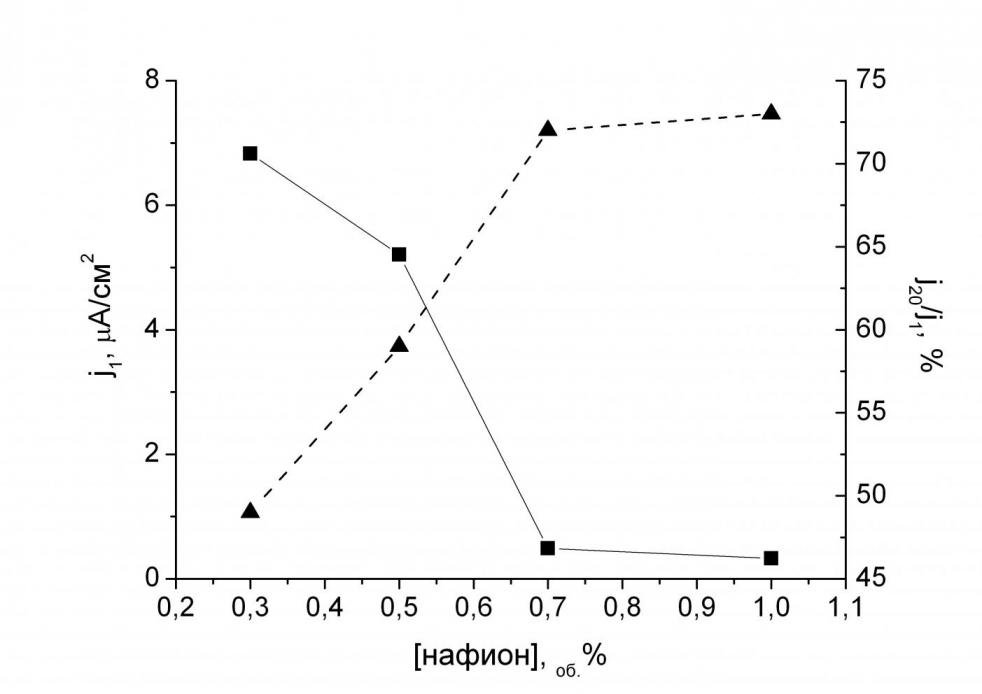 |
| Рис. 4. Выбор оптимальной концентрации фенотиазина. Концентрация нафиона в исходном растворе 0.5об.%, ГОД – 1.5 мг/мл. Фоновый раствор буфера 0.01 M KH2PO4, 0.15 M NaCl, pH 7.0. Потенциал 300 мВ. | Рис. 5. Выбор оптимальной концентрации нафиона в мембране. Концентрация фенотиазина в исходном растворе 12.5 мМ, ГОД – 1.5 мг/мл. Фоновый раствор буфера 0.01 M KH2PO4, 0.15 M NaCl, pH 7.0. Потенциал 300 мВ. |
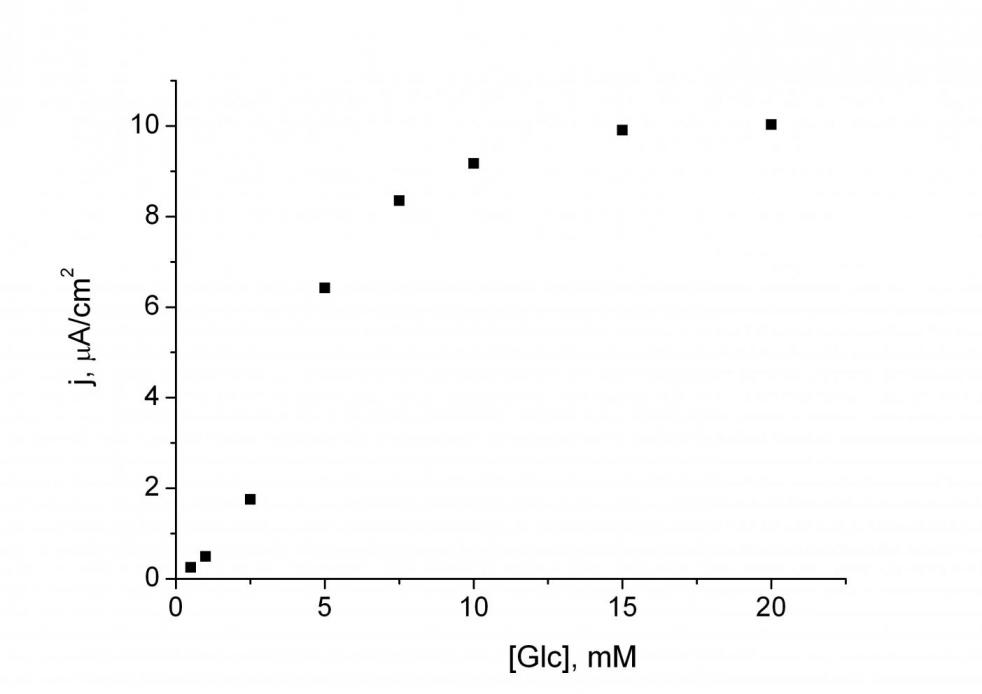 |
| Рис. 6. Градуировочный график для определения глюкозы при помощи планарного биосенсора в проточно-инжекционной системе. Концентрация в исходном растворе фенотиазина 2.5·10-2 М, нафиона 0.5об.%., ГОД 1.5 мг/мл. Раствор буфера 0.01 M KH2PO4, 0.15 M NaCl, pH 7.0. Потенциал 300 мВ. Скорость потока 0.65 мл/мин. |
Для получения биосенсоров с наилучшими аналитическими характеристиками проводили оптимизацию состава мембраны по величине отклика на присутствие 5 мМ глюкозы (что соответствует физиологической концентрации) и стабильности отклика электрода в проточно-инжекционном режиме (рис. 4, 5). Оптимальный состав мембраны был следующим: концентрация в исходном растворе нафиона 0.5об.%, фенотиазина – 25 мМ. В качестве оптимальной концентрации фенотиазина в мембране выбрали 25 мМ, т.к. несмотря на лучшие характеристики сенсоров с высоким содержанием фенотиазина (50 мМ) воспроизводимость результатов измерений была невысокой вследствие образования пересыщенных растворов медиатора.
В течение двух недель хранения в сухом виде в холодильнике снижения отклика биосенсора не наблюдалось.
Аналитические характеристики полученного биосенсора определяли в проточно-инжекционном режиме при рабочем потенциале 300 мВ (рис. 6). Диапазон определяемых концентраций составил 0.5 – 20 мМ глюкозы, коэффициент чувствительности – 1.34±0.06 мА·М-1·см-2, время отклика 30 секунд, объем образца 50 мкл.
Провели анализ образца крови (без предварительной пробоподготовки) в проточно-инжекционной системе при помощи биосенсора на основе фенотиазина (табл. 2). Концентрацию глюкозы в цельной крови определяли методами градуировочного графика и добавок. Из таблицы видно, что данные, полученные обоими методами, совпадают в пределах погрешности.
Таблица 2. Определение глюкозы в проточно-инжекционной системе (P = 0.95, n = 3)
| Определение по | сглюкозы, мМ (Vпробы = 50 мкл) |
| градуировочному графику | 3.2 ± 0.3 |
| методу добавок | 3.3 ± 0.4 |
Таким образом, разработан новый глюкозный биосенсор второго поколения на основе фенотиазина, имеющий следующие характеристики: время отклика 20 – 30 с, коэффициент чувствительности 1.34 мА/Мсм2, линейный диапазон от 0.5 до 5 мМ глюкозы, а диапазон гиперболической зависимости до 20 мМ. Биосенсоры также сохраняли чувствительность после 2 недель хранения при температуре 4°С. Показана применимость полученных биосенсоров для определения концентрации глюкозы в цельной крови в проточно-инжекционном режиме.
В главе «Конструирование электроаналитической системы для определения глюкозы в цельной крови» рассмотрены микрокапиллярные системы для анализа малых объемов образца с интегрированным биосенсором на глюкозу. Для создания капиллярной ячейки использовали двустороннюю клейкую ленту, оставляя незаклеенную полоску шириной 1.5 мм, содержащую часть рабочего и вспомогательного электрода, а также электрода сравнения. Сверху помещали крышку из пластика, внутренняя поверхность которой была обработана ПАВ для гидрофилизации капилляра и обеспечения всасывания пробы. Таким образом, разработана конструкция тонкослойной ячейки с самозаполнением для анализа малых объемов. Мембрану биосенсора наносили на поверхность рабочего электрода до нанесения капилляра.
Полученная электрохимическая система обладала следующими характеристиками: коэффициент чувствительности (6.3±0.3) мКл/М, диапазон определяемых концентраций
1 – 20 мМ глюкозы, время анализа 10 с., объем образца 1.5 мкл. Изучена примененимость полученных систем с интегрированным биосенсором для определения концентрации глюкозы в цельной крови. Определенная концентрация глюкозы равнялась 5.3 мМ (± 0.7 мМ). Для подтверждения правильности результата использовали метод определения глюкозы в разбавленной крови при помощи биосенсора первого поколения, разработанного ранее в нашей лаборатории, в проточно-инжекционном режиме. Концентрация глюкозы в образце крови составила 6 мМ (± 0.2 мМ), что совпадает с концентрацией, определенной с помощью микрокапиллярных ячеек в пределах погрешности.
Таким образом, разработана новая электроаналитическая система на основе безреагентного биосенсора на глюкозу, интегрированного в капиллярную ячейку, и показана применимость созданной систамы для анализа малых объемов неразбавленной крови.
В главе «Оценка антиоксидантной активности пищевых продуктов» рассмотрен новый способ оценки антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода под действием антиоксидантов. Для контроля за концентрацией пероксида водорода в образце использовали сенсор на основе берлинской лазури, разработанный ранее в нашей лаборатории.
Эксперимент проводили следующим образом. Образец помещали в трехэлектродную ячейку. В течение 5-7 мин. измеряли базовое значение тока до его выхода на постоянный уровень. После этого в ячейку добавляли пероксид водорода и следили за изменением его концентрации в растворе. Максимальное значение отклика на пероксид водорода устанавливалось в течение 10 с. О кинетике разложения пероксида водорода судили по падению отклика электрода во времени. В присутствии антиоксидантов наблюдается плавное падение величины отклика датчика, связанное с уменьшением концентрации пероксида водорода в растворе. Измерение проводили до тех пор, пока изменение тока не составляло менее чем 1 нА/мин. Для каждого образца измерение повторяли 3 – 4 раза. За стабильностью электрода следили по изменению его отклика на постоянную концентрацию пероксида водорода в течение эксперимента.
Исходя из градуировочной зависимости для используемого сенсора, в качестве постоянной исходной концентрации инжектируемого пероксида водорода использовали кон-центрацию в растворе 50 мкМ. Чувствительность датчика составила (0.23±0.08) А·см-2·М-1.
Разработанный способ был применен для оценки антиоксидантной активности в реальных объектах. В качестве такого объекта первоначально были выбраны сухие соки сублимационной сушки, предоставленные нам научно-исследовательской лабораторией адаптационной медицины (Факультет фундаментальной медицины). В ходе данной работы была измерена антиоксидантная активность этих продуктов в водной среде в рекомендованной производителем концентрации. Типичная зависимость концентрации пероксида водорода от времени представлена на рис. 7. О кинетике разложения пероксида водорода судили по падению отклика электрода во времени. Из рисунка видно, что в растворе антиоксиданта (БАД на основе свеклы) концентрация пероксида водорода непрерывно уменьшается, в то время как в отсутствие антиоксидантной активности (БАД на основе клюквы) она не меняется.
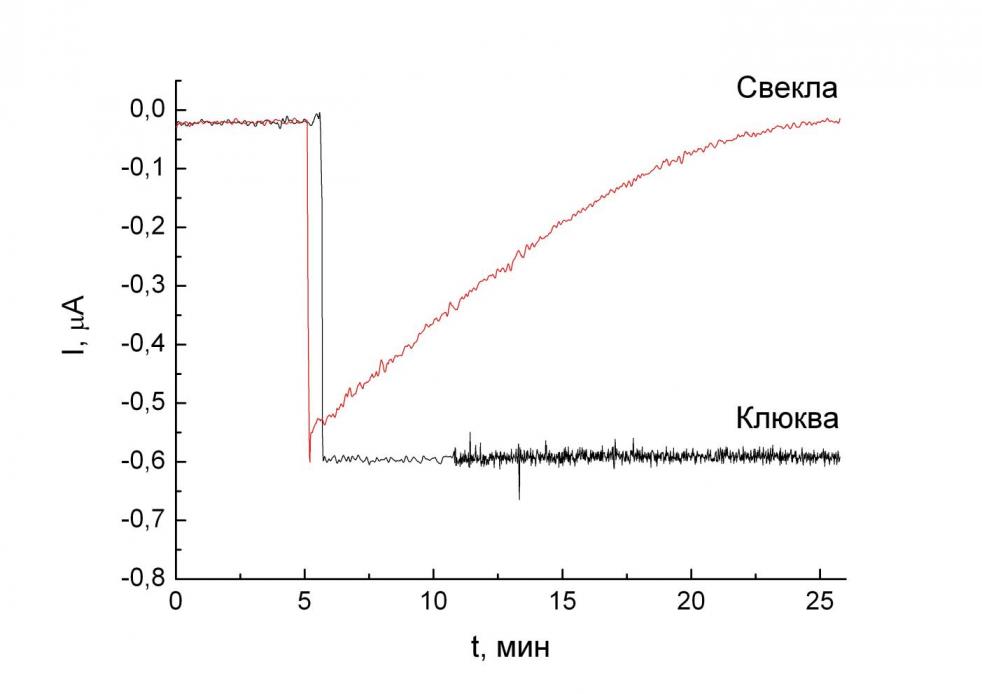 | 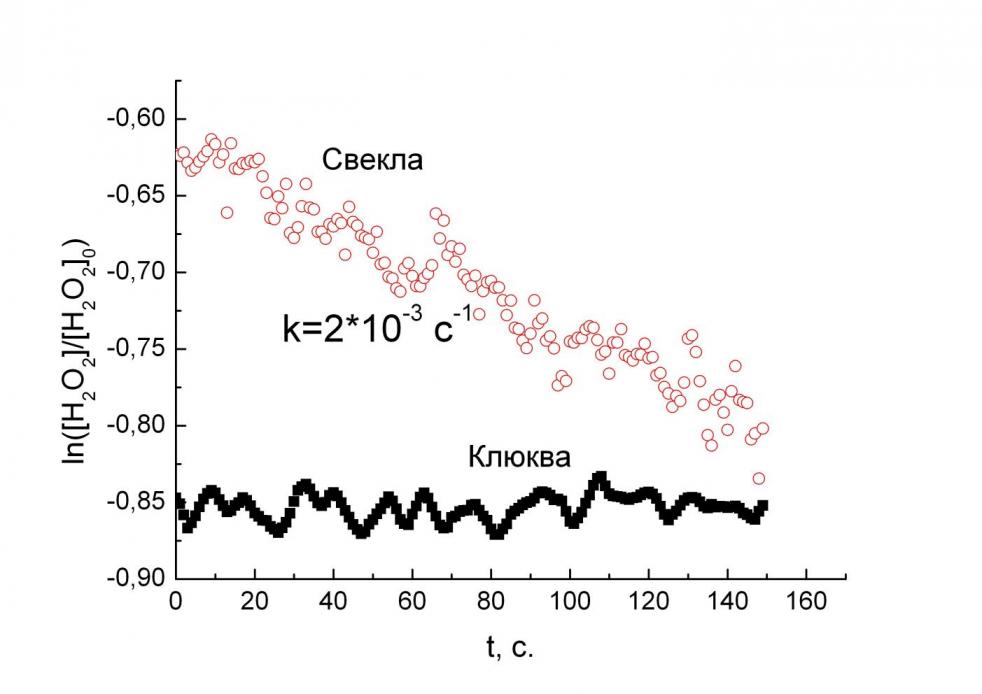 |
| Рис. 7. Зависимость тока датчика на пероксид водорода от времени в растворах БАД. Фоновый раствор 0.1 M КCl, 0.05 M KH2PO4, pH 6.0, потенциал 0 В. | Рис. 8. Зависимость логарифма остаточной концентрации пероксида водорода от времени. Фоновый раствор 0.1 M КCl, 0.05 M KH2PO4, pH 6.0, потенциал 0 В. |
Изучение кинетики разложения пероксида водорода показало, что реакция идет по псевдопервому порядку. Константа скорости в таких реакциях измеряется как тангенс угла наклона прямой в полулогарифмических координатах (рис. 8); антиоксидантная активность тем выше, чем больше эта константа. Полученные данные представлены в табл. 3. Для стандартизации данных, полученных разными методами и, как следствие, выраженных в различных единицах измерения, часто используют метод тролоксовых эквивалентов. Для этого изучают зависимость антиоксидантной активности от концентрации тролокса при использовании какого-либо метода, и активность других образцов выражают в эквивалентах тролокса. Согласно результатам измерения, антиоксидантная активность стандартного антиоксиданта (тролокса) была прямо пропорциональна его концентрации: тангенс угла наклона зависимости составил 0.093 М-1с-1. Таким образом, антиоксидантную активность образцов можно представить как количество тролокса, эквивалентное данному образцу по активности (табл. 3).
Таблица 3. Антиоксидантная активность соков сублимационной сушки (данные, полученные предложенным методом) (Р = 0.95, n = 3)
| БАД на основе | Константа, с-1 | Тролокс. эквивалент, мМ |
| свеклы (Beta) | (2.1±0.4)*10-3 | 23±4 |
| клюквы (Vaccinium) | <10-4 | <1 |
| бадана (Bergenia) | (4.9±0.6)*10-3 | 53±6 |
| моркови (Daucus) | <10-4 | <1 |
| облепихи (Hippopha) | (2.2±0.3)*10-3 | 24±3 |
Для подтверждения применимости предложенного способа использовали классический метод оценки антиоксидантной активности, основанный на регистрации максимума спектра поглощения тиобарбитурат-активных (ТБК-активных) продуктов перекисного окисления липидов. Метод основан на индукции окисления в биологических мембранах при помощи пероксида водорода и изучении степени подавления окисления в присутствии антиоксидантов. Концентрацию окисленных продуктов измеряли спектрофотометрически по величине оптической плотности при 532 нм.
Степень подавления окисления (Y) рассчитывали по формуле:
![]() ,
,
где А(50) – OD532 после 50 мин. инкубации, А(0) – OD532 в нулевой точке, АК(50) – OD532 в пробе без антиоксидантов после 50 мин. инкубации, АК(0) – OD532 в пробе без антиоксидантов в нулевой точке. Данные по степени подавления окисления приведены в табл. 4.
Таблица 4. Антиоксидантная активность соков сублимационной сушки (данные, полученные стандартным методом) (P = 0.95, n = 3)
| БАД на основе | Степень подавления окисления, % |
| свеклы (Beta) | 44.2 |
| клюквы (Vaccinium) | 95.5 |
| бадана (Bergenia) | 100 |
| моркови (Daucus) | 21.2 |
| облепихи (Hippopha) | 33.3 |
Из табл. 4 видно, что все антиоксиданты проявляют антиоксидантную активность, которая убывает в ряду: баданклюква>свекла>облепиха>морковь.
При сравнении результатов, полученных обоими методами, видно, что данные об антиоксидантной активности большинства веществ согласуются. Однако некоторые вещества, не способные разлагать пероксид водорода, тем не менее, проявляли антиоксидантную активность при индуцировании окисления в системах с биологическими мембранами. Это может быть связано, например, с тем, что присутствующие в составе таких экстрактов антиоксиданты работают на границе раздела водной и липофильной сред, но не в водной фазе. Поэтому при измерениях антиоксидантной активности предлагаемым в данной работе новым способом такие экстракты не проявляли никакой активности, а при проведении реакции в присутствии биологических мембран те же экстракты подавляли окисление липидов. Предлагаемый способ, в отличие от классического, не предполагает использования биологических мембран (которые сложно получить и невозможно стандартизировать), он гораздо более прост и экспрессен (анализ длится 15 мин., вместо 3 часов).
Таким образом, разработанный нами метод позволяет оценить антиоксидантную активность в сухих экстрактах и соках по показателям, полученным из кинетических кривых разложения пероксида водорода, и выразить антиоксидантную активность в единицах эквивалентов тролокса.
В главе «Оценка антиоксидантной активности сыворотки крови» описано применение нового способа оценки антиоксидантной активности для анализа образцов сыворотки крови.
Для уменьшения травматичности при отборе анализируемого образца требовалось уменьшить необходимый для анализа объем. Для этого было необходимо уменьшить объем ячейки. Была изготовлена ячейка объемом 0.7 мл. Но эксперимент показал, что при таком снижении объема ячейки ток восстановления пероксида водорода падает даже в отсутствии антиоксидантов в образце. Такое падение вызвано уменьшением концентрации пероксида водорода в растворе за счет его расходования при измерении концентрации. В ячейках большего объема (12–15 мл), в которых эксперименты проводились ранее, подобный эффект не наблюдался, так как количество вещества в них было гораздо больше, и концентрация пероксида водорода за счет измерения при 0 мВ уменьшалась примерно на 0.3% за 1000 с. В ячейке объемом 0.7 мл аналогичное изменение концентрации составляет 7%. Для уменьшения данного эффекта повысили потенциал измерения до 100 мВ, что позволяет снизить отклик электрода на пероксид водорода и, соответственно, количество пероксида, затраченное на измерение в единицу времени. При потенциале 100 мВ падение отклика на пероксид водорода не наблюдалось в течение 1 часа; этого времени достаточно для проведения измерений.
Была измерена антиоксидантная активность сыворотки крови спортсменов до и после нагрузки («тест на отказ» – спортсмены подвергались интенсивной физической нагрузке). Перед измерением образцы разбавляли фосфатным буферным раствором (рН 6.0) в 10 раз.
Воспроизводимость результатов анализа составляет в среднем 10%. Среднее значение антиоксидантной активности до нагрузки составляло (1.0±0.3)·103 с-1, после нагрузки – (2.0±0.4)·103 с-1; таким образом, наблюдается значимое различие между значениями антиоксидантной активности до и после нагрузки. Природа этого явления до конца не изучена, но можно предположить, что оно обусловлено гипоксией, вызванной интенсивной физической нагрузкой. Данные анализа сыворотки крови всех спортсменов приведены в виде диаграммы на рис. 9.
Видно, что увеличение антиоксидантной активности в сыворотке крови после нагрузки наблюдается для всех исследованных спортсменов. По величине изменения антиоксидантной активности при одинаковой физической нагрузке можно делать предположения о подверженности спортсмена гипоксии и, следовательно, о его общей физической подготовке.
Таким образом, разработанный нами метод позволяет оценить антиоксидантную активность в сыворотке крови по показателям, полученным из кинетических кривых разложения пероксида водорода в амперометрическом режиме.
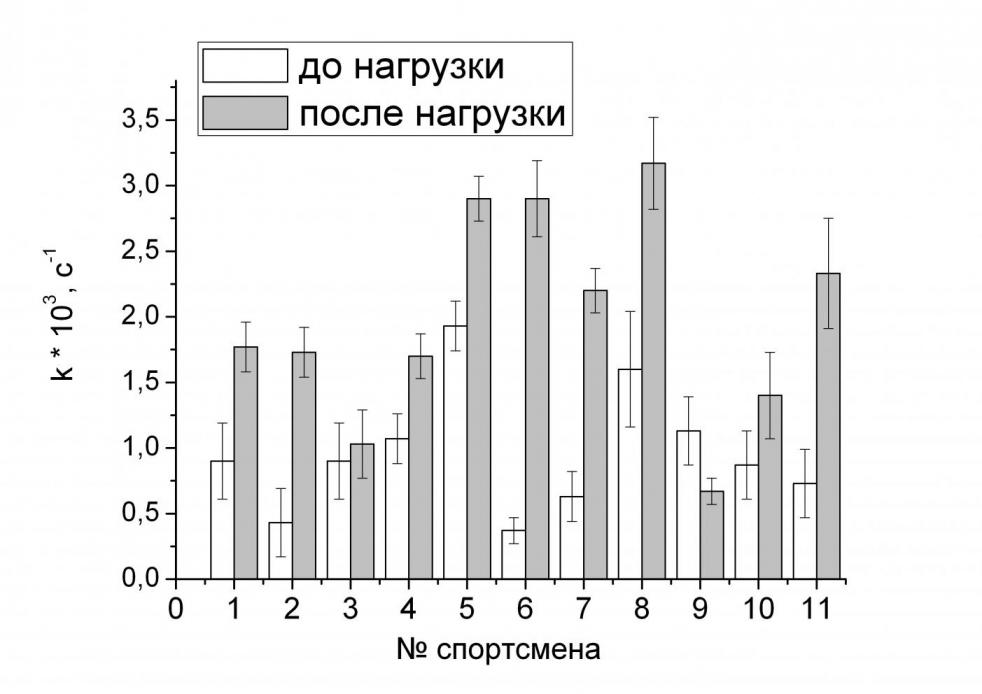
Рис. 9. Результаты определения антиоксидантной активности в сыворотке крови спортсменов до нагрузки и после нагрузки («тест на отказ»).
Глава «Оценка антиоксидантной активности в коллоидных растворах диоксида церия» посвящена применению нового способа для анализа коллоидных растворов наночастиц диоксида церия.
Известно, что наночастицы способны оказывать негативное воздействие на живые системы вследствие присущих им малых размеров, большой удельной поверхности, высокой реакционной способности, особенностей электронного строения, высокой растворимости, способности к агрегации и, в отдельных случаях, специфической формы. Одним из наиболее распространенных факторов, обусловливающих токсичность наночастиц, является их способность индуцировать окислительный стресс, то есть генерировать активные формы кислорода.
В то же время некоторые наночастицы способны проявлять антиоксидантную активность. В частности, уникальной биологической активностью, обусловленной антиоксидантными свойствами, обладает нанодисперсный диоксид церия. Перспективы биологического применения нанокристаллического диоксида церия обусловлены двумя основными факторами: присущей данному материалу высокой кислородной нестехиометрией и его низкой токсичностью. Первый фактор обусловливает активность CeO2 в окислительно-восстановительных процессах, особенно при поглощении активных форм кислорода, в том числе свободных радикалов. Второй обеспечивает сравнительную безопасность применения наночастиц CeO2 in vivo. К специфическим свойствам CeO2 следует отнести способность к регенерации, которая выражается в том, что наночастицы диоксида церия, принимавшие участие в окислительно-восстановительном процессе, за сравнительно небольшой промежуток времени способны возвращаться (в отношении кислородной нестехиометрии) к исходному состоянию.
Несмотря на значительный объем экспериментальных данных, характеризующих биологическую активность CeO2, прямое измерение антиоксидантных характеристик этого материала не представлялось возможным. Но использование нового способа позволило провести оценку антиоксидантной активности таких образцов. Образцы для анализа были предоставлены Институтом общей и неорганической химии имени Н.С.Курнакова. Согласно данным ПЭМ, золи состояли из частиц CeO2 размером 2–5 нм, имеющих форму, близкую к изотропной. Степень агрегации наночастиц в золях сравнительно невелика, однако наблюдалось образование линейных агрегатов частиц. По данным динамического светорассеяния, в обоих золях помимо индивидуальных частиц с гидродинамическим диаметром около 4 нм, присутствовали также более крупные агрегаты и агломераты частиц с размерами около 300 и 1500 нм. Более того, золь CeO2-I со временем терял седиментационную устойчивость. Согласно результатам анализа уширений дифракционных максимумов, размеры областей когерентного рассеяния образцов CeO2, полученных центрифугированием золей CeO2-I и CeO2-II, составили 3.9 и 4.0 нм, соответственно, что согласуется с данными ПЭМ. Можно констатировать, что размеры частиц CeO2, осажденных из растворов нитрата церия(III) и лимонной кислоты различного состава, различались незначительно.
Оценку антиоксидантной активности водных коллоидных растворов наночастиц диоксида церия проводили описанным выше способом. Так как при разбавлении образца фосфатным буфером наблюдалось постепенное помутнение раствора (свидетельствующее о нарушении стабильности частиц СеО2 в коллоидном растворе), использовали цитратный буфер. Данные по антиоксидантной активности образцов представлены в табл. 5. Образец CeO2-II обладает значимо большей активностью, чем образец CeO2-I, что может быть связано с меньшей агрегированностью наночастиц СеО2.
| Образец | k/[CeO2], М-1·с-1 |
| CeO2-I | 0.7±0.1 |
| CeO2-II | 1.6±0.4 |
Таблица 5. Антиоксидантная активность водных коллоидных растворов наночастиц диоксида церия, пересчитанная на 1 М СеО2
Таким образом, продемонстрирована принципиальная возможность использования способа на основе определения кинетических параметров реакции разложения пероксида водорода для оценки антиоксидантной активности коллоидных растворов наночастиц. Показано, что антиоксидантная активность наночастиц в значительной мере зависит от условий их синтеза.
ВЫВОДЫ
- Разработан новый способ совместной иммобилизации фермента и медиатора без использования ковалентного связывания в полимерные мембраны из сред с высоким содержанием органического растворителя. Показано, что в полученной ферментсодержащей полимерной мембране медиатор сохраняет диффузионную подвижность. Найден новый медиатор для фермента глюкозооксидазы – фенотиазин.
- Путём совместной иммобилизации глюкозооксидазы и медиатора создан безреагентный глюкозный биосенсор второго поколения, со следующими аналитическими характеристиками: диапазон определяемых концентраций глюкозы 0.5 – 20 мМ, коэффициент чувствительности (1.34±0.06) мА·М-1·см-2. Путем интеграции биосенсора с тонкослойной ячейкой создана система для анализа малых объемов (1-1.5 мкл) цельной крови; время анализа составило 10 с.
- Предложен способ оценки антиоксидантной активности по кинетическим параметрам реакции разложения пероксида водорода. На примере анализа биологических добавок показана корреляция результатов, полученных предложенным способом и классическим методом, основанным на регистрации максимума спектра поглощения тиобарбитурат-активных продуктов перекисного окисления липидов.
- Показана возможность оценки общего антиоксидантного статуса сыворотки крови с помощью способа, основанного на определении кинетических параметров реакции разложения пероксида водорода. Антиоксидантная активность сыворотки крови спортсменов коррелирует с наличием гипоксии, вызванной физической нагрузкой.
- Продемонстрирована принципиальная возможность использования сенсоров на основе берлинской лазури для оценки антиоксидантной активности наночастиц способом, основанным на мониторинге реакции разложения Н2О2. Показано, что антиоксидантная активность наночастиц в значительной мере зависит от условий их синтеза.
Основное содержание диссертации изложено в публикациях:
- Karyakina E.E., Vokhmyanina D.V., Sazontova T.G., Sabitov A.N., Borisova A.V., Arkhipenko Yu.V., Tkachuk V.A., Zolotov Yu.A., Karyakin A.A. Kinetic approach for evaluation of total antioxidant activity in food samples // Talanta. 2009. V. 80. P. 749–753.
- Sekretaryova A.N., Vokhmyanina D.V., Chulanova T.O., Karyakina E.E., Karyakin A.A. Reagentless Biosensor Based on Glucose Oxidase Wired by the Mediator Freely Diffusing in Enzyme Containing Membrane // Anal. Chem. 2012. V. 84. P. 12201223.
- Вохмянина Д.В., Чуланова Т.О., Карякин А.А. Электрохимические биосенсоры для индивидуальной диагностики уровня глюкозы в крови. / Съезд аналитиков России: Аналитическая химия – новые методы и возможности. Пансионат «Клязьма». 2010.
- Vokhmyanina D.V., Karyakin A.A. Kinetic approach for evaluation of total antioxidant activity / Second Regional Symposium on Electrochemistry: South-East Europe. Belgrade. 2010. P. 73.
- Vokhmyanina D.V., Chulanova T.O., Karyakin A.A. Reagentless electrochemical glucose biosensors based on enzyme-containing membrane with immobilized azines / Третий международный конкурс научных работ молодых ученых в области нанотехнологий. Москва. 2010.
- Вохмянина Д.В. Тест-система для анализа глюкозы в цельной крови / XVIII Международная конференция студентов, аспирантов и молодых ученых «Ломоносов – 2011». Москва. 2011. C. 78.
- Вохмянина Д.В. Новый метод определения антиоксидантной активности. / V Всероссийская конференция студентов и аспирантов «Химия в современном мире». Санкт-Петербург. 2011. C. 67.
- Вохмянина Д.В., Карякин А.А. Новый метод определения антиоксидантной активности с помощью сенсоров на пероксид водорода. Применение для анализа пищевых продуктов и клинической диагностики / Третья выставка инновационных проектов, посвященная 300-летию М.В.Ломоносова. Москва. 2011. C. 6.
- Вохмянина Д.В., Карякин А.А. Кинетический метод оценки антиоксидантной активности / XI конференция молодых ученых "Актуальные проблемы неорганической химии: наноматериалы, их исследование и модификация при помощи синхротронного излучения". Звенигород. 2011. C. 7.
- Вохмянина Д.В., Карякин А.А. Кинетический метод оценки: применение для клинической диагностики / VIII Всероссийская конференция по электрохимическим методам анализа «ЭМА-2012». Уфа-Абзаково. 2012. C. 44.
- Vokhmyanina D.V., Sekretaryova A.N., Chulanova T.O., Karyakin A.A. Reagentless biosensor based on glucose oxidase wired by the mediator freely diffusing in enzyme containing membrane / 63 Annual Meeting of the International Society of Electrochemistry. Prague. 2012. P. 87.

