Строение и магнитные свойства координационных соединений меди( ii ) и никеля ( ii ) с нек о торыми бензоксазинами
На правах рукописи

Исаева Элина Лечаевна
Строение и магнитные свойства
координационных соединений меди(II) и
никеля(II) с некоторыми бензоксазинами
Специальность: 02.00.01 – неорганическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Краснодар 2011
Работа выполнена на кафедре общей и неорганической химии
Чеченского государственного университета
Научный руководитель: кандидат химических наук, профессор,
Шамсутдинова Медина Хумаидовна
Официальные оппоненты: доктор технических наук, профессор
Боковикова Татьяна Николаевна
кандидат химических наук, доцент
Горохов Роман Вячеславович
Ведущая организация: Южный научный центр РАН (г. Ростов-на-Дону)
Защита диссертации состоится 26 декабря 2011 года в 14.00 на заседании диссертационного совета Д 212.101.10 при Кубанском государственном университете по адресу: 350040, г. Краснодар, ул. Ставропольская, 149, ауд. 231.
С диссертацией можно ознакомиться в библиотеке Кубанского государственного университета по адресу: 350040 г. Краснодар, ул. Ставропольская, 149.
Автореферат разослан «___» ноября 2011 г.
Ученый секретарь
диссертационного совета Д 212.101.10
кандидат химических наук Ф.А. Колоколов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Одним из типов координационных соединений, привлекающих внимание исследователей, являются полиядерные комплексы. Среди них особый интерес вызывают обменные кластеры – соединения, содержащие обменно-связанные парамагнитные ионы переходных металлов. Этот интерес, в первую очередь, связан с обширной областью применения обменных кластеров в передовых компьютерных технологиях, квантовой оптике и электронике. Обменные кластеры переходных металлов представляют также самостоятельный интерес для химии координационных соединений и катализа. Будучи составной частью важнейших биологических систем, кластеры стали объектом биофизической и бионеорганической химии. Целенаправленный поиск и синтез соединений с заданными свойствами тесно связан с уровнем знаний о структуре и электронно-ядерном строении кластеров, различных видов взаимодействия: кристаллических полях, обменных и сверхтонких взаимодействиях. Для адекватного описания магнитных свойств даже наиболее простых представителей обменно-связанных систем – биядерных комплексов – необходим одновременный учет широкого многообразия факторов электронного и геометрического характера, оказывающих определяющее влияние на силу обменных эффектов между парамагнитными центрами. Возможным путем решения этой задачи является изучение физико-химических свойств близких по составу и строению комплексов, в которых осуществляется варьирование небольшого числа отдельных факторов при условии относительного постоянства остальных. Одним из классов координационных соединений, открывающих широкие возможности для решения указанных задач, являются комплексы переходных металлов с производными бензоксазинов. Являясь би- и тридентатными азометиновыми лигандами, эти соединения позволяют проследить конкурентную способность их донорных центров в координации с атомом металла. Варьирование деталей тонкого строения лигандных систем и комплексов на их основе позволяет проследить влияние подобного изменения как на особенности проявления обменных эффектов в комплексах, так и на состав и строение изучаемых хелатных узлов и комплексов в целом. Следует также отметить большое практическое значение данного класса соединений. Многие производные 1,2-дигидро-4H-3,1-бензоксазинов и комплексы на их основе проявляют высокую физиологическую активность: антимикробное, противоопухолевое и др. действие.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 06-03-32881).
Цель работы состояла в изучении строения и магнитных свойств комплексных соединений Сu(II) и Ni(II) с 2-[2-гидроксифенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином (L1), 2-[2-гидрокси-5-нитрофенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином (L2), 2-[2-гидроксифенил]-1,2-дигидро-4Н-3,1-бензоксазином (L3), 2-[2-гидрокси-5-нитрофенил]-1,2-дигидро-4Н-3,1-бензоксазином (L4).
При этом решались следующие задачи:
1. Изучение координационных соединений в растворе методом электронной спектроскопии, расчет энергии d-d-переходов по методу модели углового перекрывания (МУП) с учетом геометрии твердых комплексов.
2. Экспериментальное изучение структуры димерных хелатов меди(II) и никеля(II) с использованием магнетохимического метода, спектроскопических методов (УФ, ИК, ЭПР), рентгеноструктурного анализа.
3. Анализ электронного влияния заместителей в молекулах лигандов на характер обменного взаимодействия в биядерных комплексах и их магнитные свойства.
На защиту выносятся:
1. Результаты изучения строения координационных соединений Cu(II) и Ni(II) с производными бензоксазинов в растворе и в твердом состоянии.
2. Сопоставление расчетов энергии d-d-переходов со структурой координационных соединений.
3. Результаты изучения магнитных свойств биядерных комплексных соединений Cu(II) и Ni(II) с производными бензоксазинов.
4. Сравнение результатов экспериментальных измерений спектроскопических и магнитных свойств комплексных соединений с результатами квантово-химических расчетов зарядового распределения на мостиковых атомах в структурах комплексных соединений.
Научная новизна:
1. Впервые изучены магнитные свойства комплексных соединений Cu(II) и Ni(II) с некоторыми бензоксазинами. Комплексное использование этих данных и данных других физико-химических методов (УФ, ИК, ЭПР, РСА) позволили надежно идентифицировать структуры полученных биядерных комплексов Cu(II) и Ni(II).
2. Установлено явление твердофазной димеризации комплексных соединений Cu(II) и Ni(II) с бензоксазинами. В рамках известных соотношений между энергиями МО биядерных комплексов и величинами обменных параметров проведено сопоставление разности энергий модельных биядерных систем с экспериментальными значениями 2J и выявлены основные факторы, определяющие обменные взаимодействия.
Практическая значимость работы заключается в получении новых данных о магнитных свойствах комплексных соединений Cu(II) и Ni(II) с бензоксазинами. Полученные экспериментальные и теоретические данные позволяют прогнозировать магнитные поведения комплексов Cu(II) и Ni(II), что открывает новые возможности использования магнитных материалов с заданными свойствами.
Результаты исследований используются при чтении специальных курсов на факультете химии и высоких технологий КубГУ, а также могут быть использованы при проведении исследований в МГУ, ЮФУ, Казанском и др. университетах, ИОНХ и ИФХЭ РАН и др.
Апробация работы. Основные результаты представлены и обсуждены на V и VII Международных конференциях по новым технологиям и приложениям современных физико-химических методов для изучения окружающей среды (Ростов-на-Дону, 2009), Международной научно-практической Интернет-конференции «Современные направления теоретических и прикладных исследований 2009» (Одесса, 2009), XXIV Международной Чугаевской конференции по координационной химии (Санкт-Петербург, 2009), Международной конференции «Новые направления в химии гетероциклических соединений» (Кисловодск, 2009), I Международной молодежной школы-конференции по физической химии краун-соединений, порфиринов и фталоцианинов (Туапсе, 2009), II Международной молодежной школы-конференции «Супрамолекулярные системы на поверхности раздела» (Туапсе, 2010), VII и VIII Международных конференциях «Спектроскопия координационных соединений». – (Туапсе, 2010, 2011).
Публикации. Основное содержание работы опубликовано в 3-х статьях и 11 тезисах докладов, сделанных на международных и российских конференциях.
Объём и структура диссертации. Диссертация состоит из введения, трех глав, выводов, списка литературы и приложений. Работа изложена на 109 страницах машинописного текста, включает 5 таблиц, 16 рисунков, и приложения. Список литературы содержит 109 библиографических наименований.
Основное СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснованы актуальность, цель и задачи диссертационной работы.
В первой главе приведен обзор литературных данных, которые отражают методы синтеза, исследование состава и строения хелатных комплексных соединений переходных металлов с основаниями Шиффа. Рассмотрены магнитные свойства биядерных комплексных соединений переходных металлов, факторы, влияющие на них, среди которых важное место занимает величина валентного угла в обменном фрагменте. Рассмотрена геометрическая модель (В.В. Луков, В.А. Коган) для биядерных комплексов, позволяющая достаточно хорошо интерпретировать строение комплексных соединений, а также магнетохимический критерий структурной изомеризации биядерных комплексных соединений.
Во второй главе описаны методики синтеза координационных соединений и методы их исследования.
В третьей главе приведены результаты изучения структуры комплексных соединений Cu(II) и Ni(II) с 1,2-дигидро-4H-3,1-бензоксазинами в растворе и в твердом состоянии, а также представлены результаты экспериментально-теоретического исследования особенностей магнетохимического поведения биядерных металл-хелатов меди(II) и никеля(II) с 1,2-дигидро-4H-3,1-бензоксазинами.
Особенности координирующей способности лигандов L1-L4
Использование бензоксазинов в координационной химии объясняется их способностью менять дентатность в зависимости от условий проведения конкретной реакции, а также образовывать различные таутомерные формы, что позволяет синтезировать разнообразные по строению координационные соединения и проследить влияние центрального иона-комплексообразователя на существование таутомерных форм лигандов.
Из литературных данных известно, что дигидробензоксазины (структура А) способны к таутомерному превращению в линейную азометиновую форму (основание Шиффа, структура Б) и в зависимости от условий проведения реакции существуют только в виде структуры А (или Б) или в виде равновесия структур А и Б.
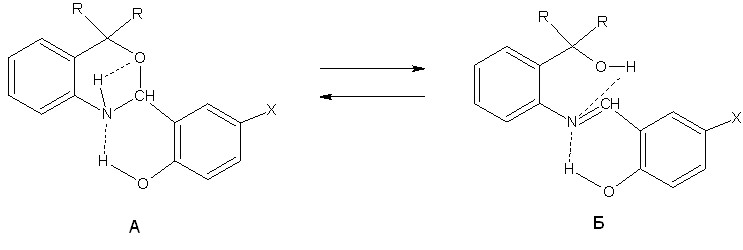
X = H (L1, L3), NO2 (L2, L4); R = C6H5 (L1, L2), H (L3, L4)
Дигидробензоксазины имеют три донорных центра (два атома кислорода и один атом азота), способных к координации и поэтому являются удобными объектами при изучении комплексообразования с переходными металлами.
Синтез и исследование строения комплексных соединений
Синтез комплексных соединений осуществляли по следующей методике: взаимодействием спиртовых растворов ацетатов меди(II) и никеля(II) c дигидробензоксазинами L1-L4 в соотношении 1:2 с последующим нагреванием раствора и выделением осадка комплексных соединении (комплексы с лигандами L3 и L4 получены нами впервые). Согласно данным элементного анализа и термогравиметрических измерений полученные комплексные соединения имеют состав МLAc.
Микроанализ на C, H, N проводился на приборе Perkin-Elmer 240C Analyzer. Электронные спектры в области 25000-5600 см-1 регистрировали на монохроматоре МДР-23. ИК спектры измеряли на фурье-спектрометре Инфралюм ФТ-02 в диапазоне 4000-400 см-1. ЭПР спектры измерены на приборе JES FA-300. Термогравиметрический анализ осуществляли на приборе Netzch STA в области 30-1000°С в атмосфере аргона, скорость нагрева 10°С в минуту.
Согласно данным термогравиметрического анализа (рис. 1 ) все исследованные соединения разлагаются при температурах выше 140°С.
На кривых ДТА для комплексных соединений состава МLAc наблюдается слабый эндо – экзоэффект с более выроженнным экзоэффектом в области 170 – 240 ОС с общей потерей массы, соответствующей отщеплению ацетатной группы с одновременной перестройкой молекулы. Такой факт можно объяснить образованием связи М-М, что подтверждается литературными данными.
Как показывают данные ИК спектроскопии в молекулах всех комплексных соединений отсутствуют валентные колебания NH-связи, наблюдаемые для лигандов в области 3320-3300 см-1, и повышается частота валентных колебаний О–Н связи до 3530-3450 см–1 (3360-3320 см-1 для лигандов).
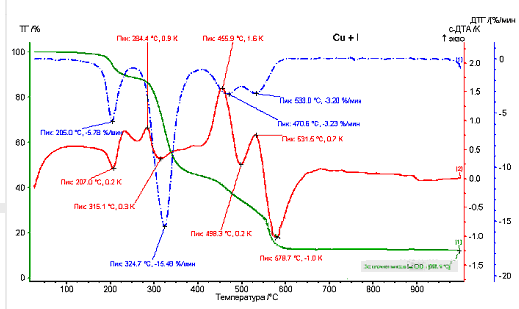
Рисунок 1 – Термограмма комплексного соединения CuL1Ac.
В ИК спектрах комплексных соединений с лигандами L1 и L2 появляется интенсивная полоса поглощения валентных колебаний C=N связи 1610-1621 см-1. Такой факт можно объяснить тем, что при комплексообразовании бензоксазиновый цикл в молекулах лиганда раскрывается, то есть лиганды находятся в виде структуры Б. Для комплексных соединений с L3 и L4, имеющиеся в спектре валентные колебания С=N связи смещаются в длинноволновую часть спектра. Валентные колебания связи Cаром–О в комплексах имеют большую частоту по сравнению с исходными лигандами и налагаются на валентные антисимметричные колебания нитрогруппы, что свидетельствует о депротонировании фенольной группы и связывании феноксидного атома кислорода с ионом металла.
В ИК спектрах соединений МLAc наблюдаются также полосы поглощения, относящиеся к валентным колебаниям карбоксилат-иона и полосы поглощения, относящиеся к валентным симметричным и антисимметричным колебаниям C-H связи метильной группы ацетат – иона в области 3000-2800 см-1.
Анализ ИК спектров соединений состава МLAc показал, что разность между валентными симметричными и антисимметричными колебаниями карбоксилат – аниона составляет 266-275 см-1, что свидетельствует, согласно литературным данным, о монодентатности карбоксилат – аниона.
Исходя из вышеизложенного в комплексообразовании должны участвовать все три донорных центра лиганда и один атом кислорода ацетатной группы.
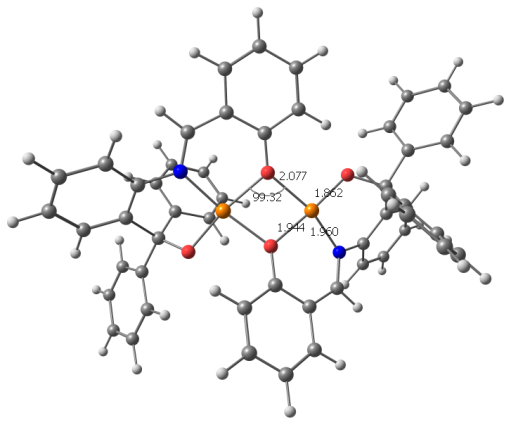
Экспериментальные данные РСА для комплекса CuLAc (В.С. Сергеенко, ИОНХ РАН) получены при комнатной температуре на автоматическом четырехкружном дифрактометре Enraf-Nonius CAD-4 (MoK-излучение с графитовым монохроматором, -сканирование, 2мах=54). Всего зарегистрировано 10811 рефлексов (Rint=0.035, -13 h 13, -18 k 18,0l 21).
Структура решена прямым методом (SHELXS-97) и уточнена методом наименьших квадратов в полноматричном анизотропном приближении (по F2) для неводородных атомов (SHELXL-97).
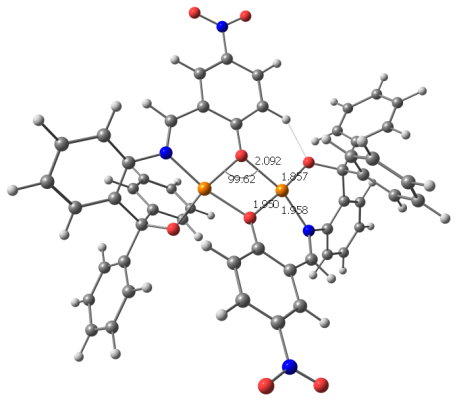
Доказано, что в триклинной ячейке комплекса содержится две центросимметричных кристаллографически независимых биядерных молекулы комплекса (CuLAc)2 (I и I’) (рис. 2). Поскольку геометрические параметры этих молекул достаточно близки, в дальнейшем обсуждается строение одной из них (I). В димерном комплексе монодепротонированный бензоксазиновый лиганд L находится в азометиновой таутомерной форме. Атом водорода Н(1), находится у атома О(2) фенилкарбинольного фрагмента лиганда, и участвует в образовании внутрикомплексной водородной связи (ВКС) между молекулой лиганда и атомом О(4) ацетатной группы. В координации с атомом меди участвуют все три донорных центра лиганда – два атома кислорода и атом азота. Лиганд в комплексе выполняет тридентатную хелатно-мостиковую структурную функцию, в результате чего в молекуле комплекса замыкаются два шестичленных металлоцикла. Ацетатная группа является монодентатно-концевой.
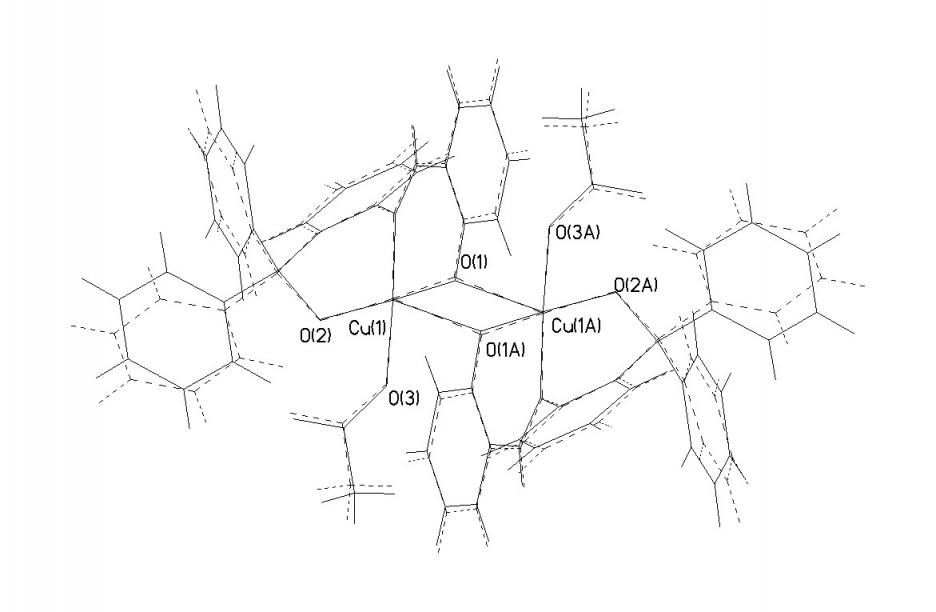
Рисунок 2 – Наложение двух независимых молекул I (сплошная линия) и I` (пунктирная линия) при условии совмещения атомов ближайшего окружения димера (внутренней координационной сферы).
Координационный полиэдр атома меди – вытянутая тетрагональная пирамида (ТП). Двойной кислородный мостик в биядерных молекулах комплекса образован атомами кислорода О(1) и (О1А) фенольных фрагментов лигандов, при этом в ТП одного атома меди О(1) занимает вершину основания Cu(1)-O(1) 1.905(3)±0.005) а в ТП инвертированного атома Cu(1A) – аксиальную позицию с существенно удлиненной связью (Cu(1A)- O(1) 2.405(3)±0.005A). В основании ТП лежат также атомы О(2) и N(1) фенилкарбинольного и азометинового фрагментов лиганда и атом О(3) ацетатной группы. Наиболее длинная связь в основании ТП Cu- OAc 1.972(3)±0.002; связи Cu-N 1.955(3)± 0.001 и Cu-O(2) 1.940(3) ±0.009 немного короче. Наибольшие угловые отклонения от идеальных значений 180 и 90° в ТП имеют углы O(1’A)Cu(2)O(2’) 169.7° и O(2)Cu(1)O(1A) 103.3°. Расстояние Cu…Cu в димерах 3.170± 0.003.
Геометрические параметры ВКС О(2)-Н(1)….О(4) в Н-гетероцикле комплекса: О(2)-Н 0.69(5), О(4)-Н 1.78(5) и О(2)-О(4) 2.430(4), угол О(2)Н(1)О(4) 168.(3). Этот Н-цикл также как и сопряженные с фенильными кольцами, шестичленные хелатные металлоциклы в комплексе имеет существенно неплоское строение. Конформация Н-цикла – заметно искаженная ванна: от средней плоскости Сu(1)O(3)O(4)H(1) (=0.04) атомы О(2) и С(27) отклонены соответственно на 0.223 и 0.086. Хелатный цикл, сопряженный с трифенилкарбинольной группой, также имеет конформацию асимметриченой ванны - из плоскости Cu(1)O(2)C(8)C(13) (= 0.03) атомы N(1) и C(14) выходят соответственноo на 0.505 и 0.692. Второй цикл, сопряженный с фенольным кольцом, принимает форму искаженного полукресла: от плоскости пяти атомов O(1)N(1)C(1)C(6)C(7) (= 0.03), атом меди отклоняется на 0.501.
Таким образом комплексные соединения с бензоксазинами способны кристаллизоваться в виде двух кристаллографически независимых центросимметричных биядерных молекул сходного строения, где лиганд находится в азометиновой таутомерной форме и выполняет тридентатную хелатно-мостиковую функцию.
Были изучены также ЭПР спектры комплексов Cu(II) с L3 и L4 при комнатной температуре в порошке; сравнение их со спектрами комплексных соединений с L1 и L2 (Т.Е. Апенышева, 2007) подтверждает аксиальную симметрию ближайшего окружения иона металла: параметры спин-гамильтониана (для комплекса с L3: g = 2.087; g = 2.230, для комплекса L4: g = 2.075; g = 2.245) соответствуют плоскому строению координационного узла с транс-расположением окси- и азометиновых групп.
Анализ электронных спектров концентрационных серий растворов комплекса в хлороформе и этиловом спирте в области d-d-переходов иона меди(II) позволил выделить три полосы поглощения с параметрами (, см-1 и (, дм3моль-1см-1)): 19230(12,7); 14493(202,8) и 8873(8,96). Использование геометрии координационного полиэдра, как искаженной тетрагональной пирамиды, позволяет отнести их к следующим d-d-переходам иона меди(II): z2xy, х2-у2ху и (xz,yz)xy, соответственно. Соответствие данного отнесения экспериментальным значениям экстинкции позволяет считать, что биядерный комплекс формируется в растворе. При этом установлено, что при растворении комплекса не происходит разрушение биядерной структуры комплекса при значительном разведении. Расчет энергии d-d-переходов иона Cu(II) осуществлялся по методу модели углового перекрывания (МУП). В результате расчетов параметров МУП с учетом фиксированного значения e(O) =
7100 см-1 для аналогичных комплексов меди(II), для атомов O(1), O(2) и O(3) получены следующие значения энергий взаимодействий: e(O1) = 3756 см-1; e(N) = 8400 см-1; ey(O2) = 3010 см-1, ey(N) = 2050 см-1 и ex(O3) + ex(N) = 4540 см-1, что позволяет считать доказанным образование биядерного комплекса меди(II) в растворе.
Экспериментально-теоретическое исследование особенностей магнетохимического поведения биядерных металл-хелатов меди(II) и никеля(II) c 1,2-дигидро-4Н-3,1–бензоксазинами[1]
Удельные магнитные восприимчивости (g) образцов определяли по методу Фарадея в интервале температур 77,4-300 К с использованием магнитного поля 0,9 Т. Калибровка прибора осуществлялась по комплексу HgCo(CNS)4. Диамагнитную восприимчивость лигандов рассчитывали по аддитивной схеме Паскаля. Теоретическая интерпретация магнитных свойств биядерных комплексов была проведена в терминах теории HDVV.
Используя полученную методом РСА модель биядерного комплекса [CuLAc]2 были проанализированы данные температурной зависимости молярной магнитной восприимчивости комплекса (рис. 3,4) в поликристаллическом состоянии указывает на наличие обменного взаимодействия антиферромагнитного типа между двумя ионами меди (2J = -57.8 см–1), что подтверждает образование биядерной структуры. Исходя из установленного строения комплекса, его антиферромагнитный обмен представляется до некоторой степени неожиданным, поскольку атомы кислорода О(1) и О(1А), являющиеся мостиковыми в обменном фрагменте ![]() , находятся в аксиальной позиции по отношению к центральным ионам меди(II). Последнее обстоятельство, в соответствии с известными теоретическими положениями изотропного обмена Гейзенберга-Дирака-Ван-Флека определяет характер магнитного обмена, подразумевая практическую ортогональность магнитных орбиталей двух ионов меди(II) при условии симметрии данных орбиталей типа
, находятся в аксиальной позиции по отношению к центральным ионам меди(II). Последнее обстоятельство, в соответствии с известными теоретическими положениями изотропного обмена Гейзенберга-Дирака-Ван-Флека определяет характер магнитного обмена, подразумевая практическую ортогональность магнитных орбиталей двух ионов меди(II) при условии симметрии данных орбиталей типа ![]() .
.
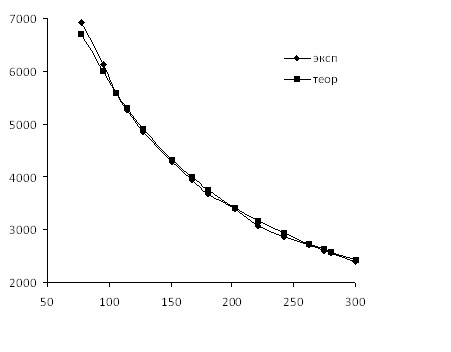
Рисунок 3 – Зависимость молярной магнитной восприимчивости от температуры
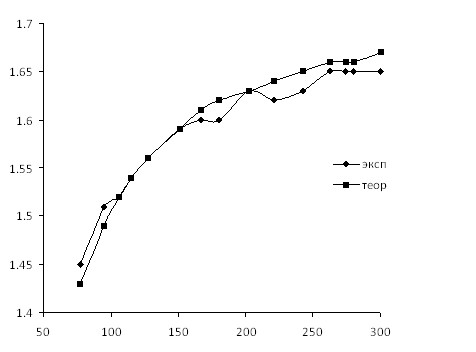
Рисунок 4 – Зависимость эффективного магнитного момента от температуры
Биядерный металл-хелат меди(II) с L2 состава 1:1 характеризуется существенным ростом по абсолютной величине параметра обменного взаимодействия антиферромагнитного типа (2J = -305.4см-1, табл.1) по отношению к биядерному комплексу меди(II) с L1. Можно предположить, что такие магнитные свойства данного комплекса могут быть обусловлены изменением характера димеризации моноядерных фрагментов с образованием указанной ниже структуры
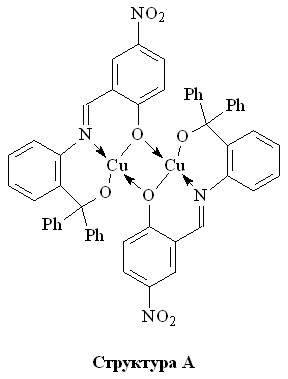
в которой реализуется практически планарное строение обменного фрагмента ![]() , подразумевающего участие в косвенном обменном взаимодействии
, подразумевающего участие в косвенном обменном взаимодействии ![]() магнитных орбиталей двух ионов меди(II), что и объясняет выраженный антиферромагнитный обмен. В пользу данного предположения свидетельствуют результаты проведённых квантово-химических расчётов.
магнитных орбиталей двух ионов меди(II), что и объясняет выраженный антиферромагнитный обмен. В пользу данного предположения свидетельствуют результаты проведённых квантово-химических расчётов.
Синглетное и триплетное состояния, определяющие параметр обмена, являются долгоживущими термически заселенными состояниями, поэтому каждому из них соответствует своя совокупность ядерных координат. Наилучшие результаты могут быть получены при раздельной оптимизации геометрии комплекса в триплетном (T) и низкоспиновом (BS) состоянии. Однако, учитывая близость энергий этих состояний (не более 1000 см-1), можно предположить, что и равновесные геометрии не должны сильно отличаться друг от друга. Именно поэтому, наилучшим подходом для определения геометрии состояний будет первоначальный расчет оптимального строения триплетного (высокоспинового) состояния. Рассчитанные гипотетические структуры представлены на рис. 5,6. Видно, что оптимизированные и экспериментальные параметры геометрии комплексов достаточно близки друг к другу.
 |  |
| Рисунок 5 - Гипотетическая структура комплекса меди(II) с лигандом L1 | Рисунок 6 - Гипотетическая структура комплекса меди(II) с лигандом L2 |
Антиферромагнитный характер обменного взаимодействия может быть объяснен изменением типа орбитальной симметрии иона Cu2+ от dx2-y2, до, например, dz2. Что касается магнитных свойств никеля(II) в биядерном комплексе с тем же лигандом, то они хорошо согласуются с таким предположением. Последнее означает, что биядерный комплекс никеля(II) имеет почти такую же структуру, как медь(II), за исключением, когда Ni2+ находится в октаэдрическом окружении.
ВЫВОДЫ
- На основе анализа рентгеноструктурных данных и данных ИК и ЭПР спектроскопии установлено, что координационные соединения Cu(II) и Ni(II) с бензоксазинами являются биядерными структурами (MLAc)2, в которых монодепротонированный лиганд L находится в азометиновой таутомерной форме. При этом атом кислорода фенилкарбинольного фрагмента лиганда участвует в образовании внутрикомплексной водородной связи между молекулой L и атомом кислорода ацетатной группы.
- Анализ электронных спектров растворов комплексов Cu(II) в хлороформе и этиловом спирте позволил определить следующие d-d-переходы: z2xy, х2-у2ху и (xz,yz)xy. Расчет энергии d-d-переходов по методу модели углового перекрывания с учетом геометрии координационного полиэдра как искаженной тетрагональной пирамиды позволил получить значения энергий взаимодействия координирующих атомов, что позволяет считать доказанным образование биядерного комплекса также и в растворе.
- По данным ЭПР спектров комплексные соединения меди(II) имеют плоское строение координационного узла.
- Исследование температурной зависимости молярной магнитной восприимчивости комплексных соединений меди(II) и никеля(II) указывает на наличие обменного взаимодействия антиферромагнитного типа между ионами металлов, что также связано с образованием биядерной структуры. Теоретические расчеты позволили предположить наиболее эффективные каналы обмена, позволяющие объяснить влияние электронной природы мостиковых атомов и парамагнитных центров в обменных параметрах, а также переходных атомов хелатных циклов на характер магнитного взаимодействия.
Основное содержание диссертации изложено в следующих публикациях:
- Bolotin S.N., Isaeva E.L., Shamsutdinova M.H., Pushkareva K.S., Bukov N.N. Structure of Copper(II) Complexes with 2-[2-Hydroxy-Phenil]-4,4-Diphenyl-1,2-Dihydro-4H-3,1-Benzoxazine in Chloroform // Research Letter in Physical Chemistry. 2009. V. 2009. Article ID 365949.
- Исаева Э.Л., Шамсутдинова М.Х., Буков Н.Н., Панюшкин В.Т. Строение и магнитные свойства комплексного соединения Cu(II) с 2-[2-гидроксифенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином // Журнал структурной химии. 2011. Т. 52. № 5. С. 1038-1040.
- Исаева Э.Л., Шамсутдинова М.Х., Буков Н.Н., Панюшкин В.Т. Строение комплексных соединений меди(II) с дигидробензоксазинами в растворе // Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки. 2011. №5. С. 47-49.
- Исаева Э.Л., Шамсутдинова М.Х., Пушкарева К.С., Буков Н.Н. Строение комплексных соединений меди(II) с дигидробензоксазинами в растворе хлороформа // Материалы V Международной конференции по новым технологиям и приложениям современных физико-химических методов для изучения окружающей среды. – Ростов-на-Дону, 2009. С. 177-178.
- Исаева Э.Л., Шамсутдинова М.Х., Буков Н.Н. Геометрия координационных полиэдров комплексов d-элементов с O,N-содержащими лигандами // Материалы Международной научно-практической Интернет-конференции «Современные направления теоретических и прикладных исследований 2009». – Одесса, 2009.
- Исаева Э.Л., Шамсутдинова М.Х., Буков Н.Н., Пушкарева К.С. Cтроение биядерного комплекса меди(II) с дигидробензоксазином в растворе // Сборник тезисов XXIV Международной Чугаевской конференции по координационной химии. – Санкт-Петербург, 2009. С. 283.
- Исаева Э.Л., Шамсутдинова, М.Х. Буков Н.Н., Фурсина А.Б. Строение комплексных соединений амидразонов с ионами кобальта(II), никеля(II) и меди(II) по данным молекулярной спектроскопии // Сборник тезисов XXIV Международной Чугаевской конференции по координационной химии. – Санкт-Петербург, 2009. С. 284.
- Буков Н.Н., Пушкарева К.С., Исаева Э.Л., ШамсутдиноваМ.Х., Бородавко А.А., Громачевская Е.В. О строении биядерного комплекса меди(II) с дигидробензоксазином в растворе // Материалы международной конференции «Новые направления в химии гетероциклических соединений». – Кисловодск, 2009. С. 273.
- Исаева Э.Л., Буков Н.Н., Колоколов Ф.А. Хелатные комплексы меди(II) с дигидробензоксазинами и галактаровой кислотой // Тезисы докладов I Международной молодежной школы-конференции по физической химии краун-соединений, порфиринов и фталоцианинов. – Туапсе, 2009. С. 44.
- Исаева Э.Л., Шамсутдинова М.Х., Костырина Т.В., Кузнецова С.Л., Буков Н.Н. Строение координационных полиэдров комплексов d-элементов с O,N-содержащими лигандами // Тезисы докладов II Международной молодежной школы-конференции «Супрамолекулярные системы на поверхности раздела». – Туапсе, 2010. – С. 53.
- Исаева Э.Л., Шамсутдинова М.Х., Костырина Т.В., Кузнецова С.Л., Панюшкин В.Т., Буков Н.Н. Строение металлокомплексов РЗЭ // Тезисы докладов II Международной молодежной школы-конференции «Супрамолекулярные системы на поверхности раздела». – Туапсе, 2010. – С. 54.
- Исаева Э.Л., Шамсутдинова М.Х., Пушкарева К.С., Буков Н.Н. Строение биядерного комплекса меди (II) с бензоксазином // Тезисы докладов II Международной молодежной школы-конференции «Супрамолекулярные системы на поверхности раздела». – Туапсе, 2010. – С. 55.
- Исаева Э.Л., Шамсутдинова М.Х., Костырина Т.В., Кузнецова С.Л., Буков Н.Н. Геометрия металлохелатов d-элементов c O,N-содержащими лигандами // Сборник тезисов докладов VII Международной конференции «Спектроскопия координационных соединений». – Туапсе, 2010. – С. 109-110.
- Исаева Э.Л., Шамсутдинова М.Х. Строение и магнитные свойства координационных соединений с некоторыми бензоксазинами // Материалы VII Международной конференции по новым технологиям и приложениям современных физико-химических методов для изучения окружающей среды. – Ростов-на-Дону, 2011. С. 197-198.
[1] Выражаем благодарность В.В. Лукову, И.Н. Щербакову и С.И. Левченкову (ЮФУ) за помощь в проведении исследований

