Синтез тиминсодержащих отрицательно заряженных пептидно-нуклеиновых кислот различного строения и исследование их гибридизационных характеристик
На правах рукописи
БОЯРСКАЯ Наталья Петровна
СИНТЕЗ ТИМИНСОДЕРЖАЩИХ ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫХ ПЕПТИДНО-НУКЛЕИНОВЫХ КИСЛОТ РАЗЛИЧНОГО СТРОЕНИЯ И ИССЛЕДОВАНИЕ ИХ ГИБРИДИЗАЦИОННЫХ ХАРАКТЕРИСТИК
02.00.10 – Биоорганическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Москва – 2007
Работа выполнена на кафедре биотехнологии Московской Государственной Академии Тонкой Химической Технологии им. М.В.Ломоносова.
Научный руководитель академик РАМН, доктор химических наук, профессор
Швец Виталий Иванович
Официальные оппоненты доктор химических наук,
профессор
Преображенская Мария Николаевна
доктор химических наук,
ведущий научный сотрудник
Долинная Нина Германовна
Ведущая организация Институт молекулярной генетики РАН
Защита состоится « » 2007 года в ч. на заседании диссертационного совета Д 212.120.01 при Московской Государственной Академии Тонкой Химической Технологии им. М.В. Ломоносова по адресу: 119571, г. Москва, проспект Вернадского, д. 86.
С диссертацией можно ознакомиться в библиотеке Московской Государственной Академии Тонкой Химической Технологии им. М.В. Ломоносова.
С авторефератом диссертации можно ознакомиться на сайте www.mitht.ru.
Автореферат разослан « » 2007 года.
Ученый секретарь Диссертационного Совета
кандидат химических наук,
старший научный сотрудник А.И. Лютик
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ[1]
Актуальность проблемы
Синтетические молекулы, которые способны специфично связываться с выбранной мишенью в исследуемой последовательности гена, представляют большой интерес в медицине и биотехнологии. Модификации нуклеиновых кислот направлены на увеличение специфичности связывания с ДНК или РНК, а, следовательно, на создание более быстрых и надежных методов молекулярной биологии, диагностики и лечения генетических заболеваний, основанных на принципах гибридизации с анализируемыми последовательностями нуклеиновых кислот.
Радикальная замена сахаро-фосфатного остова в структуре ДНК на псевдопептидный, построенный из повторяющихся единиц N-(2-аминоэтил)глицина, была положена в основу создания полиамидных ДНК-миметиков – пептидно-нуклеиновых кислот («классические», Aeg ПНК) (P. Nielsen et al., 1991). Изначально разработанные как антиген/антисенс-агенты, ПНК нашли свое применение в создании биосенсоров и микрочипов, систем для селективного расщепления нуклеиновых кислот, определения генетических мутаций и др. (E. Uhlmann et al., 1998; A. Ray et al., 2000; P. Nielsen, 2001). Однако, несмотря на многие преимущества, они также не лишены ряда недостатков. Во-первых, стабильный ПНК/ДНК-комплекс образуется даже в очень коротких сайтах (8-10 пар оснований), которые встречаются достаточно часто и не являются уникальными на всей длине ДНК. Во-вторых, ПНК не подвергаются действию ферментов и не могут быть выведены из организма. В-третьих, ахиральный незаряженный псевдопептидный остов «классических» ПНК приводит к неоднозначной ориентации пептидно-нуклеиновых кислот при образовании комплексов с нуклеиновыми кислотами. В-четвертых, ПНК обладают ограниченной растворимостью в воде и слабой проникающей способностью через клеточную мембрану.
Однако простая структура ПНК в сочетании с превосходными свойствами ДНК-миметика позволяет разрабатывать и конструировать на ее основе новые производные с улучшенными физико-химическими и биологическими свойствами за счет введения асимметрического центра и/или заряженных функциональных групп в ахиральный остов, модификации гетероциклических оснований или карбоксиметильного спейсера, получения конъюгатов с молекулами-переносчиками (M. Cantin et al., 1997; V. Kumar et al., 2002; S. Sforza et al., 2000; G. Haaima et al., 1996).
Таким образом, разработка, синтез и исследование взаимосвязи структура–активность псевдопептидных аналогов природных нуклеиновых кислот является актуальным направлением поиска ДНК-миметиков, обладающих не только биологической и химической стабильностью, но и адекватным фармакокинетическим действием.
На кафедре биотехнологии МИТХТ им. М.В. Ломоносова изучается подобная структурная модификация нуклеиновых кислот – отрицательно заряженные пептидно-нуклеиновые кислоты, содержащие асимметрический атом и анионную группу, представленную боковыми радикалами дикарбоновых аминокислот, в каждом мономерном звене регулярной псевдопептидной последовательности. В последние 10 лет на кафедре проводятся активные исследования в области их синтеза, в частности получены тимин- и аденинсодержащие мономеры отрицательно заряженных ПНК, в которых остатки L- или D-глутаминовой кислоты расположены на С-конце псевдопептидного остова. Данная работа продолжает эти исследования, проводимые на кафедре Биотехнологии МИТХТ им. М.В.Ломоносова в рамках госбюджетной темы 1Б-5-356 «Синтез новых фармакологически активных веществ, изучение их биологических свойств и методов направленного транспорта с целью создания противоопухолевых, противовирусных, антипаркинсонических средств» и по грантам президента РФ по поддержке ведущих научных школ (№ НШ-2329.2003.4, № РИ-112/001/609 и № 02.512.11.2144).
Цель настоящего исследования
Цель данной работы состояла в синтезе и исследовании гибридизационных свойств тиминсодержащих декамеров отрицательно заряженных пептидно-нуклеиновых кислот, содержащих - или -карбоксильные группы бокового радикала дикарбоновых аминокислот.
Основными задачами исследования явились:
- препаративный синтез мономеров отрицательно заряженных ПНК на основе L-глутаминовой/L-аспарагиновой кислоты, глицина и тимин-1-ил уксусной кислоты, предназначенных для олигомеризации по Вос-протоколу;
- разработка протокола и стратегии твердофазного синтеза декамеров тиминсодержащих отрицательно заряженных ПНК различного строения, а также условий, методов выделения и анализа синтезированных декамерных последовательностей;
- поиск и оптимизация условий для проведения исследований гибридизационных свойств тиминсодержащих отрицательно заряженных ПНК, на примере декамеров на основе L-глутаминовой кислоты и глицина.
Научная новизна и практическая ценность работы
В результате проведенной работы найден и оптимизирован способ получения, осуществлен синтез в препаративных количествах, а также полностью охарактеризованы четыре тиминсодержащих мономера отрицательно заряженных ПНК. Два мономера, псевдопептидная связь в которых образована между остатками дикарбоновой аминокислоты и глицина, L-GluGly и L-AspGly, содержащих анионную группировку на N-конце псевдопептидного скелета, получены впервые.
Разработан Вос-протокол ручного твердофазного синтеза декамеров отрицательно заряженных ПНК с учетом особенностей данного класса соединений. На основании разработанного протокола синтезированы, выделены и охарактеризованы два новых тиминсодержащих декамера отрицательно заряженных ПНК, построенные из повторяющихся мономеров с псевдопептидной связью GlyL-Glu и L-GluGly. Осуществлен синтез тиминсодержащих отрицательно заряженных ПНК, в которых остатки L-аспарагиновой кислоты находятся на N- или С-конце псевдопептидного остова каждого мономерного звена. Получены и охарактеризованы две тримерные последовательности. Показано, что дальнейшее наращивание олигомерной цепи до целевого декамера приводит к последовательности отрицательно заряженных ПНК необходимой длины, в которых остатки аспарагиновой кислоты находятся в различных изомерных формах.
Разработаны и оптимизированы условия для проведения исследований гибридизационных свойств тиминсодержащих отрицательно заряженных ПНК с помощью термической денатурации их комплексов с олигодезоксирибонуклеотидами. Показано высокое сродство тиминсодержащих декамерных последовательностей на основе L-глутаминовой кислоты и глицина к комплементарной последовательности олигодезоксирибонуклеотида, а также зависимость гибридизационных свойств от ионной силы раствора, наличия некомплементарного основания в середине последовательности олигодезоксирибонуклеотида и расположения анионной группы в псевдопептидном остове отрицательно заряженных ПНК.
С помощью технологии поверхностного плазмонного резонанса впервые проведено исследование биомолекулярного взаимодействия тиминсодержащего декамера ПНК, содержащего псевдопептидную связь L-GluGly, и комплементарной последовательности олигодезоксирибонуклеотида, иммобилизованной на поверхности чипа. Получены качественные и количественные характеристики взаимодействия.
Высокое сродство декамеров отрицательно заряженных ПНК к комплементарной последовательности в сочетании с возможностью управлять процессом гибридизации, варьируя ионную силу раствора и расположение заряда в псевдопептидном остове олигомеров, позволяет говорить о том, что данные структуры являются аналогами нуклеиновых кислот, которые могут найти практическое применение в технологии ДНК-гибридизации. Предложенная стратегия синтеза мономеров отрицательно заряженных ПНК является универсальной базой для создания различных структурных модификаций полиамидных ДНК-миметиков. Использование твердофазного метода синтеза олигомеров отрицательно заряженных ПНК позволит получать их конъюгаты с метками и биологическими молекулами, открывая возможность для использования данных аналогов нуклеиновых кислот в технологии НК-чипов.
Основные положения, выносимые на защиту:
- Препаративный синтез мономеров отрицательно заряженных ПНК различного строения, на основе L-глутаминовой/L-аспарагиновой кислоты, глицина и тимин-1-ил уксусной кислоты, предназначенных для олигомеризации по Вос-протоколу.
- Твердофазый синтез тиминсодержащих декамеров отрицательно заряженных ПНК, построенных из повторяющихся мономерных звеньев с регулярным расположением заряда вдоль остова.
- Исследование гибридизационных свойств тиминсодержащих отрицательно заряженных ПНК, на примере декамеров, отрицательный заряд в которых представлен боковым радикалом L-глутаминовой кислоты.
Публикации и апробации работы
По материалам диссертационной работы опубликовано 4 статьи и 7 тезисов на Всероссийских и международных конференциях. Результаты настоящего исследования были представлены на следующих научных конференциях: II, III, IV Московский международный конгресс «Биотехнология: состояние и перспективы развития - 2003», -2005», - 2007» (2003, Москва; 2005, Москва; 2007, Москва), 10-ая Международная научно-техническая конференция «Наукоемкие химические технологии» (2004, Волгоград), Первая научно-техническая конференция молодых ученых МИТХТ им. М.В. Ломоносова «Наукоемкие химические технологии» (2005, Москва), Третий съезд общества биотехнологов России им. Ю.А. Овчинникова (2005, Москва), Московская международная конференция «Биотехнология и медицина» (2006, Москва).
Структура диссертации и объем работы
Диссертация изложена на страницах машинописного текста и состоит из введения, обзора литературы, посвященному свойствам «классических» пептидно-нуклеиновых кислот и их применению в различных областях молекулярной биологии, диагностике и медицине, обсуждения результатов, экспериментальной части, выводов и списка литературы, включающего источника. Диссертация иллюстрирована
рисунками и содержит схем и таблиц.
РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ
Основой большинства методов молекулярной биологии и диагностики служит связывание молекулы зонда с комплементарным участком нуклеиновой кислоты – «мишенью». Значительную роль в развитии технологий, основанных на ДНК-гибридизации, играют пептидно-нуклеиновые кислоты (Рис. 1Б). Однако, незаряженные ахиральные молекулы с гибким остовом, очень высокими сродством к анализируемой последовательности и ферментативной устойчивостью нельзя считать конечной структурой в процессе поиска оптимальных ДНК-миметиков.
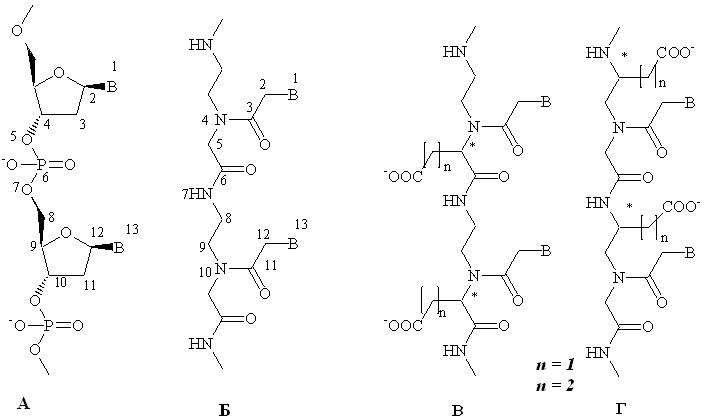
Рис. 1. Структура ДНК (А), «классических» (Б) и отрицательно заряженных (В, Г) ПНК (B= Ade, Gua, Thy, Cyt).
В нашей лаборатории была предложена новая структурная модификация нуклеиновых кислот – отрицательно заряженные пептидно-нуклеиновые кислоты (Рис. 1В, Г). Регулярное расположение отрицательного заряда, представленного - или -карбоксильной группой бокового радикала L-глутаминовой или L-аспарагиновой кислоты, вдоль остова, и сохранение расстояния между гетероциклическими основаниями, присущее нуклеиновым кислотам, приближает данную модификацию «классических» ПНК к природным олигонуклеотидам, что не только может решить проблемы, связанные с растворимостью и самоагрегацией при определенных значениях рН, но также повысить специфичность их связывания с короткими уникальными участками на длинной анализируемой последовательности нуклеиновых кислот и управлять процессом гибридизации за счет изменения ионной силы раствора.
В данной работе представлены результаты, полученные в ходе совершенствования синтеза мономеров и декамеров тиминсодержащих отрицательно заряженных ПНК различного строения, а также при проведении предварительных исследований гибридизационных свойств последних.
1. Синтез тиминсодержащих мономеров отрицательно заряженных ПНК различного строения
Твердофазный синтез пептидно-нуклеиновых кислот представляет собой олигомеризацию мономерных единиц на твердом полимерном носителе. Для получения декамеров тиминсодержащих отрицательно заряженных ПНК в количестве, достаточном для исследования их свойств, в среднем требуется 50 мг мономера на каждую стадию конденсации при проведении твердофазного синтеза на 150 мг смолы. В связи с этим нами была разработана и оптимизирована схема препаративного синтеза мономеров отрицательно заряженных ПНК (1а-г) (Схема 1), позволяющая вводить заряд в различные положения псевдопептидного остова.
Схема 1
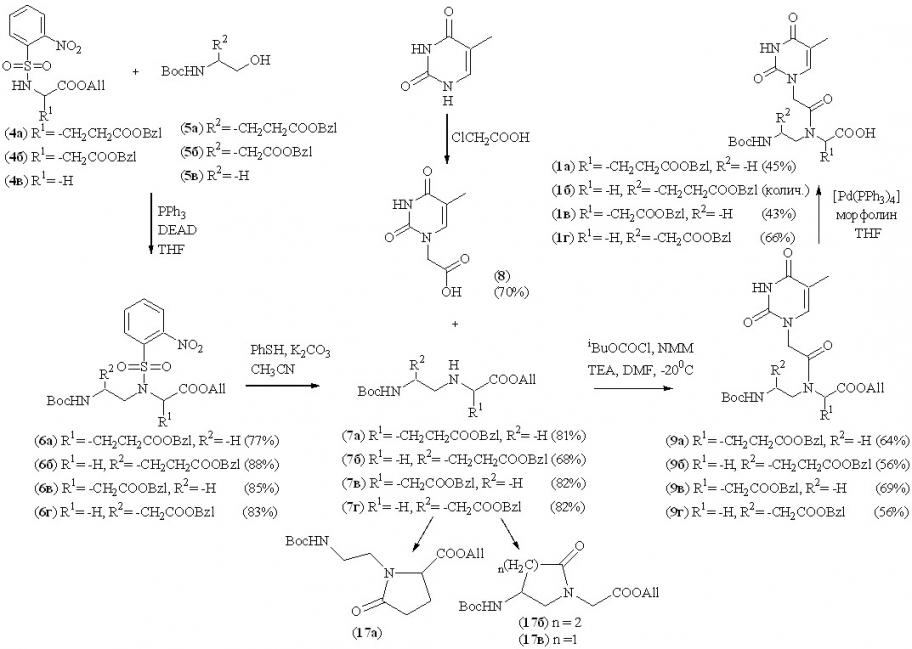
Синтез ключевых псевдопептидных фрагментов (7а-г) мономеров отрицательно заряженных ПНК осуществляли по реакции Мицунобу (B. Falkiewicz et al., 2001) между восстановленными (5а-в) и аллил-защищенными по -карбоксильной группе оNBS-производными аминокислот (4а-в) в стандартных условиях (O. Mitsunobu, 1981) с использованием DEAD и PPh3 в абсолютном THF при 00С, с последующим удалением оNBS-группы в соединениях (6а-г) тиолизом. В отличие от реакции восстановительного аминирования, в основном используемой для синтеза ахирального аминоэтилглицинового остова (G. Haaima et al., 1996; A. Puschl et al., 1998; B. Falkiewicz et al., 1999; L. Kosynkina et al., 1994), стереоспецифичность, функциональная селективность и регионаправленность реакции Мицунобу, как было показано на кафедре биотехнологии МИТХТ им. М.В. Ломоносова в ранее проведенных исследованиях с нашим участием, позволяет получать оптически более чистые вторичные амины с восстановленной пептидной связью и вводить отрицательный заряд в различные положения мономера. При этом сульфамидные производные (6а-г) являются устойчивыми соединениями и могут быть наработаны в препаративных количествах.
Сульфамидные (4а-в) и восстановленные (5а-в) производные аминокислот были синтезированы из соответствующих аминокислот, используя стандартные методы химии защитных групп. Селективное восстановление -карбоксильной группы при синтезе производных L-глутаминовой (5а) и L-аспарагиновой кислот (5б) проводили с помощью 1М раствора BH3 в THF (C. Lane, 1975) с выходами 40 и 29%, соответственно для (5а) и (5б). Выход на данной стадии зависел от качества реагента. Восстановленное производное глицина (5в) было получено из этаноламина. Структура всех производных аминокислот была подтверждена данными 1Н-ЯМР-спектроскопии.
Псевдопептиды (7а-г), после удаления орто-нитробензолсульфонильной группы соединений (6а-г) тиолизом, сразу использовали на следующей стадии конденсации с производным гетероциклического основания (8), полученным алкилированием тимина хлоруксусной кислотой (Схема 1). В качестве наиболее оптимального подхода к созданию амидной связи между псевдопептидными фрагментами и производным тимина был выбран метод смешанных ангидридов с использованием 3х-кратных избытков тимин-1-ил уксусной кислоты и изо-бутилхлорформиата в присутствии N-метилморфолина в DMF при -200С (Схема 1). Быстрая и практически полная активация карбоксильной группы производного тимина позволяет свести к минимуму вероятность образования циклических продуктов (17а-в), которые осложняют стадию выделения с помощью колоночной хроматографии ввиду их схожей хроматографической подвижности с защищенными мономерами (9а-г).
Выделение сульфамидных производных (6а-г) и защищенных мономеров (9а-г) осуществляли колоночной хроматографией, а их структура была подтверждена данными 1Н-, 13С-ЯМР-спектроскопии и элементного анализа.
Селективное удаление аллильной защиты осуществляли действием палладиевого комплекса [Pd(0)(PPh4)3] в морфолине (S. Friedrich-Bochnitschek et al., 1989). Целевые мономеры (1а), (1в) выделяли колоночной хроматографией, а (1б), (1г) – перекристаллизацией из диэтилового эфира. Структуру подтверждали данными 1Н-, 13С-ЯМР- спектроскопии, элементного анализа и LC/MS.
Таким образом, на основании разработанной стратегии нами синтезированы четыре тиминсодержащих мономера отрицательно заряженных ПНК в препаративных количествах с общими выходами, в расчете на исходные дикарбоновые аминокислоты, 3.9, 6.4, 2.3, 3.4%, соответственно для (1а), (1б), (1в) и (1г). При этом мономеры с псевдопептидной связью (L-GluGly) (1б) и (L-AspGly) (1г) получены впервые.
2. Твердофазный синтез тиминсодержащих отрицательно заряженных ПНК различного строения
В результате исследований в области синтеза «классических» ПНК (L. Christensen et al., 1995; C. Vearing et al., 2002) были представлены протоколы, позволяющие получать олигомеры с достаточно высокими выходами. Наша задача состояла в разработке эффективного, экономичного, в частности, по отношению к затратам мономеров, и менее токсичного протокола ручного твердофазного синтеза декамеров отрицательно заряженных ПНК с учетом особенностей данного класса соединений.
Синтез проводили на MBHA-смоле (0.62 ммоль-NH2/г-смолы), используя прибор для ручного твердофазного пептидного синтеза, по стратегии, представленной на Схеме 2, согласно разработанному нами Вос-протоколу.
Загрузку полимерного носителя осуществляли в интервале 0.1-0.2 ммоль-NH2/г-смолы конденсацией соответствующего мономера (1а-г) с аминогруппами полимерного носителя. Данный интервал загрузки смолы считается наиболее оптимальным, так как помимо снижения затрат мономера на каждую стадию, уменьшается вероятность агрегации близкорасположенных растущих цепей, что может приводить к снижению конечного выхода олигомера в результате ограниченного доступа реакционноспособных групп. Отсутствие линкера между смолой и первым мономером обусловлено регулярной, упорядоченной структурой синтезируемых объектов.
Схема 2
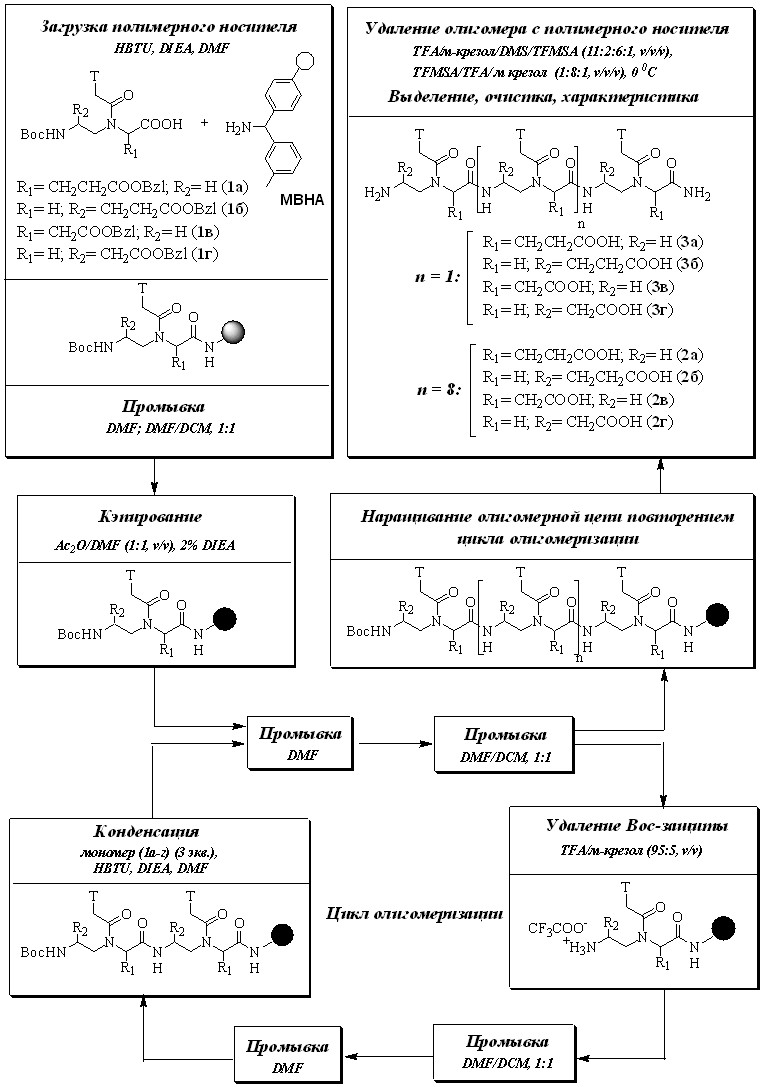
С помощью количественного нингидринового теста определяли содержание свободных аминогрупп на смоле и проводили кэпирование до отрицательного качественного теста Кайзера системой уксусный ангидрид/DMF/DIEA, которая позволяет сделать протокол твердофазного синтеза менее трудоемким и токсичным, а также менее дорогостоящим, по сравнению с протоколом синтеза «классических» ПНК, где в качестве кэпирующего реагента используют тетрафторборат N1-бензилоксикарбонил-N3-метилимидазола (реагент Раппопорта) (L. Christensen et al., 1995).
Вос-защитную группу удаляли TFA с добавлением 5% м-крезола для предотвращения трифторацетилирования как растущего олигомера, так и полимерного носителя, что может привести к терминации цепи.
Конденсацию мономера с растущей олигомерной цепью, как и в случае загрузки полимерного носителя, проводили по методу активации in situ, что позволяет избежать нежелательной реакции N-ацильного переноса гетероциклического основания на концевую аминогруппу (L. Christensen et al., 1995), которая представляет одну из основных проблем твердофазного синтеза ПНК. Раствор соответствующего мономера (1а-г) в DMF с конечной концентрацией 0.05 М, предварительно активированного эквимолярным количеством HBTU в присутствии 2 экв. DIEA, добавляли к полимерному носителю. Реакцию проводили в псевдоожиженном слое, перемешивая током инертного газа. Полноту протекания реакции контролировали по качественному тесту Кайзера. Использование трехкратных избытков мономеров по отношению к реакционноспособным аминогруппам, увеличение времени конденсации с 10-15 мин (L. Christensen et al., 1995; C. Vearing, et al., 2002) до 2 ч, а также проведение повторных конденсаций при положительном качественном тесте Кайзера, позволило отказаться от дополнительных этапов кэпирования и упростить протокол синтеза, а также избежать дополнительных основных условий, которые могут привести к рацемизации.
Использование DMF и DMF/DCM вместо пиридина, как в случае синтеза «классических» ПНК (L. Christensen et al., 1995), на этапах промывки смолы позволяет снизить основность среды растущей олигомерной цепи в течение синтеза, что уменьшает вероятность реакции N-ацильного переноса, а, следовательно, и степень укороченных последовательностей.
Олигомер ПНК необходимой длины деблокировали и удаляли с полимерного носителя стандартным методом «low-high» TFMSA (J. Tam et al., 1986), обрабатывая смолу, содержащую олигомер, растворами с разным содержанием трифторметансульфокислоты в течение 1 ч при 00С. Продукт выделяли с помощью обращенно-фазовой ВЭЖХ. Контроль протекания твердофазного синтеза отрицательно заряженных ПНК осуществляли после третьего шага синтеза для каждой из декамерных последовательностей.


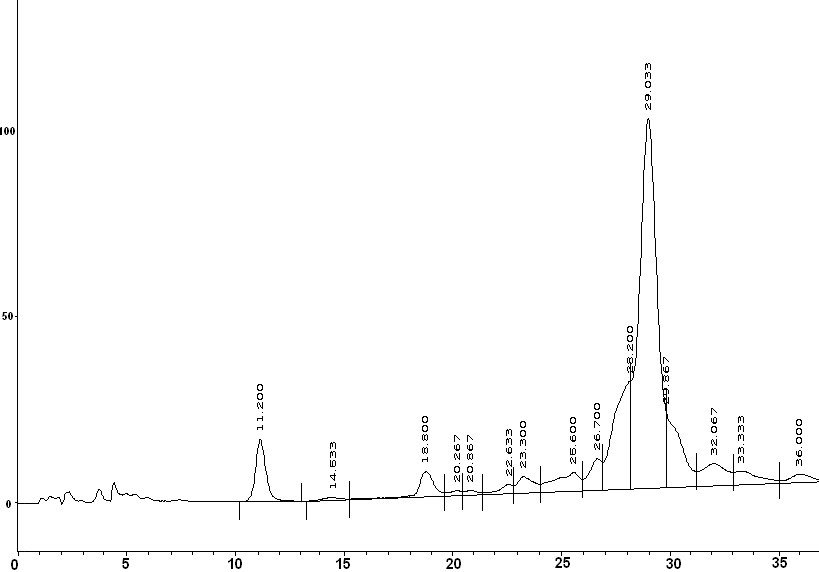


Высокое процентное содержание (74%) тримерной последовательности (3а) в реакционной смеси, полученной удалением олигомера с полимерного носителя стандартным методом «low-high» TFMSA после третьего цикла олигомеризации, доказывало эффективность разработанного протокола и стратегии твердофазного синтеза (Рис. 2А, Б). Однако использование данных условий для декамера (2а) оказалось невозможным в виду деградации последовательности при обработке смолы в течение 1 ч растворами трифторметансульфокислоты. MALDI-масс-спектр декамера (2а) показал помимо пика с m/z, равным 3400, соответствующего целевому соединению, наличие укороченных последовательностей, отличающихся по массе на одно мономерное звено, а также олигомеров различной длины без остатка тимина и карбоксиметильного линкера. Сокращение времени деблокирования и удаления олигомера (2а) с полимерного носителя с 1 ч каждого этапа до 15 и 20 мин, соответственно, при 00С, позволило получить целевой декамер только с примесью незначительного количества (n-1)-последовательности (Рис. 2В, Г). Однако в этом случае нельзя исключать вероятность неполного отщепления олигомера от смолы, что приводит к снижению выхода.
При олигомеризации мономера (1б), содержащего остаток L-глутаминовой кислоты на N-конце псевдопептидного остова, показана бльшая химическая стабильность декамера (2б) к условиям стандартного метода «low-high» TFMSA (1ч, 00С) (Рис. 3А).
MALDI-масс-спектр показал, что была синтезирована желаемая последовательность с примесью H-[Thy-(L-GluGly)]9-NH2 (Рис. 3Б). Следует отметить, что использование матрицы для анализа синтетических олигонуклеотидов (3-гидроксипиколиновой кислоты) вместо матрицы для анализа пептидов (2,5-дигидроксибензойной кислоты), позволило получить MALDI-спектры с хорошим соотношением сигнал/шум и превалирующим интенсивным сигналом пика молекулярного иона (Рис. 2Б, 3Б).*
[2]
Для полупрепаративной ВЭЖХ была выбрана система 0.1 М ацетата тетраэтиламмония с градиентом 75% раствора ацетонитрила в 0.1 М ацетате тетраэтиламмония, которая позволила уменьшить ширину хроматографической зоны, размывание пика основного вещества и время удерживания.

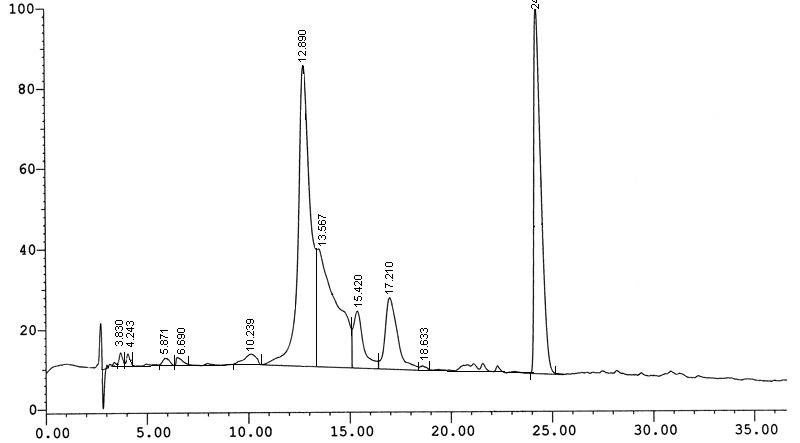

Сочетание обращенно-фазовой ВЭЖХ в различных системах и аналитического электрофореза в 20% полиакриламидном геле (7 М мочевина) в условиях, разработанных для природных олигонуклеотидов (Л. Остерман и соавт., 1981), привело к значительной (80%) потере целевого вещества на стадии выделения его из полиакриламидного геля. Поэтому декамеры (2а-б) были выделены с помощью обращенно-фазовой ВЭЖХ, с чистотой достаточной для проведения дальнейших исследований их гибридизационных свойств (98%). Приведенные в Таблице 1 выходы, соответствуют в среднем 60% на каждую стадию конденсации.
Таблица 1. Выход тиминсодержащих декамеров отрицательно заряженных ПНК (2а) и (2б)
| Олигомер | Масса смолы, мг | Загрузка смолы, ммоль-NH2/г-смолы | Выход, о.е. | Выход, мкг | |
| для синтеза олигомера | для удаления олигомера | ||||
| H-[Thy-(GlyL-Glu)]10-NH2 (2а) | 150 | 9.0 | 0.14 | 0.20 | 7.8 |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 150 | 57.9 | 0.20 | 6.65 | 257.0 |
Известно, что остатки аспарагиновой кислоты в полипептидной последовательности способствуют самопроизвольному разрушению пептидов при физиологических условиях из-за внутримолекулярной реакции образования аспартимида, который гидролизуется с образованием смеси пептидов, содержащих остатки аспарагиновой и изо-аспарагиновой кислоты в соотношении 1:3 (R. Stephenson et al., 1989) (Схема 3). Наибольшую проблему составляют участки, где аспарагиновая кислота или аспарагин связан пептидной связью с глицином, кроме того, эфиры аспарагиновой кислоты (в основном бензиловые), гораздо активнее свободной аспарагиновой кислоты или аспарагина, что облегчает процесс циклизации.
Схема 3
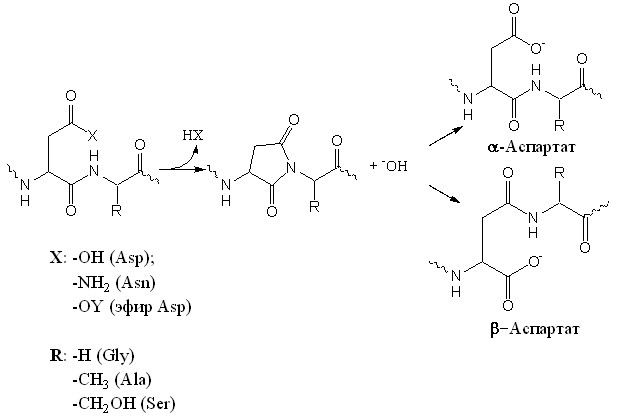
Уже на третьем этапе олигомеризации было отмечено значительное снижение чистоты и эффективности синтеза последовательностей (3в) и (3г). ВЭЖХ-анализ реакционных смесей после удаления декамеров (2в) и (2г) с полимерного носителя в стандартных условиях показал наличие ряда соединений, отличающихся по хроматографической подвижности, но, согласно данным масс-спектров, имеющих одинаковую молекулярную массу.
Мы предполагаем, что при олигомеризации мономера (1в), вероятность образования пятичленного имидного цикла достаточно велика, а, следовательно, как и в случае пептидов, возможно образование структурных изомеров ПНК, содержащих остатки аспарагиновой кислоты в -, -форме или аспартимида. Наличие ряда соединений с одинаковой молекулярной массой, но разной подвижностью в условиях обращенно-фазовой ВЭЖХ, при олигомеризации мономера (1г), является, скорее всего, результатом реакции N-ацильного переноса карбоксиметилированного остатка тимина (L. Christensen et al., 1995), которая приводит к образованию вторичных аминогрупп, участвующих в дальнейших стадиях конденсации, и к терминации цепи. Сокращение времени реакции отщепления олигомера от полимерного носителя, и использование более низких температур не приводило к изменению профиля ВЭЖХ, что позволяет сделать вывод об образовании значительного количества побочных продуктов в процессе твердофазного синтеза. Возможно проблема твердофазного синтеза декамеров отрицательно заряженных ПНК на основе L-аспарагиновой кислоты может быть решена при использовании циклопентиловых или циклогексиловых защитных групп (J. Tam et al., 1988; J. Blake, 1979) для -карбоксильной группы бокового радикала.
Таким образом, синтезированы, выделены и охарактеризованы два декамера отрицательно заряженных ПНК, построенных из повторяющихся мономерных звеньев на основе L-глутаминовой кислоты, глицина и тимин-1-ил уксусной кислоты с псевдопептидной связью GlyL-Glu и L-GluGly. Получены и охарактеризованы данными MALDI-MS две тримерные последовательности отрицательно заряженных ПНК, анионная группа в которых представлена остатками L-аспарагиновой кислоты.
3. Исследование гибридизационных свойств тиминсодержащих декамеров отрицательно заряженных пептидно-нуклеиновых кислот
3.1. Определение стабильности комплексов, образованных между тиминсодержащими декамерами отрицательно заряженных ПНК и олигодезоксирибонуклеотидами
Методы молекулярной биологии и диагностики, основанные на реакциях гибридизации, используют различия в стабильности комплексов, образованных двумя последовательностями олигонуклеотидов. Для оценки этой стабильности часто применяется термическая денатурация. Процессы денатурации и ренатурации контролируют по изменению УФ-спектра. Когда дуплекс переходит в денатурированное состояние, предполагается, что изменение коэффициента экстинкции пропорционально степени денатурации, т.е. изменение поглощения при 260 нм прямопропорционально количеству разрушенных водородных связей. Температура плавления (Т.пл.) дуплексов, то есть температура, при которой разрушено 50% водородных связей, дает представление о стабильности их комплексов с последовательностью-мишенью.
Исследование гибридизационных свойств декамеров отрицательно заряженных ПНК мы проводили на модельной последовательности H-[Thy-(L-GluGly)]10-NH2 (2б). Комплексы H-[Thy-(L-GluGly)]10-NH2 (2б)/5-(dA)10-3 и 5-(dT)10-3/5-(dA)10-3, используемый в качестве положительного контроля, получали нагреванием эквимолярных количеств олигомеров в буферной системе, содержащей 5 мМ Na2HPO4, 140 мМ KCl, 5 мМ MgCl2 (рН 7.46), до 950С, с последующим медленным (0.30С/мин) охлаждением до комнатной температуры.
Зависимость поглощения от температуры регистрировали на спектрофотометре с термостатируемой ячейкой. *
[3] Нагрев ячейки осуществляли с помощью термостата со скоростью 0.50С/мин. Температуру плавления рассчитывали как максимум зависимости первой производной поглощения от температуры. Согласно полученным кривым плавления, температура плавления комплекса 5-(dT)10-3/5-(dA)10-3 составила 230С, что соответствует литературным данным (I. Vargas-Baca et al., 2001), а комплекса H-[Thy-(L-GluGly)]10-NH2 (2б)/5-(dA)10-3 65.80С (Рис. 5, табл. 2). Высокая температура плавления дуплекса говорит о том, что отрицательно заряженные декамеры ПНК имеют упорядоченную в пространстве структуру, которая обладает высоким сродством к комплементарной последовательности.


Замена аденина в 5-м положении с 5-конца олигодезоксирибонуклеотида на гуанин, то есть наличие некомплементарного гетероциклического основания в середине последовательности-мишени, привело к незначительному снижению температуры плавления дуплекса H-[Thy-(L-GluGly)]10-NH2 (2б)/5-(dA)4dG(dA)5-3 (Т.пл. 30С).
Показана зависимость процесса гибридизации декамера отрицательно заряженных ПНК и комплементарного олигонуклеотида от ионной силы раствора (Рис. 5, табл. 2). Так, в отсутствие ионов Mg2+ температура плавления полностью комплементарного дуплекса (2б)/5-(dA)10-3 снижалась до 62.90С, а при дополнительном уменьшении содержания ионов K+ со 140 мМ до 14 мМ образование дуплекса нами не было зафиксировано.
Для исследования влияния расположения анионной группы в псевдопептидном остове отрицательно заряженных ПНК был проведен эксперимент по термической денатурации комплекса H-[Thy-(GlyL-Glu)]10-NH2 (2а)/5-(dA)10-3 в условиях, разработанных для последовательности (2б) и природных олигонуклеотидов (буфер А). Температура плавления составила 78.80С (Табл. 2). Таким образом, варьируя расположение заряда в псевдопептидном остове и изменяя ионную силу раствора, возможно регулировать процесс взаимодействия отрицательно заряженных ПНК и олигодезоксирибонуклеотидов.
Таблица 2. Температуры плавления комплексов тиминсодержащих отрицательно заряженных декамеров ПНК (2а), (2б) и олигодезоксирибонуклеотидов
| Олигомер | Мишень | Т.пл., 0С | Буфер |
| 5-(dT)10-3 | 5-(dА)10-3 | 23 | 5 мМ Na2HPO4 140 мМ KCl 5 мМ MgCl2 (рН 7.46) (А) |
| H-[Thy-(GlyL-Glu)]10-NH2 (2а) | 5-(dА)10-3 | 78.8 | (А) |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dА)10-3 | 65.8 | (А) |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dA)4dG(dA)5-3 | 62.8 | (А) |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dА)10-3 | 62.9 | 5 мМ Na2HPO4 140 мМ KCl (рН 7.46) (Б) |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dА)10-3 | * | 5 мМ Na2HPO4 14 мМ KCl (рН 7.50) (В) |
| H-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dА)10-3 | 61.9 | 3.87 мМ NaH2PO4 6.13 мМ Na2HPO4 140 мМ NaCl (pH 7.3) (Г) |
*Образование дуплекса не зафиксировано
При проведении эксперимента по термической денатурации комплекса H-[Thy-(L-GluGly)]10-NH2 (2б)/5-(dA)10-3 в условиях (буфер Г), предложенных для «классических» ПНК аналогичного состава и длины, температура плавления дуплекса составила 61.90С (Рис. 5, табл. 2) (Т.пл. H-[Thy-(GlyGly)]10-Lys-NH2/5-(dA)10-3 730С (M. Egholm et al., 1992)). Однако данная буферная система обладала значительной температурной зависимостью поглощения в интервале температур 60-750С и не подходит для работы с отрицательно заряженными ПНК.
3.2. Изучение биомолекулярного взаимодействия тиминсодержащих декамеров отрицательно заряженных пептидно-нуклеиновых кислот с олигонуклеотидами с помощью поверхностного плазмонного резонанса
Специфичность взаимодействия, прочность связывания и скорости процессов образования и разрушения комплексов Н-[Thy-(L-GluGly)]10-NH2 (2б)/5-(dA)10-3 и 5-(dT)10-3/5-(dA)10-3 исследовали на приборе «BIACORE3000», действие которого основано на технологии поверхностного плазмонного резонанса (SPR) (P. Torreri et al., 2005). SPR контролирует процессы связывания и диссоциации аналита и лиганда по изменению массы в водном слое, близком к сенсорной поверхности чипа, что приводит к изменению показателя преломления плоскополяризованного света, которое определяется как изменение SPR-сигнала, выраженное в резонансных единицах (RUs). Изменение резонансного сигнала (RU) от времени (сек) представляет собой сенсограмму.
Эксперимент состоял из иммобилизации лиганда (олигодезоксирибонуклеотида состава А10, модифицированного с 3'-конца биотином) на поверхности чипа (Sensor Chip SA) и исследования его взаимодействия со вторым компонентом в растворе – аналитом (Н-[Thy-(L-GluGly)]10-NH2 (2б) или 5-(dT)10-3).*
[4] Сенсорный чип представляет собой стекло, покрытое тонким слоем золота, модифицированного карбоксиметилированным декстраном с пре-иммобилизованным стрептавидином. Иммобилизацию лиганда проводили в течение 2 мин при концентрации лиганда 10 нг/мкл в HBS-EP-буфере (0.01 М HEPES (рН 7.4), 0.15 М NaCl, 3 мМ EDTA, 0.005% Twin20).
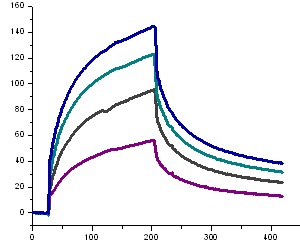
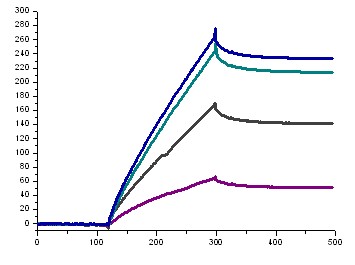

Сенсограммы (Рис. 6А), полученные инъекцией раствора декамера (2б) при различных концентрациях в HBS-EP-буфере, позволяют получить кинетические параметры (константы скорости связывания и диссоциации, ka и kd) и оценить сродство отрицательно заряженных ПНК к комплементарной последовательности олигодезоксирибонуклеотида (константа аффинности, KА).
Перед каждой инъекцией проводили регенерацию поверхности чипа буфером и регенерирующим раствором – 50 мМ NaOH (pH 11), при этом в случае отрицательно заряженного декамера ПНК для разрушения образованного комплекса использование 10 мМ NaOH (pH 8-9) оказалось недостаточным. В качестве положительного контроля, а также для сравнения свойств отрицательно заряженных ПНК и природных олигонуклеотидов, использовали данные, полученные нами в аналогичных условиях, для последовательности 5-(dT)10-3 (Рис. 6Б).
Расчет кинетических параметров осуществляли с помощью BIAevaluation software 4.1, используя модель связывания Лангмюра 1:1 (Таблица 3). Из полученных данных по кинетике взаимодействия, а также профиля сенсограмм можно сделать вывод о более высоком сродстве и прочности комплекса, образованного между декамером (2б) и комплементарным олигонуклеотидом, по сравнению с дуплексом, образованным между олигодезоксирибонуклеотидами. Более низкая, по сравнению с положительным контролем, скорость связывания должна благоприятствовать специфичному взаимодействию декамера ПНК с комплементарной последовательностью.
Таблица 3. Кинетические параметры (константы скорости адсорбции ka и диссоциации kd), и равновесная константа диссоциации (KD=1/KA) взаимодействий тиминсодержащего декамера отрицательно заряженных ПНК (2б) и олигонуклеотида 5-(dT)10-3 с комплементарной последовательностью олигонуклеотида 5-(dА)10-3, иммобилизованной на поверхности чипа, при 250С
| Аналит | Лиганд | ka (M-1с-1) | kd (с-1) | KD (М) |
| Н-[Thy-(L-GluGly)]10-NH2 (2б) | 5-(dА)10-3 | (3.17±0.05)103 | (2.1±0.3)10-4 | (6.5±0.9)10-8 |
| 5-(dT)10-3 | 5-(dА)10-3 | (6.5±0.1)103 | (5.61±0.06)10-3 | (8.6±0.2)10-7 |
Следует отметить, что при уменьшении температуры проведения эксперимента для декамера (2б) с концентрацией 1 мкМ в HBS-EP буфере до 100С, наблюдали значительное увеличение максимального отклика резонансного сигнала (RUmax = 217 RU), что говорит о температурной зависимости связывающей способности отрицательно заряженных ПНК.
Накопление экспериментальных данных по другим олигомерам отрицательно заряженных ПНК, проводимые в нашей лаборатории, позволит подойти к количественным закономерностям и использовать их для практической цели создания диагностикумов нового поколения и сенсорных устройств.
Выводы
- Синтезированы в препаративных количествах и полностью охарактеризованы четыре тиминсодержащих мономера отрицательно заряженных ПНК на основе остатков L-глутаминовой/L-аспарагиновой кислоты и глицина. Получены два новых тиминсодержащих мономера отрицательно заряженных ПНК с псевдопептидной связью, образованной между остатками защищенной дикарбоновой аминокислоты и глицина: (L-GluGly) (1б) и (L-AspGly) (1г), содержащих анионную группировку на N-конце псевдопептидного остова.
- Разработан Вос-протокол ручного твердофазного синтеза тиминсодержащих декамеров отрицательно заряженных ПНК, а также условия и методы их выделения и анализа.
- Синтезированы, выделены и охарактеризованы два новых тиминсодержащих декамера отрицательно заряженных ПНК на основе L-глутаминовой кислоты и глицина. Получены тримерные последовательности отрицательно заряженных ПНК с анионной группой, представленной боковым радикалом L-аспарагиновой кислоты, в различных положениях псевдопептидного остова. В результате синтеза декамеров тиминсодержащих отрицательно заряженных ПНК на основе L-аспарагиновой кислоты и глицина показано наличие ряда декамерных последовательностей, в которых аспарагиновая кислота находится в различных изомерных формах.
- На примере декамеров тиминсодержащих отрицательно заряженных ПНК на основе L-глутаминовой кислоты и глицина подобраны условия и проведены исследования их гибридизационных свойств. Показана способность образовывать прочные комплексы с комплементарными последовательностями олигодезоксирибонуклеотидов, а также зависимость прочности комплексов от ионной силы раствора и наличия некомплементарного основания в середине последовательности олигонуклеотида. Исследована зависимость гибридизационных свойств декамеров от расположения анионной группы в псевдопептидном остове.
- На примере декамера с псевдопептидной связью L-GluGly c помощью технологии поверхностного плазмонного резонанса (SPR) впервые получены качественные и количественные характеристики взаимодействия отрицательно заряженных ПНК с комплементарным олигодезоксирибонуклеотидом, иммобилизованным на поверхности чипа.
Основные результаты диссертации изложены в следующих публикациях:
- Прохоров Д.И., Кириллова Ю.Г., Боярская Н.П., Тевяшова А.Н., Есипова О.В., Звонкова Е.Н., Швец В.И. Синтез тиминсодержащего мономера отрицательно заряженных ПНК. // Хим.-фарм. журнал. 2005. Т. 39, № 6. – С. 39-43.
- Boyarskaya N.P., Prokhorov D.I., Kirillova Yu.G., Zvonkova E.N., Shvets V.I. Synthesis of protected pseudopeptides from dicarboxylic amino acids by Mitsunobu condensation. // Tetrahedron Lett. 2005. V. 46, № 43. P. 7359-7362.
- Боярская Н.П., Кириллова Ю.Г., Стотланд Е.А., Прохоров Д.И., Звонкова Е.Н., Швец В.И. Синтез двух новых тиминсодержащих мономеров отрицательно заряженных ПНК. // Доклады Академии наук. 2006. Т. 408, № 1. C. 55-58.
- Боярская Н.П., Кириллова Ю.Г., Есипов Д.С., Швец В.И. Твердофазный синтез декамера отрицательно заряженных ПНК с псевдопептидной связью GlyL-Glu. // Вестник МИТХТ. – 2007. Т. 2, № 5. – С. 37-41.
- Прохоров Д.И., Кириллова Ю.Г., Боярская Н.П., Швец В.И. Синтез тиминсодержащих мономеров отрицательно заряженных ПНК на основе глутаминовой кислоты. // II Московский международный конгресс «Биотехнология: состояние и перспективы развития». Москва. 2003. Ч. 1. С.111.
- Боярская Н.П., Кириллова Ю.Г., Прохоров Д.И., Швец В.И. Универсальный технологический подход к синтезу тиминсодержащих мономеров отрицательно заряженных ПНК на основе производных дикарбоновых кислот. // «Наукоемкие химические технологии XXI века». Волгоград. 2004. Т. 1. С. 263.
- Боярская Н.П., Прохоров Д.И., Баранов А.В. Разработка универсального подхода к синтезу мономеров отрицательно заряженных пептидно-нуклеиновых кислот. // III Московский международный конгресс «Биотехнология: состояние и перспективы развития». Москва. 2005. Ч. 1. С. 142-143.
- Боярская Н.П., Стотланд Е.А., Кириллова Ю.Г. Синтез мономеров отрицательно заряженных пептидно-нуклеиновых кислот различного строения. // Первая научно-техническая конференция молодых ученых «Наукоемкие химические технологии». Москва. 2005. Т. 1. С. 44-45.
- Боярская Н.П., Прохоров Д.И., Кириллова Ю.Г. Мономеры ПНК на основе дикарбоновых аминокислот и глицина. // Третий съезд общества биотехнологов России имени Ю.А.Овчинникова. Москва. 2005. С. 11-12.
- Боярская Н.П., Кириллова Ю.Г., Прохоров Д.И., Стотланд Е.А., Швец В.И. Разработка протокола ручного твердофазного синтеза отрицательно заряженных пептидно-нуклеиновых кислот. // Московская международная конференция «Биотехнология и медицина». Москва. 2006. С. 80-81.
- Боярская Н.П., Кириллова Ю.Г., Есипов Д.С., Швец В.И. Отрицательно заряженные пептидно-нуклеиновые кислоты: синтез олигомеров и исследование их свойств. // IV Московский международный конгресс «Биотехнология: состояние и перспективы развития». Москва. 2007. Ч. 1. С. 90-91.
[1] В руководстве работой принимала участие к.х.н., доц. Кириллова Ю.Г.
Список используемых сокращений: ОФ ВЭЖХ – обращенно-фазовая высокоэффективная жидкостная хроматография, НК – нуклеиновая кислота, ПНК – пептидно-нуклеиновая кислота, AegПНК – пептидно-нуклеиновая кислота, построенная на основе N-(2-аминоэтил)глицина, DEAD – диэтилазодикарбоксилат, DIEA – диизопропилэтиламин, DMS – диметилсульфид, EDTA – этилендиаминтетрауксусная кислота, HBTU – гексафторфосфат О-(бензотриазол-1-ил)-1,1,3,3,-тетраметилурония, HEPES – 4-(2-гидроксиэтил)-1-пиперазилэтансульфокислота, LC/MS – жидкостная хроматография/масс-спектрометрия, MALDI-TOF MS – матричная десорбционно-ионизационная времяпролетная масс-спектрометрия, MBHA – 4-метилбензгидриламин, oNBS – орто-нитробензолсульфонил-, NMM – N-метилморфолин, SPR – поверхностный плазмонный резонанс, TFA – трифторуксусная кислота, TFMSA – трифторметансульфокислота.
* MALDI-TOF-масс-спектрометрический анализ олигомеров отрицательно заряженных ПНК проводился совместно с ЦКП «Центр постгеномных технологий» на базе НИИ биомедицинской химии им. В.Н.Ореховича РАМН при участии Торопыгина И.Ю, а также совместно с научно-производственной фирмой «ЛИТЕХ» на базе НИИ физико-химической медицины МЗ РФ при участии Лукьяновой Т.А.
* Данная часть работы проводилась совместно с кафедрой Биоорганической химии Биологического факультета Московского Государственного Университета им. М.В.Ломоносова при участии к.х.н., с.н.с. Есипова Д.С.
* Данная часть работы проводилась совместно с лабораторией межмолекулярных взаимодействий НИИ биомедицинской химии им. В.Н. Ореховича РАМН при участии к.б.н., с.н.с. Гнеденко О.В. и д.б.н., проф., зав. лаб. Иванова А.С.

