Синтез и физико – химические свойства алкоксизамещенных гемигексафиразинов на основе 2,5 – диамино – 1,3,4 – тиадиазола
На правах рукописи
ТРУХИНА ОЛЬГА НИКОЛАЕВНА
СИНТЕЗ И ФИЗИКО–ХИМИЧЕСКИЕ СВОЙСТВА АЛКОКСИЗАМЕЩЕННЫХ ГЕМИГЕКСАФИРАЗИНОВ
НА ОСНОВЕ 2,5–ДИАМИНО–1,3,4–ТИАДИАЗОЛА
02.00.03 – Органическая химия
02.00.04 – Физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново 2010
Работа выполнена на кафедре технологии тонкого органического синтеза Государственного образовательного учреждения высшего профессионального образования «Ивановский государственный химико-технологический университет» и на кафедре органической химии Мадридского автономного университета
Научный руководитель: доктор химических наук, профессор
Исляйкин Михаил Константинович
Официальные оппоненты: доктор химических наук, профессор
Пономарев Гелий Васильевич
доктор химических наук, профессор
Бурмистров Владимир Александрович
Ведущая организация: Московский государственный университет
им. М. В. Ломоносова, г. Москва
Защита состоится «11 » октября 2010 г. в часов на заседании совета по защите докторских и кандидатских диссертаций Д 212.063.01 при Государственном образовательном учреждении высшего профессионального образования «Ивановский государственный химико-технологический университет» по адресу:
153000, г. Иваново, пр. Ф.Энгельса, д. 7.
Тел.: (4932) 32-54-33). Факс: (4932) 32-54-33. E-mail: [email protected]
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Ивановский государственный химико-технологический университет» по адресу: 153000, г. Иваново, пр. Ф.Энгельса, д. 10.
Автореферат разослан « » сентября 2010 г.
| Ученый секретарь совета по защите докторских и кандидатских диссертаций |  Кувшинова Е.М. Кувшинова Е.М. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Перспективным направлением химии макроциклических соединений является создание новых структурных аналогов порфиринов, имеющих в основе строения увеличенную координационную полость, различающуюся размерами, составом и количеством входящих в нее атомов, что обуславливает проявление специфических координационных свойств. Способность вмещать катионы металлов большого атомного радиуса успешно используется для получения комплексов с лантанидами, интересных для фотодинамической терапии и вирусологии, а также с актинидами – для аналитического определения радиоактивных ядов. Особенности строения макроциклического остова могут быть успешно использованы в избирательном транспорте через мембраны ввиду способности селективно сорбировать анионы различной природы. Порфириноиды обладают протяженной многоконтурной системой сопряжения и представляют интерес как объекты для изучения явления ароматичности в макросистемах и для разработки критериев ее оценки.
Макрогетероциклические соединения АВАВАВ типа, - гемигексафиразины, - можно рассматривать как аналоги гексафирина, в молекуле которого три пиррольных фрагмента (В) формально замещены на три тиадиазольных остатка (А), а метиновые мостики – на аза-мостики. Впервые структура гемигексафиразинов была установлена в 2008 году на примере три(трет-бутил)замещенного соединения с помощью газовой электронографии и квантово-химических расчетов.
К моменту постановки настоящей работы в литературе отсутствовали данные о структуре гемигексафиразинов в кристаллическом состоянии. Кроме того, не были изучены процессы фотовозбуждения, природа и механизмы релаксации возбужденных состояний, отсутствовали сведения о поведении в условиях ионизирующего излучения, а также о процессах окисления и восстановления макроциклов в среде электролита. Для решения этих задач требовались соединения с достаточно хорошей растворимостью, не содержащие примесей региоизомеров. Таким требованиям могли бы отвечать гемигексафиразины, содержащие алкоксильные заместители в 3,6- или 4,5-положения бензольных колец изоиндольных фрагментов макроцикла. Более того, представлялось интересным изучить влияние положения заместителей на физико-химические свойства соединений. К моменту постановки настоящей работы такие соединения получены не были.
Таким образом, постановка исследования, направленного на синтез и изучение свойств гексаалкоксизамещенных гемигексафиразинов на основе 2,5-диамино-1,3,4-тиадиазола, является важной и актуальной.
Цель работы: синтез гексаалкоксизамещенных гемигексафиразинов на основе 2,5-диамино-1,3,4-тиадиазола и изучение особенностей их геометрического и электронного строения, исследование электрохимических, люминесцентных, фотофизических, координационных и других физико-химических свойств.
Для достижения поставленной цели предполагалось решить следующие задачи:
- Разработка методов синтеза и синтез гемигексафиразинов на основе 2,5-диамино-1,3,4-тиадиазола и диалкоксизамещенных фталонитрилов, содержащих алкоксильные заместители в 4,5– или 3,6–положениях бензольных фрагментов;
- Установление структуры гемигексафиразина в твердой фазе методом рентгеноструктурного анализа (РСА);
- Изучение электрохимических свойств гексапентоксизамещенных соединений в растворе;
- Изучение люминесцентных свойств замещенных гемигексафиразинов, выявление природы и механизма релаксации фотовозбужденных состояний;
- Исследование устойчивости соединений к ионизирующему излучению в условиях окисления и восстановления, а также стабильности образующихся ион-радикалов;
- Получение комплексных соединений гексаалкоксизамещенных гемигексафиразинов с переходными металлами: Cu(II), Ni(II), Co(II);
- Исследование поведения гексаалкоксизамещенных макроциклов в среде дихлор-метан–трифторуксусная кислота;
- Изучение особенностей геометрического и электронного строения гексаалкоксизамещенных гемигексафиразинов и интерпретация их свойств с использованием методов квантовой химии (DFT); выявление природы полос в электронных спектрах поглощения с помощью TDDFT; изучение характера сопряжения в многоконтурной системе макроцикла.
Научная новизна. Впервые синтезированы макрогетероциклические соединения АВАВАВ типа, содержащие три остатка 2,5-диамино-1,3,4-тиадиазола и три изоиндольных фрагмента с алкоксильными заместителями в 4,5– или
3,6–положениях бензольных ядер (-ОСH3, -ОС3H7, -ОС5H11, -ОС12H25).
Методом РСА впервые показано, что макроциклический остов молекулы гексапентоксизамещенного гемигексафиразина в твердом состоянии имеет плоскостное строение, тиадиазольные фрагменты ориентированы атомами серы наружу макрокольца, что предполагает образование трехцентровых внутримолекулярных водородных связей.
C использованием квантово-химических расчетов высокого уровня впервые изучено электронное и геометрическое строение гексаалкоксизамещенных соединений, дана интерпретация электронных спектров поглощения, исследован характер сопряжения в макроциклическом остове.
С применением электрохимических, фотофизических, радиационно-химических методов впервые определены потенциалы окисления и восстановления в растворе, исследованы люминесцентные свойства и кинетика фотовозбужденных состояний молекул, а также охарактеризованы катион– и анион–радикальные формы молекул гемигексафиразинов.
Впервые изучены кислотно–основные взаимодействия 4,5- и 3,6-гексапентокси-замещенных макроциклов в среде дихлорметан-трифторуксусная кислота.
На основе полученных гексапентоксизамещенных соединений синтезированы новые трехъядерные комплексы с Cu (II), Ni(II), Co(II) состава 3:1.
Научная и практическая значимость.
Синтезированы новые представители класса гемигексафиразинов, содержащие шесть алкоксильных заместителей в 3,6– или 4,5–положениях бензольных ядер изоиндольных фрагментов. Электронное и геометрическое строение полученных соединений установлено как с применением комплекса физико-химических методов анализа, так и с помощью квантово-химических расчетов высокого уровня. На основе анализа электронного строения соединений, дано объяснение электронных спектров поглощения.
Изучено влияние положения алкоксильных заместителей в бензольных циклах изоиндольных фрагментов на физико-химические свойства синтезированных соединений и реакционную способность в реакциях протонирования.
Потенциалы окисления и восстановления гексаалкоксизамещенных гемигексафиразинов указывают на бльшую устойчивость соединений как к окислению, так и к восстановлению, по сравнению с октаалкоксизамещенными фталоцианинами. Определено, что в условиях фотовозбуждения макроциклы образуют короткоживущие синглетные возбужденные состояния, которые излучательно деградируют в синглетные основные состояния (F 0.10) и в более долгоживущие триплетные состояния, способные генерировать синглетный кислород. Обнаружена высокая устойчивость гемигексафиразинов в условиях ионизирующего излучения и стабильность образующихся ион-радикалов ( = 400 мкс).
Настоящая работа выполнена в рамках Договора о международном сотрудничестве между Ивановским государственным химико-технологическим университетом (Иваново, Россия) и Мадридским автономным университетом (Мадрид, Испания), при частичной поддержке гранта РФФИ № 05-03-33003а, гранта ИГХТУ 06-НИРС.
Личный вклад автора состоит в непосредственном участии во всех этапах работы: в постановке цели и задач, планировании и проведении эксперимента, выполнении квантово-химических расчетов, обсуждении результатов проведенного исследования.
Апробация работы.
Результаты работы обсуждались и были одобрены на Международных конференциях: International Conference “Organic chemistry since Butlerov and Beilstein until present”, Saint Petersburg, Russia, June 26 – 29, 2006; IV International Conference of Porphyrins and Phthalocyanines (ICPP – 4), Rome, Italy, July 2 – 7, 2006; V Conference on Cluster’s Chemistry and Polynuclear Compounds (“CLUSTERS – 2006”), Astrakhan, Russia, 4 – 8 September 2006; The 23 International Symposium on the Organic Chemistry of Sulfur, Moscow, Russia, June 29 – July 4, 2008; V International Conference of Porphyrins and Phthalocyanines (ICPP – 5), Moscow, Rusia, July 5 – 10, 2008;
“X Escuela Nacional de Materiales Moleculares”, Elche, 8 – 13 Febrero, 2009;
XXIV Международная Чугаевская конференция по координационной химии, Санкт-Петербург, Россия, 15 – 19 июня 2009.
Публикации. По материалам диссертации опубликовано 3 статьи (из них 2 в журналах, рекомендованных ВАК), 7 тезисов докладов.
Объем и структура диссертации. Диссертация изложена на 138 страницах машинописного текста и состоит из введения, литературного обзора, экспериментально-методической части, обсуждения, основных результатов и выводов, приложения. Работа содержит 13 схем, 41 рисунок, 10 таблиц, список литературы, включающий 148 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении приведено обоснование актуальности темы работы, сформулированы цель, задачи, определены научная новизна, практическая и научная значимость.
1. Литературный обзор
Литературный обзор состоит из 4 разделов. В первом разделе рассмотрены порфириноиды – макроциклические соединения с увеличенной координационной полостью. Второй раздел посвящен синтезу и особенностям строения гексаазааналогов гексафирина – макрогетероциклическим соединениям АВАВАВ, АВВАВВ, ААВААВ типов. В третьем разделе рассматриваются синтез и свойства комплексных соединений макроциклов АВАВАВ типа. Четвертый раздел содержит сведения о прикладных свойствах макрогетероциклических соединений, определяющих перспективы практического применения.
2. Экспериментально–методическая часть
В данной главе приведены характеристики исходных соединений, методики синтеза новых гемигексафиразинов и их металлокомплексов, результаты изучения их строения с помощью масс-спектрометрии, 1Н ЯМР, 13С ЯМР, ИК, электронной, спектроскопии и элементного анализа; приведены характеристики приборов, описаны методики исследований электрохимических, люминесцентных свойств соединений, фото– и ионизационно–возбужденных состояний, а также протонирования в среде дихлорметан-трифторуксусная кислота, приведены детали квантово-химических расчетов.
3. Обсуждение результатов
3.1. Синтез и строение гексаалкоксизамещенных гемигексафиразинов
Для синтеза макрогетероциклических соединений 1–3, 5–7 использовали замещенные фталонитрилы, содержащие метокси-, пентокси-, додецилоксируппы в 4,5– или изопропокси-, пентокси-, додецилоксируппы в 3,6–положениях. Было определено, что решающее влияние на выбор условий синтеза оказывают реакционная способность и растворимость исходных фталонитрилов в высококипящих спиртах – среде реакции. Соединения 1-7 получали конденсацией 2,5-диамино-1,3,4-тиадиазола с продуктами обработки замещенных фталонитрилов алкоголятами натрия (схема 1). Соединение 4 получали аналогичным образом с использованием фталонитрила.
Схема 1
 | a - i = MeONa, MeOH, 7 ч, 20-25 оС; ii = PhOH, 24 ч, 120 oC; b - i = BuONa, MeOH, BuOH, 7 ч, 20-25 оС; ii = 24 ч, t кип.; c - i = PeONa, PeOH, 36 ч, t кип; d - i = i-PrONa, i-PrOH, 36 ч, t кип. |
1 - 7
| 1 а | R1= -OCH3, R2= H; | 5 c | R1= H, R2= -OC5H11; |
| 2 b | R1= -OC5H11, R2= H; | 6 c | R1= H, R2= -OC12H25; |
| 3 b | R1= -OC12H25, R2= H; | 7 d | R1= H, R2= -OiC3H7; |
| 4 а | R1= H, R2= H |
Комплексную очистку макроциклов 2, 3, 5–7 проводили экстракцией примесей метанолом в аппарате Сокслета. Твердый остаток растворяли в хлороформе и фильтровали через слой оксида алюминия. Полученный раствор концентрировали и хроматографировали на колонке (силикагель, хлороформ : метанол = 10 : 1). После удаления растворителя соединения промывали на фильтре метанолом, гексаном, сушили под вакуумом при 60 оС. Ввиду низкой растворимости, соединения 1, 4 очищали могократной экстракцией примесей горячими растворителями:
N,N-диметилформамидом, пиридином, диметилсульфоксидом. Продукты промывали на фильтре метанолом, гексаном, после этого сушили под вакуумом. Строение соединений 1-3, 5-7 подтверждено данными масс-спектрометрии MALDI TOF,
1Н ЯМР, 13С ЯМР, ИК, электронной спектроскопии и элементного анализа (табл. 1).
Таблица 1
Характеристика синтезированных соединений 2, 4, 5*
| Соединение | Выход% | Масс-спектр MALDI-TOF, m/z найдено/ вычисл. (EM) | 1Н ЯМР, м.д. | ЭСП, макс, нм (lg) /CHCl3/ | Элементный анализ, найдено/вычисл., % |
 4 4 | 65 | 682.2/ЕМ=682.2 [M+H]+, C30H16N15S3+ | - | 306, 373, 393, 414, 466, 502, /C2H2Cl4/ | С 52.85, H 2.22, N 30.82, S 14.11/ C 52.13, H 3.02, N 30.64, S 13.92 для C30H15N15S3 |
 2 2 | 29 | 1198.6/ЕМ=1198.5 [M+H]+, C60H76N15O6S3+, 1236.5/ЕМ=1236.4 [M+K]+, C60H75N15O6S3K+ | 11.03 (3Н, NH), 6.61 (6H, H ар.), 3.71(12Н, ОСН2), 1.77 (12Н, СН2), 1.45 (24Н, СН2), 0.98 (18Н, СН3) | 292 (4.92), 399 (4.91), 421 (4.88), 511 (1.17) | C 60.19, H 6.40, N 17.44, S 7.45/ C 60.13, H 6.31, N 17.53, S 8.03 для C60H75N15O6S3 |
 5 5 | 12 | 1198.6/ЕМ=1198.5 [M+H]+, C60H76N15O6S3+ | 12.71 (3Н, NH), 7.13 (6H, H ar), 4.18 (12Н, OCH2), 1.96 (12Н, CH2), 1.63 (12Н, CH2), 1.48 (12Н, CH2), 1.00 (18Н, CH3) | 266 (3.01), 457 (4.93), 483 (4.13), 523 (1.65) | C 60.26, H 6.47, N 17.16, S 7.63/ C 60.13, H 6.31, N 17.53, S 8.03 для C60H75N15O6S3 |
*Характеристики других синтезированных соединений приведены в экспериментальной части диссертации
В масс-спектрах соединений 1-7 были зафиксированы сигналы молекулярных ионов [M+H]+, соответствующие молекулам состава (3+3), а также сигналы [M+K]+ для 4,5-алкоксизамещенных соединений.
 , м.д. , м.д. | 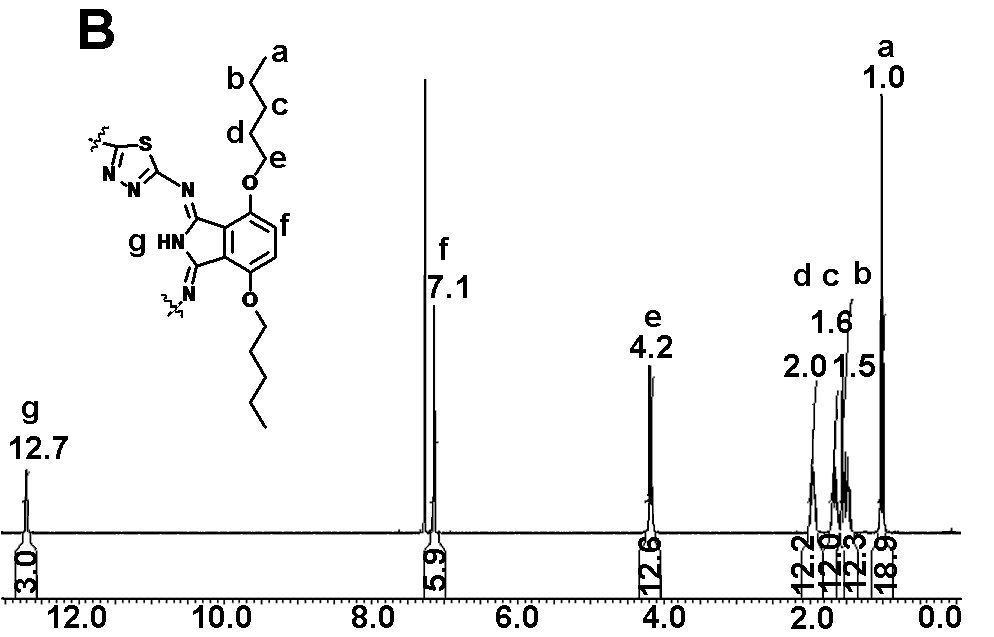 , м.д. , м.д. |
| Рис. 1. 1Н ЯМР спектры соединений 2 (A) и 5 (B) с отнесением сигналов | |
Для спектров 1Н ЯМР (CDCl3) макроциклов (-ОС3 H7, -ОС5H11, -ОС12H25) характеристичным является резонанс внутрициклических протонов иминогрупп в области слабого поля (11-13 м.д.), что указывает на неароматичный характер соединений (рис.1). Сигналы при 6.6–7.1 м.д. соответствуют резонансу протонов бензольных ядер, сигналы в области 1.0–4.2 м.д. – резонансу протонов алкоксильных групп.
3.2. Cтруктура гексапентоксизамещенного гемигексафиразина по данным РСА
Устойчивые при комнатной температуре монокристаллы в виде сольватов с ацетонитрилом (рис.2) и хлорбензолом, были получены медленным испарением раствора соединения 5 в системе хлорбензол–ацетонитрил, и охлаждением насыщенного раствора в хлорбензоле, соответственно. Методом РСА показано, что макроциклический остов молекулы гемигексафиразина в твердом состоянии имеет плоскостное строение. Тиадиазольные фрагменты ориентированы атомами серы наружу макроцикла. Расстояния между атомами азота пиррольных фрагментов и тиадиазольных ядер [NN (2.729 – 2.793 ), NHN (2.198 – 2.223 )] допускают формирование трехцентровых водородных связей, стабилизирующих данную конфигурацию. Альтернирование длин связей в макроциклическом остове указывает на отсутствие эффективной электронной –делокализации в [30]гетероаннулене. Характер связей C-N (1.371 – 1.386 ) пиррольного фрагмента и C=N (1.285 – 1.321 ) тиадиазольного фрагмента свидетельствует о том, что атом водорода локализован на атоме азота пиррольного фрагмента, и молекула в твердом состоянии существует преимущественно в виде единственного таутомера. Явление NH-таутомерии также не удалось зафиксировать в 1Н ЯМР спектрах макроциклов 2, 5 в интервале температур от +25 до 80 °C (d2-С2H2Cl4).
 | 
| ||||||||||||
Рис. 2. Структура молекулы 5 по данным РСА, (на виде сбоку заместители не показаны) | Рис. 3. Значения NICS по данным |
Таким образом, впервые структура гемигексафиразинов установлена с помощью РСА на примере гексапентоксизамещенного соединения 5.
3.3. Синтез комплексов гексапентоксизамещенных гемигексафиразинов с металлами Cu(II), Co(II), Ni(II)
Комплексы гексапентоксизамещенных соединений с Ni(II), Cu(II), Co(II) 8–14a получены взаимодействием соответствующих макроциклических лигандов 2, 5 с ацетатами металлов в диметилформамиде при 100оС в течение 6 часов (схема 2). Темплатным синтезом из 2,5-диамино-1,3,4-тиадиазола и замещенных фталонитрилов в присутствии ацетата никеля также синтезированы никелевые металлокомплексы 11a, 14a состава 3:1. Очистку соединений проводили промывкой веществ органическими растворителями и водой, а затем с помощью гель–проникающей колоночной хроматографией (Bio-Beads S-X1, тетрагидрофуран). Состав комплексов 3:1 установлен на основании данных масс-спектрометрии MALDI TOF, ИК, электронной спектроскопии, элементного анализа и ЭПР.
Схема 2
8 – 14a[1]
| 8, 8a – M = Ni(II), R1 = OC5H11, R2 = H | 11, 11a – M = Ni(II), R1 = H, R2 = OC5H11 |
| 9 – M = Cu(II), R1 = OC5H11, R2 = H | 12 – M = Cu(II), R1 = H, R2 = OC5H11 |
| 10 – M = Co(II), R1 = OC5H11, R2 = H | 13 – M = Co(II), R1 = H, R2 = OC5H11 |
| L = OAc | 14a – M = Ni(II), R1 = H, R2 = OisoC3H7 |
| i = ML2XH2O, DMF, 100oC, 6 ч; | ii = Ni(OAc)24H2O, EtOEtOH, t кип., 24 ч; |
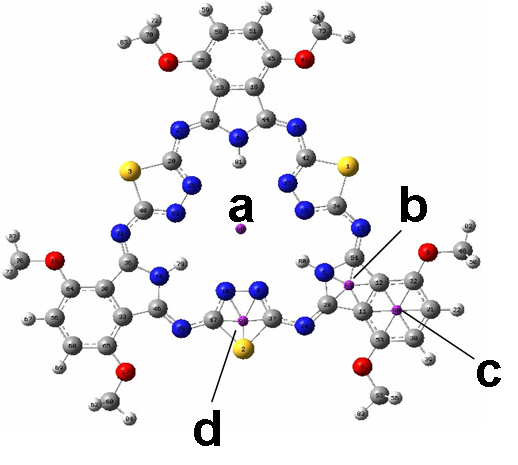
В масс-спектрах полученных соединений зафиксированы сигналы, соответствующие молекулярным ионам состава [Мс+3М+О]+, (M = Ni(II), Cu(II), Co(II)), формирование которых может быть обусловлено условиями масс-спектрального эксперимента (рис.4). С помощью ЭПР спектроскопии на примере медных и никелевых комплексов показано, что все три атома металла в молекуле металлокомплекса гемигексафиразина являются эквивалентными (рис.5).
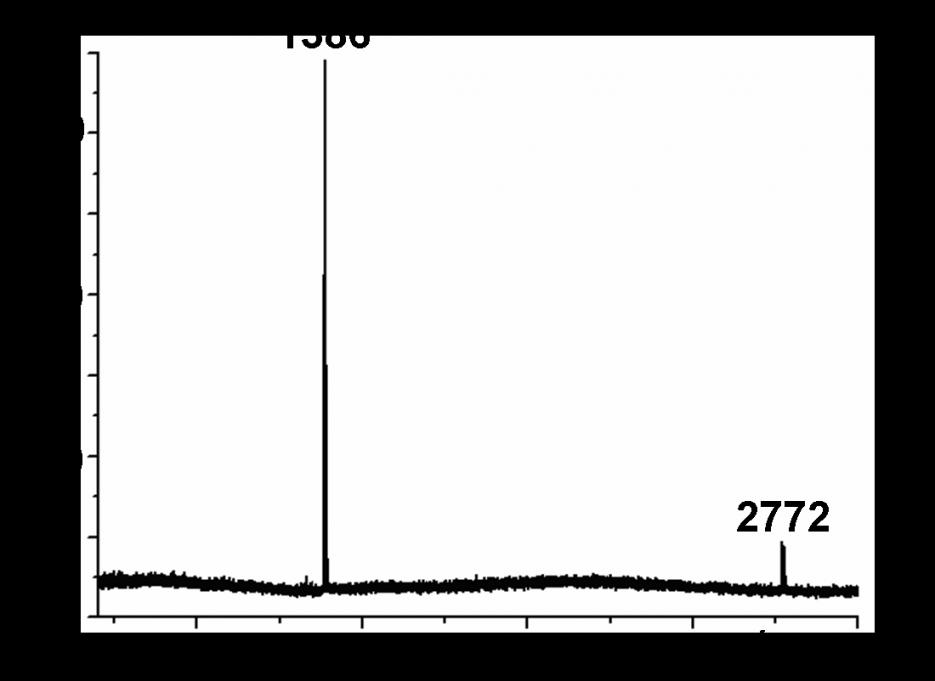 | 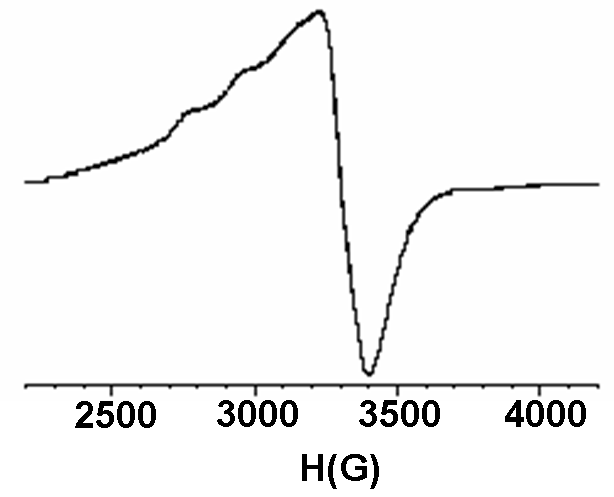 |
| Рис. 4. Масс-спектр никелевого комплекса 11, 3,6-Ni3Mc(OC5H11)6 | Рис. 5. Спектр ЭПР медного комплекса 9, 4,5-Сu3Mc(OC5H11)6 (20 К) |
3.4. Электронные спектры поглощения гексаалкоксизамещенных гемигексафиразинов
В основе строения остова гемигексафиразинов лежит гетероаннулен, состоящий из 30 атомов C и N, которые формируют формально сопряженную циклическую систему, включающую 30 pz-электронов, что соответствует правилу Хюккеля (4n+2). Расположение длинноволновых полос поглощения в области 350-550 нм указывает на отсутствие протяженной макроциклической системы сопряжения. Спектральные кривые поглощения незамещенного гемигексафиразина 4 в тетрахлорэтилене, гексаалкоксизамещенных 2 и 5 в хлороформе представлены на рис.6. Спектр незамещенного соединения 4 (рис.6а) характеризуется наличием двух интенсивных полос поглощения при 390 и 410 нм и полос поглощения при 370, 460, 500 нм меньшей интенсивности.
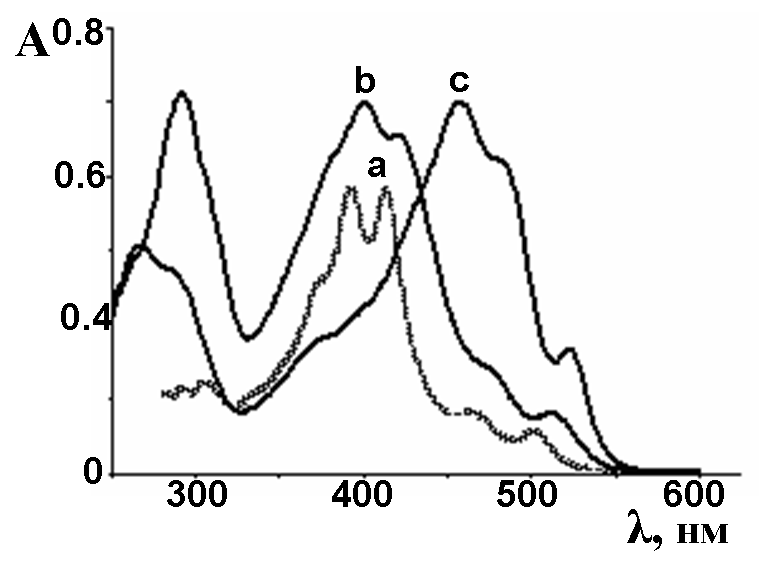 |
| Рис.6. Электронные спектры соединений: а) H3Mc (4) (C2H2Cl4, C=1.5910-5 моль/л), b) 4,5-H3Mc(OC5H11)6 (2) (CHCl3, C = 1.6510-5 моль/л), c) 3,6-H3Mc(OC5H11)6 (5) (CHCl3, C = 1.6710-5 моль/л) |
Присутствие шести алкоксильных фрагментов в молекуле гемигексафиразина приводит к уширению и батохромному смещению длинноволновых полос поглощения в среднем на 20 нм при изменении характера замещения с 4,5- (2) на 3,6- (5). Спектр соединения 2 характеризуется наличием полос поглощения при 360, 380, 400, 420, 470, 510 нм (рис.6b). В спектре соединения 5 присутствуют полосы при 380, 430, 460, 485 и 520 нм (рис.6с).
Для выявления особенностей строения хромофорной системы алкоксизамещенных гемигексафиразинов и отнесения основных полос поглощения в электронных спектрах было проведено теоретическое изучение строения молекулярных орбиталей модельных молекул A, B, C с помощью TD DFT.
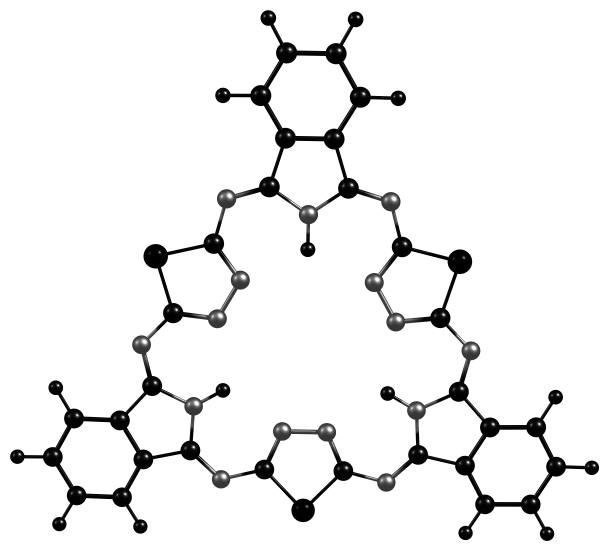 | 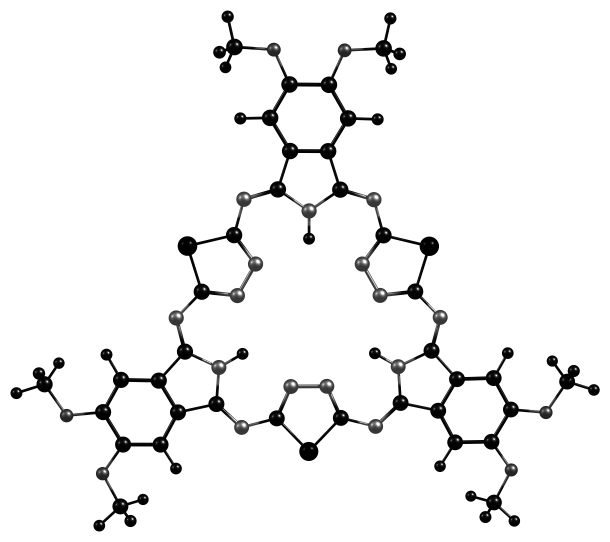 | 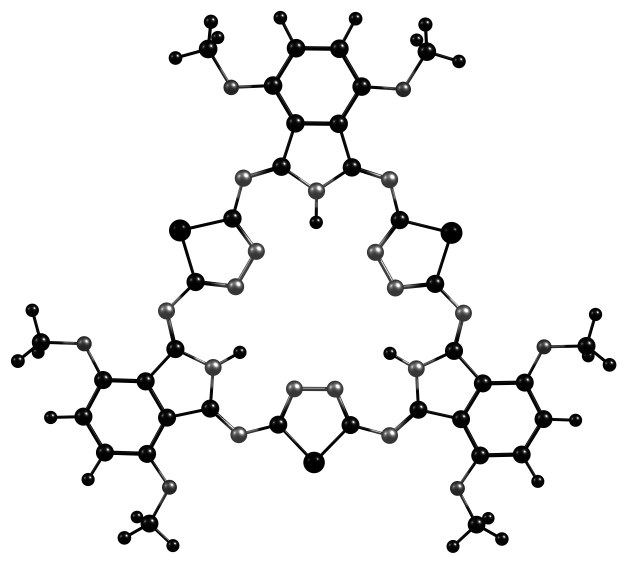 |
| А | B | C |
Рис. 7. Модели молекул, оптимизированных DFT B3LYP/6-31G(d,p)
Таблица 2
Значения энергии трех высших занятых, трех низших свободных молекулярных орбиталей и энергии возбуждения (E) для оптимизированных молекул A, B, C по данным TDDFT
| Струк- тура | Энергия молекулярной орбитали, эВ | Е, эВ | |||||
| ВЗМО-2 | ВЗМО-1 | ВЗМО | НСМО | НСМО+1 | НСМО+2 | ||
| A | -6.59 | -5.86 | -5.86 | -2.89 | -2.89 | -2.23 | 2.97 |
| B | -5.92 | -5.48 | -5.48 | -2.62 | -2.62 | -1.95 | 2.87 |
| C | -5.49 | -5.29 | -5.29 | -2.48 | -2.48 | -1.85 | 2.81 |
Квантово-химические расчеты первых синглет-синглетных электронных переходов для конфигураций, оптимизированных на уровне DFT B3LYP/6-31G(d,p), пакет программ РС GAMESS, выполнялись с использованием метода TD DFT. Как следует из данных (табл. 2, рис. 7), для моделей А, В, С две ВЗМО и две НСМО являются вырожденными орбиталями -типа, -*-электронные переходы между которыми разрешены.
Введение шести метоксильных групп в 4,5–положения макроцикла (структура В, рис.7) приводит к дестабилизации как ВЗМО, так и НСМО, причем энергия ВЗМО уменьшается в большей степени. Энергетический зазор между граничными орбиталями снижается с 2.97 до 2.87 эВ, в сравнении с незамещенным соединением (А), и поглощение световой энергии соединением 2 происходит в более длинноволновой части спектра. Введение шести метоксигрупп в 3,6–положения макроцикла приводит к дополнительной дестабилизации ВЗМО и НСМО в структуре С, и уменьшению энергии возбуждения молекулы до 2.81 эВ, что выражается в батохромном смещении полос поглощения (450-550 нм) в спектре соединения 5.
3.5. Особенности электронного строения гемигексафиразинов
Квантово-химические расчеты ядерно-независимых химических сдвигов (NICS) на уровне DFT B3LYP/6-311G(d,p) для молекулы
гексаметоксизамещенного гемигексафиразина (рис.3) указывают на то, что ароматичность сохраняется в локальных контурах сопряжения (ядрах бензола, пиррола, тиадиазола) и не характерна для [30]гетероаннулена в целом. Проведен анализ влияния ряда факторов на эффективность сопряжения в макроциклическом остове. Показано, что уменьшение количества атомов азота в серусодержащих фрагментах (замена тиадиазольных ядер на тиазольные или тиофеновые) приводит к увеличению эффективности делокализации в макроциклическом остове и отрицательным значениям NICS в центре макроциклической полости. Аналогичный эффект оказывает инверсия тиадиазольных (тиазольных) фрагментов, сопровождающаяся нарушением внутрициклических водородных связей.
3.6. Физико-химические свойства гексапентоксизамещенных гемигексафиразинов
3.6.1. Электрохимические свойства пентоксизамещенных соединений 2 и 5 были изучены методом циклической вольтамперометрии и дифференциальной импульсной вольтамперометрии. В выбранном электроактивном интервале (–2.5 1.5 В) в системе [о-дихлорбензол, 0.1 М (n-Bu)4NPF6)] были зарегистрированы четыре ступенчатых процесса восстановления для 2 и 5, и один процесс окисления для
3,6-алкоксизамещенного макроцикла 5.
Таблица 3
Электрохимические потенциалы окисления и восстановления Ep vs Fc/Fc+ (В) для 2, 5
| Потенциал Ep vs Fc/Fc+, (В) | |||||
| Восстановление | Окисление | ||||
| E0/ | E/2 | E2/3 | E3/4 | E0/+ | |
| 4,5-Н3Mc(OC5H11)6 (2) | 1.53 | 1.69 | 1.97 | 2.29 | - |
| 3,6-Н3Mc(OC5H11)6 (5) | 1.47 | 1.63 | 1.93 | 2.23 | +1.15 |
(Pt электрод (1мм), о-дихлорбензол (0.1 М(n-Bu)4NPF6), 2 (2.17 10-4 моль/л),
5 (1.00 10-4 моль/л), 100 мВ/c).
Установлено (табл. 3), что соединение 5 легче принимает электроны, по сравнению с 2, и легче их отдает, что находится в соответствии с величинами ВЗМО-НСМО энергетических зазоров, вычисленных методом DFT B3LYP/6-31G(d,p). Показано, что гемигексафиразины являются более устойчивыми как к окислению, так и к восстановлению, по сравнению с соответствующими алкоксизамещенными фталоцианинами.
3.6.2. Изучение ион–радикальных состояний с помощью импульсного радиолиза.
С помощью импульсного радиолитического окисления/восстановления соединений 2 и 5 наблюдали диссоциативную ионизацию макроциклов в растворах или присоединение электрона к растворенному веществу с образованием соответствующих катион-/анион-радикалов. Разностные спектры поглощения катион-радикалов (рис.6), соединений 2 и 5 были зафиксированы в условиях полной деградации ионизированных частиц растворителя •OOCH2Cl и •OOCHCl2. Полосы поглощения с минимумами при 420, 450 нм соответствуют обесцвечиванию неионизированного состояния. Широкие полосы с максимумами при 470 и 520 нм на спектре (рис. 6а) отнесены к собственному поглощению катион-радикала 2. Аналогично спектрам поглощения невозбужденных состояний, в случае
3,6-замещенного соединения 5, полосы поглощения в спектре его катион–радикала смещаются батохромно до 510, 550, 570 нм (рис. 6b).
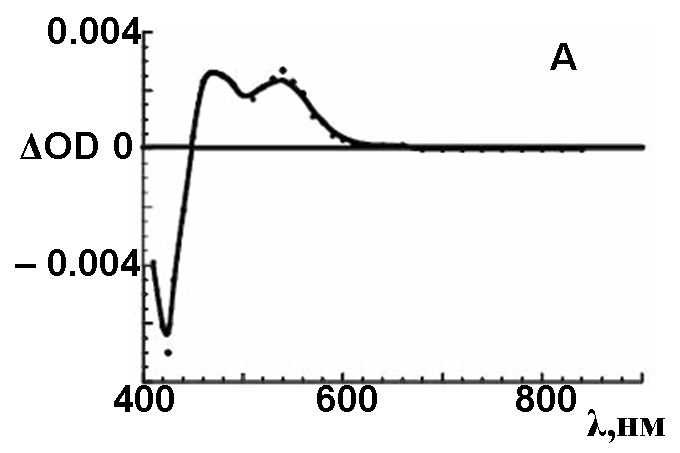 | 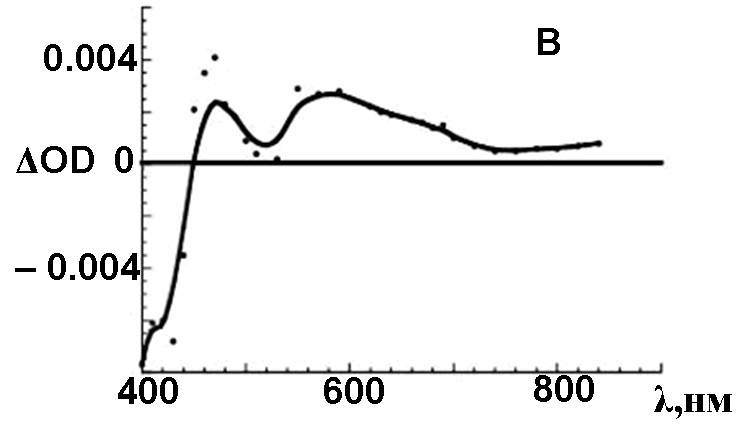 |
| Рис. 6. а) Разностный спектр поглощения катион-радикалов 2 (A) и 5 (B), инициированных к образованию частицами •OOCH2Cl и •OOCHCl2, при импульсном радиолитическом окислении (15 МэВ, 50 нс) насыщенного кислородом раствора соединения в дихлорметане | |
При изменении концентрации гемигексафиразинов от 5.010-6 моль/л до 2.010-5 моль/л было отмечено ускорение распада частиц •OOCH2Cl и/или •OOCHCl2, проявляющийся в быстром затухании поглощения. Было установлено, что образующиеся при моноокислении катион-радикалы, а также образующиеся при моновосстановлении анион-радикалы макроциклов, чрезвычайно стабильны и характеризуются временами жизни до 400 микросекунд.
3.6.1. Изучение свойств фотовозбужденных состояний молекул гемигексафиразинов впервые проведено на примере 4,5– и 3,6–замещенных соединений 2, 5 с помощью времяразрешенной спектроскопии флуоресценции и флэш–фотолиза. Спектры флуоресценции были зарегистрированы в матрице (77К) (рис.7) при воздействии на растворы соединений светом с = 400 500 нм.
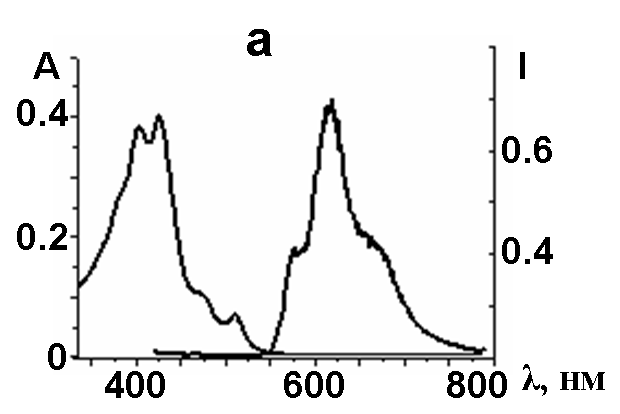 | 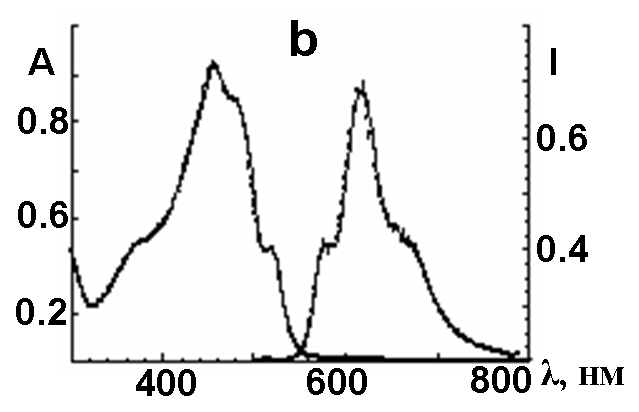 |
| Рис.7. Вид электронных спектров поглощения (CH2Cl2, 295К) (слева) и испускания (Me-THF, 77К) (справа) для a) 2 и b) 5 | |
Коротковолновые полосы испускания при 575 (рис.7а,b) соответствуют 0*–0 синглет-синглетным электронным переходам в 2 и 5, соответственно. Квантовые выходы флуоресценции для 2 и 5 составили 0.11 и 0.08. Времяразрешенные спектры флуоресценции удалось зарегистрировать лишь для 4,5–замещенного макроцикла 2. Время жизни синглетного возбужденного состояния 2 составило 120 нс. Малые величины квантовых выходов и Стоксовы сдвиги порядка 200 нм указывают на конкурентные безизлучательные процессы релаксации фотовозбужденных состояний, как межсистемные и внутрисистемные переходы.
С целью изучения динамики деградации фотовозбужденных состояний макроциклов, с применением фемтосекундного лазерного флэш-фотолиза (387 нм,
1 кГц, 150 фс) и спектроскопии поглощения фемто- и наносекундного разрешения, были записаны спектры разностного поглощения соединений 2 и 5 (рис.8).
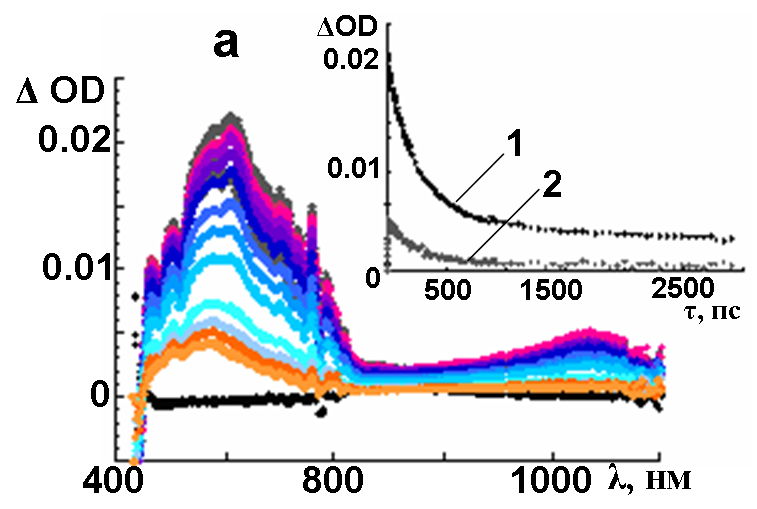 | 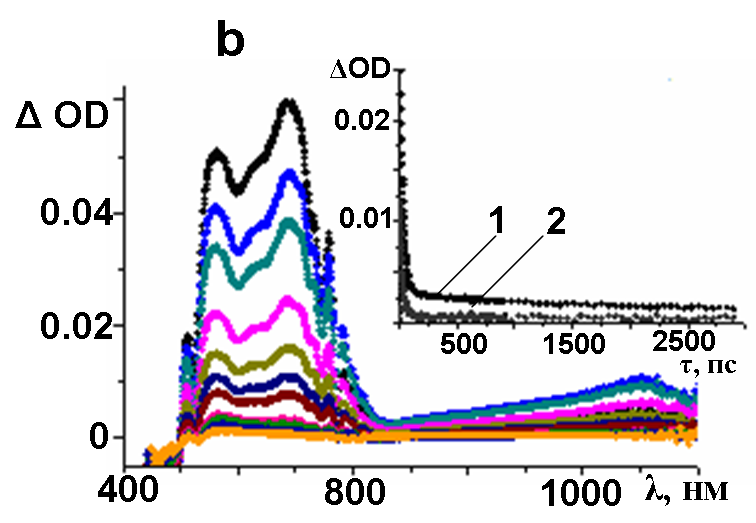 |
| Рис. 8. Разностные спектры поглощения, полученные в результате возбуждения 2 (a) и 5 (b) лазерным импульсом (387 нм, 1 кГц, 150 фс), зафиксированные в промежутках времени 03000 пс, при комнатной температуре. На вставке – зависимость изменения оптической плотности (OD) от времени (, пс) при 1) 575 и 2) 1270 нм, соответствующая образованию триплетного состояния | |
В обоих случаях наблюдается выцветание интенсивной полосы поглощения при 390–430 нм (рис. 8а) и при 440–480 нм (рис. 8b), что соответствует поглощению основного невозбужденного состояния. Появление двух групп полос, при 450–850 нм и при 1100–1400 нм, характеризует короткоживущие возбужденные синглетные состояния с периодом полураспада = 175 ± 10 нс, что находится в соответствии с временами жизни флуоресценции. Определено, что основным способом деградации возбужденных синглетных состояний является их безизлучательный переход в триплетные состояния. Константы скорости затухания синглетных возбужденных состояний были определены кинетически и составили 3.9109 с-1 для 2 и 4.31010 с-1 для 5, соответственно.
Проведением дополнительных измерений в наносекундной шкале разрешения (лазерная вспышка с длиной волны 355 нм, продолжительность воздействия 6 нс) были определены свойства долгоживущих триплетных возбужденных состояний молекул макроциклов. Так, поглощение при 565 нм и при 580 нм (рис. 8а и 8б) характеризуют триплет-триплетные переходы в соединениях 2 и 5, соответственно. Как и в спектрах поглощения основного состояния, максимум триплетного поглощения несколько смещается в длинноволновую область в 3,6–замещенном макроцикле по сравнению с 4,5–замещенным. Константы скорости триплетной инактивации составили 1.0105 с-1 для 2 и 5.
3.6.4. Кислотно–основные взаимодействия в среде дихлорметан–трифторуксусная кислота. Методом спектрофотометрического титрования было установлено, что процесс протонирования гексапентоксизамещенных гемигексафиразинов 2, 5 в среде дихлорметан–трифторуксусная кислота (TFA) (СTFA = 00.862 моль/л) протекает в две равновесные стадии и характеризуется образованием двух протонированных форм. Протонирование гексаалкоксизамещенного соединения 5 сопровождается смещением длинновых полос поглощения на 40 нм в сторону больших длин волн, тогда как в случае 2 – лишь на 7 нм. Для интерпретации результатов эксперимента были проведены квантово-химические расчеты возможных протонированных форм с оптимизацией геометрии на уровне DFT, электронные спектры поглощения рассчитаны методом TDDFT. На основании сравнения значений общих энергий систем, а также в соответствии с величинами энергий возбуждения синглет-синглетных электронных переходов, были определены центры протонирования и наиболее вероятные протонированные формы.
Основные результаты и выводы
- Взаимодействием 2,5-диамино-1,3,4-тиадиазола и продуктов реакции
4,5- и 3,6-метокси-, пентокси-, додецилоксиалкоксизамещенных фталонитрилов с алкоголятами натрия впервые осуществлен синтез 4,5- и 3,6-гекса-алкоксизамещенных (C1, С5, С12) гемигексафиразинов; - Взаимодействием гексапентоксизамещенных макроциклических лигандов получены новые Ni(II)-, Cu(II)-, Co(II)- металлокомплексы состава (3:1); соответствующие Ni(II)- комплексы получены встречным синтезом - темплатной конденсацией 2,5-диамино-1,3,4-тиадиазола и 3,6- или 4,5-дипентокси-
фталонитрилов в присутствии ацетата никеля; - Впервые на примере 3,6-гексапентоксизамещенного гемигексафиразина структура макрогетероциклических соединений состава АВАВАВ типа в твердом состоянии установлена методом РСА; показано, что основные геометрические характеристики макроциклического остова гемигексафиразина в твердой и газовой фазах хорошо согласуются между собой;
- Особенности электронного и геометрического строения макроциклов изучены с применением квантово-химических методов DFT. С применением TD DFT показано, что значение энергии возбуждения первого синглет-синглетного электронного перехода изменяется в соответствии с характером замещения в макроцикле и находится в согласии с ЭСП соединений;
- Методом циклической и дифференциальной импульсной вольтамперометрии впервые изучены окислительно-восстановительные свойства гемигексафиразинов; показано, что соединения данного класса являются более устойчивыми как к окислению, так и к восстановлению по сравнению с соответствующими алкоксизамещенными фталоцианинами;
- С помощью импульсного радиолиза и оптической спектроскопии сверхвысокого временного разрешения впервые зафиксированы чрезвычайно устойчивые ионизационно-индуцированные катион- и анион-радикалы 3,6- и 4,5-гекса-
пентоксизамещенных соединений с временем жизни = 400 мкс; - Кинетические характеристики возбужденных синглетных и триплетных состояний гемигексафиразинов впервые определены на примере гексапентоксизамещенных соединений с помощью лазерной спектроскопии фемто- и наносекундного разрешения; установлено, что, наряду с флуоресценцией, основным механизмом деградации синглетного возбужденного состояния является интеркомбинационная конверсия, сопровождющаяся тушением кислородом воздуха.
- Впервые изучено поведение 4,5- и 3,6-алкоксизамещенных гемигексафиразинов в среде дихлорметан-трифторуксусная кислота; показано, что протонирование проходит в две равновесные стадии и характеризуется образованием двух устойчивых протонированных форм; наиболее вероятное местоположения присоединения протонирующих частиц определены с помощью методов квантовой химии DFT и TDDFT.
Основное содержание работы изложено в следующих публикациях:
- Danilova, E. A. Thiadiazole Containing Macrocycles as Core-Modified Analogues of Phthalocyanine /E. A. Danilova, T. V. Melenchuk, O. N. Trukhina, A. V. Zakharov,
M. K. Islyaikin // Macroheterocycles – 2010. – Vol. 2. – Iss. 5. – P. 33 - 37. - Данилова, E. A. Исходные соединения для макрогетероциклов. Диаминотиадиазолы /E. A. Данилова, T. В. Меленчук, O. Н. Трухина, M. K. Исляйкин / Макрогетероциклы – 2010. – Т. 2. – Вып. 5. – С. 68-81.
- Trukhina, O. N. Synthesis and Properties of Alkoxysubstituted Heteroanalogues of Hexaphyrin /O. N. Trukhina, M. S. Rodrguez-Morgade, E. A. Danilova, M. K. Islyaikin,
T. Torres // J. Porphyrins and Phthalocyanines – 2008. – Vol. 12. – Iss. 3 – 6. – P. 757. - Trukhina, O. N. Thiadiazole-Related Hexaphyrin Heteroanalogues /O. N. Trukhina,
M. S. Rodrguez-Morgade, E. A. Danilova, E. Caballero, M. K. Islyaikin, T. Torres/ Abstracts: “X Escuela Nacional de Materiales Moleculares”, 8-13 Febrero 2009, Elche. – P. 25. - Boumbina, N. V. Synthesis and properties of Nickel(II)-complexes of hexaalkoxysubstituted Macroheterocyclic compounds with enlarged coordination cavity
/N. V. Boumbina, O. N. Trukhina, E. A. Danilova, M. K. Islyaikin, L. D. Yagodarova // Abstracts: International Conference “Organic Chemistry Since Butlerov and Beilstein until present”. 26 - 29 June 2006, Saint Petersburg, Russia. – P. 243 - 244. - Danilova, E. A. Template synthesis of metal complexes of substituted thiadiazole-porphyrinoids /E. A. Danilova, N. V. Boumbina, T. V. Melenchuk, Y. V. Romanenko,
O. N. Trukhina, M. K. Islyaikin // J. Porphyrins and Phthalocyanines. 2006. – Vol. 10. –
N 4 - 6. – P. 681. Abstracts: “Fourth International Conference of Porphyrins and Phthalocyanines” (ICPP-4). 2 - 7 July 2006, Rome, Italy. J. Porphyrins and Phthalocyanines. 2006. – Vol. 10. – N 4 - 6. – P. 681. - Bumbina, N. V. Synthesis and properties of polynuclear complexes based on the structural analogues of hexaphyrin /N. V. Bumbina, E. A. Danilova, M. K. Islyaikin, O. N. Trukhina, T. N. Lomova, E. E. Mozhzhukhina // Abstarcts: “V Conference on Cluster’s Chemistry and Polynuclear Compounds” (“CLUSTERS – 2006”), 4 – 8 September 2006, Astrakhan, Russia, P. 15.
- Trukhina, O. N. Hexaalkylthiasubstituted thiadiazole-based expanded heteroazaporphyrinoids /O. N. Trukhina, M. S. Rodriguez-Morgade, E. A. Danilova,
M. K. Islyaikin, T. Torres // Abstracts: “The 23d International Symposium on the Organic Chemistry of Sulfur”, 29 June – 4 July 2008, Moscow, Russia. – P. 147–148. - Суслова, Е. Е. Устойчивость и основность замещенных макрогетероциклических лигандов с расширенной координационной полостью /Е. Е. Суслова, Т. Н. Ломова,
М. К. Исляйкин, Е. А. Данилова, О. Н. Трухина // Тез. докл. “XXIV Международная Чугаевская конференция по координационной химии,” 15-19 июня 2009, Санкт-Петербург, Россия. – С. 374. - Трухина, О. Н. Металлокомплексы гексаазатритиадиазолпорфириноидов
/О. Н. Трухина, М. С. Родригез-Моргадэ, Е. А. Данилова, М. К. Исляйкин, Т. Торрес // Тез. докл. “XXIV Международная Чугаевская конференция по координационной химии,” 15-19 июня 2009, Санкт-Петербург, Россия. – С. 378.
Автор выражает глубокую признательность проф. Т. Torres (Universidad Autnoma de Madrid) и M. S. Rodrguez-Morgade (Universidad Autnoma de Madrid) за поддержку и помощь в выполнении работы.
Подписано в печать 06.09.2010 г. Усл. п. л. 1.00 Уч. изд. л. 1.03
Формат 60Ч84 1/16. Тираж 80 экз. Заказ
Государственное образовательное учреждение высшего профессионального
образования «Ивановский государственный химико-технологический
университет». 153000 г. Иваново, пр-т Ф. Энгельса, 7.
Отпечатано на полиграфическом оборудовании кафедры экономики
и финансов ГОУ ВПО «ИГХТУ»
[1] 8a, 11a, 14a – соединения, полученные темплатным синтезом.

