Натольевна реакции нуклеофильного замещения в ряду 1,3,7-триазапиренов
На правах рукописи
Сайгакова
Надежда Анатольевна
Реакции нуклеофильного замещения в ряду
1,3,7-триазапиренов
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Астрахань – 2013
Работа выполнена в ФГАОУ ВПО «Северо-Кавказский федеральный университет» на кафедре химии
| Научный руководитель: | доктор химических наук, профессор Боровлев Иван Васильевич | |
| Официальные оппоненты: | доктор химических наук, профессор Абаев Владимир Таймуразович (ГОУ ВПО «Северо-Осетинский государственный университет им. К. Л. Хетагурова», заведующий кафедрой органической и физической химии) доктор химических наук, профессор Тырков Алексей Георгиевич (ФГБОУ ВПО «Астраханский государственный университет», декан химического факультета, заведующий кафедрой неорганической и биоорганической химии) | |
| Ведущая организация: | ФГАОУ ВПО «Южный федеральный университет» (г. Ростов-на-Дону) |
Защита диссертационной работы состоится «7» июня 2013 года в 10.00 часов на заседании диссертационного совета Д 307.001.04. при ФГБОУ ВПО «Астраханский государственный технический университет» (АГТУ) по адресу: 414025, г. Астрахань, ул. Татищева, 16, АГТУ, 2-ой учебный корпус, ауд. 201
С диссертацией можно ознакомиться в библиотеке АГТУ (ул. Татищева, 16, АГТУ, главный учебный корпус).
Автореферат разослан «29» апреля 2013 г.
Ученый секретарь
диссертационного совета,
доктор химических наук, доцент Шинкарь Е. В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Традиционный интерес к полиядерным азинам обусловлен как их теоретической значимостью (ароматичность, механизмы нуклеофильного и электрофильного замещения, стабильность ион-радикалов и др.), так и прикладными аспектами. Многие соединения данного ряда используются в качестве красителей и люминофоров, входят в состав известных алкалоидов и антибиотиков.
На фоне известных достижений химии азинов, азолов и их конденсированных аналогов «белым пятном» остаются пери-аннелированные полиядерные азины типа аза- и полиазапиренов. Методы синтеза известны лишь для некоторых представителей этого обширного семейства, а химические свойства остаются практически неизвестными. Между тем, особый способ сочленения карбо- и гетероколец может иметь следствием и необычные свойства таких соединений. К их числу относится объект нашего исследования – 1,3,7-триазапирен (1a).
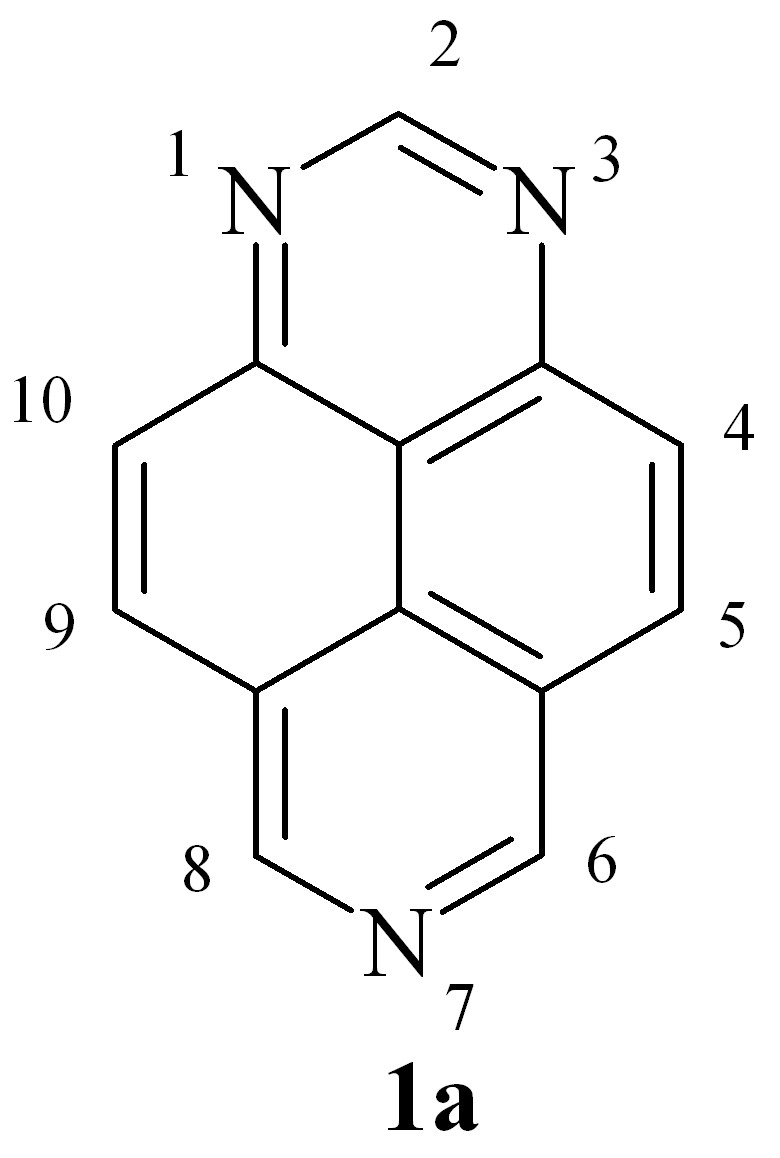
Практический интерес в отношении известных азапиренов обусловлен, в частности, изменением биологической активности по мере включения в пиреновое кольцо атомов азота, то есть при переходе от пирена к его аза- и полиазааналогам. Так, если моноазапирены проявляют мутагенную и канцерогенную активность, то производные наиболее изученных 4,9- и 2,7-диазапиренов проявляют анальгетическую, противовирусную и антибактериальную, а также противораковую активность. Механизм подобного действия обычно связывают с их известной способностью выступать в качестве интеркаляторов. Дополнительный интерес к полиазапиренам обусловлен развитием супрамолекулярной химии. Они активно используются для создания молекулярных устройств, запатентованы в качестве органических электролюминофоров (в т. ч. производные 1a), применяются для извлечения токсичных полиядерных аренов из органических сред.
Поскольку 1,3,7-триазапирен относится к -дефицитным гетероароматическим соединениям, нас интересовали, прежде всего, его реакции с нуклеофильными реагентами. В соответствии с современными представлениями нуклеофильное замещение в ряду электронодефицитных аренов и гетаренов реализуется как двухстадийный процесс присоединения – отщепления.
На первой стадии возможно образование двух промежуточных продуктов: X- аддуктов (комплексы Мейзенгеймера 2) или Н-аддуктов (комплексы Сервиса 3). При этом присоединение нуклеофила к незамещенному атому углерода является, как правило, более быстрым процессом, чем ипсо-присоединение. Даже при наличии в кольце хорошей уходящей группы ипсо-замещению предшествует быстрое и обратимое образование Н-аддуктов в качестве кинетически контролируемых продуктов.

Стабильность Н-аддуктов может быть разной, но в целом они более устойчивы, чем их X-аналоги. При наличии хорошего нуклеофуга ароматизация X-комплекса происходит путем необратимого элиминирования легко сольватирующихся анионов Х-.
Прямая же ароматизация Н-комплексов затруднена, поскольку предполагает отщепление гидрид-иона. Однако гидрид-ион не склонен к сольватации, его не удалось зарегистрировать как кинетически независимую частицу в растворах. Существует, однако, множество других путей трансформации Н-аддуктов в ароматические соединения, например, посредством элиминирования так называемых вспомогательных групп (нуклеофугов). В зависимости от их расположения различают кине-замещение, теле-замещение или викариозное нуклеофильное замещение. Общим существенным недостатком этих методов является необходимость предварительного введения в молекулу субстрата или реагента нуклеофугных групп.
Этого недостатка лишен метод прямого окислительного замещения атома водорода под действием нуклеофила (ONSH)
[1]. Поскольку отщепление гидрид-иона формально равносильно окислению субстрата, использование внешнего окислителя – наиболее очевидный способ ароматизации Н-интермедиата. Однако механизм дегидроароматизации весьма непрост и определяется как структурой Н-комплекса, так и применяемым окислителем, а также условиями проведения процесса. Наиболее вероятным представляется одноэлектронный, постадийный механизм, предполагающий последовательное отщепление от Н-аддукта (3) электрона, протона и снова электрона (EPE-механизм). Таким образом, водород отщепляется не в виде гидрид-иона, а в виде протона.
Цель настоящей работы - изучение ONSH-реакций аминирования, алкиламинирования, алкоксилирования и арилирования 1,3,7-триазапирена, а также реакций нуклеофильного ипсо-замещения в ряду алкокси- и аминопроизводных данного гетероцикла.
Научная новизна и практическая значимость. Установлено, что 1,3,7-триазапирены способны легко вступать в реакцию окислительного аминирования и алкиламинирования в водной среде. Реакция протекает при комнатной температуре в присутствии одноэлектронного окислителя (K3Fe(CN6) и позволяет получать в зависимости от условий неизвестные ранее 6-амино-, 6-алкил(диалкил)амино-1,3,7-триазапирены или продукты тандемного окислительного SNH-SNH-процесса - 6,8-бис(диалкиламино)-1,3,7-триазапирены.
Показано, что 1,3,7-триазапирены в условиях кислотного катализа легко вступают в процесс окислительного алкоксилирования, который протекает как тандем SNH-SNH-реакций с образованием 6,8-диалкокси-1,3,7-триазапиренов.
Найдено, что 1,3,7-триазапирены легко присоединяют -донорные арены и гетарены в водном растворе кислоты; образующиеся -аддукты в ходе выделения окисляются кислородом воздуха, давая продукты окислительного нуклеофильного арилирования - 6-арил(гетарил)производные 1,3,7-триазапирена. Обнаружен пример двойного SNH-арилирования.
Изучение реакций нуклеофильного ипсо-замещения алкокси- и аминогрупп в серии синтезированных соединений позволило впервые в гетероароматическом ряду обнаружить реакцию переалкоксилирования 6,8-диалкокси-1,3,7-триазапиренов, синтезировать неизвестные ранее аминоэфиры и 6,8-бис(ариламино)-1,3,7-триазапирены, получить продукты кислотного гидролиза моноаминов, а также полного или частичного гидролиза диаминов, найти условия для селективного расщепления простой эфирной связи в присутствии аминогруппы и для гидролитического отщепления обеих функциональных групп.
Исследованные реакции и разработанные методы синтеза отличаются простотой исполнения и могут найти применение в других классах -дефицитных гетероциклов для создания веществ с практически полезными характеристиками.
Апробация работы. Отдельные результаты работы докладывались на X Международном Семинаре по магнитному резонансу (Ростов-на-Дону, 2010), Международной конференции по химии гетероциклических соединений (Москва, 2010), Всероссийской научной конференции (Москва, РУДН, 2012).
Публикации[2] . Основное содержание работы опубликовано в 5 статьях в журналах, рекомендованных ВАК РФ для опубликования основных результатов кандидатских и докторских диссертаций, и 3 тезисах докладов международных и всероссийских конференций.
Структура и объем диссертации. Диссертация общим объёмом 125 страниц состоит из введения и трех глав. Она иллюстрирована 13 таблицами и 9 рисунками. Первая глава представляет собой литературный обзор по реакциям окислительного аминирования и алкиламинирования ди- и триазинов. Вторая посвящена обсуждению полученных нами результатов, а в третьей приведены детали экспериментальных исследований. Диссертацию завершают выводы и список цитируемой литературы (194 наименования).
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Окислительное нуклеофильное замещение водорода
1.1. Окислительное аминирование и алкиламинирование 1,3,7-триазапиренов
Современный вариант реакции окислительного аминирования предполагает использование жидкого аммиака в сочетании с амидами щелочных металлов или без них, но в присутствии окислителя (обычно KMnO4).
Мы же обнаружили, что 1,3,7-триазапирен (1a) и 2-метил-1,3,7-триазапирен (1b) легко аминируются действием избытка K3Fe(CN)6 в водно-диоксановом растворе аммиака (схема 1). Реакция протекает при 50-55 оС с образованием 6-амино-1,3,7-триазапирена (2a) и 6-амино-2-метил-1,3,7-триазапирена (2b) с выходом 95 и 89%, соответственно.
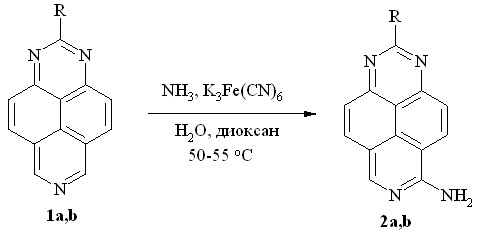
R = H (a), Me (b)
Схема 1
ONSH–алкиламинирование также никогда не проводилось в водной среде, а K3Fe(CN)6 лишь однажды использовался (1977г.) в качестве окислителя для подобной реакции. Однако мы нашли, что триазапирены 1a,b реагируют с избытком первичных аминов, в присутствии этого окислителя в водном растворе при комнатной температуре, образуя неизвестные ранее 6-алкиламино-1,3,7-триазапирены (2c-f) (схема 2, табл. 1). Аналогично реагируют вторичные алифатические амины (диметиламин, диэтиламин, пирролидин), образуя 6-диалкиламино-1,3,7-триазапирены (2g-j) (схема 2, табл. 1).
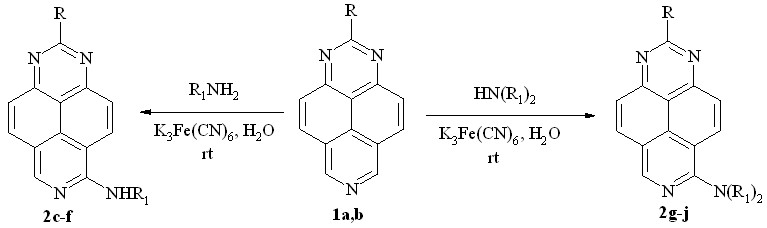
Схема 2
Таблица 1. Окислительное алкиламинирование 1,3,7-триазапиренов
(1a,b) в системе алкил(диалкил)амин/H2O/K3Fe(CN)6
| № | R | Амин | Время реакции, ч | Продукт | Выход, % |
| 1. | H | MeNH2 | 0.67 | 2c | 69 |
| 2. | Me | MeNH2 | 1.25 | 2d | 86 |
| 3. | H | AllNH2 | 7 | 2e | 67 |
| 4. | H | MeO(CH2)3NH2 | 8 | 2f | 63 |
| 5. | H | Me2NH | 0.5 | 2g | 95 |
| 6. | H | Et2NH | 6 | 2h | 71 |
| 7. | H | пирролидин | 1 | 2i | 97 |
| 8. | Me | Et2NH | 5.5 | 2j | 82 |
| 9. | H | пиперидин | 1 | 3a | 91 |
| 10. | Me | пиперидин | 5 | 3b | 85 |
Исключением в ряду первичных и вторичных аминов оказался пиперидин, который в тех же условиях образует с количественным выходом исключительно продукты двойного нуклеофильного замещения – 6,8-бис-(пиперидин-1-ил)-1,3,7-триазапирены 3a и 3b, соответственно (схема 3, табл. 1). Интересно, что структурный аналог пиперидина – морфолин – даёт лишь следы предполагаемого продукта моно-алкиламинирования.
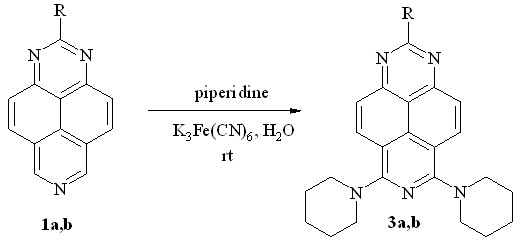
Схема 3
Мы нашли далее, что добавление в реакционную смесь KOH в случае вторичных аминов позволяет получать и другие продукты бис-диалкиламинирования 3c-e (схема 4, табл. 2).
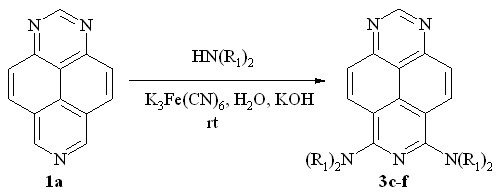
3: N(R1)2 = NMe2 (c), NEt2 (d), pyrrolidin-1-yl (e), morpholin-1-yl (f)
Схема 4
Таблица 2. Синтез 6,8-бис(диалкиламино)-1,3,7-триазапиренов (3c-h)
| № | Исх. соед. | Система реагентов для алкиламинирования | Время реакции, ч | Продукт | Выход, % |
| 1. | 1a | Me2NH/H2O/KOH/K3Fe(CN)6 | 2.5 | 3c | 62 |
| 2. | 1a | Et2NH/H2O/KOH/K3Fe(CN)6 | 24 | 3d | 68 |
| 3. | 1a | пирролидин/H2O/KOH/K3Fe(CN)6 | 2 | 3e | 85 |
| 4. | 1a | морфолин/H2O/KOH/K3Fe(CN)6 | 1.25 | 3f | 80 |
| 5. | 2g | NMe2/H2O/KOH/K3Fe(CN)6 | 5.5 | 3c | 89 |
| 6. | 2i | пирролидин/H2O/KOH/K3Fe(CN)6 | 2 | 3e | 89 |
| 7. | 2g | пиперидин/H2O/K3Fe(CN)6 | 2 | 3g | 66 |
| 8. | 2g | пиперидин/H2O/KOH/K3Fe(CN)6 | 2 | 3h | 68 |
| 9. | 2i | пиперидин/H2O/K3Fe(CN)6 | 1 | 3h | 94 |
Морфолин также вступает в эту реакцию, образуя диамин 3f. В присутствии щелочи третичные моноамины способны вступать в реакцию повторного диалкиламинирования. Так, симметричные диамины 3c и 3e и их несимметрично замещенные аналоги 3g и 3h были получены обработкой моноаминов 2g и 2i соответствующими вторичными аминами (схема 5, табл. 2). В реакциях моноаминов с пиперидином добавление KOH не является необходимым, поскольку реакция с ним даёт близкие результаты как в присутствии гидроксида калия, так и без него (табл. 2, оп. 7 и 8).
Реакция 1,3,7-триазапиренов 1a,b с первичными аминами в присутствии щелочи приводит к продуктам окислительной деструкции.
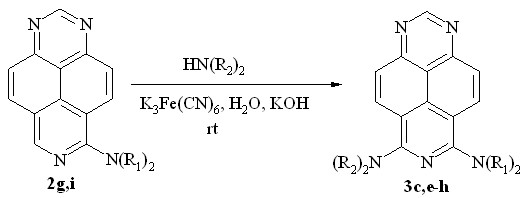
3: N(R1)2 = N(R2)2 = NMe2 (c); N(R1)2 = N(R2)2 = pyrrolidin-1-yl (e);
N(R1)2 = NMe2, N(R2)2 = piperidin-1-yl (g);
N(R1)2 = pyrrolidin-1-yl, N(R2)2 = piperidin-1-yl (h)
Схема 5
Таким образом, варьируя условия реакции в случае вторичных алифатических аминов, можно селективно получать либо моноамины, либо диамины 1,3,7-триазапиренового ряда.
На наш взгляд, тандемное SNH-SNH-алкиламинирование 1,3,7-триазапиренов 1a,b вторичными аминами протекает в соответствии с общепринятым механизмом, но окислительной дегидроароматизации подвергается не H-аддукт 4 и не дигидропроизводное 5, а его анион 6 (схема 6). Сравнительно лёгкое образование аниона обусловлено эффективной делокализацией отрицательного заряда в нём по трём кольцевым атомам азота, причем на стадии монозамещения акцептором протона является аммиак или амин.
Вторая стадия - алкиламинирование моноаминов 2 – хотя и протекает аналогично, имеет ряд особенностей. Во-первых, образование соответствующего H-аддукта, на наш взгляд, протекает труднее из-за положительного мезомерного эффекта первой аминогруппы. Во-вторых, вследствие меньшей NH-кислотности интермедиата 7 для образования аниона 8 требуется более сильное основание.
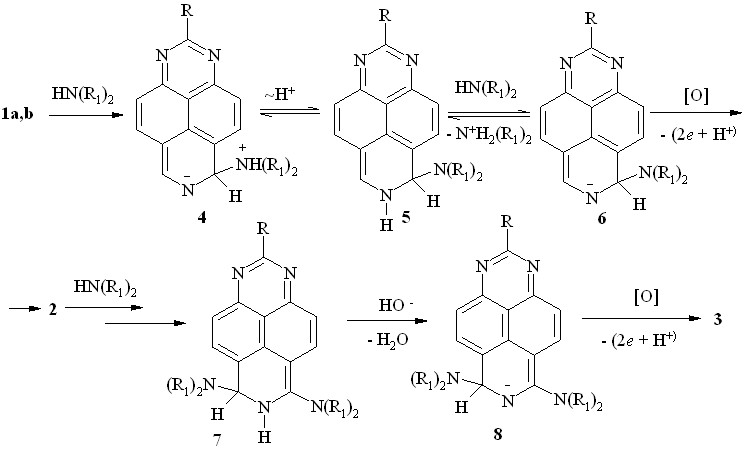
Схема 6
В 2007 году появилось сообщение (J. Org. Chem. -2007. -P. 3679), авторы которого рассчитали для первичных и вторичных аминов параметр нуклеофильности N, характеризующий относительную нуклеофильную силу аминов в воде. Как выяснилось, имеется весьма слабая корреляция между нуклеофильностью (N) и величинами pKaH, т. е. основностью аминов. В частности, вторичные алкиламины, а также анилины, значительно более нуклеофильны, чем предполагалось ранее на базе их значений pKaH, тогда как наименее нуклеофильным является аммиак.
С учётом этих данных следует, что из аминов, использованных в настоящей работе, в водной среде пиперидин обладает наибольшей нуклеофильностью и весьма высокой основностью. Первое качество необходимо для образования H-аддуктов, а второе необходимо для генерирования анионов типа 6 и 8, которые подвергаются далее окислительной реароматизации. Этот факт объясняет упомянутое выше особое поведение пиперидина и необходимость добавления KOH в других случаях для получения диаминов. Низкой основностью морфолина можно объяснить его малую реакционную способность в отсутствие щелочи.
Синтезированные моноамины 2a-j и диамины 3a-h 1,3,7-триазапиренового ряда представляют собой окрашенные кристаллические вещества с желто-зеленой флюоресценцией в УФ свете. Их строение подтверждено комплексом спектроскопических и спектрометрических методов, а также элементным анализом.
В ИК спектрах первичных аминов 2a и 2b имеются характеристические полосы поглощения валентных и деформационных колебаний NH2-группы.
Спектры ЯМР 1Н моноаминов 2 несимметричны; наиболее слабопольными являются сигналы протонов С8-Н ( 8.8 - 9.2 м. д.) и С2-Н ( 9.4 - 9.6 м. д.). Спектры диаминов 3, напротив, симметричны, а сигналы протонов С2-Н находятся в области 9.1 - 9.4 м. д. Константы спин-спинового взаимодействия протонов в положениях 4,5 и 9,10 триазапиренового кольца имеют относительно высокие значения – 9.0-9.5 Гц, что весьма характерно для данного гетероцикла.
В масс-спектрах моноаминов 2 интенсивность пика молекулярного иона изменяется от 28% (соединения 2h,2j) до 87% (соединение 2с), для диаминов 3 его интенсивность – 100%. В целом же для фрагментации аминов 2 и 3 характерен -разрыв С-С связи у атома углерода, связанного с гетероатомом, что типично для насыщенных циклических и ациклических аминов.
Таким образом, нами впервые выполнено окислительное аминирование и алкиламинирование гетероцикла в водной среде, а также обнаружен редкий пример тандемного SNH-SNH-алкиламинирования на нейтральном субстрате.
1.2. Окислительное алкоксилирование 1,3,7-триазапиренов
В литературе имеются лишь единичные примеры успешного алкоксилирования гетероциклов, соответствующие ONSH-процессу.Тем необычнее оказался разработанный ранее в нашей лаборатории способ SNH-алкоксилирования 1,3,7-триазапиренов действием избытка KOH и K3Fe(CN)6 в водно-спиртовых растворах.
В настоящей работе мы показали, что присутствие диалкиламиногрупп в триазапиреновом кольце не препятствует протеканию этой реакции. Так, 6-диметиламино- (2g) и 6-диэтиламино-1,3,7-триазапирен (2h) легко алкоксилируются при комнатной температуре тех же условиях, образуя с высоким выходом неизвестные ранее 6-алкокси-8-диалкиламино-1,3,7-триазапирены (9a-c) (схема 7).
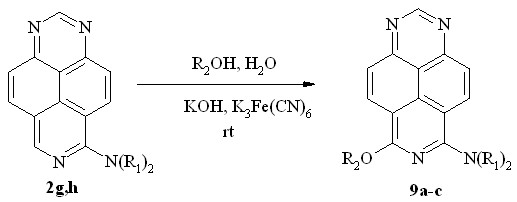
9: R1 = R2 = Me (a, 98%); R1= Me, R2 = Et (b, 90%);
R1= Et, R2 = Me (c, 91%)
Схема 7
Однако первичный и вторичные аналоги аминов 2g,h в этих условиях подвергаются окислительной деструкции.
Известно, что процессу нуклеофильного замещения водорода в азинах способствует не только щелочная среда за счет образования более нуклеофильного, чем нейтральная частица, аниона, но и кислотный катализ за счет увеличения электрофильности субстрата при его протонирования.
Продолжая исследование реакции алкоксилирования 1,3,7-триазапиренов, мы предположили возможность её проведения в условиях кислотного катализа. Действительно, в кислой среде и в отсутствие воды 1,3,7-триазапирены (1a,b) легко алкоксилируются первичными спиртами (схема 8). Реакция протекает при комнатной температуре в абсолютном спирте, насыщенном сухим HCl, в присутствии избытка K3Fe(CN)6 с образованием уже известных продуктов двойного SNH-SNH-алкоксилирования – 6,8-диалкокси-1,3,7-триазапиренов (10a-d).
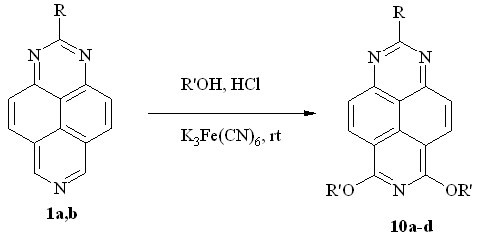
10: R = H, R’ = Me (a, 90%); R = H, R’ = Et (b, 74%); R = H, R’ = Pr (c, 73%);
R = R’ = Me (d, 88%);
Схема 8
Как и в случае щелочного катализа, остановить кислотно-катализируемую реакцию на стадии моноалкоксилирования не удалось, поскольку даже при недостатке окислителя образуются диэфиры 9 и остается исходный триазапирен (данные ЯМР 1H спектроскопии). Это означает, что и в этом случае вторая стадия алкоксилирования протекает легче, чем первая.
Начальный этап этого превращения (схема 9) включает, на наш взгляд, двойное протонирование оснований 1a,b, нуклеофильное присоединение молекулы спирта к дикатиону 11 и последующую окислительную ароматизацию катиона -аддукта 12. Вторая стадия протекает аналогично через дикатион моно-алкоксипроизводного 13, -комплекс 14 и его окислительную ароматизацию.
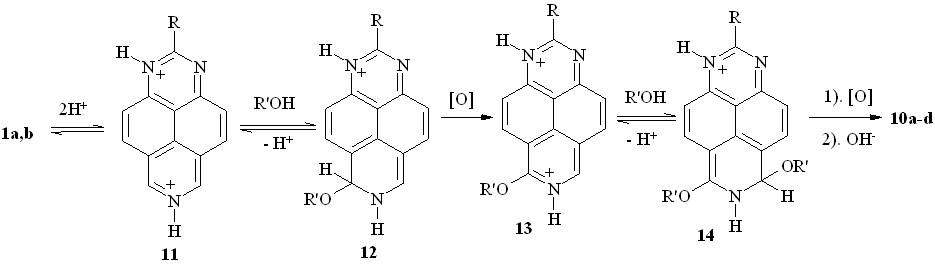
Схема 9
Конечно, в препаративном отношении (простота выполнения эксперимента) данный метод алкоксилирования 1,3,7-триазапиренов уступает предложенному нами ранее процессу их алкоксилирования в щелочной среде. Однако, насколько нам известно, это первый пример SNH-алкоксилирования гетероароматических соединений в условиях кислотного катализа, который в случае данного гетероцикла протекает как тандемный SNH-SNH-процесс. Этот метод может быть полезен для синтеза простых эфиров полиазинов, особенно содержащих лабильные в щелочной среде функциональные группы.
Наше предположение о механизме данного процесса базируется на образовании дикатионов 11 и 13, что, естественно, сильно увеличивает электрофильность субстратов и делает возможным нуклеофильное присоединение молекул спирта. Будучи триазином, 1,3,7-триазапирен отличается от своих моноциклических аналогов гораздо более обширной периферической -системой, что делает возможным их двойное протонирование. Но является ли образование дикатионов 11 и 13 необходимым условием протекания процесса?
Косвенное свидетельство в пользу этого мы обнаружили, показав в специальном эксперименте, что заведомый моно-катион – катион 7-метил-1,3,7-тризапирения (в виде метилсульфатной соли 15), не вступает в реакцию с абсолютным метанолом и K3Fe(CN)6. Напротив, в том же метаноле, насыщенном сухим HCl, и в присутствии K3Fe(CN)6 соль 15 вступает в реакцию. Правда, несколько неожиданно единственным её продуктом оказался 7-метил-6,8-диоксо-1,6,7,8-тетрагидро-1,3,7-триазапирен (17, схема 10), полученный нами ранее иным путём.
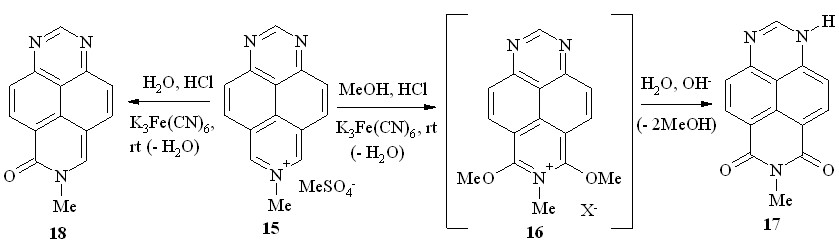
Схема 10
Мы полагаем, что образование имида 17 протекает через стадию двойного метоксилирования соли 15 и последующего поэтапного деметилирования катиона 16 в ходе выделения (например, при выливании в воду). Известно, что в кислой среде простые эфиры азинов неустойчивы и легко расщепляются. Это относится и к 6,8-диалкокси-1,3,7-триазапиренам (9), которые в кислой среде подвергаются двойному дезалкилированию. Поэтому, возможно, что этот процесс отчасти протекает уже при образовании катиона 16 за счет воды, выделяющейся при окислительной ароматизации -аддуктов.
Представленная на схеме 10 последовательность превращений соли 15 в имид 17 подтверждается также тем обстоятельством, что прямое окислительное гидроксилирование солей 7-алкил-1,3,7-триазапирения в кислой среде завершается стадией моно-замещения. Например, ранее мы нашли, что из соли 15 в присутствии K3Fe(CN)6 в среде водной кислоты образуется 6-оксо-7-метил-6,7-дигидро-1,3,7-триазапирен (18; схема 10).
Таким образом, с большой долей вероятности можно утверждать, что алкоксилирование 1,3,7-триазапиренов в кислой среде протекает через стадию двойного протонирования в соответствии со схемой 9.
С учетом обнаруженной неустойчивости соли 7-метил-6,8-диметокси-1,3,7-триазапирения (16) по отношению к нуклеофильным реагентам мы решили проверить возможность синтеза и устойчивость солей 1-метил-6,8-диалкокси-1,3,7-триазапирения. Наиболее очевидный путь их получения – кватернизация 6,8-диалкокси-1,3,7-триазапиренов (10). Ранее в нашей лаборатории было показано, что кватернизация 6,8-дизамещенных 1,3,7-триазапиренов протекает по N1-атому.
При кипячении 6,8-диметокси-1,3,7-триазапирена (10a) с избытком диметилсульфата в толуоле образовался осадок, который, судя по спектру ЯМР 1H, содержал смесь трёх веществ.
Неожиданный результат был получен также при кватернизации 6,8-диэтокси- (10b) и 6,8-дипропокси-1,3,7-триазапирена (10c) диметилсульфатом: выпавший осадок оказался в обоих случаях гидросульфатом 1,3-диметил-6,8-диоксо-1,6,7,8-тетрагидро-1,3,7-триазапирения (19a, схема 11). Действием хлорной кислоты мы превратили далее эту соль в нерастворимый в воде перхлорат (19b).
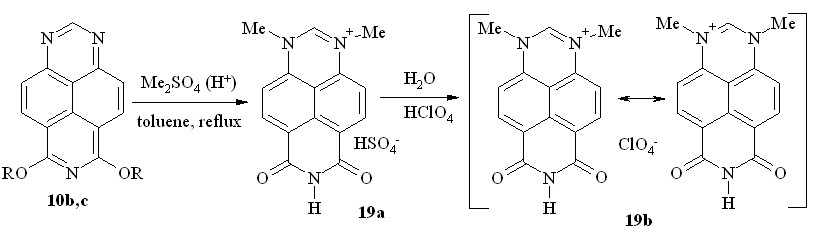
R = Et (b); Pr (c)
Схема 11
Спектры ЯМР 1H солей 19a и 19b практически совпадают; они симметричны вследствие вырожденного перераспределения положительного заряда между N1- и N3-атомами.
Для выяснения маршрута столь необычного превращения мы обратились, прежде всего, к характеристике метилирующего реагента. Как выяснилось, использованный нами диметилсульфат производства фирмы «Merck» содержит до 1% кислотных примесей (серная кислота и её моноэфир). Удалив эти примеси действием бикарбоната натрия и проведя реакцию диалкоксипроизводных 10a-c с очищенным диметилсульфатом путем кратковременного кипячения в толуоле, мы получили искомые соли – метилсульфаты 1-метил-6,8-диалкокси-1,3,7-триазапирения (20a-c, схема 12).
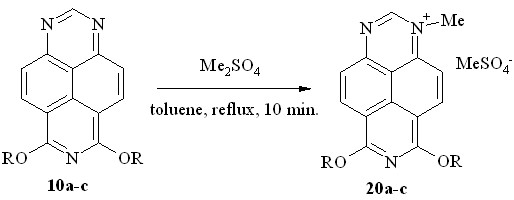
R = Me (a, 92%); Et (b, 84%); Pr (c, 85%)
Схема 12
Соли 20a-c представляют собой кристаллические вещества оранжевого цвета, разлагающиеся при плавлении. При кратковременном нагревании солей 20a-c в концентрированной соляной кислоте происходит их двойное O-дезалкилирование с образованием неизвестного ранее 1-метил-6,8-диоксо-1,6,7,8-тетрагидро-1,3,7-триазапирена (21, схема 13).
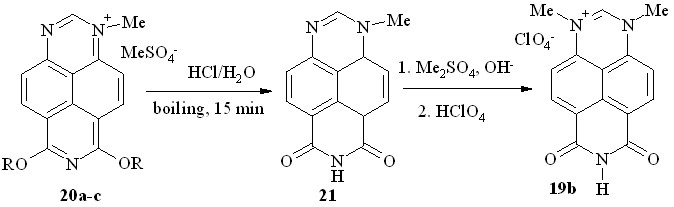
Схема 13
Соединение 21 можно рассматривать как 6,7-дизамещенный 1-метилперимидин, что подтверждает его спектр ЯМР 1H как с точки зрения химсдвигов протонов, так и констант спин-спинового взаимодействия. Метилирование имида 21 диметилсульфатом в щелочной среде протекает региоселективно по N3-атому; последующий обмен аниона позволил нам получить соль 19b встречным путем (схема 13).
Возвращаясь к анализу спектра ЯМР 1H продукта кватернизации 6,8-диметокси-1,3,7-триазапирена (9a) коммерческим диметилсульфатом в толуоле (изначальный эксперимент), мы обнаружили в нём сигналы протонов катионов 20a и 19a, а также соединения 21.
Таким образом, необычное превращение диалкоксипроизводных 10 в соль 19a (схема 11) включает, по-видимому, их кватернизацию по N1-атому, поэтапное расщепление простых эфирных связей по SN- или E-механизму в условиях кислотного катализа и последующее метилирование по N3-атому.
1.3. Окислительное нуклеофильное арилирование 1,3,7-триазапиренов
Целью данного этапа работы стало изучение поведения 1,3,7-триазапиренов по отношению к -донорным ароматическим субстратам. Подобные процессы называют электрофильным гетарилированием аренов или нуклеофильным арилированием гетаренов; они хорошо известны для многих азинов. Обычно азагетероциклы активируют N-протонированием, N-алкилированием или N-ацилированием, а сами реакции проводят в апротонных растворителях или без растворителей, но в отсутствие воды.
Мы же обнаружили, что реакцию гетарилирования 1,3,7-триазапиренами можно проводить в водном растворе кислоты. Так, 1,3,7-триазапирен (1a), 2-метил-1,3,7-триазапирен (1b) и 6-амино-1,3,7-триазапирен (2a) уже при комнатной температуре легко реагируют в концентрированной соляной кислоте с такими -донорными субстратами, как фенол, анизол, фенетол, анилин и пиррол, образуя ярко-красные H-аддукты 22a-h (с учетом ацидофобности пиррола реакцию с ним проводили в 0.1М растворе HCl). Вследствие их неустойчивости выделить эти соединения нам не удалось: при подщелачивании реакционной смеси они легко окисляются кислородом воздуха с образованием соответствующих 6-арил-1,3,7-триазапиренов 23a-h (схема 14; табл. 3).
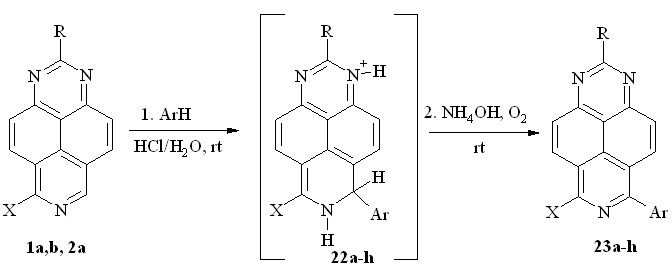
1: R = X = H (a); R = Me, X = H (b); 2a: R = H, X = NH2
Схема 14
Таблица 3. Арилирование 1,3,7-триазапиренов 1a,b и 2a в соляной кислоте
при комнатной температуре
| № оп. | Исходное соединение | Время реакции, ч | Продукт реакции | Выход, % | |||
| № соед. | R | X | Ar | ||||
| 1. | 1a | 2 | 23a | H | H | C6H4OH-п | 84 |
| 2. | 1a | 1 | 23b | H | H | C6H4OMe-п | 96 |
| 3. | 1b | 2 | 23c | Me | H | C6H4OMe-п | 68 |
| 4. | 1a | 4 | 23d | H | H | C6H4OEt-п | 79 |
| 5. | 1b | 9 | 23e | Me | H | C6H4OEt-п | 62 |
| 6. | 1a | 4 | 23f | H | H | C6H4NH2-п | 93 |
| 7. | 2a | 1 | 23g | H | NH2 | C6H4OH-п | 72 |
| 8. | 1a | 0.2 | 23h | H | H | пиррол-2-ил | 88 |
По-видимому, как и в случае алкоксилирования, 1,3,7-триазапирен в сильнокислой среде подвергается двойному протонированию с образованием дикатиона 11 (схема 9). Естественно, его повышенная электрофильность и объясняет, на наш взгляд, легкость протекания данной реакции. Конкурирующий процесс – ковалентная гидратация, – также протекающий в аналогичных условиях, становится необратимым и результативным лишь в присутствии одноэлектронного окислителя - K3Fe(CN)6.
Мы нашли далее, что соль – метилсульфат 7-метил-1,3,7-триазапирения (15) – также вступает в реакцию с фенолом в концентрированной HCl. Однако образующийся при этом H-аддукт 24 после подщелачивания окисляется кислородом воздуха весьма медленно. Его дегидроароматизацию на заключительном этапе мы проводили действием системы NH4OH/K3Fe(CN)6. Несколько неожиданно продуктом реакции в этом случае оказался 6-оксо-7-метил-8-(п-гидроксифенил)-6,7-дигидро-1,3,7-триазапирен (27; схема 15). Это означает, что, помимо ароматизации -интермедиата с образованием катиона 25, в этих условиях происходит окислительное гидроксилирование последнего через промежуточное псевдооснование 26.
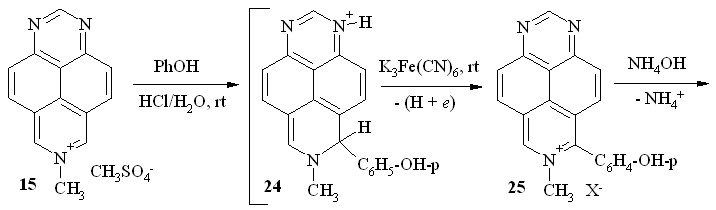
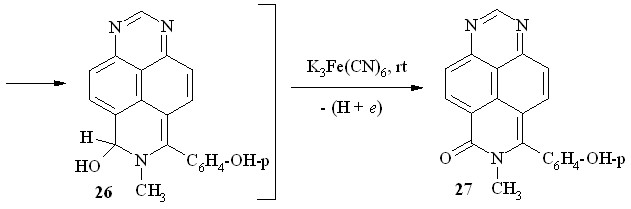
Схема 15
Отметим, что в нейтральной среде соль 15 не реагирует с фенолом, что косвенно подтверждает необходимость двойного протонирования при взаимодействии триазапиренов 1a,b и 2a с ароматическими соединениями.
В отличие от других -донорных аренов взаимодействие 1,3,7-триазапирена (1a) с N,N-диметиланилином в концентрированной HCl при комнатной температуре практически не протекает, а длительное перемешивание при 70-75 oC привело сразу к продукту двойного нуклеофильного арилирования гетероцикла – 6,8-бис(п-диметиламинофенил)-1,3,7-триазапирену (28a; схема 16).
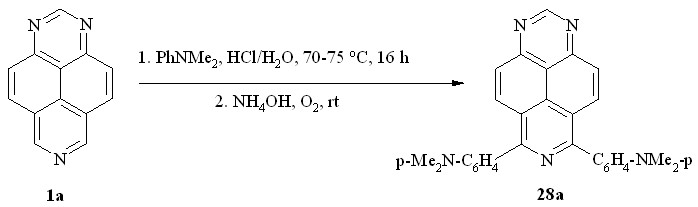
Схема 16
Мы предположили, что процесс образования соединения 28a протекает как две последовательные стадии нуклеофильного присоединения - дегидроароматизации, причем ароматизация первичного H-аддукта типа 22 проходит при участии кислорода воздуха в реакционной массе, т. е. в сильнокислой среде. Действительно, исключив кислород, т. е. проведя реакцию 1,3,7-триазапирена (1a) с N,N-диметиланилином в тех же условиях, но в анаэробной среде (схема 17), мы получили 6-(п-диметиламинофенил)-1,3,7-триазапирен (23i) в качестве единственного продукта реакции.
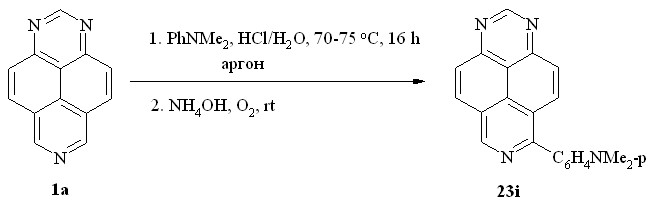
Схема 17
Однако попытки получить in one pot продукты двойного арилирования при взаимодействии 1,3,7-триазапирена (1a) с фенолом или анилином при повышении температуры до 70-75 oC и увеличении продолжительности реакции успехом не увенчалась: образуются только продукты моно-замещения 23a и 23f. Остается неясным, почему кислород проявляет свойства окислителя в реакции с N,N-диметиланилином, но не работает в других случаях.
Продукты двойного арилирования 1,3,7-триазапирена (схема 18) удалось получить при повторном взаимодействии моно-арилпроизводных 23a и 23f с фенолом и N,N-диметиланилином, соответственно, при 70-75 oC. При этом образуются симметричный 6,8-бис(п-гидроксифенил)-1,3,7-триазапирен (28b) и несимметрично замещенный 6-(п-аминофенил)-8-(п-диметиламинофенил)-1,3,7-триазапирен (28c).
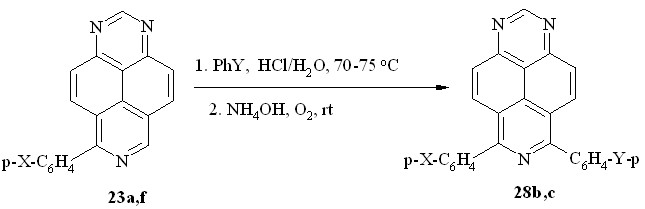
28: X = Y = OH (b); X = NH2, Y = NMe2 (c)
Схема 18
Таким образом, впервые выполнено катализируемое кислотой нуклеофильное арилирование 1,3,7-триазапиренов в водной среде. Обнаружен пример двойного SNH-арилирования.
2. Нуклеофильное ипсо-замещение в ряду
амино- и алкоксипроизводных 1,3,7-триазапиренов
Алкокси- и аминогруппы не относятся к числу классических нуклеофугов. Тем не менее, в литературе известны примеры их нуклеофильного замещения. Целью данного этапа работы стало изучение возможности ипсо-замещения этих групп при действии различных O- и N-нуклеофилов, что в случае успеха позволило бы расширить перечень производных данного гетероцикла.
2.1. Гидролиз аминов и расщепление простых эфиров
При попытке окислительного гидроксилирования 6-диалкиламинопроизводных 1,3,7-триазапирена (2g,h,j) мы наблюдали их окислительную деструкцию с образованием олигомерных продуктов. Однако в отсутствие окислителя не только третичные моноамины 2g,h,j, но и вторичный 2c, и первичный амин 2a легко гидролизуются в условиях кислотного катализа. Реакция протекает при кипячении аминов 2a,c,g,h,j в 60%-ной серной кислоте и приводит к уже известным 6-оксо-6,7-дигидро-1,3,7-триазапиренам (29a,b) (схема 19; табл.4, оп. 1-5).

2: R = H, R1 = R2 = Me (g); R = H, R1 = R2 = Et (h); R = Me, R1 = R2 = Et (j);
R = R1 = H, R2 = Me (c); R = R1 = R2 = H (a)
29: R = H (a), Me (b)
Схема 19
На наш взгляд, реакция протекает через стадию двойного протонирования аминов 2 по кольцевому атому азота и по аминогруппе с образованием дикатиона, который и подвергается нуклеофильной ипсо-атаке молекулой воды.
Как выяснилось, 6,8-бис-(диметиламино)-1,3,7-триазапирен (3c) в этих условиях подвергается двойному гидролизу, образуя 6,8-диоксо-1,6,7,8-тетрагидро-1,3,7-триазапирен (31), ранее полученный нами иным путем (схема 20; табл. 4, оп. 6).
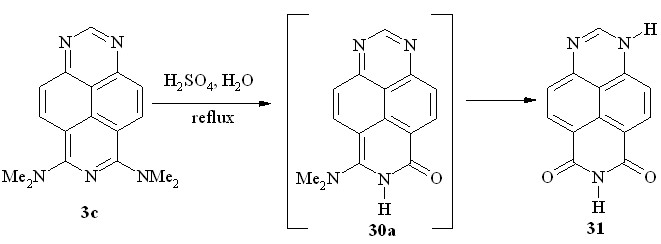
Схема 20
Несомненно, реакция протекает поэтапно с промежуточным образованием 6-оксо-8-диметиламино-6,7-дигидро-1,3,7-триазапирена (30a), который в ходе данной реакции мы не выделяли.
Однако 6,8-бис(пиперидин-1-ил)- и 6,8-бис(пирролидин-1-ил)-1,3,7-триазапирены (3a и 3e) в тех же условиях подвергаются лишь частичному гидролизу (схема 21, табл. 4, оп. 7,8) с сохранением одной из диалкиламиногрупп, образуя соответствующие 8-диалкиламино-6-оксо-6,7-дигидро-1,3,7-триазапирены (30b,c). Возможной причиной этого являются стерические помехи со стороны циклических диалкиламиногрупп соединений 30b,c.
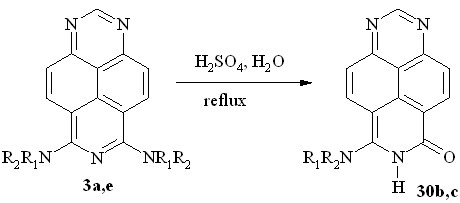
NR1R2 = piperidin-1-yl (3a,30b); NR1R2 = pyrrolidin-1-yl (3e,30c)
Схема 21
Таблица 4. Гидролиз моноаминов 2a,c,g,h,j и диаминов 3a,c,e в кислой среде
| № опыта | Исходное соединение | R | NR1R2 | Время реакции, ч | Продукт реакции | Выход, % |
| 1. | 2g | H | NMe2 | 0.5 | 29a | 84 |
| 2. | 2h | H | NEt2 | 1 | 29a | 92 |
| 3. | 2j | Me | NEt2 | 1.5 | 29b | 83 |
| 4. | 2c | H | NHMe | 2 | 29a | 60 |
| 5. | 2a | H | NH2 | 0.5 | 29a | 99 |
| 6. | 3c | H | NMe2 | 2.5 | 31 | 85 |
| 7. | 3a | H | piperidin-1-yl | 2.5 | 30b | 70 |
| 8. | 3e | H | pyrrolidin-1-yl | 2.5 | 30c | 71 |
Мы показали далее, что, в отличие от диалкоксипроизводных, в случае аминоэфиров 9a и 9b расщепление простой эфирной связи происходит в более мягких условиях: реакция легко протекает при комнатной температуре в концентрированной соляной кислоте с образованием неизвестного ранее 6-оксо-8-диметиламино-6,7-дигидро-1,3,7-триазапирена (30a; схема 22).
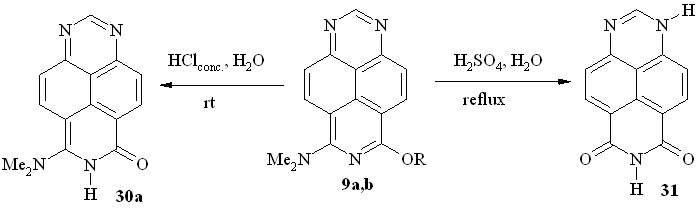
9: R = Me (a); R = Et (b)
Схема 22
Естественно, кипячение соединений 9a,b в 60%-ной H2SO4 приводит к гидролитическому отщеплению обеих функциональных групп с образованием 6,8-диоксо-1,6,7,8-тетрагидро-1,3,7-триазапирена (31, схема 22).
Таким образом, найдены условия, позволяющие селективно расщеплять простую эфирную связь в присутствии аминогруппы, а также проводить гидролитическое отщепление обеих функциональных групп.
2.2. Переалкоксилирование простых эфиров 1,3,7-триазапирена
Целью данного этапа работы стало изучение возможности нуклеофильного замещения одной алкоксигруппы на другую в случае 6,8-диалкокси-1,3,7-триазапиренов.
Два обстоятельства позволяли нам рассчитывать на успех в осуществлении этого превращения. Во-первых, 6,8-диалкокси-1,3,7-триазапирены (10) можно рассматривать как иминоэфиры, у которых связь C=N включена в гетероароматическое кольцо. Известно, что, как и сложные эфиры карбоновых кислот, эфиры иминокислот вступают в реакцию переэтерификации в условиях как кислотного, так и щелочного катализа. Во-вторых, еще в 1965 году было установлено, что расщепление простых эфиров азинов, легко протекающее под действием разбавленных минеральных кислот, проходит, главным образом, не по SN2-механизму, а в результате ипсо-замещения алкоксигруппы.
Как выяснилось, взаимные превращения 6,8-диметокси- (10a) и 6,8-диэтокси-1,3,7-триазапиренов (10b) действительно проходят при комнатной температуре в избытке соответствующего абсолютного спирта, насыщенного сухим хлороводородом (схема 23).
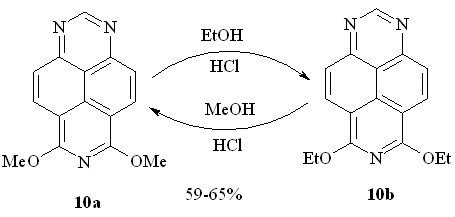
Схема 23
Однако в препаративном отношении результаты этих и ряда других экспериментов оказались трудновоспроизводимыми. Мы нашли далее, что этих недостатков лишен метод переалкоксилирования в условиях щелочного катализа, позволяющий использовать продажные растворители без предварительного их обезвоживания. Переалкоксилирование 6,8-диалкокси-1,3,7-триазапиренов (10) легко протекает при комнатной температуре в системе R’OH/MeCN/NaOH. Результаты представлены на схеме 24 и в таблице 5.

Схема 24
Таблица 5. Переалкоксилирование 6,8-диалкокси-1,3,7-триазапиренов (10a,b,d)
в системе R’OH/MeCN/NaOH
| № опыта | Исходное соединение | Время реакции, ч | Продукт реакции | Выход, % | ||
| R | Номер соедин. | R’ | Номер соедин. | |||
| 1. | Me | 10a | 2.5 | Et | 10b | 85 |
| 2. | Me | 10a | 1 | Pr | 10c | 81 |
| 3. | Me | 10a | 0.5 | Bu | 10g | 85 |
| 4. | Et | 10b | 4 | Me | 10a | 95 |
| 5. | Bu | 10g | 4 | Me | 10a | 95 |
Действием 1-бутанола на 6,8-диметокси-1,3,7-триазапирена (10a), мы, в частности, впервые синтезировали 6,8-дибутокси-1,3,7-триазапирен (10g), который нам ранее не удалось получить ранее прямым алкоксилированием 1,3,7-триазапирена.
Несомненно, реакция протекает постадийно в соответствии с SNipso-механизмом, представленным на схеме 25. Он включает в себя две последовательные стадии присоединения - отщепления алкоксид-анионов, присутствующих в системе в небольшой равновесной концентрации. Каждая стадия протекает через соответствующий комплекс Мейзенгеймера 32 и 34. В целом весь процесс переалкоксилирования является обратимым; равновесие смещается вправо за счет большого избытка реагента.
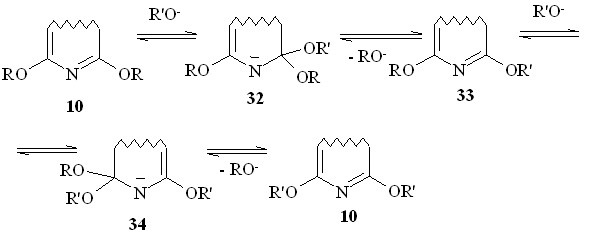
Схема 25
Прервав превращение диметоксипроизводного (10a) в дибутоксипроизводное (10g) в середине процесса, нам удалось зафиксировать с помощью хромато-масс-спектрометра образование промежуточного продукта – 6-метокси-8-бутокси-1,3,7-триазапирена (33, R = Me, R’ = Bu) – и записать его масс-спектр.
Конечно, данная реакция имеет свои границы применения. Так, при взаимодействии эфира 10a с бензиловым спиртом образуется сложная смесь веществ. Не удалось ввести в процесс переалкоксилирования вторичные и третичные спирты, что, возможно, связано со стерическими затруднениями при образовании переходного состояния реакции.
Как выяснилось далее, первичные спирты с лабильными радикалами в тех же условиях могут образовывать продукты дальнейших превращений. Так, при взаимодействии диэфира 10a с аллиловым спиртом или этиленгликолем были выделены, соответственно, 6-оксо-8-аллилокси-6,7-дигидро-1,3,7-триазапирен (35a) и 6-оксо-8-(-гидроксиэтил)-6,7-дигидро-1,3,7-триазапирен (35b) (схема 26).
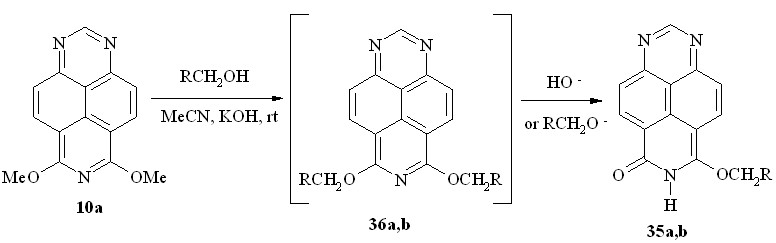
35: R = CH=CH2 (a); CH2OH (b)
Схема 26
По-видимому, в этих случаях реакция не останавливается на стадии переалкоксилирования, а сопровождается последующим моно-дезалкилированием промежуточно образующихся соединений 36a,b в результате SN- или E-процессов.
Нам неизвестны другие примеры взаимных превращений алкоксипроизводных в гетероароматическом ряду. Предложенный метод расширяет возможности синтеза простых алкилгетариловых эфиров и может найти применение в ряду других -дефицитных гетероциклов.
2.2.3. ипсо-Замещение метоксигруппы на N-нуклеофилы
Мы нашли, что при действии на 6,8-диметокси-1,3,7-триазапирен (10a) метиламином и KOH в водном ацетонитриле реакция протекает при комнатной температуре и завершается ипсо-замещением одной метоксигруппы (схема 27), образуя 6-метиламино-8-метокси-1,3,7-триазапирена (37).
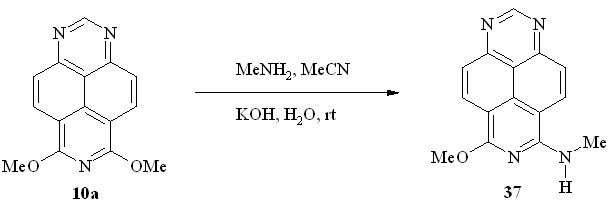
Схема 27
При взаимодействии эфира 10a с этаноламином, который является бинуклеофильным реагентом, можно было ожидать образование как продуктов переалкоксилирования, так и продуктов замещения метоксигруппы на аминогруппу. В отличие от метиламина реакция диэфира 10a с избытком этаноламина в ацетонитриле в присутствии KOH, также протекающая при комнатной температуре, завершается замещением обеих метоксигрупп, образуя с выходом 89% 6,8-бис(-гидроксиэтиламино)-1,3,7-триазапирен (38,схема 28) в качестве единственного её продукта.
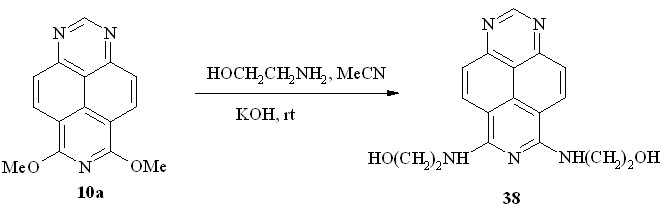
Схема 28
Спектр ЯМР 1Н аминоспирта 38 в DMSO-d6 позволяет сделать однозначный вывод о строении этого соединения. Он симметричен как в области ароматических, так и в области алифатических протонов, но главное то, что связанные межмолекулярными водородными связями с растворителем протоны NH и OH групп дают отдельные сигналы, расщеплённые в триплеты на протонах соответствующих метиленовых групп (J ~ 5 Гц).
С ароматическими и гетероароматическими аминами 6,8-диметокси-1,3,7-триазапирен (10a) не взаимодействует даже при высокой температуре. Например, он не изменяется даже при кипячении в избытке анилина. Однако в присутствии гидрида натрия реакция легко протекает в кипящем толуоле с образованием 6,8-бис(фениламино)-1,3,7-триазапирена 39a (схема 29). Это означает, что нуклеофилом в этой реакции является не анилин, а его N-анион (фениламид), обладающий, естественно, более сильными нуклеофильными свойствами. Аналогично протекает реакция диэфира 10a с п-толуидином, п-анизидином и 2-аминопиридином, образуя соответствующие 6,8-бис(ариламино)- 1,3,7-триазапирены 39b-d.
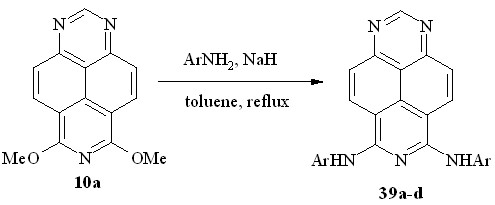
Ar = Ph (a); 4-MeC6H4 (b); 4-MeOC6H4 (c); pyridin-2-yl (d)
Схема 29
Необычным в этом превращении является то, что образующийся на стадии моно-замещения аминоэфир содержит более кислую NH-группу по сравнению с исходным ариламином и, казалось бы, должен существовать в форме аниона, устойчивого к последующему присоединению нуклеофила. Иными словами, можно было ожидать, что процесс завершится стадией моно-замещения. Тем не менее, наблюдение за ходом реакции с помощью ТСХ показало, что уже в начальный период реакции в реакционной массе присутствуют как исходный диэфир 10a, так и продукты моно- и дизамещения.
Таким образом, в зависимости от применяемого нуклеофила и условий реакции нуклеофильному ипсо-замещению может подвергаться либо одна, либо обе метоксигруппы 6,8-диметокси-1,3,7-триазапирена.
Выводы
1. Разработан эффективный метод окислительного аминирования и алкиламинирования 1,3,7-триазапиренов, уникальной особенностью которого является проведение реакции в водной среде. Процесс протекает при комнатной температуре в присутствии одноэлектронного окислителя (K3Fe(CN6) и позволяет получать в зависимости от условий неизвестные ранее 6-амино-, 6-алкил(диалкил)амино- или 6,8-бис(диалкиламино)-1,3,7-триазапирены. В последнем случае реализуется редкий пример тандемного окислительного SNH-SNH-диалкиламинирования.
2. Впервые в ряду азинов выполнено окислительное алкоксилирование 1,3,7-триазапирена в условиях кислотного катализа с образованием продуктов тандемного SNH-SNH-процесса - 6,8-диалкокси-1,3,7-триазапиренов.
3. Показано, что, в отличие от других гетероциклов, 1,3,7-триазапирены легко присоединяют -донорные арены и гетарены в водном растворе кислоты; образующиеся -аддукты в ходе выделения окисляются кислородом воздуха, давая продукты окислительного нуклеофильного арилирования - 6-арил(гетарил)производные 1,3,7-триазапирена. Обнаружен пример двойного SNH-арилирования.
4. Изучение реакций нуклеофильного ипсо-замещения алкокси- и аминогрупп в серии синтезированных соединений позволило впервые в гетероароматическом ряду обнаружить реакцию переалкоксилирования 6,8-диалкокси-1,3,7-триазапиренов, синтезировать неизвестные ранее аминоэфиры и 6,8-бис(ариламино)-1,3,7-триазапирены, получить продукты кислотного гидролиза моноаминов, а также полного или частичного гидролиза диаминов, найти условия для селективного расщепления простой эфирной связи в присутствии аминогруппы и для гидролитического отщепления обеих функциональных групп.
Основное содержание работы изложено в следующих публикациях:
Статьи в журналах перечня ВАК РФ:
1. О. П. Демидов, И. В. Боровлев, Н. А. Сайгакова, О. А. Немыкина, Н. В. Демидова, С. В. Писаренко. Окислительное аминирование и гидроксилирование 1,3,7–триазапиренов в водной среде. // Химия гетероцикл. соедин. –2011. – № 1. –С. 142-144.
2. И. В. Боровлев, О. П. Демидов, Н. А. Сайгакова. Кислотный катализ при окислительном нуклеофильном алкоксилировании 1,3,7-триазапиренов. // Изв. АН, сер. химич. -2011. -№ 8. -С. 1755-1756.
3. И. В. Боровлев, О. П. Демидов, Н. А. Сайгакова. Переалкоксилирование простых эфиров 1,3,7-триазапирена. // Химия гетероцикл. соедин. –2011. – № 5. –С. 792-793.
4. I. V. Borovlev, O. P. Demidov, N. A. Saigakova, S. V. Pisarenko, O. A. Nemykina. An Oxidative Alkylamination of 1,3,7-Triazapyrenes in the Aqueous Medium. // J. Heterocycl. Chem. -2011. –Vol. 48. –No 5. –P. 1206-1210.
5. И. В. Боровлев, О. П. Демидов, Н. А. Сайгакова. SNH-арилирование 1,3,7-триазапиренов в водном растворе кислоты. // Химия гетероцикл. соедин. –2013. –№ 4. –С. 662-668.
Статьи в сборниках и тезисы докладов:
6. Н. А. Сайгакова, О. П. Демидов, С. В. Писаренко, И. В. Боровлев. Окислительное алкоксилирование 1,3,7-триазапиренов. // Материалы X Междунар. Семинара по магнитному резонансу (спектроскопия, томография и экология): Тезисы докладов, Ростов-на-Дону. -2010. -С. 99.
7. И. В. Боровлев, О. П. Демидов, С. В. Писаренко, О. А. Немыкина, Н. А. Сайгакова. Нуклеофильное замещение в ряду 1,3,7-триазапиренов. // Международная конференция по химии гетероциклических соединений: Тезисы докладов, Москва. –2010. –С. 9.
8. Н. А. Сайгакова, О. П. Демидов, И. В. Боровлев. Окислительное аминирование и алкиламинирование 1,3,7-триазапиренов в водной среде. // Всероссийская научная конференция (с международным участием): «Успехи синтеза и комплексообразования»: Тезисы докладов. –Москва, РУДН. -2012. –Ч. 1. -С. 272.
Сайгакова Надежда Анатольевна
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Аббревиатура ONSH (Oxidative Nucleophilic Substitution of Hydrogen) введена М. Макоши.
[2] Автор выражает благодарность научному руководителю, д.х.н., проф. Боровлеву Ивану Васильевичу и научному консультанту, к.х.н., доц. Демидову Олегу Петровичу.

