Физико-химическое исследование систем, содержащих гепарин, ионы 3-d металлов и аминокислоты
На правах рукописи
![]()
Францева Юлия Викторовна
ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ СИСТЕМ,
СОДЕРЖАЩИХ ГЕПАРИН,
ИОНЫ 3-d МЕТАЛЛОВ И АМИНОКИСЛОТЫ
02.00.04 – физическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
ТВЕРЬ-2013
Работа выполнена на кафедре неорганической и аналитической химии Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Тверской государственный университет»
| Научный руководитель | кандидат химических наук, доцент Феофанова Мариана Александровна |
| Официальные оппоненты: | Смоляков Владимир Михайлович, доктор химических наук, профессор, ФГБОУ ВПО «Тверской государственный университет», профессор кафедры физической химии Евдокимов Андрей Николаевич кандидат химических наук, доцент, ФГБОУ ВПО «Санкт-Петербургский государственный технологический университет растительных полимеров», доцент кафедры физической и коллоидной химии |
| Ведущая организация | ФГБОУ ВПО «Тверской государственный технический университет» |
Защита состоится «26» декабря 2013 г. в 13 час. 00 мин. на заседании совета по защите докторских и кандидатских диссертаций Д 212.263.02 при ФГБОУ ВПО «Тверской государственный университет»: 170002, г. Тверь, Садовый пер., 35, ауд. 226
С диссертацией можно ознакомиться в научной библиотеке ФГБОУ ВПО «Тверской государственный университет» по адресу: 170100, Тверь, ул. Володарского, 44 А.
С авторефератом диссертации можно ознакомиться на сайте ТвГУ http://university.tversu.ru
Автореферат разослан «25» ноября 2013 г.
| Ученый секретарь диссертационного совета Д 212.263.02 кандидат химических наук, доцент |  | М.А.Феофанова |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
За последние 60 лет гепарин, как эффективный и нетоксичный антикоагулянт получил широкое распространение в медицинской практике. В силу своих структурных особенностей, гепарин, представляющий собой гетерогенную смесь сульфатированных полисахаридных цепей, построенных из повторяющихся единиц D-глюкозамина и L-идуроновой кислоты, способен взаимодействовать как с ионами различных металлов, так и с низкомолекулярными биологически активными веществами. Следует отметить, что если процессы комплексообразования ионов макро и микроэлементов, и катионов редкоземельных металлов с гепарином изучены достаточно полно, то комплексообразование в тройных системах ион металла-гепарин-аминокислота исследовано в значительно меньшей степени. В то же время, такие системы представляют интерес как системы, обладающие определенной антикоагулянтной активностью. Кроме того, идентификация состава смешаннолигандных комплексов необходима для определения количественного соотношения концентраций гепарина и аминокислот при синтезе твердых гепаринатов, сведений о структуре и свойствах которых в литературе недостаточны. Поэтому исследование гепарина с катионами металлов и аминокислотами, (глицин – Gly, аргинин – Arg, пролин – Pro) делает тему данного исследования актуальной.
Цель и задачи исследования
Цель исследования: изучение физико-химических свойств систем, содержащих гепарин, ионы 3-d металлов, аминокислоты в растворе и в твердом виде.
Задачи:
- синтез и исследование спектральных и термических свойств твердых гепаринатов ионов Co2+, Cu2+, Ni2+.
- исследование взаимодействия гепарина с катионами Co2+, Cu2+, Ni2+ и аминокислотами (глицин, аргинин, пролин) в водном растворе, определение состава, устойчивости и области существования pH образующихся комплексов.
- синтез и исследование методами элементного анализа, ИК - спектрального и термического анализа комплексов гепарина с катионами Co2+, Cu2+, Ni2+ и аминокислотами (глицин, аргинин, пролин).
Методы исследований
Комплексообразование в водных растворах, содержащих ионы металлов, гепарин, аминокислоты (глицин, аргинин, пролин), исследованы методом потенциометрического титрования (рН - метрическое титрование).
Расчеты моделей химических равновесий и определение соответствующих констант выполнены с помощью комплекса вычислительных программ AUTOEQUIL (Свидетельство о государственной регистрации программы на ЭВМ. 2008 г. №2008612267) и программы расчета химических равновесий New DALSFEK (KCM Soft, 2000), элементный анализ твердых гепаринатов выполнен на элементном анализаторе CHN Analyzer. Термогравиметрическое исследование проведено на приборе Derivatograph системы Paulik-Paulik-Erdey и термогравиметрическом анализаторе Pyris 1 TGA фирмы Perkin Elmer.
ИК-спектроскопическое исследование выполнено на Фурье ИК-спектрометре Equinox 55 фирмы Bruker (Германия).
Научная новизна работы
Впервые методом элементного анализа, спектральными и термическими методами исследованы твердые гепаринаты Co2+, Cu2+, Ni2+.
Впервые в широком интервале рH по данным потенциометрических измерений с использованием современных методов компьютерного моделирования исследованы металл - ионные равновесия в системах: Mn+- L1- L2 (Mn+: Co2+, Cu2+, Ni2+; L1: Hep4–; L2: Arg, Gly, Pro).
Установлено, что в данных системах возможно образование смешаннолигандных комплексов различного состава: CoOHHepGly4-, CoHepGly3-, CoHepHArg2-, CoHepArg3-, CoHepPro, CuHepArg3-, CuHepGly3-, CuOHHepGly4-, CuHepHArg2-, CuHepPro, NiHepHArg2-, NiHepGly3-, NiHepPro, определены константы устойчивости образующихся комплексов и области существования pH.
Впервые в твердом виде выделены комплексы гепарина с Co2+, Cu2+, Ni2+ и аминокислотами (глицин, аргинин, пролин). Полученные комплексы исследованы методами элементного анализа, спектральными и термическими методами, предложены брутто-формулы выделенных соединений.
Практическая значимость
Оптимизированы методики синтеза комплексов гепарина с Co2+, Cu2+, Ni2+, а также отработаны методики получения и идентификации комплексов гепарина с Co2+, Cu2+, Ni2+ и аминокислотами (глицин, аргинин, пролин). Полученные гепаринаты перспективны при разработке новых лекарственных препаратов. Рассчитанные величины логарифмов констант образования металлокомплексов гепарина и аминокислот могут быть использованы в качестве справочных данных.
Личный вклад автора
Автором непосредственно самостоятельно проведены все эксперименты, а также обработка и анализ результатов исследования.
Апробация работы
Основные положения диссертационной работы докладывались и обсуждались на следующих конференциях: XVI Региональных Каргинских чтениях. Тверь, 2009; XVII Региональных Каргинских чтениях. Областная научно-техническая конференция молодых ученых «Физика, химия и новые технологии». Тверь, 2010; на Международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов-2009», Москва, 2009 г; на Международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов-2010», Москва, 2010 г; XX Российской молодежной научной конференции «Проблемы теоретической и экспериментальной химии». Екатеринбург, 2010; XXI Российской молодежной научной конференции «Проблемы теоретической и экспериментальной химии». Екатеринбург, 2011; XXII Российской молодежной научной конференции «Проблемы теоретической и экспериментальной химии». Екатеринбург, 2012; XII науч. конф. аспирантов и студентов химического факультета Тверского гос. ун-та. Тверь, 2013 г; XX Всероссийская конференция «Структура и динамика молекулярных систем», 11-я Международная школа молодых ученых «Синтез, структура и динамика молекулярных систем», Тверь, 2013 г.
Реализация результатов
Научные результаты исследования процессов образования гепаринатов металлов использованы в учебном процессе при выполнении студентами кафедры неорганической и аналитической химии и кафедры физической химии химико-технологического факультета ФГБОУ ВПО «Тверской государственный университет» выпускных, дипломных работ и магистерских диссертаций.
Диссертационное исследование выполнено в рамках проектов ФЦП. «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы»: соглашение № 14.1337.21.1109 и соглашение №14.132.21.1308, а также при поддержке фонда содействия развитию малых форм предприятий в научно-технической сфере программы «У.М.Н.И.К.».
Публикации
По теме диссертации опубликовано 9 статей, из них 5 в отечественных научных журналах входящих в перечень ВАК, а также 13 тезисов докладов на российских конференциях, в которых автором получены все основные экспериментальные результаты, проведена интерпретация экспериментальных данных.
Структура и объем работы
Диссертация представлена на 110 страницах, иллюстрирована 44 рисунками и 23 таблицами. Состоит из введения, обзора литературы, экспериментальной части, обсуждения результатов, выводов и списка литературы, состоящего из 86 библиографических ссылок.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во «Введении» обоснована актуальность темы диссертации, поставлены основные цели и задачи исследования, положения, выносимые автором на защиту.
В главе «Литературный обзор», приведены литературные данные, посвященные вопросам структуры, кислотно-основных свойств, биологической активности гепарина, а также молекулярных его комплексов. Дан обзор биологической роли ионов 3-d-металлов (меди, никеля, кобальта) и аминокислот (глицин, аргинин, пролин). Изложены основные методы изучения комплексообразования в растворах и строения твердых комплексов, а именно, pH-потенциометрии, методы математического и компьютерного моделирования, термогравиметрии и ИК-спектроскопии.
В главе «Экспериментальная часть» приведены методики синтеза твердых гепаринатов, результаты элементного анализа, термогравиметрического и ИК-спектроскопического анализов, а также представлены результаты исследования химических равновесий в многокомпонентных системах типа: M2+-L1-L2 (М2+: Co2+, Cu2+, Ni2+; L1: Hep4-; L2: Arg, Gly, Pro).
Глава «Результаты и их обсуждения» содержит результаты экспериментального и теоретического исследования систем, содержащих гепарин, ионы 3-d-металлов (меди, никеля, кобальта) и аминокислоты (глицин, аргинин, пролин). Для проведения эксперимента был использован стандартный, фармакологический препарат высокомолекулярного гепарина в виде тетранатриевой соли (каждый миллилитр раствора соответствует 500 ЕД: 1 ЕД = 0, 0077 мг гепарина).
Для получения твердых гепаринатов меди, никеля и кобальта нами были использованы результаты изучения химических равновесий в подсистемах Na4Hep-NaCl-H2O и Na4Hep-Me, полученные ранее (Семенов А.Н. Физико-химические закономерности образования металлокомплексов ионов некоторых s-, d- и f- элементов с гепарином. Автореферат дисс. канд-та хим. наук. – Тверь, 2010). Комплексы гепарина с катионами Co2+, Cu2+, Ni2+ были получены в виде осадков, путем экстракции из водной фазы ацетоном. В состав комплексов не входит хлор, что было подтверждено методом аргентометрического титрования. По совокупности данных термогравиметрического (определение молекул воды, а также разделение на координационную и адсорбционную), элементного (CHNS-анализ) и спектрофотометрического анализов был определен состав комплексов (Табл. 1).
Как следует из таблицы, найденные и ожидаемые количества водорода, углерода, серы и азота находятся в хорошем соответствии между собой, что является подтверждением стехиометрии выделенных комплексов.
Таблица 1. Результаты элементного анализа комплексов гепарина с катионами металлов Co2+, Cu2+, Ni2+
| Комплекс | C | H | N | S | Ме | |||||
| Практ. % | Теор. % | Практ. % | Теор. % | Практ. % | Теор. % | Практ. % | Теор. % | Практ.% | Теор. % | |
| Cu-Hep | 17,77 | 19,75 | 3,79 | 2,61 | 1,86 | 1,92 | 9,55 | 9,89 | 8,78 | 8,90 |
| Ni-Hep | 18,47 | 19,89 | 4,47 | 3,62 | 1,89 | 1,93 | 7,12 | 7,87 | 8,15 | 8,26 |
| Co-Hep | 18,35 | 19,89 | 4,31 | 3,62 | 1,87 | 1,93 | 8,48 | 9,15 | 8,15 | 8,26 |
Для оценки температуры разложения комплекса и отщепления гидратной воды был проведен термический анализ образцов данных комплексов.
На рис. 1 – 4 приведены термограммы гепарина и выделенных гепаринатов микроэлементов.
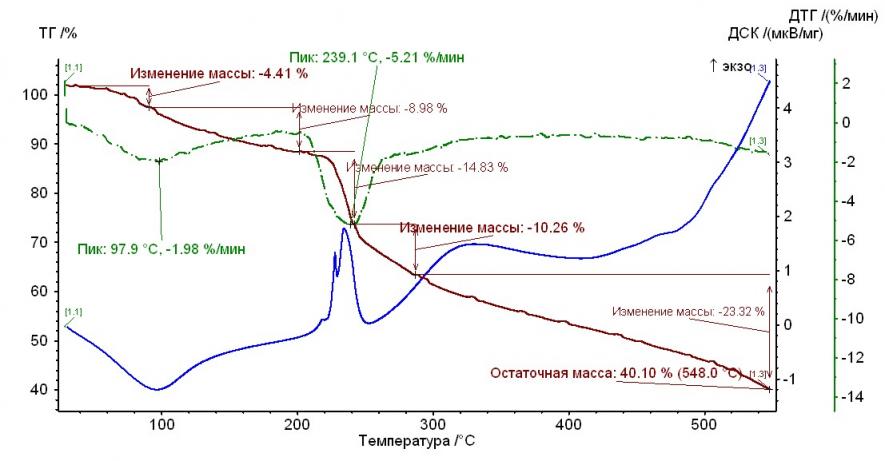 Рис. 1. Термограмма гепарина Рис. 1. Термограмма гепарина | 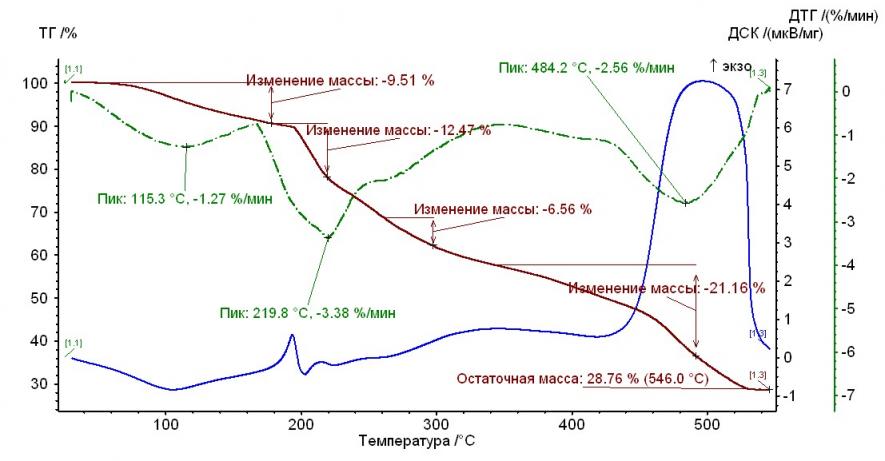 Рис. 2. Термограмма гепарината никеля (II) Рис. 2. Термограмма гепарината никеля (II) |
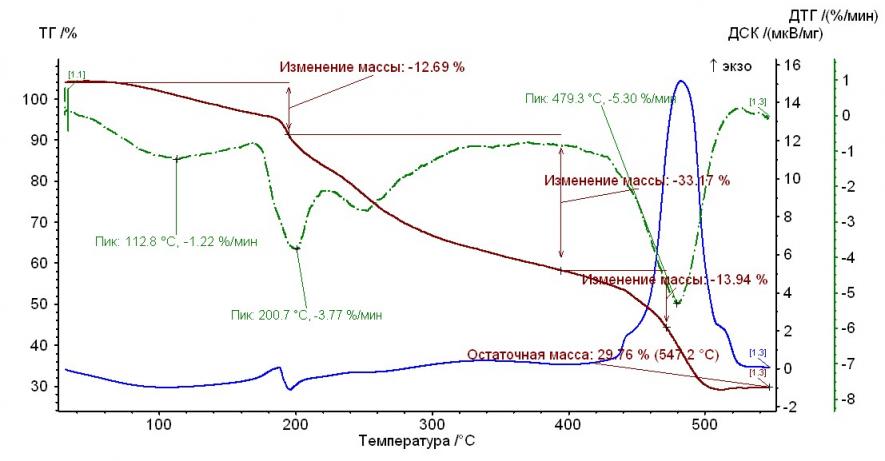 Рис. 3. Термограмма гепарината кобальта (II) Рис. 3. Термограмма гепарината кобальта (II) | 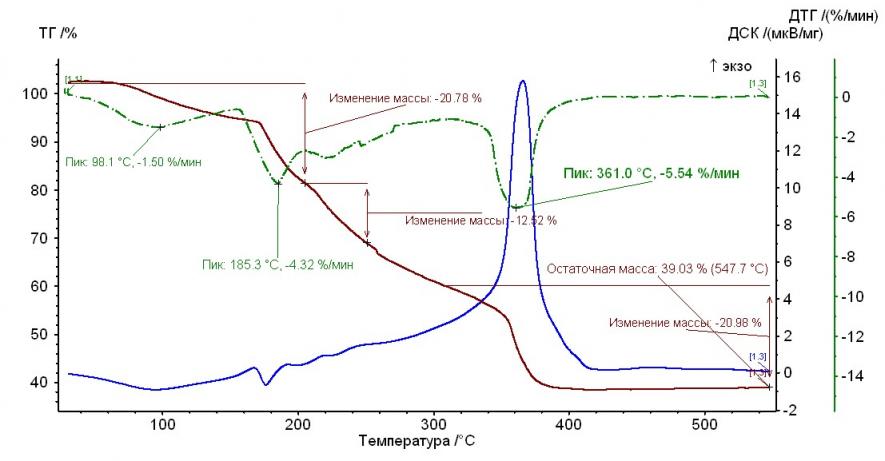 Рис. 4. Термограмма гепарината меди (II) Рис. 4. Термограмма гепарината меди (II) |
Из рисунков, представленных выше, следует, что термолиз гепаринатов носит многостадийный характер. По термохимическому исследованию образцов видно, что при температуре 100-110°С заканчивается отщепление гидратной воды. На примере комплекса меди с гепарином, молекула воды отщепляется при двух значениях температур, а если рассматривать комплекс гепарина кобальта и никеля — при одном значении температуры.
Таким образом, потеря веса комплексов соответствует отщеплению двух молекул воды, а в случае комплекса кобальта с гепарином – 1 молекулы (Табл. 2).
| Формула | I порог температур °С | nМеn+/nH2O | II порог температур °С | nМеn+/nH2O |
| Na2 [CuHep]·2H2O | 88, 4 | 1:1 | 112,1 | 1:2 |
| Na2 [NiHep]·2H2O | 104 | 1:2 | - | - |
| Na2 [CoHep]·H2O | 112 | 1:1 | - | - |
Таблица 2. Данные термограмм
ИК - спектроскопическое исследование твердых гепаринатов показало, что все спектры комплексов гепарина с ионами металлов имеют полосу поглощения 3300 см-1, что соответствует валентным колебаниям связи О-Н (Табл. 3, рис. 5-8).
Внутри карбоксильной группы, к симметричным колебаниям связи С-О можно отнести полосу поглощения 1430 см-1.
Полосы поглощения сульфоновых групп разрешены недостаточно отчетливо. В области 1210 см-1, можно отнести асимметричные колебания O=S=O, внутри сульфатной группировки.
Симметричные колебания - 1140 см-1. Область 1150-1085 см-1 и 1125 см-1 соответствует симметричным и асимметричным валентным колебаниям С-О-С.
Полоса 3500-3300 см-1 отвечает валентным колебаниям N-H в сульфамидной группе и перекрыта валентными колебаниями О-Н. Также перекрываются валентные колебания связи С-Н в области 3000-2800 см-1 валентными колебаниями О-Н. Область отпечатков пальцев начинается с 1000 см-1, где распознать полосы поглощения очень трудно. Здесь выделяют деформационные колебания N-H- 800 см-1.
| Рис. 5. ИК-спектр гепарина | Рис. 6. ИК-спектр комплекса меди с гепарином |
| Рис. 7. ИК-спектр комплекса никеля с гепарином | Рис. 8. ИК-спектр комплекса кобальта с гепарином |
На основании данных ИК – спектрального отнесения полос поглощения видно, что функциональность органической части комплексов гепарина с ионами Co2+, Cu2+, Ni2+ сохраняется и является такой же, как и в гепарине. Смещение полос поглощения гепаринатов в низкочастотную область по сравнению с гепарином объясняется образованием новых связей с ионами металлов Co2+, Cu2+, Ni2+.
Таблица 3. Спектральные характеристики образцов в ИК-области
| Образец | Отнесение колебаний | ||||||||
| N-H | O-H | C-H | C=O | as S=O | s S=O | as C-O-C | s C-O-C | ||
| as CO ( в COO-) | s CO ( в COO-) | ||||||||
| Гепарин | 3500-3300 | 3400 | 3000-2840 | 1750 | 1270 | 1230 | 1160-1075 | 1135 | |
| Cu–Hep | 3500-3300 | 3300 | 3000-2800 | 1600 | 1430 | 1210 | 1140 | 1150-1085 | 1125 |
| Cо–Hep | 3500-3300 | 3300 | 3000-2800 | 1600 | 1420 | 1200 | 1140 | 1150-1085 | 1125 |
| Ni–Hep | 3500-3300 | 3300 | 3000-2800 | 1590 | 1420 | 1210 | 1140 | 1140-1085 | 1120 |
Исследование ионно-молекулярных равновесий в системах: M2+-L1-L2 (М2+: Co2+, Cu2+, Ni2+; L1: Hep4-; L2: Arg, Gly, Pro) было проведено при температуре 37 С, на фоне 0, 15 М NaCl pH – потенциометрическим методом, с использованием метода математического моделирования. Расчет показал, что в исследованных системах идет образование смешаннолигандных комплексов, включающих катион металла, гепарин и аминокислоту. Десятичные логарифмы констант образования комплексов представлены в таблице 4.
Таблица 4. Десятичные логарифмы констант образования смешаннолигандных комплексных форм в системах: M2+ – L1 – L2 (M2+: Cu2+, Cо2+, Ni2+; L1: Hep4-; L2: Arg, Gly, Pro). I= 0.15 NaCl, 37C
| CoHepGly | 8.52±0.10 |
| CoOHHepGly | -1.301±0.12 |
| CoHepHArg | 15.71±0.10 |
| CoHepArg | 7.54 ±0.11 |
| CoHepPro | 8.3±0.13 |
| CuHepArg3- | 20.05±0.04 |
| CuHepGly3- | 15,84±0,01 |
| CuOHHepGly4- | 22,28±0,02 |
| CuHepHArg2- | 27,23±0,06 |
| CuHepPro | 10.6±0.07 |
| NiHepHArg2- | 20,60±0,05 |
| NiHepGly3- | 9,60±0,29 |
| NiHepPro | 8.9±0.1 |
При анализе полученных диаграмм распределения (в качестве примера на рисунке 9 приведена диаграмма распределения комплексных форм в системе Cо2+ - Na4Hep – H2Gly+ - NaCl – H2O), следует отметить, что в случае взаимодействия гепарина с ионами Co2+ и глицином при pH >7, идет образование смешаннолигандного гидроксокомплекса состава CoOHGlyHep4-, который постепенно разрушается с ростом pH.
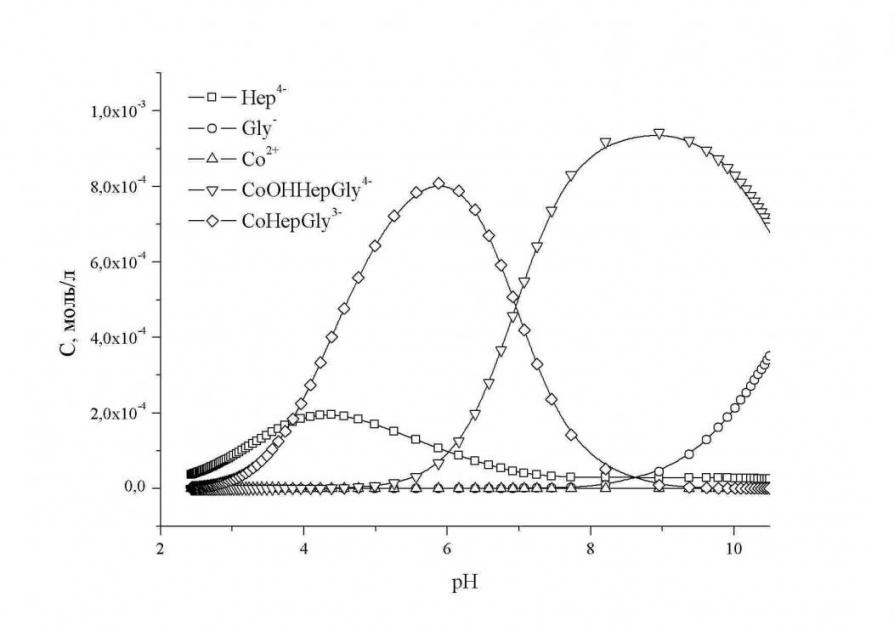 Рис. 9. Диаграмма распределения комплексных форм в системе Cо2+ - Na4Hep – H2Gly+ - NaCl – H2O при эквимолярном соотношении M:L1:L2 Рис. 9. Диаграмма распределения комплексных форм в системе Cо2+ - Na4Hep – H2Gly+ - NaCl – H2O при эквимолярном соотношении M:L1:L2 |
При взаимодействии гепарина с ионами Co2+ и аргинина с ростом pH, отмечается образование комплексной формы состава CoHepArg3-, постепенное снижение равновесной концентрации которой происходит в щелочной области. Аналогичная картина наблюдается и в системе Co2+- Hep - Pro.
При взаимодействии гепарина с ионами Cu2+ и аминокислотами идентифицируются однотипные комплексные формы: CuHepGly3-, CuHepPro, CuHepArg3- и только с глицином идет образование смешаннолигандного гидроксокомплекса CuOHGlyHep4-, который постепенно разрушается с величиной pH. При взаимодействии гепарина с ионами Ni2+ и аминокислотами (глицин, пролин) образуются однотипные комплексные формы состава: NiHepGly3-, NiHepPro, с аргинином добавляется форма NiHepHArg3-. Таким образом, по результатам моделирования металл-ионных равновесий в системах: М2+- L1 - L2 (М2+: Co2+, Cu2+, Ni2+; L1: Hep4-; L2: Arg, Gly, Pro) зафиксировано образование смешаннолигандных комплексов гепарина с глицином, аргинином и пролином состава: CoOHHepGly4-, CoHepGly3-, CoHepHArg2-, CoHepArg3-, CoHepPro, CuHepArg3-, CuHepGly3-, CuOHHepGly4-, CuHepHArg2-, CuHepPro, NiHepHArg2-, NiHepGly3-, NiHepPro.
Для подтверждения результатов моделирования были выделены твердые комплексы, включающие гепарин, биометалл и аминокислоту. Используя данные элементного анализа, термогравиметрического анализа и метода ИК-спектроскопии определен состав комплексов и предложена их брутто-формулы (Табл. 5.).
Таблица 5. Результаты элементного анализа комплексов образцов
| Формула | С, % (вычислено / найдено) | H, % (вычислено / найдено) | N, % (вычислено / найдено) | M2+, % (вычислено / найдено) |
| Na3CuHepGly·H2O | 19,80/21,10 | 2,90/2,53 | 2,70/3,51 | 7,50/7,97 |
| Na3CuHepHArg·2H2O | 22.75/21.52 | 3.71/3.20 | 7.37/6.69 | 6.69/6.50 |
| Na3CuHepPro·2H2O | 22.94/22.00 | 3.28/2.65 | 3.15/2.98 | 7.14/7.10 |
| Na3CoHepGly·2H2O | 20,20/21,22 | 1,80/2,54 | 2,20/3,54 | 7,20/7,44 |
| Na3CoHepHArg·H2O | 22.86/21.92 | 3.73/3.10 | 7.41/6.81 | 6.23/6.10 |
| Na3CoHepPro·2H2O | 23.06/22.10 | 3.30/2.78 | 3.16/2.88 | 6.66/6.30 |
| Na3NiHepGly·H2O | 20,02/21,23 | 1,90/2,54 | 3,20/3,53 | 7,21/7,41 |
| Na3NiHepArg·H2O | 23,90/24,23 | 2,80/3,39 | 6,90/7,85 | 6,30/6,58 |
| Na3NiHepPro·H2O | 24,00/24,50 | 3,00/3,02 | 2,80/3,36 | 7,00/7,04 |
Как показал термический анализ большинство исследованных гепаринатов микроэлементов, включающих аминокислоты устойчивы до 200 – 2500С и постепенно разлагаются в интервале 240-5500С, при этом во всех случаях наблюдается образование не разложившегося остатка, который в данной работе не подвергался анализу. Для большинства исследованных соединений в области 300-4000С наблюдается 50%-ная потеря массы.
На рис. 10 – 17 приведены термограммы комплексов состава: M2+ – L1 – L2 (M2+: Cu2+, Cо2+, Ni2+; L1: Hep4-; L2: Arg, Gly, Pro (исследование проводилось на дифференциальном сканирующем калориметре NETZSCH STA 449F3 STA449F3A-0354-M).
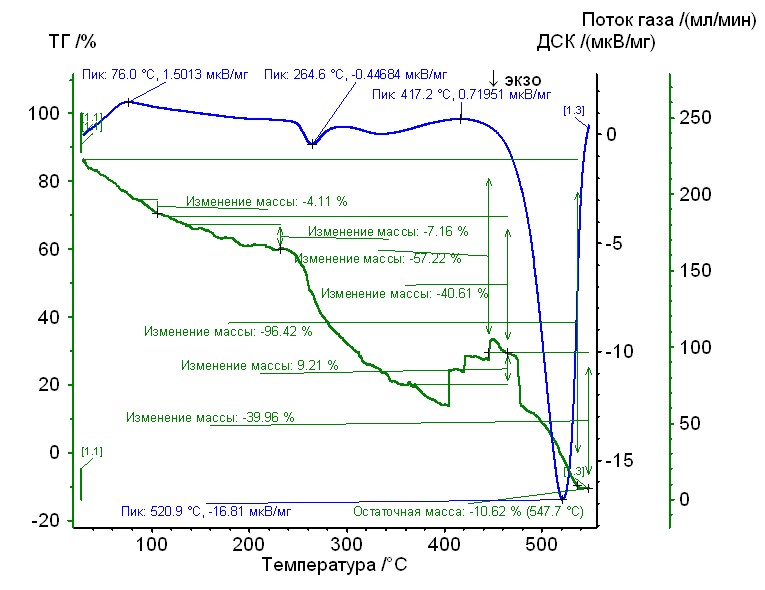 Рис. 10. Термограмма никель-аргинин-гепарин Рис. 10. Термограмма никель-аргинин-гепарин | Гепаринат никеля с аминокислотой аргинин устойчив до 250 0C, 50%-ная потеря массы при 2600С, максимумы экзотермических эффектов на кривой ДТА при 2500С и 2750С. Остаточная масса 10%. |
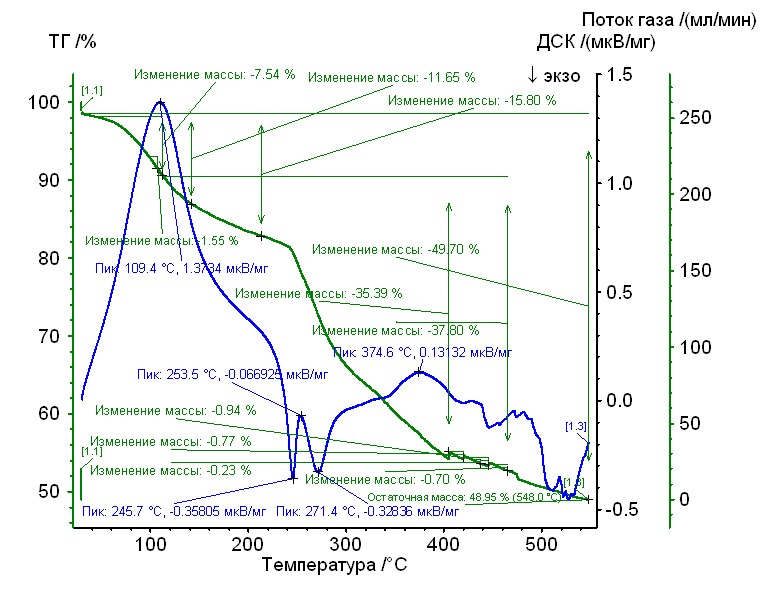 Рис. 11. Термограмма никель-пролин-гепарин Рис. 11. Термограмма никель-пролин-гепарин | Гепаринат никеля с аминокислотой пролин устойчив до 250 0C, 50%-ная потеря массы при 4600С, максимумы экзотермических эффектов на кривой ДТА при 2650С, и 5200С. Остаточная масса 48%. |
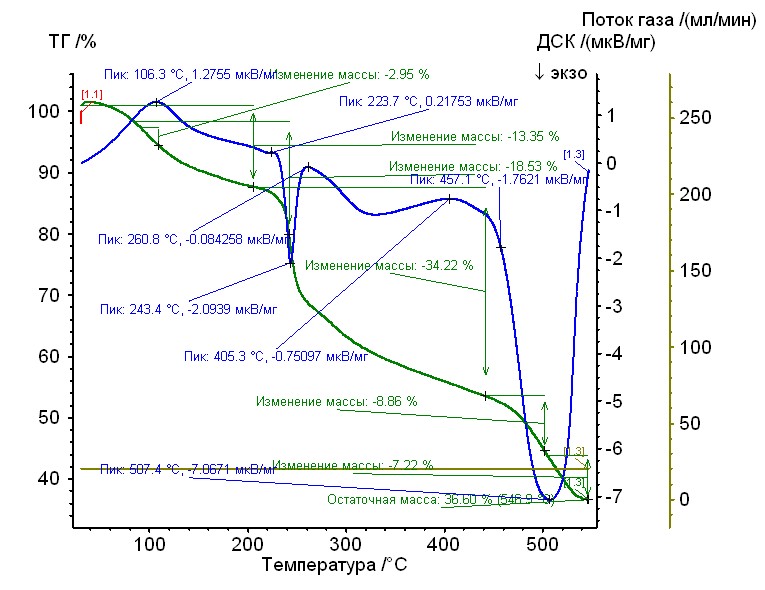 Рис. 12.Термограмма никель-глицин-гепарин Рис. 12.Термограмма никель-глицин-гепарин | Гепаринат никеля с аминокислотой глицин устойчив до 240 0C, 50%-ная потеря массы при 4800С, максимумы экзотермических эффектов на кривой ДТА при 2450С, и 5070С. Остаточная масса 36%. |
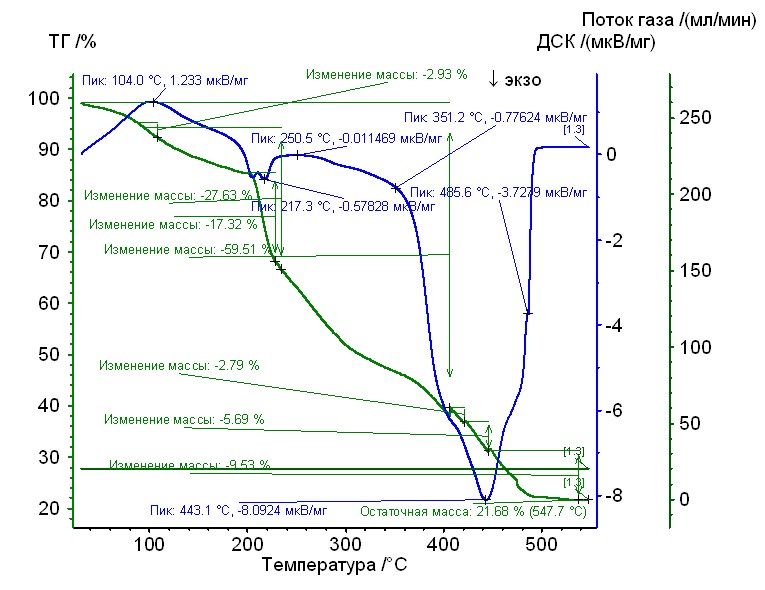 Рис. 13. Термограмма кобальт-глицин-гепарин Рис. 13. Термограмма кобальт-глицин-гепарин | Гепаринат кобальта с аминокислотой глицин устойчив до 205 0C, 50%-ная потеря массы при 3000С, максимумы экзотермических эффектов на кривой ДТА при 2200С, и 4400С. Остаточная масса 22%. |
 Рис. 14. Термограмма кобальт-пролин-гепарин Рис. 14. Термограмма кобальт-пролин-гепарин | Гепаринат кобальта с аминокислотой пролин устойчив до 240 0C, 50%-ная потеря массы при 3900С, максимумы экзотермических эффектов на кривой ДТА при 2480С, и 4430С. Остаточная масса 41%. |
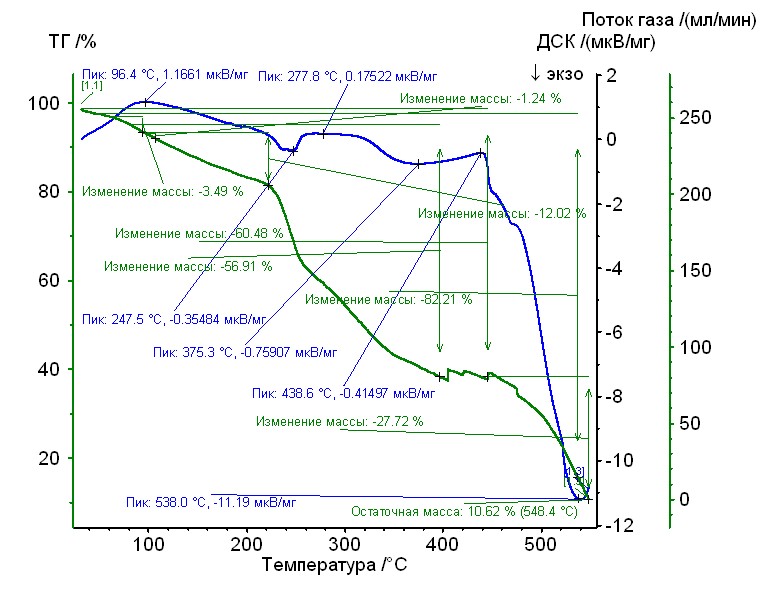 Рис. 15. Термограмма кобальт-аргинин-гепарин Рис. 15. Термограмма кобальт-аргинин-гепарин | Гепаринат кобальта с аминокислотой аргинин устойчив до 220 0C, 50%-ная потеря массы при 3200С, максимумы экзотермических эффектов на кривой ДТА при 2480С, и 5350С. Остаточная масса 11% |
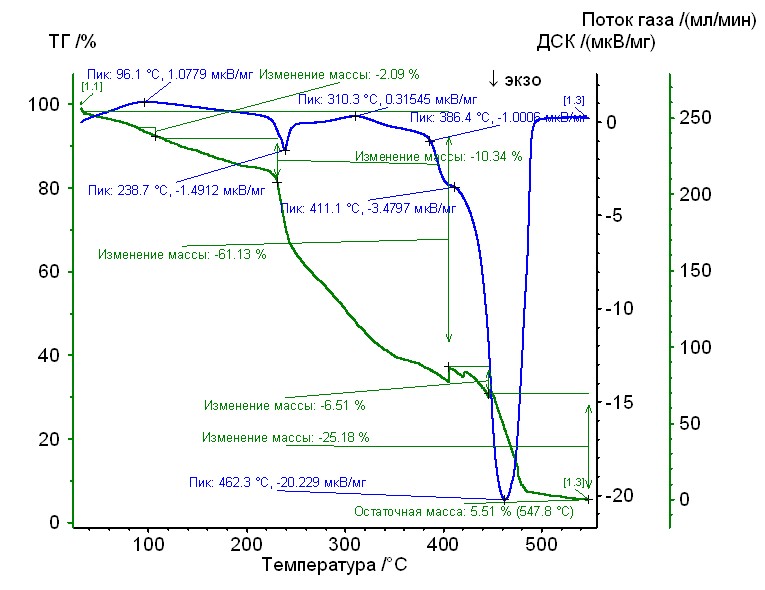 Рис. 16. Термограмма медь-аргинин-гепарин Рис. 16. Термограмма медь-аргинин-гепарин | Гепаринат меди с аминокислотой аргинин устойчив до 230 0C, 50%-ная потеря массы при 3000С, максимумы экзотермических эффектов на кривой ДТА при 2400С, и 4600С. Остаточная масса 6%. |
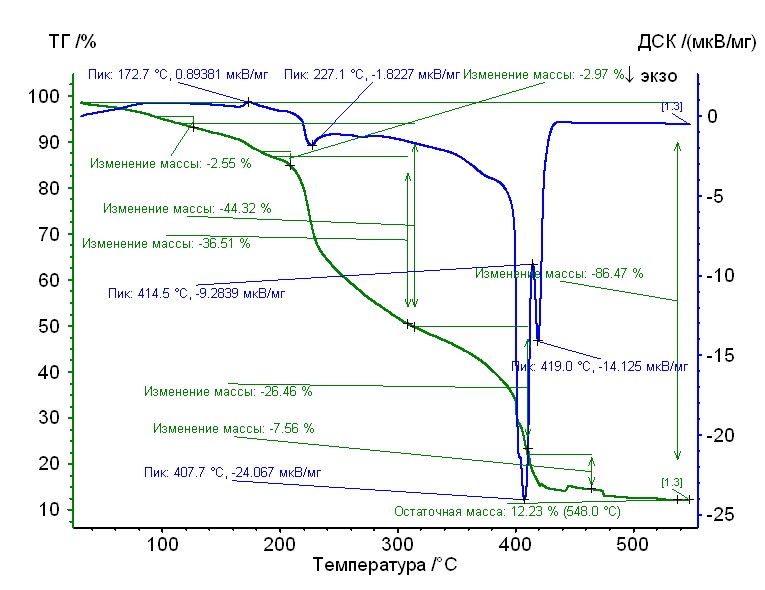 Рис. 17. Термограмма медь-глицин-гепарин Рис. 17. Термограмма медь-глицин-гепарин | Гепаринат меди с аминокислотой глицин устойчив до 215 0C, 50%-ная потеря массы при 3100С, максимумы экзотермических эффектов на кривой ДТА при 2270С, 4100С и 4200С. Остаточная масса 12%. |
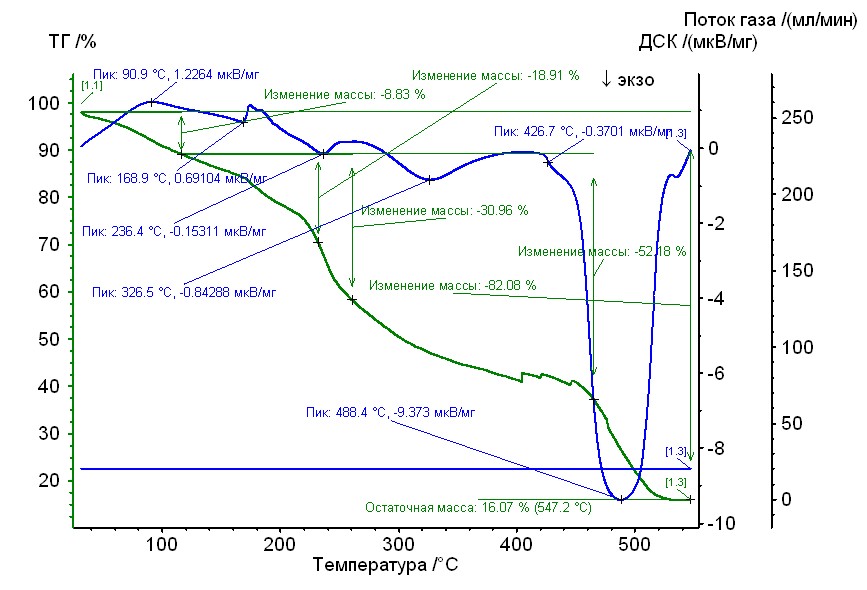 Рис. 18. Термограмма медь-пролин-гепарин Рис. 18. Термограмма медь-пролин-гепарин | Гепаринат меди с аминокислотой пролин устойчив до 230 0C, 50%-ная потеря массы при 2900С, максимумы экзотермических эффектов на кривой ДТА при 2400С, 3300С и 4900С. Остаточная масса 16%. |
Процесс термического разложения является многостадийным, и для большинства исследованных соединений включает две стадии термической деструкции, о чем говорят перегибы на кривых потери массы. Исходя из полученных зависимостей, можно заключить, что наименее термически стабильным является гепаринат кобальта с аминокислотой глицин, который устойчив до 2000С и разлагается в две стадии с максимумами на кривой ДТА при 2200С и 450 0С. Наиболее термически стабильными являются гепаринат никеля с аминокислотой пролин и гепаринат никеля с аминокислотой аргинин – устойчивы вплоть до 2500С, с максимумами на кривых ДТА при 2500С, 2750С и 2650С, 5200С соответственно.
Для всех изученных соединений на кривых потери массы наблюдаются весовые потери от 5 до 15% массы в интервале температур от 250С до 1000С, это свидетельствует о том, что происходит потеря адсорбционной воды. Для всех исследуемых соединений наблюдаются потери массы в интервале 100 – 1800С. В этом температурном интервале происходит отщепление кристаллизационной воды, которая присутствует во всех комплексах, о чем говорят результаты элементного анализа. Исходя из процентной потери массы в этом температурном интервале, нами были проведены расчеты по установлению количества молекул кристаллизационной воды для каждого из синтезированных комплексов путем подсчета потери массы. Полученные результаты хорошо согласуются с данными элементного анализа, по расчету количества молекул кристаллизационной воды в составе изученных комплексов.
Заключительный этап работы – проведение ИК-спектроскопического исследования выделенных смешаннолигандных комплексов (Табл. 6), в ИК - спектрах которых происходят изменения в области деформационных колебаний, что свидетельствует о том, что катион металла и аминокислота встраиваются в структуру гепарина, что подтверждает смещение полос поглощения функциональных групп -COOH, -SO3H, -NSO3H.
Таблица 6. Спектральные характеристики образцов в ИК - области
| Образец | Отнесение колебаний | ||||||||
| N-H | O-H | C-H | C=O | as S=O | s S=O | as C-O-C | s C-O-C | ||
| as CO (COO-) | s CO (COO-) | ||||||||
| Гепарин | 3500-3300 | 3400 | 3000-2840 | 1750 | 1415-1380 | 1230 | 1160-1075 | 1135 | |
| Cu–Gly–Hep | 3500-3300 | 3300 | 3000-2800 | 1610 | 1430 | 1410-1390 | 1195-1185 | 1150-1080 | 1135 |
| Ni–Gly–Hep | 3500-3300 | 3300 | 3000-2800 | 1590 | 1420 | 1400-1375 | 1200-1180 | 1140-1085 | 1120 |
| Co–Gly–Hep | 3500-3300 | 3300 | 3000-2800 | 1590 | 1420 | 1420-1390 | 1200-1185 | 1150-1085 | 1125 |
| Cu–Arg–Hep | 3500-3300 | 3300 | 3000-2800 | 1600 | 1420 | 1410-1386 | 1200-1185 | 1150-1085 | 1125 |
| Ni–Arg–Hep | 3500-3300 | 3300 | 3000-2800 | 1610 | 1420 | 1415-1380 | 1190-1185 | 1150-1085 | 1125 |
| Co–Arg–Hep | 3500-3300 | 3300 | 3000-2800 | 1620 | 1420 | 1415-1380 | 1200-1180 | 1150-1085 | 1125 |
| Cu–Pro–Hep | 3500-3300 | 3300 | 3000-2800 | 1595 | 1420 | 1420-1380 | 1200-1180 | 1150-1060 | 1125 |
| Ni–Pro–Hep | 3500-3300 | 3300 | 3000-2800 | 1610 | 1420 | 1415-1380 | 1200-1170 | 1150--1085 | 1125 |
| Co–Pro–Hep | 3500-3300 | 3300 | 3000-2800 | 1600 | 1420 | 1390-1380 | 1140-1085 | 1150-1085 | 1125 |
ВЫВОДЫ
1. Впервые методом элементного анализа, спектральными и термическими методами исследованы твердые гепаринаты катионов биометаллов Co2+, Cu2+, Ni2+ состава: Na2[CuHep]2H2O, Na2[NiHep]2H2O, Na2[CoHep]H2O.
2. В ИК - спектрах комплексах наблюдается смещение полос поглощения функциональных групп (-N-H, -O-H, -C-H, -S=O, C-O-C), что свидетельствует об образовании координационных связей ковалентного характера гепарина с катионом металла.
3. Впервые на основе репрезентативного научного эксперимента (рН-метрическое титрование), с использованием метода математического моделирования, в широком интервале рН, в среде физиологического раствора (t=37 C и ионная сила 0,15М) исследованы металл - ионные равновесия в системах M2+: Co2+, Cu2+, Ni2+; L1: Hep4–; L2: Arg, Gly, Pro). Во всех системах зафиксировано образование значимых комплексных форм состава: CoOHHepGly4-, CoHepGly3-, CoHepHArg2-, CoHepArg3-, CoHepPro, CuHepArg3-, CuHepGly3-, CuOHHepGly4-, CuHepHArg2-, CuHepPro, NiHepHArg2-, NiHepGly3-, NiHepPro, для которых определены логарифмы констант образования и области существования pH.
4. Впервые в твердом виде выделены смешаннолигандные комплексы гепарина с катионами Co2+, Cu2+, Ni2+ и аминокислотами (глицин, аргинин, пролин)
Полученные комплексы исследованы методом элементного анализа, спектральными и термическими методами. Определен элементный и кристаллогидратный состав комплексов, предложены брутто-формулы выделенных соединений: Na3CuHepGly·H2O, Na3CuHepHArg·2H2O, Na3CuHepPro·2H2O, Na3CoHepGly·2H2O, Na3CoHepHArg·H2O, Na3CoHepPro·2H2O, Na3NiHepGly·H2O, Na3NiHepArg·H2O, Na3NiHepPro·H2O.
Перечень работ, опубликованных по теме диссертации
Статьи в журналах, рекомендованных ВАК РФ
- Францева, Ю.В. Хелатные комплексы гепарина с биометаллами (медь, цинк) / Ю.В. Францева, М.А. Феофанова, А.Н. Семенов // Вестник ТвГУ. Сб. науч. тр. Серия «Биология и экология» - 2009, №18, С. 81 – 90.
- Францева, Ю.В. Комплексообразование высокомолекулярного гепарина с катионами La (III), Рr (III) и Nd (III) / С.И. Кузьмина, А.Н. Семенов, М.А. Феофанова, Ю.В. Францева, С.С. Шафранович // Вестник ТвГУ. Сб. науч. тр. – Серия: Биология и экология. Вып. 15, 2009 г., С. 82-87.
- Францева, Ю.В. Смешаннолигандные комплексы ионов Cu и Ni с высокомолекулярным гепарином и некоторыми аминокислотами / М.А. Феофанова, Ю.В. Францева, А.Н. Семенов, Н.В. Баранова // Научно-технический вестник Поволжья. Сб. науч. статей №5 2011 Казань. С. 36-40.
- Францева, Ю.В. Физико-химические исследования гепаринатов Cu2+, Ni2+, Co2+ / М.А. Феофанова, Ю.В. Францева, Е.В. Журавлев, Ю.М. Смирнов, В.В. Новикова // Вестник ТвГУ. Серия «Химия». 2012. Выпуск 14. С. 25-32.
- Францева, Ю.В. Расчет химических равновесий в системе гепарин-ион Co2+ - глицин / М.А. Феофанова, Ю.В. Францева, Е.В. Журавлев, Ю.М, С.С. Рясенский, Н.В. Баранова // Журнал физической химии. 2013. Т. 87. № 8. С. 1432-1434.
Работы, опубликованные в центральной печати, материалах
общероссийских и международных конференций
- Кузьмина, С.И. Взаимодействие высокомолекулярного гепарина с катионами La (III), Pr (III), Nd (III) / С.И. Кузьмина, А.Н. Семенов, М.А. Феофанова, Ю.В. Францева, С.С. Шафранович // Вестник ТвГУ. Сб. науч. тр. Серия «Химия». – 2008, №8. С. 29 – 34.
- Семенов, А.Н. Взаимодействие гепарина с катионами меди и цинка / А.Н. Семенов, Ю.В. Францева, М.А. Феофанова // Физико-химия полимеров. Сб. науч. тр. – 2009, Вып. 15. С. 116 – 122.
- Францева, Ю.В. Комплексообразование ионов меди и цинка с высокомолекулярным гепарином / Ю.В. Францева, А.Н. Семенов // Тез. докл. XIX Росс. Молодежной науч. конф. «Проблемы теоретической и экспериментальной химии». Екатеринбург, 2009. С. 69.
- Францева, Ю.В. Комплексообразование ионов меди и цинка с высокомолекулярным гепарином / Ю.В. Францева, А.Н. Семенов // Материалы докладов XVI Международной конференции студентов, аспирантов и молодых ученых «Ломоносов» / Отв. ред. И.А. Алешковский, П.Н. Костылев, А.И. Андреев. [Электронный ресурс] — М.: МАКС Пресс, 2009. — 1 электрон. опт. диск (CD-ROM); 12 см.
- Францева, Ю.В. Комплексообразование ионов Cu2+ и Zn2+ с высокомолекулярным гепарином // VIII науч. конф. аспирантов и студентов химического факультета Тверского гос. ун-та. Тезисы докладов. Тверь: Тверской гос. ун-т, 2009. С. 49.
- Францева, Ю.В. Комплексообразование гепарина с ионами некоторых микроэлементов / А.В. Гуманюк, Т.В. Трофимова, Ю.В. Францева // IX науч. конф. аспирантов и студентов химического факультета Тверского гос. ун-та. Тезисы докладов. Тверь: Тверской гос. ун-т, 2010. С. 22.
- Гуманюк, А.В. Комплексообразование высокомолекулярного гепарина с ионами кобальта (II) и никеля (II) / А.В. Гуманюк, Т.В. Трофимова, Ю.В. Францева, А.Н. Семенов, М.А. Феофанова // Физико-химия полимеров. Сб. науч. тр. – 2010, Вып. 16. С. 231 – 236.
- Францева, Ю.В. Исследование комплексообразования высокомолекулярного гепарина с ионами некоторых микроэлементов / Ю.В. Францева, М.А. Феофанова, А.Н. Семенов // Сб. тезисов докладов и сообщений XVII Всеросс. конф. «Структура и динамика молекулярных систем». Уфа – Казань – Москва – Йошкар-Ола, 2010. С. 207.
- Францева, Ю.В. Исследование комплексообразования высокомолекулярного гепарина с ионами некоторых микроэлементов / Ю.В. Францева, М.А. Феофанова, А.Н. Семенов // Тезисы докладов и сообщений XVIII Всероссийской конференции. Структура и динамика молекулярных систем 28 июня – 2 июля 2010. С. 101.
- Францева, Ю.В. Комплексообразование высокомолекулярного гепарина с ионами некоторых 3-d металлов (Ni2+, Co2+, Mn2+, Fe2+) / Ю.В. Францева, А.В. Гуманюк, Т.В. Трофимова // Тез. докл. VIII Росс. Молодежной науч. конф. «Проблемы теоретической и экспериментальной химии». Екатеринбург, 2010. С. 107.
- Францева, Ю.В. Взаимодействие гепарина с ионами некоторых d-элементов (Ni2+, Co2+, Mn2+, Fe2+) / Ю.В. Францева, А.В. Гуманюк, Т.В. Трофимова // XVII Региональные Каргинские чтения: Тезисы докладов. Тверь, 2010. С. 90.
- Смешаннолигандное комплексообразование ионов никеля и меди с гепарином и некоторыми аминокислотами // Ю.В. Францева, А.В. Гуманюк, Т.В. Трофимова // XVIII Региональные Каргинские чтения: Тезисы докладов. Тверь, 2011. С. 92.
- Францева, Ю.В. Комплексообразование гепарин-ион металла / Ю.В. Францева, М.А. Феофанова, Н.В. Баранова / Журнал «Международный журнал прикладных и фундаментальных исследований». № 12, 2011. С 92.
- Францева, Ю.В. Смешанолигандное комплексообразование ионов в системе гепарин-аминокислота-металл / Ю.В. Францева, В.В. Новикова // X науч. конф. аспирантов и студентов химического факультета Тверского гос. ун-та. Тезисы докладов. Тверь: Тверской гос. ун-т, 2011. С. 33.
- Францева, Ю.В. Физико-химические исследования гепаринатов 3-d переходных металлов / Ю.В. Францева, М.А. Феофанова, В.В. Новикова // Материалы V Всероссийского с международным участием медико-биологического конгресса молодых ученых, г. Тверь, ТвГУ, 2012. С. 194–195.
- Францева, Ю.В. Ионно-молекулярные равновесия в системах: ион биометалла (Cu(II), Ni(II) и Co(II)), высокомолекулярный гепарин – аминокислота аргинин / Е.В. Потеха, М.И. Скобин, Т.В. Крюков, И.А. Тормозова, Б.А. Кустарев, Ю.В. Францева // XII науч. конф. аспирантов и студентов химического факультета Тверского гос. ун-та. Тезисы докладов. Тверь: Тверской гос. ун-т, 2013. С. 38.
- Францева, Ю.В. Композиции на основе биополимера гепарина, биометаллов и аминокислот / М.А. Феофанова, Н.В. Баранова, Ю.В. Францева, М.И. Скобин // Сборник тезисов докладов и сообщений. XX Всероссийская конференция «Структура и динамика молекулярных систем» и 11-я Международная школа молодых ученых «Синтез, структура и динамика молекулярных систем», 2013. С. 120.
Технический редактор А.В. Жильцов
Подписано в печать 25.11.2013. Формат 60x84 1/16.
Усл. печ. л. 1,5. Тираж 100. Заказ № 465.
Тверской государственный университет
Редакционно-издательское управление
Адрес: 170100, г. Тверь, ул. Желябова, 33.
Тел. РИУ (4822) 35-60-63.

