Кинетические закономерности и механизм жидкофазного окисления винилпиридинов
На правах рукописи
Казнина Марина Александровна
Кинетические закономерности и механизм жидкофазного окисления винилпиридинов
02.00.04 – Физическая химия
автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново 2013
Работа выполнена на кафедре общей и физической химии
федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Ярославский государственный университет им. П. Г. Демидова»
Научный руководитель:
| доктор химических наук, профессор | Плисс Евгений Моисеевич |
Официальные оппоненты:
| доктор химических наук, профессор | Касаикина Ольга Тарасовна (ФГБОУ ВПО «Московский государственный университет им. М.В. Ломоносова», профессор кафедры коллоидной химии) |
| доктор химических наук, профессор | Лефедова Ольга Валентиновна (ФГБОУ ВПО «Ивановский государственный химико-технологический университет», профессор кафедры физической и коллоидной химии) |
| Ведущая организация: | ФГБУН «Институт органической химии им. Н.Д.Зелинского РАН» (г. Москва) |
Защита состоится «__» _________ 2013 г. в __:__ на заседании диссертационного совета Д 212.063.06 при Ивановском государственном химико-технологическом университете по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 7.
Тел.: (4932) 32-54-33, факс: (4932) 32-54-33, e-mail: [email protected]
С диссертацией можно ознакомиться в Информационном центре Ивановского государственного химико-технологического университета по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 10
Автореферат разослан «___» _____________ 2013 г.
| Ученый секретарь совета Д 212.063.06 e-mail: [email protected] | Егорова Елена Владимировна |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Реакции жидкофазного окисления винильных соединений имеют большое практическое значение для химии и химической технологии. Химический анализ таких процессов является весьма важной научной задачей, сочетающей несомненную практическую ценность с фундаментальным характером проводимых исследований. Радикально-цепной механизм данного процесса сформулирован уже давно, однако многие важные его аспекты до настоящего времени остаются нераскрытыми. Особое место здесь принадлежит исследованию кинетики элементарных реакций, что в столь сложной системе возможно только при использовании всего арсенала современной физической химии.
В настоящее время изучен и установлен механизм окисления многих классов непредельных соединений: классических винильных мономеров (стирол, акрилаты, метакрилаты и т.п.), аллильных соединений, 1,2-замещенных этилена и 1,4замещенных бутадиена. Исключением в этом ряду являются винилпиридины, для которых не только не установлен механизм окисления, но и практически отсутствуют систематические данные о кинетических закономерностях их взаимодействия с кислородом. Интерес к установлению механизма окисления винилпиридинов диктуется тем обстоятельством, что в органической химии существует представление о том, что пиридиновое кольцо аналогично таковому в стироле, в то же время наличие в данном кольце атома азота, и, соответственно, изменение распределения в нем электронной плотности, может придавать процессу особую специфику.
Постановка такой работы представляет значительный интерес и для химической технологии, поскольку винилпиридины используются для синтеза сополимеров, которые в виде латексов широко применяются в качестве различного рода адгезивов, покрытий, клеев, а также в производстве шин и синтетического каучука. При этом, как и другие винильные соединения, винилпиридины, являются полимеризационноспособными веществами, поэтому их стабилизация является одной из важных задач химической технологии.
Для решения этой задачи необходимо получение обширной кинетической информации по элементарным реакциям исследуемых соединений, изучение продуктов их окисления, анализ связи между структурой реагирующих частиц и их реакционной способностью, установление детального механизма ингибирования и поиск эффективных антиоксидантов процессов окисления.
Настоящая работа является частью НИР, проводимых в Ярославском государственном университете им. П. Г. Демидова, и выполнена в рамках ФЦП Минобрнауки РФ «Научные и научно-педагогические кадры инновационной России» (проекты: «Кинетическое и квантово-химическое исследование реакционной способности химически и электрохимически генерируемых радикалов, анион-радикалов и анионов в элементарных жидкофазных реакциях с органическими соединениями», Госконтракт № П2272, «Термодинамика и кинетика элементарных гомолитических и гетеролитических реакций стабильных и лабильных радикалов и анион-радикалов в химических, электрохимических и биохимических процессах» Госконтракт Роснауки № 02.740.11.0636) и Тематического плана Минобрнауки (проект: «Теоретическое и экспериментальное исследование роли полярных эффектов в цепных реакциях лабильных и стабильных радикалов в конденсированной фазе»).
Целью работы явилось установление механизма неингибированного и ингибированного окисления винилпиридинов.
Для ее реализации необходимо решить следующие задачи:
• провести кинетическое исследование механизма инициированного окисления винилпиридинов;
• проанализировать состав первичных продуктов окисления исследуемых соединений;
• изучить реакционную способность винилпиридинов в реакциях с пероксирадикалами;
• исследовать кинетические закономерности окисления винилпиридинов в присутствии стабильных нитроксильных радикалов и продуктов их превращения.
Научная новизна. Проведен сравнительный квантово-химический анализ основных структурных и электронных параметров стирола и винилпиридинов (2-винилпиридин,4-винилпиридин, 2-метил-5-винилпиридин). Полученные результаты свидетельствуют о близости электронного строения этих соединений, что позволяет рассматривать винилпиридины как близкие аналоги стирола в радикальных реакциях присоединения к двойной связи. Однако, наличие атома азота в винилпиридинах приводит к некоторым различиям в реакционной способности -связей, как в ряду исследуемых мономеров, так и при их сравнении со стиролом.
Впервые изучен состав первичных продуктов инициированного окисление винилпиридинов; определены кинетические параметры процесса. Показано, что окисление винилпиридинов протекает по радикально-цепному механизму с квадратичным обрывом цепей, при этом ведущим цепи окисления является полипероксирадикал.
Впервые методом Говарда-Ингольда определены значения констант скорости присоединения кумил- и трет.-бутилпероксирадикалов к изучаемым мономерам. Обнаружено, что изменение константы скорости происходит симбатно изменениям в значениях электронной плотности двойной связи и энергии стабилизации образующегося в акте присоединения радикального аддукта.
Исследованы кинетические закономерности окисления винилпиридинов в присутствии ингибиторов разных классов (фенолы, ароматические амины, соединения переходных металлов). Обнаружен многократный обрыв цепей на молекулах введенных ингибиторов.
На основании изучения кинетики поглощения кислорода в окисляющихся винилпиридинах в присутствии циклических нитроксильных радикалов (пипиридинового, пирролинового рядов) и соответствующих им гидроксиламинов и анализа данных ЭПР-спектроскопии установлен механизм ингибированного стабильными нитрокисльными радикалами процесса окисления виннилпиридинов. Обнаружен эффект многократного обрыва цепей на стабильных нитроксильных радикалах, который с помощью кинетического компьютерного моделирования объяснен реакцией пероксидных радикалов субстрата с нитроксильными радикалами и продуктами их превращения – гидроксиламинами.
Положения, выносимые на защиту
• механизм инициированного окисления винилпиридинов;
• механизм регенерации стабильных нитроксильных радикалов в окисляющихся винилпиридинах.
Научно-практическая ценность. Полученная обширная кинетическая информация о детальном механизме ингибированного и неингибированного окисления является научной основой регулирования процессов синтеза, хранения и переработки винилпиридинов в изделия.
Важное практическое значение имеет обнаруженное явление эффективной регенерации ингибиторов при окислении исследуемых соединений, позволяющее длительно тормозить процесс малыми добавками антиоксидантов.
Апробация работы. Основные положения диссертации докладывались и обсуждались на следующих конференциях: XXII Симпозиум «Современная химическая наука» (г.Туапсе, 2010г.); Международная конференция «Биоантиоксидант» (г.Москва, 2010г.); V международная конференция «Современные проблемы физической химии» (Украина, г. Донецк, 2011г.); Международная научно-практической конференция «Современные проблемы биологии, экологии, химии» (г. Ярославль, 2011г.); XXV Юбилейная Международная научно-техническая конференция, посвященная памяти академика АН РБ Рахманкулова Д.Л. «Химические реактивы, реактивы и процессы малотоннажной химии» (г. Уфа, 2011г.); 50-я Юбилейная международная научно-студенческая конференция «Студент и научно- технический прогресс» (г. Новосибирск, 2012 г.); 65-я Всероссийская научно-техническая конференция студентов, магистров и аспирантов с международным участием (г. Ярославль, 2012 г.); Международная научно-техническая конференция «Наукоемкие химические технологии 2012» (г. Тула, 2012 г.); Международная конференция молодых ученых и V школа им. академика Н. М. Эмануэля «Окисление, окислительный стресс, антиоксиданты» (г. Москва – г. Ереван, 2012 г.).
Публикации. По результатам работы опубликовано 3 статьи в рекомендованных ВАК журналах и 9 тезисов докладов на Международных и Всероссийских конференциях.
Объем и структура работы. Диссертация состоит из введения, 5 глав, заключения и списка использованных источников. Работа изложена на 117 страницах, включая 76 рисунков и 23 таблицы. Список использованных источников включает 113 наименования.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Введение
Во введении обоснована актуальность исследования, сформулированы цели и основные задачи работы.
Глава 1. Обзор литературы
Проанализированы литературные данные о механизме окисления непредельных соединений. Охарактеризованы механизмы действия ингибиторов разных классов.
Глава 2. Экспериментальная часть
Изучение кинетики инициированного окисления без ингибиторов и в их присутствии проводилось с помощью микроволюмометра высокой чувствительности с ячейкой, конструкция которой позволяет добавлять необходимые компоненты без ее снятия. Продукты окисления анализировали методами йодометрического титрования и полярографии. За изменением концентрации стабильных нитроксильных радикалов следили методом спектроскопии ЭПР. Для установления механизмов и измерения кинетических параметров использовали методы инициаторов и ингибиторов. Значения констант скорости присоединения кумил- и трет.-бутилпероксирадикалов к изучаемым мономерам определяли методом Говарда-Ингольда. Квантово-химические расчеты проводились полуэмпирическим методом AM1 и ab initio методом функционала плотности B3LYP/631G(d, p ). Экспериментальные результаты обрабатывали с помощью пакета программ MS Office 2007. Кинетическое компьютерное моделирование осуществляли с использованием программы «Кинетика - 2012».
Глава 3. Кинетические закономерности и механизм окисления винилпиридинов
Кинетические закономерности процесса. Кинетика инициированного азо-бис-изобутиронитрилом (АИБН) окисления 2-винилпиридина (2-ВП), 4-винилпиридина (4-ВП), 2-метил-5-винилпиридина (МВП) исследовалась в температурном диапазоне 313 – 333 K в среде инертного растворителя хлорбензола (ХБ), поскольку неразбавленные мономеры окисляются с высокой скоростью уже без добавок инициатора. Скорость окисления (W) прямо пропорциональна концентрации мономера (рис. 1), корню квадратному из скорости инициирования (Wi0,5) и не зависит от парциального давления кислорода в диапазоне 20 – 100 кПа.
Следовательно, данный процесс подчиняется формально-кинетическим закономерностям радикально-цепного окисления винильных мономеров, которое при доминирующей реакции присоединения описывается схемой 1. Скорость окисления в соответствии с данной схемой подчиняется уравнению
W = k2/(k60,5)·[M]·Wi 0,5 (1)
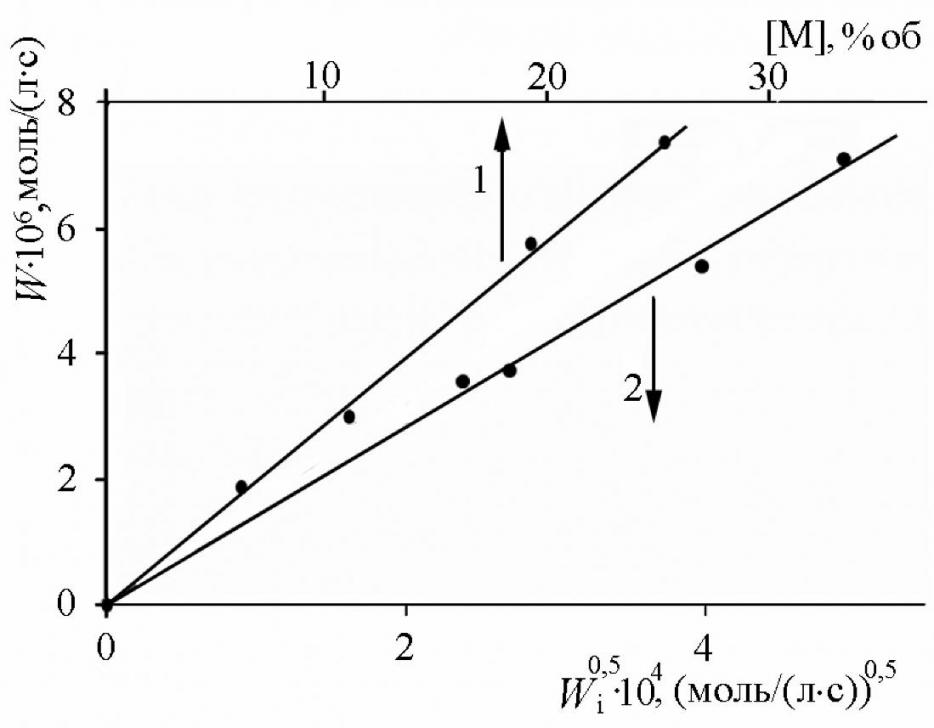 | Рис. 1. Зависимости скорости окисления МВП (323 K, Po2 = 20 кПа) от [МВП] (1) и от Wi0,5 (2) 1 – Wi = 1,210-7 моль/(лс); 2 – [МВП] = 2,0 моль/л |
Схема 1
Инициатор ![]() M• (i)
M• (i)
M• + O2 MO2• (1)
MO2• + M MOOM• (M•) (2)
MO2• + MO2• молекулярные продукты (6)
где м – молекула винилпиридина; (нумерация реакций здесь и далее соответствует общепринятой для радикально-цепных процессов окисления).
В соответствии с уравнением (1) рассчитаны значения k2/k60,5 (табл. 1).
Значения k2/k60,5 для винилпиридиновых мономеров
Таблица 1
| Мономер | k2/k60,5103, [л/(мольс)]0,5 | ||
| 313 K | 323 K | 333 K | |
| Стирол * | 8,85 | 13,7 | 20 |
| 2-ВП | 6,3±0,3 | 9,2±0,5 | 15,0±0,2 |
| 4-ВП | 5,3±0,7 | 8,7±0,4 | 12,5±0,6 |
| МВП | 9,7±0,4 | 18,4±0,9 | 23,6±1,0 |
* Могилевич М.М., Плисс Е.М. Окисление и окислительная полимеризация непредельных соединений. – М.: Химия, 1990. – 240 с.
Как видно из таблицы, по окисляемости винилпиридины близки к стиролу. Этот результат в первом приближении можно считать аргументом в пользу существующего в органической химии представления о том, что пиридиновая система является аналогом бензольного кольца.
Анализ первичных продуктов окисления. Исследуемые мономеры могут иметь разные реакционные центры. Известно, что в структуре МВП помимо двойной связи имеется еще одна реакционно-способная группа – атом водорода в -положении к атому азота и двойной связи. Не исключено, что окисление данного мономера может происходить и по реакции отрыва указанного атома водорода. С целью установления места атаки проведен анализ пероксидных продуктов окисления винилпиридинов методами йодометрического титрования и полярографии (табл. 2).
Продукты окисления винилпиридинов
Таблица 2
| Мономер | [O2]102, моль/л | [ROOH]104, моль/л; (йодометрическое титрование) | [-O-O-]102,моль/л; (полярография) |
| 2-ВП | 2,1 6,1 | < 3 < 5 | 1,9 6,0 |
| 4-ВП | 2,1 6,1 | < 3 < 5 | 2,1 5,9 |
| МВП | 2,1 | 22,1 | 2,0 |
Видно, что при окислении 2-ВП и 4-ВП гидропероксид практически не образуется, а при окислении МВП его доля составляет до 10% от полипероксида. Следовательно, если при окислении 2-ВП и 4-ВП доминирует реакция присоединения пероксидных радикалов по двойной связи, то в случае МВП реализуется смешанный механизм: происходит как присоединение MO2• к связи, так и отрыв этими радикалами атомов водорода от С–Н связей.
Реакционная способность винилпиридинов в реакциях с кумил и трет.-бутилпероксирадикалами. Методом Говарда-Ингольда измерены константы скорости присоединения пероксирадикалов кумила (ГПК) и трет.-бутила (ГПТБ) к двойным связям исследуемых мономеров. Зависимость скорости инициированного АИБН окисления 4ВП от концентрации ГПК приведена на рис. 2.
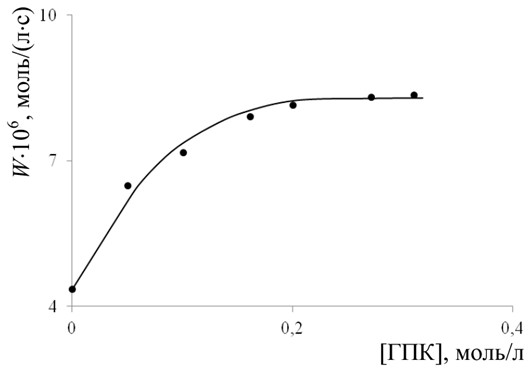
Согласно теории метода, при концентрациях ГПК или ГПТБ, соответствующих постоянной скорости окисления (т.н. предельной скорости, когда все радикалы MO2• мономера заменены на RO2• гидропероксида), реализуется следующая кинетическая схема процесса (схема 2).
Схема 2
Инициатор ![]() M• (i)
M• (i)
M• + O2 MO2• (1)
MO2• + M M• (2)
MO2• + ROOH MOOH + RO2• (обмен)
RO2• + M M (2')
RO2• + RO2• ROOR + O2 (6')
W = k'2/(k'60,5)·[M]·Wi 0,5 (2)
Значения констант скоростей реакции присоединения кумил и трет.-бутилпероксирадикалов к винилпиридинам
Таблица 3
| Мономер | ||
| PhC(CH3)2COO• | (CH3)3COO• | |
| МВП | 18,0 ± 0,9 | – |
| 2-ВП | 5,8 ± 0,3 | 2,8 ± 0,13 |
| 4-ВП | 5,1 ± 0,2 | 2,8 ± 0,13 |
При известных значениях k'6 рассчитаны значения k'2 (табл. 3). Приведенные в таблице экспериментальные данные позволяют сделать вывод, что изменение реакционной способности происходит в ряду МВП > 2ВП 4 ВП.
Используя полученные значения k'2 для радикалов (CH3)3COO• и известные величины электронной плотности двойной связи () и энергии стабилизации образующегося радикального аддукта (EC) для ряда других винильных мономеров (Могилевич М.М., Плисс Е.М.), построены корреляционные зависимости lg(k'2) от указанных индексов реакционной способности (рис 3, 4).
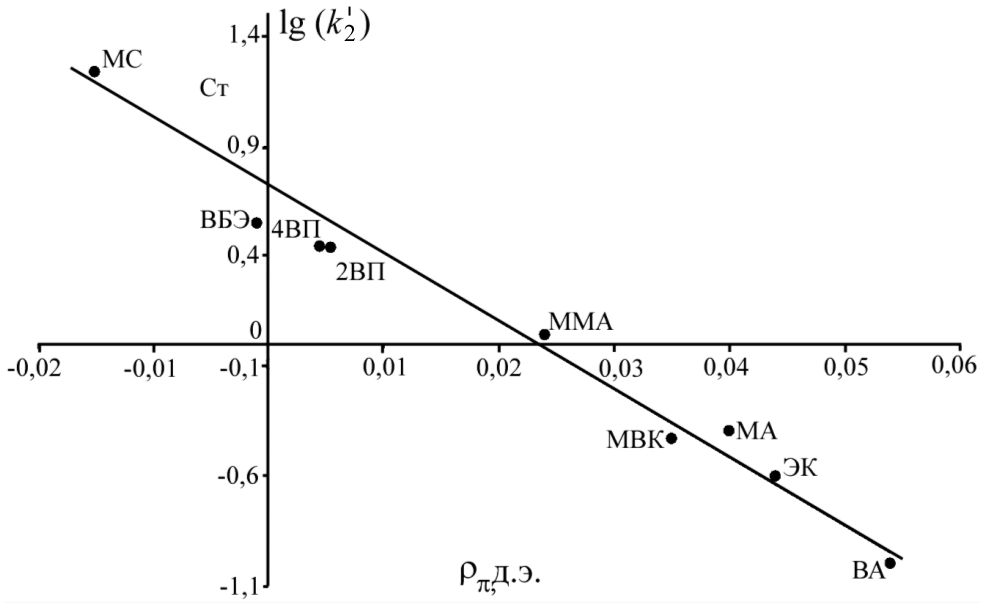 | 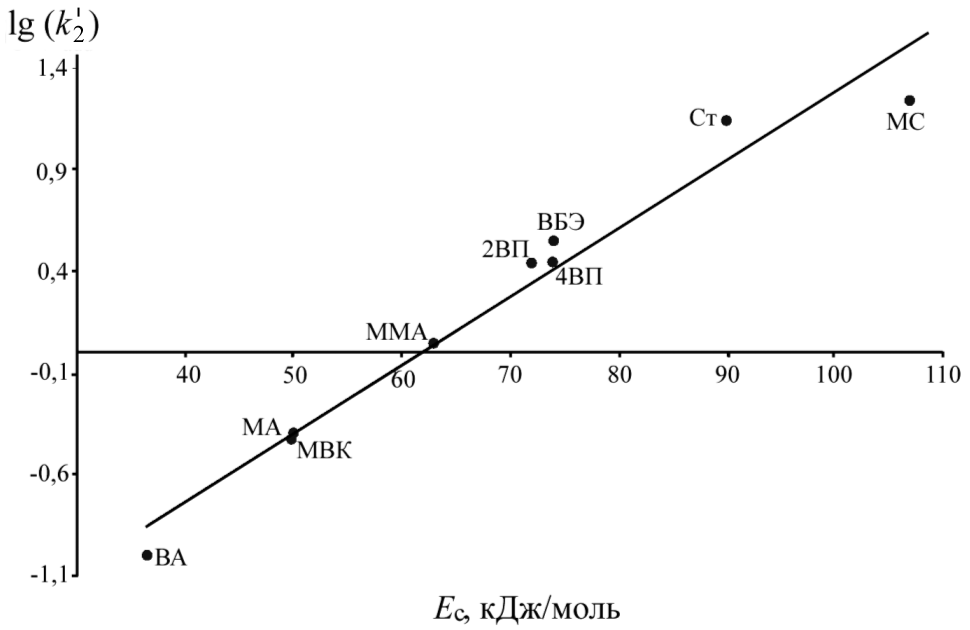 |
| Рис. 3. Зависимость lg(k'2) от для присоединения (CH3)3COO• к винильным мономерам | Рис. 4. Зависимость lg(k'2) от ЕС для присоединения (CH3)3COO• к винильным мономерам |
Как видно из рисунков, полученные для винилпиридинов константы скорости хорошо укладываются в линейную корреляцию для всего массива винильных соединений. Эти факты свидетельствуют о том, что для исследуемых объектов справедливы подходы, применяемые для анализа реакционной способности винильных мономеров. Во-первых, снижение константы скорости совпадает с уменьшением электронной плотности двойной связи. Во-вторых, реакция присоединения MO2• + CH2=C(X1)(X2) протекает через переходное состояние типа комплекса с переносом заряда ![]() . Следовательно, стабилизация такого радикального аддукта имеет существенное значение.
. Следовательно, стабилизация такого радикального аддукта имеет существенное значение.
Глава 4. Окисление винилпиридинов в присутствии
классических ингибиторов окисления
В настоящей работе исследовано влияние на процесс окисления винилпиридинов фенолов (2,6-ди-трет.-бутил-4-метилфенол(ионол) и 2-метилгидрохинон), дифениламина и соединений переходных металлов (хлорид меди II и ацетат меди II). Окисление в присутствии ингибиторов разных классов проводилось при 323 K в режиме инициированного АИБН окисления. На рис. 5, 6 представлены типичные кинетические зависимости поглощения кислорода при ингибированном окислении винилпиридинов. Видно, что в начальный момент времени зависимости имеют линейный характер, и с ростом концентрации ингибитора скорость окисления падает. При переходе от Po2 = 20 кПа к Po2 = 100 кПа скорость окисления фактически не меняется. Скорость окисления остается практически постоянной длительное время, значительно превышающее теоретический период индукции (рис. 7). Эти факты свидетельствую о том, что в общем случае окисление винилпиридинов в изученных ингибиторах подчиняется формально-кинетической схеме, справедливой для других винильных мономеров (схема 3).
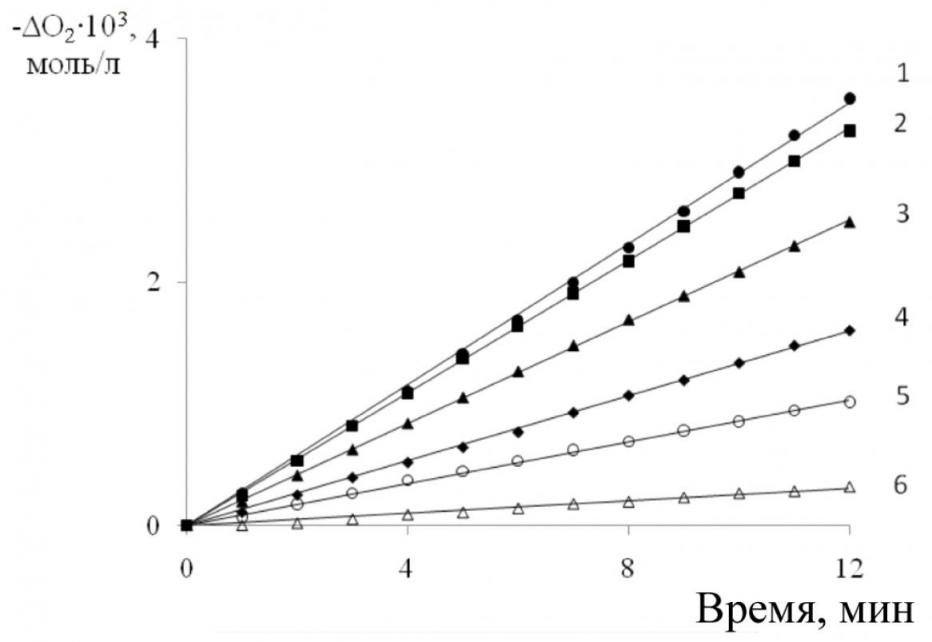 | 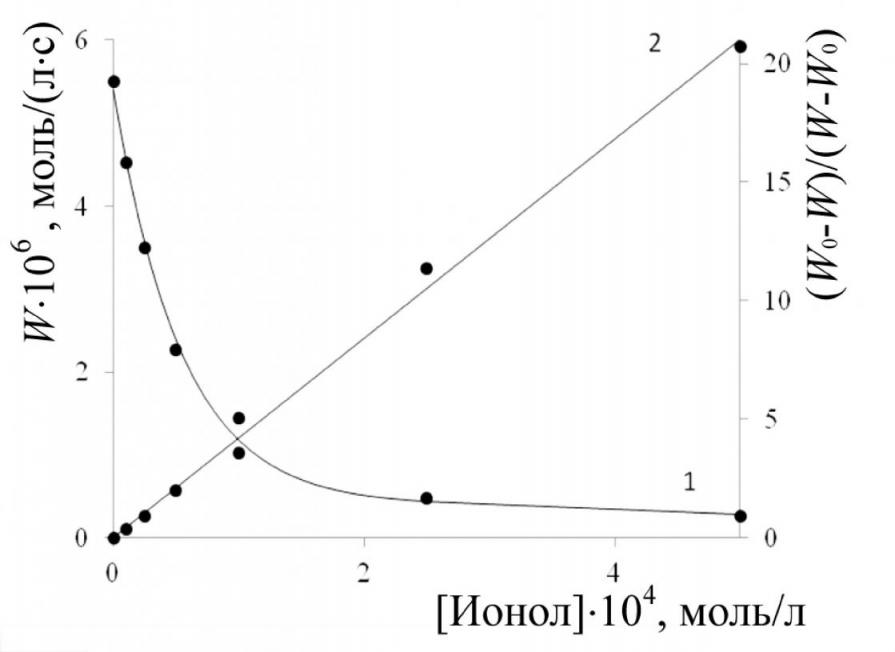 |
| Рис. 5. Кинетика поглощения кислорода при окислении 2-ВП в присутствии ионола; Wi = 1,2·10-7 моль/(л·с): [2-ВП]= 1,8 моль/л; [Ионол]104, моль/л: 1 – 0;2 – 1,0;3 – 2,5; 4 – 5,0;5 – 10,0; 6 –25,0 | Рис. 6. Зависимость скорости окисления (W) 2ВП от концентрации ингибитора (1) и анаморфозы этой кривой (2): [2-ВП] = 1,8 моль/л; Wi = 1, 2·10-7 моль/(л·с) |
![Кинетика поглощения кислорода при окислении 2-ВП:[2-ВП] = 1,8-10](/images1/404303/10-kinetika-pogloscheniya-kisloroda-pri.jpg) | Рис. 7. Кинетика поглощения кислорода при окислении 2-ВП: [2-ВП] = 1,8 моль/л; Wi = 1, 210–7 моль/(лc); Po2 = 20 кПа; теор=14 мин: 1 – [CuCl2]0 = 0; 2 – [CuCl2]0 = 9,510–5 моль/л |
Схема 3
I ![]() M• (i)
M• (i)
M• + O2 MO2• (1)
MO2• + M MOOM• ( M•) (2)
2MO2• молекулярные продукты (6)
MO2• + InH МООН + In• (7)
МO2• + In• молекулярные продукты (8)
Для схемы (3) справедливо следующее уравнение:
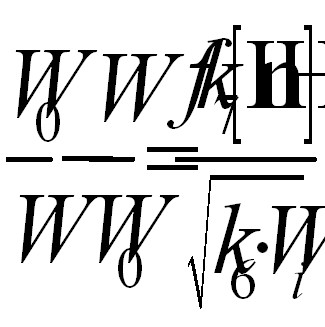 (3)
(3)
Поскольку абсолютное значение k6 для винилпиридинов неизвестно, в качестве характеристики эффективности действия антиоксидантов рассчитаны значения параметра fk7k6-0,5 (табл. 4). Приведенные в таблице значения f являются лишь нижней границей, поскольку измеренная величина соответствует лишь длительности проведенного опыта, и с увеличением его протяженности будет возрастать. Поэтому в таблице приведены значения не стехиометрического, а кинетических коэффициентов ингибирования.
Параметры антиоксидантной активности исследованных ингибиторов
Таблица 4
| Мономер | Ингибитор | fk7k6-0,5, [л/(мольс)]0,5 | f |
| 2-ВП | МГХ | 13,10 ± 0,65 | > 13 |
| Ионол | 1,50 ± 0,08 | – | |
| ДФА | 5,70 ± 0,29 | – | |
| CuCl2 | 10,60 ± 0,53 | > 6 | |
| Cu(СН3СOO)2 | 15,88 ±0,79 | – | |
| 4-ВП | МГХ | 17,20 ± 1,86 | >11 |
| Ионол | 0,35 ± 0,02 | – | |
| Cu(СН3СOO)2 | 17,13 ± 0,86 | – | |
| МВП | ДФА | 2,11 ± 0,11 | – |
| Ионол | 2,97 ± 0,15 | – | |
| Cu(СН3СOO)2 | 24,07 ± 1,20 | – |
Приведенные результаты (табл. 4) позволяют заключить, что фенолы, амины и соединения переходных металлов длительно тормозят окисление винилпиридинов. Обнаруженный при этом факт многократного обрыва цепей свидетельствует о том, что реакция (8) схемы 3 приводит к образованию продуктов, участвующих в обрыве цепей. Химическая природа этих соединений неизвестна. Можно лишь предполагать протекание реакции (8) по механизму диспропорционирования, что приводит к восстановлению исходной формы ингибитора. Еще одно предположение связано с тем, что в процессе окисления в результате изомеризации пероксирадикала образуется гидропероксидный радикал HO2•, обладающий окислительно-восстановительными свойствами. Если это предположение верно, то при неингибированном окислении в составе продуктов окисления должен присутствовать пероксид водорода (H2O2). Однако попытки его обнаружить с помощью соответствующего селективного реагента – каталазы – не увенчались успехом. Возможно также, что H2O2 при окислении действительно не образуется, а многократный обрыв обусловлен реакциями пероксирадикалов субстратов с некоторыми продуктами окисления ингибиторов, природа которых не установлена. Не исключено также, что в среде винилпиридинов каталаза может утрачивать своё каталитическое действие.
Глава 5. Кинетические закономерности и механизм окисления винилпиридинов в присутствии стабильных нитроксильных радикалов и продуктов их превращения
Окисление в присутствии нироксильных радикалов (>NO•) и соответствующих им гидроксиламинов (>NOН) проводилось при 323 K в режиме инициированной АИБН реакции. На рис. 8 приведены типичные кинетические зависимости поглощения кислорода при окислении винилпиридинов в присутствии >NO•. В начальный момент времени зависимости имеют линейный характер. При введении в окисляющиеся винилпиридины как >NO•, так и соответствующего >NOH, скорость окисления сохраняется ниже значения скорости неингибированного окисления в течение длительного времени, значительно превышающего теоретический период индукции (рис. 9). При введении в субстрат >NOH в концентрации, соответствующей [>NO•]0, наблюдается быстрое накопление нитроксильного радикала и его дальнейшее расходование со скоростью, близкой к скорости расходования исходного >NO• (рис. 10).
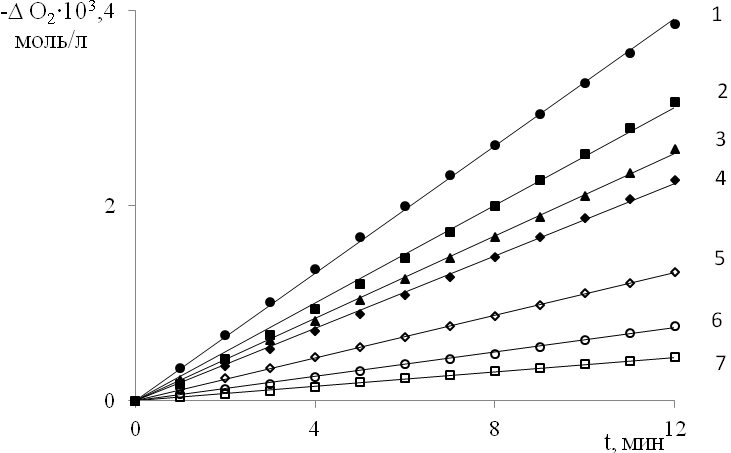 | Рис. 8. Кинетика поглощения кислорода при окислении 4ВП в присутствии >NO• (4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксил): Wi = 3,8·10-7 моль/(л·с); [4-ВП] = 2,8 моль/л; Po2 = 20 кПа; [>NO•]105, моль/л: 1 – 0; 2 – 0,3; 3 – 0,5; 4 – 1,0; 5 – 2,5; 6 – 5,0; 7 – 10,0 |
Совокупность представленных результатов позволяет заключить, что стабильные нитроксильные радикалы, во-первых, тормозят окисление винилпиридинов, реагируя не только с алкильными, но и с пероксидными радикалами, и, во-вторых, регенерируются в данном процессе. Наличие процесса регенерации подтверждается данными табл. 5, где приведены кинетические коэффициенты ингибирования.
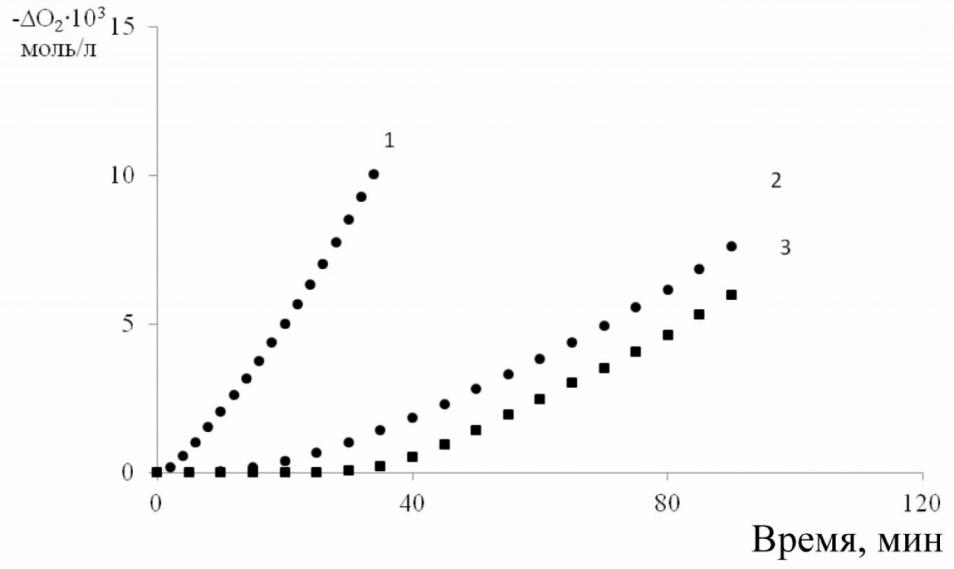 | Рис. 9. Кинетика поглощения кислорода при окислении 2-ВП в присутствии >NO• (4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксил) [2-ВП] = 1,8 моль/л. Wi = 2,110–7 моль/(лc); | |
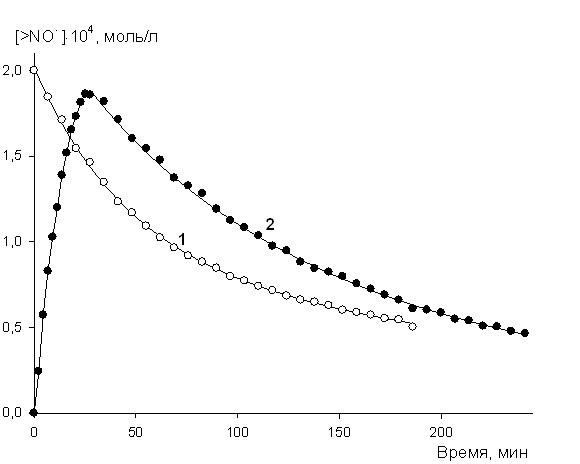 | Рис. 10. Кинетика расходования (1) >NO• (4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксил) и его накопления и расходования (2) из соответствующего гидроксиламина >NOH при окислении МВП: Wi = 2107 моль/(лс), Po2 = 20 кПа; 323 K | |
Параметры антиоксидантной активности исследованных ингибиторов
Таблица 5
| Ингибитор | [InH]104, моль/л | Pо2, кПа | W106, моль/(лс) | f |
| 4-гидрокси-2,2,6,6-тетраметилпиперидин -1-оксил >NO(I) | 4,95 | 20 | 2,53 | >30 |
| 4-бензоилокси-2,2,6,6- тетраметилпиперидин-1-оксил >NO(II) | 4,29 | 20 | 2,14 | >32 |
| 4,22 | 100 | 2,31 | >29 | |
| 2,2 | 20 | 2,58 | >35 | |
| 2,2,5,5-тетраметил-2,5-дигидро-1Н-пиррол-3-карбоксамид-1-оксил >NO(III) | 4,45 | 20 | 4,27 | >28 |
Аналогичные результаты ранее были получены для стирола и ряда других винильных мономеров. Поэтому механизм ингибированного >NO• окисления винилпиридинов в первом приближении может быть описан схемой 4.
Схема 4
| Инициатор | MO2• + >NO•>NOH + продукты (7.1) |
| M• + O2 MO2• (1) | MO2• + >NOH—MOOH + >NO• (7.2) |
| MO2• + MM• (2) | M• + >NO•>NOM (8) |
| MO2• + MO2•продукты (6) | M• + >NOHMH + >NO• (9) |
Для подтверждения экспериментальных данных проведено компьютерное кинетическое моделирование изучаемого процесса. Пример такого моделирования приведен на рис. 11. Использованные при моделировании константы скорости взяты из литературы по аналогии с соответствующими реакциями винильных мономеров и стабильных нитроксильных радикалов (Е.М. Плисс, Р.Л. Сафиуллин, С.С. Злотский. Ингибированное окисление непредельных соединений. Кинетика, механизм, связь структуры с реакционной способностью // Saarbruchen: LAP LAMBERT Academic Publishing. – 2012 – 130 p.). Корректность принятых величин констант скорости проверялась с помощью термохимических расчетов по известной процедуре.
![Кинетика поглощения кислорода при окислении 2-ВП (323 K):[2-ВП] =-19](/images1/404303/19-kinetika-pogloscheniya-kisloroda-pri.jpg)
Рис. 11. Кинетика поглощения кислорода при окислении 2-ВП (323 K):
[2-ВП] = 1,8 моль/л; Po2 = 20 кПа;
1 – [>NO•(III)]0 = 4,510–4 моль/л; Wi = 2,4210–7 моль/(лc);
2 – [>NO•(III)]0 = 4,510–4 моль/л; Wi = 2,64 10–7 моль/(лc);
3 – [>NOH(III)]0 = 4,510–4 моль/л; Wi = 2,42 10–7 моль/(лc);
4 – [>NOH(III)]0 = 4,010–4 моль/л; [>NO•(III)]0 = 4,010–5 моль/л;
Wi = 2,9710–7 моль/(лc); k1 = 1108 л/(мольс); k2 = 100 л/(мольс); k6 = 8107 л/(мольс); k7.1 = 2104 л/(мольс); k7.2 = 2106 л/(мольс); k8 = 1,8107 л/(мольс);
1, 3 – экспериментальные данные (точки); 2, 4 – результаты моделирования
Как видно из рисунков, результаты моделирования с использованием схемы 4 достаточно удовлетворительно описывают экспериментальные данные. Наблюдаемые различия, по-видимому, связаны с тем, что в схеме не учитываются возможные реакции образующегося алкоксиамина (>NOM) с пероксидными радикалами субстрата МO2• + >NOМ продукт + >NO•.
Не исключено также, что реакция (7.1) протекает не по механизму диспропорционирования, а путем образования триоксида, который в дальнейшем распадается с образованием нитроксильного радикала, либо гидроксиламина (Е.М. Плисс, Р.Л. Сафиуллин, С.С. Злотский).
МO2• + >NO• NOOOM + продукты (10)
NOOOM >NO• + продукты (11)
NOOOM >NOH + продукты (12)
ВЫВОДЫ
1. Методами AM1 и DFT B3LYP/6-31G(d,p) проведен сравнительный квантово-химический анализ структур стирола и винилпиридинов, а также структур переходных состояний реакций присоединения к двойной связи данных субстратов соответствующих перекисных радикалов. Показано, что по основным геометрическим и электронным параметрам структуры как реакционных центров стирола и винилпиридинов, так и переходных состояний различаются несущественно.
2. Методом микроволюмометрии впервые проведено кинетическое исследование механизма окисления винилпиридинов в температурном диапазоне 313-333 K. Установлено, что исследованные соединения окисляются по радикально-цепному механизму, характерному для других винильных мономеров класса 1,1-замещенных этилена с лимитирующей стадией присоединения полипероксидного радикала к двойной связи. Из кинетической схемы рассчитаны отношения константы скорости продолжения цепи к корню квадратному из константы скорости обрыва цепи (k2/k60,5), характеризующие способность винилпиридинов к окислению.
3. Методами йодометрического титрования и полярографии показано, что при окислении МВП образуется не только полипероксид, но и гидропероксид (до 10% от объема поглощенного кислорода). Это свидетельствует, что при окислении этого мономера атакуется не только двойная связь, но и -СН-связи.
4. Методом Говарда-Ингольда определены значения констант скорости присоединения кумил- и трет.-бутилпероксирадикалов к -связям винилпиридинов. На основании полученных результатов проведен сравнительный корреляционный анализ реакционной способности винилпиридинов и других винильных мономеров класса 1,1-замещенных этилена. Показано, что изменение константы скорости в ряду винилпиридинов происходит симбатно изменениям в значениях электронной плотности двойной связи и энергии стабилизации образующегося в акте присоединения радикального аддукта.
5. Исследованы кинетические закономерности окисления винилпиридинов в присутствии фенолов, ароматического амина и соединений переходных металлов. Обнаружен многократный обрыв цепей на молекулах введенных ингибиторов.
6. На основании изучения кинетики поглощения кислорода в окисляющихся винилпиридинах в присутствии >NO• и соответствующих им >NOН и анализа данных ЭПР-спектроскопии предложен механизм процесса. Показано, что обнаруженный эффект регенерации ингибиторов обусловлен участием >NO• и продуктов их превращения в реакциях с пероксирадикалами субстрата. Этот механизм подтвержден кинетическим компьютерным моделированием и анализом литературных данных.
Основные результаты диссертации опубликованы в следующих работах
1. Казнина М.А. «Кинетические закономерности и механизм окисления винилпиридинов»/М.А. Казнина, А.М. Гробов, И.В. Тихонов, Е.М. Плисс, А.И. Русаков//Башкирский хим. журнал. – 2011. – № 1. – С. 95–97.
2. Казнина М.А. «Реакционная способность винилпиридинов в реакциях с кумилпироксирадикалом»/М.А. Казнина, А.М. Гробов, А.В. Сирик, Е.М. Плисс, А.И. Русаков // Башкирский хим. журнал. – 2011. – № 2. – С. 12–14.
3. Казнина М.А. «Кинетика и механизм ингибированного стабильными нитроксильными радикалами окисления винилпиридинов»/М.А. Казнина, А.С.Копылова, А.М. Гробов, И.В. Тихонов, Е.М. Плисс//Башкирский хим. журнал. – 2012. – № 19. – С. 92–94.
4. Казнина М.А. «Кинетические закономерности и механизм окисления винилпиридинов»/М.А. Казнина, А.М. Гробов, А.С.Копылова, Е.М. Плисс // Мат. Международной конференции «Биоантиоксидант».– Москва, 2010. – С.124-125.
5. Казнина М.А. «Роль полярности среды в реакциях окисления винильных соединений»/М.А. Казнина, А.М. Гробов, А.В. Сирик, Е.М. Плисс//Тезисы XXII Симпозиума «Современная химическая наука». – Туапсе, 2010. – С.137-138.
6. Казнина М.А. «Кинетические особенности ингибированного окисления винилпиридинов» /М.А. Казнина, Е.С. Егорова, А.М. Гробов, И.В. Тихонов, Е.М. Плисс //Мат. V Международной конференции «Современные проблемы физической химии». – Донецк, 2011. – С.119.
7. Казнина М.А. «Антиоксидантная активность стабильных нитроксильных радикалов при окислении 2-винилпиридина»/М.А. Казнина, Е.С. Егорова, И.В. Тихонов, А.В. Сирик//Мат. Международной научно-практической конференции «Современные проблемы биологии, экологии, химии».– Ярославль, 2011. –С.274-279.
8. Казнина М.А. «Стабильные нитроксильные радикалы и соответствующие им гидроксиламины в реакциях ингибированного радикально - цепного окисления винилпиридинов»/М.А. Казнина, А.М. Гробов, А.С.Копылова, Е.М. Плисс//Мат. XXV Юбилейной Международной научно-технической конференции «Химические реактивы, реактивы и процессы малотоннажной химии». – Уфа, 2011. – С.54.
9. Казнина М.А.«Исследование радикально-цепных процессов окисления винилпиридинов в присутствии как стабильных нитроксильными радикалами, так и соответствующих им гидроксиламинов»/М.А. Казнина, А.С.Копылова//Мат. 50-й Юбилейной международной научно-студенческой конференции «Студент и научно- технический прогресс». – Новосибирск, 2012. – С.102.
10. Казнина М.А.Исследование процессов радикально-цепного окисления винилпиридинов в присутствии стабильных нитроксильных радикалов и соответствующих им гидроксиламинов / М.А. Казнина, А.С.Копылова, А.М. Гробов // Мат. 65-ой Всероссийской научно-технической конференции студентов, магистров и аспирантов с международным участием. – Ярославль, 2012. – С. 54.
11. Казнина М.А. «Ингибирование радикально-цепных процессов окисления винилпиридинов в присутствии стабильных нитроксильных радикалов и соответствующих им гидроксиламинов»/М.А. Казнина, А.С.Копылова, А.М. Гробов, Е.М. Плисс // Мат. XIV Международной научно - технической конференции «Наукоемкие химические технологии 2012». – Тула, 2012. – С.57.
12. Казнина М.А. «Ингибирование стабильными нитроксильными радикалами окисления винилпиридинов»/М.А. Казнина, А.С.Копылова, А.М. Гробов, А.В. Сирик, Е.М. Плисс //Мат. Международной конференции молодых ученых и V школа им. академика Н. М. Эмануэля «Окисление, окислительный стресс, антиоксиданты». – Москва-Ереван, 2012. – С.184-185.

