Синтез дикарбоновых кислот в реакциях окислительного сочетания и нуклеофильного замещения с участием енолят-анионов ацилатов лития
На правах рукописи
ЧАНЫШЕВА АЛИЯ РАФАЭЛЕВНА
СИНТЕЗ ДИКАРБОНОВЫХ КИСЛОТ В РЕАКЦИЯХ
ОКИСЛИТЕЛЬНОГО СОЧЕТАНИЯ И НУКЛЕОФИЛЬНОГО
ЗАМЕЩЕНИЯ С УЧАСТИЕМ ЕНОЛЯТ-АНИОНОВ
АЦИЛАТОВ ЛИТИЯ
Специальность 02.00.03 – Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Уфа-2009
Работа выполнена в ГОУ ВПО «Уфимский государственный нефтяной технический университет».
| Научный руководитель | доктор химических наук, профессор Зорин Владимир Викторович. |
| Официальные оппоненты: | доктор химических наук, профессор Абдрахманов Ильдус Бариевич; кандидат химических наук, с.н.с. Колбин Александр Михайлович. |
| Ведущая организация | Башкирский государственный университет. |
Защита состоится «22» декабря 2009 года в 15-00 на заседании совета по защите докторских и кандидатских диссертаций Д 212.289.01 при ГОУ ВПО «Уфимский государственный нефтяной технический университет» по адресу: 450062, Уфа, ул. Космонавтов, 1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Уфимский государственный нефтяной технический университет».
Автореферат диссертации разослан « » ноября 2009 года.

| Ученый секретарь совета | Сыркин А.М. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Енолят-анионы и дианионы, генерируемые из кетонов, карбоновых кислот и их производных под действием различных металлирующих агентов, являются доступными промежуточными продуктами, которые широко используются в органическом синтезе. Их реакции нуклеофильного замещения, присоединения по кратным C=C-, C= N-, C= O-связям, окислительного сочетания и перегруппировки лежат в основе построения углеродных скелетов сложных органических соединений. В литературе описано множество примеров реакций нуклеофильного замещения и присоединения, протекающих с участием енолят-анионов. Реакции окислительного сочетания с участием енолят-анионов и, особенно, дианионов являются менее изученными, хотя обладают высоким синтетическим потенциалом и могут быть использованы при создании и совершенствовании методов образования новых углерод-углеродных связей, а также синтезе практически ценных моно-, би- и полифункциональных органических соединений. Реакции нуклеофильного замещения, протекающие с участием енолят-анионов ацилатов лития, представляют значительный интерес для функционализации карбоновых кислот и введения оксикарбонилалкильных групп в сложные органические соединения, содержащие электрофильные центры. Эти реакции перспективны, в частности, для создания методов получения дикарбоновых кислот нормального и разветвленного строения, широко используемых в медицинской, фармакологической, пищевой и других отраслях промышленности.
В связи с этим исследование реакций нуклеофильного замещения и окислительного сочетания с участием енолят-анионов ацилатов лития, генерируемых металлированием карбоновых кислот, с целью создания методов синтеза дикарбоновых кислот, представляется актуальной задачей и перспективным направлением научных исследований.
Диссертационная работа выполнена в соответствии с заданием Министерства образования и науки по тематическому плану НИР УГНТУ «Разработка перспективных методов синтеза би- и полифункциональных органических соединений на основе фундаментальных исследований свойств новых реагентов, катализаторов и нетрадиционных методов интенсификации химических реакций» (2006–2010 гг.) и в соответствии с аналитической ведомственной целевой программой «Развитие научного потенциала высшей школы» (2009–2010 гг.) по проекту № 2.1.2/5048.
Цель работы. Исследование реакций нуклеофильного замещения и окислительного сочетания с участием енолят-анионов ацилатов лития для создания методов синтеза дикарбоновых кислот.
Исходя из поставленной цели, в работе решались следующие задачи:
– изучение возможности использования реакции окислительного сочетания дианионов карбоновых кислот, содержащих С-анионоидные центры у первичного, вторичного и третичного -атомов углерода под действием молекулярного иода в синтезе дикарбоновых кислот;
– поиск условий эффективного протекания реакции окислительного сочетания енолят-анионов ацилатов лития, приводящей к образованию дикарбоновых кислот;
– исследование возможности использования доступных трет-бутилгипогалогенитов в качестве реагентов в реакции окислительного сочетания енолят-анионов ацилатов лития;
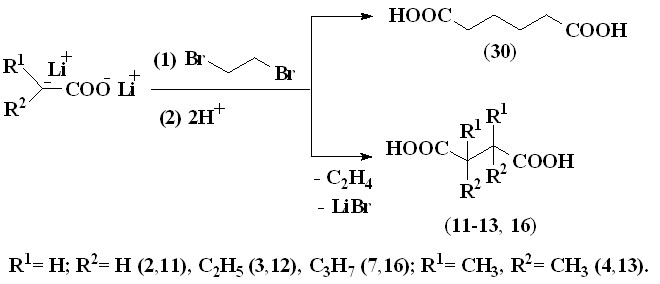
– исследование методов синтеза дикарбоновых кислот в реакциях нуклеофильного замещения, протекающих с участием енолят-анионов ацилатов лития различного строения, 1,2-дибромалканов и 1,2-дихлорэтана, 1,4-дибромбутана и 1,8-дибромоктана, а также влияния строения карбоновых кислот на выходы дикарбоновых кислот;
– разработка метода получения несимметричных 2-замещенных янтарных кислот на основе промышленно-доступного продукта – хлорацетата натрия и металлированных карбоновых кислот.
Научная новизна. Выполнено целенаправленное исследование по разработке методов синтеза дикарбоновых кислот нормального строения с терминальными карбоксильными группами и их моно-, ди- и тетра--замещенных производных в реакциях окислительного сочетания и нуклеофильного замещения с участием енолят-анионов ацилатов лития, генерируемых металлированием монокарбоновых кислот диизопропиламидом лития (LDA).
Показано, что окислительное сочетание металлированных карбоновых кислот под действием молекулярного иода при 20–25 °С в ТГФ в инертной атмосфере, приводящее к образованию дикарбоновых кислот, является общей реакцией енолят-анионов ацилатов лития с анионоидным центром при первичном, вторичном и третичном -атоме углерода. Установлено, что выходы дикарбоновых кислот увеличиваются при переходе от енолят-анионов ацилатов лития с анионоидным центром при первичном -атоме углерода к третичному и вторичному.
Найдено, что трет-бутилгипогалогениты (ButOX, где X=I, Br, Cl) могут выступать в качестве реагентов окислительного сочетания енолят-анионов ацилатов лития и их эффективность возрастает в ряду ButOCl<ButOBr<ButOI.
Впервые установлено, что в реакции енолят-анионов ацетата лития с
1,2-дибромэтаном при 20–25 °С в ТГФ в инертной атмосфере параллельно образуются адипиновая и янтарная кислоты, являющиеся продуктами реакций нуклеофильного замещения и окислительного сочетания. При взаимодействии енолят-анионов ацилатов лития, содержащих анионоидные центры при вторичном и третичном -атомах углерода, с 1,2-дибромэтаном и 1,2-дибромалканами образуются дикарбоновые кислоты, являющиеся исключительно продуктами окислительного сочетания исходных енолят-анионов ацилатов лития.
Установлено, что в отличие от 1,2-дибромалканов при взаимодействии енолят-анионов ацилатов лития с дибромалканами с удаленными бромметильными группами (1,4-дибромбутан, 1,8-дибромоктан), протекает реакция нуклеофильного замещения с образованием соответствующих дикарбоновых кислот. Выходы продуктов практически не зависят от длины цепи дибромалканов и определяются строением енолят-анионов ацилатов лития. С бльшим выходом протекает реакция енолят-анионов ацилатов лития с анионоидным центром у вторичного и особенно третичного -атома углерода и менее эффективно – у первичного.
Найден новый подход к синтезу янтарной кислоты и ее 2-моно- и
2,2-дизамещенных производных, основанный на взаимодействии енолят-анионов ацилатов лития с хлорацетатом натрия при 20–25 °С в ТГФ в инертной атмосфере.
Показана принципиальная возможность синтеза моно- и дикарбоновых кетокислот в реакции енолят-анионов кетонов с хлорацетатом натрия.
Практическая ценность. Разработаны методы синтеза практически ценных дикарбоновых кислот нормального и разветвленного строения, основанные на реакциях окислительного сочетания и нуклеофильного замещения, протекающих с участием енолят-анионов ацилатов лития, генерируемых из карбоновых кислот, и других доступных реагентов: иода, трет-бутилгипогалогенитов, дигалогеналканов с терминальными бромметильными группами и хлорацетата натрия.
В результате испытаний полученных дикарбоновых кислот было установлено, что 2,3-диэтилянтарная, 2-фенилянтарная и 2,2,11,11-тетраметилдодекан-диовая кислоты проявляют антибактериальную активность по отношению к грамположительным и грамотрицательным бактериям.
Результаты научных исследований используются в учебном процессе при выполнении учебно-исследовательских работ студентов и в лабораторном практикуме по специализации «Технология биоорганического синтеза» специальности 240901 «Биотехнология» на кафедре биохимии и технологии микробиологических производств Уфимского государственного нефтяного технического университета.
Апробация работы. Основные результаты диссертационной работы докладывались на следующих конференциях и семинарах: 59-й и 60-й научно-технической конференции студентов, аспирантов и молодых ученых УГНТУ (Уфа, 2008, 2009); VI Республиканской научно-практической конференции «Научное и экологическое обеспечение современных технологий» (Уфа, 2009); Международной научной студенческой конференции по естественнонаучным и техническим дисциплинам «Научному прогрессу – творчество молодых» (Йошкар-Ола, 2009); VII Всероссийской конференции с молодежной научной школой «Химия и медицина, Орхимед-2009» (Уфа, 2009).
Публикации. По теме диссертации опубликовано 8 работ, в том числе
3 статьи в журналах, рекомендованных ВАК Минобрнауки России, и материалы 5 докладов конференций.
Структура и объем работы. Диссертационная работа состоит из введения, литературного обзора, обсуждения результатов, экспериментальной части, выводов, списка литературы и приложения. Материал диссертации изложен на 115 страницах машинописного текста, содержит 10 рисунков и 4 таблицы. Список литературы включает 139 наименований.
СОДЕРЖАНИЕ РАБОТЫ
Дикарбоновые кислоты находят широкое применение в различных отраслях промышленности. В медицине они используются для приготовления различных кремов, мазей, отдушек, для получения полиамидов, полиэфиров и полиуретанов, которые применяются для производства широкого спектра товаров для медицины. Дикарбоновые кислоты применяются для профилактики множества заболеваний и являются стимуляторами многих функций организма, обладают антиоксидантными свойствами, антибактериальной и фунгицидной активностью. Дикарбоновые кислоты также применяются для производства пластификаторов, синтетических смазочных материалов, клеев, красок, лаков и др.
Нами с целью создания методов синтеза дикарбоновых кислот исследованы реакции нуклеофильного замещения и окислительного сочетания, протекающие с участием дианионов, генерируемых металлированием карбоновых кислот.
1 Синтез дикарбоновых кислот в реакциях окислительного сочетания енолят-анионов ацилатов лития
Известно, что в реакции металлированных при нормальных условиях этиловых эфиров ацетоуксусной и масляной кислот с иодом в эфире образуются соответствующие продукты окислительного сочетания. В литературе также приведены примеры сочетания металлированных LDA при -78 °С карбоновых кислот (изомасляной, циклопропан- и циклобутанкарбоновых кислот), содержащих третичный -атом углерода.
С целью изучения влияния строения монокарбоновых кислот на выходы дикарбоновых кислот в реакциях окислительного сочетания енолят-анионов ацилатов лития были исследованы металлирование карбоновых кислот, содержащих первичный, вторичный и третичный -атомы углерода, и сочетание образующихся енолят-анионов ацилатов лития под действием молекулярного иода.
При подборе условий металлирования карбоновых кислот и окислительного сочетания образующихся дианионов под действием молекулярного иода в ТГФ варьировали температуру и время реакция в интервалах
-10 - +60 °С и 0,5-24 часа, соответственно. В результате проведенных исследований были подобраны наиболее благоприятные условия, обеспечивающие достаточную глубину превращения субстратов и выходы дикарбоновых кислот.
Установлено, что взаимодействие металлированных LDA (1) уксусной (2), масляной (3), изомасляной (4), валериановой (5), изовалериановой (6), капроновой (7), энантовой (8) и фенилуксусной (9) кислот с кристаллическим иодом (10) при мольном соотношении реагентов (1):(2-9):(10)=2:1:1 в ТГФ в атмосфере аргона при нормальных условиях (20-25 °С) приводит к образованию литиевых солей соответствующих дикарбоновых кислот, при обработке которых соляной кислотой выделяются соответственно: янтарная кислота (11) и ее 2,3-ди- и 2,2,3,3-тетразамещенные производные: 2,3-диэтил(12)-, 2,2,3,3-тетраметил (13)-, 2,3-ди-пропил (14)-, 2,3-диизопропил (15)-, 2,3-ди-бутил (16)-, 2,3-диамил (17)- и 2,3-дифенил (18)-янтарные кислоты с выходами 40-90% (Таблица 1).

Формально данное превращение можно представить как окислительно-восстановительный процесс, приводящий к образованию дикарбоновых кислот (11-18) – продуктам окислительного сочетания енолят-анионов ацилатов лития (2а-9а), генерируемых из монокарбоновых кислот (2-9).
Образование продуктов реакции (11-18) можно представить по схеме, включающей одноэлектронное окисление дианионов (2а-9а) до анион-радикалов (2b-9b), взаимодействие которых с енольной формой дианионов (2а-9а) приводит к спин-аддуктам (11а-18а) и далее через одноэлектронное окисление и протонирование к целевым продуктам. Последние также могут образовываться при рекомбинации анион-радикалов (2b-9b).


Не исключается и гетеролитический механизм образования литиевых солей янтарной (11b) и других дикарбоновых кислот (12b-18b), включающий иодирование енолят-анионов ацилатов лития (2а-9а) молекулярным иодом (10) с образованием литиевых солей -иодкарбоновых кислот и последующее нуклеофильное замещение иода на -оксикарбонилалкильные остатки.

Однако при анализе спектров ЯМР 1Н и 13С образующихся в изученных условиях продуктов реакции предполагаемые -иодкарбоновые кислоты не были обнаружены.
Таблица 1 – Выходы дикарбоновых кислот в реакции окислительного
сочетания енолят-анионов ацилатов лития под действием молекулярного иода
(t=20–25 °C, растворитель - ТГФ, инертная атмосфера (Ar), молярное
соотношение (2-9):(10)=1:1, =2ч)
| Монокарбоновая кислота | Дикарбоновая кислота | Выход, % от теор. |
| 40 | ||
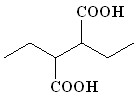 (12) (12) | 85 | |
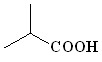 (4) (4) | 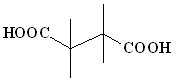 (13) (13) | 60 |
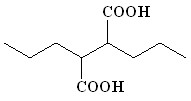 (14) (14) | 88 | |
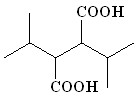 (15) (15) | 90 | |
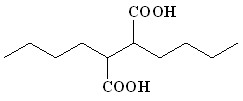 (16) (16) | 76 | |
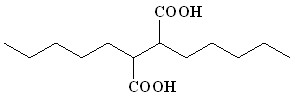 (17) (17) | 65 | |
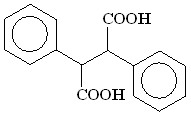 (18) (18) | 85 |
Полученные дикарбоновые кислоты были выделены из реакционной смеси экстракцией серным эфиром и идентифицированы по спектрам ЯМР Н1 и 13С.
В спектрах ПМР присутствуют сигналы характеристичных групп атомов водорода дикарбоновых кислот (11-18). Так, например, для -СН-СООН и
-СН2-СООН групп характерны сигналы в области 2.2-2.7 м.д. Сигналы атомов водорода карбоксильных групп наблюдаются в слабом поле в области 7.0-11.0 м.д. Метильные и метиленовые группы резонируют в сильном поле в диапазоне 0.8-1.2 м.д. и 1.2-1.8 м.д., соответственно.
Спектры ЯМР 13С дикарбоновых кислот (11-18) являются более информативными. Атомы углерода карбоксильных групп резонируют в области
175.9-183.1 м.д., СН3-групп – в диапазоне 9.9-18.5 м.д., четвертичных атомов углерода (СН3)2С-групп – при 49.2 м.д., СН2-групп – в области 20.0-33.1 м.д.,
-СН2-групп – 28.5 м.д., -СН-СООН – 46.7-51.9 м.д.
Дикарбоновые кислоты (12,14-17) присутствуют в виде смеси диастереомеров (смеси мезо- и (±)-форм в соотношении ~ 810:1), наличие которых подтверждается спектрами ЯМР Н1 и 13С. Например, в спектре Н1 2,3-диэтилянтарной кислоты триплет метильных групп мезо-2,3-диэтилянтарной кислоты находится в диапазоне 0.9-1.05 м.д., а протоны метильных групп (±)-2,3-диэтилянтарной кислоты - в интервале 1.05-1.1 м.д.; сигналы метиленовых групп мезо-2,3-ди-этилянтарной кислоты присутствуют в виде двух мультиплетов в интервале
1.52-1.87 м.д., а (±)-2,3-диэтилянтарной кислоты – в виде одного мультиплета в области – 1.87-1.9 м.д.; мультиплет метиновых групп мезо-2,3-диэтилянтарной кислоты резонируют в диапазоне 2.63-2.7 м.д., а сигналы протонов метиновых групп (±)-2,3-диэтилянтарной кислоты находятся в более слабом поле – при 2.7-2.8 м.д. В спектре ЯМР 13С сигналы атома углерода СН3-групп наблюдаются при 13.03 и 11.09 м.д., СН2-групп– при 22.2 и 22.36, -СН-СООН – при 46.79 и 48.48, а атомы углерода карбоксильных групп – при 182.08 и 182.88 м.д.
При поляриметрическом исследовании полученные дикарбоновые кислоты не проявили оптической активности.
Полученные результаты показывают, что выходы дикарбоновых кислот заметно зависят от строения вовлекаемых в реакцию монокарбоновых кислот. При сопоставлении выходов полученных дикарбоновых кислот (таблица 1) становится очевидным, что с наибольшими выходами образуются продукты окислительного сочетания енолят-анионов ацилатов лития, содержащих анионоидный центр у вторичного -атома углерода. В случае окислительного сочетания енолят-анионов изобутирата лития и особенно енолят-анионов ацетата лития выходы соответствующих дикарбоновых кислот заметно ниже. Полученная зависимость не может быть объяснена известными представлениями о реакционной способности кислот на стадии металлирования или различной активностью образующихся дианионов.
В соответствии с предложенной схемой эффективность образования промежуточных анион-радикальных спин-аддуктов (11а-18а), являющихся предшественниками целевых дикарбоновых кислот, должна зависеть от концентрации енольной формы енолят-анионов ацилатов лития (2а-9а). Известно, что концентрация енольной формы енолят-анионов карбонильных соединений существенно зависит от строения анионоидного центра енолят-аниона. Концентрация енольной формы возрастает при переходе от первичного к третичному и далее вторичному -атому углерода анионоидного центра. В связи с этим, можно предположить, что уменьшение выходов дикарбоновых кислот в случае окислительного сочетания дианионов уксусной и изомасляной кислот связано с пониженной концентрацией их енольных таутомерных форм.
В целом, следует отметить, что в изученных условиях дикарбоновые кислоты (11-18) образуются с удовлетворительными выходами (40-90 %), сопоставимыми с выходами дикарбоновых кислот, полученными в работах Renaud, Belletire (1984, 1988) металлированием LDA изомасляной и фенилуксусной кислот при низких температурах (-78 °С) и последующим взаимодействием с молекулярным иодом при 65 °С в течение ночи. Очевидно, что используемые нами условия являются более удобными с препаративной точки зрения.
Однако в этих условиях не удается осуществить окислительное сочетание енолят-анионов, генерируемых из эфиров карбоновых кислот.

При исследовании реакции с участием этилацетата (19), этилбутирата (20), этилизобутирата (21) было установлено, что во всех случаях на стадии металлирования протекает реакция конденсации с образованием соответствующих кетоэфиров (23-25), и только в случае этилизобутирата в незначительных количествах образуется диэтиловый эфир 2,2,3,3-тетраметилянтарной кислоты (22).
С целью повышения эффективности синтеза дикарбоновых кислот в реакции окислительного сочетания енолят-анионов ацилатов лития и расширения сырьевой базы была изучена возможность использования в качестве окислителей трет-бутилгипогалогенитов, являющихся доступными продуктами органическогосинтеза. На примере масляной кислоты (3) было установлено, что при взаимодействии енолят-анионов бутирата лития с трет-бутилгипоиодитом (26) в ТГФ при 20-25 °С в инертной атмосфере при мольном соотношении (3):(26), равном 2:1, в течение 2 часов также образуется 2,3-диэтилянтарная кислота (12) с выходом 92 %. Взаимодействие енолят-анионов бутирата лития с трет-бутилгипо-бромитом (27) и особенно с трет-бутилгипохлоритом (28) в аналогичных условиях протекает менее эффективно и приводит к образованию 2,3-диэтилянтарной кислоты (12) с выходами 23 и 3-5 %, соответственно.
Образование 2,3-диэтилянтарной кислоты (12) можно описать двумя альтернативными схемами:
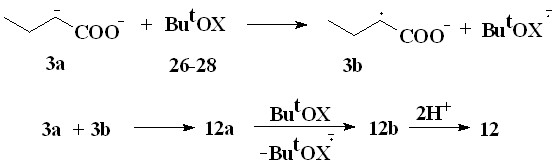
или

В первом случае в результате одноэлектронного окисления енолят-аниона бутирата лития(3a) трет-бутилгипогалогенитом (26-28) возникает анион-радикал бутирата лития (3b). Взаимодействие последнего с б енолят-аниона бутирата лития(3a) приводит к образованию соответствующего спин-аддукта (12а), в результате одноэлектронного окисления которого образуется литиевая соль 2,3-диэтилянтарной кислоты (12b) и затем 2,3-диэтилянтарная кислота (12).
Вторая схема предполагает галогенирование дианиона бутирата лития до литиевой соли -галогенмасляной кислоты и участие ее в реакции нуклеофильного замещения галогена енолят-аниона бутирата лития. Уменьшение выхода 2,3-диэтилянтарной кислоты при переходе от ButOI к ButOBr и ButOCl свидетельствует в пользу второй схемы, так как эффективность нуклеофильного замещения галогена убывает в ряду I>Br>Cl.
Однако при исследовании реакционных смесей в случае ButOI и ButOBr
-галогенкарбоновые кислоты не были обнаружены, а в случае ButOCl в спектре ЯМР Н1 присутствует триплет в области 3.98-4.05 м.д., соответствующий триплету CH-Cl-группы -хлормасляной кислоты.
Образование -галогенкарбоновых кислот также может протекать как гетеролитически, так и через стадию одноэлектронного переноса с дианиона на трет-бутилгипогалогенит и гомолитического галогенирования образующегося анион-радикала трет-бутилгипогалогенитом.
Таким образом, полученные результаты показывают, что в изученных условиях при взаимодействии енолят-анионов ацилатов лития, генерируемых металлированием карбоновых кислот LDA, с молекулярным иодом и трет-бутилгипогалогенитами протекает реакция окислительного сочетания, приводящая к образованию дикарбоновых кислот.
Выходы продуктов реакции существенно зависят от строения енолят-аниона ацилата лития и природы окислителя. Наиболее эффективно реакция протекает с енолят-анионами ацилатов лития, содержащими -анионоидный центр при вторичном атоме углерода и менее эффективно с енолят-анионами ацилатов лития, содержащими -анионоидный центры при первичном и третичном атоме углерода.
При использовании трет-бутилгипогалогенитов с наибольшим выходом протекает реакция с трет-бутилгипоиодитом.
2 Синтез дикарбоновых кислот в реакции енолят-анионов ацилатов
лития с 1,2-дигалогеналканами
Известно, что при взаимодействии енолят-анионов ацилатов лития с галогеналкилами протекает реакция нуклеофильного замещения галогена на
-карбоксиалкильный остаток с образованием соответствующих -алкил-замещенных солей карбоновых кислот.
Известно также, что при взаимодействии енолят-анионов ацилатов лития, полученных металлированием изомасляной кислоты, с 1,3-дибромпропаном и 1,4-дибромбутаном образуются соответствующие 2,2,6,6-тетраметил-гептандиовая и 2,2,7,7-тетраметилоктандиовая кислоты. Аналогичная реакция с 1,2-дихлорэтаном не протекает.
Нами исследована возможность получения дикарбоновых кислот в реакциях нуклеофильного замещения брома или хлора в 1,2-дибромэтане и 1,2-дихлор-этане соответственно на -оксикарбонилалкильные остатки под действием енолят-анионов ацилатов лития различного строения, генерируемых металлированием карбоновых кислот, содержащих первичный, вторичный и третичный -атомы углерода, также изучено влияние их строения на выходы целевых продуктов.
В ходе исследований были подобраны температура и время реакции, обеспечивающие высокую конверсию субстрата и выходы дикарбоновых кислот.
Установлено, что при взаимодействии енолят-анионов ацетата лития, генерируемых из уксусной кислоты (2) под действием LDA, с 1,2-дибромэтаном (29) в ТГФ в инертной атмосфере при 20-25 °С при мольном соотношении (1):(2):(29), равном 4:2:1, в течение 2 часов наряду с нуклеофильным замещением, приводящим к образованию адипиновой кислоты (30) с выходом 38%, протекает реакция окислительного сочетания енолят-анионов ацилатов лития с образованием янтарной кислоты (11) с выходом 40%.
При взаимодействии енолят-анионов ацилатов лития, полученных металлированием масляной (3), изомасляной (4), капроновой (7) кислот, с 1,2-ди-бромэтаном (29) в аналогичных условиях в реакционной смеси обнаружены только продукты окислительного сочетания енолят-анионов ацилатов лития: 2,3-диэтилянтарная (12), 2,2,3,3-тетраметилянтарная (13), 2,3-дибутилянтарная (16) кислоты с выходами 21-58% (таблица 2).
Образование янтарной кислоты (11) из металлированной уксусной кислоты (2) и 2,3-диэтилянтарной (12), 2,2,3,3-тетраметил (13)- и 2,3-дибутилянтарной (16) кислот из соответствующих металлированных масляной (3), изомасляной (4) и капроновой (7) кислот под действием 1,2-дибромэтана (29) не является очевидным результатом реакции и предполагает окисление енолят-анионов ацилатов лития 1,2-дибромэтаном. В случае одноэлектронного окисления должны образовываться соответствующие анион-радикалы, последующие бимолекулярные превращения которых приводят к образованию дикарбоновых кислот.


Образующиеся дикарбоновые кислоты (11-13, 16) были идентифицированы методами ЯМР Н1и 13С. Дикарбоновые кислоты (12,16) присутствуют в виде смеси диастереомеров (смеси мезо- и (±)-форм в соотношении ~ 810:1).
Таблица 2 – Выходы продуктов нуклеофильного замещения и окислительного сочетания в реакции енолят-анионов ацилатов лития с 1,2-дибромэтаном
(t= 20–25 °С, растворитель - ТГФ, инертная атмосфера (Ar), молярное
соотношение (2-4, 7):(29)= 2:1, =2ч)
| Монокарбоновая кислота | Продукты реакции | |||
| Нуклеофильное замещение | Выход, % от теор. | Окислительное сочетание | Выход, % от теор. | |
| 38 | 40 | |||
| _ | – | 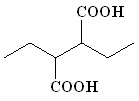 (12) (12) | 64 | |
 (4) (4) | _ | – | 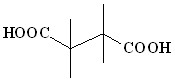 (13) (13) | 37 |
| _ | – | 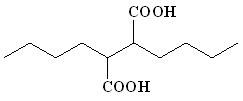 (16) (16) | 76 | |
Установлено, что в аналогичных условиях окислительное сочетание енолят-анионов ацетата лития также протекает под действием других 1,2-дибромалканов.

Полученные результаты согласуются с литературными данными, указывающими на то, что галогеналканы: 1,2-дихлорэтан, иодистый метил выступают в качестве одноэлектронных окислителей дианионов сопряженных непредельных углеводородов и в ходе реакции образуются соответствующие продукты окислительного сочетания, а не нуклеофильного замещения. Показано, что 1,2-дибромэтан также выступает в качестве окислителя дианионов непредельных соединений и в ходе реакции превращается в этилен. Это свидетельствует в пользу предложенной выше схемы образования продуктов окислительного сочетания. Примечательно, что как и при окислительном сочетании енолят-анионов ацилатов лития под действием молекулярного иода, в случае
1,2-дибромэтана наибольшие выходы целевых продуктов наблюдаются при сочетании енолят-анионов ацилатов лития, содержащих анионоидный центр у вторичного -атома углерода, по сравнению с продуктами, полученными в результате сочетания енолят-анионов ацетата и изобутирата лития, содержащих анионоидные центры, соответственно, у первичного и третичного атома углерода.
Можно предположить, что в случае 1,2-дихлорэтана (33) одноэлектронное окисление енолят-анионов ацилатов лития должно протекать более эффективно из-за большей электроотрицательности атомов хлора и, вероятно, большего сродства к электрону молекулы 1,2-дихлорэтана по сравнению с 1,2-ди-бромэтаном. Однако в аналогичных условиях в реакции с 1,2-дихлорэтаном (33) продукты окислительного сочетания не были обнаружены. При этом в следовых количествах образовывались продукты нуклеофильного замещения. При нагревании (40-50 °С) и значительном увеличении продолжительности реакции (24 часа) выходы продуктов нуклеофильного замещения несколько возрастали. Максимальный выход 2,2,5,5-тетраметилгександиовой кислоты (34) 29 % достигается в реакции 1,2-дихлорэтана с енолят-анионами изобутирата лития, обладающими в изученном ряду енолят-анионов ацилатов лития наиболее высокой нуклеофильностью и как следствие более высокой реакционной способностью при замещении малоподвижного атома хлора.
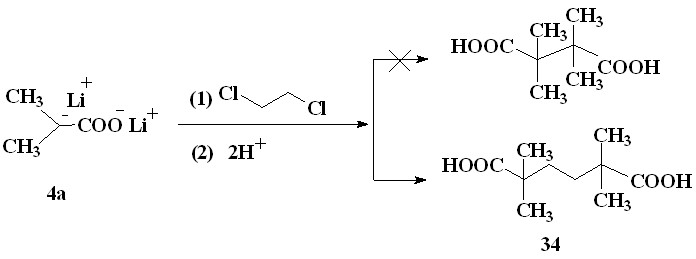
В целом, низкие выходы продуктов нуклеофильного замещения связаны с низкой реакционной способностью атомов хлора в 1,2-дихлорэтане.
Можно предположить, что окислительное сочетание енолят-анионов ацилатов лития под действием 1,2-дибромэтана и отсутствие продуктов сочетания в реакции с 1,2-дихлорэтаном связаны с более выраженным d-эффектом вицинально расположенных атомов брома по сравнению с атомами хлора.
Bahl, Bates (1976) при описании взаимодействия дианионов, генерируемых металлированием диенов, с 1,2-дибромэтаном предложили механизм образования замещенных циклопропанов (продуктов внутримолекулярного окислительного сочетания), включающий перенос электрофильного брома с молекулы
1,2-дибромэтана на дианион, и последующую циклизацию образующегося бромсодержащего аниона. Можно предположить, что при взаимодействии енолят-анионов ацилатов лития с 1,2-дибромэтаном также происходит перенос катиона брома на енолят-анион ацилата лития и промежуточным продуктом реакции является литиевая соль -бромкарбоновой кислоты, которая при взаимодействии с енолят-анионом ацилата лития образует соответствующую соль дикарбоновой кислоты.

Однако при анализе реакционных смесей -бромкарбоновые кислоты не были обнаружены, что не позволяет принять рассматриваемый механизм протекания реакции.
Таким образом, обнаружено необычное протекание реакций енолят-анионов ацилатов лития с 1,2-дибромалканами, в которых последние выступают в качестве окислителей, и в ходе реакции образуются продукты окислительного сочетания енолят-анионов ацилатов лития. Продукты нуклеофильного замещения брома на -оксикарбонильный остаток образуются параллельно лишь в реакции 1,2-дибромэтана с енолят-анионами ацетата лития, по-видимому, обладающими меньшей восстановительной способностью.
- Синтез дикарбоновых кислот в реакции енолят-анионов ацилатов лития с дибромалканами с удаленными бромалкильными группами
Ранее (Durr P. (1966), Renaud A. (1988)) было показано, что при взаимодействии енолят-анионов бутирата лития, генерируемых металлированием изомасляной кислоты LDA, с терминальными бромалканами С4-С10 протекает нуклеофильное замещение атомов брома и образуются соответствующие тетра-метилзамещенные дикарбоновые кислоты.
С целью определения синтетического потенциала этой реакции нами исследована возможность применения данного подхода к синтезу различных дикарбоновых кислот на основе монокарбоновых кислот, содержащих первичный, вторичный и третичный -атомы углерода, а также изучено влияние их строения на выходы целевых продуктов.
Были исследованы реакции 1,4-дибромбутана и 1,8-дибромоктана с енолят-анионами ацилатов лития, генерируемыми из уксусной (2), масляной (3) и изомасляной (4) кислот в условиях, аналогичных их взаимодействию с 1,2-ди-бромэтаном.
Установлено, что при взаимодействии 1,4-дибромбутана (35) с енолят-анионами ацилатов лития, генерируемыми из уксусной (2), масляной (3) и изомасляной (4) кислот, в ТГФ в инертной атмосфере атмосфере при 20-25 °С при мольном соотношении реагентов (1):(2-4):(35), равном 4:2:1, в течение 2 часов, протекает последовательное нуклеофильное замещение атомов брома на -оксикарбонилалкильные остатки и образуются октандиовая (36), 2,7-ди-этилоктандиовая (37) и 2,2,7,7-тетраметилоктандиовая (38) кислоты с выходами 47-78% (таблица 3).
В реакции 1,4-дибромбутана с наименее активными в исследуемом ряду енолят-анионами ацетата лития, в изученных условиях наряду с октандиовой кислотой (36), в реакционной смеси в небольших количествах (~5%) присутствует 6-бромгексановая кислота (39) – промежуточный продукт последовательного замещения одного из атомов брома в 1,4-дибромбутане на оксикарбонилметильный остаток.
Взаимодействие енолят-анионов ацилатов лития, полученных металлированием уксусной (2), масляной (3) и изомасляной (4) кислот под действием LDA, с 1,8-дибромоктаном (40) в ТГФ в инертной атмосфере при 20-25 °С при мольном соотношении реагентов (1):(2-4):(40), равном 2:1, в течение 2 часов, приводит к образованию додекандиовой (41), 2,11-диэтилдодекандиовой (42) и 2,2,11,11-тетраметилдодекандиовой (43) кислот с выходами 35-68%, соответственно (таблица 3).
Таким образом, образующиеся в результате металлирования карбоновых кислот енолят-анионы ацилатов лития последовательно замещают в терминальных дибромалканах (35, 40) атомы брома на -оксикарбонилалкильные остатки с образованием целевых дикарбоновых кислот. Продукты окислительного сочетания в реакционной смеси не были обнаружены.
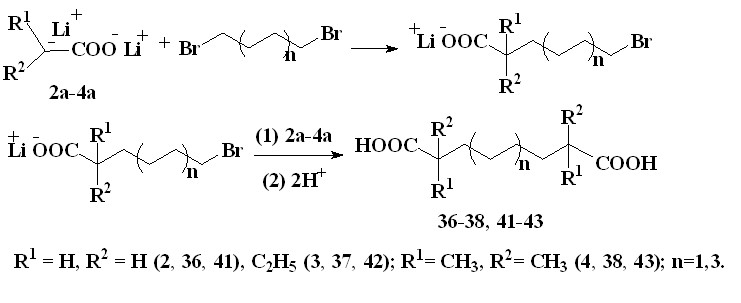
Образующиеся дикарбоновые кислоты были идентифицированы методами ЯМР Н1и 13С. Дикарбоновые кислоты (37, 42) присутствуют в виде диастереомеров (смеси мезо- и (±)-форм в мольном соотношении ~ 810:1), наличие которых подтверждается спектрами ЯМР Н1 и 13С.
При поляриметрическом исследовании смесей диастереомерных дикарбоновых кислот установлено, что они оптически неактивны и представляют эквимолярные смеси оптических антиподов.
Анализ выходов (Таблица 3) полученных дикарбоновых кислот
(36-38,41-43) показывает, что они практически не зависят от длины цепи дибромалканов, однако, заметно изменяются в зависимости от строения енолят-анионов ацилатов лития. С бльшим выходом протекает реакция енолят-анионов ацилатов лития с анионоидным центром у вторичного и особенно третичного -атома углерода и менее эффективно – с енолят-анионами ацилатов лития с анионоидным центром у первичного -атома углерода.
Таблица 3 – Выходы продуктов нуклеофильного замещения в реакции енолят-анионов ацилатов лития с 1,4-дибромбутаном и 1,8-дибромоктаном
(t=20–25°C, растворитель - ТГФ, инертная атмосфера (Ar), молярное
соотношение (2-4):(35, 40)=2:1, =2ч)
| Монокарбоновая кислота | Дибромалкан | Продукты реакции | Выход, % от теор. |
| 35 | |||
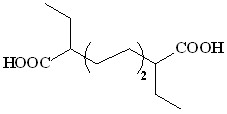 (37) (37) | 43 | ||
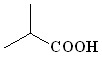 (4) (4) | 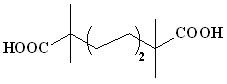 (38) (38) | 78 | |
| 36 | |||
 (42) (42) | 68 | ||
 (4) (4) |  (43) (43) | 64 |
Полученные результаты хорошо согласуются с известными представлениями об основности (симбатно изменяющейся c нуклеофильностью в ряду енолят-анионов) карбанионов, которая отражает их активность в реакциях нуклеофильного замещения и уменьшается в ряду: третичные>вторичные>первичные карбанионы.
Таким образом, в целом, нуклеофильное замещение атомов брома в ди-бромалканах с удаленными бромметильными группами протекает достаточно эффективно с енолят-анионами ацилатов лития, имеющими первичный, вторичный и третичный анионоидные центры на -атоме углерода, что позволяет получать дикарбоновые кислоты различного строения на основе разных монокарбоновых кислот.
Следует отметить, что дибромалканы с удаленными бромметильными группами, в отличие от 1,2-дибромалканов, не проявляют окислительных свойств в исследуемых реакциях.
- Синтез дикарбоновых кислот в реакциях енолят-анионов ацилатов лития с хлорацетатом натрия
В предыдущих разделах была показана возможность синтеза симметричных дикарбоновых кислот на основе енолят-анионов ацилатов лития, генерируемых металлированием соответствующих монокарбоновых кислот и доступных электрофильных и окислительных реагентов.
Ранее было установлено (Renaud P., 1988), что при взаимодействии иодуксусной кислоты с металлированной циклопрпилуксусной кислотой при
-78°С с высоким выходом (93%) образуется 2-циклопропилянтарная кислота.
Известно, что в реакциях нуклеофильного замещения атом иода замещается легче, чем атом хлора. В связи с этим в данном разделе изучена возможность получения несимметричных 2-замещенных янтарных кислот на основе промышленно-доступного продукта – хлорацетата натрия и различных по строению металлированных монокарбоновых кислот, а также исследовано влияние строения енолят-анионов ацилатов лития на выходы целевых продуктов.
В результате проведенных исследований были найдены условия, при которых хлорацетат натрия достаточно эффективно вступает в реакцию с енолят-анионами ацилатов лития, генерируемыми из монокарбоновых кислот.
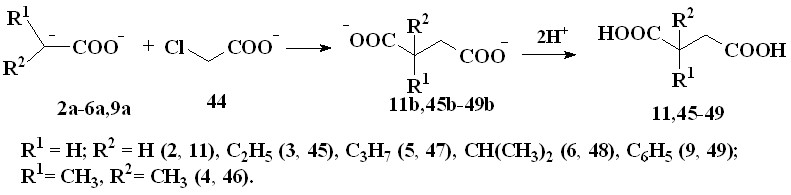
Установлено, что при взаимодействии енолят-анионов ацилатов лития, полученных металлированием уксусной (2), масляной (3), изомасляной (4), валериановой (5), изовалериановой (6) и фенилуксусной (9) кислот с помощью LDA, с хлорацетатом натрия (44) в ТГФ в атмосфере аргона при 20–25 °С в течение 24 часов при мольном соотношении реагентов (1):(2-6,9):(44)=2:1:1 образуются литиевые соли соответствующих дикарбоновых кислот, при обработке которых соляной кислотой выделяются янтарная кислота (11) и соответствующие ее замещенные производные: 2-этилянтарная (45), 2,2-диметил-янтарная (46), 2-пропилянтарная (47), 2-изопропилянтарная (48) и 2-фенил-янтарная (49) кислоты с выходами 27–96% (таблица 4).
Образование продуктов происходит в результате нуклеофильного замещения атома хлора в хлорацетате натрия на -оксикарбонилалкильный остаток.
Продукты реакции были выделены из реакционной смеси и идентифицированы методами ЯМР Н1и 13С.
Таблица 4 – Выходы продуктов нуклеофильного замещения в реакции енолят-анионов ацилатов лития с хлорацетатом натрия
(t=20–25°C, растворитель - ТГФ, инертная атмосфера (Ar), молярное
соотношение (2-6, 9):(44)=1:1, =24ч)
| Монокарбоновая кислота | Продукты реакции | Выход, % от теор. |
| 68 | ||
| |  (45) (45) | 58 |
 (4) (4) |  (46) (46) | 27 |
| |  (47) (47) | 46 |
| |  (48) (48) | 38 |
| | | 96 |
При поляриметрическом исследовании дикарбоновые кислоты (45-49) оптической активности не проявили.
Целевые продукты (11, 45-49) образуются с удовлетворительными выходами. Из анализа выходов продуктов (таблица 4), полученных на основе различных монокарбоновых кислот, следует, что кислоты, содержащие разветвленные и более объемные алкильные группы, образуют продукты с меньшими выходами.
С наибольшим выходом образуется 2-фенилянтарная кислота (49), являющаяся производной фенилуксусной кислоты (9).
По-видимому, нуклеофильное замещение атома хлора в хлорацетате натрия контролируется не только полярными характеристиками енолят-анионов ацилатов лития, но и стерическими факторами.
Таким образом, показана возможность получения 2-замещенных янтарных кислот на основе металлированных монокарбоновых кислот и промышленно-доступного хлорацетата натрия.
В изученном ряду фенилуксусная кислота по сравнению с алкилуксусными кислотами является наиболее сильной CH-кислотой. В связи с этим сопряженное основание фенилуксусной кислоты (енолят-анион фенилацетата лития) будет менее основным. Однако взаимодействие такого основания с хлорацетатом натрия приводит к 2-фенилянтарной кислоте с выходом 95%. Можно предположить, что вовлечение в реакцию нуклеофильного замещения атома хлора хлорацетата натрия енолят-анионов, генерируемых из более сильных СН-кислот, например, кетонов, может привести к образованию моно- и дикарбоновых кетокислот.
Установлено, что при взаимодействии енолят-анионов, генерируемых из ацетона (50), циклопентанона (51) и циклогексанона (52) под действием LDA, с хлорацетатом натрия (44) в ТГФ в атмосфере аргона при 20–25 °С в течение 24 часов при мольном соотношении реагентов (1):(50-52):(44)=2:1:2 образуется смесь литиевых солей соответствующих моно- и дикарбоновых кетокислот, при обработке которых соляной кислотой выделяется смесь моно- и дикарбоновых кетокислот со сравнительно низкими суммарными выходами в соотношении (мольн.): 4-оксопентановая (53) и 4-оксогептандиовая (54) (40%, 4:1);
2-оксоциклопентилуксусная (55) и 2’,2”-(2-оксоциклопентан-1,3-диил)-диуксусная (56) (4 %, 4:1); 2-оксоциклогексилуксусная (57) и 2’,2”-(2-оксо-циклогексан-1,3-диил)диуксусная (58) (22%, 1:2.5).

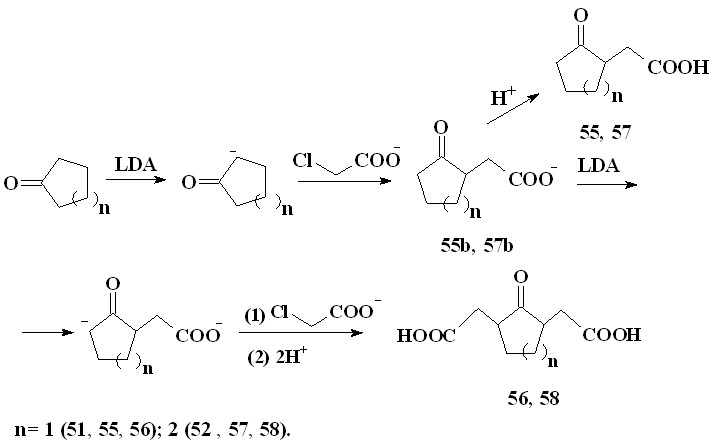
Продукты реакции были идентифицированы по спектрам ЯМР Н1и С13.
Полученные результаты показывают, что в изученных условиях реакция протекает малоэффективно, по-видимому, из-за более высокой стабильности и низкой реакционной способности енолят-анионов, генерируемых из кетонов, по сравнению с енолят-анионами ацилатов лития, вследствие чего наблюдается низкая конверсия хлорацетата натрия.
Примечательно, что при переходе от циклопентанона к циклогексанону и далее к ацетону соотношение дикарбоновой кетокислоты к монокарбоновой кетокислоте возрастает, что может быть связано с большей склонностью ацетона к металлированию, вследствие образования анионоидного центра при первичном, а не вторичном атоме углерода, как в случае циклических кетонов.
Таким образом, показана принципиальная возможность получения моно- и дикарбоновых кетокислот в реакции енолят-анионов, генерируемых из кетонов, с хлорацетатом натрия.
ВЫВОДЫ
- Разработаны методы синтеза дикарбоновых кислот нормального строения с терминальными карбоксильными группами и их моно-, ди- и тетра--замещенных производных, основанных на реакциях окислительного сочетания и нуклеофильного замещения с участием енолят-анионов ацилатов лития, генерируемых металлированием монокарбоновых кислот диизопропиламидом лития.
- Показано, что окислительное сочетание енолят-анионов ацилатов лития под действием молекулярного иода при 20–25 °С в ТГФ в инертной атмосфере (Ar), приводящее к образованию янтарной кислоты и ее 2,3-ди- и 2,2,3,3-тетра-замещенных производных, является общей реакцией для енолят-анионов ацилатов лития с анионоидным центром при первичном, вторичном и третичном -атоме углерода. Выходы дикарбоновых кислот при окислительном сочетании увеличиваются при переходе от енолят-анионов ацилатов лития с анионоидным центром при первичном -атоме углерода к третичному и далее вторичному.
- Найдено, что в качестве реагентов окислительного сочетания енолят-анионов ацилатов лития могут выступать доступные трет-бутилгипогалогениты. При окислительном сочетании енолят-анионов бутирата лития под действием трет-бутилгипогалогенитов при 20–25 °С в ТГФ в инертной атмосфере (Ar) выход 2,3-диэтилянтарной кислоты возрастает в ряду:
ButOCl> ButOBr> ButOI. - Установлено, что при взаимодействии енолят-анионов ацетата лития с 1,2-дибромэтаном при 20–25 °С в ТГФ в инертной атмосфере (Ar) параллельно протекает реакция нуклеофильного замещения атомов брома с образованием адипиновой кислоты и реакция окислительного сочетания, приводящая к образованию янтарной кислоты. Реакция енолят-анионов ацилатов лития, содержащих анионоидные центры при вторичном и третичном -атомах углерода, с 1,2-дибромэтаном приводит исключительно к продуктам окислительного сочетания:2,3-ди- и 2,2,3,3-тетраалкилзамещенным дикарбоновым кислотам. Взаимодействие ацетоксидианионов с 1,2-дибромгептаном или 1,2-дибром-нонаном также приводит к продукту окислительного сочетания (янтарной кислоте).
- Показано, что в отличие от 1,2-дибромэтана при взаимодействии енолят-анионов ацилатов лития, генерируемых из различных карбоновых кислот, с дибромалканами с удаленными бромметильными группами (1,4-ди-бромбутан, 1,8-дибромоктан), протекает исключительно реакция нуклеофильного замещения с образованием соответствующих дикарбоновых кислот. Выходы продуктов практически не зависят от длины цепи дибромалканов и определяются строением енолят-анионов ацилатов лития. С бльшими выходами протекают реакции енолят-анионов ацилатов лития с анионоидными центрами у вторичного и особенно третичного -атома углерода и менее эффективно – у первичного.
- Установлено, что при взаимодействии енолят-анионов ацилатов лития с хлорацетатом натрия при 20–25 °С в ТГФ в инертной атмосфере (Ar) образуется янтарная кислота и ее 2-моно- и 2,2-дизамещенные производные. Найдены условия проведения эффективного протекания реакции. Разработан метод получения янтарной кислоты и ее 2-моно- и 2,2-дизамещенных производных на основе карбоновых кислот и доступного хлорацетата натрия.
- Выходы продуктов нуклеофильного замещения хлора в хлорацетате натрия зависят от строения заместителей (R1, R2) при анионоидном центре
-атома углерода енолят-анионов ацилатов лития и возрастают в ряду (R1, R2): CH3-,CH3- < (CH3)2, H < C3H7-, H- < C2H5, H- < H-, H- < C6H5-, H- с ростом стабильности енолят-аниона. - Показано, что при взаимодействии хлорацетата натрия с енолят-анионами, генерируемыми из кетонов, при 20–25°С в ТГФ в инертной атмосфере (Ar) образуются соответствующие моно- и дикарбоновые кетокислоты.
Список работ, опубликованных по теме диссертации
1 Чанышева А. Р. Синтез 2,3-диэтилянтарной кислоты окислительным сочетанием металлированной литиевой соли масляной кислоты / А. Р. Чанышева, А. В. Зорин, Л. В. Спирихин, А. Ю. Валиев, В. В. Зорин // Башкирский химический журнал. – 2008. – Т. 15, № 4. – С. 34.
2 Чанышева А. Р. Взаимодействие металлированного ацетата лития с 1,2-дибромэтаном / А. Р. Чанышева, А. В. Зорин, А. Б. Хачатурян, Л. В. Спирихин, В. В. Зорин // Башкирский химический журнал. – 2009. – Т. 16, № 1. – С. 24–25.
3 Чанышева А. Р. Нуклеофильное замещение и окислительное сочетание в реакции металлированного ацетата лития с 1,2-дибромэтаном / А. Р. Чанышева, А. В. Зорин, В. С. Климаков, Л. В. Спирихин, В. В. Зорин // Башкирский химический журнал. – 2009. – Т. 16, № 2. – С. 165–166.
4 Чанышева А. Р. Взаимодействие ацетоксидианиона с 1,8-дибромоктаном / А. Р. Чанышева, А. В. Зорин, В. С. Климаков, Л. Н. Зорина // Актуальные проблемы технических, естественных и гуманитарных наук: материалы Международной научно-технической конференции. – Уфа, 2009. – C. 203–205.
5 Чанышева А. Р. Реакция металлированного ацетата лития с 1,4-дибромбутаном / А. Р. Чанышева, А. В. Зорин, В. С. Климаков, Л. Н. Зорина // Научное и экологическое обеспечение современных технологий: материалы VI Республиканской студенческой научно-практической конференции. – Уфа, 2009. – С.103.
6 Чанышева А. Р. Взаимодействие металлированной масляной кислоты с трет-бутилгипогалогенитами / А. Р. Чанышева, А. В. Зорин, В. С. Климаков,
Л. Н. Зорина // Научное и экологическое обеспечение современных технологий: материалы VI Республиканской студенческой научно-практической конференции. – Уфа, 2009. – С.104.
7 Чанышева А. Р. Взаимодествие металлированной масляной кислоты с трет-бутилгипоиодитом / В. С. Климаков, А. Р. Чанышева, А. В. Зорин,
Л. Н. Зорина // Международная научная студенческая конференция по естественнонаучным и техническим дисциплинам «Научному прогрессу – творчество молодых»: сборник материалов. – Йошкар-Ола, 2009. – С. 163.
8 Чанышева А. Р. Синтез дикарбоновых кислот в реакциях нуклеофильного замещения и окислительного сочетания с участием енолят-анионов ацилатов лития / А. Р. Чанышева, А. В. Зорин, В. В. Зорин // VII Всероссийская конференция с молодежной научной школой «Химия и медицина, Орхимед-2009»: материалы конференции. – Уфа, 2009. – С. 310.

