Н о в а ольга борисовна анатомо-эндоскопические и клинико-функциональные основы гастроэзофагеальной рефлюксной болезни
На правах рукописи
Д Р О Н О В А Ольга Борисовна
АНАТОМО-ЭНДОСКОПИЧЕСКИЕ И КЛИНИКО-ФУНКЦИОНАЛЬНЫЕ ОСНОВЫ ГАСТРОЭЗОФАГЕАЛЬНОЙ РЕФЛЮКСНОЙ БОЛЕЗНИ
14.00.27 Хирургия
14.00.02 Анатомия человека
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Оренбург - 2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Научные консультанты: доктор медицинских наук, профессор
ТРЕТЬЯКОВ Анатолий Андреевич
доктор медицинских наук, профессор
КАГАН Илья Иосифович
Официальные оппоненты:
доктор медицинских наук, профессор,
член. кор. РАМН
КУБЫШКИН Валерий Алексеевич
доктор медицинских наук, профессор
ЕСИПОВ Вячеслав Константинович
доктор медицинских наук, профессор
ВАГАПОВА Василя Шарифьяновна
Ведущая организация: Государственное образовательное учреждение высшего
профессионального образования «Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию».
Защита диссертации состоится «_____»______________2008 г. в __________часов на заседании диссертационного совета Д 208.066.02 при Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» (460000, г. Оренбург, ул. Советская 6).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Автореферат разослан «_____»__________________________2008 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук,
профессор Сайфутдинов Р.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Гастроэзофагеальную рефлюксную болезнь называют болезнью XXI века, так как она имеет тенденцию к распространенности (Т.Л. Лапина, 2002) и утяжелению течения (А.В. Калинин, 2004). В Японии распространенность ГЭРБ составляет 17,0%, в США – 30,0%, в Бельгии – 43,5%, а в России – до 60,0%. Среди лиц, страдающих гастроэзофагеальной рефлюксной болезнью в России, эзофагит имеют 45,0% – 80,0%, из них - 10,0% - 35,0% - тяжелой степени (В.Т. Ивашкин, А.С. Трухманов, 2003; А.С. Трухманов, 2004). Актуальность изучения гастроэзофагеальной рефлюксной болезни определяется не только широкой распространенностью этого заболевания, но и теми тяжкими осложнениями, которые возникают при этой болезни: язвенного эзофагита с периодическими кровотечениями или стенозированием органа, формированием пищевода Барретта, который относится к предраковым состояниям (В.А. Кубышкин, В.С. Корняк, 1999).
Актуальность проблемы гастроэзофагеальной рефлюксной болезни обусловлена еще и тем, что она может протекать под маской многих заболеваний, что затрудняет ее диагностику, а также отсутствием параллелизма между выраженностью эндоскопических и клинических проявлений (И.В. Маев с соавт., 2003).
Кроме того, актуальность гастроэзофагеальной рефлюксной болезни определяется особенностями эндоскопической анатомии пищеводно-желудочного перехода и отсутствием согласованного понимания вопросов совмещения анатомических и эндоскопических ориентиров в пищеводно-желудочном переходе. Так, проблемным является вопрос об уровне Z-линии по отношению к кардии, от чего зависит определение нормы или болезни. Существует мнение, что Z-линия и розетка кардии должны совпадать, если же она выше розетки кардии, то - это пищевод Барретта (Э.А. Годжелло, Ю.И. Галлингер, 2001). По мнению Р.А. Testoni (1997) Z-линия часто располагается выше кардии, в то время как Д.А. Ионкин (1999) указывает на довольно редкое расположение Z-линии выше нее.
Имеются разногласия и в отношении гистологического строения участка слизистой оболочки с цилиндрическим эпителием в пищеводе. Так, М.П. Королев с соавт. (2002), A. Paull et. al. (1976) различают три типа слизистой Барретта: донный, кардиальный и специализированный. В.И. Чиссов с соавт. (1988) выделяют 4 типа: фундальный, кардиальный, пищеводный и кишечный. И.В. Маев, 2000, Э.А. Годжелло, Ю.И. Галлингер (2001) считают, что диагноз пищевода Барретта может быть поставлен только при гистологическом выявлении специализированной метаплазии по кишечному типу. Между тем распространенность пищевода Барретта среди больных с эзофагитом составляет от 3,0% до 30,0%, а риск развития аденокарциномы на фоне пищевода Барретта повышается в десятки раз. (В.Т. Ивашкин, А.С. Трухманов, 2000; R.C. Haggil, 1986).
Пищевод Барретта встречается не только у взрослых, но и у детей в 7,0% - 13,0% случаев с рефлюкс-эзофагитом (E. Cooper et. al. 1987, С.-Х.М. Батаев с соавт., 2001).
Остается не до конца решенным вопрос о влиянии Helicobacter pylori на развитие гастроэзофагеальной рефлюксной болезни и пренеопластических осложнений. Существующие мнения противоречивы. Так, С.И. Рапопорт (2000), И.В. Маев (2002), G. Holtmann et al. (1998), J.F. Bretagne et al. (1998) считают, что присутствие Helicobacter pylori снижает риск развития гастроэзофагеальной рефлюксной болезни, по мнению P. Malfertheiner – способствует развитию заболевания, а R.S. Goffeld et. al. (1992) и J.A. Houck, S.G. Gucas (1999) не придают значение Нelicobacter pylori, так как наличие или отсутствие их не оказывает существенной роли на развитие заболевания и пренеопластических осложнений. Эпидемиологические исследования М.А. Виноградовой с соавт. (1998) отвергают роль бактериальной инфекции в патогенезе рефлюкс-эзофагита. Об определении Helicobacter pylori в цилиндрическом эпителии пищевода сведений мало (S.P. Gistert, S.M. Paj,ares, 2002). Вопрос о нахождении Нelicobacter pylori в пищеводе, о влиянии Нelicobacter pylori на течение гастроэзофагеальной рефлюксной болезни важен, так как это влияет на лечение, на целесообразность включения антихеликобактерной терапии в комплекс лечения гастроэзофагеальной рефлюксной болезни.
Важна диагностика пренеопластических осложнений гастроэзо-фагеальной рефлюксной болезни на ранних стадиях. В последние годы с этой целью стали использовать методы оптической спектроскопии, в частности, аутофлуоресценцию, которая является высокочувствительным и специи-фическим методом. Различные исследователи использовали в качестве лазерного источника возбуждения аутофлуоресценции в основном лазерный источник в ультрофиолетовом и синем диапазонах спектра (C.R. Kapatida et. al., 1990, R.L. Prosst et. al., 2002). Интересным представляется исследование, в которых в качестве возбуждения флуоресценции будет использован лазерный источник в зеленом диапазоне спектра.
Несмотря на значительное число работ, посвященных вопросам патогенеза гастроэзофагеальной рефлюксной болезни, до настоящего времени остается фактически невыясненной роль хеликобактерной обсемененности пищевода в развитии гастроэзофагеальной рефлюксной болезни и метаплазии слизистой пищевода, отсутствуют гистотопографические данные пищеводно-желудочного перехода при указанной болезни.
Цель и задачи исследования
Целью исследования является совершенствование диагностики и лечения гастроэзофагеальной рефлюксной болезни и некоторых ее осложнений на основе углубленных представлений о патогенезе и клинико-морфологических проявлениях этого заболевания.
Для достижения этой цели были поставлены следующие задачи:
- Уточнить макромикроанатомические характеристики пищеводно-желудочного перехода у лиц, не имевших заболеваний желудочно-кишеч-ного тракта.
- Выявить особенности функционального состояния нижнепище-водного сфинктера и варианты расположения Z-линии по отношению к розетке кардии у больных гастроэзофагеальной рефлюксной болезнью.
- Исследовать выраженность воспалительных и пренеопластических процессов в слизистой оболочке пищеводно-желудочного перехода у больных гастроэзофагеальной рефлюксной болезнью.
- Определить значение Helicobacter pylori в возникновении осложне-ний гастроэзофагеальной рефлюксной болезни.
- Оценить значение лазерного источника при возбуждении аутофлуоресценции в зеленом диапазоне спектра при локальной флуоресцентной спектроскопии и уровня антилизоцимной активности Helicobacter pylori для диагностики пренеопластических осложнений в слизистой оболочке пищеводно-желудочного перехода у больных гастроэзофагеальной рефлюксной болезнью.
- Изучить влияние некоторых хирургических заболеваний (язвенной болезни желудка и двенадцатиперстной кишки, болезнь оперированного желудка, грыжи пищеводного отверстия диафрагмы) на развитие гастроэзофагеальной рефлюксной болезни и ее осложнений.
- Выявить особенности кислотообразующей функции верхних отделов желудочно-кишечного тракта и моторно-эвакуаторной функции желудочно-кишечного тракта у больных гастроэзофагеальной рефлюксной болезнью.
- Оценить эффективность различных методов лечения гастроэзо-фагеальной рефлюксной болезни.
Научная новизна
В работе установлен ряд закономерностей и получен комплекс новых данных, характеризующих сущность гастроэзофагеальной рефлюксной болезни, улучшающих диагностику гастроэзофагеальной рефлюксной болезни и ее осложнений.
Дано анатомическое обоснование эндоскопических индивидуальных различий в уровне расположения и форме Z-линии, установлен диапазон различий в расположении Z-линии в норме и при гастроэзофагеальной рефлюксной болезни.
Впервые показаны формы гистотопографических взаимоотношений слизистых пищевода и желудка в виде образований пищеводно-желудочных дупликатур.
Доказано преобладание в слизистой оболочке пищевода Helicobacter pylori и повышение ее антилизоцимной активности у больных гастроэзо-фагеальной рефлюксной болезнью, сопровождающейся пренеопласти-ческими осложнениями.
Впервые выявлены пять вариантов рН-грамм при суточном мониторировании внутрипищеводного рН и три типа электрогастро-энтерограмм при периферической компьютерной электрогастро-энтерографии, соответствующие различным степеням эзофагита при гастроэзофагеальной рефлюксной болезни и определены критерии их для прогноза течения заболевания.
Впервые при возбуждении аутофлуоресценции в зеленом диапазоне спектра при применении локальной флуоресцентной спектроскопии выявлены различия между нормальным цилиндрическим эпителием пищеводно-желудочного перехода и метаплазированным по кишечному типу цилиндрическим эпителием.
Получены новые данные об особенностях клинических, эндоскопических проявлений гастроэзофагеальной рефлюксной болезни на фоне язвенной болезни желудка и двенадцатипертсной кишки, после резекции желудка и при грыже пищеводного отверстия диафрагмы.
Научно-практическое значение
Научно-практическое значение состоит, прежде всего, в возможности клинического использования двух новых разработанных способов ранней диагностики пренеопластических осложнений гастроэзофагеальной рефлюксной болезни, основанных на определении уровня антилизоцимной активности Helicobacter pylori, выделенного из слизистой оболочки пищеводно-желудочного перехода, и применении локальной флуоресцентной спектроскопии цилиндрического эпителия пищеводно-желудочного перехода при лазерном возбуждении аутофлуоресценции в зеленой области спектра.
Важным является выделение вариантов рН-грамм и типов электрогастроэнтерограмм, соответствующих определенной степени эзофагита у больных гастроэзофагеальной рефлюксной болезнью, что позволяет прогнозировать развитие болезни и своевременно назначать адекватное лечение.
В работе получена дополнительная информация, подтверждающая преимущества применения при резекции желудка по Бильрот-II поперечного антирефлюксного гастроэнтероанастомоза, обеспечивающего надежную профилактику гастроэзофагеального рефлюкса и связанных с ним осложнений.
Внедрение в клиническую практику комплекса методов диагностики гастроэзофагеальной рефлюксной болезни и ее осложнений, включающего эндоскопическое и морфологическое исследования пищеводно-желудочного перехода, определение Helicobacter pylori в цилиндрическом эпителии пищеводно-желудочного перехода и антилизоцимной активности микроба, проведение локальной флуоресцентной спектроскопии слизистой пищеводно-желудочного перехода при лазерном возбуждении аутофлуоресценции в зеленой области спектра, суточного мониторинга рН пищевода и периферической компьютерной электрогастроэнтерографии, позволяет значительно улучшить диагностику и результаты лечения заболевания.
Кроме того, результаты диссертационного исследования могут быть использованы при обучении студентов и переподготовке специалистов на кафедрах терапии, хирургии, эндоскопии, микробиологии, онкологии, а также при написании соответствующих разделов учебных пособий и монографий.
Основные положения диссертации, выносимые на защиту
- Различия в уровне расположения Z-линии по отношению к розетке кардии, особенности взаимоотношений пищеводного и желудочного эпителиев в месте их соединения, являясь вариантами нормы, в сочетании с морфологическими изменениями в области межэпителиального соединения, могут являться основой для развития пренеопластических осложнений гастроэзофагеальной рефлюксной болезни.
- Определение уровня антилизоцимной активности Helicobacter pylori в слизистой оболочке пищевода, проведение суточного мониторирования внутрипищеводного рН, компьютерной периферической электрогастроэнтерографии, локальной флуоресцентной спектроскопии расширяют возможности ранней диагностики гастроэзофагеальной рефлюксной болезни и ее осложнений.
- Неопластические осложнения гастроэзофагеальной рефлюксной болезни могут возникать у больных, не имеющих выраженных клинических и эндоскопических проявлений этого заболевания, что диктует необходимость проведения морфологического исследования слизистой оболочки пищеводно-желудочного перехода.
- Больные, перенесшие резекцию желудка по Бильрот-II в модификации Гофмейстера-Финстерера, больные с язвенной болезнью желудка и 12-перстной кишки, с грыжей пищеводного отверстия диафрагмы должны быть отнесены к группе риска по развитию гастроэзофагеальной рефлюксной болезни и ее осложнений.
Апробация работы и публикации
Материалы диссертации представлены и обсуждены на Областной научно-практической конференции хирургов, посвященной 100-летию со дня рождения профессора А.С. Альтшуля (Оренбург, 2000), на II научно-практической конференции врачей Приволжско-Уральского военного округа «Актуальные вопросы военно-практической медицины» (Оренбург, 2001), на научно-практической конференции, посвященной 15-летию ФППС Оренбургской государственной медицинской академии (Оренбург, 2001), на II межобластной конференции хирургов и онкологов «Актуальные проблемы хирургического лечения онкопатологии» (Бугуруслан, 2001), на 18 Всероссийской научной конференции с международным участием «Физиология и патология пищеварения» (Геленджик, 2002), на научно-практической конференции, посвященной 25-летию городской клинической больницы №1 Скорой медицинской помощи (Оренбург, 2002), на научно-практической Областной конференции эндоскопистов (Оренбург, 2001, 2003), на I съезде Россйского общества эндоскопии пищеварительной системы в рамках работы Восьмой гастроэнтерологической недели (г. Москва, 2002), на VI Московском международном конгрессе по эндоскопической хиругии (Москва, 2002), на Российской научно-практической конференции «Миниинвазивная хирургия в клинике и эксперименте» (г. Пермь, 2003), на учредительном съезде Российского общества хиругов-гастроэнтерологов «Физиология и патология заболеваний пищевода» (Сочи, 2004), на межрегиональной научно-практической конференции «Актуальные проблемы педиатрии» (Оренбург, 2004), на Областной конференции онкологов «Актуальные вопросы теоретической, экспериментальной и клинической онкологии (Оренбург, 2006), на VI Межрегиональной научно-практической конференции Приволжско-Уральского военного округа (Оренбург, 2005), в рамках XI гастроэнтерологической недели (г. Москва, 2005), на межрегиональной научно-практической конференции Приволжско-Уральского округа (Оренбург, 2008).
По материалам работы опубликованы 32 печатные работы, монография, пособие для врачей и получен один патент на изобретение №2229712.
Внедрение
По результатам выполненной работы опубликовано пособие для врачей, утвержденное Министерством здравоохранения РФ и получен патент на изобретение №2229712 «Способ диагностики пренеопластических осложнений гастроэзофагеальной рефлюксной болезни».
Результаты диссертационной работы внедрены в учебный процесс на кафедрах хирургии с эндоскопией факультета последипломной подготовки специалистов, оперативной хирургии и клинической анатомии, детской хирургии, микробиологии Оренбургской государственной медицинской академии.
Методы диагностики гастроэзофагеальной рефлюксной болезни, ее осложнений и лечения внедрены в работу эндоскопических служб, терапевтических, хирургических отделений Муниципальной городской клинической больницы №1 Скорой медицинской помощи г. Оренбурга, Центра детской хирургии, Оренбургской муниципальной городской детской клинической больницы, детской поликлиники №10 г. Оренбурга, Медицинского диагностического центра г. Оренбурга, в областных и районных больницах Оренбургской области.
Объем и структура диссертации
Диссертация изложена на 304 страницах и состоит из введения, восьми глав, выводов и указателя литературы, включающего 250 источников, в том числе 170 работ отечественных и 80 иностранных авторов. Указатель литературы составлен в соответствии с ГОСТ 7.1-84 «Библиографическое описание документа. Общие требования и правила составления», разработанного на основе международного стандарта ISBD.
Работа иллюстрирована 23 фотографиями макро- и микропрепаратов, 87 эндофотографиями, 5 рН-граммами, 9 электрогастроэнтерограммами, 27 рисунками и 70 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛ И МЕТОДИКИ
Общая характеристика объекта исследования
Настоящее исследование основано на изучении и анализе секционного и клинического материала.
Секционный материал составили 70 макропрепаратов пищеводно-желудочного перехода лиц умерших от заболеваний, не связанных с желудочно-кишечным трактом, а также 70 продольных гистотопограмм этого отдела.
Клинико-инструментальный раздел включил анализ клинической и эндоскопической картины у 1143 пациентов (таблица 1), из них – у 823 взрослых и 210 детей больных гастроэзофагеальной рефлюксной болезнью, и 110 – без заболеваний желудочно-кишечного тракта, 63–х суточных рН-грамм пищевода и 140 электрогастроэнтерограмм, полученных при проведении периферической компьютерной электрогастроэнтерографии.
Таблица 1 – Структура обследованных больных
| Структура обследованных больных | Количество пациентов | |
| Абсолютное число | Процентное выражение | |
| Дети | 210 | 18,4 |
| Взрослые: - с язвенной болезнью желудка и 12-перстной кишкой - после резекции желудка; - с ГПОД - с кровотечением -прочие патологии Без ГЭРБ | 823 200 112 28 112 371 110 | 72,0 17,5 9,8 2,5 9,8 32,4 9,6 |
| Всего | 1143 | 100,0 |
Исследованы биоптаты слизистой пищевода и желудка для определения морфологических изменений и определения Helicobacter pylori у 623 взрослых пациентов (538 больных гастроэзофагеальной рефлюксной болезнью и 84 – без патологии желудочно-кишечного тракта) и у 210 детей.
Изучены и проанализированы спектры, полученные при локальной флуоресцентной спектроскопии слизистой оболочки пищевода у 41 пациента во время эндоскопии, проведена фотодинамическая терапия пренео-пластических осложнений гастроэзофагеальной рефлюксной болезни в цилиндрическом эпителии пищевода у 11 больных.
Антилизоцимная активность определена у 72 больных гастроэзо-фагеальной рефлюксной болезнью: у 28 – с пренеопластическими осложне-ниями и у 44 – без них.
Методы исследования
В настоящем исследовании для решения поставленных задач использован следующий комплекс методов:
1. Морфологические методы исследования:
- Изготовление макропрепаратов пищеводно-желудоч-ного перехода;
- Изготовление продольных гистотопограмм пищевод-но-желудочного перехода с окраской срезов гематоксилином-эозином и по Ван-Гизону;
- Гистологический метод исследования биопсийного материала пищеводно-желудочного перехода и желудка.
- Общее клиническое исследование больных
- Эндоскопические методы исследования:
- Методика проведения эндоскопии и оценки слизистой пищеводно-желудочного перехода;
- Методика взятия биопсии;
- Методика локальной флуоресцентной спектроскопии эпителия пищеводно-желудочного перехода.
- Микробиологические методы:
- Методы выявления Helicobacter pylori (цитологи-ческий, гистологический, бактериологический и уреазные тесты);
- Определение антилизоцимной активности Helico-bacter pylori по методике О.В. Бухарина;
- Функциональные методы исследования:
- Суточный мониторинг внутрипищеводного рН;
- Компьютерная периферическая электрогастроэнтеро-графия.
- Методы вариационной статистики
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Индивидуальные различия в уровне расположения стыка пищеводного и желудочного эпителиев (Z-линии) и их значение при гастроэзофагеальной рефлюксной болезни
Актуальность этой проблемы вызвана разным толкованием пищеводно-желудочного перехода, кардии, Z-линии или нечеткостью в их определениях. Хотя имеются достаточно четкие определения этих образований, но некоторые исследователи (А.В. Кононов, 2004) их отождествляют, некоторые указывают на проблемность распознавания этого отдела (M. Дельво, Е.Д. Федоров, 2001; M. Taveuchi et. al., 2006).
Что касается соотношения Z-линии и кардии, то мнения также противоречивы, а от правильности понимания зависит определение понятий, в частности, пищевода Барретта. Н. Барретт в своей статье в 1950 году писал, что «пищевод должен быть ограничен сквамозным эпителием», т.е. Z-линия должна находиться на уровне розетки кардии, а если она выше кардии, то это уже патология. Этого же мнения придерживаются и Э.А. Годжелло и Ю.И. Галлингер (2001); Б.К. Поддубный, Ю.П. Кувшинов, О.А. Маликова (2002). Д.А. Ионкин (1999) указывает на довольно редкое расположение Z-линии выше кардии. По мнению P.A. Testoni (1997) Z-линия часто располагается выше розетки кардии.
С этой целью нами проанализированы макропрепараты пищеводно-желудочного перехода умерших от заболеваний не связанных с желудочно-кишечным трактом (норма) и эндоскопические исследования пищевода и желудка у пациентов, не имевших заболеваний желудочно-кишечного тракта (норма), а также эндоскопические исследования у больных гастроэзо-фагеальной рефлюксной болезнью.
Макромикроскопическая анатомия эпителия пищеводно-желудочного перехода
Проведенные исследования 70 макропрепаратов пищеводно-желудочного перехода (норма) выявили, что уровень стояния этой линии подвержен значительным индивидуальным различиям, которые укладываются в диапазон, ограниченный двумя крайними формами.
При одной крайней форме высота стояния линии стыка эпителиев составляет 40 мм над анатомической границей между пищеводом и желудком.
При другой крайней форме – пищеводный эпителий выстилает не только всю внутреннюю поверхность пищевода, но и переходит анатомическую границу между пищеводом и желудком и заходит в пределы желудка на расстояние до 18 мм.
На уровне границы между пищеводом и желудком линия стыка эпителиев обнаруживается лишь в 24,3%, ниже - в 12,9%, а в 62,8% - выше этой границы.
Причем, интерес представляет треть всех исследований (34,2%) с расположением линии стыка эпителиев от 10 до 40 мм, а из них – 7,0% - случаи с максимальной ее высотой от 20 до 40 мм.
Между двумя крайними формами располагаются наблюдения, представляющие собой варианты постепенного перехода от одной крайней формы к другой.
Различия гистотопографических взаимоотношений пищеводного и желудочного эпителиев в зоне пищеводно-желудочного перехода
Изучение 70 продольных гистотопограмм 40 секционных наблюдений показало, что главной гистотопографической особенностью пищеводно-желудочного перехода является взаимоотношение пищеводного и желудочного эпителиев в месте соединения. На 26 гистотопограммах (37,1%) соединение эпителиев происходило «в стык» или с незначительным захождением друг на друга в пределах менее одного миллиметра. В остальных 44 гистотопограммах пищеводный эпителий заходил на желудочный эпителий, то есть создавалась дупликатура. При этом каждый эпителий имел свою собственную пластинку.
Длина дупликатуры эпителиев может быть различной. В 17,2% она находится в пределах от 1 мм до 2 мм и может характеризоваться как небольшая, в 30,0% - в пределах от 2 до 5 мм и определяется как средняя и в 15,7% - в пределах от 5 до 9,4 мм и определяется как значительная.
Таким образом, размах диапазона длины дупликатуры эпителиев ограничен пределами от 0 до 9,4 мм.
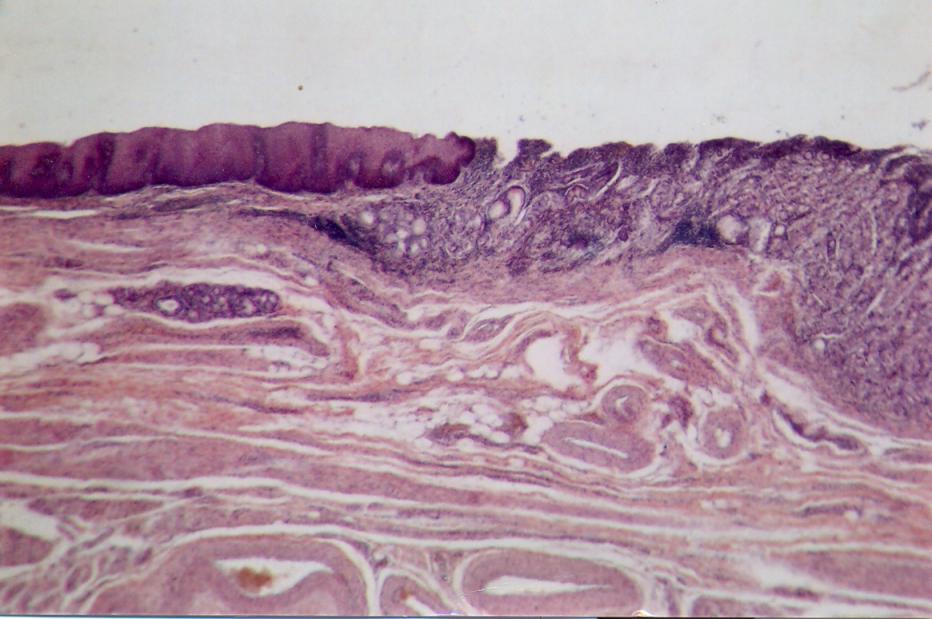
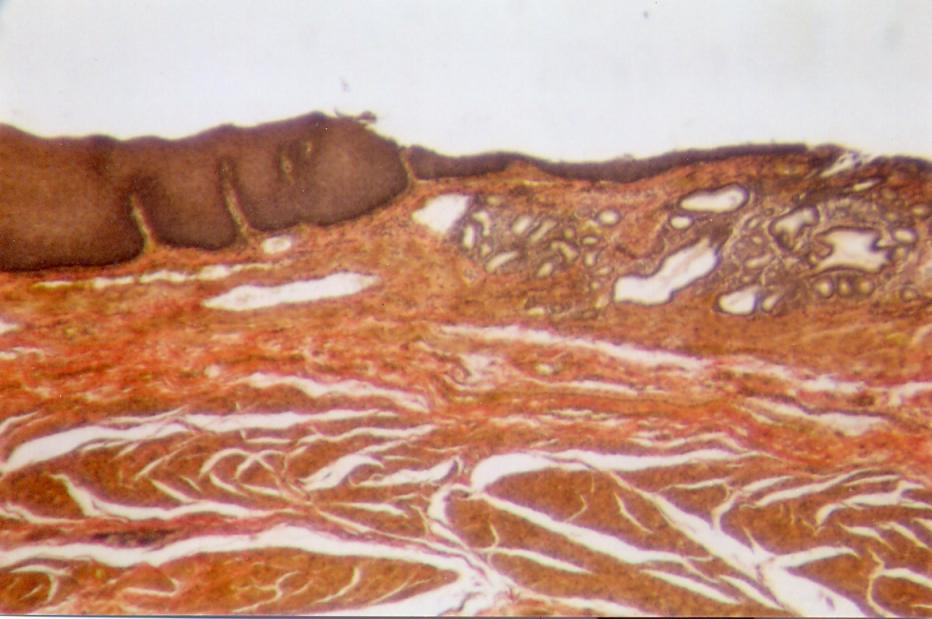
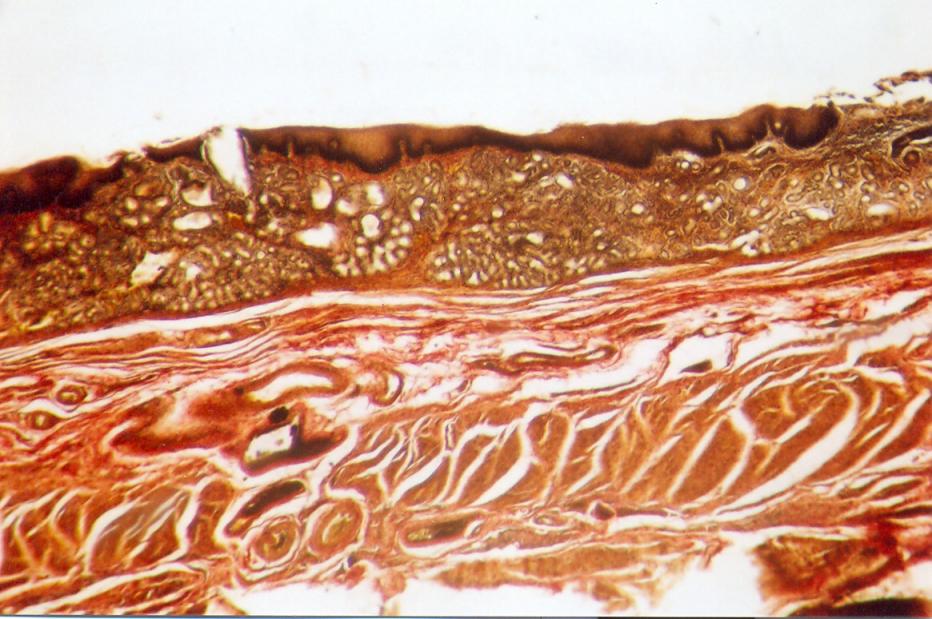
В описываемой зоне соединения пищеводного и желудочного эпителиев эпителиальные пласты претерпевают значительные морфоло-гические изменения, представленные на рис. 1.
Пищеводный эпителий перед соединением с желудочным в большинстве случаев утолщается (рис. 1Б, В). Если толщина пласта пищеводного эпителия на протяжении пищевода составляет 200-500 мкм, то перед соединением с желудочным она возрастает до 400-900 мкм.
При соединении с желудочным эпителием пласт пищеводного эпителия может резко обрываться без изменения его толщины (рис. 1А). Если же он немного заходит на конец желудочного эпителия, то окончание пищеводного эпителия приобретает коническую форму, укороченную или удлиненную (рис. 1Б). В наблюдениях, где пищеводный эпителий покрывает желудочный на расстоянии более 4 мм, эпителиальный пласт резко истон-чается до 150-200 мкм (рис. 1В, Г).
Желудочный эпителий в зоне соединения с пищеводным претерпевает существенные структурные изменения. Прежде всего, пласт желудочного эпителия утолщается, теряет свою обычную структуру. В нем преобладают гландулоциты, образующие скопления желудочных (кардиаль-ных) желез. Толщина таких железистых скоплений составляет до 15 мм, а длина до 60 мм (рис.1).
Во многих случаях они содержат микрополости или кисты. Вывод-ные протоки желез могут укрупняться, проходить через покрывающий пищеводный эпителий и открываться общим отверстием на его поверхности.
Превращение края желудочного эпителия в фактический железистый пласт, расположенный полностью или частично под пищеводным эпителием, заслуживает особенного внимания в связи с возможностью развития аденокарциномы в зоне пищеводно-желудочного перехода.

Пищеводный Железистый Пищеводный Железистый
эпителий эпителий эпителий эпителий
А Б

Пищеводный Железистый Желудочные Пищеводный Железистый
эпителий эпителий железы эпителий эпителий
В Г

Пищеводный Железистый Желудочные Пищеводный Железистый
эпителий эпителий железы эпителий эпителий
Д Е
Рис. 1 - Различия соединений пищеводного и желудочного эпителиев (объяснение в тексте). Продольные гистотопограммы. Окраска: Б. Е – гематоксилин-эозином, А, В, Г, Д – по Ван-Гизону. Фото через МБС-9. А, В – ок.6, об.7, Б, Г, Д, Е – ок.6, об. 4. А – наблюдение №25, м., 71 г., Б – наблюдение №8, ж., 44 г., В – на блюдение №48, м., 76 л.
Эндоскопическая анатомия пищеводно-желудочного перехода
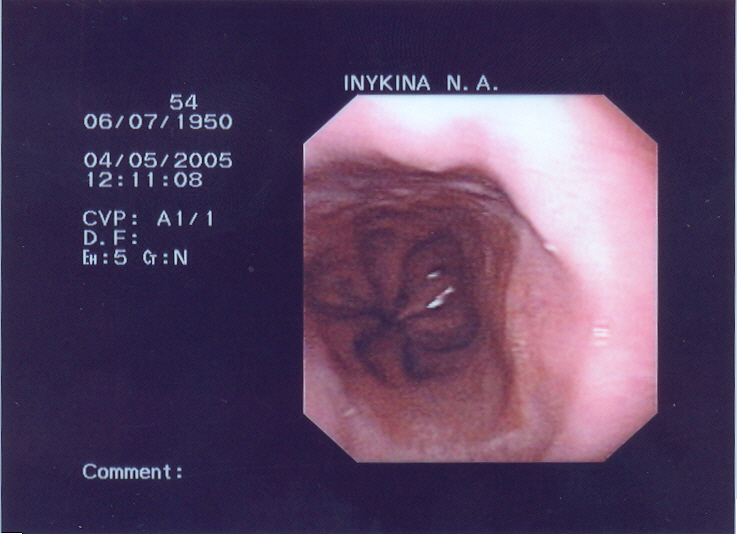
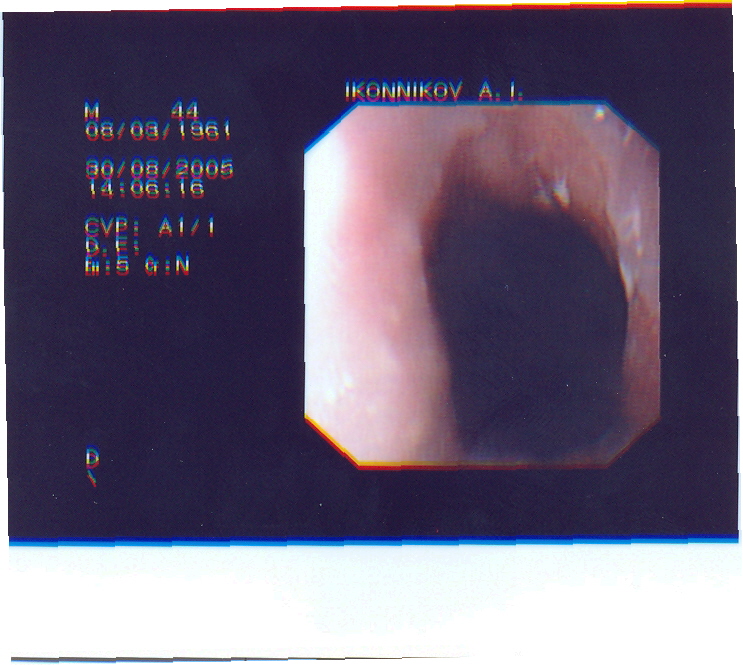
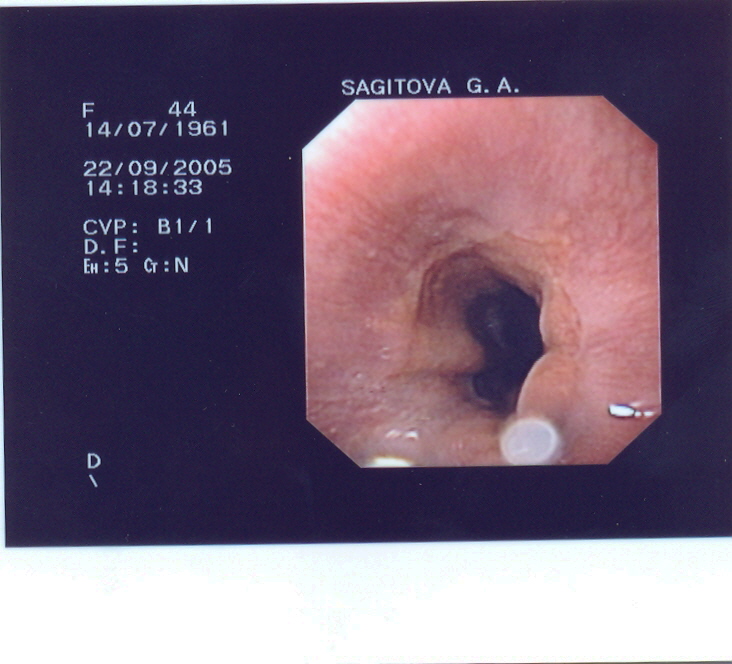
При эндоскопическом обследовании пищеводно-желудочного перехода у пациентов, не имевших заболеваний желудочно-кишечного тракта (норма), также выявлена вариабельность расположения Z-линии по отношению к розетке кардии. Также при одной крайней форме Z-линии располагалась до 40 мм выше розетки кардии (рис. 2А). Так в 71,8% случаев Z-линия находилась в пределах от 5 до 40 мм выше кардии. Другая крайняя форма имела место в 8,2% - до 18 мм ниже розетки кардии (рис. 2Б). На уровне розетки кардии Z-линия находилась лишь у пятой части пациентов (20,0%) (рис. 3А и Б). В эту группу включены варианты расположения Z-линии на 4 мм выше и ниже розетки кардии.
А Б
Рис. 2 - Различия в высоте расположения Z-линии по отношению к кардии (крайние формы) и форме фигур кардии в сомкнутом (А) и открытом (Б) состоянии (круглая, грушевидная).

А Б
Рис. 3 - Различия в уровне расположения Z-линии по отношению к кардии у пациентки С., 44 лет (эндофотография).
А – кардия в сомкнутом состоянии.
Б – кардия в раскрытом состоянии.
Различна форма Z-линии. Выделены следующие формы ее: волнистая, ровная, зубчатая, сложная, сочетание разных форм. Ровная и волнистая формы Z-линии выявлена в 64,5% случаев.
Большое разнообразие фигур, которые образованы Z-линией, выделены в группы: круглая, овальная, звездчатая, типа кленового листа, амебовидная, сложная. У пациентов без патологии желудочно-кишечного тракта преобладали простые и правильные формы фигур: овальная (61,8%), круглая (10,0%).
Обращает внимание факт различий форм отверстия кардии в сомкнутом и открытом состоянии.
В раскрытом состоянии преобладают овальная (53,6%) и круглая (38,2%) формы, в сомкнутом – щелевидная (50,9%) и круглая (45,5%), то есть правильные формы.
Эндоскопическая анатомия пищеводно-желудочного перехода при гастроэзофагеальной рефлюксной болезни
Среди 370 больных с гастроэзофагеальной рефлюксной болезнью Z-линия на уровне кардии определялась лишь в 16,8% случаев, а в 81,3% - выше розетки кардии, из которых от 10 до 40 мм – в 61,6%. В этой группе обследуемых появляются больные с расположением Z-линии от 40 до 60 мм выше кардии (2,4%). Ниже розетки кардии Z-линия спускается до 10 мм в 1,9% случаев.
Сопоставление уровней расположения Z-линии в условиях нормы и при гастроэзофагеальной рефлюксной болезни представлено в таблице 1.
Таблица № 1 Сопоставление уровней расположения Z – линии в условиях нормы и
при гастроэзофагеальной рефлюксной болезни
| Уровень располо-жения Z-линия по отношению к кардии (мм) | Линия стыка пи-щеводного и же-лудочного эпите-лиев на анатоми-ческих препара-тах (норма) | Эндоскопическая анатомия (норма) | |
| В норме | При гастроэзофагеальной рефлюксной болезни | ||
| Процент наблюдений | |||
| Процентное выражение (%) | Процентное выражение (%) | Процентное выражение (%) | |
| Выше на 40 – 60 | - | - | 2,4 |
| Выше на 20 - 39 | 7,1 | 10,0 | 27,0 |
| Выше на 10 – 19 | 27,1 | 30,0 | 34,6 |
| Выше на 5 – 9 | 28,6 | 31,8 | 17,3 |
| Уровень кардии | 24,3 | 20,0 | 16,8 |
| Ниже на 5 – 9 | 4,3 | 4,6 | 1,2 |
| Ниже на 10 - 18 | 8,6 | 3,6 | - |
| Всего: | 100,0 | 100 | 100,0 |
Симметричное расположение Z-линии по всем стенкам по отношению к розетки кардии из 370 больных имелось у 78 (21,1%), в других случаях – на разных уровнях.
У больных гастроэзофагеальной рефлюксной болезнью встречаются сложные формы Z-линии (языкообразная, сложная, типа кленового листа, зубчатая, сочетания разных форм) – в 51,8%, сложная форма фигур, которые она образует, - в 57,8%.
У этих больных преобладают и сложные формы кардии в открытом (46,2%) и в сомкнутом (53,2%) состояниях.
Эндоскопические проявления гастроэзофагеальной рефлюксной болезни в слизистой оболочке пищеводно-желудочного перехода
Учитывая вариабельность и диапазон уровней расположения Z-линии, а также смену уровня Z-линии после проведения эндоскопа в желудок, мы руководствовались правилами осмотра пищеводно-желудочного перехода:
- оценивать функцию розетки кардии и уровень расположения Z-линии до проведения эндоскопа в желудок и не доходя до розетки кардии 5,0 – 6,0 см;
- заброс желудочного содержимого в пищевод считать рефлюксом в том случае, если нет рвотного рефлекса;
- при биопсии из пищевода не должны использоваться щипцы, которыми проводилась биопсия в желудке или двенадцатиперстной кишке.
При эндоскопическом осмотре и описании пищеводно-желудочного перехода обращали внимание на:
- кардию – ее форму в раскрытом и сомкнутом состоянии, полноту и ритмичность смыкания ее стенок;
- стенки пищевода (эластичность, симметричность и глубину перистальтики);
- Z-линию – (форму ее, выраженность этих форм по всей окружности, форму фигуры, образованной Z-линией, симметричность ее по отношению к «розетке» кардии;
- слизистую выше Z-линии: выраженность сосудистого рисунка, отек (очагами, равномерный), очаги с цилиндрическим эпителием, дефекты, эрозии, язвы;
- слизистую ниже Z-линии – отек, гиперемию (равномерную, очагами, в виде полос), рыхлость, ранимость, зернистость, наличие «островков» плоского эпителия;
- наличие и характер рефлюксата (светлый желудочный, окрашенный желчью, желчный).
Эндоскопия пищеводно-желудочного перехода сопровождалась биопсией на цитологическое и гистологическое исследования, на наличие Helicobacter pylori по общепринятым правилам, а у части больных делалась контрольная биопсия в области кардии, в случае расположения Z-линии на уровне розетки кардии или ниже ее – вдоль Z-линии с захватом обоих видов эпителия.
При оценке степени эзофагита мы руководствовались Лос-Анджелесской классификацией, но считаем целесообразным учитывать изменения и в слизистой оболочке с цилиндрическим эпителием, находящейся в пределах пищевода.
При сравнении эндоскопических изменений в слизистой оболочке с цилиндрическим эпителием в пищеводно-желудочном переходе у больных гастроэзофагеальной рефлюксной болезнью с наличием и без Helicobacter pylori обнаружено, что для хеликобактер-позитивных больных в сравнении с хеликобактер-отрицательными характерны: отек (82,9% в сравнении с 29,4%), очаговая гиперемия (58,6% в сравнении с 19,1%), рыхлость (62,2% в сравнении с 6,8%), зернистость, а геморрагический компонент имелся только у хеликобактер-позитивных больных.
Эндоскопические и морфологические исследования позволили обратить внимание на факт наличия пренеопластических осложнений гастроэзофагеальной рефлюксной болезни при менее тяжелых степенях эзофагита. Существенным является частое отсутствие визуальных признаков кишечной метаплазии, дисплазии, а порой и интраэпителиальной аденокарциномы, на что указывают Э.А. Годжелло и Ю.И. Галлингер (2001).
Исследование возможностей лазер-индуцированной аутофлуоресценции нормального и метаплазированного эпителия
В настоящее время одной из важных задач диагностической службы является своевременное распознавание пренеопластических осложнений гастроэзофагеальной рефлюксной болезни для первичной профилактики онкопатологии этого отдела пищеварительной системы (А.С. Трухманов, 2002).
В последнее десятилетие в эндоскопии используется такая современ-ная технология, как оптическая спектроскопия и, в частности, локальная флуоресцентная спектроскопия, которая в целях диагностики тяжелой дисплазии и аденокарциномы пищевода была впервые применена в 1996 году (J. Haringsma, G. N. J. Tytgat, 2001). Хотя в последующие годы диагностическая эффективность этого метода изучалась во многих научных центрах (J. Bourg-Heckly et al., 2000; I. Georgakoudi et. al., 2001; K. K. Wong, 2001), но существуют только две зарубежные побликации, в которых изучались возможности аутофлуоресцентного детектирования метаплазированного эпителия слизистой пищеводно-желудочного перехода (K. Niepsuj, G. Niepsuj, W. Cebula et. al., 2003; L. M. Wong Kee Song, N. E. Marcon, 2001). Все исследования проводились при возбуждении аутофлуоресценции лазерными источниками в ультрафиолетовом или синем диапазонах спектра. Нами использован впервые в России для возбуждения флуоресценции лазерный источник в зеленом диапазоне спектра.
Были выявлены различия в спектрах аутофлуоресценции нормального цилиндрического и метаплазированного по кишечному типу цилиндри-ческого эпителия пищеводно-желудочного перехода при возбуждении в зеленой области спектра у 13 из 15 пациентов. Определены параметры спектров аутофлуоресценции (интенсивность флуоресценции и спектрально-флуоресцентный диагностический параметр Df) нормального цилиндри-ческого, плоского и метаплазированного по кишечному типу цилиндри-ческого эпителия и аденокарциномы пищеводно-желудочного перехода. Таким образом, локальная флуоресцентная спектроскопия при возбуждении аутофлуоресценции в ходе эзофагоскопии in vivo в реальном времени позволила получить диагностическую информацию, что способствовало взятию прицельной биопсии и позволило минимизировать их количество и провести своевременно диагностику и лечение.
Гастроэзофагеальная рефлюксная болезнь и Helicobacter pylori
Одной из проблем гастроэзофагеальной рефлюксной болезни является участие хеликобактерной инфекции в развитии заболевания. В настоящее время общепризнана и доказана центральная роль Helicobacter pylori в воз-никновении гастрита, язвенной болезни желудка и двенадцатиперстной кишки, а также в желудочном канцерогенезе (В.Т. Ивашкин, Ф. Мегро, Т.Л. Лапина, 1999; В.Д. Пасечников с соавт., 2004), а в развитии гастроэзофагеальной рефлюксной болезни еще не выяснена (А.А. Шептулин, 1999; А.С. Трухманов, 2002; А.А. Шептулин, В.А. Киприанис, 2006). На роль Helicobacter pylori в развитии гастроэзофагеальной рефлюксной болезни существуют 3 мнения: присутствие Helicobacter pylori снижает риск развития гастроэзофагеальной рефлюксной болезни (М.А. Виноградова с соавт., 1998; С.И. Рапопорт, О.Н. Лаптева, Н.Т. Райхлин, 2000; И.В. Маев, 2002; G. Holtmann, C.R. Cain, P. Malfertheiner, 1999), присутствие Helicobacter pylori играет отрицательную роль в развитии болезни (P. Malfertheiner, S.Veldhuyzen van Zanten, 1998) и наличие или отсутствие Helicobacter pylori не влияет на частоту возникновения гастроэзофагеальной рефлюксной болезни (F. Carbone, M. Neri, E. Zaterza et al., 1999). Но это преимущественно касается присутствия Helicobacter pylori в желудке. Известно определение Helicobacter pylori в цилиндрическом эпителии пищевода (J.P. Gisbert, J.M. Pajares, 2002), а сообщений о влиянии Helicobacter pylori на пренео-пластические преобразования цилиндрического эпителия в пищеводе не встретилось.
С этой целью нами обследованы 485 взрослых и 210 детей с гастроэзофагеальной рефлюксной болезнью. Пренеопластические осложнения в слизистой оболочке с цилиндрическим эпителием пищеводно-желудочного перехода обнаружены у взрослых в 13,2%, у детей – в 10,9%. Helicobacter pylori выявлен у взрослых – в 35,2%, у детей – в 31,4% случаев, а у больных с пренеопластическими осложнениями – в 79,1% и в 82,6% соответственно. У 64 (13,2%) больных с пренеопластическими осложнениями выявлена кишечная метаплазия – у 56 (11,6%), атрофия – у 33 (6,8%), дисплазия - у 8 (1,7%), аденокарцинома – у 2 (0,4%), а среди больных с кишечной метаплазией у 18 (3,8%) была неполная кишечная метаплазия, у 38 (7,8%) полная кишечная метаплазия. Причем чаще эти осложнения имели место на фоне эзофагита А степени – у 48 (75,0%).
Нelicobacter pylori был обнаружен у больных с неполной кишечной метаплазией в 83,3%, с полной кишечной метаплазией – в 81,6%. У больных с атрофией слизистой оболочки этого отдела – в меньшем проценте случаев – в 57,6%, с дисплазией – в 50,0%.
Сопоставление частоты развития пренеоплазий в антральном отделе, теле и пищеводе у 348 больных гастроэзофагеальной рефлюксной болезнью выявило, что атрофия в этих отделах наблюдается в убывающей последовательности: 30,5% - 17,6% - 7,5%, как и дисплазия: 1,8% - 1,2% - 0,9%, кишечная метаплазия в антральном отделе – в 14,4% в теле – в 8,3%, а в пищеводе – в 11,8%. Причем, неполная кишечная метаплазия в структуре общей кишечной метаплазии в антральном отделе составляет 32,0%, в теле – 17,2%, а в пищеводе 36,6%.
У этих больных Нelicobacter pylori выявлен при метаплазии в антральном отделе в 66,7%, в теле – 66,2%, в пищеводе – 83,3%, при атрофии – в 56,4% - 55,6% и 52,9%, т.е. обсемененность Нelicobacter pylori при атрофических процессах в желудке и пищеводе ниже, чем при кишечной метаплазии, но при этом Нelicobacter pylori при кишечной метаплазии в пищеводе выявляется чаще.
Таким образом, выявлен параллелизм между высокой частотой обсемененности Нelicobacter pylori слизистой пищеводно-желудочного перехода у больных гастроэзофагеальной рефлюксной болезнью с пренеопластическими осложнениями в ней.
Так как слизистая с цилиндрическим эпителием этого отдела пищевода имеет значительные морфологические изменения в отличие от подобной слизистой в желудке, то она может представлять тот благоприятный фон, на котором при наличии Нelicobacter pylori, кислого или щелочного рефлюкса, развиваются неопластические процессы.
Из этого следует, что антихеликобактерная терапия является оправданной в комплексном лечении гастроэзофагеальной рефлюксной болезни в случае обнаружения этого микроорганизма в желудке, а тем более в слизистой оболочке пищеводно-желудочного перехода, т.е. эрадикация Нelicobacter pylori может быть одним из компонентов профилактики пренеоплазий и аденокарциномы пищевода. Наше мнение совпадает с выводами Б.Н. Хренникова, Е.Е. Серегина (2004), В.Д. Пасечникова, С.З. Чукова (2006), N.A. Wright (1998), P. Malfertheiner et al. (2005): при отсутствии эрадикации Нelicobacter pylori отмечено прогрессирование неопластического и воспалительного процессов, а также Д.М. Кадырова с соавт. (2004), которые отмечают, что после резекции желудка по Бильрот-II реинфекция Helicobacter pylori и гастроэзофагеальный рефлюкс способствуют развитию воспалительных и атрофических процессов, поэтому необходима эрадикационная терапия, улучшающая функциональную реабилитацию больных.
При определении степени активности воспалительного процесса в слизистой оболочке с цилиндрическим эпителием пищеводно-желудочного перехода у хеликобактер-позитивных больных высокая и средняя степени активности воспалительного процесса выявлены в 51,9% и 39,4%, а низкая в 8,7%, а у хеликобактер-отрицательных – преимущественно (80,9%) низкая степень воспаления.
Анализ наших исследований обращает внимание на факт обнаружения пренеопластических осложнений гастроэзофагеальной рефлюксной болезни при менее тяжелых степенях эзофагита: в 75,0% при эзофагите А степени и лишь в 15,9% и в 9,1% при эзофагите В и С степени соответственно, а также не зависит и от возраста: встречается и в возрасте 20 – 30 лет (17,2%) и у детей (10,9%). Существенным является частое отсутствие характерных визуальных признаков кишечной метаплазии, дисплазии, а порой и интраэпителиального рака в слизистой с цилиндрическим эпителием в пищеводе.
Рядом исследователей установлено, что с кишечной метаплазией, а особенно со специализированной кишечной метаплазией, связан риск возникновения дисплазии, а затем аденокарциномы (В.И. Чиссов с соавт., 1998; Л.И. Аруин с соавт., 1999; В.А. Кувшинов, Б.С. Корняк, 1999; А.Ф. Черноусов с соавт., 2001; М.П. Королев с соавт., 2002; G.N. Tytgod et al., 1985). В настоящее время известно определение Нelicobacter pylori в пищеводе дистальнее Z-линии (J.P. Gisberg, J. M. Pajares, 2002). Но нет сведений об использовании антилизоцимной активности Нelicobacter pylori для диагностики пренеопластических процессов в пищеводе. Учитывая, что Нelicobacter pylori обладает антилизоцимной активностью, а в тканях на фоне развития раковой опухоли возрастает содержание лизоцима, (V.F. Vi; V.R. Huang, 1998), нами была предпринята попытка определить уровень антилизоцимной активности Нelicobacter pylori, выделенного со слизистой оболочки с цилиндрическим эпителием в пищеводе, при наличии пренеопластических осложнений гастроэзофагеальной рефлюксной болезни и без них. Было выявлено, что у больных гастроэзофагеальной рефлюксной болезнью при наличии кишечной метаплазии и дисплазии уровень антилизоцимной активности Нelicobacter pylori равен или более 2 мкг/мл (патент № 2229712 от 27 мая 2004 года), что позволило использовать эти результаты для выявления пренеопластических осложнений гастроэзофагеальной рефлюксной болезни на ранних стадиях.
Функциональное состояние желудочно-кишечного тракта у больных гастроэзофагеальной рефлюксной болезнью
Функциональное состояние желудочно-кишечного тракта оценивалось с помощью суточного мониторинга рН в верхних отделах желудочно-кишечного тракта.
Что касается суточной рН-метрии, то имеются работы, посвященные оборудованию, технике самого исследования, основным характеристикам рН-грамм (Е.Ю. Линар, 1988; Ю.Я. Лея, 1996; А.В. Охлобыстин, 1996; S. Mantilla et al., 1988). Много исследований, посвященных патогенезу, диагностике заболеваний верхних отделов желудочно-кишечного тракта (чаще всего заболеваний желудка и двенадцатиперстной кишки) у взрослых и детей (М.А. Осадчук, А.Ю. Кулиджанов, 2005; О.А. Саблин с соавт., 2002; П.Л. Щербаков, 2002), выявлению эффекта лекарственных препаратов на желудочную секрецию, на заживление эрозий в пищеводе (Б.Д. Старостин, Г.А. Старостина, 2004; M.P. Williams et al., 1998; C. Birbara et al., 2000), результату операции ваготомии (Ю.М. Панцырев с соавт., 2005). И.В.Маев (2000) предлагает 30 - часовую внутрипищеводную рН-метрию для оценки действия лекарственных препаратов, используемых при лечении больных гастроэзофагеальной рефлюксной болезнью. С.С. Белоусов, С.В. Муратов, А.М. Ахмад (2005), J.N.Tytgat (1998) привели сравнение распространенности гастроэзофагеального и дуоденогастрального рефлюксов, показаний среднесуточного рН и инфицированности Helicobacter pylori в желудке. Но среди большого количества работ не встретилось исследований, в которых бы указывалось на возможность с помощью суточной рН-метрии у больных гастроэзофагеальной рефлюксной болезнью предположить степень эзофагита и определить прогноз заболевания.
С этой целью нами проанализированы данные суточного мониторинга внутрипищеводного рН у 63 больных гастроэзофагеальной рефлюксной болезнью, имевших эзофагит А (50,8%), В (26,9%) и С (22,3%) степеней. Среди них кишечную метаплазию цилиндрического эпителия в пищеводе имели 10 (15,9%) и дисплазию – 2 (3,2%) больных. Наиболее значимыми показателями рН-грамм в диагностике изменений слизистой оболочки пищевода были: общее время закисления (рН < 4,0), общее количество гастроэзофагеальных рефлюксов и, что особенно важно, продолжительность рефлюкса. Выделено 5 вариантов рН-грамм соответственно степеням эзофагита и клиническим проявлениям (пищеводным и внепищеводным), которые представлены на рисунках 4-8. Так, для нормального состояния пищевода характерен I вариант рН-грамм, для эзофагита А степени – II (53,2%) и III (15,6%) варианты, для В степени – IV (88,2%) и для С степени – V (100,0%) вариант рН-грамм.
Больные гастроэзофагеальной рефлюксной болезнью с пищеводными симптомами имели I (100,0%) и II (88,2%) варианты, а с внепищеводными проявлениями – III (100,0%), IV (84,2%) и V (90,5%) варианты рН-грамм. Пренеопластические осложнения гастроэзофагеальной рефлюксной болезни обнаруживаются при меньшем общем количестве рефлюксов и при менее продолжительных рефлюксах, чем эзофагиты В и С степеней, что соответствует эндоскопическим и морфологическим соотношениям. Метаплазия и дисплазия цилиндрического эпителия в пищеводе выявлена при менее выраженных значениях рН-грамм, чем лейкоплакия многослойного плоского эпителия.
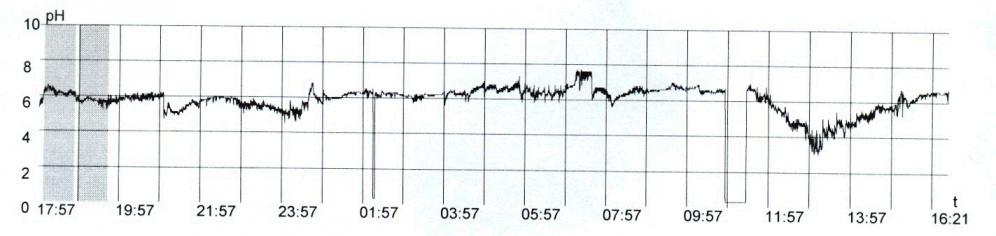
Рис. 4 - Больная М., 59 лет. Диагноз: Хронический гиперацидный хеликобактер-ассоциированный гастрит: А – 24 - часовая рН-грамма пищевода (I вариант)

Рис. 5 - Больной К., 31 год. Диагноз: Гастроэзофагеальная рефлюксная болезнь. Эзофагит степени А: А – 24 - часовая рН-грамма пищевода(II-вариант)
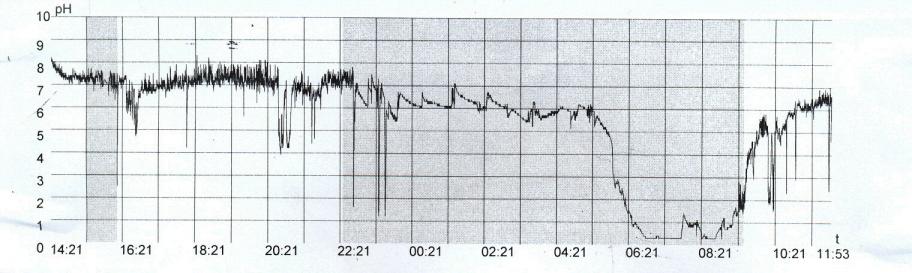
Рис. 6 - Больная Г., 38 лет. Диагноз: Гастроэзофагеальная рефлюксная болезнь. Эзофагит степени А. Пищевод Барретта: А – 24 - часовая рН-грамма пищевода(III-вариант)
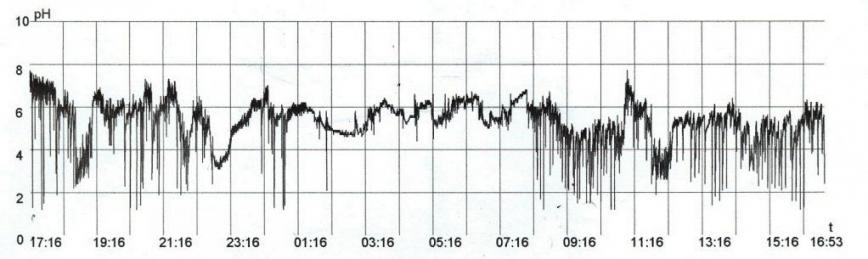
Рис. 7 - Больная П., 50 лет. Диагноз: Гастроэзофагеальная рефлюксная болезнь. Эзофагит степени В: А – 24 - часовая рН-грамма пищевод(IV – вариант)
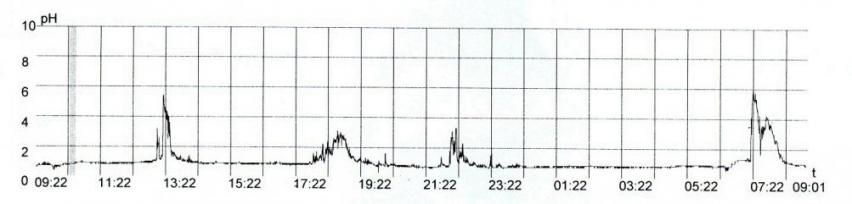
Рис. 8 - Больной И., 45 лет. Диагноз: Гастроэзофагеальная рефлюксная болезнь. Эзофагит степени С: А – 24- часовая рН-грамма пищевода(V-вариант)
Периферическая компьютерная электрогастроэнтерография – метод, характеризующий моторно-эвакуаторную функцию желудочно-кишечного тракта.
В последние годы в силу неинвазивности и хорошей переносимости пациентами электрогастроэнтерография все чаще используется для углубленного изучения патогенеза заболеваний, для их диагностики как у взрослых (H.P. Hугаева с соавт., 1998; С.Л. Пильская с соавт., 2000; С.А. Выскребенцева с соавт., 2002; В.А. Ступин с соавт., 2005; W.K. Kauer, 1999; J. Lin et. al., 2001), так и у детей (А.М. Запруднов, А.И. А.И. Волков, 1995; Л.Н. Цветкова, П.Л. Щербаков, В.А. Филин, 2000; Е.Е. Краснова, 2005). Г.Н. Шлякова указывает на возможность прогнозировать рецидив язвенной болезни с помощью электрогастроэнтерографии. Но мало исследований, посвященных гастроэзофагеальной рефлюксной болезни (С.А. Выскре-збенцева с соавт., 2002). Поэтому нами была поставлена задача с помощью периферической компьютерной электрогастроэнтерографии изучить некото-рые патогенетические моменты гастроэзофагеальной рефлюксной болезни, а также ее возможности в диагностике заболевания.
Моторную функцию желудка, двенадцатиперстной кишки, тощей, подвздошной и толстой кишок больных гастроэзофагеальной рефлюксной болезнью оценивали в тощаковую (I) и пищевую (II) фазы по показателям:
- уровня электрической активности (Pi/Ps), который указывает на выраженность кровоснабжения органов
- уровня коэффициента соотношения (или коэффициента сравнения), который свидетельствует о скоординированности работы между отделами (Pi/Ps+1).
Из 140 человек с гастроэзофагеальной рефлюксной болезнью, которым проведена периферическая компьютерная электрогастроэнтеро-графия, 88 человек (62,8%) были с эзофагитом степени А, 36 человек (25,7%) с эзофагитом степени В и 16 человек (11,5%) с эзофагитом степени С.
Из 140 больных гастроэзофагеальной рефлюксной болезнью, имеющих различные степени эзофагитов, нетипичные электрогастроэнтеро-граммы имели 22 (15,7%) человека.
Основываясь на показателях электрической активности и коэффициента соотношения различных отделов желудочно-кишечного тракта в тощаковую и пищевую фазы, выявлены нарушения моторно-эвакуаторной функции желудка, двенадцатиперстной кишки, тонкой и толстой кишок. Сопоставляя данные электрогастроэнтерографии и эндоскопии, удалось выделить три типа электрогастроэнтерограмм, характерные для каждой степени эзофагита, что схематически представлено на рисунках 9 и 10.
| Эзофагит | Электрическая активность | |||||||||
| Желудка (22,4±11,2) | 12-перстной кишки (2,1± 1,2) | Тощей кишки (3,35±1,65) | Подвздошной кишки (8,08±4,01) | Толстой кишки (64,0±32,01) | ||||||
| I фаза | II фаза | I фаза | II фаза | I фаза | II фаза | I фаза | II фаза | I фаза | II фаза | |
| Степень А | N max | N | N min | N | ||||||
| Степень В | N max | N | N min | N | ||||||
| Степень С | N max | N | N min | N | ||||||
Рис. 9 - Схематическое изображение изменений электрической активности различных отделов желудочно-кишечного тракта у больных гастроэзофагеальной рефлюксной болезнью
| Эзофагит | Коэффициент соотношения | |||||||
| Желудка (10,0±5,7) | 12-перстной кишки (0,6± 0,3) | Тощей кишки (0,45±0,25) | Подвздошной кишки (0,13±0,08) | |||||
| I фаза | II фаза | I фаза | II фаза | I фаза | II фаза | I фаза | II фаза | |
| Степень А | N | N | N | N | N | N | ||
| Степень В | N | N | N | N | N | N | ||
| Степень С | N | N | N | N | N | N | ||
Рис. 10 - Схематическое изображение изменений коэффициента соотношения различных отделов желудочно-кишечного тракта у больных гастроэзофагеальной рефлюксной болезнью
По нетипичным признакам электрогастроэнтерограммы больного с какой – либо степенью эзофагита можно предположить улучшение или утяжеления заболевания, что и было подтверждено клинически и эндоско-пиически.
По изменению электрической активности и коэффициента соотноше-ния выявляется нарушение скоординированности функции желудка и двенадцатиперстной кишки. Но также по этим показателям выявляются нарушения скоординированности между тонким и толстым кишечником, что также является патогенетическим моментом гастроэзофагеальной рефлюксной болезни.
В свою очередь нарушение скоординированности работы различных отделов желудочно-кишечного тракта приводит к гастроэзофагеальным рефлюксам. Суточное мониторирование внутрипищеводного рН свидетельствует о том, что в патогенезе гастроэзофагеальной рефлюксной болезни наряду с длительностью и степенью закисления в пищеводе, количеством патологических гастроэзофагеальных рефлюксов важное значение играет длительность рефлюкса.
Таким образом, представленные функциональные методы диагностики гастроэзофагеальной рефлюксной болезни дают возможность провести скрининг тяжести воспалительного процесса в пищеводе, определить необходимость морфологических исследований, дифференцировать внепищеводные проявления гастроэзофагеальной рефлюксной болезни от заболеваний соответствующих органов, а также прогнозировать течение заболевания.
Гастроэзофагеальная рефлюксная болезнь как осложнение некоторых хирургических заболеваний верхних отделов желудочно-кишечного тракта
В литературе уделяется значительное внимание таким осложнениям после резекции желудка, как синдрому приводящей петли, демпинг-синдрому, эрозивно-язвенным поражениям желудочно-кишечного анастомо-за (Е.И. Захаров с соавт., 1969; Ю.Е. Березов, Ю.В. Варшавский, 1974; Г.К. Жарков с соавт., 2000; Г.Л. Ли, Н.С. Тропская, 2002; Н.В. Медникова, 2002; В.И. Оноприев, И.Б. Уваров, 2002; А.С. Трухманов, 2002; М.В. Вусик, В.А. Евтушенко, Т.Я. Кучерова, 2005; Л.Ю. Зюбина с соавт., 2005; Д.М. Кадыров с соавт., 2005; С.А. Мунтян с соавт., 2005).
Имеются исследования, свидетельствующие о нарушении моторно-эвакуаторной функции верхнего отдела желудочно-кишечного тракта у больных после резекции желудка (Г.К. Жарков с соавт., 2000; Л.А. Иванов с соавт., 2002; М.А. Иванов с соавт., 2004).
В последние годы проводится большое количество исследований по изучению гастроэзофагеальной рефлюксной болезни и ее осложнений у лиц, не подвергшихся оперативному лечению органов брюшной полости (Э.А. Годжелло, Ю.И. Галлингер, 2001; А.В. Кононов, 2004; М.П. Корнев с соавт., 2002; В.А. Кубышкин, В.С. Корняк, 1999; Л.З. Ханамирова с соавт., 2002; D. Armstrong, A.L. Blum, M. Savary, 1999; F.T. Reters et al., 1999; A.J. Cameron, 1995; P.A. Testoni, 1997), в меньшей степени по изучению тяжелых клинических проявлений, значительно ухудшающих качество жизни боль-ных после резекции желудка, а также образованию стриктур и язв пищевода (Г.К. Жарков с соавт., 2000; Л.А. Иванов соавт., 2002; М.А. Иванов с соавт., 2005; С.Н. Романенко, 2007). Работ, посвященных развитию пренео-пластических осложнений ГЭРБ в пищеводе у больных после резекции желудка, мало (М.А. Иванов с соавт., 2004), также как и недостаточно исследований посвященных гастроэзофагеальной рефлюксной болезни на фоне язвенной болезни желудка и двенадцатиперстной кишки, (Е.Н. Зайцева с соавт., 2004; Д.В. Куклин, В.О. Тимошенко, В.В. Цуканов, 2007). Хотя исследований, посвященных проблемам язвенной болезни в целом, значительное количество (Х.М. Норов, К.М. Курбанов, 2005; О.В. Понятов с соавт., 2005), но отсутствуют сведения об особенностях клинических и эндоско-пических проявлений, пренеопластических осложнениях гастроэзофа-геальной рефлюксной болезни в пищеводе у больных с язвенной болезнью желудка и 12-перстной кишки, после резекции желудка и у пациентов с грыжей пищеводного отверстия диафрагмы, что и явилось побудительным моментом к исследованию.
При обследовании больных с язвенной болезнью желудка (36 человек) и двенадцатиперстной кишки (50 человек), перенесших резекцию желудка по Бильрот-II (112 человек) в модификации Гофмейстера-Финстерера (54 больных) и с формированием поперечного анастомоза (58 больных), а также больных с грыжей пищеводного отверстия диафрагмы (28 больных) гастро-эзофагеальная рефлюксная болезнь была выявлена в 64,5%, 74,7% и в 84,8% случаях соответственно.
У них имелись некоторые особенности клинических проявлений. Так, больные этих групп предъявляли жалобы (пищеводные и внепищеводные), характерные для гастроэзофагеальной рефлюксной болезни, но у больных с язвенной болезнью желудка и двенадцатиперстной кишки преобладала жа-лоба на изжогу различной локализации (в 90,7% случаев), после резекции желудка – на чувство горечи (50,0%), особенно в модификации Гофмейстера-Финстерера (92,6%), с грыжей пищеводного отверстия диафрагмы - на боль в эпигастрии, за грудиной (в 92,8%).
Эндоскопические проявления гастроэзофагеальной рефлюксной болезни были различны у этих больных: для больных после резекции желудка характерен эзофагит А степени (62,5%), с язвенной болезнью желудка и 12-перстной кишки - эзофагит А и В степеней (34,9% и 33,7%), с грыжей пищеводного отверстия диафрагмы – более тяжелые степени – В, С и D (35,7%; 25,0% и 21,4% соответственно). Пренеопластические процессы чаще осложняют гастроэзофагеальную рефлюксную болезнь у больных после резекции желудка (52,0%) по сравнению с больными с язвенной болезнью (33,7%) и с грыжей пищеводного отверстия диафрагмы (28,4%), несмотря на чаще встречающуюся хеликобактерную обсемененность при язвенной болезни желудка и 12-перстной кишки. Причем, достоверно чаще эти осложнения выявляются у больных, перенесших резекцию желудка по Бильрот-II в модификации Гофмейстера-Финстерера, при которой частота гастроэзофагеального рефлюкса желчью, обладающей детергентным действием, составляет 66,7% в сравнении с больными, у которых сформирован поперечный гастроэнтероанастомоз (8,9%). У больных язвенной болезнью желудка и двенадцатиперстной кишки достоверно чаще (16,0%) обнаруживается кишечная метаплазия и дисплазия цилиндрического эпителия пищеводного-желудочного перехода, чем у больных с язвенной болезнью желудка (8,3%). Резекция желудка по Бильрот-II с формированием поперечного анастомоза реже приводит к подобным изменениям в пищеводе (15,6% и 4,4%) в сравнении с формированием анастомоза Гофмейстера-Финстерера (20,0% и 10,0%).
Таким образом, больные из каждой исследуемой группы имеют особенности клинических и эндоскопических проявлений. У больных язвенной болезнью желудка и двенадцатиперстной кишки и больных перенесших резекцию желудка по Бильрот-II, особенно в модификации Гофмейстера-Финстерера, достоверно чаще гастроэзофагеальная рефлюксная болезнь осложняется пренеопластическими изменениями в цилиндрическом эпителии пищеводно-желудочного перехода, что диктует необходимость выделения этих больных в группу риска с периодическими контрольными обсле-дованиями с участием эндоскопии и морфологического исследования биоптатов, а хирургам следует рекомендовать отдавать предпочтение резекции желудка по Бильрот-II с формированием поперечного анастомоза, преимущества которого отмечают также Д.М. Кадыров, Х.Ш. Косимов, Д.М. Курбанов (2005).
Наши данные подтверждают, что гастроэзофагеальная рефлюксная болезнь – часто встречающееся заболевание с довольно частым хеликобактерным обсеменением слизистой оболочки пищеводно-желудочного перехода и дающее высокий процент пренеопластических осложнений в пищеводе как у взрослых, так и у детей.
Заболевание и его осложнение может не иметь выраженных клинических и/или эндоскопических проявлений, что диктует необходимость включать в комплекс методов диагностики биопсию слизистой оболочки с морфологическим исследованием, электрогастроэнтерографию, суточный мониторинг внутрипищеводного рН, локальную флуоресцентную спектроскопию, определение уровня антилизоцимной активности Helicobacter pylori, значительно увеличивают возможности диагностики заболевания и его осложнений.
ВЫВОДЫ
- Уровень соединения пищеводного и желудочного эпителиев по отношению к анатомической границе пищевода и желудка подвержен значительным индивидуальным различиям, которые укладываются в диапазон, ограниченный двумя крайними границами: выше кардии до 40 мм и ниже кардии до 18 мм. Такие различия могут рассматриваться как индивидуальные варианты анатомической нормы.
- Гистотопографические соотношения соединяющихся краев пищеводного и желудочного эпителиев в 52,9% случаев образуют пищеводно-желудочную дупликатуру с наложением пищеводного эпителия на желудочный на расстоянии до 10 мм. При этом пограничный отдел пласта желудочного эпителия претерпевает морфологические изменения, состоящие в его утолщении, изменении формы эпителиальных клеток, появлении многорядности эпителия и микрокист.
- Индивидуальная вариабельность уровня стояния Z – линии по отношению к розетке кардии, измеряемая при эндоскопических исследованиях, соответствует диапазону различий уровня расположения линии стыка пищеводного и желудочного эпителиев, установленных анатомическими исследованиями.
- У больных гастроэзофагеальной рефлюксной болезнью высота расположения Z-линии от 20 до 60 мм выше розетки кардии встречается в 3 раза чаще, чем у здоровых лиц, частота их сложных форм возрастает у больных гастроэзофагеальной рефлюксной болезнью на фоне язвенной болезни желудка и двенадцатиперстной кишки.
- Высокая частота обнаружения (до 83,1%) Helicobacter pylori у больных гастроэзофагеальной рефлюксной болезнью с пренеоплас-тическими осложнениями в слизистой оболочке абдоминального отдела пищевода, обнаружение повышенного уровня антилизоцимной актив-ности его, которая может являться одним из ранних признаков наличия пренеопластических процессов, позволяет присоединиться к мнению ряда исследователей о возможной патогенетической роли этого микроор-ганизма в развитии пренеоплазий пищеводно-желудочного перехода.
- Наличие в пищеводно-желудочном переходе очаговой гипер-емии, ранимости, рыхлости и зернистости слизистой оболочки с ци-линдрическим эпителием в 62,2% случаев сочетающиеся с обнаружением в ней Helicobacter pylori, может служить косвенным признаком присутствия этого микроба в слизистой оболочке пищевода.
- Разработанный способ диагностики пренеопластических осложнений гастроэзофагеальной рефлюксной болезни, основанный на определении уровня антилизоцимной активности Helicobacter pylori, выделенного из слизистой оболочки ниже Z-линии, позволяет выявлять пренеопластические осложнения на ранних стадиях их появления, когда отсутствуют клинические симптомы и эндоскопические признаки, провести своевременно дополнительные методы исследования, начать адекватное лечение.
- Суточный мониторинг внутрипищеводного рН и перифе-рическая компьютерная электрогастроэнтерография позволили выявить пять вариантов рН-грамм и 3 типа электрогастроэнтерограмм, каждый из которых соответствует степени эзофагита, отражает индивидуальные особенности клинических проявлений заболевания и позволяет прогнозировать течение болезни.
- Впервые примененный метод локальной флуоресцентной спектроскопии нормального и метаплазированного по кишечному типу цилиндрического эпителия пищеводно-желудочного перехода у больных гастроэзофагеальной рефлюксной болезнью при лазерном возбуждении в зеленой области спектра и полученные величины интенсивности аутофлуоресценции и спектрально - флуоресцентного диагностического параметра (Df) позволяют диагностировать пренеопластические ослож-нения заболевания на ранних стадиях.
- У пациентов с эндоскопически негативной формой гастроэзо-фагеальной рефлюксной болезни и/или отсутствием клинических симптомов комплекс методов диагностики, включающий биопсию слизистой оболочки с морфологическим исследованием, электрогастро-энтерографию, суточный мониторинг внутрипищеводного рН, локальную флуоресцентную спектроскопию, определение уровня антилизоцимной активности Helicobacter pylori, значительно увеличивают возможности диагностики заболевания и его осложнений.
- Сочетание в пищеводно-желудочном переходе слизистой оболочки с цилиндрическим эпителием, ее хеликобактерная обсемененность, воздействие кислоты и/или желчи при гастроэзофагеальном рефлюксе, морфологические изменения эпителиев в области их стыка в значительной степени увеличивают риск пренеопластических осложнений у пациентов гастроэзофагеальной рефлюксной болезнью.
- Сформированный при резекции желудка по Бильрот-II поперечный гастроэнтероанастомоз обладает антирефлюксными свойства-ми в отличие от методики Гофмейстера-Финстерера, при которой в 66,7% случаев возникает гастроэзофагеальный рефлюкс, что ведет к длитель-ному контакту слизистой оболочки пищевода с кислым и/или щелочным содержимым и развитию гастроэзофагеальной рефлюксной болезни, а также неопластических изменений.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При эндоскопическом исследовании пищевода рекомендуется соблюдать следующие правила осмотра: а) оценивать функцию розетки кардии до проведения эндоскопа в желудок, не доходя до нее на 5,0 – 6,0 см; б) оценивать уровень расположения Z-линии до осмотра желудка; в) гастроэзофагеальным рефлюксом считать заброс содержимого из желудка в пищевод при отсутствии рвотного рефлекса; г) биопсию со слизистой пищеводно-желудочного перехода проводить щипцами, которые не использовались при биопсии в желудке; д) при определении места биопсии в пищеводе необходимо учитывать индивидуальные различия и диапазон расположения Z-линии.
- Необходимо выполнять биопсию слизистой пищеводно-желудочного перехода не только у больных гастроэзофагеальной рефлюксной болезнью с тяжелыми степенями эзофагита, но и при степени А и Б, а также при эндоскопически негативной форме заболевания у взрослых и детей.
- Рекомендуется больным гастроэзофагеальной рефлюксной болезнью на фоне антирефлюксной терапии при наличии Helicobacter pylori в желудке и/или пищеводе проведение антихеликобактерной терапии для ликвидации воспалительного процесса и профилактики пренеопластических осложнений заболевания и нормализации моторной функции.
- Больных гастроэзофагеальной рефлюксной болезнью, перенесших резекцию желудка по Бильрот-II, особенно в модификации Гофмейстера-Финстерера, учитывая высокий процент неоплазий у них, целесообразно включать в группу риска по этим осложнениям с регулярным проведением эндоскопического и морфологического контроля.
- В качестве альтернативного выбора при резекции желудка по Бильрот-II рекомендовать хирургам формирование поперечного гастроэнтероанастомоза, при создании которого поперечные мышцы тощей кишки сохраняются, соустье обладает антирефлюкснами свойствами, обеспечивает порционную эвакуацию из культи желудка и предупреждает энтерогастроэзофагеальный рефлюкс и пренеоплас-тические изменения.
- Наличие в слизистой оболочке с цилиндрическим эпителием отека, очаговой гиперемии, рыхлости, ранимости, зернистости ее может свидетельствовать о наличии Helicobacter pylori в ней, что требует проведения биопсии с морфологическим исследованием (гистологи-ческим, цитологическим) и уреазных тестов.
Список работ,
опубликованных по теме диссертации
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь и предраковые изменения слизистой пищевода //Актуальные вопросы хирургии». Тезисы докладов Областной научно-практической конференции хирургов, посвященной 100-летию со дня рождения профессора А.С.Альтшуля. – Оренбург.- 2000. - С. 43-44.
- Маев, И.В. Секреторная, моторная функция желудка и двенадцатиперстной кишки, дуоденогастральный рефлюкс у больных язвенной болезнью двенадцатиперстной кишки /И.В. Маев, А.А. Самсонов, Л.П. Воробьев, Л.М. Салова, А.О. Занданов, О.Б. Дронова //Клиническая медицина. – 2000. - №6. – С. 39-42.
- Дронова, О.Б. Диагностические аспекты гастроэзофагеальной рефлюксной болезни //«Актуальные вопросы военно-практической медицины». Сборник трудов II научно практическая конференция врачей Приволжско-Уральского военного округа. – Оренбург. - 2001. – С.100-103.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь. //Достижения современной науки и практики в здравоохранении». Сборник трудов к 15-летию ФППС Оренбургской государственной медицинской академии. – Оренбург.- 2001. - С.162-165.
- Дронова, О.Б. Роль Нр в развитии гастроэзофагеальной рефлюксной болезни /О.Б. Дронова, В.А.Кириллов, Ф.Г. Гильмутдинова //Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2001. - Т. IX. - №5. - С.7.
- Дронова, О.Б. Эндоскопия в диагностике изменения слизистой пищевода при гастроэзофагеальной рефлюксной болезни / О.Б. Дронова, В.А. Кириллов, СБ. Зайцев, Е.В.Колесникова //Тез. докл. II межобластной конференции хирургов и онкологов «Актуальные проблемы хирургического лечения онкопатологии». – Бугуруслан. - 2001. – С. 153-160.
- Дронова, О.Б. Эрозивно-язвенные кровотечения у больных с гастроэзофагеальной рефлюксной болезнью /О.Б. Дронова, В.А. Кириллов //Сб. трудов 6 Московского Международного конгресса по эндоскопической хирургии. - Москва. – 2002. – С. 137-138.
- Дронова, О.Б. Эндоскопическая анатомия пищеводно-желудочного перехода // Морфология. – 2002. – Т. 121.- № 2-3. - С. 49.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь у детей /О.Б. Дронова, В.А. Кириллов //Рос. журн. гастроэнтерол., гепатол., колопроктол. - Приложение №17. – Москва. - 2002. - №5. - С. 6.
- Кириллов, В.А. Антилизоцимная активность Helicobacter pylori / В.А. Кириллов, О.Б. Дронова //Материалы 18 Всероссийской научной конференции с международным участием «Физиология и патология пищеварения». - Геленджик. - 2002. - С. 78-79.
- Дронова, О.Б. Кровотечения при эрозивно-язвенном эзофагите у больных с гастроэзофагеальной рефлюксной болезнью /О.Б. Дронова, В.А. Кириллов, С.Б. Зайцев, А.А. Жигалин //Материалы юбилейной научно-практической конференции, посвященной 25-летию городской клинической больницы скорой медицинской помощи. – Оренбург. – 2002. - С. 82-83.
- Кириллов, В.А. Факторы персистенции Helicobacter pylori /В.А. Кириллов, О.Б. Дронова, О.В. Бухарин //Журнал микробиологии, эпидемиологии и иммунобиологии. – 2003.- №4. – С. 8-11.
- Дронова, О.Б. Роль морфологического исследования слизистой оболочки пищевода при гастроэзофагеальной рефлюксной болезни /О.Б. Дронова, В.А. Кириллов, С.Б. Зайцев // Морфология. – 2003. - С. 48.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь у детей и изменения слизистой дистального отдела пищевода /О.Б. Дронова, В.А. Кириллов, С.Б. Зайцев //«Актуальные проблемы педиатрии». Материалы межрегиональной научно-практической конференции. – Оренбург. – 2004. - С. 146-147.
- Дронова, О.Б. Эндоскопическая анатомия и морфологическая картина пищеводного – желудочного перехода и зубчатой линии //«Актуальные вопросы хирургии и клинической анатомии». Сборник научных трудов Х научно-практической конференции в рамках международной выставки «Медицина и здоровье 2004», - Пермь. – 2004. - С. 43-45.
- Дронова, О.Б. Предраковые осложнения гастроэзофагеальной рефлюксной болезни у детей /О.Б. Дронова, В.А. Кириллов //Физиология и патология заболеваний пищевода. – Сочи. – 2004. - С. 61.
- Дронова, О.Б. Диагностические аспекты гастроэзофагеальной рефлюксной болезни у детей /О.Б. Дронова, В.А. Кириллов //III Российский конгресс «Современные технологии в педиатрии и детской хирургии». – Москва. – 2004. - С. 21-22.
- Дронова, О.Б. Пренеопластические осложнения гастроэзофагеальной рефлюксной болезни у детей // Рос. журн. гастроэнтерол., гепатол., колопроктол. - Приложение № 23. – Москва. – 2004. - Т. XIV. - № 5. - С. 5.
- Каган, И.И. Различия взаимоотношений эпителиев зоны пищеводно-желудочного перехода и их прикладное значение / И.И. Каган, О.Б. Дронова, А.О. Мирончев, СВ. Зайцев //Анатомо-физиологические аспекты современных хирургических технологий. Материалы Всероссийской научной конференции, посвященной столетию со дня рождения А.Н. Максименкова. - Санкт-Петербург. - 2006. - С. 95-96.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь патогенез, эндоскопическая анатомия, клиника и диагностика //Последипломная подготовка специалистов здравоохранения первичного звена. – Оренбург. - 2006. – С. 297-305.
- Дронова, О.Б. Клинико-морфологические аспекты пищевода Барретта при гастроэзофагеальной рефлюксной болезни //Клиническая анатомия и экспериментальная хирургия. Ежегодник Российской ассоциации клинических анатомов. Выпуск 6-й. Приложение к журналу «Морфологические ведомости». – Оренбург. – 2006. - С. 124-130.
- Дронова О.Б. Гастроэзофагеальная рефлюксная болезнь и язвенная болезнь желудка и двенадцатиперстной кишки (эндоскопические и морфологические изменения в слизистой пищеводно-желудочного перехода) /О.Б. Дронова, СБ. Зайцев // Вестник хирургической гастроэнтерологии.– 2006. - №1. - С. 81.
- Дронова, О.Б. Эндоскопическая анатомия пищеводно-желудочного перехода в норме и при гастроэзофагеальной рефлюксной болезни /О.Б. Дронова, С.Б. Зайцев //Актуальные вопросы теоретической, экспериментальной и клинической онкологии. – Оренбург. - 2006. - С. 306 – 312.
- Дронова, О.Б. Различия эндоскопической анатомии пищеводно-желудочного перехода у больных с рефлюкс-эзофагитом при язвенной болезни желудка и двенадцатиперстной кишки //Вестник хирургической гастроэнтерологии. -2006. – №1. - С. 61.
- Дронова, О.Б. Особенности эндоскопической анатомии пищеводно-желудочного перехода при язвенной болезни желудка и 12- перстной кишки у больных с гастроэзофагеальной рефлюксной болезнью //Морфология. - 2006 г. Т. 129. - №4. – С. 47.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь (Дискуссионные вопросы эндоскопической анатомии пищеводно-желудочного перехода и необходимости антихеликобактерной терапии). Обзор литературы //Вестник ОГУ. - 2006. – №12. - С. 182-185.
- Дронова, О.Б. Варианты рН-грамм у больных гастроэзофагеальной рефлюксной болезнью /О.Б. Дронова, А.Н. Мищенко //Рос. журн. гастроэнтерол., гепатол., колопроктол. Приложение №30. Материалы тринадцатой Российской Гастроэнтерологической недели. - 2007. - С. 6.
- Дронова, О.Б. Анатомо-эндоскопические особенности пищеводно-желудочного перехода и их клиническое значение /О.Б. Дронова, А.О. Мирончев //Вопросы реконструктивной и пластической хирургии.– 2007. - №3-4. - С. 40-42.
- Соколов, В.В. Флуоресцентные методы в эндоскопической диагностике тяжелых дисплазий и раннего рака пищевода Барретта / В.В. Соколов, О.Б. Дронова, Н.Н. Булгакова, А.Н. Мищенко, Г.В. Белова //Российский онкологический журнал. – 2008. - №3. – С 46-49.
- Дронова, О.Б. Флуоресцентные методы в диагностике тяжелых дисплазий и раннего рака пищевода Барретта (обзор литературы) /О.Б. Дронова, В.В. Соколов, Н.Н. Булгакова, А.Н. Мищенко, Г.В. Белова //Вестник хирургической гастроэнтерологии.– 2008. - №1. – С 68-74.
- Дронова, О.Б. Исследование возможностей лазер-индуцированной аутофлуоресценции в диагностике пищевода Барретта /О.Б. Дронова, А.А. Третьяков, А.Н. Мищенко, Н.Н. Булгакова //Сибирский онкологический журнал. – 2008.- №4(28). – С.11-16.
- Дронова, О.Б. Гастроэзофагеальная рефлюксная болезнь и Helicobacter pylori /О.Б. Дронова, А.А. Третьяков //Вестник хирургической гастроэнтерологии. – 2008. – №2. – С. 57-64.
Монография
Дронова, О.Б. Диагностика гастроэзофагеальной рефлюксной болезни /О.Б. Дронова, И.И. Каган, А.А. Третьяков, А.Н. Мищенко.– Оренбург. – 2008. – 92 с.
Пособие для врачей
Дронова, О.Б. Диагностика пренеопластических осложнений гастроэзофагеальной рефлюксной болезни: Пособие для врачей утвержденное Министерством здравоохранения РФ /О.Б. Дронова, О.В. Бухарин, А.А. Третьяков, И.И. Каган, А.Н. Мищенко. – Оренбург. – 2008. – 85 с.
Изобретение
Патент на изобретение №2229712 «Способ диагностики пренеопластических осложнений гастроэзофагеальной рефлюксной болезни» Авторы: О.В. Бухарин, А.А. Третьяков, О.Б.Дронова, В.А. Кириллов. 2004 г.
Подписано в печать 27.09.2008г.
Формат 60х84/16. Печать офсетная.
Усл. печ.л.2.0. Тираж 150экз. Заказ 3117.
Отпечатано в издательском центре ОГАУ.
460795, г. Оренбург, ул. Челюскинцев,18. Тел.(3532) 77-61-43.

