Нарушения сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями
На правах рукописи
УДК: 616.8-009.836:616.831-005-036.12:(616.1/.2+616.4)
ЛЮБШИНА
Ольга Владимировна
Нарушения сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями
14.01.04 - «Внутренние болезни»
14.01.11 - «Нервные болезни»
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2010
Работа выполнена в ГОУ ВПО «Московский государственный медико-стоматологический университет»
Научные консультанты:
Заслуженный деятель науки РФ,
доктор медицинских наук, профессор Верткин Аркадий Львович;
доктор медицинских наук, профессор Максимова Марина Юрьевна
Официальные оппоненты:
Академик РАМН, профессор, Соколов Евгений Иванович
Доктор медицинских наук, профессор Левин Яков Иосифович
Доктор медицинских наук, профессор Ощепкова Елена Владимировна
Ведущая организация:
ФГУ «Государственный научно-исследовательский центр профилактической медицины» Министерства здравоохранения и социального развития РФ
Защита состоится «___» ______________ 2010 г. в ___ часов на заседании диссертационного совета Д 208.041.01 при ГОУ ВПО «Московский государственный медико-стоматологический университет» Росздрава (127473, Москва, ул. Делегатская, д.20 стр.1)
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Московский государственный медико - стоматологический университет» Росздрава (127206, Москва,ул.Вучетича,д.10а)
Автореферат разослан «____»______________ 2010 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Ющук Е.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Сон – особое генетически детерминированное состояние организма человека и теплокровных животных (млекопитающих и птиц), характеризующееся закономерной последовательной сменой определенных полиграфических картин в виде циклов, фаз и стадий (В.М. Ковальзон, 1993).
Под инсомнией подразумевается количественный и качественный дефицит сна, необходимого для нормальной дневной деятельности, а в МКБ-10 она трактуются, как первично психогенное состояние с эмоционально обусловленным нарушением качества, продолжительности или ритма сна.
Интрасомнические расстройства в виде синдрома обструктивного апноэ во сне (СОАС), особенно часто наблюдаются у больных с метаболическим синдромом (МС). При этом авторы, изучающие эти взаимоотношения, отмечают четкую зависимость между сонным апноэ, дневной сонливостью, хроническим воспалением, резистентностью к инсулину и атерогенными заболеваниями (A.J.Scheen, 1999; E.Shahar et al., 2001; L.Kubik, 2004).
В свою очередь, СОАС является фактором риска для развития МС (C. Leineweber et al., 2003; J.Lam et al., 2004). Основанием для этого положения являются повышенные уровни триглицеридов и мочевой кислоты в крови у пациентов с сочетанием МС и СОАС (A.S.Gami V., K.Somers, 2004; Teramoto et al. 2008).
Расстройства дыхания во время сна у лиц с МС повышает риск развития тяжелых заболеваний сердечно-сосудистой системы (E.Shahar 2001; A.S.Gami, K.Somers, 2004; L.Kubik, 2004; S.Teramoto et al., 2005).
Более того, ряд авторов отмечают, что нарушения дыхания во сне занимают настолько значительное место в симптоматике МС, что предлагают включить в него СОАС (I.Wilcox et al., 1998; С.А.Бутрова, 2004).
Значительно меньше внимания уделено изучению архитектуры сна (характеристика фаз и стадий) при МС, его адаптивной функции и инсомническим расстройствам.
Патогенетически проблема МС тесно связана с дисфункцией интегративных неспецифических структур головного мозга – лимбико-ретикулярного комплекса, проявляющейся нейроэндокринно-обменными, эмоциональными, вегетативными, мотивационными и биоритмологичес-
кими расстройствами, в том числе нарушением цикла бодрствование-сон (Вейн А.М., 2003).
Известно, что основными причинами хронических цереброваскулярных заболеваний (ХЦВЗ) являются артериальная гипертония (АГ) с поражением артерий мелкого калибра (Fernandes J., de Oliveira R., Mamoni R. et al., 2008), атеросклероз, приводящий к нарушению проходимости крупных вне – и внутричерепных артерий, изменения коагулирующих и реологических свойств крови с наклонностью к тромбообразованию и др. (Johnston S. et al., 2004; Mathiesen E. et al., 2004; Purandare N. et al., 2006). При этом в структуре коморбидности больных с ХЦВЗ помимо АГ и атеросклероза выделяют и другие не менее важные состояния, такие как ожирение (Моисеев С.В., 2002) и сахарный диабет (СД) типа 2 (D. Nash, 2002; Ford E.S., Giles W.H., Dietz W.H., 2002). Это, вероятно, и обуславливает особенности течения и прогноз МС у больных с ХЦВЗ.
Известно, что особые вегетативные соотношения в период сна могут служить фактором риска развития или существенно изменять картину различных заболеваний, в том числе и цереброваскулярных (А.М. Вейн, Т.С. Елигулашвили, М.Г. Полуэктов, 2002).
В одном из исследований (Густов А.В., Мельникова Т.В., Гузанова Е.В., 2005) было показано, что более 85% пациентов с ХЦВЗ имеют инсомнию, проявляющуюся в нарушении качества и продолжительности сна.
Выживаемость пациентов с ХЦВЗ, у которых представлены все стадии сна, составляет 89%, а при отсутствии только фазы быстрого сна прогноз выживаемости снижается до 50% (Я.И.Левин, Г.В.Ковров, 2003).
В связи с этим изучение и выявление расстройств сна у больных МС и ХЦВЗ является актуальным, как с клинической точки зрения, так и с позиции разработки комплексной терапии указанных состояний.
Особую значимость проблемы подчеркивают прогнозы ВОЗ и других статистических организаций, согласно которым прогрессирующее постарение населения будет сопровождаться дальнейшем ростом и числа больных с ХЦВЗ.
Цель исследования:
Определить клинико-патогенетическую роль и фармакотерапию нарушений сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями.
Задачи исследования:
- Изучить патогенетические особенности нарушений сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями
- Провести анализ больных метаболическим синдромом с целью выделения паттернов клинических проявлений данного заболевания и особенностей нарушений сна при цереброваскулярной патологии.
- Выявить эффективность и безопасность применения гипнотиков без миорелаксирующего эффекта для коррекции расстройств сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями.
- Провести сравнительную эффективность гипнотиков без миорелаксирующего эффекта и селективных ингибиторов обратного захвата серотонина у больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями.
Научная новизна
Впервые проведено комплексное сомнологическое исследование, включавшее оценку как субъективных, так и объективных характеристик сна у больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями. Показана роль инсомнии в клинической картине и патогенезе артериальной гипертонии, сахарного диабета, ожирения и дисциркуляторной энцефалопатии.
Установлено, что жалобы пациентов не раскрывают в полной мере характер и степень выраженности нарушений сна у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями.
Впервые показано, что у больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями существует два типа нарушений сна: первый - характеризуется выраженными расстройствами дыхания во сне и вторичными изменениями архитектуры сна и второй - проявлениями психофизиологической инсомнии.
Отличительной особенностью первого типа является увеличение преимущественно второй стадии фазы медленного сна, что являлось вторичным по отношению к событиям во сне и связано с расстройствами дыхания (апноэ) в данной стадии. В клинической картине заболевания превалируют более высокие показатели системного артериального давления и индекса массы тела.
Для второго типа инсомнии характерным является увеличение представленности первой стадии фазы медленного сна, как проявление ограничения механизмов инициации и поддержания сна. В клинической картина заболевания это отражалось большей выраженностью психо-вегетативных расстройств с тревожно-депрессивными проявлениями.
Показано, что у всех больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями наблюдалось снижение представленности глубоких стадий фаз медленного и быстрого сна. Однако, у больных с расстройствами сна первого типа это являлось следствием вторичных активационных сдвигов (arousal) в результате апноэ и гипоксии мозга, а у пациентов второго типа данные изменения отражали недостаточность первичных механизмов инициации и поддержания сна.
Первый механизм предполагает преимущественное вовлечение в патологический процесс системы дыхания, возникновение событий во сне в виде дыхательных расстройств. Следствием этого является нарушение внутренней организации сна, в наибольшей степени его адаптивно-метаболическая функция (характерно для больных с ожирением).
Второй механизм связан с инсомническими расстройствами по стрессогенному типу с первичными нарушениями механизмов инициации и поддержания сна (характерно для больных с артериальной гипертензией).
Практическая значимость
Выявлена высокая значимость нарушений сна по типу психофизиологической инсомнии у больных артериальной гипертензией, их сочетание с более тяжелым течением основного заболевания по показателям системного артериального давления, частоты гипертонических кризов, выраженности психо-вегетативных расстройств.
Разработаны подходы комплексного исследования нарушений сна, включавшие количественную оценку субъективных жалоб, связанных с пре-, интра- и постсомническими расстройствами, метод объективной регистрации параметров сна – полисомнографию и оценку выраженности психо-вегетативных проявлений.
Показана эффективность разработанного метода, учитывающего изменения в цикле сон-бодрствование, эмоционально-мотивационной и вегетативной сферах, в клинической оценке расстройств психосоматического ряда.
У больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями была показана ассоциативная связь расстройств дыхания во сне и тяжести неврологической и соматической патологии, предполагавшую отношения по типу «порочного круга»: чем больше выраженность симптомов основного заболевания, тем больше предпосылок для формирования нарушений дыхания во сне (апноэ), и, чем тяжелее расстройства дыхания во сне – тем тяжелее течение заболевания.
Впервые разработана методика лечения инсомнии, основанная на дифференцированном подходе к больным метаболическим синдромом и хроническими цереброваскулярными заболеваниями.
При этом показано, что эффективность и безопасность препарата флуоксетин, повышающего уровень серотонина в центральной нервной системе, приводило к регрессу нейро-эндокринно-обменных расстройств, снижению массы тела и, как следствие, редукции расстройств дыхания во сне и вторичных нарушений архитектуры сна.
Использование зопиклона - гипнотика, не имеющего миорелаксирующего действия высокоэффективно для коррекции психофизиологической инсомнии.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ
- Нарушения ночного сна у больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями, представленных расстройствами дыхания и психофизиологической инсомнией, играют существенную роль в формировании заболевания и его клинической картины
- Среди больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями имеется два характерных клинико-патогенетических паттерна нарушений цикла сон-бодрствование. Первый - преимущественно связанный с нарушениями дыхания во сне, постсомническими расстройствами и вторичными нарушениями архитектуры сна, второй –с проявлениями психофизиологической инсомнии, психо-вегетативными расстройствами, первичными нарушениями архитектуры сна и недостаточностью его стресс-лимитирующей функции.
- Комплексная терапия больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями должна включать лечение, направленное на коррекцию цикла сон-бодрствование с учетом двух клинико-патогенетических паттернов. При выраженных расстройствах дыхания во сне и вторичных нарушениях архитектуры сна целесообразно применение препаратов, повышающих уровень серотонина в центральной нервной системе и влияющих на нейро-регуляторные процессы метаболизма. При проявлениях психофизиологической инсомнии и психо-вегетативных нарушениях целесообразно применение гипнотиков, не оказывающих миорелаксирующего действия.
ЛИЧНОЕ УЧАСТИЕ СОИСКАТЕЛЯ В РАЗРАБОТКЕ ПРОБЛЕМЫ.
Автор является организатором создания лаборатории полисомнографии и отделения преморбидных состояний на базе ГКБ № 81 Департамента здравоохранения Москвы, самостоятельно осуществлял набор пациентов, клиническое, инструментальное и лабораторное их обследование, заполнение соответствующих и специально разработанных для данного исследования учетных форм и клинических карт.
Диссертантом лично проведена статистическая обработка обобщенного материала, сделаны научные выводы и изложены практические рекомендации.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ.
Результаты работы внедрены и используются в практической деятельности консультативно-диагностических центрах ГКБ №50 и ГКБ №81 Департамента здравоохранения, кардиологических, терапевтических и неврологических отделений ГКБ №20, №50 и №81 Департамента здравоохранения Москвы и в учебно-методической работе со студентами и курсантами последипломного образования на кафедрах неврологии и клинической фармакологии, фармакотерапии и скорой медицинской помощи МГМСУ, а также в лекционном курсе и семинарских занятиях с курсантами НИИ неврологии РАМН.
АПРОБАЦИЯ ДИССЕРТАЦИИ
Материалы диссертации доложены на Сибирском национальном конгрессе «Здоровье человека как основа национальной безопасности» (Красноярск, 2006), 1st European Congress of the Aging Male (Warsaw, Poland, 2007), II Съезде кардиологов Сибирского федерального округа (Томск, 2007), Объединенном Российском Национальном конгрессе кардиологов и Конгрессе кардиологов стран СНГ (Москва, 2007), I и II Национальном конгрессе терапевтов (Москва, 2006, 2007), Круглом столе «Мужское здоровье как демографический фактор» комитета по социальной политики Федерального собрания РФ (Москва, 2007), Национальных конгрессах «Человек и лекарство» (Москва, 2008-2010), совместной межклинической конференция кафедр неврологии и клинической фармакологии, фармакотерапии и скорой медицинской помощи МГМСУ и сотрудников НИИ неврологии РАМН 18 марта 2010.
ПУБЛИКАЦИИ
По теме диссертации опубликовано 45 печатных работ, в том числе 13 в изданиях, рекомендованных ВАК РФ для публикации материалов диссертационных исследований, 6 монографий, в том числе 4 – в соавторстве, а также 1 методические рекомендации, утвержденные Департаментом здравоохранения Москвы
СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ
Диссертационная работа изложена на 210 страницах машинописного текста и состоит из введения, обзора литературы, материалов и методов исследования, главы с результатами исследования, заключения, выводов, практических рекомендаций и списка литературы. Диссертация проиллюстрирована рисунками, таблицами, клиническими примерами. Список литературы включает 200 источников (отечественных и зарубежных).
Содержание работы
Материал и методы исследования
Исследование характера, выраженности и распространенности расстройств сна проводилось у 264 больных с ХЦВЗ разделенных на 4 группы.
Первую группу составили 62 больных (30 женщин и 32 мужчин) с АГ и ХЦВЗ в возрасте 53,4±7,4 лет и длительностью 7,6±5,6 лет.
Вторая группа включала 42 пациента (27 женщин и 15 мужчин) с повышением индекса массы тела > 30 кг/м2 и ХЦВЗ в возрасте 49,3±7,3 лет.
В третью группу вошли 40 больных (25 женщин и 15 мужчин) с СД 2 типа и ХЦВЗ в возрасте 51,3±7,4 лет. Средний уровень глюкозы крови натощак составил 7,4±1,9 ммоль/л. Все пациенты получали в качестве сахароснижающей терапии глибомет.
Четвертую группу составили 120 больных (67 женщин и 53 мужчин) с МС и ХЦВЗ в возрасте 53,3±11,2 лет. Среди изучаемых пациентов преобладали больные с АГ 2 степени (70%). У 88 больных АГ имела кризовое течение, из них 58 пациентов принимали антигипертензивные препараты нерегулярно.
Контрольную группу составили 24 здоровых добровольцев (14 женщин и 10 мужчин) в возрасте 49, 3±8,2 лет.
Критериями исключения для исследуемых групп больных являлись: зависимость от алкоголя; психическое заболевание или недееспособность; отсутствие готовности больного к сотрудничеству; АГ 3 степени (АД > 180/ 110 мм рт. т.), а также вторичная АГ; прогрессирование АГ в течение последнего месяца; нарушение мозгового кровообращения или инфаркт миокарда или тромбоэмболия легочной артерии давностью менее 3 месяцев до исследования; сердечная недостаточность II-IV класса по классификации NYHA; стеноз устья аорты, билатеральный стеноз почечных артерий; нестабильная стенокардия или стенокардия напряжения III-IV функционального класса; тяжелые нарушения ритма и проводимости сердца; расстройство периферического кровообращения (I-IV фаза по Fontaine); выраженные неврологические нарушения; гипотиреоз и акромегалия и ряд др.
На завершающем этапе исследования больные 4-ой группы были разделены на две подгруппы в зависимости от степени нарушений дыхания во время сна, в том числе 1 подгруппа характеризовалась проявлениями психофизиологической инсомнии, 2 – выраженными расстройствами дыхания во сне. Пациентам 1 подгруппы был назначен зопиклон, 2 - флуоксетин.
Психологическое тестирование включало оценку двух ведущих составляющих эмоциональных расстройств: тревожности и депрессии (Госпитальная шкала тревоги и депрессии – Hospital Anxiety and Depression Scale; Zigmond A.S. et al., 1983).
Для оценки состояния когнитивных функций была использована шкала Mini-Mental State Examination (MMSE) (Folstain, 1975).
Суточное мониторирование АД (СМАД) больным с АГ осуществлялось с помощью аппарата ТМ – 2421 (AND, Япония) по стандартной методике.
Всем пациентам и лицам контрольной группы проводилась трансторакальная эхокардиография с использованием ультразвуковой диагностической системы «ACUSON Sequoia 512» (США) по стандартной методике.
Исследование сна
1. Субъективная оценка качества сна
Для исследования частоты и выраженности диссомнических проявлений у больных использовалась анкета субъективной оценки нарушений сна, разработанная в Сомнологическом центре МЗ РФ.
2. Объективная оценка параметров сна и событий во сне
Объективная оценка параметров сна проводилась с помощью полисомнографического исследования, включавшего параллельную регистрацию электроэнцефалограммы в центральных и затылочных отведениях в соответствии с международной системой 1020 (ЭЭГ), электроокулограммы (ЭОГ), электромиограммы подбородочной мускулатуры (ЭМГ).
Статистический анализ полученных в ходе исследования клинических данных выполнялся с использованием пакета прикладных программ «Statistica 6.0» (StatSoft, Inc., США) на компьютере IBM PC/AT-586. Количественные признаки, имевшие нормальное распределение, описывались средними (M) и среднеквадратическими отклонениями (s), не имевшие нормального распределения – медианами (Ме) и квартилями (Q1; Q3).
Для количественных признаков сравнение несвязанных групп проводилось с использованием теста Манна-Уитни. Анализ динамики признаков в группах проводился с использованием методов Вилкоксона. Для сравнения частот значений признаков в группах применялся критерий Хи-квадрат и точный критерий Фишера.
Различия считались статистически значимыми при достигнутом уровне значимости р<0.05.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ.
Исследование сна у больных с АГ и ХЦВЗ.
Жалобы на нарушения ночного сна предъявляли 97% пациентов. Средний суммарный балл оценки качества сна равнялся 16,1±4,3 баллам, что отражало выраженные расстройства сна у данной группы больных. Среди жалоб фигурировали трудность засыпания, пробуждения ранние или в течение ночи. Низкая субъективная оценка касалась всех основных характеристик сна, наиболее значимым было увеличение времени засыпания и повышение сновиденческой активности по сравнению с группой контроля (рис1).

р<0,05
Рис 1. Субъективная оценка сна у больных артериальной гипертензией и хроническими цереброваскулярными заболеваниями
При объективном исследовании сна методом полисомнографии было выявлено статистически значимое снижение индекса эффективности сна и общей длительности сна у больных с АГ и ХЦВЗ (78±2,2% и 384±72 мин, соответственно) по сравнению с группой контроля, р<0,05 (табл.1).
Таблица 1. Объективные показатели структуры сна больных у больных артериальной гипертензией и хроническими цереброваскулярными заболеваниями
| Показатели сна | АГ и ХЦЗВ | Контроль |
| Индекс эффективности сна (%) | 78±2,2# | 94±3,7 |
| Общая длительность сна (мин.) | 384±72# | 442±23 |
| Латентный период 1-ой стадии (мин.) | 31,5±9,8# | 9,1±2,9 |
| Бодрствование внутри сна (%) | 21,1±7,9# | 5,5±3,7 |
| 1-я стадия сна (%) | 18,5±10,7# | 3,8±2,3 |
| 2-я стадия сна (%) | 55,9±11,4 | 48,9±8,1 |
| Дельта-сон 3-я и 4-я стадии (%) | 11,7±7,8# | 23±3,2 |
| Фаза быстрого сна (%) | 12,9±6,5# | 24±3,8 |
# - различие с группой контроля - р < 0,05
У пациентов отмечались нарушения всех составляющих архитектуры сна, как фазы медленного, так и фазы быстрого сна, что свидетельствует о значимости структурных изменений сна. Также у больных данной группы было зарегистрировано статистически значимое удлинение времени засыпания (31,5±9,8 мин) и увеличение представленности бодрствования внутри сна (21,1±7,9%) по сравнению с группой контроля (р<0,01). Существенных расстройств дыхания во время сна у исследованных пациентов выявлено не было.
Для выявления возможной связи нарушений сна и тяжести основного заболевания было проведено разделение всех пациентов на две равные подгруппы – с относительно низким (13,8±2,5) и относительно высоким (18,1±2,1) средним баллом субъективной оценки сна, соответственно (табл.2, рис 2).
В результате анализа выявлена четкая зависимость тяжести субъективных жалоб на нарушение сна и выраженности нарушений архитектуры сна у больных с АГ и ХЦВЗ. Пациенты подгруппы 1 отличались от больных подгруппы 2 статистически значимо сниженным индексом эффективности сна, уменьшением времени общей длительности сна, удлинением латентного периода 1-ой стадии, увеличением времени бодрствования внутри сна, а также большей представленностью поверхностной 1-й стадии фазы медленного сна (р<0,05).
Таблица 2. Объективные показатели структуры сна у больных артериальной гипертензией и хроническими цереброваскулярными заболеваниями в подгруппах 1 и 2
| Показатели сна | Подгруппа 1 | Подгруппа 2 |
| Индекс эффективности сна (%) | 71±1,2#* | 83±2,7# |
| Общая длительность сна (мин) | 361±42#* | 401±57# |
| Латентный период 1-ой стадии (мин) | 40,8±10,3#* | 21,3±8,9# |
| Бодрствование внутри сна (%) | 28±4,3#* | 16,2±7,1# |
| 1-я стадия сна (%) | 23,1±5,9#* | 16±11,2# |
| 2-я стадия сна (%) | 53,1±9,5 | 56,3±11,9 |
| Дельта-сон 3-я и 4-я стадии (%) | 10,7±4,7# | 11,9±8,3# |
| Фаза быстрого сна (%) | 10,3±5,9# | 14,5±4,7# |
#различие с группой контроля, р < 0,05
* - различие между подгруппами 1 и 2, р < 0,05
Рис 2. Архитектура сна больных с артериальной гипертензией и хроническими цереброваскулярными заболеваниями
Относительно низкое качество сна ассоциировалось с достоверно более высокими показателями САД и ДАД, более частыми гипертоническими кризами и проявлениями психо-вегетативного синдрома с преимущественно тревожными расстройствами, р<0,05 (табл.2). При этом длительность основного заболевания в подгруппах не различалась.
Таблица 2. Клинические проявления артериальной гипертензии у больных 1-ой и 2-ой подгрупп
| Клинические проявления | Подгруппа1 | Подгруппа2 |
| САД (мм рт.ст.) | 161±13* | 156±10 |
| ДАД (мм рт.ст.) | 92±8,3* | 86±7,3 |
| Количество кризов в месяц | 4,3±4,3* | 1,2±4,3 |
| Длительность заболевания (лет) | 5,4±4,3 | 5,9±4,7 |
| Тревожность (баллы) | 13,4±4,2* | 9,3±2,9 |
| Депрессия (баллы) | 10,2±3,0 | 8,1±2,1 |
| Вегетативные расстройства (баллы) | 28,1±2,8* | 24,4±3,4 |
| Анкета сна (баллы) | 13,8±2,5* | 18,1±2,1 |
* - различие между подгруппами 1 и 2, р < 0,05
При анализе психологических характеристик в группе больных АГ было выявлено повышение показателей тревожных и депрессивных расстройств - 11,3±1,5 баллов 10,4±2,3 баллов, соответственно, и наличие выраженных вегетативных проявлений (27±5,9 балов) по сравнению с данными группы контроля, р<0,05.
Таким образом, у больных с АГ и ХЦВЗ выявлена убедительная связь субъективных и объективных параметров нарушений сна с показателями системного АД, частотой гипертонических кризов и выраженностью психо-вегетативных расстройств. Из этого следует, что сопряженность нарушений сна по типу психофизиологической инсомнии с выраженностью психо-вегетативного синдрома и тяжестью основного заболевания у больных с АГ и ХЦВЗ предполагает необходимость коррекции нарушений сна и нормализации его адаптационной функции, как для снижения выраженности психо-вегетативных расстройств, так и компенсации артериальной гипертензии.
Исследование сна у больных с ожирением и ХЦВЗ
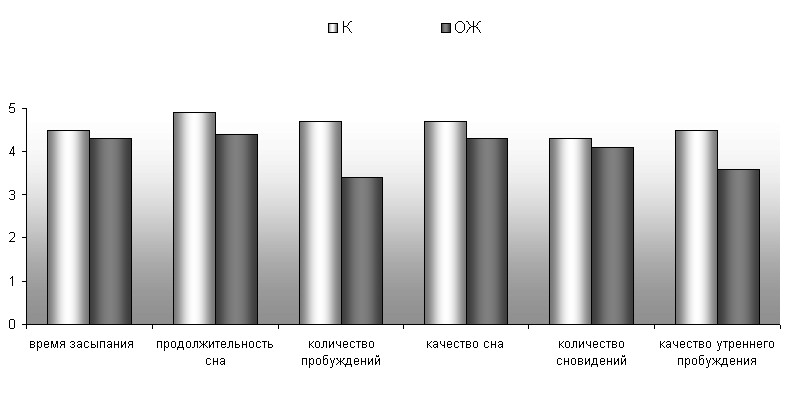
При исследовании субъективной оценки сна было определено, что 69% больных не были удовлетворены ночным сном. В структуре их жалоб наибольший удельный вес составляли постсомнические расстройства - низкое качество утреннего пробуждения, отсутствие бодрости после сна, увеличение времени включения в активную деятельность и др. (рис.3).
- р<0,05
Рис 3. Субъективная оценка сна больных с ожирением и хроническими цереброваскулярными заболеваниями
Средний балл субъективной оценки сна, однако, находился в пределах нормальных значений (21,2±3,3 балла). При этом 65% обследованных имели постоянный храп во время сна, 71% - отмечали выраженную дневную сонливость, у 59% - наблюдались утренние головные боли.
При полисомнографии было выявлено достоверное снижение общей длительности сна (375±71 мин.) и индекса его эффективности (80,7±19,2) по сравнению с группой контроля, р<0,05. У больных были увеличены латентный период 1-ой стадии сна, а также относительная представленность бодрствования внутри сна по сравнению с группой контроля (14,2±5,8 мин, 20,7±7,6% и 9,1±2,9 мин, 5,5±3,7% соответственно), p<0,05. Также отмечалось достоверное повышение представленности первой и второй стадий фазы медленного сна по сравнению с группой контроля (18,4±2,9%, 57,1±10,4% и 3,8±2,3%, 48,9±8,1%, соответственно), p<0,05.
У этих больных была выявлена редукция глубоких 3-ей и 4-ой стадий медленноволнового сна, их процентная представленность в структуре сна была статистически значимо ниже показателя группы контроля (9,4±6,9% и 23±3,2%, соответственно), р<0,01. Представленность фазы быстрого сна была статистически значимо снижена по сравнению с группой контроля (13,2±6,5% и 24±3,8% соответственно), р<0,05, а дыхательные расстройства (апноэ во сне) - значимо чаще, чем в группе контроля (индекс апноэ 17,1±9,8 и 5,3±1,4 соответственно), р<0,001. Насыщение крови кислородом (сатурация) было статистически значимо ниже, чем в группе контроля (84,2 ±1,4% и 96,4 ±1,1% соответственно), р<0,05.
Для исследования связи жалоб на нарушение сна и объективных показателей сна все пациенты с ожирением и ХЦВЗ были разделены на две равные подгруппы - с относительно низким (16,9±1,8) и относительно высоким (23,1±2,1) средним баллом субъективной оценки сна (табл. 3). По факторам возраста, пола, длительности заболевания данные подгруппы не различались.
Таблица 3. Объективные показатели структуры сна больных с ожирением и хроническими цереброваскулярными заболеваниями
| Показатели сна | с жалобами | без жалоб |
| Индекс эффективности сна (%) | 75,6±13,5#* | 83,5±11,7# |
| Общая длительность сна (мин) | 352±21# | 398±36# |
| Латентный период 1-ой стадии (мин) | 21,1±7,2#* | 7,6±4,2 |
| Бодрствование внутри сна (%) | 25,0±8,4#* | 15,9±3,3# |
| 1 стадия сна (%) | 18,7±1,3# | 18,3±3,0# |
| 2 стадия сна (%) | 48,6±11,9 | 64,0±7,0#* |
| Дельта-сон 3-я и 4-я стадии (%) | 16,5±8,9# | 5,3±3,4#* |
| Фаза быстрого сна (%) | 14,1±7,4# | 12,8±5,11# |
| Индекс апноэ (апноэ/час) | 10,1±4,2# | 23,8±10,4#* |
| Сатурация кислородом (%) | 89,0 ±1,9# | 78,9 ±2,1#* |
# - различие с группой К - р < 0,05
* - различие подгрупп ОЖ с жалобами и без жалоб - р < 0,05
Анализ межгрупповых показателей полисомнографии выявил диссоциацию между жалобами на нарушение сна с объективными показателями архитектуры сна и событиями во сне. При этом установлено повышение индекса апноэ и снижение сатурации кислородом у пациентов без жалоб по сравнению с подгруппой больных с жалобами и группой контроля (p<0,01).
Выраженное снижение индекса эффективности сна, повышение времени бодрствования внутри сна и латентного периода 1-ой стадии на фоне снижение представленности глубоких стадий фазы медленного сна и фазы быстрого сна было отмечено у больных 1 подгруппы и, вероятно, обусловлено инсомническими нарушениями первичного характера по типу психофизиологической инсомнии.
ИМТ у больных без жалоб достоверно превышал таковой у больных имеющих жалобы (34,9±1,9 кг/м2 и 31,5±1,1 кг/м2 соответственно, р<0,001). Эти подгруппы различались также и по уровню триглицеридов в сыворотке крови - 3,2±0,4 ммоль/л и 2,4±1,2 ммоль/л соответственно (р<0,01. При исследовании психо-вегетативного статуса (табл. 4) было зарегистрировано повышение уровня тревожных и депрессивных расстройств и выраженность вегетативных нарушений в 1 подгруппе (р<0,05).
Таблица 4. Характеристика психовегетативного статуса у больных с жалобами и без жалоб
| Показатели | С жалобами | Без жалоб |
| Депрессия (баллы) | 12,9±3,0#* | 10,1±6,3 |
| Тревожность (баллы) | 10,8±4,1#* | 7,9±2,1 |
| Вегетативные расстройства (баллы) | 38,5±3,9#* | 32,3±4,5# |
# - различие с группой К - р < 0,05; *- различие подгрупп - р < 0,05
Таким образом, больные с ожирением и ХЦВЗ с жалобами на нарушенный сон отличались наличием выраженного психо-вегетативного синдрома с тревожно-депрессивными проявлениями, сочетавшимся с первичными инсомническими расстройствами по типу психофизиологической инсомнии. Подобные изменения архитектуры сна характеризуют снижение адаптивной, стресслимитирующей его функции, что, возможно, имеет значение в формировании стрессогенных мотивационных расстройств, связанных с нарушением пищевого поведения (гиперфагической реакцией на стресс) и, как следствие, ожирением. Наличие у этих пациентов расстройств дыхания во сне (повышение индекса апноэ, снижение сатурации кислородом) позволяет диагностировать у них и вторичные расстройства сна, связанные с нарушением дыхания во сне. В то же время показатели степени ожирения не коррелировали с выраженностью жалоб на нарушение сна, но имели четкую связь с выраженностью расстройств дыхания во сне. Это связано с большей нагрузкой на мышцы, участвующие в акте дыхания при увеличении веса и сужением воздухоносных путей за счет преимущественного отложения жира в области шеи. Дыхательные расстройства во сне приводят к вторичным нарушениям архитектуры сна, в том числе редукции и фрагментации глубоких стадий фазы медленного сна. Это, в свою очередь, нарушает выделение гормона роста, обладающего липолитическим действием. По сути, происходит образование «порочного круга»: ожирениерасстройства дыхания во снередукция и фрагментация медленноволнового снаснижение выработки гормона ростаожирение и так далее. В результате происходит дальнейшее увеличение веса и нарастание тяжести дыхательных расстройств во сне.
Исследование сна у больных с сахарным диабетом и ХЦВЗ
У больных СД и ХЦВЗ было выявлено достоверное повышение уровня тревоги и депрессии (7,4±1,7 и 9,2±1,9 баллов, соответственно) по сравнению с группой контроля и наличие выраженных вегетативных проявлений (в среднем по группе – 35,4±7,2 балов, р<0,05).
Активные жалобы на нарушения ночного сна предъявляли 29% больных, средний суммарный балл субъективной оценки качества сна составил 18,2±5,3 балла, что отражало умеренную выраженность расстройств сна у этой группы пациентов (рис.4).
При этом было выявлено снижение индекса эффективности сна и общей длительности сна (77,3±9,7% и 372±26 мин в группе контроля, р<0,05), увеличение латентного периода наступления 1-ой стадии сна и относительная представленность бодрствования внутри сна (16,0±2,9 мин, 23,0±9,2% и 9,1±2,9 мин, 5,5±3,7%, соответственно, p<0,05), повышение
представленности первой стадии сна (19,5±4,1% и 3,8±2,3%, соответственно, p<0,05), нарушения глубоких 3-ей и 4-ой стадий медленноволнового сна (их процентная представленность в структуре сна достоверно была ниже показателя группы контроля -6,5±3,1% и 23±3,2%, соответственно, р<0,001), представленность фазы быстрого сна была снижена (15,9±4,7% и 24±3,8% соответственно, р<0,05), индекс апноэ составил 8,2±1,9 и 5,3±1,4, соответственно (р<0,05) а сатурация - 87,1 ±1,2% и 96,4 ±1,1%, соответственно (р<0,05).

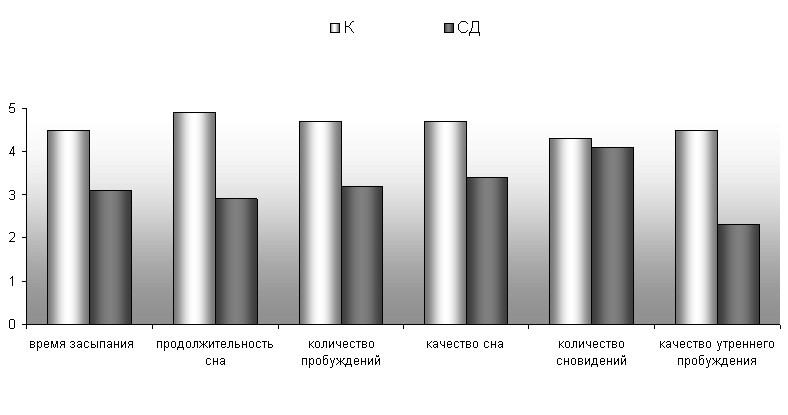
р<0,05
Рис. 4 Субъективная оценка сна больных с сахарным диабетом и хроническими цереброваскулярными заболеваниями
Для выявления связи инсомнических и интрасомнических расстройств с клиническими проявлениями СД и ХЦВЗ больные были разделены на две равные подгруппы (табл. 5) по 20 человек по фактору выраженности дыхательных расстройств во сне: с относительно высоким и относительно низким индексом апноэ (подгруппы СД условно с СОАС и СД и условно без СОАС, соответственно).
Таблица 5. Клиническая характеристика подгрупп сахарным диабетом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без с синдрома обструктивного апноэ во сне
| Клинические показатели | с СОАС | без СОАС |
| Длительность СД (годы) | 8,9±4,5 | 6,2±5,6 |
| Легкая степень тяжести СД (%) | 10 | 5 |
| Средняя степень тяжести СД (%) | 90 | 95 |
| Терапия инсулином (%) | 55 | 55 |
| Табл. препараты и инсулин (%) | 45 | 45 |
| Нефропатия (%) | 15* | 5 |
| Ретинопатия (%) | 70* | 35 |
| Макроангиопатия нижних конечностей (%) | 50 | 45 |
| Проявления сенсо-моторной полиневропатии (%) | 100 | 100 |
| Артериальная гипертензия (%) | 80 | 70 |
| ИБС стенокардия напряжения ФК I, ФК II (%) | 25 | 20 |
| Тревожность (баллы) | 5,0±1,7 | 7,7±1,4* |
| Депрессия (баллы) | 7,1±2,1 | 9,9±2,0* |
| Вегетативные расстройства (баллы) | 38,5±7.3* | 28,1±6,9 |
| Оценка качества сна (баллы) | 18,9±4,1 | 17,7±5,8 |
* - различие подгрупп СД с СОАС и без СОАС- р<0,05
Подгруппы не различались по половому составу, возрасту и индексу массы тела, но в 1 подгруппе было больше пациентов с осложненным течением СД (нефропатия и ретинопатия), и выраженными вегетативными расстройствами. 2 подгруппа имела более выраженные тревожно-депрессивные проявления (р<0,05).
При полисомнографии, наряду с изменениями архитектуры сна (снижение индекса эффективности сна, увеличение относительного времени бодрствования внутри сна, увеличение представленности 1 и 2-й стадии фазы медленного сна во 2-й и 1-й подгруппе соответственно, снижение представленности 3-й и 4-й стадий медленноволнового сна и фазы быстрого сна), выявлено закономерное повышение индекса апноэ и снижение сатурации кислородом в 1 подгруппе (табл.6, рис. 5).
Таблица 6. Объективные показатели структуры сна больных сахарным диабетом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без синдрома обструктивного апноэ во сне
| Показатели сна | СД и ХЦВЗ с СОАС | СД и ХЦВЗ без СОАС |
| Индекс эффективности сна (%) | 73,4±3,3#* | 82,5 ±3,8 |
| Общая длительность сна (мин) | 363±32# | 421±23 |
| Латентный период 1-ой стадии (мин) | 12,3±2,1 | 20,1±4,8#* |
| Бодрствование внутри сна (%) | 26,4±2,2#* | 18,3±3,1# |
| 1-я стадия сна (%) | 18,6±2,1# | 24,6±3,1#* |
| 2-я стадия сна (%) | 61,7±11,4#* | 49,1±8,1 |
| Дельта-сон 3-я и 4-я стадии (%) | 4,9±3,1#* | 8,5±2,2# |
| Фаза быстрого сна (%) | 14,9±4,2# | 16,2±3,9# |
| Индекс апноэ (апноэ/час) | 11,0±1,4#* | 5,5 ±2,2 |
| Сатурация кислородом (%) | 86,8 ±1,3#* | 92,4 ±1,5 |
# - различие с группой К - р < 0,05
* - различие подгрупп СД и ХЦВЗ с СОАС и без СОАС- р < 0,05
Выявленные изменения в подгруппе СД и ХЦВЗ без СОАС в совокупности со снижением представленности глубоких стадий фазы медленного сна и фазы быстрого сна характерны для первичных инсомнических расстройств - психофизиологической инсомнии.
Рис.5 Архитектура сна больных сахарным диабетом 2 типа и хроническими цереброваскулярными заболеваниями
При анализе вариабельности ритма сердца (ВРС) в состоянии расслабленного бодрствования было выявлено достоверное снижение общей вариабельности РС (SDNN и ТР) у всех больных СД по сравнению с группой контроля (табл.7). Показатели вариабельности ритма сердца в частотных диапазонах VLF (надсегментарные влияния), LF (преимущественно симпатические влияния), HF (парасимпатические влияния) также были снижены в обеих подгруппах больных СД по сравнению с показателями контролем (р<0,01). Данные изменения свидетельствуют о равномерном поражении как симпатических, так и парасимпатических вегетативных волокон у больных СД 2 типа как с СОАС, так и без СОАС. Однако, в подгруппе с СОАС снижение показателей общей вариабельности РС и вариабельности ритма сердца в отдельных частотных диапазонах было достоверно ниже данных показателей подгруппы СД без СОАС (р<0,05), что характеризовало более выраженные проявления диабетической автономной невропатии (ДАН) у больных СД с СОАС.
Таблица 7. Данные анализа вариабельности ритма сердца у больных сахарным диабетом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без с синдрома обструктивного апноэ во сне
| Показатели ВРС | СД и ХЦВЗ с СОАС | СД и ХЦВЗ без СОАС | К |
| RRNN (мс) | 675±12#* | 695±14# | 893±13 |
| SDNN (мс) | 24,1±1,1#* | 27,2±0,9# | 39,8±0,7 |
| ТP (мс2) | 580±10#* | 620±9# | 1023±12 |
| LF (мс2) | 267,4±9,3#* | 285,3±14,0# | 403,5±5,2 |
| НF (мс2) | 34,4±8,1#* | 69,6±7,7# | 113,8±6,5 |
| VLF (мс2) | 243,6±5,3#* | 260,4±8,2# | 432,1±5,0 |
| LF/НF | 3,8±0,1#* | 2,4±0,1# | 1,7±0,07 |
#различие с группой К, р < 0,01
* - различие между подгруппами СД с и без СОАС, р < 0,05
Таким образом, можно заключить, что больные СД 2 типа и ХЦВЗ без ожирения с расстройствами дыхания во сне (апноэ) отличались более частым развитием нефро- и ретинопатии, а также ДАН. У больных СД и ХЦВЗ с СОАС было выявлены вторичные нарушения архитектуры сна в виде снижения индекса эффективности сна, увеличения времени бодрствования внутри сна, увеличения представленности 2-й стадии фазы медленного сна, снижения представленности 3-й и 4-й стадий медленноволнового сна и фазы быстрого сна на фоне расстройств дыхания во сне (arousal-эффект). Больные сахарным диабетом 2 типа и ХЦВЗ без СОАС характеризовались большими тревожно-депрессивными проявлениями и изменениями архитектуры сна, характерными для психофизиологической инсомнии: удлинении латенции ко сну, увеличении представленности 1-й стадии фазы медленного сна при снижении представленности глубоких стадий фазы медленного сна и фазы быстрого сна.
Особо следует подчеркнуть ассоциативную связь расстройств дыхания во сне и выраженность периферических вегетативных нарушений у больных СД предполагающую отношения по типу «порочного круга»: чем больше выраженность ДАН, тем больше предпосылок для формирования нарушений дыхания во сне (апноэ), и, чем более выражены расстройства дыхания во сне – тем чаще формируются осложнения СД, в том числе и ДАН.
Исследование сна у больных с метаболическим синдромом и ХЦВЗ
Больные с МС и ХЦВЗ предъявляли жалобы на головные боли, классифицируемые как головные боли напряжения в 94% случаев, несистемное головокружение – в 20%, шум в голове и ушах – в 20%, расстройство памяти – в 30%, снижение работоспособности – в 30%, хронические боли вертеброгенной природы (боли в спине) – в 60% случаев, синдром вегетативной дистонии с перманентными – в 88% случаев и пермаментно-пароксизмальными – в 10% случаев проявлениями.
У этих лиц (табл. 8) выявлено статистически значимое повышение уровня депрессии (8,4±2,1 баллов), тревожности (7,3±1,7 балла) и клинически значимых проявлений синдрома вегетативной дистонии (32,7±6,2 балла) по сравнению с группой контроля (р<0,05).
Таблица 8. Показатели психо-вегетативного статуса больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями
| Показатели | МС и ХЦЗВ | Контроль |
| Тревожность (баллы) | 7,3±1,7# | 4,3±1,2 |
| Депрессия (баллы) | 8,4±2,1# | 5,4±1,7 |
| Вегетативная дистония (баллы) | 32,7±6,2# | 15,5±3,8 |
# - различие с группой контроля, р < 0,05
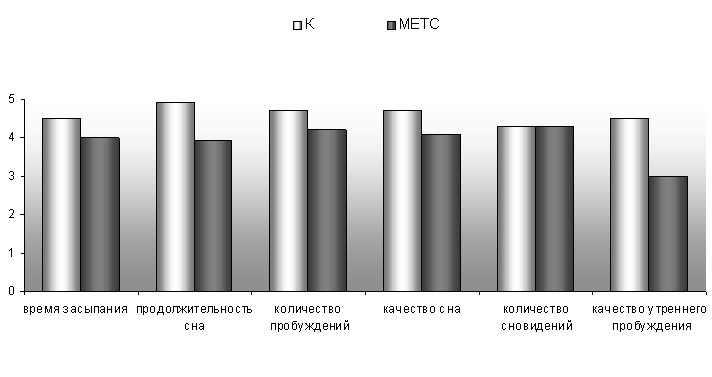
Жалобы на неудовлетворенность ночным сном были отмечены в 91% случаев. При субъективной оценке сна отмечалось низкое качество утреннего пробуждения, однако средний суммарный балл оценки качества сна находится в пределах нормальных значений - 24,3±2,2 балла. В структуре предъявляемых жалоб преобладали вышеперечисленные постсомнические нарушения, в то время как проблемы засыпания практически отсутствовали, а интрасомнические жалобы выявлялись только при активном, направленном расспросе (рис. 6).
P<0,05
Рис 6. Субъективная оценка сна больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями
При полисомнографии (табл.9) было выявлено статистически значимое снижение индекса эффективности сна по сравнению с группой контроля (85,1±8,8%, 94±3,7%, соответственно, р<0,05), увеличение представленности времени бодрствования внутри сна (11,3±2,7% и 5,5±3,7%, соответственно, р<0,05), что сочеталось с жалобами на частые пробуждения при активном направленном расспросе больных.
Таблица 9 Объективные показатели структуры сна больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями
| Показатели сна | МС и ХЦЗВ | Контроль |
| Индекс эффективности сна (%) | 85,1±8,8# | 94±3,7 |
| Общая длительность сна (мин.) | 421±35 | 442±23 |
| Латентный период 1-ой стадии (мин.) | 10,3±3,3 | 9,1±2,9 |
| Бодрствование внутри сна (%) | 11,3±2,7# | 5,5±3,7 |
| 1-я стадия сна (%) | 11,6±3,1# | 3,8±2,3 |
| 2-я стадия сна (%) | 68,4±21,# | 48,9±8,1 |
| Дельта-сон 3-я и 4-я стадии (%) | 5,8±4,1# | 23±3,2 |
| Фаза быстрого сна (%) | 10,1±3,8# | 24±3,8 |
| Индекс апноэ (апноэ/час) | 17,5±4,7# | 4,5±2,8 |
| Сатурация кислородом (%) | 84,4±5,1# | 96,4±3,7 |
# - различие с группой контроля, р < 0,05
При исследовании архитектуры сна было определено, что процентная представленность поверхностных стадий фазы медленного сна (1-ой и 2-ой) статистически выше у больных с МС и ХЦЗВ по сравнению с группой контроля (11,6±3,1%, 68,4±21,3% и 3,8±2,3%, 48,9±8,1%, соответственно, р<0,01). Напротив, представленность глубоких стадий медленноволнового сна (дельта-сон) и фазы быстрого сна - была статистически значимо ниже, (5,8±4,1%, 10,1±3,8% и 23±3,2%, 24±3,8%, соответственно, р<0,01). Также было выявлено увеличение показателей дыхательных расстройств во сне – индекса апноэ (17,5±4,7 апноэ/час) и сатурации крови кислородом (84,4%) по сравнению с показателями группы контроля (4,5±2,8 апноэ/час и 96,4%, соответственно, р<0,01).
Таким образом, все пациенты с МС и ХЦЗВ клинически характеризовались наличием психо-вегетативного синдрома с тревожно-депрессивными проявлениями. Жалобы у подавляющего большинства больных были связаны с постсомническими и интрасомническими расстройствами. Объективно у больных была снижена эффективность сна и увеличено время бодрствования внутри сна, при этом было выявлено наличие дыхательных расстройств во сне. Нарушенная архитектура сна отражает снижение адаптивной функции сна, что может приводить к расстройству вегетативных и нейро-эндокринных регуляторных механизмов, однако, не позволяют судить о первичности и/или вторичности нарушений в цикле сон-бодрствование. Тем не менее они, возможно, могут быть следствием двух, принципиально различных патогенетических процессов: вторичных нарушений сна вследствие дыхательных расстройств во сне и нарушений в цикле сон-бодрствование, как одного из проявлений психо-вегетативного синдрома - психофизиологической инсомнии.
Для подтверждения данного положения был проведен анализ больных с МС и ХЦЗВ при различных механизмах нарушения сна.
Анализ больных группы с метаболическим синдромом и хроническими цереброваскулярными заболеваниями в зависимости от ведущих механизмов нарушений сна
Всех пациентов с МС и ХЦЗВ разделили на две подгруппы: 1 (МС с СОАС) были включены 98 (82%) пациентов с выраженными расстройствами дыхания во сне (индекс апноэ > 10/час), 2 (МС без СОАС) - составили 22 (18%) больных без выраженных дыхательных расстройств во сне (индекс апноэ < 10/час). По возрасту, половому составу и уровню гликемии пациенты данных подгрупп не различались.
Как видно из табл. 10 уровень тревожности и депрессии, а также вегетативных расстройств был выше у пациентов 2 подгруппы и достигал клинически значимого уровня - 12,2±1,9 и 36,1±3,2 баллов, соответственно (p<0,05). В 1 группе был выше уровень САД и ДАД и ИМТ (р<0,05). Уровень глюкозы в крови натощак в обеих группах не различался и составил, соответственно, 7,1±0,4 и 7,6±0,7.
При исследовании субъективной оценки сна было выявлено ухудшение показателей сна в группе МС без СОАС (рис.6). Эти же пациенты хуже оценивали качество своего сна, были не удовлетворены его продолжительностью, дольше времени проводили в постели до момента наступления сна, чаще просыпались в течение ночи, что указывало на наличие проявлений психофизиологической инсомнии у данных больных.
Таблица 10 Клинические показатели больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без него
| Показатели | МС с СОАС | МС без СОАС |
| Тревожность (баллы) | 6,2±1,7 | 12,2±1,9#* |
| Депрессия (баллы) | 6,4±2,1 | 11,6±1,6#* |
| Вегетативная дистония (баллы) | 29,6±3,1# | 36,1±3,2#* |
| САД (мм рт.ст.) | 175±21#* | 148±21# |
| ДАД (мм рт.ст.) | 108±11#* | 86±13 |
| Индекс массы тела (кг/м2) | 35,8±2,6#* | 24,9±1,9# |
# - различие с группой К, р < 0,05
* - различие между группами МС с СОАС и без СОАС, р < 0,05
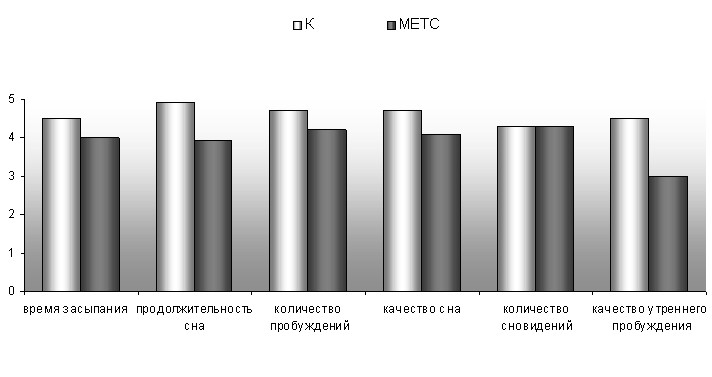
P<0,05 Рис.6 Субъективная оценка сна больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без него.
При полисомнографии у больных МС и ХЦЗВ без СОАС было выявлено снижение индекса эффективности, общей длительности сна и увеличение латентного периода наступления первой фазы сна и времени бодрствования внутри сна по сравнению с больными МС и ХЦЗВ с СОАС и группой контроля (табл.11). Это в полной мере соответствовало субъективным жалобам на трудность засыпания и прерывистый сон, а также частые пробуждения.
Процентная представленность 1-ой стадии фазы медленного сна достоверно был выше в подгруппе МС без СОАС, а показатель 2-ой стадии фазы медленного сна больных МС с СОАС, напротив, превышал значение как в контроле, так и подгруппы МС без СОАС (р<0,05).
Таким образом, больные МС и ХЦЗВ с выраженными нарушениями дыхания во сне имели более высокие показатели системного АД и ИМТ. В свою очередь больные без СОАС характеризовались большей выраженностью психо-вегетативного синдрома с тревожно-депрессивными проявлениями.
Таблица 11 Объективные показатели структуры сна больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями с синдромом обструктивного апноэ во сне и без него
| Показатели сна | МС с СОАС | МС без СОАС |
| Индекс эффект. сна (%) | 92,0±4,9 | 70,1±4,1#* |
| Общая длит. сна (мин) | 438±30 | 287±25#* |
| Лат. период 1-ой ст. (мин) | 4,3±0,4 | 25,1±3,2#* |
| Бодрств. внутри сна (%) | 7,3±0,6 | 28,1±4,9#* |
| 1-я стадия сна (%) | 8,6±2,1# | 24,2±4,8#* |
| 2-я стадия сна (%) | 75,7±11,4#* | 47,8±7,9 |
| Дельта-сон 3-я и 4-я ст. (%) | 4,9±3,1#* | 8,5±2,2# |
| Фаза быстрого сна (%) | 9,7±2,8# | 11,2±3,9# |
| Индекс апноэ (апноэ/час) | 25,1±3,8#* | 8,4±1,1 |
| Сатурация кислородом (%) | 74,5±3,9#* | 93,4±4,0 |
# - различие с группой К, р < 0,05; * - различие между группами, р < 0,05
Таким образом, больные МС и ХЦЗВ с выраженными нарушениями дыхания во сне имели более высокие показатели системного АД и ИМТ. В свою очередь больные без СОАС характеризовались большей выраженностью психо-вегетативного синдрома с тревожно-депрессивными проявлениями.
Архитектура сна больных МС и ХЦЗВ без СОАС свидетельствовала о наличии у них психофизиологической инсомнии, отражая недостаточность первичных механизмов поддержания сна. У больных МС и ХЦЗВ с СОАС увеличение преимущественно второй стадии фазы медленного сна являлось вторичным по отношению к событиям во сне и было связано с расстройствами дыхания (апноэ) в данной стадии, являясь следствием гипоксии мозга.
У всех больных МС и ХЦЗВ наблюдалось снижение представленности глубоких стадий фазы медленного сна и фазы быстрого сна. Однако причина этих изменений была различной. Снижение представленности фазы быстрого сна у больных МС без СОАС отражало недостаточность циклической организации сна, характерной для первичных инсомнических расстройств, а у больных с СОАС - следствием фрагментации периодов быстрого сна вследствие эпизодов апноэ. Именно поэтому полисомнографическое исследование должно входить в комплекс обязательных параклинических методов обследования больных МС, так как только с его помощью можно точно определить патогенетический характер нарушений сна и определить стратегию фармакотерапии.
Лечение зопиклоном больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями без дыхательных расстройств во сне
Выбор препарата был связан с его фармакодинамическими особенностями: отсутствием отрицательного влияния на дыхательную функцию во сне, а так же хорошей сочетаемостью с гипотензивными, вазоактивными и гипогогликемическими средствами. Препарат был назначен в дозе 7,5 мг, однократно, на ночь за 30 мин. до сна, длительность терапии составила 21 день. После лечения зопиклоном у больных с МС без СОАС была выявлена достоверная положительная динамика в виде снижения уровня тревожности и депрессии, уменьшения выраженности вегетативных расстройств, улучшения качества сна, р<0,05. Влияния препарата в данной дозе на показатели системного АД, частоту и выраженность дыхательных расстройств, уровень сатурации во сне отмечено не было (табл.12).
Таблица 12. Динамика клинических показателей больных метаболическим синдромом без синдрома обструктивного апноэ во сне
| Показатели | До лечения | После леч. | % |
| Тревожность (балл) | 12,2±1,9 | 8,2±2,8* | 32 |
| Депрессия (балл) | 11,6±1,6 | 7,4±2,6* | 36 |
| Вегетативная дистония (балл) | 36,1±3,2 | 26,4±3,0* | 26 |
| Качество сна (балл) | 17,9±2,7 | 22,3±2,8* | 24 |
| САД мм рт.ст. | 148±21 | 130±19* | 12 |
| ДАД мм рт.ст. | 86±13 | 83±11 | 3 |
* - различие показателей до и после лечения, р < 0,05
После лечения зопиклоном больные с МС и ХЦВЗ без СОАС отметили достоверное улучшение показателей качества сна: уменьшилось время засыпания, увеличилась продолжительность сна, снизилось количество пробуждений, уменьшилось количество тревожных сновидений, повысилось качество утреннего пробуждения, что отразилось в повышении суммарного балла качества сна по результатам анкетирования на 24%, р<0,05 (табл.13 и рис.7). По шкале Общей клинической оценки (SGI) значительное улучшение общего состояния отметили 47% пациентов, получавших лечение зопиклоном, улучшение общего состояния отметили 37% пациентов, 16% пациентов не отметили заметной положительной динамики своего состояния.
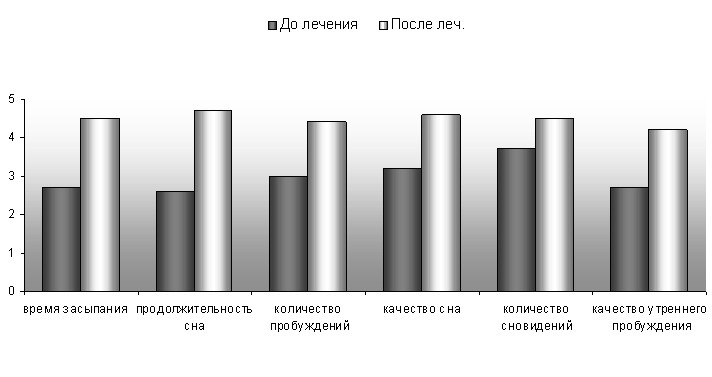
Субъективное улучшение показателей сна на фоне лечения зопиклоном соответствовало достоверной положительной динамике объективных показателей сна по данным полисомнографии. В наибольшей мере улучшились показатели латентного периода 1-ой стадии фазы медленного сна (на 52%), то есть уменьшилось время засыпания; снизился показатель бодрствования во сне (на 71%), то есть сон стал менее прерывистым, р<0,01. Эти изменения обусловили повышение индекса эффективности сна на 24%, р<0,05 (табл.13, рис. 8).
p<0,05
Рис. 7 Динамика субъективной оценки сна больных метаболическим синдромом без синдрома обструктивного апноэ во сне
Существенные изменения на фоне лечения зопиклоном были связаны с архитектурой сна – процентной представленности его фаз и стадий. Особо следует отметить достоверное снижение процентной представленности 1-ой стадии фазы медленного сна (на 20%), в наибольшей степени измененной у больных МС без СОАС до лечения, и увеличение представленности 2-ой стадии фазы медленного сна (на 14%), р<0,05.
Таблица 13. Динамика показателей сна больных метаболическим синдромом без синдрома обструктивного апноэ во сне
| Показатели | До лечения | После леч. | % |
| Индекс эффективности сна (%) | 70,1±4,1 | 87,0±4,9* | 24 |
| Общая длительность сна (мин) | 287±25 | 338±34* | 18 |
| Латентный период 1 стадии (мин) | 25,1±3,2 | 12,3±0,4* | 52 |
| Бодрствование внутри сна (%) | 28,1±4,9 | 8,3±2,6* | 71 |
| 1 стадия сна (%) | 24,2±4,8 | 19,6±2,1* | 20 |
| 2 стадия сна (%) | 47,8±7,9 | 54,7±12,4* | 14 |
| Дельта-сон 3-я и 4-ая стадии (%) | 8,5±2,2 | 8,9±4,1 | 4 |
| Фаза быстрого сна (%) | 11,2±3,9 | 15,7±3,8* | 40 |
| Индекс апноэ (апноэ/час) | 8,4±1,1 | 8,7±3,3 | 3 |
| Сатурация кислородом (%) | 93,4±4,0 | 94,5±3,9 | 1 |
* - различие показателей до и после лечения, р<0,05
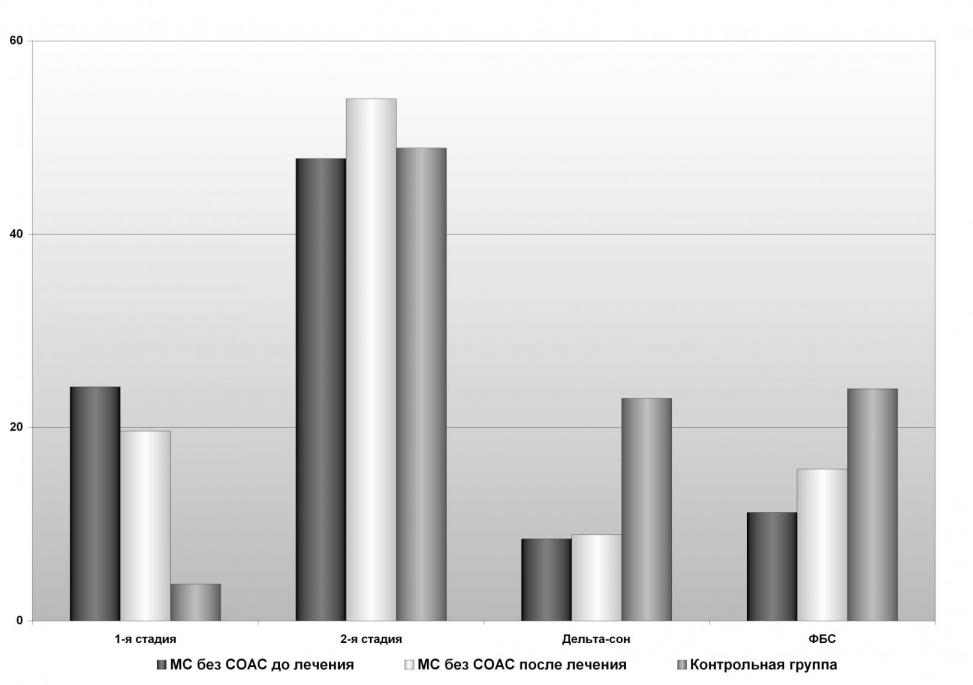
Рис. 8 Архитектура сна больных без синдрома обструктивного апноэ во сне на фоне терапии зопиклоном
Данные изменения характеризовали повышение функциональной активности механизмов инициации и поддержания сна. После лечения изменился в сторону улучшения показатель процентной представленности фазы быстрого сна (на 40%), р<0,01, что отражало улучшение адаптационной стресс-лимитирующей функции сна у данных больных.
На фоне лечения зопиклоном у 2 пациентов (11%) при прекращении терапии наблюдался синдром отмены – от 1 до 4 ночей пациенты испытывали трудности засыпания и повышенную сонливость днем, у 3 - (14%) возникло ощущение «металлического вкуса во рту». Умеренная тошнота была зарегистрирована у 1(4%) пациента, однако данные побочные действия не приводили к существенному ухудшению самочувствия больных и прекращению приема препарата.
Применение зопиклона для лечения нарушений сна, протекавших преимущественно по типу психофизиологической инсомнии, у больных с МС и ХЦВЗ без СОАС было безопасно, так как не сопровождалось увеличением частоты и длительности расстройств дыхания во сне. Это связано с отсутствием миорелаксирующего действия у данного препарата. На фоне терапии пациенты не жаловались на снижение активности в дневное время, дневную сонливость, ухудшение концентрации внимания. Напротив, отмечали улучшение качества утреннего пробуждения, что связано с фармакокинетическими особенностями зопиклона – быстрой элиминацией. Исходя из вышесказанного, можно констатировать, что зопиклон является высоко эффективным и безопасным лекарственным средством лечения инсомнических нарушений у больных метаболическим синдромом без выраженных расстройств дыхания во сне.
Лечение флуоксетином больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями с расстройствами дыхания во сне
После курса флуоксетина у больных с МС и СОАС достоверно снизился индекс массы тела на 12% (р<0,05). Существенного влияния на эффективность гипотензивной терапии у данных больных препарат не оказывал (табл. 14).
После лечения флуоксетином у больных с МС и СОАС регрессировали постсомнические расстройства, которые были представлены жалобами на «неосвежающий» сон, отсутствие бодрости, увеличение времени включения в активную деятельность после сна, чувство разбитости, «сонного опьянения» после сна, утренние головные боли. Данные улучшения субъективного состояния отразились в достоверном улучшении балла качества утреннего пробуждения (на 24%) с 3,3±1,3 баллов до 4,1±0,8 по данным анкеты качества сна, р<0,05 (рис.9)
Таблица 14. Динамика клинических показателей больных метаболическим синдромом с синдромом обструктивного апноэ во сне на фоне лечения флуоксетином
| Показатели | До лечения | После леч. | % |
| Тревожность (балл) | 6,2±1,7 | 5,4±1,2 | 12 |
| Депрессия (балл) | 6,4±2,1 | 6,8±2,3 | 6 |
| Вегетативная дистония (балл) | 29,6±3,1 | 27,2±3,9 | 8 |
| САД (мм рт.ст.) | 175±21 | 144±23* | 17 |
| ДАД (мм рт.ст.) | 108±11 | 86±13* | 20 |
| Индекс массы тела (кг/м2) | 35,8±2,6 | 31,4±2,1* | 12 |
* - различие показателей до и после лечения, р < 0,05
Рис.9 Динамика субъективной оценки сна больных метаболическим синдромом с синдромом обструктивного апноэ во сне
При полисомнографическом исследовании больных с СОАС, проведенном после лечения флуоксетином, было отмечено достоверное снижение показателя бодрствования внутри сна (на 33%), р<0,05, что отразилось в улучшении показателя эффективности сна (табл.15).
Таблица 15. Динамика показателей сна больных метаболическим синдромом с синдромом обструктивного апноэ во сне на фоне лечения флуоксетином
| Показатели | До лечения | После леч. | % |
| Индекс эффективности сна (%) | 92,0±4,9 | 95,0±3,2 | 3 |
| Латентный период 1 стадии (мин) | 4,3±0,4 | 4,4±0,7 | 2 |
| Бодрствование внутри сна (%) | 7,3±0,6 | 4,9±3,4* | 33 |
| 1 стадия сна (%) | 8,6±2,1 | 8,2±3,8 | 4 |
| 2 стадия сна (%) | 75,7±11,4 | 64,8±8,9* | 15 |
| Дельта-сон 3-я и 4-ая стадии (%) | 4,9±3,1 | 8,4±2,2* | 71 |
| Фаза быстрого сна (%) | 9,7±2,8 | 12,2±4,9* | 25 |
| Индекс апноэ (апноэ/час) | 25,1±3,8 | 19,4±3,1* | 20 |
| Сатурация кислородом (%) | 74,5±3,9 | 83,7±4,2 | 12 |
* - различие показателей до и после лечения, р < 0,05
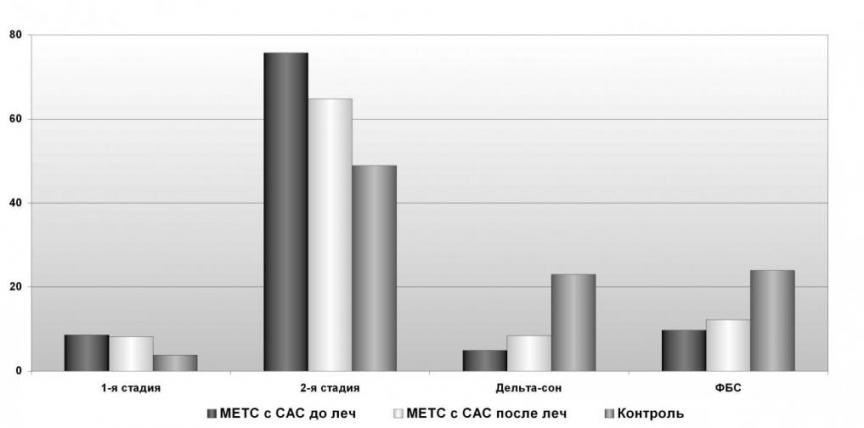
После лечения флуоксетином у больных с МС и СОАС было зарегистрировано достоверное снижение индекса дыхательных расстройств (на 20%) и повышение уровня насыщения крови кислородом - сатурации (на 12%), р<0,05. У пациентов после лечения улучшилась архитектура сна: достоверно снизилась представленность 2-ой стадии фазы медленного сна на 15%, и значительно повысилась процентная представленность медленноволнового дельта-сна (на 71 %), кроме того, достоверно увеличилась представленность фазы быстрого сна (на 25%), р<0,05.
Данные изменения отражали увеличение представленности глубоких стадий фазы медленного сна, что являлось показателем улучшения качество сна, улучшением его адаптивной восстановительно-метаболической функции, что выразилось в регрессе постсомнических расстройств (низком качестве утреннего пробуждения, дневной сонливости). Эти позитивные сдвиги вероятнее всего обусловлены регулирующим действием серотонина на фазы и стадии сна: облегчение наступления и поддержание медленноволнового сна (J.M. Shneerson, 2001). Следует отметить, что изменение фазы быстрого сна в сторону нормализации (увеличение) у больных с МС и СОАС после лечения флуоксетином характеризовало улучшение адаптивной стресс-лимитирующей функции сна.
%
Рис. 13 Динамика архитектуры сна больных метаболическим синдромом с синдромом обструктивного апноэ во сне на фоне терапии флуоксетином
При применении флуоксетина у больных с МС и СОАС выраженных побочных действий препарата и влияния его на проявления основного заболевания зарегистрировано не было. Среди побочных действий следует отметить возникновение головной боли (по типу головной боли напряжения) у 2 пациентов (2%), повышение тревожности в первые 14 дней приема у 4 человек (4%), повышение потливости - у 1 человека (1%), учащение мочеиспускания у 1 человека (1%). Данные расстройства не носили выраженного характера и полностью регрессировали в течение 14 дней.
Таким образом, назначение флуоксетина больным МС с СОАС оказало существенное положительное влияние на объективные показатели архитектуры сна и дыхательные нарушения во сне. Субъективно пациенты отмечали регресс постсомнических расстройств. Терапия флуоксетином была безопасна, побочные действия возникали редко и не носили выраженного характера.
Выводы
- Жалобы на нарушения сна встречались у подавляющего большинства больных с метаболическим синдромом и хроническими цереброваскулярными заболеваниями, и в основном, они отражали постсомнические расстройства. Нарушение архитектуры сна, в частности, увеличение представленности первой стадии фазы медленного сна, снижение индекса его эффективности, удлинение латенции ко сну и времени бодрствования внутри сна на фоне редукции быстрого и глубоких стадий медленного сна является проявлением психофизиологической инсомнии.
2. Нарушения сна у больных метаболическим синдромом и хроническими цереброваскулярными заболеваниями включают также у подавляющего большинства расстройства дыхания во сне в виде апноэ и изменения архитектуры сна, что свидетельствует о выраженном снижении адаптивной функции сна. Эти изменения ассоциировалась с тяжестью течения соматического заболевания и степенью психо-вегетативных нарушений.
3. У больных с артериальной гипертензией и хроническими цереброваскулярными заболеваниями выявлена убедительная связь субъективных и объективных параметров нарушений сна с показателями системного артериального давления, частотой гипертонических кризов и выраженностью психо-вегетативных расстройств.
4. Жалобы на нарушение сна у больных с ожирением и хроническими цереброваскулярными заболеваниями отражают наличие психо-вегетативного синдрома, характеризующегося тревожно-депрессивными проявлениями и психофизиологической инсомнией. Выраженность ожирения является определяющим фактором тяжести расстройств дыхания во сне.
5. У больных с сахарным диабетом типа 2 без ожирения и хроническими цереброваскулярными заболеваниями существует прямая зависимость между расстройствами дыхания во сне и выраженностью периферических вегетативных нарушений.
6. Применение гипнотика зопиклона у больных с психофизиологической инсомнией привело по данным полисомнографии к ускорению засыпания, увеличению продолжительности сна, уменьшению количества пробуждений, повышению качества утреннего пробуждения. Это сопровождалось улучшением эффективности сна, уменьшением латенции ко сну, снижением показателя бодрствования во сне, снижением представленности 1-ой стадии и повышением представленности 2-ой стадии фазы медленного сна, а также улучшением показателя фазы быстрого сна.
7. Назначение селективного ингибитора обратного захвата серотонина - флуоксетина в течение полугода у больных с расстройствами дыхания (апноэ) во сне приводило к регрессу постсомнических расстройств, снижению индекса массы тела, выраженности расстройств дыхания во сне и улучшением показателей архитектуры сна. Терапия флуоксетином была безопасна и негативно не влияла на течение основного заболевания.
Практические рекомендации
- Пациентам с метаболическим синдромом и хроническими цереброваскулярными заболеваниями необходимо проводить комплексное исследование нарушений цикла сон-бодрствование, включающее количественную оценку субъективных жалоб, связанных с пре-, интра- и постсомническими расстройствами (анкета качества сна), объективную регистрацию параметров ночного сна – полисомнографию и оценку выраженности психо-вегетативных проявлений (анкета вегетативных расстройств, госпитальная шкала тревоги и депрессии).
- При выборе препарата для коррекции нарушений сна следует учитывать принадлежность к одному из двух паттернов: расстройств дыхания во сне и вторичных изменений архитектуры сна или первичных изменений сна по типу психофизиологической инсомнии. В клинике заподозрить первый вариант возможно при наличии жалоб на постсомнические нарушения: низкое качество утреннего пробуждения, «неосвежающий» сон, отсутствие бодрости после сна, увеличение времени включения в активную деятельность, чувство разбитости после сна, утренние головные боли и дневная сонливость. При наличии жалоб на пресомнические расстройства (трудность засыпания, жесткая необходимость привычных условий для наступления сна), сочетающихся с увеличением латенции ко сну и повышенной представленностью первой стадии фазы медленного сна по данным полисомнографии, а также выраженными психо-вегетативными проявлениями, следует предполагать нарушения сна по второму паттерну.
- В случае первого паттерна целесообразно назначение длительного курса (6 месяцев) препаратов, повышающих уровень серотонина в центральной нервной системе, в частности флуоксетина, в случае второго - следует назначать гипнотики без миорелаксирующего эффекта, в частности зопиклон, в течение 3-4 недель.
- В виду высокой частоты встречаемости проявлений психофизиологической инсомнии у пациентов с артериальной гипертензией и высокой корреляцией между показателями анкеты качества сна и данных объективной оценки сна для этих больных следует использовать анкету оценки качества сна в качестве обязательного компонента комплексного обследования. Результаты исследования помогут существенно оптимизировать терапию больных артериальной гипертензией.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Каллистов Д.Ю., Матвеев А.Ю., Любшина О.В., Верткин А.Л. Расстройства сна и избыточная сонливость.// “Медицинская картотека”, №1 (21), 1999 г. С.12-14.
2.Верткин А.Л., Любшина О.В. Диагностика нарушений сна у больных бронхиальной астмой. Материалы 11 Национального конгресса по болезням органов дыхания. Москва, 9-13 ноября 2001 г. С.41.
3. Верткин А.Л., Кривцова.В., Любшина О.В., Дорохов В.Б., Полосьянц О.Б., Григорьянц А.А., Верткин М.А. Значение нарушений сна и его коррекция у больных бронхиальной астмой. Материалы 11 Национального конгресса по болезням органов дыхания. Москва, 9-13 ноября 2001 г. С.28.
4. Верткин А.Л., Алексанян Л.А., Любшина О.В., Манченко Н.В., Вигант М.С. Зависимость нарушений сна от уровня артериального давления у пациентов с гипертонической болезнью. Журнал «Медицинская кафедра», 4(8) 03.С. 142-149.
5.Любшина О.В. Бронхиальная астма и сон. //«Лечащий врач», № 4, 2002. С. 10-13.
6.Баррер Г.М., Верткин А.Л., Любшина О.В., Коротаева О. Полисомнографическое исследование пациентов с синдромом жжения полости рта. Журнал «Cathedra», №8, 2003. С.9-12
7. Н.В. Манченко, Л.А. Алексанян, О.В. Любшина, А.Л. Верткин, М.В. Вигант. Влияние гипотензивной терапии на нарушения структуры сна у больных с артериальной гипертензией. //«Русский медицинский журнал», Том 12, № 7 (207), 2004. С.456-458.
8.О.В. Любшина, О.Б. Талибов, А.Л. Верткин. Алгоритм диагностики и лечения инсульта на догоспитальном этапе.// «Consilium Medicum» том 6, № 8, 2004 г. С.606-609.
9.Верткин А.Л., Алымов Г.В., Кривцова Е.В., Любшина О.В., Вигант М.В., Ткачева О.Н. Клиническое значение нарушений сна у беременных.// «Русский медицинский журнал», Том 12, №1 (201), 2004. С.18-19.
10.А.Л. Верткин и соавт.«Скорая медицинская помощь» Руководство для фельдшеров. Издательство «ГЕОТАР-Медиа», 2006. С 368.
11.А.Л. Верткин и соавт «Скорая медицинская помощь» Руководство для врачей. Издательство «ГЕОТАР-Медиа», 2006. С.365.
12.Любшина О.В., Удовенко Е.В., Пироева К.Э. Синдром обструктивного апноэ во сне у больных диабетической автономной нейропатией.// «Терапевт», №6, 2006. С.29-32.
13.О.В. Любшина. Ведение больных с острым нарушением мозгового кровообращения на догоспитальном этапе. «Врач скорой помощи», № 5, 2006г. С.59-64.
14.Любшина О.В., Алексанян Л.А., Манченко Н.В., Калашникова О.В. Нарушения сна у больных с артериальной гипертензией и способы их медикаментозной коррекции.// «Терапевт», №6, 2006. С.53-60.
15.Б.С. Брискин, А. Л. Верткин. «Рациональная фармакотерапия неотложных состояний». - М. : Литтерра, 2007. С.646.
16.А.Л.Верткин, А.В.Тополянский, В.Г.Москвичев, О.В.Любшина. Применение седативных средств в терапевтической практике.// «Consilium Medicum» том 9, № 8, 2007 г. С.89-91.
17.А.Л.Вёрткин, О.В.Зайратьянц, Е.И.Звягинцева, Е.В.Адонина, М.И.Лукашов, О.В.Любшина, О.Ю.Аристархова, М.Т.Гургенидзе, М.М.Шамуилова, Э.Н.Мекаберидзе. Место метаболического синдрома в сердечно-сосудистом континууме.// Лечащий врач», № 3, 2008. С. 71-77.
18. О.В. Любшина, О.Н. Зимин, Э.Н. Микаберидзе, Е.В. Адонина, Е.И. Звягинцева. Нарушение сна у больных артериальной гипертонией. Фармакотерапия.// «Терапевт», № 6, 2008.С.33-45.
19.Л.М. Ибрагимова, О.В. Любшина, А.А. Данчинова, Э.Н. Микаберидзе, Е.В. Удовенко. Фармакологическая коррекция нарушений микроциркуляции нижних конечностей у больных с диабетической дистальной полинейропантией.// «Врач скорой помощи», № 7, 2008.С.25-30.
20. Любшина О.В. Применение седативных средств в терапевтической практике.// «Терапевт», № 5, 2008.С.55-58
21. О.В. Любшина, Е.В. Удовенко. Нарушение сна у пациентов с МС: фактор риска или случайность? // «Терапевт», № 9, 2008.С.47-55.
22.О.В. Любшина, Е.В. Удовенко, М.К. Тамкаева. Особенности сна при ожирении.// «Терапевт», № 11, 2008. С.8-14.
23.О.В.Любшина, М.Ю.Максимова. Нарушение сна у больных с хроническими цереброваскулярными заболеваниями и метаболическим синдромом. Труды Национального конгресса «Неотложные состояния в неврологии» под редакцией З.А.Суслиной, М.А.Пирадова. Москва, 2-3 декабря 2009 г. С.372.
24.Любшина О.В., А.В. Наумов, А.А. Данчинова, Ю.С. Скорикова. К вопросу «адекватности» и эффективности современных нейропротекторов.// «Неотложная терапия», №1-2, 2009. С.45-51.
25.О.В.Любшина, М.Ю.Максимова. Первичные и вторичные механизмы нарушения сна у больных с метаболическим синдромом. Труды Национального конгресса «Неотложные состояния в неврологии» под редакцией З.А.Суслиной, М.А.Пирадова. Москва, 2-3 декабря 2009 г.С.371.
26.О.В. Любшина. Факторы риска и нарушения сна при цереброваскулярных заболеваниях. Москва 2009. С.122.
27.О.В. Любшина, М.Ю. Максимова, З.А. Суслина. Комплексное патогенетическое лечение острых и хронических форм нарушений мозгового кровообращения у больных артериальной гипертонией. Москва 2009. С.60.
28. О.Н. Ткачева, А.Л. Верткин и соавт. Диабетическая автономная нейропатия. «Гэотар-Медиа» - 2009. С.176.
29. М.Ю.Максимова, О.В.Любшина, В.Н.Михальченко. Двустороннее поражение позвоночных артерий. //«Здравоохранение Кыргызстана», № 4, 2009. С. 194-188
30.Е.В. Удовенко, О.В. Любшина, М.К. Тамкаева. Распространённость и способы метаболической коррекции синдрома апноэ во сне у больных с диабетической автономной нейропатией.// «Терапевт», № 8, 2009. С.15-25.
31.Э.Н.Микаберидзе, А.С. Скотников, О.Ю.Аристархова, А.А.Отпушенко, Е.В.Удовенко, О.В.Любшина, Л.Ю.Моргунов. Роль препаратов альфа-липоевой кислоты в фармакотерапии СД 2 типа и его осложнений. // «Врач скорой помощи», № 10, 2009г. С.38-44
32.О.В. Любшина. Фармакотерапия нарушения сна у больных с метаболическим синдромом и синдромом обструктивного апноэ во сне.// «Рациональная фармакотерапия в кардиологии». Том 6, №3, 2010. С.75-79.
33. О.В. Любшина. Нарушение сна у пациентов с метаболическим синдромом.// «Рациональная фармакотерапия в кардиологии». Том 6, №3, 2010. С.32-36
34.А.Л.Верткин, А.В.Тополянский, В.Г.Москвичев, Э.Н.Микаберидзе, О.В.Любшина. Алгоритм догоспитального этапа ведения больных с острыми осложнениями сахарного диабета. // «Терапевт», № 2, 2010.С.8-13.
35.О.Любшина, А. Вёрткин, М. Максимова, А. Скотников. Нарушение сна у больных СД типа 2 с цереброваскулярными заболеваниями.// «Врач», №4, 2010. С.47-53.
36. О.В. Любшина. О взаимоотношениях нарушения сна с течением сахарного диабета типа 2 и цереброваскулярными заболеваниями.// «Врач скорой помощи», № 5, 2010г. С.17-24.
37.О.В.Любшина, А.Л.Вёрткин, М.Ю.Максимова. Фармакотерапия нарушения сна без выраженных дыхательных расстройств у больных с метаболическим синдромом.//«Кардиоваскулярная терапия и профилактика», № 2, 2010.С.54-60.
38. О.В. Любшина. Расстройства сна и их значение у больных с артериальной гипертонией.// «Врач скорой помощи», № 4, 2010. С.65 -74.
39.О.В. Любшина, А.Л.Верткин, М.Ю.Максимова. Нарушение сна у больных артериальной гипертензией и избыточной массой тела.//«Кардиоваскулярная терапия и профилактика», № 3, 2010.С.10-19.
40. О.В. Любшина. Метаболический синдром и нарушения сна.// «Терапевт», № 4, 2010.С. 32-39.
41. О.В. Любшина. «Как научиться управлять мечтой», или метаболический синдром и нарушения сна: зависимость и интеграция.// «Врач скорой помощи», № 4, 2010г. С.28-35.
42. О.В. Любшина, М.Ю. Максимова. Нарушения сна у больных с артериальной гипертензией.// «Терапевт» №5, 2010. С.30-41.
43.О.В. Любшина, А.С. Скотников, Ю.С. Скорикова, Е.Л. Майборода, А.А. Данчинова, С.М. Комиссаров, М.А. Фельдман. Острые неврологические состояния на догоспитальном этапе.// «Врач скорой помощи», № 5, 2010г. С.36 -41.
44. О.В.Любшина, М.Ю.Максимова. Нарушение сна у больных с дисциркуляторной энцефалопатией и метаболическим синдромом. «Анналы клинической и экспериментальной неврологии» Том 4, № 2, 2010. С 23-28.
45.О.В. Любшина. Сомнологические проблемы при сосудистых заболеваниях головного мозга. Москва 2010. С.66.

