Клинико-патогенетические основы фетального алкогольного синдрома у детей раннего возраста
На правах рукописи
МАЛАХОВА ЖАННА ЛЕОНИДОВНА
КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ ОСНОВЫ ФЕТАЛЬНОГО АЛКОГОЛЬНОГО СИНДРОМА У ДЕТЕЙ РАННЕГО ВОЗРАСТА
14.01.08 – педиатрия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Екатеринбург - 2012
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Уральская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный консультант:
доктор медицинских наук, профессор Шилко Владимир Иванович
Официальные оппоненты:
доктор медицинских наук, профессор Таточенко Владимир Кириллович
доктор медицинских наук, профессор Козлова Светлана Николаевна
доктор медицинских наук, профессор Федоров Игорь Анатольевич
Ведущая организация:
Государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт-Петербургская государственная педиатрическая медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Защита диссертации состоится «_____» _______________2012 года в 10 часов на заседании Совета по защите докторских диссертаций Д 208.102.02, созданного при Государственном бюджетном образовательном учреждении высшего профессионального образования «Уральская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации по адресу: 620028, г. Екатеринбург, ул. Репина, д. 3.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО УГМА Минздравсоцразвития Российской по адресу: 620028, г. Екатеринбург, ул. Ключевская, д. 17, с авторефератом на сайте ВАК: vak.ed.gov. ru
Автореферат разослан «_____» _________________2012г.
Ученый секретарь совета по защите
докторских диссертаций,
доктор медицинских наук, профессор Гришина И.Ф.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Результаты многочисленных клинических исследований, посвященных оценке состояния здоровья населения Российской Федерации, свидетельствуют о явной тенденции к ухудшению общих морфометрических и функциональных показателей у детей и подростков, что дает основание рассматривать сложившуюся ситуацию как угрожающую для национальной безопасности России.
Следует отметить, что на сегодняшний день, среди основных причин ухудшения физического состояния и явной тенденции к задержке нервно-психического развития детей выделяют неблагополучное течение внутриутробного периода, в том числе обусловленного ростом алкоголизма среди женщин детородного возраста.
Так, исследования последних лет свидетельствуют о неуклонном росте числа женщин, больных алкоголизмом. Если в 80-е годы соотношение мужчин и женщин, больных алкоголизмом, составляло в среднем 10 : 1, то в 2000г - 5 : 1. К началу ХХI века в РФ число женщин состоящих на учете по поводу хронического алкоголизма составило в среднем 443,5 на 100 тыс. женского населения (Сенцов В.Г., 2004; Спектор Ш.И., 2008).
Увеличение женского алкоголизма фиксируют и зарубежные агентства по изучению рыночной конъюнктуры. Со свойственным Западу прагматизмом, исследователи отмечают, что «растущая независимость» женщин и поздний старт создания семьи делают молодых женщин «демографическим ключом» для сбыта алкогольных напитков (U.S. Centers for Disease Control and Prevention, 2005). Эпидемиологические исследования, проведенные в США (Wiess M., Cronk C.E., Mahcom S. et al., 2004) подтверждают, что 13% женщин продолжают употреблять алкоголь во время беременности, 3% из них страдают хроническим алкоголизмом. В Ирландии процент женщин употребляющих алкоголь во время беременности составляет в среднем 82%, при этом 10% женщин употребляют алкоголь постоянно.
Тревожит и тот факт, что рядом исследователей доказана роль алкоголизма в прогрессирующем росте изменений в фенотипической структуре популяции человека. Показано, что в ближайшие годы речь может идти об алкогольной деструкции генофонда и необратимом снижении общего уровня здоровья населения (Кершенгольц Б.М., Колосова О.Н., Кривогорницына Е.А., 2000).
Развернутая клиническая картина, возникающая у плода, вследствие внутриутробного воздействия этанола, носит название фетального алкогольного синдрома (ФАС). Именно ФАС, по литературным данным, занимает лидирующую позицию в списке известных причин задержки умственного развития (Bertrand J., 2009).
Эпидемиологические исследования последних лет показали, что и социальная среда представляет собой самостоятельный, независимый от других важный фактор срыва адаптационных механизмов, лежащих в основе нормального развития детского организма. Имеются сведения о том, что в группе наибольшего биологического риска, находятся дети, оказавшиеся без родительского попечения и помещенные в учреждения социальной опеки. Рожденные от матерей из неблагополучной социальной среды, они в антенатальном периоде, обычно подвергаются действию множества патогенных факторов. Это подтверждено тем, что практически все воспитанники учреждений интернатного типа (УИТ), несмотря на достаточное питание и медицинское обслуживание, отстают в физическом и нервно-психическом развитии (Долотова Н.В., 2005; Филькина О.М., Воробъева Е.А., 2006).
В настоящее время во многих работах уделяется большое внимание изучению состояния здоровья детей с акцентом на перинатальное поражение ЦНС гипоксически-ишемического генеза: изучены особенности вегетативной нервной системы (Краснова Е.Е. с соавт., 2004), дыхательной, пищеварительной (Горелов А.В. с соавт., 2005), сердечно-сосудистой (Попов С.В., 2003), костно-мышечной систем (Воробушкова М.В. с соавт, 2004). Такие дети формируют группу часто болеющих, более склонны к хроническому течению заболеваний; у них чаще выявляются кожные и респираторные аллергозы (Тонкова-Ямпольская Р.В., 2002; Маркова Т.А., 2003; Балаболкин И.И. с соавт., 2003), а также отклонения физического развития (Чиненова Н.С., 2001; Шниткова Е.В., 2003). Все эти нарушения наиболее выражены у воспитанников Домов ребенка (Ларина О.А., 2005; Филькина О.М. с соавт., 2006).
Редкие отечественные работы (Пальчик А.Б., Шабалов Н.П., 2009; Хацкель С.Б., Попов И.В., 2008,2009) подчеркивают значение внутриутробной экзогенной интоксикации, как причины внутриутробного тератогенного воздействия и его последствий в форме врожденных пороков и малых аномалий развития. Однако эти данные разрозненны, не систематизированы.
Практикующие врачи не устанавливают диагноз ФАС. Затруднения в этом вопросе понятны еще и потому, что кроме отсутствия подобного грифа в отечественном списке диагнозов, нет и апробированой, широко известной методики определения ФАС. Представленные в зарубежной медицинской периодике диагностические подходы также имеют различия, их специфичность дискутируется (Вашингтонские Критерии ФАСН - The 4-Digit Diagnostic Code. Seattle: University of Washington, 2004; Руководящие принципы ЦКЗ - CDC Retrieved on 2007; Критерии института медицины США - Clarification Institute of Medicine (IOM) criteria FASD, 2005; Канадские руководящие принципы - FASD: Canadian guidelines for diagnosis, 2005). В Европе, в настоящее время, не существует согласованной диагностической схемы ФАС. Британская медицинская ассоциация приводит все диагностические системы с рекомендацией использования врачами-практиками на самостоятельный выбор (FASD: A guide for healthcare professionals, BMA 2007).
Практически не изучены морфофункциональные особенности общего развития и состояния ЦНС у детей раннего возраста с последствиями внутриутробного воздействия алкоголя.
Полностью не определены патогенетические механизмы, лежащие в основе формирования структурно-функциональных изменений, определяющих клинические синдромы внутриутробного воздействия алкоголя у детей раннего возраста.
Актуальной проблемой педиатрии является и выбор тактики ведения детей с данной патологией.
Все вышесказанное и послужило основанием к проведению настоящей работы и определило выбор цели и задач исследования.
Цель исследования
Разработать концепцию патогенеза структурно-функциональных изменений, определяющих основные клинические синдромы внутриутробного воздействия алкоголя у детей раннего возраста. Оптимизировать раннюю диагностику и обосновать выбор медико-организационных мероприятий у детей с ФАС в периоде раннего детства.
Задачи исследования
- На основании данных комплексного исследования показателей здоровья, морфологических изменений лицевого черепа и отклонений со стороны ЦНС с использованием оценочной системы ІОМ (США, 2005), дополненной и модифицированной нами, определить показатели частоты ФАС в УИТ и открытой популяции.
- Дать объективную характеристику клинической картины ФАС и чФАС у детей в периоде раннего детства.
- Установить воздействие алкоголя на систему факторов роста (TGF-1) у беременных женщин и детей, а также в эксперименте у животных.
- Установить особенности тератогенного действия этанола на морфо-функциональные показатели развития на организменном и органном уровнях и доказать в эксперименте влияние этанола на эмбриогенез.
- Дать оценку степени тяжести психо-неврологических проявлений у детей с ФАС, показать их сочетанность с метаболическими изменениями (в том числе, концентрацией факторов роста) и отклонениями гистоморфологического характера).
- Сформулировать концепцию патогенеза ФАС, позволяющую рекомендовать подбор и подходы к медико-организационным и педагогическим мероприятиям на различных этапах наблюдения за подобными пациентами как в условиях УИТ, так и в открытой сети.
- Обосновать необходимость создания регистра детей с ФАС с целью дальнейшего мониторирования абилитационных и реабилитационных воздействий.
Научная новизна
Впервые в отечественной педиатрии сформулирована концепция развития ФАСН и определены его основные варианты – ФАС, чФАС. Частота ФАС в УИТ составила 139 на 1000, в общей популяции 18-19 на 1000.
Доказано, что отставание в физическом развитии детей тесно связано с тератогенным воздействием алкоголя. Получены научные данные о взаимосвязи уровня трансформирующего фактора роста TGF-1 у беременных женщин, злоупотребляющих алкоголем, в эксперименте на алкоголизированных животных и у детей с ФАС, что позволяет обосновать включение данного биомаркера в систему диагностических критериев ФАС и высказать гипотезу о блоке рецепторов тканей к факторам роста, что до настоящего времени не было освещено в мировой медицинской литературе.
Следует считать уникальными найденные различия при сопоставлении клеточного состава отделов мозга алкоголизированного потомства от препаратов группы сравнения. Результаты гистометрии (в контрольной группе участки разряжения (выпадения) составили 43%, в опытной – 88%) имели существенные различия в опытной и контрольной группах, что может быть новым шагом при объяснении не только синдромов дефектности патофизического статуса, но и механизма тонатогенеза.
Установлено, что в группах ФАС и чФАС статистически достоверно определяется задержка нервно-психического развития детей, в т.ч. нарушения сенсорного аппарата. Определены особенности электрофизиологических показателей (ЭЭГ, УПП) при ФАС и чФАС, ассоциированные с нарушениями нейросенсорного аппарата. Наблюдается повышенная, по сравнению с общей популяцией, манифестация ВПР (ФАС - 62,5%, чФАС - 40,6%, неФАС - 19,6%, р < 0,001).
Обоснованы рекомендации к ранней диагностике ФАС с использованием модифицированной системы IOM (CША) и проведению дифференцированных абилитационных и реабилитационных мероприятий.
Практическая значимость работы
Апробирована на большом количестве пациентов и доказана диагностическая значимость системы IOM для выявления внутриутробного воздействия алкоголя на потомство и развитие синдромов ФАС и чФАС. Надежность диагностики возрастает при использовании таких тестов, как увеличение уровня TGF-1 и документирование ущербности сенсорного аппарата.
Выделение детей с ФАСН меняет структуру показателей здоровья в ДР. Получены первые данные о распространенности ФАСН среди воспитанников УИТ и в общей популяции, что должно быть ориентиром для практических врачей и документироваться в истории развития. Разработаны диагностические подходы к выявлению ФАС и его отсроченных проявлений у детей раннего возраста, полезная модель для морфометрии лица (патент № 93250 от 27.04.2010).
Дана четкая клиническая очерченность основных проявлений ФАС (отставание в росте, фациальные морфометрические особенности, структурно-функциональные нарушения ЦНС и повышение концентрации факторов роста, во много раз превышающей референтные значения (0 – 3,46 нг/мл ).
Выявлена резистентность детей с ФАС к традиционно проводимой терапии. Результаты работы позволили рекомендовать практикующим врачам выделение в УИТ группы детей с ФАСН, требующих специальных медико-организационных, педагогических, абилитационных и реабилитационных мероприятий; включение в диагностический комплекс определение концентраций ФР (TGF-1); учитывать, что при усыновлении таких пациентов необходима комиссионная оценка состояния здоровья ребенка и информирование родителей.
Основные положения, выносимые на защиту:
- Специфические клинические проявления у детей внутриутробно подвергшихся воздействию этанола диагностируются в виде ФАС (показатели веса и роста, окружности головы и размеры глазной щели ниже 10 процентили, сглаженности фильтра верхней губы, узкой каймы верхней губы) и чФАС (с исключением одного из признаков).
- Задержка физического развития в сочетании с отклонениями нервно-психического развития у пациентов раннего возраста может свидетельствовать о наличии фетального алкогольного спектра нарушений (ФАСН) и требует дополнительного обследования: оценки фациальных структур и концентрации факторов роста.
- Разработанный комплекс клинических, морфологических, экспериментальных, лабораторно-инструменталных показателей является основанием для формирования концепции патогенеза ФАСН.
- Необходима ранняя диагностика ФАСН для дифференцированного подхода к медико-организационным, абилитационным и реабилитационным мероприятиям у детей, находящихся в УИТ. Учитывая стойкость симптоматики и резистентность к проводимой терапии у данных пациентов, основной акцент медико-профилактических мероприятий следует сводить к профилактике алкоголизации населения.
Апробация работы
Основные положения диссертации доложены на научно-практических семинарах в Специализированных домах ребенка №№ 1, 2, 4, 6 Свердловской области, гг. Ревды, Каменск-Уральска, Первоуральска; на научно-практической конференции для сотрудников Домов ребенка Свердловской области, на Межрегиональной научно-практической конференции «Актуальные проблемы педиатрии», г. Уфа, 2007г, III Российском конгрессе «Современные технологии в педиатрии и детской хирургии», Москва, 2008г, Конгрессе акушеров-гинекологов Урала с международным участием «Высокотехнологические виды медицинской помощи на службе охраны здоровья матери и ребенка», Екатеринбург, 2009г, Общероссийской конференции «Современные исследования социальных проблем», Красноярск, 2009, Российской научной конференции «Педиатрия: из ХIХ в ХХI век», С-Петербург, 2010.
Внедрение результатов работы
Материалы исследования включены в учебные программы для студентов 4 и 5 курсов лечебно-профилактического и медико-профилактического факультетов, врачей последипломного образования, опубликованы в виде методических рекомендаций «Диагностические подходы к выявлению фетального алкогольного синдрома и его отсроченных проявлений у детей раннего возраста» (Екатеринбург, 2010).
Результаты работы внедрены в повседневную практику Государственных учреждений ЗО Свердловской области: Домов ребенка, ОДКБ № 1.
Получен патент на полезную модель «Устройство для фотометрии», № 93250 от 27.04.2010.
По материалам диссертации опубликовано 32 работы, в том числе 14 статей в изданиях, рекомендуемых ВАК, и 2 монографии: «Качество жизни населения и экология» (Красноярск, 2011), «Фетальный алкогольный синдром: клинико-патогенетическая характеристика последствий у детей раннего возраста» (Екатеринбург, 2011).
Структура и объем диссертации
Диссертация изложена на 183 страницах машинописного текста, состоит из введения, обзора литературы, 6 глав собственных исследований, заключения, выводов и практических рекомендаций. Работа иллюстрирована 29 таблицами, 31 рисунком. Библиография включает 152 отечественных и 144 зарубежных источников.
Весь материал, представленный в диссертации, получен, обработан и проанализирован лично автором.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена в ГБОУ ВПО «Уральская государственная медицинская академия» Минздравсоцразвития России с 2005г по 2011г на базе кафедры детских болезней лечебно-профлактического факультета; Государственных учреждений здравоохранения Свердловской области: «Специализированный дом ребенка» № 1, № 2, № 4, № 5, № 6, № 9; МУ Городская детская больница № 10; МУ Детская психиатрическая больница № 31 (наркологическое отделение); Городская клиническая больница 24 (отделение патологии беременных); детских дошкольных физиологических учреждениях общего типа (ДДУ) Кировского района г. Екатеринбурге; в общеобразовательной школе (СОУ) г. Екатеринбурга. Всего обследованы 1221 человек: в ДР – 445 детей в возрасте от 1 месяца до 4-х лет; в ДДУ – 326 детей в возрасте от 1,5 до 4,5 лет; в СОУ – 342 ученика в возрасте 7 – 17 лет; в ГДБ № 10 – 54 ребенка от 1 месяца до 14 лет; в Детской психиатрической больнице № 31 – 25 детей в возрасте от 9 до 14 лет; в ГКБ № 24 – 29 беременных женщин.
Экспериментальная часть работы с животными выполнена на базе Центральной научно-исследовательской лаборатории и вивария ГБОУ ВПО УГМА.
Научное исследование состоит из 5 этапов: І-го, ретроспективного, II и III – проспективного (сравнение с контролем), IV – экспериментальная часть работы, V – поиск возможных терапевтических методик.
Методы исследования
Автором лично осуществлялся первичный осмотр всех детей ДР, ДДУ и СОУ, а также динамическое наблюддение в течение периода исследования (2005 – 2011гг).
С помощью клинико-анамнестического метода изучались акушерско-гинекологический анамнез матерей: характер и наличие отклонений родовой деятельности; особенности патологии и течение неонатального периода; проводимой терапии.
Антропометрические измерения проводились по общепринятым точкам с использованием стандартных измерительных приборов и обрабатывались при помощи программы «WHO Anthro» (version 3, April 2009) для ПК на основании свободного лицензионного соглашения (WHO Software License). Были использованы таблицы «WHO Child Growth Standards» с разрешенной адаптацией показателей в соответствии с приказом МЗ РФ № 151 от 07.05.1998г и приказом МЗ РФ № 307 от 28.04.07 для амбулаторно-поликлинической службы.
Основные лицевые аномалии документировались по шкале «губы-желобок» и путем измерения дины глазной щели (рис. 1). Для более точного документирования морфологических особенностей ребенка осуществлялась цифровая фотография лица в 2-х позициях с использованием полезной модели, разработанной автором (патент № 93250).
Для определения ТGF-1 использовали метод гетерогенного твердофазного иммуноферментного анализа (тест-система Human ТGF-1 ELISA BMS249/2 and BMS249/2TEN, Bender MedSystems, Австрия; тест-система Rat TGF-1 ELISA BMS 623 and BMS 623TEN, Bender MedSystems, Австрия).
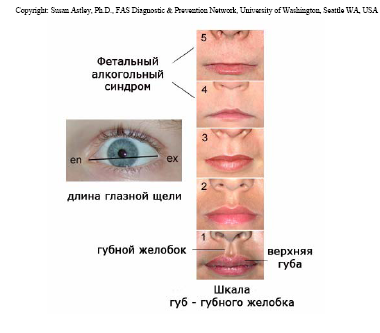
Рис. 1. Шкала выраженности диагностических критериев ФАС по
особенностям строения верхней губы и размерам глазной щели
Для выявления точечных мутаций в геноме (CYP2E1, ADN1B, ALDH2) использовался метод ПЦР выявления мутации в лейкоцитах крови.
Гистологическое исследование включало обзорную оценку состояния ткани мозга, сердца, печени и почек лабораторных животных с применением окрасок гематоксилином-эозином, пикрофуксином по Ван гизону и по Нисслю, шик-реакции; проводился подсчет общей численной плотности нейронов.
Электронномикроскопическое исследование головного мозга лабораторных животных осуществлялось на электронном микроскопе JEM-200CX при ускоряющем напряжении 80 киловольт. Срезы контрастировали уранилацетатом и цитратом свинца по Рейнольдсу. Этот же метод применен при исследовании мозга ребенка с летальным исходом.
Оценки психомоторного развития детей проводилась с использованием Денверский II скрининг-теста (Denver II, Frankenburg WK, Dodds J, Archer P, et al; Pediatrics. 1992). Кроме того, учитывались заключения и диагнозы специалистов-психоневрологов, имеющихся в медицинской документации ДР.
Измерение температуры тела выполнялось в течение суток с интервалом 3 часа, ректально, электронными термометрами (торговая марка AND A@D MEDICAL, DT-625).
Исследование постоянного потенциала (омега-потенциала) головного мозга проводилось по методу В.А. Илюхиной (Бехтерева Н.П., Илюхина В.А., 1986, 1989).
ЭЭГ исследования осуществлялись при помощи компьютерного электроэнцефалографа «NICOLET Bravo» (США).
УЗИ органов брюшной полости и почек, НСГ выполнялись аппаратом «Карис плюс» (Россия, ОАО «Уральский приборостроительный завод») с использованием линейного и конвексного датчиков.
Скрининговое сурдологическое обследование детей осуществлялось методом регистрации отоаккустической эмиссии. Использована система «AccuScreen» фирмы Madsen филиала компании GN Otometrics (Дания).
Все дети осмотрены офтальмологический согласно стандартному протоколу.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Следует отметить, что в настоящее время в отечественной медицине не существует учета врожденных состояний, связанных с воздействием алкоголя на плод.
Исследование, согласно целям и задачам, осуществлялось в несколько этапов. На I-ом этапе исследования, на основании анализа ретроспективных данных биометрических показателей при рождении (массы, длины, окружности головы) у 445 детей ДР были сформировано две выборки: 1-я, основная, где критериями включения стали ведущие диагностические признаки ФАС – низкие (ниже 10 перцентили средних популяционных данных) показатели веса, роста, окружности головы. Среди них дети с низкой массой тела составили 147 человек (82,6%), с очень никой массой тела – 28 (15,7%), с экстремально низкой массой – 3 (1,7%). Необходимо отметить, что учет соотношения массы и срока гестации во многих случаях не проводился ввиду частого отсутствия данной информации в медицинской документации ДР.
Вторая выборка, контрольная, была рандомизирована в тех же учреждениях и группах при значении приведенных критериев более 10% перцентили и составила 267 детей.
При реализации II-го этапа, на основании сплошного поперечного обследования оценивались показатели массы тела, длины/роста и окружности головы на момент осмотра детей ДР. Обращает на себя внимание, что 172 человека, имеющих низкие показатели при рождении, и на момент осмотра сохраняли эту тенденцию. В дальнейшем проводилась морфометрия лица (оценивали продольный размер глазной щели, ширину верхней губы и выраженность желобка верхней губы). В результате было сформировано 3 группы:
- группа (62 ребенка) – дети с ФАС, которые согласно диагностическим критериям с использованием системы IOM (Институт медицины США, 2-й пересмотр, Hoyme HE, et al, 2005) имели низкие показатели длины, массы тела и ОГ как при рождении, так и на момент осмотра ( 10% перцентили); ширину глазной щели на момент осмотра 10% перцентили; выраженность желобка верхней губы на уровне IV -V ранга; ширину верхней губы на уровне IV -V ранга;
- группа (112 детей) – дети с частичным ФАС (чФАС), которые не имели полного набора всех выше перечисленных критериев;
- группа (249 пациентов) – дети без признаков, характерных для ФАС (неФАС).
Недоношенные дети (1 гр. - 10%, 2 гр. – 23%, 3 гр. – 13%) и дети с задержкой внутриутробного развития (1 гр. – 90%, 2 гр. – 54%, 3 гр. – 43%) присутствовали во всех 3-х группах, но динамика физического развития в последующие возрастные периоды у детей с ФАС и чФАС имела значительно более низкие темпы в сравнении с группой контроля (неФАС). Данный факт свидетельствует об адекватности выбранного нами комплекса диагностических критериев ФАСН.
Для подтверждения специфичности используемых диагностических критериев и, учитывая, что в ДР концентрируется «особый» социальный контингент, мы решили провести исследования и в школьно-дошкольных физиологических учреждениях. Проведено обследование 326 детей дошкольных образовательных учреждений (ДДУ) г. Екатеринбурга и 342 учеников среднего общеобразовательного учреждения (СОУ). В результате в ДДУ выявлено 6 детей (1,8%) с морфологическими отклонениями, характерными для внутриутробного воздействия алкоголя. У учеников СОУ обозначенные признаки не выявлены.
Отсутствие альтернативных признаков у школьников СОУ (лицея) возможно связано с социальным статусом и отбором детей в данные учебные заведения. Так как пациенты с ФАС могут не освоить программу общеобразовательного учреждения и нередко переводятся в специализированные школы и интернаты.
При аппроксимации данных, возможно, заключить, что в общей популяции детей г. Екатеринбурга, посещающих ДДУ количество детей, имеющих ФАСН может составить 18-19/1000, что резко отличается от данных, полученных К. Уорреном с соавт. по России (Warren KR et al: 2001). В свою очередь это сопоставимо с данными показателями по другим странам (May PA et al: 2001, 2007), см. табл. 1.
Таким образом, в результате наших исследований впервые в России получены предварительные клинико-эпидемиологические результаты по распространенности ФАСН, как среди детей-воспитанников ДР, так и в общей популяции.
Таблица 1. Количество детей в популяции с признаками ФАС на 1000 рожденных
| Страна | Количество (абс.) ФАС/1000 рожденных | Источник |
| США | 10.0 | May P.A. et al: 2001 |
| Южная Африка | 68.0 – 89.0 | May P.A. et al: 2007 |
| Россия | 141.0 | Warren K.R. et al: 2001 |
| Канада | 0.5 | Habbick et al: 1996 |
| Италия | 120.0 | Ceccanti et al: 2007 |
| Россия, Свердл. обл., Дома ребенка | 139 | Малахова Ж.Л., Шилко В.И., Бубнов А.А.: 2008 |
| Россия, Екатеринбург, ДДУ | 18.0 – 19.0 | Малахова Ж.Л., Шилко В.И., Бубнов А.А.: 2008 |
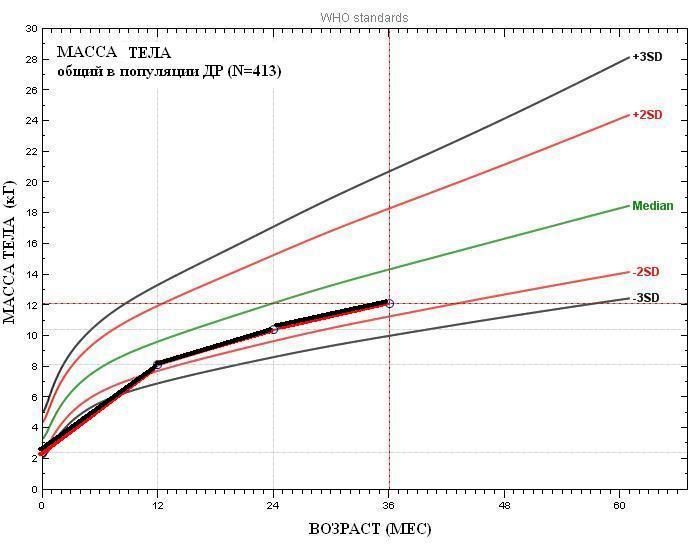
Известно, что физическое развитие является генетически запрограммированным процессом и одним из важнейших критериев оценки и прогноза здоровья детей. При неблагоприятных воздействиях происходит репрограммирование наследственной информации плода методами эпигенетических изменений. Мы проанализировали динамику физического развития детей от рождения до 3-х лет в общем массиве (см. рис. 2) и в соответствии с выделенными группами (см. рис. 3, 4).
При общем анализе средних значений антропометрических показателей (массы, длины/роста), наши данные совпадают с результатами других ученых (Витрук Е. Л., 2006; Конова С. Р. с соавт., 2006, 2008; Ибрагимов А. И., 2006; Широкова О. С., 2007; Волкова О. А., Чередниченко А. М., 2007; Филькина О. М. с соавт., 2008). Однако, очень редко (Сибирякова Н.В., 2007) авторы отходят от «средних» показателей физического развития и выделяют конкретные причины, приводящие к таким особенностям роста детей. Такой «усредненный» подход формирует мнение об общем отставании физического развития воспитанников ДР (до 98%).
Анализ физического развития детей по выделенным группам показывает статистически достоверные различия ( 0,005) показателя динамики массы тела от рождения до 3-х лет между 3-й (неФАС) и 1-й и 2-й группами (ФАС и чФАС). При этом значения среднего показателя массы тела детей 3 группы находятся в среднем коридоре (=50th), а иногда и превышают его, в то время как дети 1 и 2 групп за весь период наблюдения имеют значение массы тела значительно ниже среднего ( 3% для ФАС и 15% для чФАС).
 наблюдаемая группа наблюдаемая группа | 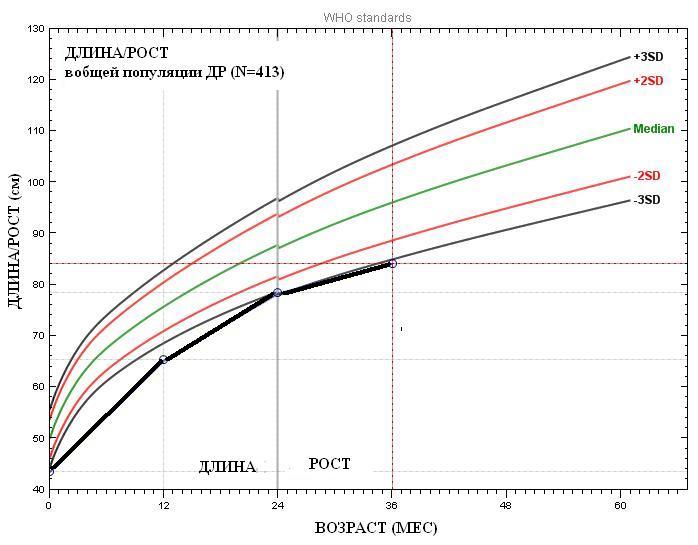 наблюдаемая группа наблюдаемая группа |
Рисунок 2. Показатели физического развития воспитанников ДР от рождения до 3-х лет с
интервалом 12 мес. (n=423)
Эти данные подтверждают воздействие алкоголя на трофические процессы и нашу гипотезу о роли алкоголя, как фактора, изменяющего генетическую программу развития ребенка и, в частности, прибавки массы тела, как на первом году, так и последующие периоды – до 3-х лет (в нашем исследовании).
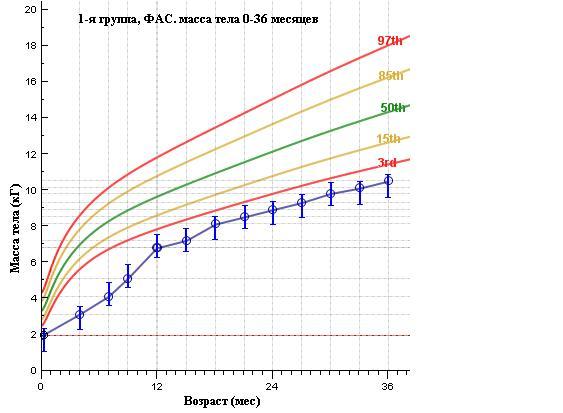
| 1-я гр. ФАС (n= 62) | 2-я гр. чФАС (n= 112) | 3-я гр. неФАС (n= 249) | |
 наблюдаемая группа наблюдаемая группа | 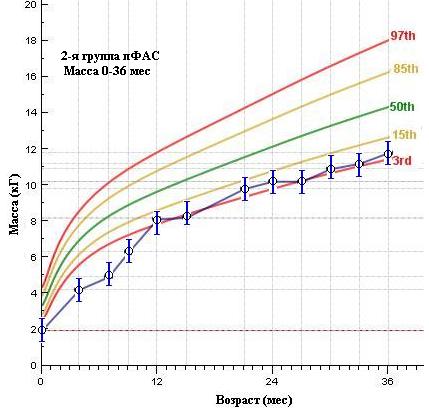 наблюдаемая группа наблюдаемая группа | 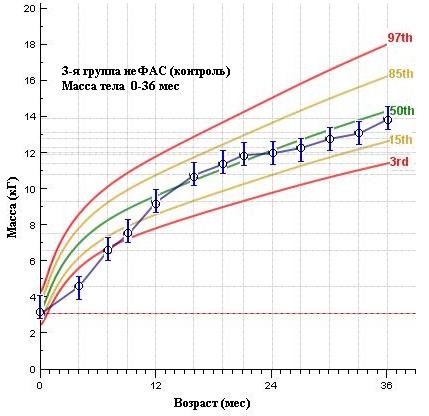 наблюдаемая группа наблюдаемая группа | |
Рисунок 3. Средние показатели массы тела воспитанников ДР по выделенным группам
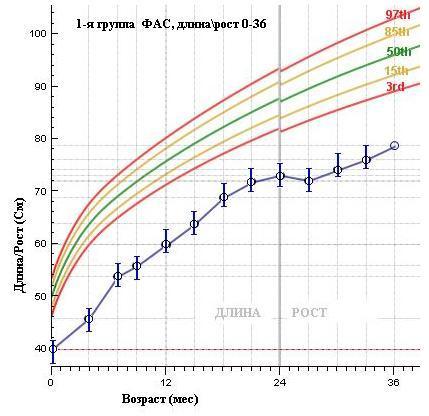
Аналогичны выше приведенным, и результаты по динамике роста детей ДР: в 1-й группе показатели роста в течение первых трех лет жизни находятся ниже 3-го перцентиля средней популяционной нормы, как и в группе чФАС.
В группе контроля (неФАС) средние показатели роста имеют сложную динамику: в течение 1-го года жизни они низкие ( 15), но в дальнейшем увеличиваются, хотя так и не поднимаются выше 50 перцентильного значения. По нашему мнению, это отражает действие других факторов на рост и развитие ребенка – например, алиментарного, госпитализма, последствий внутриутробной гипоксии, перенесенной инфекции и т.п.
Полученные данные очень интересны! Они подтверждают гипотезу, что эти дети с эмбриофетопатией искажают всю благоприятную статистику по ДР.
Представленный анализ основных показателей физического развития воспитанников ДР свидетельствует о четком различии между детьми трех групп. Наши данные позволяют высказаться о том, что «внутриутробный» алкоголь имеет четкий тератогенный эффект, изменяющий как морфологические критерии, так и физические показатели развивающегося детского организма.
| 1-я гр. ФАС | 2-я гр. чФАС | 3-я гр. неФАС |
 наблюдаемая группа наблюдаемая группа | 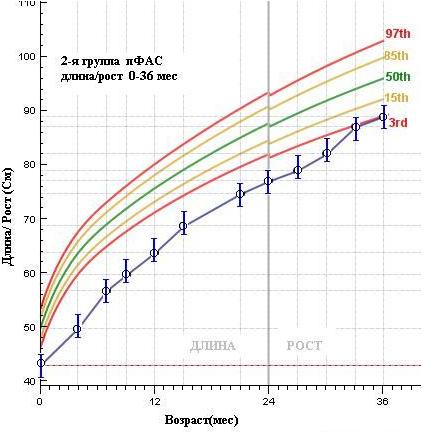 наблюдаемая группа наблюдаемая группа | 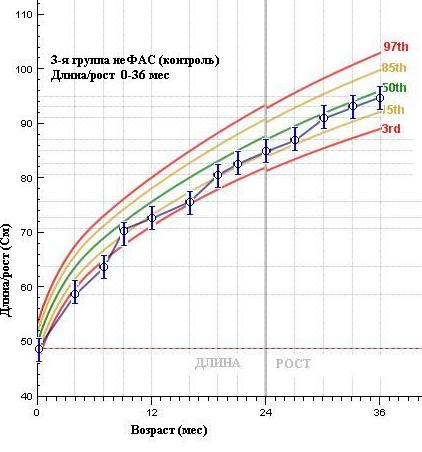 наблюдаемая группа наблюдаемая группа |
Рисунок 4. Средние показатели длины тела воспитанников ДР по выделенным группам
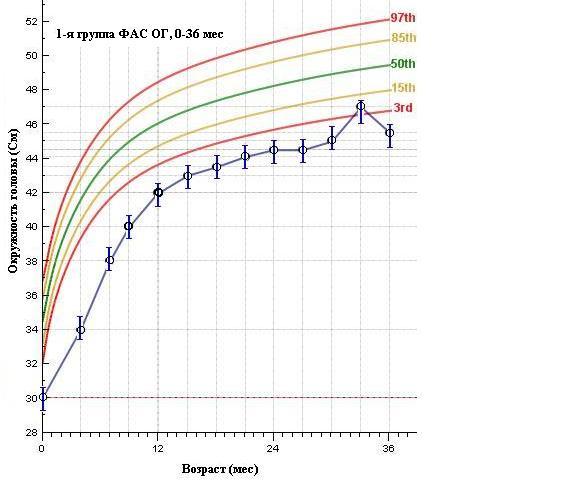
В этом смысле двоякое значение имеют показатели динамики изменений размеров ОГ (рис. 5), которые показывают статистические различия (p 0,005) по всем 3-м анализируемым группам. Если в 1 группе (ФАС) ОГ значительно ниже 3-го перцентиля средней популяционной нормы, что сохраняется и в дальнейшем в течение всего срока наблюдения, то в 3-й группе (неФАС) мы видим, как в течении 1-го года идет интенсивное увеличение показателя ОГ к возрасту 12 мес., достигая среднего популяционного значения.
| 1-я гр. ФАС | 2-я гр. чФАС | 3-я гр. неФАС |
 наблюдаемая группа наблюдаемая группа | 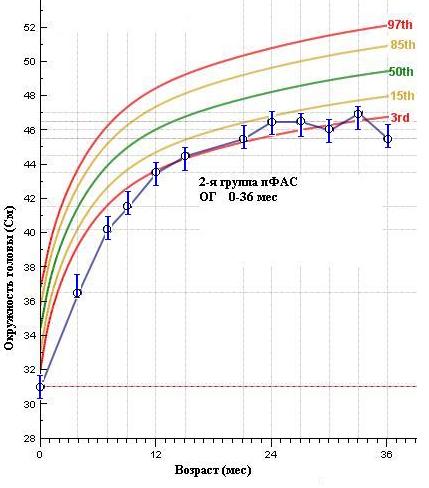 наблюдаемая группа наблюдаемая группа | 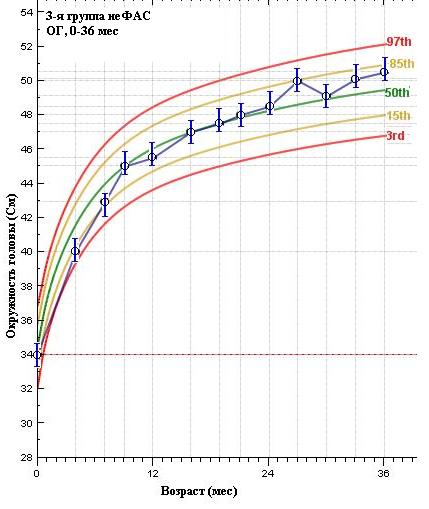 наблюдаемая группа наблюдаемая группа |
Рисунок 5. Средние показатели ОГ (см) воспитанников ДР по выделенным
группам
Во 2-й группе (чФАС) дети, рожденные с низкими показателями ОГ, имеют на первом году жизни интенсивное ее увеличение, аналогичное с 3-й группой, но в дальнейшем характеризуются низкими показателями, что согласуется с наблюдениями других авторов (McNeil T.F., 1993, Хацкель С.Б., 1994).
Размер ОГ, косвенно характеризующий объемные размеры мозгового черепа, тесно связан с размерами головного мозга. В литературе имеются указания на четкую связь снижения интеллекта со снижением размеров ОГ (Simek Z., 2008).
Таким образом, анализ основных антропометрических показателей в выделенных группах показал, что они сформированы плотно, в большей части признаков имеют статистически достоверные различия и особенности. Недостаточные темпы роста и развития детей с ФАС в сравнении с общепопуляционными показателями воспитанников ДР не исключает тератогенное действия алкоголя на плод и экспрессию генов.
Все вышесказанное послужило поводом для изучения уровня трансформирующего фактора роста 1 (TGF-1) у обследуемых детей.
Результаты концентрации TGF-1 оказались несколько неожиданными. При отставании в массе, росте, ОГ, напротив, документировано увеличение нарастания TGF-1 в 1-ой группе (средний показатель в группе ФАС составил 71,2 нг/мл, в группе неФАС - 45,6 нг/мл). Отмеченная тенденция (р=0,2) заставляет подробнее изучить динамику показателей TGF-1, что было выполнено и представлено ниже (в эксперименте у животных, а также при обследовании беременных женщин).
Уточняя воздействия различного рода рисков рождения детей с ФАСН, мы рассмотрели взаимодействие биологических, медико-организационных и социальных причин (см. табл. 2). Следует отметить, что в большинстве случаев данные о матери ребенка-сироты весьма скудные. Фактически все женщины не наблюдались в женской консультации, у 84 (20,4%) – «домашние» роды.
Прослеживается явная линейная зависимость между возрастом матери на момент рождения ребенка и тяжестью проявлений внутриутробного алкогольного воздействия. В свою очередь трудно (или невозможно) определить, является ли этот факт проявлением влияния биологического возраста или «стажа» алкоголизации матери.
Таблица 2. Средний возраст и количество беременностей матерей наблюдаемых детей
| Показатель | Матери гр. ФАС | Матери гр. чФАС | Матери гр. неФАС |
| Средний возраст на момент рождения данного ребенка, лет | 34 ± 4* | 29 ± 6 | 23 ± 3 |
| Среднее количество беременностей | 6 ± 2** | 4 ± 2** | 2 ± 1 |
| Среднее количество живых детей | 4 ± 2*** | 3 ± 1 | 2 ± 1 |
| Среднее количество мед. абортов | 0,3 ± 0,1*** | 0,6 ± 0,4*** | 0,1 ± 0,1 |
| Среднее количество выкидышей | 3 ± 3*** | 1,2 ± 0,7*** | 0,4 2 ± 0,1 |
* р 0,01; ** р 0,05; *** р > 0,05 (по отношению к гр. неФАС – контроль)
Аналогичная тенденция отмечается и по количеству беременностей: вероятность рождения ребенка с ФАС нарастает с каждой последующей беременностью.
Количество выкидышей также увеличивается с возрастом и количеством беременностей, что, вероятно, можно связать с проявлением вынужденного увеличения дозы с течением алкоголизма матери и/или острым токсическим действияем алкоголя на плаценту и плод. Это согласуется и с результатами других авторов как зарубежных (Astley et аl., 2000; Kvigne et аl., 1998; Stratton et аl., 1996), так и российских (Шурыгин Г.И.,1974).
Как правило, «отказные» дети, прежде чем попасть в ДР, переводятся в клиническую больницу и, в конечном итоге, имеют окончательный диагноз ППЦНС (заключительные выписки из стационара не имеют даже предположительного указания на синдром ФАС). Все дети поступают в ДР в клинически стабильном, удовлетворительном состоянии, однако срок госпитализация детей 3 группы (не ФАС) составил в среднем 58 дней, 2 группы – 74 дня, 1 группы - 86 дней. Подобное динамическое различие можно связать с тем, что достижение стабильного состояния детей с ФАС требует дополнительных клинических усилий (р 0,01), особенно в наборе массы.
В структуре общей заболеваемости детей преобладают: анемия (1 группа (ФАС) - 71%, 2 группа (чФАС) - 50,9%, 3 группа (неФАС) – 19%), рахит (1 группа - 88,5%, 2 группа - 62, 3 группа – 47%), атопический дерматит (1 группа - 11,1%, 2 группа - 19%, 3 группа - 34,2%), гипотрофия (1 группа - 85,7%, 2 группа – 78%, 3 группа - 12,4%). Выявлена высокая частота острых инфекций, среди которых преобладает патология респираторного тракта. На 1-ом году жизни на одного ребенка 1 группы в среднем приходится 7 острых инфекций, во 2-й группе - 5, в 3 группе - 4. Как видно, основную часть детей, вошедших в 1-ю и 2-ю группы, можно отнести по критериям к часто болеющим, на 2-м году наблюдения это относится только к 1 группе (ФАС).
Таким образом, дети, подвергшиеся внутриутробно воздействию алкоголя, имеют повышенные показатели фоновых заболеваний и являются часто болеющими детьми.
Данные наших исследований свидетельствуют и в пользу сопряженности высокой частоты порочности, связанной с ФАСН у детей из ДР. Различия частоты пороков в группах ФАС (62,5%) и чФАС (40,6%) статистически высоко достоверны с группой неФАС (19,6%, р < 0,001). При этом, пороки ЦНС являются преобладающими: 1 группа - 43,7%; 2 группа – 21,8%; 3 группа – 12,5%. Что касается порочности со стороны сердечно-сосудистой и мочеполовой систем, то наши данные не совпадают с приводящимися в литературе более высокими цифрами (Astley SJ., Bailey D. Et al., 2000).
Высокая порочность ЦНС возможно связана с особенностями метаболизма алкоголя. А именно, распределение этанола в тканях определяется законами диффузного равновесия и содержанием воды в них (Линг Л.Д., Кларк Р.Ф., Эриксон Т.Б. и др., 2006), иными словами диффузия алкоголя в органы и ткани тем больше, чем лучше их васкуляризация.
При оценке нервно-психического развития с использованием Денвер-II теста у 124 детей воспитанников ДР получены следующие данные: задержка развития в выраженной форме в 45,9%, умеренное отставание в 43,6% и только у 10,5% психомоторное развитие соответствовало возрасту.
При распределении этих детей по выделенным группам, мы получили следующие результаты: в 1 группе психомоторное развитие задержано у 90,5% пациентов, умеренно задержано - у 9,5%; во 2 группе психомоторное развитие задержано у 81,3%, умеренно задержано – 18,7%; в 3 группе (контроль) также отмечается высокий процент отставания психомоторного развития (82,2%), но оно относится преимущественно и достоверно (р< 0,005) к умеренному отставанию.
У детей 1-й и 2-й групп отмечались сниженные показатели по всем 4 психическим сферам (социальная адаптация, тонкая моторика, общая моторика, речь), средний процент выполнения заданий теста не превышает по всем сферам 50%. У детей 3-й группы обращает на себя внимание преимущественные отклонения со стороны тонкой моторики и речи.
В итоге можно сделать вывод о том, что в группе обследуемых, подвергшихся внутриутробно воздействию алкоголя, задержка развития носит относительно равномерный характер, затрагивая как сенсорно-моторную, так и эмоционально-волевую и коммуникативную сферы.
На III-м этапе – проспективном – проведено лабораторно-инструментальное обследование детей по выделенным группам.
Изучение биоэлектрической активности мозга у детей было направлено на выявление степени и характера отклонений ЭЭГ от возрастной нормы, патологических изменений биопотенциалов и их локализации, которые могут свидетельствовать о задержке в возрастном развитии и, как следствие, иметь проблемы в обучении и поведении детей.
Проведен анализ результатов ЭЭГ у 69 детей обоего пола в возрасте от 18 до 29 месяцев. Прежде всего, необходимо отметить, что только у 11,1% воспитанников ДР ЭЭГ была в пределах нормы. По выделенным группам имеются существенные различия в состоянии биоэлектрической активности головного мозга. Так в 1 и 2 группах зафиксированы умеренные и выраженные диффузные изменения, значительно реже встречается «усиление синхронизирующего влияния срединно–стволовых структур», которое преобладает в контрольной группе неФАС (47,8%). По всей видимости, это является особенностью медленноволновой активности, исходящей из стволовых структур у части детей с последствиями ППЦНС, включенных в эту группу (Благосклонова Н.К., Новикова Л.А. 1994.).
В свою очередь, у пациентов 1 и 2 групп преобладают признаки нарушения межполушарного синергизма. Это, обычно, связывают с усилением -активности лобной и лобно-височной локализации, которая активируется бензодиазепиновыми рецепторами мозга (Duffy F.U. et al. 1989) и имеет определенную связь с тормозной нейромедиаторной системой ГАМК (Зенков Л.Р, 2002). В работах Гнездицкого В.В. (2000), Dierks T. et al. (1993) отмечается, что усиление -активности в лобно-центральных областях имеет четкую связь с ухудшением когнитивных функций у детей с задержкой психического и речевого развития. Следует отметить и тот факт, что при внутриутробном воздействии алкоголя на плод, во многих случаях фиксируется выраженное уменьшение размеров мозолистого тела, которое соединяет между собой два полушария мозга, как морфологически, так и функционально (Епистратова Т.В., Соловьев А.Г., 2008).
В группах ФАС (69%) и чФАС (62,5%) имеются признаки ирритации таламических структур (р 0,01), связанные с десинхронизированным характером большого числа бета-колебаний высокой частоты (Майорчик В.Е.и др.1973., Spelman R., 1982), что может говорить о повышенной активности у данных пациентов специфических и неспецифических ядер таламуса, свидетельствующих о нарушении нейро-эндокринных взаимодействий.
Признаки снижения функциональной лабильности головного мозга (1 группа (ФАС) - 21%, 2 группа (чФАС) - 37,5%, р 0,02) и задержки возрастной феноменизации (1 группа (ФАС) - 69%, 2 группа (чФАС) - 62,5%, р 0,02) указывают на незрелость биоэлектрической активности головного мозга у значительной части детей с внутриутробным воздействием алкоголя. Наличие эпилептиформной активности мозга у детей 1 группы в нашем исследовании не выявлено, что может быть косвенным свидетельством диффузного морфо-функционального поражения мозга.
Таким образом, анализ биоэлектрической активности головного мозга детей показал, что особенности нейрофизиологической картины имеются во всех 3-х группах, но в 1-й и 2-й - преобладают диффузные изменения биоэлектрической активности головного мозга, что согласуется с результатами Денвер-теста II и свидетельствует об общей задержке психического развития.
Оценивая особенности энергетического состояния головного мозга у обследуемых детей, нами проведено измерение уровня постоянных потенциалов (УПП) головного мозга по стандартной методике у 69 детей обоего пола в возрасте от 18 до 29 месяцев.
Показательным является анализ динамики УПП в возрастном аспекте (см. табл. 3), когда величина УПП в 1-й и 2-й группах, в отличие от группы контроля, с возрастом прогрессивно снижается. Таким образом, уменьшение интенсивности метаболических процессов в мозге свидетельствует о внутриутробном воздействии алкоголя.
| Таблица 3. УПП головного мозга (мВ) по возрастным категориям | ||||||||||||||||
| ||||||||||||||||
*Р<0,05 (по отношению к гр. неФАС – контроль) |
Морфо-функциональная несостоятельность ЦНС, как следствие внутриутробного воздействия алкоголя, может проявляться девиациями и со сторны сенсорного аппарата.
При стандартном офтальмологическом обследовании 89 детей (1-2 группа - 36 детей, 3 группа – 53 ребенка) выявлено, что у детей с ФАС острота зрения без коррекции составила в среднем 0,77±0,28, в контрольной группе - 0,85±0,26. У всех обследованных пациентов преобладала эмметропия. Однако у детей с ФАС в структуре аметропии преобладала гиперметропия, тогда как в группе неФАС – эмметрпия и миопия. Астигматизм среди детей с ФАС был отмечен почти в 4 раза чаще (26%), чем у детей 3 группы соответствующего пола и возраста (6%).
По данным офтальмоскопии у детей с ФАС чаще был отмечен косой выход зрительного нерва (5 детей, 7 глаз; 7%), что, по-видимому, можно связать с дисморфологией развития мозга. К специфическим проявлениям ФАС следует отнести и наличием микрофтальма (у 96% больных), косоглазия (16%), птоза верхнего века (10).
Рассмотренные функционально–анатомические нарушения зрительного анализатора служат дополнительным свидетельством наличия у ребенка ФАС и упрощают диагностику этого заболевания. Вместе с тем, приходится констатировать тот факт, что в сочетании с соматическими и психомоторными нарушениями, они утяжеляют общее состояние и замедляют развитие детей.
Для определения состоянии слуха у детей ДР было проведено скрининговое исследование методом отоакустической эмиссии, которое выявило возможные нарушения нейросенсорных механизмов у детей с ФАС и чФАС (43%, р<0,005), в отличие от контроля, где только 11% детей не прошли тест. Эти ожидаемые данные дают возможность говорить о комплексном нарушении нейросенсорного аппарата, как по данным анализа состояния зрения, так и по скринингу слуха у детей с ФАС и чФАС.
В настоящее время существует ряд гипотез, объясняющих механизм развития ФАС. Это, прежде всего, тератогенное действие этанола на эмбрион и плод и генетическая особенность биотрансформационных систем в отношении этанола у беременных. Дети, рожденные от пьющих женщин, имеют малую массу при рождении и в дальнейшем отстают в физическом развитии, формируя группу детей с гипотрофией, которая резистентна к проводимой терапии. В связи с этим представляет большой интерес изучение факторов роста (ФР), которые предопределяют будущую морфологию (развитие) как плаценты, так и плода. Они способны стимулировать или тормозить рост тканей. Изменение их уровня можно считать одним из ведущих механизмов таких клинических проявлений как отставание в физическом развитии внутриутробно (ЗВУР) и в постнатальном периоде; морфологические и клинические признаки недоразвития ЦНС, мозгового и лицевого черепа, зрительного и слухового анализатора, что, как уже говорилось, составляет клиническую основу ФАС. По-нашему мнению, большой интерес представляет трансформирующий фактор роста 1 (TGF-1), оказывающий множественные влияния на большое число типов клеток. Так, TGF-1 участвует в регуляции роста клеток, их дифференцировке и апоптозе, а также в модуляции иммунной системы. Тем более, как это было продемонстрировано на рис. 7 и в тексте на стр. 21, тенденция в различиях концентрации TGF-1 очевидна у детей с ФАС и неФАС.
Все вышесказанное явилось обоснованием выявления возможных различий содержания TGF-1 в сыворотке крови беременных женщин, злоупотребляющих алкоголем, и не принимающих спиртные напитки (IV этап исследования – эксперимент).
В обследовании участвовало 28 беременных женщин, находящихся на лечении в отделении патологии беременных ГДБ № 24. Они были разделенных на 2 группы: 1 - (основную) составили 8 женщин (имеющих в анамнезе указания на злоупотребление алкоголем), 2 - (контрольную) – 20 пациенток. Определение уровня ТGF-1 производилось на 11 – 14 недели беременности.
В 1 группе средний возраст женщин составил 33,5 лет. Среди генитальной патологии обращает на себя внимание наличие хронической внутриматочной инфекции, указания на мертворожденных детей у 2-х женщин. Каждая 2-я беременная, помимо употребления алкоголя, являлась никотинзависимой.
Вторая группа была представлена 20-ю женщинами, средний возраст которых составил 31,6 лет. По основным характеристикам группа была идентична первой и не имела статистически значимых отличий репродуктивного статуса и соматического здоровья.
Средний показатель ТGF-1 в 1 группе составил 71,7 нг/мл, во 2-й – 6,6 нг/мл (t = 2,18, р < 0,05). Референтные значения ТGF-1 0 – 3,46 нг/мл. В результате проведенного исследования логично следовало бы ожидать снижение фактора роста в первой группе, напротив, мы получили увеличение его в несколько раз, как и у детей с ФАС, что потребовало своего объяснения. За исключением алкоголизации, мы имели практически одинаковый спектр особенностей течения беременности. Все вышесказанное подвигло нас провести экспериментальную часть работы на здоровых животных. При этом естественно исключались генетическая и экстрагенитальная патология, имевшая место у беременных женщин, бытовые и стрессовые влияния (никотин и т.п.).
Исследования проводились в осенне-зимний период на 26 крысах стадного разведения линии Вистар в возрасте 1-2 месяцев, массой 280-300г. Животные содержались при комнатной температуре в условиях свободного доступа к пище. Они были разделены на две гр.: 1 – основная (13 животных, получавших вместо воды в течение 1 месяца до беременности и в течение всей беременности 15% раствор спирта), 2 - контрольная (13 интактных крыс). В результате были также получены статистические значимые различия в значениях ТGF-1: в опытной группе М = 187,9 нг/мл, в контрольной М = 129,7 нг/мл, t = 2,68, р < 0,02. И хотя этот вопрос мало изучен и требует дальнейшего осмысливания, параллелизм показателей фактора роста у детей, беременных женщин и опытных животных позволяет высказаться о дефектности рецепторного аппарата клеток-мишеней. При этом по данным ряда авторов накопление этого фактора в крови (Bredensen D.E., 1996) может быть связано с блокированием ТGF-1-рецепторов развивающихся клеток алкоголем, в результате чего нарушается рост и миграция клеток и активизируется апоптоз.
Известно так же, что TGF-1 ингибирует пролиферацию клеток цитотрофобласта нормальной плаценты (Ogura Y., Takakura N., Yoshida H. Et al., 1996), что при повышении концентрации данного фактора роста может привести к первичной плацентарной недостаточности, а это, в свою очередь, к развитию ЗВУР плода, который является одним из диагностических критериев ФАС.
Важнейшими этапами раннего нейроонтогенеза являются: образование в перивентрикулярной зоне путем митоза более сотни миллиардов нейронов из нескольких десятков клеток-прародительниц; миграция молодых нейронов к местам своего назначения; рост аксона к клетке-мишени; рост и ветвление дендритного дерева; завершение синаптогенеза с последующим отбором наиболее эффективных функциональных связей.
Этанол меняет скорость деления клеток, уменьшает синаптическую плотность в молекулярном слое коры, индуцирует преждевременную трансформацию радиальной астроглии в астроциты, в результате чего нарушается миграция молодых нейронов к своему месту в мозге (de La Monte SM, Wands JR. Mitochondrial, 2001).
Подтверждение этому мы получили и в наших исследованиях на экспериментальных животных. Как говорилось выше, животные были разделены на две группы: 1 – основная (крысы, получавшие вместо воды в течение 1 месяца до беременности и в течение всей беременности 15% раствор спирта), 2 - контрольная (интактные животные). У полученного потомства в возрасте одного мес. для светооптического и электронномикроскопического исследований брали фрагменты головного мозга. Уже визуально у части животных наблюдались пороки развития глаз, ушей, черепа. В 1-ой опытной группе были найдены выраженные изменения: кора имела очаги разрежения нервных клеток, чередовавшихся по выраженности и распространенности (см. рис. 6). Участки разрежения локализовались преимущественно в средних слоях коры, но встречались единичные зоны разряжения, которые шли через все слои. Были выражены дистрофические изменения нейронов, главным образом, в виде хроматолиза в средних слоях и пикнотичесчких изменений в верхних слоях.
В ядрах гипоталамуса также отмечалось разрежение нервных клеток и их дистрофические изменения. Преобладал гиперхроматоз и пикнотические изменения, а также субтотальное снижение (иногда полное отсутствие) нейрокринных гранул.
В мозжечке имело место истончение извилин. В зернистом слое наблюдались полосы разрежения и резкое уменьшение количества корзинчатых клеток. Сохранные клетки располагались на разных уровнях и неравномерно. В них преобладали гиперхроматоз и пикнотические изменения.
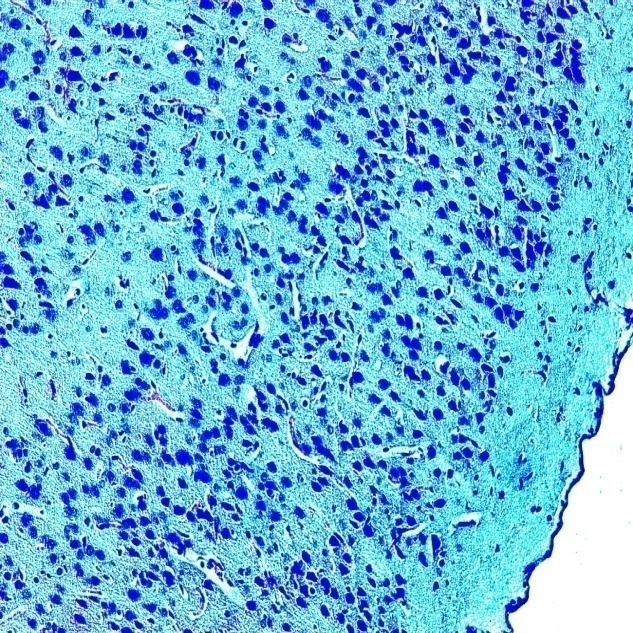
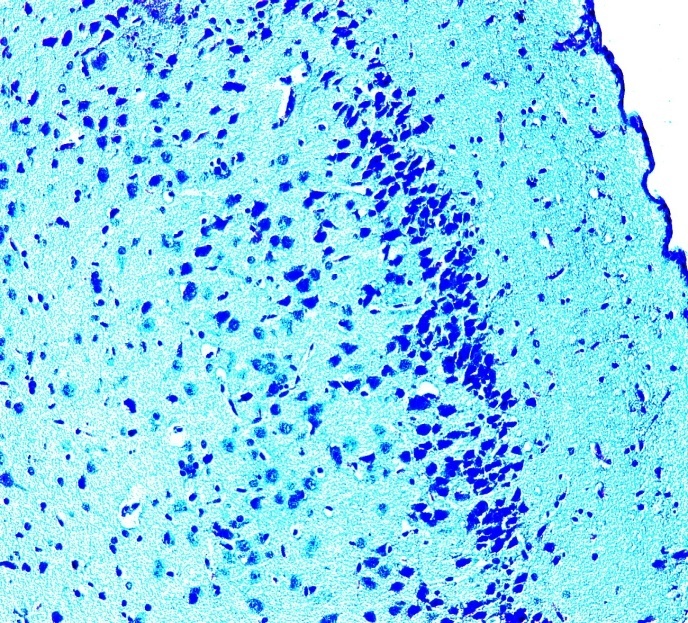
а. контрольная группа б. основная группа (участки разрежения,
(бесклеточные участки - 43%) дистрофические изменения нейронов- 88%)
Рисунок 6. Морфологическая характеристика коры больших полушарий
При гистологическом исследовании тканей мозга в контрольной группе животных не удалось отметить каких-либо существенных отклонений от нормы. В коре была сохранена четкая стратификация нервных клеток, отмечался легкий периваскулярный отек в виде непостоянного расширения пространства Вирхова-Роден-Снесарева. Это явление, по-видимому, следует рассматривать как результат острой гипоксии, связанной с эфтаназией животных.
Также при электронной микроскопии в головном мозге подопытных животных выявлялись нейроны с повышенно электроноплотной цитоплазмой, гомогенизированным ядерным хроматином, нечеткими границами цитоплазмы и редуцированной системой эндоплазматического ретикулома в виде мелких, неравномерно расположенных цистерн. Максимум изменений отмечается в гипоталамической области, с чем, вероятно, следует связать значительное отставание в физическом развитии крысиного потомства, поскольку эта область является высшим подкорковым центром, регулирующим вегетативные функции организма.
Таким образом, в опытной группе животных отмечались выраженные морфологические изменения в виде нарушения распределения и дистрофических явлений в нервных клетках различных функциональных структур головного мозга, что отражает результат воздействия на организм хронической алкогольной интоксикации.
Выявленые морфологические изменения ЦНС в группе опытных животных, коррелируют и с изменениями, документированными при судебно-медицинской экспертизе случая смерти ребенка с чФАС (ГБУЗ СО ГО Судебно-медицинской экспертизы, Акт судебно-медицинского исследования № 5479 от 19.09.2011г) у 2-х месячного ребенка, погибшего в результате ЧМТ, не совместимой с жизнью (очаги разряжения и дистрофические изменения нейронов, уменьшение корзинчатых клеток в мозжечке). Мальчик, 20.07.2011г рождения, от V беременности, протекавшей на фоне угрозы прерывания, гестоза, привычной алкогольной интоксикации родителей, II срочных родов. Масса при рождении 3652,0, длина тела – 52 см. При обследовании поставлен диагноз чФАС.
Таким образом, при гистологическом исследовании мозга погибшего ребенка с чФАС было выявлено разряжение клеток ЦНС, отмеченное в эксперименте у животных.
При гистологическом исследовании печени животных в опытной группе -балочное строение очагово нарушено за счет фокальных некрозов гепатоцитов без клеточной реакции, имеет место умеренный склероз стромы портальных трактов без воспалительной клеточной реакции, выраженный перидуктальный фиброз, анизонуклеоз в гепатоцитах, редкое обеднение цитоплазмы гепатоцитов гликогеном, нарушение «зональности», его накопления. Отмечается увеличение содержания клеток Купфера по сравнению с контрольной группой (на 100 гепатоцитов содержание клеток Купфера возросло в 2 раза).
При гистологическом исследовании печени животных в опытной группе -балочное строение очагово нарушено за счет фокальных некрозов гепатоцитов без клеточной реакции, имеет место умеренный склероз стромы портальных трактов без воспалительной клеточной реакции, выраженный перидуктальный фиброз, анизонуклеоз в гепатоцитах, редкое обеднение цитоплазмы гепатоцитов гликогеном, нарушение «зональности», его накопления. Отмечается увеличение содержания клеток Купфера по сравнению с контрольной группой (на 100 гепатоцитов содержание клеток Купфера возросло в 2 раза).
При гистологическом исследовании почек животных в опытной группе – отмечается уменьшение толщины коркового слоя почек, в 2-х наблюдениях имеет место неравномерное распределение клубочков в корковом слое («густо – пусто»), что укладывается в понятие «дисплазия почечной ткани», в эпителии извитых канальцев – очаговое разрушение Шик-позитивной апикальной каймы и дистрофические изменения в эпителиоцитах, мозговой слой и чашечно-лоханочная система без видимых изменений.
Полученные результаты исследований позволяют нам схематизировать развитие патологического процесса (см. рис. 7). Представленная схема, несмотря на нозологическую моновариантность развития ФАС, иллюстрирует, что в патогенезе можно выделить несколько ключевых звеньев, которые определяют соответствующие этапы развития заболевания, а также исходы.
Первый шаг не требует конкретизации, он очевиден. Это – употребление алкоголя беременной женщиной. Следующим шагом в развитии эндогенных отклонений является образование концентраций токсических метаболитов. В связи, с чем логичным и целесообразным представляется выделение преморбидного (фонового) этапа. На этом этапе действие разнообразных метаболитов экзогенного этанола, образующихся в результате реакций биотрансформации (перекисного окисления, эстерификации и т.п.) может спровоцировать нарушение гомеостаза. В такой ситуации патогены способны, преодолевая защитные рубежи устойчивости клеточных мембран, цитоплазмы воздействовать на ядерный аппарат клеток, транслоцироваться за пределы первичных контактных тканей с алкоголем у беременной женщины по всему организму, включая плаценту и плод. При этом, во время этапа транслокации становятся возможными к реализации эпигенетические процессы (например, реакции, связанные с метилированием ДНК), сохраняющие свой потенциал на следующем потомстве.
В пользу эпигенетических процессов говорят и наши исследования точечных мутаций в геноме детей ДР (мутаций генов алкогольного цитохрома CYP2E1, алкогольдегидрогеназы ADN1B, альдегиддегидрогеназы ALDH2) с целью определения врожденной недостаточности ферментов, отвечающих за распад алкоголя. Было обследованог 20 детей, из которых у 10 был диагностирован ФАС и 10 нормально развивающихся детей (контрольнаяй группа). Мутаций выявлено не было.
С клинической точки зрения какой-либо специфической симптоматики «этанолового» протекания беременности нет. Преморбидный этап и этап транслокации являются как бы «немыми», не считая общесоматического и социального статуса пьющей женщины. Однако по истечению эмбрионального периода обнаруживаются различные признаки ФПН, базирующиеся на деструктивно-пролиферативных изменениях плаценты.
В итоге можно иметь невынашиваемость (выкидыши), ФАС, ВПР, отклонения в деятельности ЦНС (интеллектуальные нарушения, гипермоторность, сенсорные расстройства и т.п.).
Рисунок 7. Гипотетическая схема патогенеза ФАС
(с учетом литературных данных и собственных исследований)
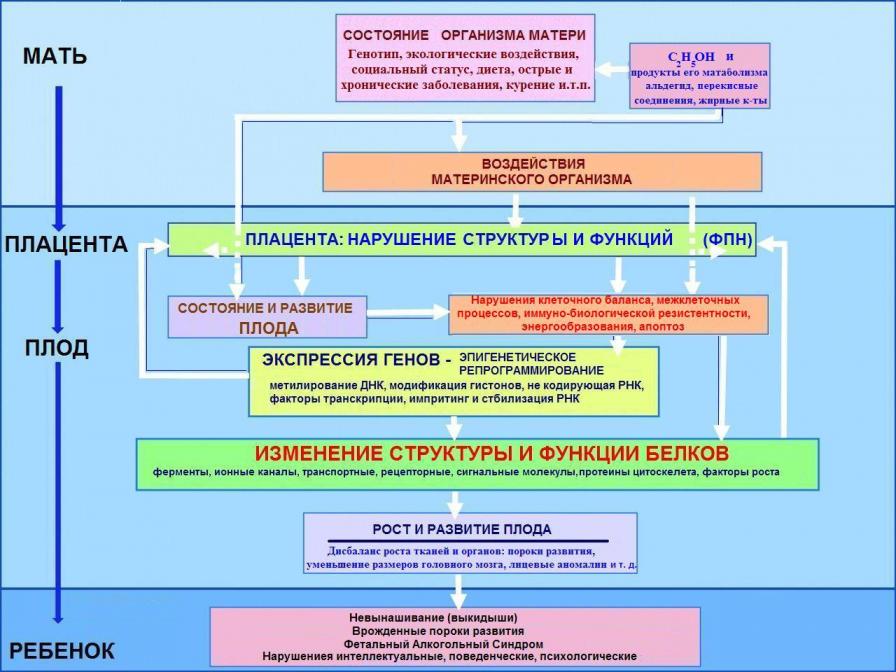
Данная схема, безусловно, носит элементы условности, так как неясны вопросы дозы и длительности, индивидуальной переносимости, зависящей от типа АДГ, питания женщины, возраста и др., но вектор направленности основных патогенетических механизмов укладывается в ложе известных исследователям симптомов, морфологических, биохимических реакций, а также последних разработок, сопряженных с эпигенетическими воззрениями.
На основании вышеизложенного, мы пришли к выводу, что «статическая энцефалопатия» (СЭ) является ведущим первичным пороком, вызванным действием алкоголем внутриутробно. СЭ означает, что нарушения носят постоянный характер и в развитии мозга маловероятно улучшение. Поэтому, на современном этапе, не существует методов коррекции полученных врожденных церебральных повреждений (Coles CD., 1991). Более того, не представляется возможным говорить о реабилитации. Скорее речь должна идти об абилитации.
Абилитация - процесс частичного обретения функции, происходящего на фоне изначального патологического отклонения от физиологических норм развития ЦНС. Цель абилитации - достижение ребенком, по возможности, более высокой функциональной активности, ущербной от рождения. Это предусматривает лечебно-педагогическую коррекцию двигательной, психологической и речевой сферы в раннем возрасте.
Реабилитация (восстановительное лечение) - это процесс и система медицинских, психологических, педагогических, социально-экономических мероприятий, направленных на устранение или, возможно, более полную компенсацию ограничений жизнедеятельности, вызванных нарушением здоровья со стойким расстройством функций организма. Наиболее проблематичными в плане терапевтических подходов у детей с ФАС являются ликвидация ЗВУР, фациальных отклонений, снижения темпов весоростовых показателей, изменений со стороны ЦНС.
Как показывают наши данные, у детей с ФАС, при традиционных подходах в лечении гипотрофии, нормализации важнейших антропометрических показателей не происходит, в отличие от детей без явлений внутриутробного алкогольного воздействия. Некоторыми авторами (Легонькова С.В., 2007; Попова-Латкина Н.В., 1962) отмечается, что нарушение роста и развития у детей-сирот, находящихся в группе риска по возможному внутриутробному воздействию алкоголя, сходны по своему проявлению с хронической белково-энергетической недостаточностью. Сопротивление действию трансформирующего фактора роста (TGF-) возможно через ряд аутокринных и паракринных эффектов, возникающих при эпигенетическом репрограмировании соматических клеток организма.
Следует констатировать, что не смотря на то, что все дети ДР прошли через стационарный этап лечения с диагнозом «ППЦНС» и получали, как правило терапию, улучшающую метаболизм в ЦНС (пирацетам, пантогам и т.п.), это также не имело значимого эффекта на становление нервно-психического развития детей с ФАС о чем свидетельствует наши данные.
Положительные результаты в абилитационном плане были получены в отношении эмоциональной, речевой сферы и общей моторики при использовании транскраниальной микрополяризации головного мозга (ТКМП) и сенсорнойной комнаты. Из целого ряда возможных терапевтических воздействий наше внимание привлек метод ТКМП, как неинвазивный, простой, малозатратный и фактически не имеющий противопоказаний. Микрополяризация может использоваться как самостоятельный лечебный метод и как оптимизирующий прием в комплексном лечении различных заболеваний ЦНС у детей и взрослых любого возраста. ТКМП силой тока 0,03-0,08 мА проводилась в виде сеансов по 15-20 мин 1 раза в неделю через 2 электрода, которые накладывались на нижние отделы затылочной области левого полушария (катод), анод сначала на границу нижнелобной области и передних отделов верхней височной области (3-6 сеансов), затем в течение 2-3 сеансов на проекции моторной коры левого полушария (патент № 2180245, ИлюхинаВ.А., Шайтор В.М., Кожушко Н.Ю. и др.).
Дети были разделены на 3 группы (см. табл. 4) по отношению к проведению процедуры ТКМП: 1-я группа ФАС+ТКМП – 13 детей (опыт); 2-я - ФАС без ТКМП - 9 детей (контроль); 3-я - неФАС + ТКМП (группа сравнения) – 10 детей. Для контроля эффективности проведенного курса ТКМП осуществлялась оценка динамики психомоторного развития детей с использованием Денвер- II теста до начала и спустя месяц после окончания терапевтического воздействия. Для контроля состояния сна заполнялся «Журнал состояния сна», данные из которого обработаны с помощью «Краткой анкеты – опросника для скрининга проблем сна у детей раннего возраста», где учтены время общего дневного сна и время ночного бодрствования.
Таблица 4. Степень выраженности задержки психомоторного развития среди обследуемых детей до и после проведения ТКМП
| Степень выраженности задержки | До проведения ТКМП | После проведения ТКМП | ||||
| 1-я гр. ФАС+ТКМП (опыт) N=13 | 2-я гр. ФАС без ТКМП (контроль) N= 9 | 3-я гр. неФАС + ТКМП (сравнение) N= 10 | 1-я гр. ФАС+ТКМП (опыт) N=13 | 2-я гр. ФАС без ТКМП (контроль) N= 9 | 3-я гр. неФАС + ТКМП (сравнение) N= 10 | |
| Выраженная задержка | 13 | 9 | 2 | 13 | 9 | 1 |
| Умеренная задержка | 0 | 0 | 7 | 0 | 0 | 4 |
| Развитие в пределах нормы | 0 | 0 | 1 | 0 | 0 | 5 |
Мы не получили эффекта от метода ТКМП в 1-й группе, что сравнимо с данными 2-й группы, где ТКМП не проводилась. Это, по-видимому, связано с развитием СЭ в результате тератогенного действия алкоголя на ЦНС и, как результат, ее низкой нейропластичностью. В свою очередь, в 3-й группе (неФАС + ТКМП) отмечается положительная динамика, как в улучшении психофизического развития, так и в навыках ухода за собой. Особенно это заметно в развитии речевых навыков, когда ребенок в течение месяца наблюдения осваивал и расширял словарный запас. Это согласуется с литературными данными где, по экспертной оценке, получены аналогичные результаты ТКМП у детей с гипоксико-ишемической энцефалопатией (В.А. Илюхина, В.М. Шайтор и др., 2001), которая чаще всего, не носит системного характера и сохраняет нейропластичность, что способствует в дальнейшем функциональному восстановлению ЦНС. При СЭ такие механизмы отсутствуют.
Также после процедуры ТКМП мы решили провести оценку продолжительности и качества сна у детей с ФАС (см. табл. 5). При проведении исследования дети находились в рамках распорядка дня Дома ребенка, где предусмотрен один дневной (с 14.00 до 16.00) и ночной сон (с 22.00 до 8.00).
По данным «Журнала состояния сна» дневной сон в 3 группе (неФАС + ТКМП) до проведения процедуры ТКМП составил в среднем 1 час 21 мин., при максимальной возможности согласно режиму – 2 часа. В 1-й группе (ФАС+ТКМП) и 2-й (ФАС без ТКМП) дневной сон составил в среднем значении 21 мин. и 22,8 мин. соответственно. После проведения процедуры ТКМП можно отметить достоверное увеличение времени дневного сна в опытной группе до 64 мин. Этот эффект сохранялся в течение месяца последующего наблюдения. Время ночного бодрствования в 1-й группе статистически достоверно уменьшилось, как и в других группах, но с меньшей достоверностью.
| Таблица 5. Влияние ТКМП на показатели суточного цикла «сон-бодрствование» у обследуемых детей | ||||||
| Показатели цикла сон-бодрствование | До проведения ТКМП | После проведения ТКМП | ||||
| 1-я гр. ФАС+ТКМП (опыт) N=13 | 2-я гр. ФАС без ТКМП (контроль) N= 9 | 3-я гр. неФАС + ТКМП (сравнение) N= 10 | 1-я гр. ФАС+ТКМП (опыт) N=13 | 2-я гр. ФАС без ТКМП (контроль) N= 9 | 3-я гр. неФАС + ТКМП (сравнение) N= 10 | |
| Среднее время общего дневного сна (часы, max= 2,0) | 0,35± 0,23 * | 0,38± 0,29*** | 1,35± 0,6*** | 1,05± 0,19* | 0,33±0,36*** | 1,39± 0,42** |
| Время ночного бодрствования (часы, min=0,0) | 1,18±0,69* | 1,78± 0,84*** | 0, 52± 0, 47** | 0,35± 0,33* | 2,07± 0,41*** | 0,64± 0,64** |
| * P< 0,005 ** P< 0,01 *** P> 0,01 | ||||||
Таким образом, проведение процедура ТКМП по стандартной методике у детей-сирот в ДР, как при наличии у них ФАС, так и в группе контроля, имеет положительные результаты и может быть применена в общем комплексе терапевтических воздействий. Применение метода ТКМП у детей без признаков внутриутробного воздействия алкоголя позволяет улучшить показатели динамики их психофизического развития, а у детей с ФАС - синхронизирующий эффект на механизмы нейроэндокринной регуляции циркадной активности мозга, что приводит к нормализации измененного цикла «сон-бодрствование».
Нарушения зрения или слуха, а также воспитание в условиях искусственно обедненной среды (отсутствие новых и разнообразных зрительных и слуховых стимулов в сочетании с дефицитом общения со взрослыми) отрицательно сказываются на психическом развитии ребенка. С целью коррекции нервно-психического развития (тонкой моторики, общей моторики, речевого развития и т.п.) проводились занятия в «сенсорной комнате». Нами отмечена хорошая реакция пациентов на комплекс процедур и положительные сдвиги в становлении общей моторики и речи.
Педагогическая абилитация таких детей играет решающую роль в их психофизическом развитии, личностном становлении и в обеспечении жизнедеятельности в целом, хотя это относится к более старшим возрастным группам.
Если отклонения со стороны ЦНС корригируются только в абилитационном плане, то имеется ряд состояний, ассоциированных с ФАС (пороки сердца, органов зрения, слуха, почек и т.д.), которые подлежат реабилитационным воздействиям по рекомендациям профильных специалистов. Среди наблюдаемых нами детей оперативное лечение было проведено в 13 случаях (по поводу спинномозговой грыжи, врожденных пороков сердца, дизэмбриогенеза почек).
Таким образом, приходится констатировать тот факт, что в настоящее время наилучшим эффектом обладают мероприятия по профилактике развития ФАС, не требующие больших материальных затрат.
Важным является и вопрос комиссионной оценки состояния здоровья ребенка и информирование родителей при усыновлении подобных детей.
ФАС и чФАС до настоящего времени для многих остаются непознанными болезнями, хотя жизнь, общество интуитивно формирует медикосоциальный заказ и изучение этой патологии. Как показали исследования вопроса патогенеза, диагностики и коррекции исключительно трудоемки. Однако вознаграждение от знакомства с этой проблемой медицинской общественности и населения (особенно женщин) может быть 100% профилактика – воздержание от приема алкоголя!
ВЫВОДЫ
- Использование программы комплексного обследования детей раннего возраста с включением критериев IOM (Институт медицины США, 2005) позволило выявить распространенность ФАС среди детей УИТ 139 на 1000 и в общей популяции – 18-19 на 1000 (дети ДДУ).
- Применение дополнительных оценочных тестов психофизического развития, характеристик сенсорного аппарата, а также определение повышенной концентрации TGF-1 расширяет возможности диагностики фетального алкогольного синдрома.
- Дети, подвергшиеся влиянию алкоголя по сумме анамнестических, клинических и лабораторных данных могут быть определены как отдельные клинические формы: ФАС – дефицит массы и роста ниже 10-й процентили, наличие морфологических особенностей лица (короткие глазные щели, уплощенный фильтр верхней губы, узкая верхняя губа) и отклонений со стороны ЦНС (наличие структурных, неврологических и функциональных отклонений); чФАС – наличие неполного вышеперечисленного комплекса диагностических критериев с подтверждением алкоголизации матери.
- Повышение концентрации TGF-1 у женщин (медиана – 71,7нг/мл), регулярно принимавших алкоголь во время беременности, и подобная тенденция в эксперименте у алкоголизированных беременных крыс (медиана – 187,9 нг/мл) позволяют высказаться о имеющемся блоке рецепторов к фактору роста, связанном с действием этанола. Это объясняет наличие клинических проявлений, свойственных новорожденным с ФАС: задержку внутриутробного развития, дисморфизм развития черепа, необратимые изменения со стороны ЦНС.
- Доказано тератогенное действие алкоголя в эксперименте, выражающееся в разряжении нервных клеток (в опытной группе – 88%, в контрольной – 43%), их дистрофических изменениях в виде пикнотических нарушений и хроматолиза в коре, гипоталамусе и мозжечке, а также субтотальное снижение (иногда полное отсутствие) нейрокринных гранул. Балочное строение печени очагово нарушено; имеет место умеренный склероз стромы портальных трактов без воспалительной клеточной реакции; выраженный перидуктальный фиброз. В почках – нарушение дифференцировки тканей по клубочковому типу.
- Проведенные исследования позволяют считать изменения в организме больных эпигенетического характера, а изменение концентраций факторов роста одним из ведущих механизмов таких клинических проявлений патологии как общая задержка нервно-психического развития (социальная адаптация, тонкая моторика, общая моторика, речь) у 90,5% детей с ФАС.
- Полученные результаты позволили схематизировать развитие патологического процесса (ФАС) и представить в виде концепции. Многокомпонентность звеньев патогенеза, во многом распределенных по времени (преконцептуальный, внутриутробный, неонатальный и постнатальный периоды), определяет терапевтическую рефрактерность имеющихся отклонений и заставляют формировать комплексную стратегию абилитации и коррекции тератогенных эффектов алкоголя.
- Обоснована необходимость создания регистра пациентов с ФАС, что позволит врачам-педиатрам, неврологам и др. специалистам дифференцировать диспансерное наблюдение и расширить схемы абилитации и реабилитации, включая процессы педагогического воздействия.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Наличие высокой распространенности последствий (в ДР 139 на 1000, в ДДУ – 18-19 на 1000) внутриутробного воздействия алкоголя на плод, как среди детей - воспитанников ДР, так и в общей популяции, диктует необходимость использования скрининга в ранней диагностике ФАС, чФАС с использованием дополненной и модифицированной тест-системы IOM (США) для дифференцированного лечении, реабилитации со стороны медицинских работников и индивидуального психолого-педагогического подхода к этой группе детей со стороны дефектологов, педагогов, логопедов и психологов.
- Учитывая возможность полнообьемной профилактики таких состояний, как ФАС, необходимо расширение информированности женщин-матерей о пагубном воздействии алкоголя и других тератогенных веществ на плод. С этой целью необходимо использовать трибуны школы будущих родителей, центры планирования семьи, кабинеты здорового ребенка детских поликлиник, печать и тиражирование санитарно-просветительских изданий.
- Включить в программы обучения врачей ФПК и ПП разделы, сопряженные с диагностикой ФАСН и подходами к абилитационно-реабилитационным мероприятиям.
- Объединение усилий муниципального управления и медицинских, социальных работников, педагогов и психологов, дефектологов в информированности населения о вредном воздействии алкоголя и других наркотических веществ на будущего ребенка позволит сократить, как количество врожденных пороков, вызывающих инвалидизацию, так и помочь в социальной реабилитации людей, подвергнутых внутриутробно воздействию тератогенных веществ
Список работ, опубликованных по теме диссертации
- Антропометрические и краниофациальные знаки пренатального воздействия алкоголя на ребенка/ Малахова Ж.Л., Бубнов А.А., Ефремов А.В.// Сб. материалов Межрегиональной научно-практической конференции «Актуальные проблемы педиатрии».-Уфа, 2007 – с. 168-171.
- Фетальный алкогольный синдром (литературный обзор)/ Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Нижегородский медицинский журнал.- 2008.- № 2.- С. 94-101.
- Оценка фенотипических и психолого-педагогических характеристик детей в контексте последствий алкогольных эффектов плода./ Малахова Ж.Л., Бубнов А.А., Ефремов А.В. // Уральский медицинский журнал.- 2008.- № 5(45).- С. 67-69.
- Перспективы здоровья будущего поколения и отношение к алкоголизму родителей/ Малахова Ж.Л., Семенова Е.А., Чернядьева Т.С., Плотников Ю.В. // Сб. материалов Научно-практической конференции «Актуальные вопросы современной медицинской науки и ЗО».- Екатеринбург - 2008- с. 176.
- Фетальный алкогольный спектр нарушений/ Малахова Ж.Л., Бубнов А.А.// Вестник УГМА – 2008- вып. 16- с. 20-24.
- Диагностические подходы к выявлению синдрома фетального алкогольного спектра нарушений у детей раннего возраста/ Шилко В.И., Малахова Ж.Л., Бубнов А.А., Галимшина Г.В.// Сб. материалов VII российского конгресса «Современные технологии в педиатрии и детской хирургии».- М., 2008- с. 21-23.
7. Фетальный алкогольный спектр нарушений среди воспитанников домов ребенка/ Малахова Ж.Л., Бубнов А.А., Сергеева Л.М.// Наркология.- 2008.- № 11.- С. 53-56.
8. Алкоголь и беременность/ Малахова Ж.Л., Марчук Т., Горячкина А.// Сб. материалов 64-й научно-практической конференции с международным участием «Актуальные вопросы современной медицины и ЗО».- Екатеринбург- 2009- с. 345-350.
9. Экспериментальное подтверждение поражения центральной нервной системы при антенатальном воздействии алкоголя/ Малахова Ж.Л.// Кубанский научный медицинский вестник.- 2009.- № 3 (108).- С. 124-127.
10. Клинико-экспериментальные сопоставления при фетальном алкогольном синдроме/ Малахова Ж.Л., Бубнов А.А., Исайкин А.И., Женыспаев К.С. // Уральский медицинский журнал.- 2009.- № 7 (61).- С. 25-28.
11. Фетальный алкогольный синдром: клинико-экспериментальные сопоставления / Шилко В.И.,Малахова Ж.Л., Бубнов А.А., Базарный В.В., Клейн А.В. // Наркология.- 2009.- № 8.- С. 38-40.
12. Фетальный алкогольный спектр нарушений среди воспитанников социальных учреждений/ Малахова Ж.Л., Шукшина Л.А.// Казанский медицинский журнал.- 2009.- № 5.- С. 647-650.
13. Тератогенный эффект алкоголя/ Малахова Ж.Л., Бубнов А.А., Клейн А.В., Кирпищников А.Г// Сю. Материалов XIV межрегиональной конференции «Актуальные вопросы диагностики, лечения и реабилитации больных».- Пенза, 2009- с. 647-650.
14. Особенности цитоморфологической структуры головного мозга при фетальном алкогольном синдроме/ Малахова Ж.Л.// Сб. материалов конгресса акушеров-гинекологов Урала с международным участием «Высокотехнологичные виды медицинской помощи на службе охраны здоровья матери и ребенка».- Екатеринбург, 2009- с. 53.
15. Алкоголь – фетальное программирование социальной нестабильности/ Малахова Ж.Л., Бубнов А.А.// Сб. статей общероссийской научно-практической конференции «Современные исследования социальных проблем».- Красноярск, 2009- вып. 4- с. 24-27.
16. О фетальном алкогольном спектре нарушений среди воспитанников домов ребенка/ Шилко В.И., Малахова Ж.Л., Бубнов А.А., Сергеева Л.М.// Вестник Угма- 2009- вып. 2- с. 105-108.
17. Врожденные пороки развития мочевой системы, анализ факторов риска дизэмбриогенеза/ Зеленцова В.Л., Шилко В.И., Вараксин А.Н., Архипова М.М., Малахова Ж.Л. // Экология человека.- 2010.- № 1.- С. 38-41.
18. Роль трансформирующего фактора роста в патогенезе фетального алкогольного синдрома/ Малахова Ж.Л., Бойко В.С., Минин В.В.// Сб. материалов научно-практической конференции «Актуальные вопросы современной медицинской науки и ЗО».- Екатеринбург, 2010- с. 142-143.
19. Устройство для фотоиетрии/ Малахова Ж.Л., Бубнов А.А.// Бюллетень «Изобретения, полезные модели».- М., 2010, 12 (V ч.)- с. 1135.
20. Поражение головного мозга при фетальном алкогольном синдроме / Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Бюллетень экспериментальной биологии и медицины.- 2010.- № 7.- С. 100-104.
21. Уровень трансформирующего фактора роста (TGF-1) у беременных женщин, имеющих пристрастие к алкоголю и у детей с фетальным алкогольным синдромом/ Малахова Ж.Л.// Сб. материалов 2-й Российской научной конференции «Педиатрия из XIX в XXI век».- С-Петербург, 2010- с. 40.
22. Закономерности развития и факторы роста (TGF-1) у детей с ФАС, находящихся в учреждениях государственного воспитания/ Малахова Ж.Л.// Наркология.- М., 2010- № 11- с.48-53.
23. Диагностические подходы к выявлению фетального алкогольного синдрома (ФАС) и его отсроченных проявлений у детей раннего возраста (Методические рекомендации)/ Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Екатеринбург, 2010- 18 с.
24. Трансформирующие факторы роста (ТGF-1) и их уровни у беременных женщин, страдающих алкоголизмом и у детей с фетальным алкогольным синдромом/ Шилко В.И., Малахова Ж.Л.// Российский вестник перинатологии и педиатрии.- 2010.- № 6 (55).- С. 20-22.
25. Фетальный алкогольный синдром среди воспитанников домов ребенка/ Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Вестник ВолгГМУ- 2010- № 4 (36)- с. 108-111.
26. Особенности роста детей раннего возраста, антенатально подвергшихся воздействию алкоголя/ Малахова Ж.Л., Бубнов А.А.// Сб. материалов 66-й всероссийской научно-практической конференции «Актуальные вопросы современной медицины и ЗО».- Екатеринбург, 2011- с. 209-210.
27. Дети-сибсы от матери с установленным диагнозом хронического алкоголизма/ Малахова Ж.Л., Аршинова Т.М.// Сб. материалов 66-й всероссийской научно-практической конференции «Актуальные вопросы современной медицины и ЗО».- Екатеринбург, 2011- с. 185-187.
28. Качество жизни населения и экология/ Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Красноярск, Изд-во «Научно инновационный центр, 2011- 85 с.
29. Опыт применения транскраниальной микрополяризации головного мозга у детей раннего возраста с фетальным алкогольным синдромом/ Малахова Ж.Л., Бубнов А.А., Шукшина Л.А.// Уральский медицинский журнал- 2011- № 4 (82)- с. 118-120.
30. К патогенезу фетального алкогольного синдрома// Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Вестник уральской медицинской академичекой науки- 2011- № 3 (36)- с. 55-58.
31. О роли трансформирующего фактора роста-1 в развитии фетального алкогольного синдрома/ Шилко В.И., Малахова Ж.Л.// Клинико-лабораторный консилиум- С-Петербург, 2011- № 1 (37)- с. 46-48.
32. Фетальный алкогольный синдром: клинико-патогенетическая характеристика последствий у детей раннего возраста/ Шилко В.И., Малахова Ж.Л., Бубнов А.А.// Екатеринбург- 2011- 169 с.
Список сокращений
ВПР – врожденный порок развития
ДДУ – детские дошкольные учреждения
ДР – дом ребенка
ЗВУР – задержка внутриутробного развития
МГВ – масса меньше гестационного возраста
НМТ – низкая масса тела
НСГ - нейросонография
ОГ – окружность головы
ППЦНС – перинатальное поражение ЦНС
ПЦР - метод полимеразной цепной реакции
СГВ – масса соответствующая гестационному возрасту
СОУ – средние образовательные учреждения
СЭ – статическая энцефалопатия
ТКМП – транскраниальная микрополяризация
УИТ – учреждения интернатного типа
УПП – уровень постоянного потенциала головного мозга
ФАС – фетальный алкогольный синдром
чФАС – частичный фетальный алкогольный синдром
ФАСН – фетальный алкогольный спектр нарушений
ФР – фактор роста
ЦНС – центральная нервная система
TGF-1 – трансформирующий фактор роста 1

