Клинические фенотипы атопической бронхиальной астмы и дифференцированная тактика диагностики и лечения
На правах рукописи
Ненашева
Наталья Михайловна
КЛИНИЧЕСКИЕ ФЕНОТИПЫ АТОПИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ И ДИФФЕРЕНЦИРОВАННАЯ ТАКТИКА ДИАГНОСТИКИ И ЛЕЧЕНИЯ
14.00.36. — Ааллергология и иммунология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва-2008г.
Работа выполнена в ГОУ ДПО Российская медицинская академия последипломного образования
Научный консультант:
Доктор медицинских наук, профессор, академик РАМН Кашкин Кирилл Павлович
Официальные оппоненты:
доктор медицинских наук, профессор Ильина Наталья Ивановна
доктор медицинских наук, профессор Резников Юрий Петрович
доктор медицинских наук, профессор Ревякина Вера Афанасьевна
Ведущая организация: ГОУ ВПО «Российский государственный медицинский университет» Росздрава
ФГУН Казанский научно-исследовательский институт эпидемиологии и микробиологии
Защита состоится « 18 » марта ____________2009 г. в 10 _____________ часов на
зЗаседании диссертационного совета Д. 208.071.04
При ГОУ ДПО «Российская медицинская академия последипломного образования» по адресу 123995, г. Москва, Баррикадная ул., д. 2/1
С диссертацией можно ознакомиться в библиотеке ГОУ ДПО «Российская медицинская академия последипломного образования»
(125445, г. Москва, ул. Беломорская, д.19).
Автореферат разослан « »_______________________2009 года
Ученый секретарь диссертационного совета,
доктор медицинских наук В.Т.Морозова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Бронхиальная астма (БА) относится к одному из самых распространенных заболеваний человека во всех возрастных группах. По экспертной оценке академика А.Г. Чучалина в России БА страдают около 7 млн человек. Доля Частота атопической БА у взрослых колеблется от 40% до 80% в общей структуре заболевания и зависит от условий проведения исследования. И, хотя ассоциация между астмой и атопией установлена и хорошо известна, однако точные связи между этими двумя состояниями не ясны и полностью не определены (GINA, 2006). Следует отметить малочисленность отечественных работ, посвященных атопической БА у взрослых, ее доле в общей структуре БА, возрастной и гендерной структуре, особенностям течения и контроля, спектру сенсибилизации и сочетанной патологии.
На сегодняшний день В настоящее время в значительной степени изучены особенности течения БА у детей различного возраста, а также у взрослых и менее изучены особенности подростковой БА. Многие лечебно-консультативные центры России сталкиваются с проблемой медицинского освидетельствования подростков и призывников с целью верификации диагноза БА, что обусловлено развитием клинической ремиссии БА у 80% пациентов в возрасте между 10 и 20 годами и отсутствием алгоритма верификации диагноза БА у подростков.
БА – заболевание, имеющее генетическую предрасположен-ность. В дополнение к генам, которые предрасполагают к развитию БА, существуют гены, которые ассоциированы с определенным ответом на противоастматическую терапию. Примером является ген 2-адренергического рецептора - ADRB2. На сегодняшний день неизвестны особенности течения и терапии БА у больных, являющихся гомозиготами по аргинину в 16-ой позиции 2-адренергического рецептора, по сравнению с пациентами, не имеющими данной аминокислотной последовательности в 16-ой позиции рецептора.
Современные представления о БА, как о системном заболевании, диктуют необходимость системного подхода к лечению, наглядным образцом которого является аллергенспецифическая иммунотерапия (АСИТ). В этой связи актуальной является оценка эффективности и безопасности локальных методов АСИТ у взрослых больных атопической БА.
Основной концепцией GINA2006 и целью лечения больных БА является достижение и поддержание оптимального контроля БА. Достижение полного контроля БА возможно при условии контроля воспаления, лежащего в ее основе Несмотря на прогресс, достигнутый в терапии БА за последние десятилетия, у большинства пациентов с БА заболевание на сегодняшний день адекватно не контролируется. Выяснение причин неконтролируемой атопической БА, определение критериев адекватной фармакотерапии, ее схем и методов, разработка комплексной оценки контроля атопической БА, включающей клинико-функциональные параметры и маркеры аллергического воспаления в нижних дыхательных путях, являются актуальными задачами, решение которых позволит оптимизировать управление болезньюконтроль БА и улучшить качество жизни больных.
Таким образом, изучение клинических и патогенетических характеристик атопической БА у подростков и взрослых представляет значительный научный и практический интерес с точки зрения разработки дифференцированных диагностических подходов к верификации различных фенотипов этой формы заболевания, а также определения оптимальных терапевтических режимов.
Цель исследования. Установить клинические и прогностические особенности формирования и течения атопической бронхиальной астмы у подростков и взрослых для разработки эффективных диагностических и дифференцированных терапевтических мероприятий.
Задачи исследования:
- Представить возрастную и гендерную структуру, а также клинико-функциональную характеристику атопической бронхиальной астмы взрослых.
- Охарактеризовать клинические фенотипы ранней и поздней атопической БА, с точки зрения прогноза течения заболевания.
- Определить диагностические особенности и представить клинико-функциональную характеристику атопической БА у подростков в возрасте от 16 до 18 лет и разработать методы выявления специфической бронхиальной реактивности при длительной стойкой ремиссии атопической БА.
- Разработать алгоритм верификации диагноза БА для медицинского освидетельствования подростков и призывников.
- Разработать алгоритм верификации диагноза БА для военно-медицинской экспертизы.
- Изучить возрастные особенности содержания общего IgE и аллерген-специфической кожной реактивности у больных атопической БА разной степени тяжести.
- Исследовать особенности течения и терапии БА у лиц с В16 Arg/Arg типом 2-адренорецептора.
- Оценить эффективность и безопасность различных режимов фармакотерапии в достижении контроля атопической БА.
- Изучить эффективность и безопасность сублингвальной и интраназальной АСИТ у пациентов с аллергическим риноконъюнктивитом, страдающих легкой интермиттирующей атопической астмой в сравнении с пациентами, не имеющими астматических проявлений.
- Разработать комплексную оценку эффективного контроля атопической БА, включающую клинико-функциональные параметры и маркеры воспаления.
Научная новизна. В результате выполнения данной работы Пполучены новые теоретические знания, касающиеся клинических фенотипов атопической БА у взрослых. Впервые выделены и охарактеризованы клинические фенотипы атопической БА с ранним и поздним дебютом. Определена вероятность формирования более тяжелой формы БА с частыми обострениями у больных с поздним началом болезни.
Впервые показано, что в настоящее время приоритетным пыльцевым аллергеном у взрослых больных атопической БА – жителей Москвы, является пыльца деревьев.
Дана полная клинико-функциональная характеристика атопической БА у подростков мужского пола. Клинический фенотип атопической БА подростков мужского пола характеризуется легким интермиттирующим течением и нормальными функциональными показателями у большинства больных. Показано, что пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет.
Впервые разработан специфический бронхопровокационный тест (БПТ) двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для верификации пациентов с интермиттирующей атопической БА в фазе стойкой ремиссии.
Показано, что исследование индуцированной мокроты у больных интермиттирующей БА может служить дополнительным диагностическим методом, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном. Доказано существование суб-клинического воспаления в нижних дыхательных путях у пациентов с атопической БА в фазе стойкой ремиссии, проявляющееся повышенным содержанием эозинофилов и эозинофильного катионного протеина (ЕСР) в индуцированной мокроте.
Приоритетными являются результаты, обнаруживающие нали-чие В16-Arg/Arg типа 2-адренорецептора у 19% больных БА – жителей Московского региона России. Доказано, что наличие этого типа 2-адренорецептора не влияет на естественное развитие БА, но паци-енты с этим типом рецептора проявляют более выраженный бронходилатационный ответ на воздействие антихолинергического препарата, по сравнению с короткодействующим 2-агонистом. Одновременно была доказана одинаковая эффективность комбинированных препаратов ингаляционных кортикостероидов и длительнодействующих 2-агонистов (ИГКС+ДД2А) у пациентов с положительным В16-Arg/Arg и отрицательным В16-Arg/Arg типами 2-адренорецептора.
Показана одинаковая эффективность и безопасность комбинированных препаратов ИГКС+ ДД2А, применяемых двумя различными режимами (стабильного дозирования и SMART) у больных среднетяжелой и тяжелой атопической БА, в отношении достижения клинико-функционального контроля болезни и улучшения качества жизни.
Показана эффективность и безопасность локальных (сублингвального и интраназального) методов АСИТ у больных легкой атопической БА.
Впервые показана эффективность комплексной оценки контроля атопической БА, сочетающей клинико-функциональные параметры и маркеры аллергического воспаления. Доказана высокая информативность АСТ-теста, коррелирующего с функциональными показателями, степенью бронхиальной гиперреактивности (БГР) и уровнем оксида азота в выдыхаемом воздухе (NOex).
Впервые определена высокая специфичность и чувствитель-ность, в зависимости от этиологической формы БА, применяемого нами метода измерения NOex с помощью портативного прибора NIOX MINO, в зависимости от этиологической формы БА. NO в выдыхаемом воздухе является важным и высокочувствительным маркером маркером для БА, высокочувствительным для больныхлиц с атопической формой БАболезни и для пациентов со смешанным вариантом БА.
Показано, что NOех является чувствительным маркером ответа на противовоспалительную терапию: снижение NOex 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Практическая значимость.
Определена пропорция атопической БА в общей структуре болезни, дана возрастная и гендерная характеристика атопической БА взрослых.
Определен спектр сенсибилизирующих аллергенов у взрослых больных атопической БА – жителей Московского региона и. вВпервые показано доминирование (среди пыльцевых аллергенов) сенсибилизации к пыльце деревьев у жителей Москвы, больных атопической БА.
Обоснована целесообразность выделения клинических фенотипов ранней и поздней атопической БА. Пациенты с поздним дебютом (после 16 лет) АБА требуют пристального внимания и раннего назначения противовоспалительной базисной терапии ИГКС или ИГКС+ДД2А.
Доказана высокая чувствительность и разработаны показания к проведению специфического БПТ двукратными разведениями аллергена.
Разработан и внедрен специфический БПТ двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов в фазе стойкой ремиссии атопической БА.
Доказана диагностическая значимость определения индуци-рованной мокроты у больных интермиттирующей БА, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном.
Доказана одинаковая эффективность и безопасность комбинированных препаратов ИГКС+ ДД2А, применяемых двумя различными режимами (стабильного дозирования и SMART) у больных среднетяжелой и тяжелой атопической БА, в отношении достижения клинико-функционального контроля болезни и улучшения качества жизни.
Обоснована эффективность и безопасность локальных (сублингвального и интраназального) методов АСИТ у больных легкой атопической БА.
Обоснована необходимость комплексной оценки контроля атопической БА, включающей оценку интенсивности воспаления неинвазивными методами. Наряду с клиническими и функциональными параметрами, целесообразно оценивать интенсивность подлежащего воспаления с помощью неинвазивных методов, в частности измерения NO в выдыхаемом воздухе.
Доказана целесообразность примененияиспользования АСТ-теста на всех уровнях медицинской помощи больным БА, и прежде всего, врачами-терапевтами, что будет способствовать для оптимизации терапии и достиженияю более высокого контроля болезни.
Обоснована целесообразность проведения генетического типирования 2-адренорецепторов у больных БА. Пациентам с В16-Arg/Arg типом 2-адренорецептора показано применение антихолинергического или комплексного (антихолинергический+короткодей-ствующий 2-агонист) препарата, в качестве средства для купирования приступов удушья.
Доказана полезность мониторинга уровня NOex у больных атопической БА для определения эффективности проводимой противоастматической терапии. Снижение NOex 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Основные положения, выносимые на защиту.
- Атопическая БА доминирует в общей структуре заболевания у взрослых, характеризуясь преобладанием полисенсибилизации и легкой формы у 2/3 пациентов. Большинство больных атопической БА заболевают в детском и юношеском возрасте. Клинические фенотипы атопической БА с ранним (до 16 лет включительно) и поздним дебютом БА различаются по полу, частоте отягощенной наследственности, вероятности формирования более тяжелой формы бронхиальной астмы с частыми обострениями.
- Клинический фенотип атопической БА подростков мужского пола характеризуется легким интермиттирующим течением и сочетанием с аллергическим ринитом у большинства больных; нормальными функциональными показателями и наличием полисенсибилизации к различным ингаляционным аллергенам. Большинство подростков имеют высокую или среднюю степень бронхиальной гиперреактивности, несмотря на ремиссию и легкую форму болезни. Пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет.
- Разработанный специфический бронхопровокационный тест двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов в фазе стойкой ремиссии атопической БА и отрицательными прямыми БПТ, является безопасным и обладает аллергенспецифической чувствительностью.
- Распространенность В16 Arg/Arg типа 2-адренорецептора составляет 19% у больных БА – жителей Москвы и Московской области. Наличие В16-Arg/Arg типа 2-адренорецептора не влияет на естественное развитие БА, но определяет выраженность бронходилатационного ответа на короткодействующие 2-агонисты.
- У большинства пациентов со среднетяжелой и тяжелой неконтролируемой атопической БА возможно достижение клинико-функциональной ремиссии астмы в результате применения фармакотерапии комбинированными препаратами (ИГКС+ДД2А) с использованием разных лечебных режимов.
- Сублингвальная АСИТ аллергеном клещей домашней пыли и интраназальная АСИТ аллергоидом и водно-солевым аллергеном домашней пыли, являются эффективными и безопасными методами лечения аллергических риноконъюнктивитов и легкой формы атопической БА, обусловленных сенсибилизацией к бытовым аллергенам, позволяющими проводить лечение в домашних условиях.
- Комплексная оценка контроля БА, включающая не только клинико-функциональные параметры, но и маркеры аллергического воспаления, позволяет проводить объективный мониторинг состояния БА и эффективности противоастматической терапии. NO в выдыхаемом воздухе является важным маркером для БА, высокочувствительным для лиц с атопической формой болезни и для пациентов со смешанным вариантом БА. Снижение NOex 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА.
Внедрение в практику. Результаты исследований внедрены в практику работы аллергологического отделения ГКБ №52 и поликлинического консультативного аллергологического центра на базе ГКБ №52 г. Москвы, а также включены в материалы лекций, практических и семинарских занятий на кафедре клинической аллергологии РМАПО. По результатам исследований написаны методические рекомендации и учебные пособия для врачей.
Апробация диссертации. Основные результаты работы доложены и обсуждены на совместном заседании кафедр клинической аллергологии и иммунологии ГОУ ДПО РМАПО (ноябрь, 2008 г.), а также на 16-ом Национальном Конгрессе по болезням органов дыхания (г. Санкт-Петербург, ноябрь 2006 г.), на 2-м Международном Конгрессе «Иммунитет и болезни: От теории к терапии» (г. Москва, 2007 г.) на 17-ом Национальном Конгрессе по болезням органов дыхания (г. Казань, октябрь 2007 г.), на XII Конгрессе педиатров России (г. Москва, февраль 2008 г.).
Публикации по теме диссертации включают 52 наименования, из них 15 статей в рецензируемых журналах, 2 учебных пособия для врачей, методические рекомендации, глава в монографии под редакцией академика А.Г.Чучалина «Бронхиальная астма. Клинические рекомендации», глава в монографии под редакцией проф. А.Н.Цой «Бронхиальная астма. Новые решения».
Объем и структура диссертации. Диссертационная работа изложена на 325 страницах машинописного текста, содержит 42 таблицы, иллюстрирована 47 рисунками и состоит из введения, обзора литературы, материалов и методов исследования, результатов исследования (главы 3-6), обсуждения, выводов, практических рекомендаций, списка литературы и приложения. Библиографический указатель содержит 539 источников литературы, из которых 84 – в отечественной и 455 – в зарубежной печати.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для настоящей работы явились: результаты обследования 1154 пациентов в возрасте от 16 до 82 лет с диагнозом БА (1089 из них были с атопической БА различной степени тяжести), а также результаты ретроспективного анализа 515 амбулаторных карт пациентов, наблюдающихся в консультативной поликлинике ГКБ №52 с диагнозом БА.
Исследование проводилось на кафедре клинической аллергологии РМАПО, в аллергологическом отделении и консультативной поликлинике ГКБ №52.
Методы исследования
1. Общеклиническое обследование включало оценку физикального статуса пациента, проведение стандартных лабораторно-инструментальных методов обследования. (клинический и биохимический анализы крови, клинический анализ мочи, рентгенографию грудной клетки, ЭКГ).
2. Специфическое аллергологическое обследование включало: сбор аллергологического анамнеза; постановку кожных проб; проведение провокационных (назальных и бронхиальных) тестов с аллергенами, в том числе определение порога специфической тканевой чувствительности. Анализ анамнеза проводили методом анкетирования, с помощью специально разработанной анкеты. Кожное аллергометрическое титрование проводили с помощью прик-теста, используя либо десятикратные, либо двукратные разведения аллергенов
3. Функциональные методы. Для изучения функции внешнего дыхания (ФВД) использовали спирометрию; измерялись показатели кривой «поток - объем». Исследование проводили на аппарате фирмы «Jaeger» Master Screen Lab. Процедуру проводили согласно протоколу «Стандартизация легочных функциональных тестов» Европейского респираторного общества. Проба на обратимость бронхиальной обструкции, выполнялась согласно тем же стандартам и считалась положительной в случае увеличения ОФВ1 более чем на 15%. Для оценки неспецифической бронхиальной гиперреактивности (БГР) проводился тест с метахолином (Acetyl--methycholine chloride, SIGMA). Применяли дозовый метод с помощью компрессорного небулайзера фирмы «Пари». Для определения степени БГР использовалась провокационная концентрация метахолина, которая вызвала падение ОФВ1 на 20% (ПК20 ОФВ1). ПК20 метахолина равная 0,03-0,124мг/мл выявляет тяжелую степень БГР, 0,125 – 1,99мг/мл – среднюю степень БГР, а 2,00 – 7,99мг/мл – легкую степень БГР. ПК20 >8,00мг/мл – норма. БПТ с физической нагрузкой проводился с помощью беговой дорожки. Пациент подвергался физической нагрузки в течение 6 минут. Измерение ОФВ1 производилось через 1, 5, 10, 15, 20, 30 минут после нагрузки. Тест считался положительны при падении ОФВ1 на 15%.
4. Бронхопровокационные тесты с аллергенами. После необходимых приготовлений (обязательно наличие адреналина, парентеральных кортикостероидов, ингалятора с короткодействующим 2-агонистом) приступали к процедуре теста. Специфические БПТбронхопровокационные тесты с десятикратными разведениями аллергенов проводились пациентам с использованием методики предложенной Адо А.Д., 1976г.: производилась последовательная ингаляция раствора аллергена в концентрациях 10, 100, 1000 PNU/мл (1:1000, 1:100, 1:10). Ингаляции проводились с помощью компрессорного небулайзера, методом непрерывного дыхания, в течение 2-х минут. Через 5, 10, 20, 30, 40, 60 минут после окончания ингаляции фиксировали состояние больного и проводили спирометрию. Диагностически значимым считалось появление жалоб на дыхательный дискомфорт, сухих свистящих хрипов над поверхностью легких, снижение ОФВ1 на 15% и более от исходного, в течение 60 мин после провокации.
БПТБронхопровокационный тест двукратными разведениями аллергена проводился по методике, описанной Cockcroft D. W. и коллегами, 1987г. Использовали стандартизованные водно-солевые экстракты аллергенов в двойных разведениях от 1:4096(2,44 PNU) до 1:2(5000 PNU). Предполагаемую дозу аллергена, при которой следует ожидать 20% снижение ОФВ1, определяли с помощью логарифмической формулы, предложенной Cockcroft D. W. и коллегами:
Log ПК20 аллергена = 0,41 Log ПК20 метахолина+0,50 Log конечной точки кожного теста- 0,42 (1)
Конечная точка кожного теста определялась с помощью кожного аллергометрического титрования. Она представляла собой концентрацию аллергена, продуцирующую папулу диаметром 2мм или на 2мм больше отрицательного тест-контроля. Использовался метод непрерывного вдыхания аллергена в течение 2-х минут, с интервалами между ингаляциями последовательных концентраций 10 минут Для обеспечения безопасности теста, использовалась начальная концентрация аллергена - на 2 разведения ниже предполагаемой. Применяли метод непрерывного дыхания. Исследование продолжали до развития ранней астматической реакции или, при отсутствии таковой, пока не достигалась максимальная концентрация аллергена (на 4 дозы выше предсказанной). Развитие ранней астматической реакции соответствует падению ОФВ1 15 % в течение первого часа после ингаляции аллергена, а поздней - падением ОФВ1 10% между третьим и седьмым часом после последней ингаляции. Наблюдение за пациентом осуществлялось в течение суток для оценки поздней астматической реакции.
Стандартной методики для проведения провокационного теста с низкой дозой аллергена не существует. Низкая (субклиническая) доза аллергена представляет собой некумулятивную дозу аллергена, вызывающую 5% снижение ОФВ1 в ходе проведения теста В нашем исследованиие низкая (субклиническая) доза аллергенаона вычислялась как среднее арифметическое дозы, вызывающей 5% снижение ОФВ1 при проведении БПТ с аллергеном по стандартной методике. Ингаляция субклинической дозы аллергена проводилась однократно с помощь компрессорного небулайзера. Оценка субклинического ответа на низкодозовую провокацию аллергеном проводилась с помощью метода индуцированной мокроты, в которой анализировались маркеры воспаления.
5. Определение оксида азота в выдыхаемом воздухе (NOex). Оксид азота в выдыхаемом воздухе определяли с помощью портативного прибора для определения NOex (NIOX MINO; Aerocrine AB, Щвеция). Данный прибор, рекомендованный к применениюиспользование Европейским респираторным и Американским торакальным обществами, функционирует на основании электрохимического сенсора. Пределы измерения NOex с помощью NIOX MINO от 5 до 300 ppb. В качестве контрольной группы нами было обследовано 7 здоровых лиц (4 мужчин и 3 женщины). Уровень NO у них составил Ме=10; 517 pрb.
6. Метод индуцированной мокроты. Индуцированную мокроту получали в соответствии с общепринятой методикой проведения данной процедуры у больных БАастматиков. В ходе индукции использовались концентрации, начиная с 3% NaCl, и последовательно увеличивающиеся до 4% и 5 % NaCl. Ингаляции проводились с использованием ультразвукового небулайзера OMRON Micro AIR с мощностью распыления от 0,25мл/мин, средним размером распыляемых частиц менее 5мкм. Исследование мокроты проводилось не позднее чем через 2 часа после ее получения. Полученный материал гомогенизировали с помощью дитиотреитола (DTT), с последующей обработкой на водяной бане и фильтрацией для получения клеточной суспензии, которую центрифугировали при 800 об/мин в течение 10 минут. ДалееЗатем готовились мазки для изучения клеточного состава мокроты. Дифференцированный подсчет клеток осуществлялся под микроскопом «вручную». Полученный супернатант сохранялся при температуре -70 °C для последующего определения ЕСР.
7. Лабораторные методы. Уровень общего IgE в сыворотке крови определяли иммуноферментным методом с помощью диагностических наборов «IgE общий–ИФА–БЕСТ», производства компании Вектор-Бест в соответствии с инструкцией производителя. Анализы производили в клинико-диагностической лаборатории ГКБ№52 г. Москвы. Нормальные показатели общего IgE в сыворотке крови у взрослых, по данным лаборатории, составляют от 15 до 140 МЕ/мл.
Определение количества эозинофилов в назальном секрете оценивали с помощью эксфолиативного цитологического анализа.. После приготовления и окрашивания мазка, подсчитывали количество клеток, определяя процент эозинофилов. Мазок содержимого полости носа на стекле высушивали при комнатной температуре и фиксировали в метиловом спирте в течение 10 минут. Препарат окрашивали водным раствором эозина К (1 г/л), затем водным раствором азура (1г/л). После окрашивания, в мазке подсчитывали количество клеток, определяя процент эозинофилов.
Определение содержания эозинофильного катионного протеина (ECP ) в назальном секрете и сыворотке крови пациентов проводили иммунохемилюминесцентным методом на приборе «UniCAP 100» (Phadia, Швеция) с применением реагентов для определения ECP в сыворотке крови и секретах, согласно инструкции производителя. Исследования проводили в лаборатории иммунологии, биохимии и микологии ФГУ НКЦ оториноларингологии Росздрава. Содержание ЕСР в сыворотке крови здоровых лиц, по данным этой лаборатории, составляет до 15 мкг/л, а ЕСР в назальном смыве здоровых лиц до 156 мкг/л. ЕСР в индуцированной мокроте определяли иммунохемилюминесцентным методом с помощью системы UniCap ECP, Pharmacia CAP System ECP FEIA, в соответствии с инструкцией производителя.
Для измерения уровня sIgA в назальном секрете использовали набор реагентов для количественного определения sIgA в биологических жидкостях человека "sIgA-ИФА" производства компании «Хема-Медика», методом твёрдофазного иммуноферментного анализа. Исследования проводили в лаборатории иммунологии, биохимии и микологии ФГУ НКЦ оториноларингологии Росздрава. Содержание sIgA в назальном секрете здоровых лиц, по данным этой лаборатории, составляет 170-2920 мг/л.
8. Выявление пациентов с В16 Arg/Arg типом 2-адренорецептора. Пациенты с В16 Arg/Arg типом 2-адренорецептора были определены в результате международного клинического исследования BI 205.342. Наличие В16 Arg/Arg типа 2-адренорецептора у больных БА являлось критерием включения в данное клиническое исследование. Генетическое исследование соскобов со слизистой оболочки щеки проводилось в международной лаборатории EPIDAUROS Biotechnologie AG, Германия.
9. Оценка клинических симптомов и качества жизни. При проведении курса фармакотерапии или АСИТ все пациенты вели дневники самоконтроля, где отмечали выраженность симптомов БА и аллергического ринита (АР). Степень выраженности симптомов оценивали по четырех бальной шкале для БА, учитывая отдельно ночные и дневные симптомы. Степень выраженности симптомов АР также учитывалась в баллах от 0 – нет симптомов до 3-х – тяжёлая степень выраженности симптомов.
Исследование качества жизни (КЖ) больных БА проводили с помощью русифицированнойых версиий вопросникаов, специально предназначенных для оценки КЖ у больных БА: «Качество жизни больных бронхиальной астмой» (AQLQ) – “Asthma Quality of life Questionnaire”, E. Juniper) и, а для оценки КЖ у больных аллергическим риноконъюнктивитом с помощью вопросникам: «Качество жизни больных аллергическим риноконъюнктивитом» (RQLQ). – “Rhinoconjunctivitis Quality of life Questionnaire”, E. Juniper).
10. Методы оценки контроля бронхиальной астмы. Оценку контроля БА проводили по динамике симптомов, оцениваемой по балльной шкале симптомов; по показателям ФВДспирометрии (ОФВ1 и ПСВ); по уровню NOexоксида азота в выдыхаемом воздухе и уровню БГР, оцениваемой в метахолиновом тесте; иа также с помощью АСТ-теста.
11. Методы статистической обработки. Данные обрабатывали с помощью компьютерной программы Statistica 6.0. В исследовании проводили анализ вариационных рядов методами описательной статистики. Качественные переменные описывали абсолютными и относительными частотами, для количественных переменных определяли среднее арифметическое (М), стандартное отклонение (), медиану (Me) и интерквартильный интервал (IQR, 25%75%). Анализ вида распределения количественных данных проводился с использованием критерия Шапиро-Уилка. Анализ различий по количественным признакам выполнялся методами множественного сравнения зависимых и независимых групп. Для проверки статистических гипотез о различиях абсолютных и относительных частот, долей и отношения шансов (ОШ) в двух независимых выборках использовался критерий 2 с поправкой Йетса. Доверительные интервалы (ДИ) строились для вероятности р=95%. В работе применялся непараметрический метод ранговой корреляции по Спирмену. Статистическая оценка зависимости признаков осуществлялась методом многофакторного дисперсионного анализа. Непараметрическое сравнение средних в связанных выборках проводилось с помощью критерия Вилкоксона и Манна-Уитни для сравнения показателей внутри групп.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Ретроспективная оценка клинических фенотипов атопической БА. Возрастные особенности содержания общего IgE в сыво-ротке крови больных атопической БА. Проведен ретроспективный анализ 515 амбулаторных карт пациентов, обращавшихся в консультативную поликлинику ГКБ№52 в период с 2003 по 2008 гг. 402 пациента (78%) имели атопическую форму БА (АБА), 103 (20%) – неатопическую БА (НАБА) и 10 (2%) – атопическую и неатопическую БА (АБА+НАБА). Мужчин было 280 человек, женщин–235. В возрастной структуре АБА преобладают лица юношеского и молодого возраста (66,4% больных) (Рис.1), тогда как среди больных НАБА - лица среднего и пожилого возраста (92,2% больных), что, по-видимому, является закономерным отражением более позднего дебюта неатопической БА. При сравнении возраста начала БА у больных АБА и НАБА в выборках, совпадающих по возрастной периодизации, оказалось, что возраст начала астмы у больных АБА (М=36,0 (13,7)) лет, статистически значимо (р<0,05) отличался от возраста начала болезни у пациентов с НАБА (М=51,6 (11,9)) лет. Большинство пациентов с АБА (62%) заболевают в детском и юношеском возрасте. Гендерная характеристика АБА отличается превалированием мужчин среди лиц молодого и юношеского возраста (82%), а среди пациентов старших возрастных групп – женщин (75%) (Рис.1). Данное явление–следствие того, что БА в детском и подростковом возрасте значительно чаще встречается у лиц мужского пола. Возрастная и гендерная структура НАБА, напротив, характеризуется доминированием женщин (77,7%), причем все они относящихтся к старшим возрастным группам.
Для пациентов с АБА характерна отягощенная наследственность по БА и/или атопии (у 44% больных). У, тогда как среди больных НАБА отягощенная наследственность была отмечена только у 15,5% пациентов.
Выявлено, что наиболееСамым распространенным причинноо значимым аллергеном у больных АБА, –жителей Московского региона, являетсяоказалась домашняя пыль, положительные пробы с которым были выявлены (у 363 (90%) больных), затем следуюет клещи домашней пыли–328 пациентов (81,6%) (Рис.2). Частота сенсибилизации к эпидермальным аллергенам составила 72,9%. На первом месте среди пыльцевых аллергенов оказалась пыльца деревьев (51,7%), затем злаковых (39,1%) и сорных трав (36,8%) (Рис.2). Однако общепризнанным фактом считалось, что в центральных регионах России наиболее распространенными являются аллергены пыльцы луговых трав, и в меньшей степени, деревьев и сорняков. Наши результаты, причем полученные на разных выборках больных (при анализе амбулаторных карт 402 больных АБА и при обследовании 716 подростков с АБА), показывают, что сенсибилизация к пыльце деревьев доминирует среди пыльцевой аллергии у взрослых больных АБА - жителей Москвы. По-видимомуВероятно, смена первенства среди пыльцевых аллергенов произошла в последние годы в результате глобального потепления климата в центральном регионе России. Значительно более раннее наступление весны, вероятно, приводит к удлинению периода пыления деревьев, что в свою очередь способствует более распространенной сенсибилизации. Моносенсибилизацию к одной группе ингаляционных аллергенов имели лишь 64 пациента (16%) с АБА, остальные имели сочетанную сенсибилизацию к нескольким группам ингаляционных аллергенов. Половина больных АБА имели полисенсибилизацию к бытовым, пыльцевым и эпидермальным аллергенам. Моносенсибилизация к одной группе ингаляционных аллергенов была отмечена лишь у 16% больных. 23,4% пациентов имели пищевую аллергию, из них 74 - перекрестную пищевую аллергию (или пищевую аллергию второго типа), что составило 26,8% от всех больных, имеющих пыльцевую аллергию.

Рис. 1 Возрастная и гендерная структура атопической БА
Для пациентов с АБА характерна отягощенная наследственность по БА и/или атопии (у 44% больных). У больных НАБА отягощенная наследственность была отмечена у 15,5% пациентов.
Выявлено, что наиболее распространенным причинно-значимым аллергеном у больных АБА, жителей Московского региона, является домашняя пыль (у 363 (90%) больных), затем следуют клещи домашней пыли–328 пациентов (81,6%) (Рис.2). На первом месте среди пыльцевых аллергенов оказалась пыльца деревьев (51,7%), затем злаковых (39,1%) и сорных трав (36,8%) (Рис.2). Однако общепризнанным фактом считалось, что в центральных регионах России наиболее распространенными являются аллергены пыльцы луговых трав, и в меньшей степени, деревьев и сорняков. Наши результаты, причем полученные на разных выборках больных (при анализе амбулаторных карт 402 больных АБА и при обследовании 716 подростков с АБА), показывают, что сенсибилизация к пыльце деревьев (березы, ольхи, орешника, дуба и др.) доминирует среди пыльцевой аллергии у взрослых больных АБА - жителей Москвы. По-видимому, смена первенства среди пыльцевых аллергенов произошла в последние годы в результате глобального потепления климата в центральном регионе России. Более раннее наступление весны, вероятно, приводит к удлинению периода пыления деревьев, что в свою очередь способствует более распространенной сенсибилизации. Моносенсибилизацию к одной группе ингаляционных аллергенов имели лишь 64 пациента (16%) с АБА, остальные имели сочетанную сенсибилизацию к нескольким группам ингаляционных аллергенов.
Лекарственная аллергия отмечалась у 22 больных АБА (к пенициллину – у 16 человек и нестероидным противовоспалительным препаратам – у 4 человек). Была отмечена высокая частота сочетания АБА с АР: у 98% больных,. пПричем у 65% больных АР предшествовал БА., Ммедиана периода времени от начала АР до дебюта БА составила у этих пациентов Ме=6,25 (2 7) года. У 28% больных АР начался одновременно с БА.
При Аанализе тяжести БА показалболезни, было определено, что у больных АБА преобладает легкая форма болезни – у 264 человек (65,67%), 126 пациентов (31,34%) имели среднетяжелую БА и лишь 12 больных (3 %) страдали тяжелой формой АБА. Данное распределение по тяжести совпадает со структурой тяжести БА в целом, что еще раз свидетельствует о доминирование атопической формы БА в общей структуре болезни. В анализируемой выборке пациентов с АБА, мы не обнаружили статистически значимой зависимости тяжести АБА от моно- и полисенсибилизации, и от спектра сенсибилизации., в частности от наличия бытовой аллергии. Среди больных с НАБА, доминировала среднетяжелая форма астмы доминировала – у 75 больных (72,82%), легкая форма встречалась у 16 пациентов (11,3%), тяжелая – у 12 (11,65%). Течение неатопической БА традиционно тяжелее атопической, что, помимо особенностей подлежащего воспаления, вероятно обусловлено возрастом больных и частотой сопутствующих заболеваний. Такие сопутствующие заболевания как гипертоническая болезнь (ГБ), ИБС, ожирение, ХОБЛ и хронический бронхит курильщика, встречались значимо (p<0,05) чаще у больных НАБА, по сравнению с больными АБА. Косвенным подтверждением различий в тяжести течения АБА и НАБА, является тот факт, что, несмотря на сравнимую длительность болезни, пациенты с АБА имеют более высокие функциональные показатели (ОФВ1 % от должного) по сравнению с больными НАБА: МАБА=84,5 %(18,3) по сравнению с МНАБА=73,6% (17,9), р<0,05. По-видимому, неатопическая БА значительно более гетерогенное заболевание, в котором участвуют вирусные и бактериальные агенты, а также сопутствующие заболевания.

Рис.2 Частота встречаемости сенсибилизации к различным ингаляционным аллергенам у больных атопической БА
Была отмечена высокая частота сочетания АБА с АР: у 98% больных, причем у 65% больных АР предшествовал БА. Медиана периода времени от начала АР до дебюта БА составила у этих пациентов Ме=6,25 (2 7) года. У 28% больных АР начался одновременно с БА.
Анализ тяжести БА показал, что у больных АБА преобладает легкая форма болезни – у 264 человек (65,67%), 126 пациентов (31,34%) имели среднетяжелую БА и лишь 12 больных (3 %) страдали тяжелой формой АБА. Данное распределение по тяжести совпадает со структурой тяжести БА в целом, что еще раз свидетельствует о доминирование атопической формы БА в общей структуре болезни. В анализируемой выборке пациентов с АБА, мы не обнаружили статистически значимой зависимости тяжести АБА от моно- и полисенсибилизации, и от спектра сенсибилизации. Среди больных с НАБА, доминировала среднетяжелая форма астмы – у 75 больных (72,82%), легкая форма встречалась у 16 пациентов (11,3%), тяжелая – у 12 (11,65%).
При анализе терапии АБА, обращает на себя внимание низкий процент больных (12,9%, 52 пациента), получавших АСИТ, и. Лишь 52 пациентам (12,9%) проводилась АСИТ, причем из них, только у 27 было проведено 3-и и более курсов АСИТ.
С целью оценки реального состояния БА у пациентов, нами был проведен опрос пациентов, случайно выбранных из 515 больных, чьи амбулаторные карты были включены в ретроспективный анализ. Опрос больных осуществлялся с помощью телефонного интервью по специально разработанной анкете, включающей 6 вопросов, касающихся течения БА за последний год, а также терапии и контроля БА. Для оценки контроля астмы использовали АСТ-тест. Получить ответы на все вопросы интервью удалось у 200 пациентов с БА в возрасте от 17 до 77 лет (средний возраст–34 ± 15,8), мужчин было 121, женщин 79 человек. Большинство пациентов (168 человек) имели АБА, 29–страдали НАБА и 3 пациента– АБА+НАБА. У 122 больных, по данным амбулаторных карт, была легкая БА, у 73 – среднетяжелая БА и у 5–тяжелая БА.
Была отмечена выраженная диссоциация в фармакотерапии между данными амбулаторной карты и результатами опроса больных. Частота использования препаратов 2-агонистов короткого действия в качестве монотерапии в 2,5 раза выше по результатам интервью, чем по данным амбулаторных карт, а частота базисной терапии ИГКС, наоборот, в 2,2 раза ниже, также как и кромонов – в 2,8 раза ниже. Комбинированные препараты (ИГКС+ДД2-агонисты), напротив, использовало в 2 раза большее число больных, чем по данным анализа амбулаторных карт. Результаты интерактивного опроса показали, что 43% больных БА имеют неконтролируемую астму, причем большинство больных (79,5%) отмечали обострения болезни в течение последнего года, по поводу которых, 10% больных лечились в стационаре, а 8% - прибегали к неотложной помощи. 74% пациентов (148 человек) обращались к врачу в течение последнего года, в связи с ухудшением БА, причем большинство обращений (40%) было к врачу-терапевту, что демонстрирует важность первичного звена медицинской помощи в отношении лечения и контроля БА. Наши данные согласуются с результатами последних международных исследований по оценке контроля БА. В частности, в исследовании REACT (Real-world Evaluation of Asthma Control and Treatment), проведенном в США, результаты АСТ-теста показали, что 45% пациентов имели контролируемую БА и 55% - неконтролируемую БА.
С целью определения уровня общего IgE в крови больных АБА различного возраста, пола, с разной степенью тяжести БА и спектром сенсибилизации, был обследован 91 пациент (58 мужчин и 33 женщины) в возрасте от 16 до 82 лет. Большинство пациентов (59,3%), независимо от возраста и пола, имели повышенный уровень общего IgE сыворотки крови. Уровень общего IgE у мужчин (Ме=189; 80409) оказался несколько выше, чем у женщин (Ме=160; 86330), однако разница статистически незначима (р=0,8656) (Рис. 3).

Рис. 3 Содержание общего IgE в крови больных атопической БА
Уровень общего IgE сыворотки крови статистически значимо коррелирует с аллергенспецифической кожной реактивностью у всех больных АБА (R=0,37, p=0,0002), независимо от пола и возраста: чем шире спектр сенсибилизации, тем выше общий IgE. Не было выявлено статистически значимой корреляции между уровнем общего IgE и ОФВ1, а также между возрастом дебюта БА и уровнем общего IgE. Уровень общего IgE у мужчин имел характерную кривую и статистически значимо положительно коррелировал с тяжестью астмы (R=0,34, p=0,01), чтоего не наблюдалось у женщин., Полученные данные,что возможно, обусловленыо возрастной разницей между мужчинами и женщинами с АБА. Была Ввыявлена статистически значимая обратная корреляция уровня общего IgE в зависимости от возраста женщин (R=-0,44, p=0,01).
На основании результатов проведенного исследования и использования статистического анализа, мы оказалось возможным выделилить клинические фенотипы АБА взрослых, в зависимости от возраста начала астмы. Нами Ббыли выделены: возраст раннего начала БА до 16 лет включительно (детство и ранний подростковый возраст) и возраст позднего дебюта БА – после 16 лет. Результаты проведенного исследования показали, что эти клинические фенотипы АБА различаются (Табл.1). Для АБА с ранним началом, более характерна отягощенная наследственность по БА (ОШ=2,15; ДИ 1,31-3,52) и атопии (ОШ=2,84; ДИ 1,74-4,65), по сравнению с больными, заболевшими после 16 лет. Вероятность заболеть АБА в возрасте до 16 лет выше у мужчин (ОШ =11,8; ДИ 7,29-19,09, р<0,05), а в возрасте после 16 лет выше у женщин (ОШ= 0,08; ДИ 0,05-0,14, р<0,05). Кроме этого, возраст начала болезни может служить в некоторой степени предикторным фактором относительно дальнейшего течения АБА. У больных АБА, заболевших после 16 летнего возраста, вероятность формирования более тяжелой формы БА выше, по сравнению с заболевшими в детстве и подростковом возрасте (ОШ 0,37; ДИ 0,24-0,56, р<0,05) (Рис. 4). Косвенным подтверждением этого является наличие статистически значимого (р<0,001) различия в средних значениях ОФВ1 (% должного) между этими группами: ОФВ1 у заболевших до 16 лет - 88,7% (17,3), а у заболевших после 16 лет – 75,8% (17,26). При этом, мы обнаружили статистически значимое (р<0,05) различие в частоте встречаемости полисенсибилизации к бытовым+пыльцевым+эпидермальным аллергенам у больных, заболевших до и после 16- летнего возраста (Р=0,57, ДИ 0,50;0,63 и Р=0,39, ДИ 0,31;0,47), что свидетельствует о том, чтот.е. лица, заболевающие астмой в детском и подростковом возрасте,раньше чаще имеют полисенсибилизацию к наиболее распространенным ингаляционным аллергенам, но при этом течение их БА значимо легче, что было продемонстрировано нами при проведении исследования реального контроля БА у 200 пациентов. Пациенты с поздним дебютом БА, имеют достоверно (р<0,05) большую частоту обострений БА за последний год (ОШ=0,51; ДИ 0,28-0,93), а также получают достоверно больший объем противовоспалительной фармакотерапии (ОШ=0,24; ДИ 0,13-0,44, р<0,05). Одновременно было статистически значимо (р<0,05) показано, что достижение контролируемой астмы по результатам АСТ-теста преобладает в группе лиц, заболевших до 16 лет (ОШ=2,83, ДИ 1,58-5,9).
Таблица 1.
Характеристика клинических фенотипов раннего
и позднего дебюта атопической БА
| Признак | АБА с ранним (до 16 лет включительно) началом | АБА с поздним (после 16 лет) началом | Статистическая значимость признака |
| Пол | Более вероятно мужской | Более вероятно женский | p<0,05 |
| Тяжесть течения БА | Более вероятно легкая | Более вероятно среднетяжелая или тяжелая | p<0,05 |
| Функция легких | Менее вероятно снижение | Более вероятно снижение | p<0,05 |
| Полисенсибилизация к ингаляционным аллергенам | Более вероятна | Менее вероятна | p<0,05 |
| Частота обострения БА | Редкие | Частые | p<0,05 |
| Достижение контроля БА | Более характерно | Менее характерно | p<0,05 |
| Частота сопутствую-щих заболеваний | Менее выражена | Более выражена | p<0,05 |
 Рис. 4 Тяжесть течения атопической БА в зависимости от клинических фенотипов с ранним и поздним дебютом
Рис. 4 Тяжесть течения атопической БА в зависимости от клинических фенотипов с ранним и поздним дебютом
Таким образом, клинический фенотип АБА с поздним дебютом, характеризуется большей вероятностью формирования более тяжелой неконтролируемой астмы, а стало быть, требует особого подхода к назначению базисной противовоспалительной терапии и мониторингу больных.
2. Клинический фенотип атопической бронхиальной астмы подростков мужского пола. Обследовано 728 подростков мужского пола с БА (средний возраст: 17,3±0,8 лет). В Кконтрольную группу (10 человек) составиливошли подростки 16-18 лет без анамнеза аллергических заболеваний, с отрицательными результатами кожных тестов с аллергенами и отсутствием нарушений бронхиальной проходимости. Всем им проводились БПТбронхопровокационные тесты с метахолином и субклинической дозой аллергена.
Выявлено, что уУ подростков мужского пола, страдающих астмой, доминирует атопическая форма болезни (у 98% больных). Клинический фенотип атопической БА подростков мужского пола характеризуется: легким интермиттирующим течением у большинства (72%) больных; нормальными показателями ФВД (у 95,5% больных); сочетанием с АР практически у всех пациентов (99%); наличием сочетанной сенсибилизации к бытовым и пыльцевым аллергенам у 42,0, а к бытовым, пыльцевым и эпидермальным у 30,6% больных; моносенсибилизаци к бытовым или пыльцевым аллергенам – у 14,4%. Аллергены пыльцы деревьев оказались на втором месте (у 70,1% больных) (после домашней пыли –(у 93,8% больных) по частоте положительных кожных тестов. 41,6% подростков с пыльцевой сенсибилизацией отметили наличие перекрестной пищевой аллергии, преимущественно к свежим фруктам и овощам. Самым частым пищевым аллергеном (исключая перекрестную пищевую аллергию) у обследованных подростков оказалась рыба - 9,8%. Большинство подростков (62,5%) с АБА имели отягощенную наследственность по БА и/или атопии.
Пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет (Рис. 5). Частота постановки диагноза АБА у мальчиков до 5 лет и после 15 лет практически совпадают. Интервал с момента появления первых симптомов болезни до постановки диагноза исчислялся 2 – 5 годами и составил в среднем 3,6 лет.

Рис. 5 Возраст постановки диагноза атопической БА у подростков
В связи с особенностями естественного течения заболевания с частыми длительными ремиссиями, возникают проблемы диагностики БА у лиц подросткового возраста, что особенно актуально для юношей. В этой связи большое значение предается бронхопровокационным тестам (БПТ), направленным на выявление БГР, как основного маркера БА, ибо выявление обратимости бронхиальной обструкции для этой категории пациентов является малоинформативным. Наши результаты показали, что тест на выявление обратимой обструкции бронхов оказался положителен лишь у 20,5% подростков с БА, что обусловлено стабильной ремиссией болезни и отсутствием функциональных нарушений у большинства пациентов. БПТ с метахолином оказался высокочувствительным (Se=90,2%) и специфичным (Sp=90%) методом для диагностики БА у подростков. Прогностическая ценность положительного результата (+PV) - 99,8%, а прогностическая ценность отрицательного результата (-PV) – 14,5%. Несмотря на ремиссию и легкую форму БА,Следует отметить, что большинство подростков (59%) имелиют высокую или среднюю степень БГР, чтонесмотря на ремиссию и легкую форму болезни. Данный факт свидетельствует о наличии персистирующего бессимптомного воспаления в нижних дыхательных путях у этих пациентов. Тест с физической нагрузкой был проведен 23 пациентам и у 11 – оказался положительным. Чувствительность провокационного теста с физической нагрузкой, выполненного у 23 подростков с БА (положительный – у 11 больных), по результатам нашего исследования, составила Se = 47,8%.
С целью изучения диагностической значимости специфического БПТ, а также различных малоинвазивных методов определения аллергического воспаления в нижних дыхательных путях, было обследовано 78 подростков и молодых людей мужского пола, страдающих легкой интермиттирующей АБА и 7 здоровых субъектов в возрасте от 16 до 23 лет, составивших контрольную группу. Все пациенты были в возрасте от 16 до 25 лет и на момент проведения исследования имели ремиссию или стойкую ремиссию легкой формы БА.
На первом этапе проводилиПосле традиционноего обследование я(общеклиническое, специфическое аллергологическое, исследование ФВД с тестом на обратимость бронхообструкции и БПТ с метахолином). на первом этапе, Нна втором этапе- проводили изучение диагностической значимости специфического БПТ с аллергеном, исследования индуцированной мокроты до и после субклинического БПТ с аллергеном, определение NOexя NO в выдыхаемом воздухе. В зависимости от результатов начального этапа обследования, пациенты были разделены на четыре группы. В первую группу вошли 13 пациентов с отрицательным БПТ с метахолином и низкой кожной специфической чувствительностью. На втором этапе им проводился БПТ с десятикратными разведениями аллергена домашней пыли. Во вторую группу вошли 18 пациентов с положительным БПТ с метахолином. Все эти пациенты имели сенсибилизацию к домашней пыли и на втором этапе исследования им проводился провокационный ингаляционный тест с аллергеном из домашней пыли по стандартной методике (Cockcroft D.W. и коллеги, 1987 г). Третью группу составиляли 31 пациент с отрицательным неспецифическим БПТ с метахолином и для них был специально разработан специфический БПТ с расчетом предполагаемой дозы аллергена на основании кожного титрования. Четвертую группу составили 16 пациентов в стадии стойкой ремиссии БА. Симптомы болезни отсутствовали у этих больных на протяжении более 2-х лет (в среднем: 4,5 ± 3,07). Все они были сенсибилизированы к бытовым, а 10-ь человек и к пыльцевым аллергенам. Пациентам из этой группы было проведено изучение в индуцированной мокроте клеточного состава и содержания ЕСР в индуцированной мокроте до и после БПТ с низкой (субклинической) дозой специфического аллергена (домашней пыли).
БПТ с десятикратными разведениями аллергена домашней пыли былоказался положительнымен у 4-х пациентов и у 9-и – отрицательнымен. Чувствительность этого теста, по результатам нашего исследования, составила Se =30,8%. Целью проведения исследования во 2-й группе являлось изучение чувствительности методики, определение корреляции между специфической кожной чувствительностью и чувствительностью бронхов, а также определение субклинической дозы аллергена для дальнейшего проведения низкодозового специфического БПТ. В результате БПТ с аллергеном домашней пыли у пациентов из 2-ой группы оказался положительным у 17-и человек, и только а уу одного пациента - отрицательным. Снижение ОФВ1 происходило в течение 15-30 мин после ингаляции клинически значимой дозы специфического аллергена, поздних астматических реакций зафиксировано не было. Чувствительность (Se) БПТ с двукратными разведениями аллергенами, выполненного по стандартной методики, составила - 94,4%. Было выявлено существование статистически значимой корреляции только между фактической ПК20 аллергена и конечной точкой кожного теста (R=0,492, p=0,045). Данный факт послужил основой для разработки специфического БПТ для пациентов с отрицательным БПТ с метахолином. Нами (совместно с Л.А.Горячкиной и М.Ч.Тотиковой) [32,44] был разработан специфический БПТ двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию, для пациентов с отрицательными неспецифическими БПТ. При аллергометрическом кожном титровании для пыльцевых аллергенов и аллергенов клеща домашней пыли использовали разведения от 1:4096(2,44 PNU) до 1:4(2500 PNU), для аллергена домашней пыли от 1:4096(2,44 PNU) до 1:2(5000 PNU). После определения конечной точки кожного теста, выбирали начальную концентрацию аллергена, отступая на 4-е двукратных разведения ниже конечной точки кожного теста и это разведение специфического аллергена являлось стартовым. Дальнейшее проведение БПТ не отличалось от стандартного метода. У 9-и пациентов БПТ со специфическим аллергеном оказался отрицателен, несмотря на положительные данные анамнеза и кожного тестирования, причем у большинства пациентов (5 человек) - с аллергеном клеща дерматофагоид. У 7-и пациентов, предполагаемая (по кожному тесту) доза аллергена, совпала с фактической дозой, вызвавшей 20% снижение ОФВ1 при БПТ. У половины больных (10 человек) фактическая доза превышала расчетную в 1-4 раза, и тольколишь у 5-и пациентов она оказалась ниже предполагаемой на 1-3 разведения. У 9-и пациентов БПТ со специфическим аллергеном был отрицательным. Чувствительность, разработанного нами теста, зависит от вида аллергена: Se аллергена клеща домашней пыли =54,55%, Se аллергена дом. пыли =66,67%, Se пыльцевых аллергенов =88,89%. Наши результаты показали, что в случае отрицательного БПТ с метахолином, для расчета предполагаемой ПК20 аллергена для специфического БПТ, возможно использовать результаты кожного титрования со специфическим аллергеном, отступая на 4-е разведения вниз, т.к. риск развития тяжелого бронхоспазма для этих пациентов составляет Р =0,32, ДИ: 0,074-0,720, р<0,05.
У 21 подростка с атопической БА было проведено определение NO в выдыхаемом воздухе: медиана (Ме) выборки составляла 17(10 31) ppb. Было отмечено существование слабой обратной корреляционной связи (R=0.26) между уровнем NOех и ПК20 метахолина у этих пациентов, что закономерно, ибот.к. известно, что NОех и БГР являются биологическими маркерами аллергического воспаления при БА. 6-и пациентам с отрицательным результатом БПТ со специфическим аллергеном и 4-м с положительным, было проведено определение NOex до и через 24 часа после БПТ. У пациентов с отрицательным БПТ с аллергеном, не наблюдалось статистически достоверных различий уровня NOех по сравнению с контрольной группой, как до БПТ (Ме=11, 717, p=0,15), так и после (Ме=12,5, 1115, p=0,15), что служит косвенным подтверждением отсутствия аллергического эозинофильного воспаления в дыхательных путях у этих пациентов. А у пациентов с положительным БПТ с аллергеном было отмечено статистически значимое изменение уровня NOex через 24 часа после БПТ (Ме до=39,5, 29 53; Ме после=58,5, 48,5 95, р=0.067). Таким образомСледовательно, изменение NOex является чувствительным маркером бронхиального ответа на специфический аллерген.
Субклиническая (низкая) доза аллергена для проведения низкодозового БПТ для пациентов в фазе стойкой ремиссии БА (4-я группа) составила 1250 PNU. Пациентам провели исследование индуцированной мокроты до и после (через 8-10 часов) низкодозового БПТ с аллергеном домашней пыли. Такая же процедура исследования была проведена подросткам, составившим контрольную группу. Было выявлено повышенное Ссодержание эозинофилов и уровень ЕСР в индуцированной мокроте больных БА были достоверно выше, по сравнению с контрольной группой здоровых (р<0,05), до проведения специфического БПТ. После БПТ, в позднюю фазу ответа у больныхних происходило достоверное увеличение (р<0,05) количествасодержания эозинофилов и ЕСР в индуцированной мокротемокроте, тогда как в контрольной группе значимых изменений не наблюдалось (Рис. 6). Достоверных изменений количества других клеток отмечено не было.
Таким образом, у пациентов с атопической БА даже в фазе стойкой ремиссии болезни отмечаются признаки субклинического аллергического воспаления в нижних дыхательных путях, проявляющегося повышенным содержанием эозинофилов и ЕСР в индуцированной мокроте, которые достоверно возрастают после низкодозовой аллергенной провокации аллергеном. Исследование индуцированной мокроты у больных интермиттирующей БА может служить дополнительным диагностическим методом, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном.


Рис 6. Изменение количества эозинофилов и уровня ЕСР в индуцированной мокроте больных БА, по сравнению со здоровыми после БПТ со специфическим аллергеном
В контрольной группе отмечено относительно более высокое содержание нейтрофилов, по сравнению с больными БА. Содержание ЕСР в индуцированной мокроте больных также было достоверно выше (р<0,05), чем в контрольной группе, при исследовании образцов до проведения БПТ. После БПТ в позднюю фазу ответа было выявлено повышение уровня ЕСР (р<0,05) в индуцированной мокроте больных, тогда как в контрольной группе никаких изменений с этим показателем не происходило (Таблица 2).
Таблица 2
Клеточный состав и уровень ЕСР в индуцированной мокроте
| Клетки | Пациенты с БА (n=16) | Контрольная группа (n=7) | ||
| До БПТ (%) | После БПТ(%) | До БПТ (%) | После БПТ (%) | |
| Нейтрофилы | 19,64 ± 4,20 | 19,90 ± 3,54 | 45,46 ± 3,79 | 43,40 ± 10,27 |
| Эозинофилы | 27,50 ± 5,19 | 34,59 ± 5,77 | 13,78 ± 5,08 | 14,52 ±6,57 |
| Моноциты | 30,03±5,58 | 24,63 ± 6,67 | 21,40 ±1,87 | 20,32 ±3,86 |
| Лимфоциты | 21,85 ± 3,25 | 23,10±5,05 | 19,36 ±5,96 | 21,76 ± 5,12 |
| ECP | 64,67± 10,56 g/l | 76,87 ± 20,63 g/l | 12,26 ±12,84 g/l | 13,88±13,91 g/l |
Нами разработан алгоритм медицинского освидетельствования подростков и призывников с БА (Рис. 76). Следуя этому алгоритму, диагноз БА может быть подтвержден на различных этапах обследования, в зависимости от полученных результатов. Комплексная поэтапная диагностика БА, включающая функциональное обследование легких с проведением БПТ, и специфическое аллергологическое обследование, позволяет верифицировать диагноз БА даже в фазе стойкой ремиссии болезни у подростков.
Оценка уровня контроля БА у подростков с помощью АСТ-теста показала, что более половины (56%) подростков, имеющих легкую форму БА, отмечают неконтролируемое ее течение, не получают адекватной фармакотерапии и, соответственно, являются группой риска развития обострения БА. Анализ результатов АСТ и объективных параметров контроля БА (ОФВ1 и степени БГР) выявил наличие статистически значимой корреляции между ОФВ1 и АСТ (R=0,28, р<0,05) и между порогом БГР (ПК20) и АСТ (R=0.24, р<0,05). Показатель АСТ-теста связан с функциональными маркерами контроля БА и, прежде всего, с ОФВ1, что важно и это очень важная связь, так как далеко не во всех медицинских учреждениях возможно проведение спирометрического исследования., а АСТ не требует никакого дополнительного оборудования.

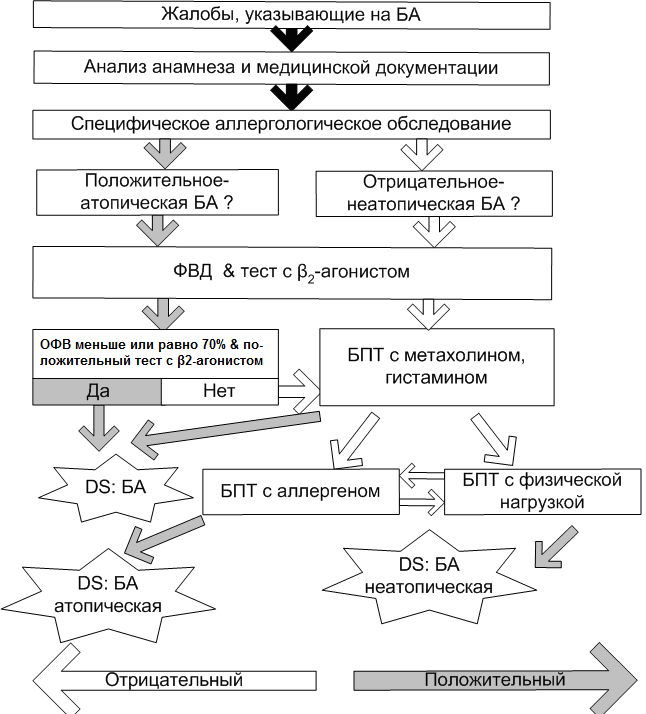
Рис. 76 Алгоритм медицинского освидетельствования подростков и
призывников с БА
3. Клинический фенотип бронхиальной астмы у больных с В16 Arg/Arg типом 2-адренорецептора. В результате скринингового обследования 100 пациентов с БА (муж. 47, жен. 53; средний возраст: 42,6±13,2) было выявлено 19 больных (19%), являющихся гомозиготами по В16-Arg/Arg 2-адренорецептора. На основании проведенного анализа и расчета ОШ, показано, что наличие В16-Arg/Arg типа 2-адренорецептора не зависит от пола, этиологической формы БА и степени тяжести болезни, наличия ринита и частоты сопутствующих заболеваний. При анализе возраста начала БА у пациентов с В16-Arg/Arg типом 2-адренорецептора (Ме=21; 730) и не имеющих такового (Ме=27; 1435) с помощью критерия Манна-Уитни не было обнаружено статистически значимого (р=0,054) различия, однако прослеживается тенденция к более раннему развитию БА у больных, имеющих В16-Arg/Arg тип 2-адренорецептора. Анализ длительности применения комбинированных препаратов (ИГКС+ДД2А) больными в группе с В16-Arg/Arg типом 2-адренорецептора и в группе больных, не имеющих этого типа рецептора (ОШ =1,87; ДИ: 0,57- 6,09) позволяет утверждать, что не существует статистически значимого различия (р<0,05) между данными группами с точки зрения эффективности применения комбинированных препаратов. Данный факт нашел косвенное подтверждение в анализе функциональных параметров. Средние значения ОФВ1, составившие в 1-й группе больных (+В16-Arg/Arg тип 2-адренорецептора) 73,3% (13,8), а во 2-й - 75,6 (13,6), статистически значимо (р=0,5229) не различались. С целью изучения воздействия различных бронхолитических препаратов на пациентов 1-й (+В16-Arg/Arg тип 2-адренорецептора) и 2-й (-В16-Arg/Arg тип 2-адренорецептора) групп, мы провели тесты на выявление обратимой обструкции бронхов с препаратом 2-агонистом (сальбутамол в дозе 400 мкг) и антихолинергическим препаратом (ипратропия бромид 80 мг) (Рис. 87).

Рис. 87 Изменение ОФВ1 у больных 1-й (+В16-Arg/Arg тип 2-адренорецептора) и 2-й (- В16-Arg/Arg тип 2-адренорецептора) групп в бронхолитическом тесте с сальбутамолом и ипратропия бромидом
У пациентов с + В16-Arg/Arg типом 2-адренорецептора бронхолитический ответ на сальбутамол (ОФВ1=11,8% (5,6%)) менее выражен, чем на ипратропия бромид (ОФВ1= 20,5% (10,4%)), р=0,0037, в отличие от пациентов 2-й группы, с отрицательным В16-Arg/Arg типом 2-адренорецептора. У последних бронхолитический ответ на короткодействующий 2-агонист (ОФВ1=16,5% (6,9%)) статистически значимо (р=0,0047) выше, по сравнению с ответом на антихолинергический препарат (ОФВ1=9,54% (5,56%)), а также по У пациентов с + В16-Arg/Arg типом 2-адренорецептора бронхолитический ответ на сальбутамол (ОФВ1=11,8% (5,6%)) менее выражен, чем на ипратропия бромид (ОФВ1= 20,5% (10,4%)), р=0,0037, в отличие от пациентов 2-й группы, с отрицательным В16-Arg/Arg типом 2-адренорецептора. У последних бронхолитический ответ на короткодействующий 2-агонист (ОФВ1=16,5% (6,9%)) сравнению с ответом на сальбутамол у больных 1-й группы (p=0,038). При исследовании БГР у этих больных в тесте с метахолином, не было выявлено статистически значимых (р=0,4414) различий в средних значениях ПК20 для 1-й (Ме=0,75; 0,54,0) и 2-й групп (Ме=1,0; 0,64,0).
4. Эффективность различных методов лечения и контроля атопической бронхиальной астмы
Эффективность и безопасность различных режимов фармакотерапии в достижении контроля атопической БА. Целью лечения больных астмой является достижение и поддержание оптимального контроля БА. В идеале полный контроль БА должен означать отсутствие не только симптомов болезни и нормальную функцию легких, но и отсутствие признаков воспаления в нижних дыхательных путях, как уже было показано в этой работе, даже при отсутствии клинических симптомов, субклиническое, персистирующее воспаление сохраняется и может приводить к БГР. ИГКС являются приоритетными препаратами среди группы противовоспалительных противоастматических средств, однако, зачастую среди пациентов с легкой БА отмечается низкая приверженность этому виду фармакотерапии. Мы исследовали возможность альтернативной базисной противовоспалительной фармакотерапии с помощью антилейкотриенового препарата монтелукаст в качестве монотерапии (10 мг один раз в сутки вечером в течение 12 недель) у 15 пациентов с легкой неконтролируемой БА. Контрольной группой являлись 5 пациентов с легкой персистирующей АБА, получавшие только короткодействующие 2-агонисты в режиме по требованию.
Оценка эффективности терапии проводилась с использованием комплекса параметров, позволяющих оценить не только клинический, но и противовоспалительный эффект проводимого лечения: динамики симптомов и потребности в скоропомощных препаратах по дневникам самонаблюдения пациентов, показателейи пикфлоуметрии и спирометрии, АСТ-теста, измерение NOех, изменение БГР в метахолиновом тесте. Безопасность терапии исследовалась путем выявления нежелательных побочных явлений с помощью опроса пациентов. В результате монотерапии монтелукастом была отмечена статистически значимая положительная динамика в дневных симптомах БА (до лечения – 10 (79), после – 0 (06), р=0,0034) и потребности в бронхолитических препаратах (до лечения 2,5 (25), после 0 (00), р=0,0483). Увеличилась утренняя ПСВ (л/мин) (до лечения 385.7 (334,3 497,1), после – 402,1 (344,3499,1), р=0,0323) и ОФВ1 (%долж.) (до лечения 88 (72100), после – 98 (84106), р=0,047). Уровень контроля астмы, оцениваемый больными с помощью АСТ-теста, также статистически значимо вырос (до лечения – 19 (1820), после – 23,5 (2125), р=0,0327). На момент включения в исследование, уровень NОex у больных в группе лечения (Me=77; 4686 ppb), а также в контрольной группе (Me=35; 2140) оказался статистически значимо выше по сравнению со значениями NОex в контрольной группе здоровых (Me=10; 517), р=0,0008 и р=0,017, соответственно. Изменения в уровне NОex после лечения монтелукастом, хотя и имели тенденцию к уменьшению, но статистически незначимую. Изменения в пороге БГР у пациентов также оказались статистически не достоверныне различимы до и после лечения монтелукастом. Каких-либо значимых изменений показателей в контрольной группе не отмечалось. Все пациенты, получавшие монтелукаст, отметили хорошую его переносимость и отсутствие каких-либо побочных эффектов.
Полученные результаты показывают, что клинический контроль БА не означает контроль воспаления дыхательных путей. ИзучаемыеТакие маркеры воспаления, как (NOex и БГР), свидетельствуют об отсутствии контроля воспаления у данных пациентов. Применение антилейкотриенового препарата, в качестве монотерапии в течение 12 недель, у больных легкой персистирующей неконтролируемой АБА, является эффективным для достижения клинико-функционального контроля, но недостаточно эффективным для достижения контроля воспаления.
У 44 больных со среднетяжелой и тяжелой АБА проводилось сравнительное исследование клинической эффективности и безопасности комбинированных препаратов (ИГКС+ДД2А), применяемых с помощью различных терапевтических режимов. 18 пациентов получали терапию сальметерол/флутиказона пропионат (САЛ/ФП) в виде стабильной дозы (50/500 мкг дважды в день в течение 12 недель) с использованием сальбутамола в качестве скоропомощного препарата. 26 больных получали формотерол/будесонид (ФОР/БУД) (в дозе 9/320 дважды в день в течение 12 недель) в режиме SMART (Symbicort Maintenance and Reliever Therapy), который подразумевает использование одного ингалятора, как в качестве средства базисной терапии, так и для купирования приступов затрудненного дыхания. Группы больных имели сходные характеристики в отношении возраста, пола, тяжести БА и сопутствующих заболеваний. Эффективность проводимого лечения у этих больных оценивалась по тем же самым клинико-функциональным параметрам и маркерам воспаления, что и у больных, получавших монтелукаст. На время вводного периода (1 неделя) все пациенты были переведены на монотерапию ИГКС (беклометазона дипропионат 500 мкг дважды в день + сальбутамол «по требованию»). В результате лечения, в группе больных, получавших ФОР/БУД в режиме SMART, была отмечена статистически значимая положительная динамика в дневных (вводный период – 7 (3-11), последняя неделя лечения – 4 (0-8), р=0,044) и ночных симптомах (1 (0-4) и 0 (0-0), соответственно, р=0,032) астмы, в снижении потребности в дополнительных ингаляциях ФОР/БУД (вводный период – 8 (2-12), последняя неделя лечения – 1(0-8), р=0,033) в функциональных показателях (ОФВ1 ввод. период – 746,5 (58,0-89,066,0), последняя неделя лечения – 83 (70-89), р=0,012). Произошло статистически значимое снижение NOex (34 (21-66) и 21 (11-32), р=0,004), однако не было отмечено статистически значимого изменения неспецифической БГР, измеренной у 10 больных из этой группы. В результате лечения, количество больных с хорошо контролируемой астмой увеличилось на 16 больных (на 633%) по результатам АСТ-теста. Статистически значимо выросло качество жизни этих пациентов, оцененное по вопроснику AQLQ (вводный период – 146,5 (121-181), последняя неделя лечения – 189 (173-199) баллов, р<0,0001).
В группе больных, получавших САЛ/ФП в режиме стабильной дозы, была отмечена статистически значимая выраженная положительная динамика всех клинико-функциональных показателей, а также уровня NOex после 12-недельного лечения. Исследование неспецифической БГР было выполнено лишь у трех пациентов из этой группы и не выявило значимых изменений в результате проведенного лечения. В этой группе больных, количество пациентов с хорошо контролируемой астмой увеличилось на 7 человек (на 275%) и также произошло статистически значимое улучшение качества жизни больных. С целью сравнения двух режимов лечения комбинированными препаратами больных АБА, мы сопоставили изменения, произошедшие в клинико-функциональных параметрах, NOex, АСТ и AQLQ у больных, получавших ФОР/БУД в режиме SMART и САЛ/ФП в режиме стабильного дозирования (Таблица 3). Как видно из таблицы, не было выявлено существенной разницы в клинико-функциональной эффективности этих двух режимов фармакотерапии БА. Оба они оказались эффективными в отношении достижения хорошо контролируемой астмы (по данным АСТ-теста) и привели к улучшению качества жизни больных. Было зафиксировано более выраженное уменьшение дневных симптомов и снижение NOex у больных, получавших САЛ/ФП в режиме стабильной дозы, что возможно отражает большую противовоспалительную активность данного режима. Однако это предположение требует дальнейших исследований. Частота побочных эффектов также статистически значимо не различалась у пациентов, получавших САЛ/ФП в режиме стабильной дозы, и у пациентов, получавших ФОР/БУД в режиме SMART.
Эффективность и безопасность сублингвальной АСИТ. С целью изучения эффективности и безопасности СЛАСИТ у пациентов с аллергией к клещу домашней пыли, проведено открытое несравнительное исследование СЛАСИТ сублингвальными аллергенами смеси клещей (Acarus siro, Dermatophagoides farinae, Dermatophagoides pteronyssinus) фирмы «Sevapharma» (Чехия) у пациентов, страдающих изолированным аллергическим риноконъюнктивитом (8 больных) или в сочетании с АБА легкого интермиттирующего или персистирующего течения (9 пациентов). Никто из пациентов, включенных в исследование, ранее не получал АСИТ. Общая продолжительность исследования составила 408,0 (399,0418,0) дней.
Таблица 3.
Сравнение изменений в клинико-функциональных параметрах, NOex, АСТ и AQLQ у больных, получавших ФОР/БУД в режиме SMART и САЛ/ФП в режиме стабильного дозирования

* статистически значимо
Средняя продолжительность СЛАСИТ составила 367,1 (2,6) дней. Мы использовали сокращенную схему, при которой инициирующая фаза длится в течение 50 дней. Пациенты начинали с приёма 1 капли минимальной концентрации (1 PNU) и каждый день повышали дозу на 1 каплю вплоть до достижения 10 капель. После чего переходили на 1 каплю следующей повышенной концентрации. По достижении максимальной концентрации (10 000 PNU) и дозы (10 капель), пациенты переходили на поддерживающую дозу (5-10 капель аллергена концентрации 10 000PNU) 1 раз в 7-10 дней. Средняя суммарная доза аллергена, полученная за период исследования, составила - 329559 (1015,8) PNU. В результате СЛАСИТ у всех пациентов отмечено статистически значимое уменьшение клинических проявлений АР, БА и аллергического конъюнктивита, проявляющиесяпроявляющиеся в
Эффективность и безопасность сублингвальной АСИТ. С целью изучения эффективности и безопасности СЛАСИТ у пациентов с аллергией к клещу домашней пыли, проведено открытое рандомизированное несравнительное исследование СЛАСИТ сублингвальными аллергенами смеси клещей (Acarus siro, Dermatophagoides farinae, Dermatophagoides pteronyssinus) фирмы «Sevapharma» (Чехия) у пациентов, страдающих изолированным аллергическим риноконъюнктивитом (8 больных) или в сочетании с АБА легкого интермиттирующего или персистирующего течения (9 пациентов). Никто из пациентов, включенных в исследование, ранее не получал АСИТ. Общая продолжительность исследования составила 408,0 (399,0418,0) дней. в снижениии общего балла клинических симптомов (с 14,0 (13,016,0) до лечения, до 4,0 (3,05,0) – после, р=0,0003). У всех пациентов статистически значимо произошло уменьшение (р<0,05) потребности в симптоматической терапии (антигистаминовых препаратах, интраназальных кортикостероидах, бронхолитических препаратах), проявляющееся в сокращении количества дней использования этих препаратов. До проведения СЛАСИТ, все больные имели положительный специфический провокационный назальный тест с аллергеном клеща, причем средний порог чувствительности составил 156,25 (39,1312,5) PNU. После проведения СЛАСИТ, назальная провокация аллергеном клеща оказалась положительной только у 6 пациентов, а порог специфической назальной чувствительности вырос до 10000 (250010000) PNU. Системный эффект СЛАСИТ демонстрирует и значимое снижение кожной специфической чувствительности, проявляющееся в уменьшении размера кожной пробы на аллерген клеща после лечения (до СЛАСИТ - 8,9 (1,5) мм, после - 6,9 (2,4), р=0,0007). Мы не обнаружили статистически значимых изменений в уровне ЕСР в сыворотке крови, однако было выявлено статистически значимое снижение количества эозинофилов и ЕСР в назальном секрете больных после проведения СЛАСИТ. Процентное содержание эозинофилов в назальном секрете больных до СЛАСИТ–15,0 (12,020,0), после–7,5 (4,512,0), р=0,005; ЕСР: 474,0 (416,0599,0) и 78,0 (56,0321,0) g/л, соответственно, р=0,02. Одновременно отмечалось выраженное увеличение sIgA в назальном секрете у пролеченных пациентов (с 55,0 (23,597,5) мг/л до 330,0 (270,5929,0) g/л, р=0,01). По-видимому, именно этими изменениями объясняется снижение специфической назальной гиперреактивности, в основе которой, лежит эозинофильное воспаление в слизистой носа. В качестве косвенного подтверждения можно рассматривать существование сильной обратной корреляционной связи (R=-0,94, р=0,0008) между изменением количества эозинофилов в назальном секрете и порогом специфической назальной чувствительности. Все эти локальные изменения свидетельствуют о противовоспалительном эффекте СЛАСИТ. У пациентов, получавших СЛАСИТ, статистически значимо повысилось качество жизни, оцениваемое с помошью вопросников RQLQ и AQLQ. Статистически значимой разницы в изучаемых показателях у больных АР+АБА по сравнению с пациентами, страдающими изолированным АР, обнаружено не было. Из чего было сделано заключение об одинаковой эффективности СЛАСИТ для больных АР и АБА.
Безопасность СЛАСИТ оценивалась по наличию побочных реакций в процессе проведения АСИТ. Системных реакций не было отмечено ни у одного больного. Локальные побочные реакции зафиксированы у 2 пациентов (11,8%) и ). Они проявлялись жжением, зудом, покалыванием в ротовой полости. Эти реакции были легкими, возникали сразу после приема аллергена и, как правило, проходили в течение 30 минут самостоятельно. Локальные реакции отмечались у одного пациента в течение 7 дней, а у другого – в течение 8 дней.
В результате проведения СЛАСИТ у 16 пациентов (94,1%) получены отличные и хорошие результаты лечения, у одного больного - удовлетворительный эффект.
Эффективность и безопасность интраназальной АСИТ. ВБыло проведено открытоме рандомизированноме исследованиие нами совместно с О.С. Дробик изученасравнительной оценки клиническаяой эффективностьи и безопасностьи ИНАСИТ аллергеном клеща домашней пыли и аллергоидом домашней пыли по сравнению с классическим подкожным методом (ПКАСИТ) при у пациентов, страдающих круглогодичноым аллергическоим ринитеом легкого течения без или в сочетании с АБА легкого персистирующего течения. Использовали вариант проведения ИНАСИТ, в основе которого была схема, предложенная Ушаковой Т.А., 1973г. Для проведения ИНАСИТ, начальную концентрацию аллергена определяли выявлением пороговой чувствительности пациента с помощью аллергометрического титрования на слизистой носа. Проведение ИНАСИТ рекомендуется пациентам с порогом специфической назальной чувствительности 100 PNU/мл или выше. Начальная концентрация аллергена при ИНАСИТ: 0,1 PNU/мл для водно-солевых аллергенов и 1 PNU/мл для аллергоидов, как при подкожном методе АСИТ. Количество вводимой аллерговакцины было постоянным, с постепенно повышающейся концентрацией. Общее количество (0,25мл) аллерговакцины закапывали интраназально инсулиновым шприцом по 5 капель в каждую ноздрю. Наблюдая за пациентом в течение 30 минут, оценивали реакцию со стороны слизистой оболочки носа. Суммарная доза аллергена, так же как и кратность введения, были индивидуальны для каждого больного: учитывалась назальная реакция и общее самочувствие пациента. Интервал между введениями аллергена составлял 24—48 часов, в зависимости от предыдущей реакции на введение аллергена. По достижении концентрации аллергена 2500 PNU, лечение продолжали в режиме поддерживающих доз (один раз в 7-14 дней) в течение года, с учетом индивидуальной переносимости лечения. В исследование было включено 48 пациентов: 9 женщин и 39 мужчин, в возрасте от 18 до 26 лет (средний возраст 19,7±2,5). 9 (18,7%) пациентов имели изолированный АР, а 39 (81,2%) - сочетание АР и АБА обусловленные сенсибилизацией только к бытовым аллергенам. 1-я группа больных (29 человек) получали лечение ИНАСИТ, 2-я (19 больных) – ПКАСИТ. Общая продолжительность лечения составила 12 месяцев. Эффективность терапии оценивали по совокупности параметров: клинических проявлений и их интенсивности (общий индекс симптомов АР и БА), потребности в симптоматической терапии, а также по объективным критериям, таким как ФВД, специфической назальной реактивности, порогу чувствительности к метахолину. У всех пациентов была отмечена статистически значимая (р<0,05) положительная динамика симптомов АР и БА, и функциональных показателей.Все больные перед проведением АСИТ в течение 4-ех недель получали терапию антигистаминными препаратами II поколения (лоратадин). Эффективность лечения оценивали через 6 и 12 месяцев от начала АСИТ. На рисунке 8 представлена динамика симптомов БА на фоне проведения АСИТ аллергоидом домашней пыли.
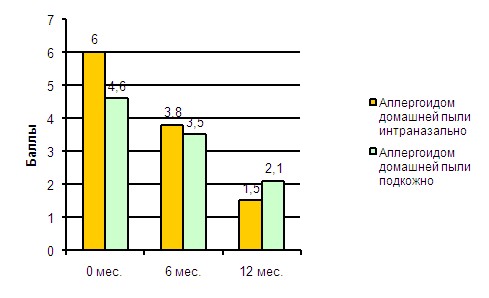
Рис. 8 Динамика симптомов АБА на фоне проведения АСИТ
У большинства пациентов в результате проведения АСИТ произошло уменьшение БГР, наиболее выраженное в группе больных, получавших ИНАСИТ аллергоидом домашней пыли ( ПК 20 мг/мл до ИНАСИТ - 0,18±0,01, после – 4.5±0,9, р<0,001). Пациенты, получавшие ИНАСИТ аллергоидом домашней пыли, достигали самой большой курсовой дозы PNU 100 909, что в 6,8 раза превысило дозу при подкожном методе АСИТ (14 702 PNU).
Эффективность терапии оценивали по совокупности параметров: клинических проявлений и их интенсивности (общий индекс симптомов АР и БА), потребности в симптоматической терапии, а также по объективным критериям, таким как ФВД, специфической назальной реактивности, порогу чувствительности к метахолину.
Отличный эффект АСИТ был получен в 59% случаев, причем в подгруппе пациентов, получавших ИНАСИТ аллергоидом домашней пыли, отличный эффект отмечен у 15 человек (100% группы).
За время лечения ни у одного из пациентов в обеих группах (ИНАСИТ и ПКАСИТ) не было зарегистрировано системных реакций. Локальные побочные реакции регистрировались чаще при АСИТ аллергенами, по сравнению с аллергоидами, особенно при переходе на новое разведение, и исчезали при повторении дозы. Местные реакции возникали через 1020 минут после введения аллерговакцины интраназально и проявлялись чиханьем, зудом в носу, ринореей, иногда - преходящей заложенностью носа, слезотечением. В подгруппе пациентов, получавших аллергоид домашней пыли интраназально, побочные реакции были отмечены только у двух пациентов (13,3%), а в подгруппе больных, получавших ИНАСИТ аллергеном клеща домашней пыли у 9-и (64,3% ) пациентов. При этом Вв подгруппе пациентов, получавших аллергоид домашней пыли подкожно, местные реакции наблюдались у 9 человек (81,8%). Не было отмечено статистически значимой разницы в эффективности и переносимости ИНАСИТ у больных с изолированным АР, по сравнению с больными, страдающими АР+АБА.
Роль NOex в оценке контроля атопической БА. С целью оценки клинического значения определения NO в выдыхаемом воздухе у больных БА, а также его роли в качестве критерия контроля болезни и взаимосвязи с другими показателями контроля, нами были обследованы 114 больных БА (91 – с АБА, 7 – с НАБА, 16 – с АБА+НАБА). Уровень NOex у больных, в зависимости от этиологической формы БА, представлен в Ттаблице 4.
Как видно из таблицы, уровень NOex у больных АБА и АБА+НАБА статистически значимо выше, чем в контрольной группе здоровых и у пациентов с НАБА. У пациентов с НАБА уровень NOex не отличался от значений в контрольной группе здоровых.
Для определения взаимосвязи уровня NO в выдыхаемом воздухе с другими показателями контроля (АСТ-тестом, ОФВ1, степенью БГР), а также с тяжестью, фазой и получаемой терапией, рассматриваемые как качественные порядковые признаки, использовался непараметрический корреляционный анализ (корреляция Спирмена). В результате проведенного корреляционного анализа было установлено существование статистически значимых корреляционных связей между уровнем NOex и фазой БА (R=0,3739,p=0,0002), уровнем NOex и ОФВ1 (R=-0,262,p=0,0124), NOex и уровнем контроля астмы (АСТ-тест) (R=-0,245,p=0,0194) только для больных АБА.
Таблица 4
Уровень NOex при различных этиологических формах БА
| АБА (n=91) | НАБА (n=7) | АБА+НАБА (n=16) | Контрольная группа здоровых (n=7) | |
| NOex, Me(25%-75%) | 35 (17 – 66) | 14 (9 – 16) | 36 (22 – 116) | 10 (5 – 17) |
| АБА | - | - | - | - |
| НАБА | p=0.004* | - | - | - |
| АБА+НАБА | p=0.3490 | p=0.004* | - | - |
| Контрольная группа | p=0.0008* | p=0.9307 | p=0.019* | - |
*-статистически значимо
| АБА Ме(25%-75%) | НАБА Ме(25%-75%) | АБА+НАБА Ме(25%-75%) | Контрольная группа здоровых Ме(25%-75%) | |
| NOex | 35 (17 – 66) | 14 (9 – 16) | 36 (22 – 116) | 10 (5 – 17) |
| АБА | - | - | - | - |
| НАБА | p=0.004* | - | - | - |
| АБА+НАБА | p=0.3490 | p=0.004* | - | - |
| Контрольная группа | p=0.0008* | p=0.9307 | p=0.019* | - |
Специфичность, применяемого нами метода определения NOex (NIOX MINO), при диагностически значимом значении NOex для БА у взрослых >20 ppb, составила Sp=85,7%. Чувствительность была рассчитана для различных этиологических форм БА и составила: SeАБА=73,6%; SeНАБА=0%; : SeАБА+НАБА=81,3%.
Таким образом, результаты проведенного исследования демонстрируют, что NOex является важным маркером для БА, высокочувствительным для лиц с атопической формой болезни и для пациентов со смешанным вариантом БА, при котором, по-видимому, доминирует аллергическое эозинофильное воспаление.
Всем пациентам с неконтролируемой БА была скорректирована (увеличена на 1 ступень) базисная противоастматическая фармакотерапия.
С целью оценки возможности мониторинга эффективности противоастматической терапии на основании значения NОex и основываясь на работе Silkoff PE и коллег, 2004г., свидетельствующих, что снижение NОex по крайней мере на 20% у пациентов с нестабильной БА может указывать на эффективность противовоспалительной терапии, мы разделили наших пациентов на 2-е группы. На основании вычисления ОШ достижения контролируемого состояния БА в группе больных, у которых снижение NОex в ответ на коррекцию терапии составило 20% от первоначального уровня, и группы больных, у которых снижение NОex в ответ на коррекцию терапии составило <20%, можно утверждать, что снижение NOex 20% в ответ на проводимую терапию является признаком, который формирует группу больных, в которой статистически значимо (p<0,05) более вероятно достижение контроля БА, ОШ= 3,18; ДИ:1,13-8,92, по сравнению с больными у которых в результате лечения NOex снизился <20%.
Таким образом, NO в выдыхаемом воздухе является чувствительным маркером ответа на противовоспалительную терапию при БА, позволяющим оценивать эффективность назначенного лечения, причем именно в отношении влияния на подлежащее воспаление в нижних дыхательных путях.
Выводы
- Атопическая БА составляет 78% от общего числа взрослых больных астмой. В возрастной структуре атопической БА преобладают лица юношеского и молодого возраста (66,4% больных). Гендерная характеристика атопической астмы отличается превалированием мужчин среди лиц молодого и юношеского возраста (82%), а среди пациентов старших возрастных групп – женщин (75%). Большинство пациентов (65,7%) имеют легкую форму атопической БА. Сочетание атопической БА и аллергического ринита отмечается у 98% больных, причем у 65% - АР предшествовал БА, а у 28% больных АР начался одновременно с БА.44% больных атопической БА имеют отягощенную наследственность по БА и/или атопии. Большинство пациентов (62%) заболевают в детском и юношеском возрасте.
- У взрослых больных атопической БА преобладает легкая форма болезни – у 65,7% пациентов, 31,3% - имеют среднетяжелую БА и лишь 3 % - страдают тяжелой формой атопической астмы.
- Самыми распространенными аллергенами у взрослых больных атопической БА – жителей Москвы являютсяоказались: домашняя пыль и клещ домашней пыли, затем (в порядке убывания) эпидермальные аллергены, пыльца деревьев, пыльца злаков, пыльца сорных трав и грибковые аллергены. Поливалентная сенсибилизация к ингаляционным аллергенам нескольких групп была выявлена у подавляющего большинства больных (84%).
- Сочетание атопической БА и аллергического ринита отмечается у 98% больных, причем у 65% - АР предшествовал БА (Ме периода времени от начала АР до дебюта БА составила 6,25( 27) года, а у 28% больных АР начался одновременно с БА. АтД страдали лишь 5% взрослых больных атопической БА.
- Выделены и охарактеризованы клинические фенотипы АБА взрослых, в зависимости от возраста начала болезни: АБА с ранним дебютом (до 16 лет включительно) и АБА с поздним началом (после 16 лет). Эти клинические фенотипы АБА статистически значимо (р<0,05) различаются (р<0,05) по полу, частоте отягощенной наследственности и спектру причинно-значимых аллергенов. Клинический фенотип АБА с поздним дебютом характеризуется большей вероятностью формирования более тяжелой неконтролируемой астмы с частыми обострениями.
- Уровень общего IgE сыворотки крови статистически значимо (р<0,05) коррелирует с аллергенспецифической кожной реактивностью у всех больных АБА, независимо от пола и возраста: чем шире спектр сенсибилизирующих аллергенов, тем выше общий IgE; не было выявлено статистически значимой корреляции между уровнем общего IgE и ОФВ1, а также между возрастом дебюта БА и уровнем общего IgE.
- Оценка реального контроля БА показала, что 43% больных имеют неконтролируемую астму, причем большинство пациентов (79,5%) отмечают обострения болезни в течение последнего года, по поводу которых 10% - лечились в стационаре, а 8% больных прибегали к неотложной помощи. 74% пациентов обращались к врачу, в течение последнего года, в связи с ухудшением БА, причем большинство обращений (40%) было к врачу-терапевту.
- У подростков мужского пола, страдающих астмой, доминирует атопическая форма болезни (у 98% больных). Клинический фенотип атопической БА подростков мужского пола характеризуется легким интермиттирующим течением у большинства (72%) больных; нормальными показателями ФВД (у 95,5% больных); сочетанием с аллергическим ринитом практически у всех пациентов (99%); наличием поливалентнойсочетанной сенсибилизации к ингаляционным аллергенам нескольких групп у 85,6% больных.бытовым и пыльцевым аллергенам у 42,0, а к бытовым, пыльцевым и эпидермальным у 30,6% больных, моносенсибилизаци к бытовым или пыльцевым аллергенам – у 14,4%. Пик заболеваемости атопической БА у мальчиков приходится на возраст от 7 до 13 лет и существенно снижается после 15 лет.
- Бронхопровокационный тест с метахолином является высокочувствительным (Se=90,2%) и специфичным (Sp=90%) методом для диагностики БА у подростков. Прогностическая ценность положительного результата (+PV) - 99,8%, а прогностическая ценность отрицательного результата (-PV) – 14,5%. Большинство подростков (53,2%) имеют высокую или среднюю степень бронхиальной гиперреактивности, несмотря на ремиссию и легкую форму болезни.
- Разработанный алгоритм медицинского освидетельствования подростков и призывников с БА позволяет верифицировать диагноз БА на различных этапах обследования, в зависимости от полученных результатов. Для пациентов в фазе стойкой ремиссии атопической БА и отрицательными неспецифическими прямыми БПТ разработан специфический бронхопровокационный тест двукратными разведениями аллергена, на основании расчета предполагаемой дозы аллергена по кожному специфическому титрованию. Чувствительность данного теста зависит от вида аллергена (Se аллергена клеща домашней пыли =54,55%, Se дом. пыли =66,67%, Se пыльцевых аллергенов =88,89%).
- У пациентов с атопической БА даже в фазе стойкой ремиссии болезни отмечаются признаки субклинического аллергического воспаления в нижних дыхательных путях, проявляющегося повышенным содержанием эозинофилов и ЕСР в индуцированной мокроте, которые достоверно (р<0,05) возрастают после низкодозовой аллергенной провокации. Исследование индуцированной мокроты у больных интермиттирующей БА может служить дополнительным диагностическим методом, особенно в сочетании с низкодозовым БПТ со специфическим аллергеном.
- Существенная часть больных атопической БА (43% взрослых и 56% подростков) отмечают неконтролируемое течение астмы, не получают адекватной фармакотерапии, являясь группой риска развития обострений БА. 78,5% больных атопической БА имели обострения заболевания в течение года. Результаты АСТ-тест, с помощью которого оценивали текущий уровень контроля БА, коррелируют с функциональными показателями (ОФВ1), а также степенью бронхиальной гиперреактивности, являющейся маркером аллергического воспаления в нижних дыхательных путях.
11. Более половины (56%) подростков, имеющих легкую форму БА, отмечают неконтролируемое ее течение и не получают адекватной фармакотерапии, являясь группой риска развития обострения БА. Результаты АСТ-теста у этой группы больных статистически значимо (р<0,05) коррелируют с функциональными показателями (ОФВ1), а также степенью бронхиальной гиперреактивности, являющейся маркером аллергического воспаления в нижних дыхательных путях.
112. Распространенность В16 Arg/Arg типа 2-адренорецептора составляет 19% у больных БА – жителей Москвы и Московской области. Наличие В16-Arg/Arg типа 2-адренорецептора не влияет на естественное развитие БА, однако определяет выраженность бронходилатационного ответа на короткодействующие 2-агонисты. Однако, бронходилатационный Оответ на сальбутамол у пациентов с В16 Arg/Arg типом 2-адренорецептора них значимо меньше, по сравнению с пациентами, не имеющими этого типа рецептора (р=0,0038), а также по сравнению с бронхолитическим ответом на воздействие ипратропия бромида (р=0,0037). Статистически значимого различия (р<0,05) между пациентами с + В16-Arg/Arg типом 2-адренорецептора и пациентами с - В16-Arg/Arg типом 2-адренорецептора в отношение эффективности применения комбинированных препаратов (ИГКС+ДД2А) обнаружено не было.
Применение антилейкотриенового препарата монтелукаст, в качестве монотерапии в течение 12 недель, у больных легкой персистирующей неконтролируемой атопической БА является эффективным для достижения клинического контроля, но недостаточно эффективным для достижения контроля воспаления, о чем свидетельствуют такие биомаркеры воспаления, как NOex и БГР.
12. Разные режимы фармакотерапии комбинированными препаратами ИГКС+ДД2А (САЛ/ФП в режиме стабильной дозы и ФОР/БУД в режиме SMART) являются одинаково эффективными и безопасными в отношении достижения клинико-функционального контроля и улучшения качества жизни больных среднетяжелой и тяжелой атопической БА. Применение антилейкотриенового препарата монтелукаст, в качестве монотерапии в течение 12 недель, у больных легкой персистирующей неконтролируемой атопической БА является эффективным для достижения клинического контроля, но недостаточно эффективным для достижения контроля воспаления.
- Сублингвальная АСИТ аллергенами смеси клещей домашней пыли фирмы «Sevapharma», Чехия является эффективным методом лечения аллергических риноконъюнктивитов и легкой формы атопической БА, обусловленных сенсибилизацией к клещу домашней пыли (у 94% больных получены отличные и хорошие результаты). Безопасность и хорошая переносимость СЛАСИТ этими аллергенами позволяет проводить лечение в домашних условиях, посещая врача аллерголога-иммунолога 1 раз в месяц.
- Интраназальная АСИТ водно-солевыми аллергеном клещаами домашней пыли и аллергоидомами домашней пыли является эффективным (у 79% больных – отличный эффект) альтернативным методом подкожной АСИТ, позволяющим достичь высокой общей курсовой дозы аллерговакцины (100 909 PNU при лечении аллергоидом домашней пыли) одновременно с хорошим профилем безопасности (0%- системных реакций, у 77,5% больных – локальные реакции, контролируемые антигистаминными препаратами).
- Измерение уровня NO в выдыхаемом воздухе в комплексной оценке степени контроля атопической БА позволяет определять не только клинико-функциональные параметры, но и активность воспаления. Оценка контроля БА должна быть комплексной, включающей не только оценку клинических симптомов, но и маркеров воспаления. NOexO в выдыхаемом воздухе является важным маркером для БА, высокочувствительным маркером для атопической БАдля лиц с атопической формой болезни и для пациентов со смешанным вариантом БА. Специфичность, применяемого нами метода определения NOex (NIOX MINO), составила Sp=85,7%. Чувствительность для различных этиологических форм БА составила: SeАБА=73,6%; SeНАБА=0%; SeАБА+НАБА=81,3%.
- NOех является чувствительным маркером ответа на противовоспалительную терапию при БА: снижение NOex 20% свидетельствует об эффективности назначенного лечения и сопряжено с высокой вероятностью достижения контроля БА (ОШ= 3,18; ДИ:1,13-8,92, р<0,05).
Измерение уровня Noex в комплексе с другими параметрами эффективности терапии, оценивающими влияние лечения на клинические проявления болезни и потребность в скоропомощных препаратах (АСТ-тест), а также на функцию легких (ОФВ1), позволяет проводить объективный мониторинг терапии БА.
Список работ, опубликованных по теме диссертации:
- Особенности фенотипических проявлений -I-протеолитического ингибитора при некоторых патогенетических вариантах бронхиальной астмы //Сборник научных работ ЛМИ и ВНИИП МЗ СССР «Бронхиальная астма».- Л., 1989.- С.61-63. (Соавт. Горячкина Л.А., Доценко В.Л., Яровая Г.А.).
- Клиническая оценка эффективности препарата Беклокорт при различных формах бронхиальной астмы и аллергического ринита // Новости фармации и медицины.- 1989.-№5.- С. 42-45. (Cоавт. Горячкина Л.А.).
- Specific phenotypical effects of the -I-protheolytical inhibitor for some pathogenetic versions of bronchial asthma // Procc. of the XVth Congress of the European Academy of Allergology and Clinical Immunology.- Paris, 1992.- Р.192.(Соавт. Горячкина Л.А.).
- The influence of Ditec treatment on the Proteolytic and Antiproteolytic Activity of Blood Serum in Patients with Atopic Bronchial Asthma // Abstracts ERS Annual Congress.- Firenze (Italy), 1993.- Р. 319.(Соавт. Горячкина Л.А., Пужко С.Г.).
- Клинический опыт применения Дитека в лечении аллергических заболеваний // Терапевтический архив.- 1994.- № 3.- С. 19-24.(Соавт. Горячкина Л.А., Даулетбаев Н.Б., Пужко С.Г.).
- Эффективность препарата Ингакорт в терапии бронхиальной астмы // Материалы 4-го Национал.ального Конгресса по Болезням органов дыхания.- М., 1994.- C. 7. (Соавт. Горячкина Л.А., Терехова Е.П.).
- Участие нейтрофилов в патогенезе аллергического воспаления, ингибиторно-протеазный индекс в оценке и прогнозировании атопических заболеваний // Вопросы медиц.инской химии.- 1994.- Т.40.-№5.- C. 37-42. (Соавт. Доценко В.Л., Нешкова Е.А., Пужко С.Г., Горячкина Л.А.)
- Эффективность отечественного препарата Будезонид в комплексной терапии бронхиальной астмы // Материалы 5-го Национального Конгресса по Болезням органов дыхания.- М., 1995.- C 14. (Соавт. Горячкина Л.А., Терехова Е.П.).
- Эффективность сальметерола в комплексной базисной терапии бронхиальной астмы // Материалы 5-го Национального Конгресса по Болезням органов дыхания.- М., 1995.- C. 14. (Соавт. Горячкина Л.А.,Даулетбаев Н.Б., Тринько В.И.)
- Эффективность нового комбинированного препарата Интал-плюс в лечении атопической бронхиальной астмы // Материалы 5-го Национального Конгресса по Болезням органов дыхания.- М., 1995.- C. 25.(Соавт. Горячкина Л.А.).
- Кромогликат натрия в терапии внелегочных проявлений аллергии // Пульмонология.- 1995.- № 3.- C. 84-87. (Соавт. Горячкина Л.А.).
- Efficacy of Salmeterol in Atopic mild-to moderate adult asthma //Abstracts of 16th Int. Congress EAACI.- Madrid, 1995.-P.316. (Соавт. Горячкина Л.А., Даулетбаев Н.Б.).
- Влияние кромогликата натрия и недокромила натрия на бронхиальную гиперреактивность // Материалы VI Национального Конгресса по Болезням органов дыхания.- Новосибирск, 1996.- C. 18. (Соавт. Горячкина Л.А., Арутюнов Т.Г., Терехова Е.П.).
- Эффективность препарата Интал-плюс в лечении атопической бронхиальной астмы // Материалы VI Национал.ьного Конгр.есса по Болезнямм органов дыхания.- Новосибирск, 1996.- C. 22. (Соавт. Горячкина Л.А.).
- Применение фликсоназе при аллергическом рините// Пульмонология.- 1996.-№2.-C.54-56.
- Результаты лечения аллергического круглогодичного ринита интраназальным глюкокортикоидом – фликсоназе // Российская ринология.- 1997.-№2.-C.53-55. (Cоавт. Горячкина Л.А., Воржева И.И., Черняк Б.А. ).
- Влияние различных противоастматических препаратов на бронхиальную гиперреактивность // Сборник трудов РМАПО.- 1997.- C. 52-54.(Соавт. Горячкина Л.А., Арутюнов Т.Г., Терехова Е.П.).
- Результаты исследования гиперреактивности дыхательных путей у лиц, страдающих бронхиальной астмой // Материалы III Национального конгресса РААКИ.- Дагомыс, 2000.- С. 22. (Соавт. Горячкина Л.А.,Гусева А.Ю.)
- Оценка бронхиальной гиперреактивности у лиц призывного возраста, страдающих бронхиальной астмой // Материалы Х Национального Конгресса по Болезням органов дыхания.- Санкт-Петербург, 2000.- C. 69. (Соавт. Горячкина Л.А.,Гусева А.Ю.)
- Рациональная терапия аллергического ринита //Российская ринология.-2000.- №2.-C.53-56. (Соавт. Горячкина Л.А., Беда М.В., Пересецкий А.А.)
- Бронхиальная гиперреактивность у лиц подросткового возраста, страдающих бронхиальной астмой // Материалы VIII Национального конгресса «Человек и лекарство».- М.,2001.- C.39. (Соавт. Горячкина Л.А.,Гусева А.Ю., Автандилов А.Г.).
- Бронхиальная гиперреактивность у лиц призывного возраста, страдающих бронхиальной астмой // Материалы IV Конгресса РААКИ.- М.,2001.- C.470. (Соавт. Горячкина Л.А.,Гусева А.Ю., Автандилов А.Г.).
- Bronchial hyperresponsiveness in the adolescents have been suffering from bronchial asthma // XX Congress of EAACI.- Berlin, 2001.- P.171. (Соавт. Горячкина Л.А.,Гусева А.Ю.).
- Bronchial hyperresponsiveness in the adolescents with bronchial asthma //Annual Congress of ERS.- Berlin, 2001.- abstract №3932. (Соавт. Горячкина Л.А.,Гусева А.Ю.).
- Особенности функциональной диагностики бронхиальной астмы у лиц призывного возраста //Аллергология.- 2002.-№2.-C.21-26. (Соавт. Горячкина Л.А.,Гусева А.Ю.)
- Современная терапия бронхиальной астмы // Лечащий врач.- 2002.-№4.-C.28-32. (Соавт. Горячкина Л.А.).
- Пример рациональной терапии бронхиальной астмы // Лечащий врач.- 2002.-№4.-C. 40-43.
- Медицинское освидетельствование подростков и призывников с бронхиальной астмой. Методические рекомендации (№5) Комитета Здравоохранения правительства Москвы.- М., 2003.- 14с. (Соавт. Горячкина Л.А., Гусева А.Ю., Автандилов А.Г., Троицкая Т.А., Куликов В.В., Ядчук В.Н., Работкин О.С.).
- Опыт применения интраназальной специфической иммунотерапии при аллергическом рините // Материалы ХI Национального конгресса «Человек и лекарство».-М.,2004.-C. 201. (Соавт. Горячкина Л.А., Дробик О.С.)
- Терапия бронхиальной астмы: вклад аллерголога // В монографии под ред. А.Н.Цой, В.В.Архипова «Бронхиальная астма. Новые решения» / Изд-во Медицинское Информац. Агентство.- Москва, 2007.-С.148-177.
- Возможности достижения контроля над бронхиальной астмой в условиях клинической практики // Атмосфера. Пульмонология и Аллергология. -2007.-№4(27).-C.36-39.
- Медицинское освидетельствование подростков и призывников с бронхиальной астмой // Учебное пособие для врачей ГОУ ДПО РМАПО.- М., 2008.- 32с. (Соавт. Горячкина Л.А., Тотикова М.Ч.)
- Значение бронхопровокационных тестов с аллергенами в диагностике бронхиальной астмы у подростков мужского пола // Российский аллергологический журнал.- 2008.-№1 (приложение 1).- С.196-197. (Соавт. Тотикова М.Ч.)
- Результаты кожного теста с аутосывороткой у пациентов с бронхиальной астмой // Российский аллергологический журнал.-2008.- №1 (приложение 1).- C.68-69. (Соавт. Горячкина Л.А., Фомина Д.С.)
- Локальная аллергенспецифическая иммунотерапия в лечении бронхиальной астмы // Материалы Объединенного иммунологического форума / Российский иммунологический журнал, 2008, Т.2 (11).- №2-3.- C.221. (Соавт. Дробик О.С., Бжедугова Е.Р.)
- Эволюция бронхиальной астмы у подростков // Материалы Объединенного иммунологического форума / Российский иммунологический журнал, 2008, Т.2 (11).- №2-3.- C.212. (Соавт. Горячкина Л.А., Буриев Б.Б.)
- Значение определения оксида азота в выдыхаемом воздухе у пациентов с атопической бронхиальной астмой // Материалы Объединенного иммунологического форума / Российский иммунологический журнал, 2008, Т.2 (11).- №2-3.- C. 227. (Соавт. Горячкина Л.А., Фомина Д.С.)
- Возможности достижения контроля над бронхиальной астмой у подростков мужского пола // Материалы ХII Конгресса педиатров России «Актуальные проблемы педиатрии».-М., 2008.- C. 167. (Cоавт. Горячкина Л.А.)
- Атопический синдром при бронхиальной астме // В монографии под ред. А.Г.Чучалина «Клинические рекомендации. Бронхиальная астма».-М., Издат. Дом «Атмосфера».-2008.- С.57-77. (Соавт. Горячкина Л.А., Астафьева Н.Г.)
- Базисная терапия бронхиальной астмы // Справочник поликлинического врача.-2008.-№2.-C.51-55. (Соавт. Горячкина Л.А.)
- Особенности бронхиальной астмы у подростков мужского пола // Пульмонология.- 2008.-№2.-C.15-19. (Соавт. Горячкина Л.А., Тотикова М.Ч., Шмелева Н.В. )
- Контроль над бронхиальной астмой и возможности его достижения // Пульмонология.-2008.-№3.-C.91-96.
- Контроль бронхиальной астмы у подростков // Педиатрическая фармакология.- 2008.-Т.5.-№3.-С.98-103.
- Диагностическое значение малоинвазивных методов определения воспаления в нижних дыхательных путях при интермиттирующей бронхиальной астме // Российский аллергологический журнал.- 2008.-№4.-C.29-36. (Соавт. Горячкина Л.А., Тотикова М.Ч. )
- Локальная аллергенспецифическая иммунотерапия // Учебное пособие для врачей ГОУ ДПО РМАПО.- М., 2008.- 38с. (Cоавт. Горячкина Л.А., Дробик О.С., Бжедугова Е.Р.)
- Астма и аллергия // Врач.- 2008.- №11, с. 16-19.
- Стартовая поддерживающая терапия бронхиальной астмы // Российский аллергологический журнал.- 2008.-№5.-C.60-63.
48. Аллергический ринит, как фактор риска развития бронхиальной астмы // Consilium Medicum.- 2008.-№10.-С.90-97.
49. Этапы диагностики бронхиальной астмы у подростков мужского пола // Российский аллергологический журнал.- 2008.-№6.-C.19-25.
50. Эффективность и безопасность сублингвальной аллергенспецифической иммунотерапии аллергенами клещей домашней пыли// Российский аллергологический журнал.- 2008.-№6.-C.58-62. (Cоавт. Бжедугова Е.Р.).
51. Влияние интраназальной иммунотерапии на динамику показателей бронхиальной гиперреактивности у больных аллергическим ринитом // Материалы Всероссийской научно-практической конференции «Вакцинология 2008. Совершенствование иммунобиологических средств профилактики, диагностики и лечения инфекционных болезней».-М.,2008.-С.17. (Соавт. Горячкина Л.А., Антонова Т.Н.)
52. Эффективность и безопасность сублингвальной аллергенспецифической иммунотерапии бытовыми аллергенами // Материалы Всерос.научно-практич. конфер. «Вакцинология 2008».-М., 2008.-С.23 (Соавт. Бжедугова Е.Р.).
Список сокращений
| АБА – атопическая бронхиальная астма | NOех – оксид азота в выдыхаемом воздухе | |
| АСИТ – аллергенспецифическая иммунотерапия | SMART –режим фармакотерапии,при котором один ингалятор используется для поддерживающего лечения и для купирования симптомов | |
| АСТ – тест – тест по контролю бронхиальной астмы | ОФВ1 – объем форсированного выдоха за первую секунду | |
| АР – аллергический ринит | ОШ – отношение шансов | |
| Аrg – аргинин | ПСВ – пиковая скорость выдоха | |
| AQLQ – вопросник оценки качества жизни больного астмой | ПК20 – пороговая концентрация метахолина (аллергена, вызывающая снижение ОФВ1 на 20% от исходного уровня) | |
| БА – бронхиальная астма | ПКАСИТ – подкожная АСИТ | |
| БГР – бронхиальная гиперреактивность | СЛАСИТ – сублингвальная АСИТ | |
| БПТ – бронхопровокационный тест | САЛ/ФП – сальметерол/флутиказона пропионат | |
| ДД2А – длительно действующие 2-агонисты | ФОР/БУД – формотерол/будесонид | |
| ДИ – доверительные интервалы | PNU – единицы белкового азота | |
| ЕСР – эозинофильный катионный протеин | ppb – (part per billion) единица измерения концентрации газа в воздухе, отражающая число частиц газа на биллион частиц воздуха | |
| GINA – Глобальная стратегия лечения и профилактики бронхиальной астмы | RQLQ – вопросник оценки качества жизни больного аллергическим ринитом | |
| ИГКС – ингаляционные глюкокортикостероиды | ФВД – функция внешнего дыхания | |
| ИНАСИТ – интраназальная АСИТ | Se – чувствительность метода | |
| НАБА – неатопическая бронхиальная астма | Sp – специфичность метода |

