Взаимосвязь генетических и социальных факторов в модуляции гормональной функции семенников у лабораторных мышей
На правах рукописи
Зарубина Екатерина Александровна
ВЗАИМОСВЯЗЬ ГЕНЕТИЧЕСКИХ И СОЦИАЛЬНЫХ ФАКТОРОВ В МОДУЛЯЦИИ ГОРМОНАЛЬНОЙ ФУНКЦИИ СЕМЕННИКОВ У ЛАБОРАТОРНЫХ МЫШЕЙ
03.03.01 - физиология
АВТОРЕФЕРАТ
диссертации на соискание
учёной степени кандидата биологических наук
Новосибирск – 2011
Работа выполнена в лаборатории эндокринологической генетики Института цитологии и генетики Сибирского Отделения РАН
| Научный руководитель: | доктор биологических наук Осадчук Людмила Владимировна Институт цитологии и генетики СО РАН, г.Новосибирск |
| Официальные оппоненты: | доктор биологических наук Обут Тимофей Александрович Научно-исследовательский институт физиологии СО РАМН, г.Новосибирск |
| доктор биологических наук Громов Владимир Степанович Институт проблем экологии и эволюции им. А. Н. Северцова, г. Москва | |
| Ведущая организация: | Институт физиологии им. И. П. Павлова, г. Санкт-Петербург |
Защита состоится «_»___________ 2011 г. в «__» часов на заседании диссертационного совета в НИИ физиологии СО РАМН, 630117, г. Новосибирск, ул. Академика Тимакова, 4., тел: (383) 334-89-61, факс (383) 335-97-54, е-mail: [email protected]
С диссертацией можно ознакомиться в библиотеке НИИ физиологии СО РАМН
Автореферат диссертации разослан «___»_______2011 г.
Ученый секретарь
диссертационного совета
кандидат биологических наук И.И. Бузуева
Актуальность темы. Тестостерон является главным андрогеном семенника и синтезируется из ацетата и холестерина в клетках Лейдига (Saez, 1994; Johnson, Everett, 1995). Тестостерон принимает участие в формировании и поддержании мужской репродуктивной функции: половой дифференцировке, развитии вторичных половых признаков и структур, анаболических процессах и половом поведении, осуществляет регуляцию гипоталамо-гипофизарной оси по принципу обратной отрицательной связи и необходим для нормального протекания сперматогенеза (Hall, 1994; Saez, 1994; MacLusky et al., 1997; Hiort, Holterhus, 2000; Nef, Parada, 2000; Eacker et al., 2008). Продукция тестостерона в клетках Лейдига находится под контролем лютеинизирующего гормона (ЛГ) гипофиза (Saez, 1994; Johnson, Everett, 1995; Eacker et al., 2008). Хорионический гонадотропин (ХГ) является функциональным аналогом лютеинизирующего гормона. Изучение механизмов, регулирующих гормональную реакцию семенников при стимуляции ХГ, является актуальной общебиологической и медицинской проблемой из-за широкого применения в медицине и сельском хозяйстве для стимуляции тестикулярной функции, и при исследовании гормональных резервов семенников. Препараты ХГ назначают мужчинам при нарушениях сперматогенеза, дефиците андрогенов или гонадотропных гормонов любой этиологии (Bhasin, 2007; Oldereid, Tanbo, 2008; Valdes-Socin et al., 2009; Depenbusch, 2002; Chudnovsky, 2007). ХГ используется для усиления тестикулярного стероидогенеза и сперматогенеза у домашних животных, крупного и мелкого рогатого скота, при разведении в неволе пушных зверей, рыб, земноводных (Geary et al., 2001; Browne et al., 2006; Sahoo et al., 2009).
В клетках Лейдига отсутствуют сколько-нибудь значительные запасы тестостерона, но при необходимости они способны быстро повысить его биосинтез за счет увеличения экспрессии генов ферментов стероидогенеза (Нишлаг, Бере, 2005). Гормональный потенциал семенников – характеристика резервных возможностей семенников продуцировать тестостерон, т.е. способности экстренной мобилизации гормональных ресурсов клеток Лейдига. В частности, это необходимо в условиях социальной конкуренции (Mazur, Booth, 1998; Trainor et al., 2003; Oyegbilie, Marler, 2005) и при размножении (Amstislavskaya, Popova, 2004; Осадчук и др., 2007; Амстиславская, 2008).
Общеизвестно, что уровни тестостерона в крови и его содержание в семенниках являются прямыми показателями гормональной активности семенников. Однако рядом исследователей показано, что исходный уровень андрогенной активности семенников в условиях физиологического «покоя», как правило, не предсказывает резервных возможностей эндокринной функции семенников и не дает полного представления о гормональном потенциале клеток Лейдига (Осадчук, Свечников, 1995; Marchlewska-Koj, 1997). О гормональном потенциале семенников можно судить по реакции семенников на введение ХГ in vivo или инкубируя выделенные клетки Лейдига или ткань семенников in vitro с определенными дозами ХГ (Нишлаг, Бере, 2005).
Известно, что индивидуальный фармакологический ответ на лекарственное средство зависит от пола, возраста, сопутствующих заболеваний, совместно применяемых лекарственных препаратов, вредных привычек, фотопериода, социальных условий (Hipkin L. J., 1972; Нишлаг, Бере, 2005). Еще одним важным фактором, влияющим на эффективность лекарственных препаратов, является генетический потенциал – наследственные различия, выражающиеся в определенной реакции на лекарства.
Установлены генотипические различия в эндокринной функции семенников (Bartke, 1974; Selmanoff et al., 1977; Осадчук, Науменко, 1981; Stalvey, Payne, 1984; Осадчук, Свечников, 1995, 1998; Бусыгина, Осадчук, 2001а, Ахмерова и др., 2002). У самцов лабораторных мышей наблюдаются генотипические различия по уровню тестостерона в крови (Bartke, 1974; Selmanoff et al., 1977; Осадчук, Науменко, 1981), а также по продукции тестостерона семенниками in vitro в ответ на стимуляцию ХГ (Осадчук, Науменко, 1981; Stalvey, Payne, 1984; Осадчук, Свечников, 1994, 1995; Бусыгина, Осадчук, 2001а; Ахмерова и др., 2002). Осадчуком А.В. с соавторами проводился сравнительный анализ продукции тестостерона изолированными клетками Лейдига в покое и при действии ХГ у мышей шести инбредных линий A/He, CBA/Lac, C57BL/6J, DD, YT и PT. Стимуляция ХГ дифференцировала линии мышей, при этом наибольшей реакцией на ХГ характеризовалась линия PT, наименьшей – CBA/Lac, остальные линии занимали промежуточное положение (Осадчук, Свечников, 1995; Бусыгина, Осадчук, 2001а).
Исследования in vitro позволяют изучать молекулярные аспекты действия ХГ, например особенности рецепции ХГ (Saez, 1994) и внутриклеточной передачи сигнала (Kicman et al., 1991; Нишлаг, Бере, 2005). Однако исследование генотипических различий в реакции изолированных клеток Лейдига на ХГ имеет ряд ограничений. Важно, что эндокринная функция семенников регулируется не только гормонами гипоталамуса и гипофиза, но и паракринными механизмами (Verhoeven, 1991; Bilinska et al., 2006), поэтому стимуляция ХГ гормональной функции клеток Лейдига in vitro не включает одну из важнейших регуляторных компонент – паракринную. Кроме того, изучение генотипических различий в реакции клеток Лейдига на действие ХГ проводилось на определенном количестве клеток, выделенных из семенника (Осадчук, Науменко, 1981; Stalvey, Payne, 1984; Осадчук, Свечников, 1994, 1995; Бусыгина, Осадчук, 2001а; Ахмерова и др., 2002), тогда как количество клеток Лейдига в нативных семенниках может отличаться у разных генотипов.
Воздействие ХГ в условиях in vivo позволяет оценить гормональный потенциал семенников в целостном организме, при функционировании всех звеньев гипоталамо-гипофизарно-семенниковой оси. Однако остается неизвестным, сохраняется ли в условиях целостного организма генотипические различия в реакции семенников на введение ХГ и совпадает ли гормональная реакция на действие ХГ in vivo и in vitro. Генетическая предрасположенность к реакции на ХГ остается главной и пока малоизученной проблемой фармакогенетики.
Одним из необходимых условий существования сообществ является структура поведенческих отношений. В частности, социальная иерархия – структура поведенческих отношений, проявляющаяся в конкуренции за лимитированные экологические ресурсы (пищу, территорию, полового партнера и др.), когда доминантные особи декларируют свое право первенства за доступ к ним. Формирование социальной иерархии происходит главным образом в результате агрессивных столкновений между животными за тот или иной ограниченный экологический ресурс. Сложившаяся таким образом структура доминантно-субординантных отношений (стабильная социальная иерархия) сохраняется, как правило, в течение длительного периода (Осадчук, Науменко, 1981; Науменко и др., 1983)
Известно, что социальное окружение – важный регулятор репродуктивной функции (Mackintosh 1981; Осадчук, Науменко, 1981; Науменко и др., 1983; Амстиславская и др. 1989; Wysocki, Lepri, 1991; Gore et al., 2000; Koyama, 2004; James et al., 2006; Осадчук и др., 2007, 2010). Исследования лаборатории эндокринологической генетики Института цитологии и генетики СО РАН, проведенные на инбредных линиях мышей, указывают на существенную связь между генетическими особенностями, андрогенным статусом, положением в иерархической структуре и дифференциальным размножением (Осадчук, Науменко, 1981; Осадчук, Свечников, 1995, 1998; Бусыгина, Осадчук, 2001а; Науменко, Осадчук и др., 1983; Осадчук и др., 2010). Опыт лаборатории показывает, что лабораторные мыши являются удобным объектом для моделирования эффектов генотипа и социальных отношений на репродуктивную функцию, поскольку имеется достаточно широкий набор инбредных линий.
Доминантно-субординантные отношения, которые складываются между особями в сообществе, являются важными модуляторами эндокринной функции семенников (McKinney, Desjardins, 1973; Bronson et al., 1973; Selmanoff et al., 1977; Garrett, Campbell, 1980; Осадчук, Науменко, 1981, 1983, 1986; Marchlewska-Koj, 1997; Бусыгина, Осадчук, 2001а; Осадчук и др., 2007). У животных, находящихся в группе, эндокринная функция половых желез снижена (Науменко, Осадчук и др., 1983; Marchlewska-Koj, 1997). В некоторых случаях показано, что у мышей угнетение репродуктивной оси может наблюдаться у субординантных особей, у которых понижается уровень гонадотропных гормонов и тестостерона в периферической крови по сравнению с доминантными особями (McKinney, Desjardins, 1973; Bronson, 1973). Однако другие авторы не выявили прямой зависимости между уровнем тестостерона и социальным рангом особи и не обнаружили ранговой асимметрии по ряду других репродуктивных параметров, например, по характеристикам полового поведения (Осадчук и др., 2007, 2010). С другой стороны, формирование доминантно-субординантных отношений может сопровождаться стрессом, который ослабляет репродуктивную ось как у доминантов, так и у подчиненных особей (Осадчук, 1990; Rivier, Rivest, 1991; Tamashiro et al., 2005).
Таким образом, у особей, живущих в социальных группах, складываются сложные взаимоотношения между социальным статусом и состоянием гипоталамо-гипофизарно-тестикулярной оси. С одной стороны данные литературы предполагают, что установление социальной иерархии в сообществе животных может модифицировать эндокринную функцию семенников, с другой стороны известно, что генотип оказывает влияние на гормональную функцию семенников, но взаимосвязь генетических и социальных факторов в регуляции эндокринной функции семенников изучена слабо. Исследования лаборатории эндокринологической генетики Института цитологии и генетики СО РАН дали возможность предполагать, что эндокринная функция семенников в микропопуляциях мышей разных инбредных линий зависит не только от положения животного в иерархической структуре, но и от генотипа особи (Науменко и др., 1983). В частности, показано, что генетически детерминированная повышенная гормональная активность семенников является одним из факторов, обусловливающих наследственную предрасположенность к социальному доминированию (Бусыгина, Осадчук, 2001б). В дальнейшем установлено, что на первых этапах формирования доминантно-субординантных отношений в группе из 6 самцов мышей инбредных линий происходило снижение реакции семенников на ХГ, далее следовала ее нормализация. Однако порядок межлинейных различий по стимулированной ХГ продукции тестостерона семенниками in vitro был одинаков как в условиях одиночного содержания, так и в условиях микропопуляции (Бусыгина, Осадчук, 2001а).
Таким образом, остается не ясным, какова взаимосвязь между генотипом особи, ее социальным рангом и гормональным потенциалом семенников. Представляет интерес изучение связи социальной иерархии и гормональной реакции семенников на введение стимулятора тестикулярной функции – ХГ с учетом генетически-детерминированных особенностей тестикулярного стероидогенеза.
Взаимоотношения между особями противоположного пола – другой важнейший вид социальных отношений. У самцов млекопитающих присутствие самки оказывает активирующее влияние на андрогенную функцию семенников, которое индуцируется феромонами самки и опосредуется вомероназальной системой самца (Wysocki, Lepri, 1991; Gore et al., 2000; Амстиславская, Храпова, 2002; Amstislavskaya, Popova, 2004; Koyama, 2004; James et al., 2006; Осадчук и др., 2008). Интересно отметить, что стимулирующий эффект самки на эндокринную функцию семенников наблюдается в течение короткого периода времени. Например, у самцов мышей через 20 минут после предъявления самки наблюдалось повышение уровня тестостерона в крови, но к 60-ой минуте он уже не отличался от контрольных значений (Amstislavskaya, Popova, 2004). Если самцы мышей находились с самкой в течение недели, то уровень тестостерона в крови также не отличался от контроля (Macrides et al., 1975; Bartke, Dalterio, 1975). Активация эндокринной функции семенников в ответ на кратковременное помещение самки зависит от генотипа животного (Осадчук, 1990; Amstislavskaya, Khrapova, 2002; James et al., 2006; Осадчук и др. 2008). В то же время не проводилось исследований, проясняющих эффекты длительного содержания самцов с самками на резервные возможности гормональной функции семенников. То есть, остается неясным, каковы эффекты длительного содержания самцов с самками на индивидуальный фармакологический ответ на введение ХГ. Поэтому представляло интерес, используя инбредные линии мышей, изучить у самцов различных генотипов влияние длительного содержания с самками на реакцию семенников к действию ХГ.
Для исследования генетических и физиологических аспектов социального доминирования предложены различные экспериментальные этологические модели. В нашем институте было разработано несколько моделей с использованием инбредных линий мышей (Осадчук, Науменко, 1981; Науменко, Осадчук и др., 1983; Брагин и др., 2006). Например, изменение уровня тестостерона в крови при формировании и поддержании доминантно-субординантных отношений изучалось на генетически гетерогенных микропопуляциях, состоящих из 6 самцов мышей разных генотипов (Осадчук, Науменко, 1981; Науменко, Осадчук и др., 1983). Широко используется модель социальной иерархии, состоящая из 4-5 самцов и 2 самок крыс, содержащихся в условиях, приближенных к естественным (Blanchard et al., 1995; Tamashiro et al., 2005). Недостатком таких моделей является большое количество животных в социальной группе, что затрудняет мониторинг поведения и четкое определение социального ранга каждой особи, или делает невозможным анализ генетических эффектов. Наиболее простой и перспективной моделью для изучения эффектов генотипа и социального статуса на эндокринную функцию семенников у лабораторных мышей представляется генетически гетерогенная этологическая модель социальной иерархии, состоящая из 3-х особей: 2-х самцов и самки. Модель имитирует основную социальную ячейку сообщества мышей, которая как минимум имеет разнополый состав, с другой стороны генетическая гетерогенность самцов дает возможность изучить эффект генотипа.
Цель исследования. Исследовать взаимосвязь генетических и социальных факторов в модуляции гормонального потенциала семенников в условиях in vivo у лабораторных мышей.
Задачи исследования:
- Провести оценку гормональной реакции семенников на действие ХГ in vivo у мышей 8 инбредных линий A/Sn, CBA/Lac, C57Bl, CC57Br, DBA, GR, PT и YT.
- Изучить особенности формирования гормональной реакции семенников на введение ХГ in vivo самцам мышей инбредных линий РТ и СВА/Lac в зависимости от дозы препарата, времени, прошедшего после его введения и генотипа животных.
- Исследовать генотип-зависимые изменения тестикулярного ответа на действие ХГ у самцов мышей инбредных линий СВА/Lac и РТ при длительном (5 дней) содержании с самкой.
- Изучить влияние стабильной социальной иерархии на реакцию семенников к действию ХГ in vivo у мышей инбредных линий СВА/Lac и РТ в зависимости от генотипа.
Положения, выносимые на защиту:
- Введение хорионического гонадотропина in vivo самцам мышей инбредных линий выявляет генотипические различия в гормональном потенциале семенников и расширяет диапазон генетической изменчивости, указывая на генетическую предрасположенность к реакции на данный лекарственный препарат.
- Особенности формирования гормональной реакции семенников на введение ХГ in vivo зависят от генотипа. Выраженная ХГ-зависимая активация тестикулярного стероидогенеза у мышей инбредных линий, выявляющая межлинейные различия в гормональном потенциале семенников наблюдается при введении 10 МЕ ХГ спустя 120 мин после введения препарата.
- У самцов мышей инбредных линий РТ и СВА/Lac при длительном (5 дней) содержании с самкой происходит повышение гормональной реакции семенников на введение ХГ в зависимости от генотипа самца.
- Условия стабильной социальной иерархии модифицируют гормональную функцию семенников. У самцов мышей инбредных линии PT и CBA/Lac наблюдается снижение реакции семенников на введение ХГ. Направленность и выраженность изменений базальных гормональных параметров зависят от генотипа и социального статуса самца.
Научная новизна исследования. Используя набор инбредных линий мышей, впервые показано, что при введении ХГ in vivo гормональная реакция семенников на этот препарат зависит от генотипа. У самцов мышей 8 инбредных линий показаны генотипические различия в реакции семенников на действие ХГ in vivo.
Впервые показано, что у самцов мышей инбредных линий PT и CBA/Lac, не отличающихся по базальному уровню тестостерона в крови и его содержанию в семенниках, генотипические различия по гормональной реакции семенников на введение ХГ обусловлены особенностями формирования гормонального ответа семенников на введение ХГ. Максимальные уровень тестостерона в крови и его содержание в семенниках у самцов линии CBA/Lac наблюдались при введении меньшей дозы ХГ и через более короткий промежуток времени по сравнению с PT. Реакция семенников на введение одной и той же дозы препарата различалась – у самцов линии PT она существенно превосходила таковую у CBA/Lac. У самцов мышей инбредных линий PT и CBA/Lac введение ХГ in vivo в дозах 10 МЕ и выше через 120-240 мин вызывает активацию тестикулярного стероидогенеза, приводящую к выявлению межлинейных различий по гормональному потенциалу семенников.
Впервые установлено, что у самцов мышей инбредных линий PT и CBA/Lac длительное (5 дней) содержание самца с самкой не изменяет базальный уровень тестостерона в крови и его содержание в семенниках, но усиливает реакцию семенников к действию ХГ у самцов линии PT, но не CBA/Lac.
С применением оригинальной экспериментальной модели социальной иерархии впервые установлено снижение стимулированного ХГ уровня тестостерона в крови и его содержания в семенниках у самцов мышей инбредных линий PT и CBA/Lac вне зависимости от социального ранга. Однако приобретение доминантного ранга у самцов линии PT оказывало стимулирующее влияние на базальный уровень тестостерона в крови и его содержание в семенниках.
Теоретическая и практическая значимость исследования. Теоретическое значение работы состоит в получении новых фундаментальных знаний о гормональном ответе организма на классический стимулятор тестикулярного стероидогенеза – хорионический гонадотропин. Принципиальную теоретическую значимость имеет установление роли генотипа, а также социальных взаимодействий между особями в сообществе в формировании индивидуального фармакологического ответа на ХГ.
Выявленный генотип-зависимый эффект ХГ на тестикулярный стероидогенез может быть рекомендован к дальнейшему использованию в клинической и ветеринарной практике для прогнозирования фармакологического ответа на ХГ и разработки индивидуальных способов коррекции тестостерондефицитных состояний, что позволит повысить эффективность и безопасность его применения. Следует так же учитывать, что эффект ХГ на тестикулярный стероидогенез может быть модифицирован социальными условиями.
Результаты исследования используются в курсе лекций по репродуктивной физиологии на кафедре физиологии, анатомии и безопасности жизнедеятельности Новосибирского государственного педагогического университета и могут быть использованы в других университетах биологического и медицинского профилей.
Апробация работы. Представленные в работе данные обсуждались на VI Сибирском физиологическом съезде (Барнаул, 2008), XLVII Международной научной студенческой конференции «Студент и научно-технический прогресс» (Новосибирск, 2009), V Съезде Вавиловского общества генетиков и селекционеров (Москва, 2009), 12-th Rodens et Spatium The International Conference on Rodent Biology (Zonguldak, Turkey, 2010), XXI Съезде физиологического общества им. И.П. Павлова (Калуга, 2010).
Публикации. По результатам исследований опубликовано 8 работ, в том числе 3 статьи в рецензируемых журналах, рекомендованных ВАК РФ для публикации основных научных результатов диссертации на соискание ученой степени кандидата наук.
Структура и объем диссертации. Работа состоит из введения, обзора литературы, материалов и методов, результатов работы, обсуждения, выводов, списка литературы, включающего 112 источников, в том числе 86 на английском языке, а также списка используемых в работе сокращений. Материал изложен на 90 страницах, содержит 13 рисунков и 3 таблицы.
Финансовая поддержка. Задачи настоящей работы являются дополнением к теме работ, выполняемых по плану Института цитологии и генетики СО РАН 012.01.000797 – Физиологическая генетика эндокринных функций поведения и доместикации. Исследования проводились при поддержке Российского фонда фундаментальных исследований (гранты № 06-04-48937 и 09-04-00930) и Президиума СО РАН (Комплексный интеграционный проект СО РАН – № 5.11).
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Для экспериментальных исследований использовали взрослых (возраст 90 дней) самцов мышей инбредных линий не имеющих сексуального опыта. Для оценки реакции семенников на действие ХГ использовали 252 самца восьми инбредных линий мышей – A/Sn, CBA/Lac, C57Bl/6J, CC57Br, DBA/2J, GR, PT и YT по 10-15 самцов каждого генотипа. Для изучения особенности формирования гормональной реакции на введение ХГ и влияния социальных взаимодействий на гормональный потенциал семенников выбраны 2 инбредные линии мышей PT и CBA/Lac, как контрастные по реакции семенников на действие ХГ, а также как наиболее изученные в отношении социального поведения (Осадчук, Науменко, 1981; Науменко др., 1983; Осадчук, 1990; Брагин и др., 2006; Осадчук и др., 2010). Особенности формирования гормональной реакции на введение ХГ изучали на 189 самцах мышей инбредных линий РТ и СВА/Lac, а эффекты длительного содержания с самкой – на 130 самцах тех же линий. В экспериментах по социальной иерархии использовали 228 самцов линий PT и CBA/Lac, по 114 самцов каждого генотипа. Мышей содержали в стандартных условиях вивария Института цитологии и генетики СО РАН при постоянном фотопериоде (свет/темнота – 12/12) и температуре (+24С0), пищу и воду животные получали без ограничений.
Экспериментальные подходы и процедуры. Для снятия группового эффекта за 4-5 суток до проведения эксперимента животных подвергали одиночному содержанию (Marchlewska-Koj, 1997). Для исследования эндокринного потенциала семенников использовали коммерческий препарат ХГ человека (Прегнил, фирма «Н.В. Органон», Нидерланды), который разводили физиологическим раствором до необходимой концентрации и вводили самцам подкожно.
Для проведения феногенетического анализа гормональной реакции семенников на действие ХГ самцам мышей 8 инбредных линий раствор ХГ вводили в объеме 200 мкл, содержащем 10 МЕ ХГ, за 120 минут до декапитации. Контролем служили животные тех же генотипов, которым вводили физиологический раствор в объеме 200 мкл за 120 минут до декапитации.
При исследовании особенностей развития гормональной реакции на действие ХГ для изучения дозозависимых эффектов препарат вводили в объеме 200 мкл, содержащем 5, 10 и 20 МЕ ХГ, за 120 минут до декапитации. Контролем служили животные, которым вводили 200 мкл физиологического раствора за 120 минут до декапитации. Для изучения временной динамики гормонального ответа препарат вводили в объеме 200 мкл, содержащем 10 МЕ, за 20, 40, 60, 120 и 240 минут до декапитации. Контролем служили интактные животные, которым инъекции физиологического раствора не проводили. В предварительном эксперименте установлено, что у самцов PT и CBA/Lac введение физиологического раствора в объеме 200 мкл за 120 минут до декапитации не вызывало изменений в уровне тестостерона в крови и его содержании в семенниках по сравнению с интактными самцами, поэтому в некоторых экспериментах в качестве контроля к введению ХГ использовали интактных животных.
Хемосенсорная стимуляция тестикулярного стероидогенеза, индуцируемая феромонами самки, является нейроэндокринным рефлексом и не зависит от сексуального опыта. Показано, что у самцов мышей эндокринный ответ гипоталамо-гипофизарно-семенникового комплекса самца в ответ на предъявление сексуального стимула осуществляется с участием нейромедиаторов центральной нервной системы (Амстиславская, 2008), а выраженность гормонального ответа на присутствие за перегородкой самки зависит от генотипа самца (Осадчук, Науменко, 1981). Опыт нашей лаборатории показывает, что при получении гибридов (PT DD, CBA/Lac DD) величина помета не зависела от генотипа самца, т. е. не наблюдалось признаков неприятия самки самцами какого либо из генотипов. Кроме того, Осадчуком с соавторами показано, что число подходов и время, проведенное у перегородки рецептивной самкой линии DD, не отличалось при нахождении за перегородкой самца линии PT либо CBA/Lac, что говорит об одинаковом интересе самки к самцам обоих исследуемых генотипов (Осадчук и др., 2008). Поэтому, для исследования влияния продолжительного содержания с самкой на эндокринную функцию семенников к каждому самцу на 5 дней помещали взрослую самку линии DD (возраст 90 дней) не имеющую сексуального опыта. Данная методика по нашему мнению обеспечивает относительно стандартную половую стимуляцию, поэтому различия в гормональном уровне должны определяться главным образом генотипом исследуемых линий
За 120 минут до декапитации самцам вводили либо 200 мкл раствора ХГ, содержащего 10 МЕ ХГ, либо инъекции не проводили. В качестве контроля использовали животных, к которым самка не помещалась, ХГ также либо вводили в дозе 10 МЕ за 120 минут до декапитации, либо инъекции не проводили.
Для исследования эффектов доминантно-субординантных отношений на эндокринную функцию семенников использовали генетически гетерогенную этологическую модель социальной иерархии минимального социума. Социальная группа состояла из 2 взрослых (возраст 90 дней) самцов линии PT и CBA/Lac (по одному самцу от каждой линии) с максимально выровненной массой тела и взрослой (возраст 90 дней) самки линии DD. Дизайн эксперимента был следующим. Самца помещали в экспериментальную клетку и на следующий день к нему помещали самку. На 3 день к самцу с самкой помещали второго самца. Социальное поведение самцов в группе тестировали ежедневно в течение 5-ти последовательных дней (день подсадки второго самца – первый день наблюдений), а социальный ранг каждого самца оценивали ретроспективно по соотношению числа побед и поражений в агрессивных столкновениях. Было сформировано 114 гетерогенных групп, которые делили на 2 части: самцам первой группы вводили 200 мкл раствора ХГ, содержащего 10 МЕ ХГ, а второй – физиологический раствор за 120 минут до декапитации. В качестве контроля к этому эксперименту использовали гормональные показатели самцов, содержащихся в течение 5 дней с самкой. Это позволило отделить в нашей модели социальной иерархии эффекты собственно социальной конкуренции от влияния, которое оказывало на тестикулярную функцию присутствие самки.
По окончании поведенческих тестов самцов декапитировали для дальнейшего исследования гормонального статуса. Периферическую кровь собирали, центрифугировали 20 мин при 3000 об/мин и +4оС. Сыворотку хранили при -400С до определения тестостерона. Семенники гомогенизировали на ультразвуковом гомогенизаторе в 500 мкл фосфатного буфера, гомогенаты хранили при -40оС до определения тестостерона.
Определение тестостерона в сыворотке крови и гомогенатах семенников. Тестостерон определяли иммуноферментным методом с использованием наборов «Стероид ИФА-тестостерон-01» фирмы «Алкор Био» (Санкт-Петербург) согласно прилагаемой инструкции. Градуировочную кривую для расчета содержания тестостерона в семенниках строили с использованием стандарта тестостерона после разведения фосфатным буфером, а кривую для определения концентрации гормона в сыворотке – после разведения стандарта тестостерона мышиной сывороткой, не содержащей стероидов.
Статистическая обработка результатов. Статистическую обработку данных проводили с использованием дисперсионного анализа (ANOVA), пакет компьютерных программ STATISTICA (версия 6.0). Для всех исследуемых параметров высчитывали выборочную среднюю и ошибку выборочной средней. Различия считали статистически достоверными при p<0.05. Статистическую обработку гормональных данных проводили двухфакторным (главные факторы генотип и введение ХГ) и трехфакторным дисперсионным анализом (главные факторы генотип, введение ХГ и самка). Массу тела самцов в экспериментах по содержанию самцов с самкой и по социальной иерархии анализировали как фактор с повторными внутрииндивидуальными измерениями (repeated measures factor). Для анализа результатов экспериментов по социальной иерархии применяли двухфакторный дисперсионный анализ (главные факторы генотип и социальный статус, либо генотип и социальная группа). В рамках дисперсионного анализа для сравнения групп применяли тесты множественного сравнения Duncan, Fisher и Newman-Keuls. Для выявления корреляционной зависимости между уровнем тестостерона в крови и его содержанием в семенниках для каждого генотипа высчитывали коэффициент корреляции Пирсона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Феногенетическая оценка гормональной реакции семенников на действие хорионического гонадотропина у самцов мышей 8 инбредных линий.
Базальный уровень тестостерона в крови и его содержание в семенниках слабо варьировали у самцов 8 инбредных линий (рис. 1), но установлено достоверное влияние генотипа на уровень тестостерона в крови (F7,113 = 2.89, p<0.05) и его содержания в семенниках (F7,111 = 3.73, p<0.05). У самцов линии A/Sn базальный уровень тестостерона в крови достоверно повышен по сравнению с CBA/Lac, CC57Br, PT и YT, а содержание гормона в семенниках достоверно выше, чем у самцов остальных линий (p<0.05). Различий по базальным гормональным показателям между остальными линиями не обнаружено.
Введение ХГ значительно увеличивало уровень тестостерона в крови (F7, 221 = 700.84, p<0.001) и его содержание (F7, 221 = 751.39, p<0.001) в семенниках (рис. 1). Например, введение ХГ увеличивало содержание тестостерона в семенниках в 10-79 раз в зависимости от линии мышей.
При введении ХГ наблюдались межлинейные различия по уровню тестостерона в крови (F7, 221 = 3.56, p<0.001) и его содержанию в семенниках (F7, 221 = 23.31, p<0.001). У самцов лабораторных мышей диапазон генетических различий по гормональной функции семенников существенно расширялся при введении ХГ по сравнению с таковым для базальных значений. Например, базальный уровень тестостерона в крови составлял 0.84±0.13 – 7.23±2.08 нг/мл, содержание тестостерона в семенниках 3.56±0.46 – 42.45±11.66 нг/оба семенника, а стимулированные гормональные параметры 29.24±1.85 – 82.49±5.90 нг/мл и 68.86±7.97 – 342.54±13.48 нг/оба семенника, соответственно.
В нашем наборе инбредных линий максимальным значением стимулированного уровня тестостерона в крови характеризовалась линия A/Sn, минимальным CBA/Lac, максимальным значением стимулированного содержания тестостерона в семенниках линия PT, минимальным DBA.
Существует целый ряд факторов, которые делают существенный вклад в формирование межлинейных различий по уровню тестостерона в крови и его содержанию в семенниках. Одной из установленных причин являются генетические различия в активности ферментов стероидогенеза (Осадчук, Свечников, 1998). Другой возможной причиной могут быть генетические различия в функциональной активности и/или количестве рецепторов к ЛГ и ХГ (ЛГ/ХГР), поскольку лютеинизирующий гормон и его аналог ХГ связываются на поверхности клеток Лейдига с одним и тем же рецептором, стимулируя целую цепь реакций, результатом которых является усиление биосинтеза тестостерона (Saez, 1994; Dufau, 1998; Lei et al., 2001).
Известно, что индивидуальный фармакологический ответ на лекарственное средство зависит от множества факторов, таких как пол, возраст, сопутствующие заболевания, совместно применяемые лекарственные средства, характер питания, вредные привычки и т.д. Наши исследования предполагают, что эффекты от применения хорионического гонадотропина могут детерминироваться генетическими особенностями особи. Данный набор инбредных линий мышей представляет собой удачную модель для проведения фармакологических исследований, поскольку она позволяет выявлять генетические различия в действии лекарственных препаратов.
 | Рис. 1. Базальный и стимулированный введением ХГ уровень тестостерона в крови (А) и его содержание в семенниках (Б) у самцов мышей восьми инбредных линий. *p<0.05 – достоверность различий между базальным и стимулированным значением. Количество животных в группе варьировало от 10 до 15. |
В условиях физиологического «покоя» наблюдалась положительная взаимосвязь между уровнем тестостерона и его содержанием в семенниках (r=0.78, p<0.05), тогда как после введения ХГ взаимосвязь между этими показателями отсутствовала (r=0.25). Введение ХГ может вызывать изменение в перераспределении тестостерона между кровью и семенниками ((Maddocks, Setchell, 1989), которое может быть частично объяснено сосудорасширяющим действием ХГ, однако такой эффект изучен только у самок (Hermsteiner et al., 1999;Toth et al., 2001; Rao, Alsip, 2001).
При оценке массы тела и семенников у самцов мышей восьми инбредных линий обнаружено достоверное влияние генотипа на оба показателя (F7, 245 = 39.78, p<0.001 для массы тела и F7, 242 = 114.79, p<0.001 для массы семенников). Не обнаружено достоверной взаимосвязи между реакцией семенников на действие ХГ, массой тела или семенников. Выбранные нами для дальнейшего изучения инбредные линии PT и CBA/Lac достоверно отличались по массе тела (рис. 2А): самцы линии PT весили меньше, чем CBA/Lac (p<0.001), однако масса семенников (рис. 2Б) у самцов PT была больше, чем у CBA/Lac (p<0.001). Очевидно, что индекс семенников (отношение массы семенников к массе тела) у самцов линии PT выше по сравнению с CBA/Lac (p<0.001, рис. 5В).
 |
| Рис. 2. Масса тела (А), семенников (Б) и индекс семенников – отношение массы семенников к массе тела (В) у самцов мышей восьми инбредных линий. +p<0.05 – достоверность различий между линиями PT и CBA/Lac. Количество животных в группе варьировало от 29 до 31. |
Гормональная реакция семенников на действие хорионического гонадотропина у самцов мышей инбредных линий СВА/Lac и PT: эффект дозы и времени после введения препарата.
Исследование дозозависимых эффектов и временной динамики тестикулярного ответа на введение ХГ у самцов мышей инбредных линий PT и CBA/Lac показало, что они имеют генотип-зависимый характер.
Двухфакторный дисперсионный анализ позволил установить, что на уровень тестостерона в крови достоверно влияла доза ХГ (F3, 99 = 54.05, p<0.001) и генотип (F1, 99 = 119.94, p<0.001). Обнаружено достоверное взаимодействие главных факторов (F3, 99 = 10.92, p<0.001). Межлинейные различия по уровню тестостерона в крови наблюдались при введении 5 МЕ ХГ и сохранялись при увеличении дозы (рис. 3А). В исследованном диапазоне доз самцы линии PT обладали более выраженной гормональной реакцией на введение ХГ по сравнению с CBA/Lac.
На содержание тестостерона в семенниках достоверно влияла доза ХГ (F3, 98 = 52.27, p<0.001) и генотип (F1, 98 = 26.15, p<0.001). Наблюдалось достоверное взаимодействие главных факторов (F3, 98 = 6.26, p<0.001), связанное с тем, что семенники двух исследованных линий мышей по-разному реагировали на увеличение дозы ХГ. У самцов линии CBA/Lac содержание тестостерона в семенниках достигало максимальных значений при введении 5 МЕ ХГ (p<0.001), в дальнейшем не меняясь при увеличении дозы. У самцов линии PT содержание тестостерона в семенниках росло при увеличении дозы ХГ и достигало максимальных значений при введении 20 МЕ (p<0.001, рис. 3Б). Межлинейные различия по содержанию тестостерона в семенниках наблюдались при введении 10 МЕ ХГ и сохранялись при дальнейшем увеличении дозы (рис. 3Б). Таким образом, оптимальной дозой ХГ, дифференцирующей данные генотипы мышей, можно считать 10 МЕ.
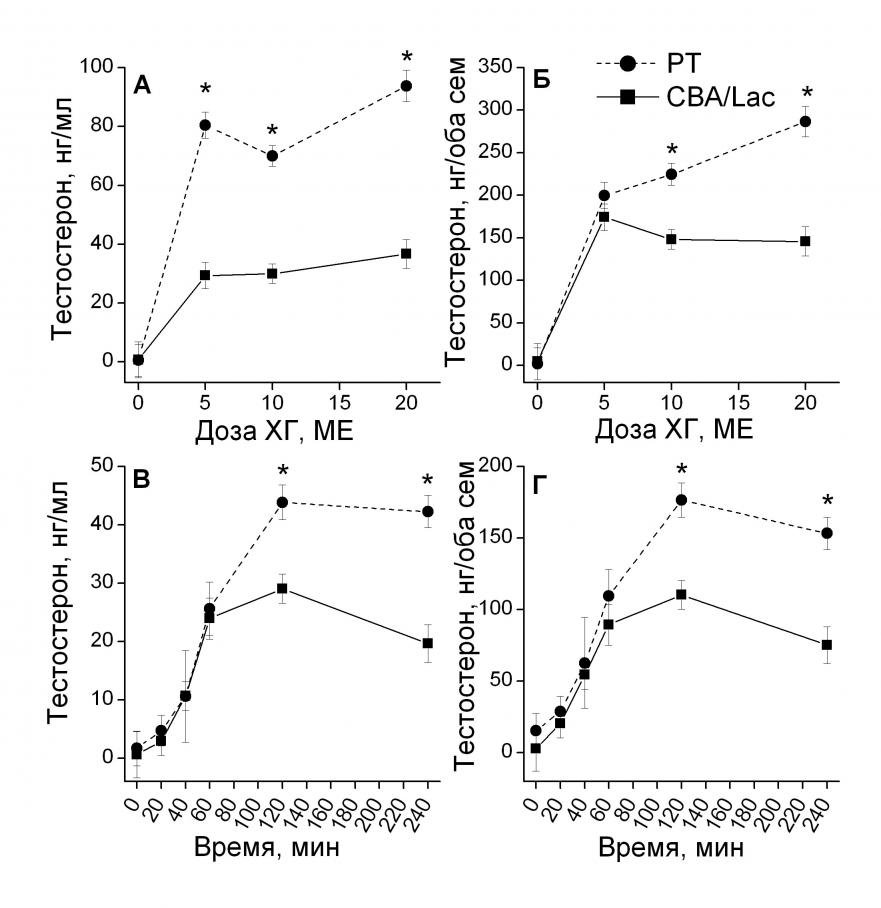 | Рис. 3. Уровень тестостерона в крови (А, В) и его содержание в семенниках (Б, Г) у самцов инбредных линий PT и CBA/Lac А, Б – через 120 минут после введения различных доз ХГ. Контроль (0 МЕ) – введение физиологического раствора. В, Г – в различные временные интервалы после введения 10 МЕ ХГ. Контроль (0 минут) – интактные животные. *p<0.05 – достоверность межлинейных различий. Количество животных в группе варьировало от 10 до 15. |
При исследовании временной динамики гормонального ответа на введение 10 МЕ ХГ показано, что уровень тестостерона в крови достоверно зависит от времени, прошедшего после введения препарата (F5, 68 = 50.45, p<0.001), и генотипа (F1, 68 = 10.59, p<0.05). Наблюдалось достоверное взаимодействие главных факторов (F5, 68 = 4.52, p<0.05). Уровень тестостерона в крови у самцов обеих линий увеличивался после инъекции ХГ до 60 минуты, но впоследствии у самцов линии CBA/Lac он стабилизировался, а у PT – продолжал расти и достигал максимума только на 120 минуте. Через 120 и 240 минут после введения ХГ наблюдались достоверные межлинейные различия по уровню тестостерона: он был выше у самцов РТ по сравнению с CBA/Lac (p<0.05, рис. 3В).
На содержание тестостерона в семенниках достоверно влияло время, прошедшее после введения ХГ (F5, 68 = 49.77, p<0.001), и генотип (F1, 68 = 17.17, p<0.001). Обнаружено достоверное взаимодействие главных факторов (F5, 68 = 4.07, p<0.05). У линии CBA/Lac содержание гормона к 60 минуте после введения ХГ стабилизировалось, а у линии PT продолжало расти и достигало максимума к 120 минуте, сохраняясь на этом же уровне до 240 минуты (рис. 3Г). Межлинейные различия по содержанию тестостерона в семенниках наблюдались через 120 и 240 минут после введения ХГ (p<0.01), поэтому оптимальным временным интервалом для выявления межлинейных различий можно считать 120 мин.
Из двух исследованных линий самцы линии PT характеризовались более выраженным гормональным ответом семенников на введение ХГ по сравнению с CBA/Lac. Например, через 120 минут после введения 10 ME ХГ содержание тестостерона в семенниках у самцов линии PT превосходило контрольные значения в 67 раз, а у CBA/Lac – только в 12 раз. С другой стороны, полученные данные подтверждают, что наиболее достоверную информацию о генетических особенностях гормонального потенциала семенников дают измерения гормональных показателей при введении ХГ, а не базальных величин, поскольку базальные показатели у 2 изучаемых линий мышей не отличались.
Можно предположить, что причины обнаруженных нами межлинейных различий в особенностях формирования гормональной реакции на введение ХГ могут определяться наследственно обусловленными особенностями процессов биосинтеза, метаболизма и выведения гормона из организма. Не исключено, что наблюдаемые нами межлинейные различия могут определяться различным количеством и/или функциональной активностью рецепторов ЛГ.
Гормональная реакция семенников на действие хорионического гонадотропина при длительном содержании с самкой у самцов мышей инбредных линий PT и CBA/Lac.
Трехфакторный анализ уровня тестостерона в крови и его содержания в семенниках (главные факторы – генотип, присутствие самки и введение ХГ) позволил установить достоверное влияние всех факторов, а также их двухфакторные и трехфакторное взаимодействие. При введении ХГ контрольным животным наблюдали достоверное увеличение уровня гормона в крови (F1, 122 = 665.72, p<0.001) и его содержания в семенниках (F1, 122 = 482.10, p<0.001) у самцов обеих линий, причем более выраженный подъем отмечался у самцов РТ по сравнению с CBA/Lac (p<0.001, рис. 4). Длительное содержание с самкой не повлияло на базальный уровень гормона и его содержание в семенниках у самцов обеих линий, но повышало реакцию семенников на действие ХГ (F1, 122 = 8.24, p<0.001 для уровня тестостерона в крови и F1, 122 = 7.52, p<0.001 для содержания тестостерона в семенниках). Этот эффект зависел от генотипа самца (F1, 122 = 108.70, p<0.001 для уровня и F1, 122 = 25.72, p<0.001 для содержания тестостерона в семенниках). Увеличение гормонального потенциала семенников в присутствии самки наблюдалось лишь у самцов линии PT.
Можно предположить, что феромоны самки могут непосредственно влиять на реактивность клеток Лейдига к ЛГ (или к его аналогу ХГ). Не исключено, что феромоны самки могут увеличивать количество или функциональную активность рецепторов к ЛГ на клетках Лейдига. Такое предположение, разумеется, требует экспериментальной проверки.
У самцов РТ длительное присутствие самки повышало содержание тестостерона в семенниках в ответ на введение ХГ, но снижало его уровень в крови. Такая своеобразная реакция у самцов РТ наблюдалась и при кратковременном помещении самки (Осадчук и др., 2008). Объяснение этому факту может быть следующее. Известно, что запахи самки активизируют у самцов метаболические процессы, в частности, усиливают спонтанный синтез иммуноглобулинов и тромбоцитов, способствуют перераспределению иммунных клеток, которые перемещаются из кровяного русла на периферию, вследствие чего мобилизуются внутренние ресурсы, необходимые для размножения (Мошкин и др., 2005). Можно предположить, что у самцов в присутствии самки усиливается метаболизм тестостерона и уменьшается его уровень в крови. Не исключено, что увеличение содержания тестостерона в семенниках у самцов линии PT может быть связано с некоторым уменьшением его выброса из клеток Лейдига в кровь.
 | Рис. 4. Уровень тестостерона в крови (А) и его содержание в семенниках (Б) у самцов инбредных линий PT и CBA/Lac после длительного содержания с самкой (5 дней) и введения ХГ (10 МЕ за 120 минут до декапитации). +p<0.05 – достоверность влияния самки. Количество животных в группе варьировало от 12 до 22. Примечания: К – контроль (без самки и введения ХГ), самка – длительное содержание с самкой. |
Двухфакторный дисперсионный анализ позволил установить достоверное влияние длительного содержания с самкой (F1, 68 = 5.97, p<0.05) и генотипа (F1, 68 = 81.50, p<0.001) на массу тела самцов (рис. 5А). Достоверного взаимодействия факторов не установлено. У самцов линии CBA/Lac масса тела достоверно выше по сравнению с PT (p<0.001), после содержания с самкой изменения массы тела у самцов имели однонаправленный характер – она незначительно, но достоверно (p<0.05) снизилась. Как уже упоминалось, у самцов в присутствии самок активизируются метаболические процессы (Мошкин и др., 2005), таким образом, снижение массы тела у самцов в присутствии самок может быть обусловлено повышением энергозатрат.
Обнаружено достоверное влияние генотипа (F2, 172 = 227.90, p<0.05) и длительного содержания с самкой (F2, 172 = 5.88, p<0.05) на массу семенников (рис. 5Б). Наблюдалось достоверное взаимодействие факторов (F2, 172 = 5.88, p<0.05). Масса семенников в присутствии самки достоверно увеличивалась только у самцов линии CBA/Lac (p<0.05). Такое увеличение массы семенников с одной стороны может быть обусловлено активацией феромонами самки притока крови к семенникам. С другой стороны, известно, 60% массы семенников складывается за счет семенных канальцев (Нишлаг, Бере, 2005). Увеличение размера семенных канальцев вследствие активации феромонами самки биосинтеза тестостерона и, следовательно, сперматогенной функции, может быть причиной увеличения массы семенников.
Таким образом, взаимоотношения между особями противоположного пола могут менять гормональную реакцию семенников на действие ХГ, а также влиять на массу тела и семенников, однако эти эффекты определяются генетическими особенностями самцов.
 | Рис. 5. Масса тела (А) и семенников (Б) у самцов инбредных линий PT и CBA/Lac после длительного содержания с самкой (5 дней). +p<0.05 – достоверность различий между группами. Количество животных в группе варьировало от 30 до 40. |
Гормональная реакция семенников на действие хорионического гонадотропина в условиях стабильной социальной иерархии у самцов мышей инбредных линий СВА/Lac и PT.
Одной из задач настоящего исследования было выявление эффектов социальной иерархии на гормональную функцию семенников. На первом этапе представлялось целесообразным продемонстрировать влияние генотипа, социального ранга и их взаимодействия на гормональную функцию семенников без стимуляции ХГ (рис. 6).
Двухфакторным дисперсионным анализом (главные факторы – генотип и социальный ранг) не выявлено влияния генотипа на базальный уровень тестостерона в крови и его содержание в семенниках. Показано достоверное влияние социального ранга на эти показатели (F2, 149 = 6.49, p<0.05 для уровня тестостерона в крови и F2, 149 = 4.63, p<0.05 для содержания тестостерона в семенниках). Взаимодействия между факторами не установлено. Эффекты социального ранга на уровень тестостерона в крови и его содержание в семенниках имели однонаправленный характер у самцов обеих линий – у доминантов исследуемые гормональные показатели достоверно выше, чем у субординантов (p<0.05, рис. 6). У субординантных самцов обоих генотипов уровень тестостерона в крови и его содержание в семенниках статистически не отличались от контрольных значений (рис. 6). Полученные данные свидетельствуют о том, что в условиях стабильной социальной иерархии может наблюдаться стимулирующее влияние доминантного ранга на уровень тестостерона в крови и его содержание в семенниках у самцов обоих изучаемых генотипов.
Ранее с использованием аналогичной модели социальной иерархии, но без присутствия самки, не установлено влияния доминантного ранга на продукцию тестостерона семенниками (Осадчук и др., 2010). Авторы предположили, что межранговые различия в андрогенной активности семенников транзиторны. В период установления социального ранга у самцов доминантов по сравнению с субординантами тестостерон действительно более активно секретируется семенниками, что обусловлено повышенной агрессией. В период стабильных иерархических отношений межранговые различия по уровню тестостерона могут исчезать вместе со снижением агрессии, поскольку она сопряжена со значительными энергетическими затратами и поэтому не адаптивна (Creel, 2001; Poisbleau et al., 2005).
 | Рис. 6. Базальный уровень тестостерона в крови (А) и его содержание в семенниках (Б) у самцов инбредных линий PT и CBA/Lac в период стабильной социальной иерархии. +p<0.05 – достоверность различий между группами. Количество животных в группе варьировало от 12 до 44. Примечания: в качестве контроля взяты гормональные данные, полученные в эксперименте по длительному содержанию самцов с самкой, т.е. в отсутствии доминантно–субординантных отношений. |
Можно предположить, что обнаруженное в наших экспериментах стимулирующее влияние доминантного ранга на тестикулярный стероидогенез формируется за счет эффектов присутствия самки. Действительно, кратковременное помещение рецептивной самки в социальную группу самцов мышей активизировало тестикулярный стероидогенез только у самцов доминантов (Осадчук и др., 2010).
Далее были рассмотрены эффекты доминантно-субординантных отношений на гормональный потенциал семенников (рис. 7), в частности проведен анализ межранговых различий в гормональной функции семенников при стимуляции ХГ. Двухфакторный дисперсионный анализ позволил установить достоверное влияние генотипа на стимулированные ХГ уровень тестостерона в крови (F1, 102 = 5.69, p<0.05) и его содержание в семенниках (F1, 101 = 42.13, p<0.001). Достоверного влияния социального ранга на гормональные показатели или взаимодействия факторов не установлено. Уровень тестостерона в крови и его содержание в семенниках достоверно выше у самцов линии PT по сравнению с CBA/Lac (p<0.05). Следовательно, несмотря на отчетливые поведенческие сигналы социального доминирования в экспериментальных группах, социальная иерархия не дифференцировала гормональный потенциал семенников у самцов обоих генотипов. Кроме того, в условиях стабильной социальной иерархии самцы линии PT сохраняли свой более высокий, по сравнению с CBA/Lac, гормональный потенциал семенников.
 | Рис. 7. Уровень тестостерона в крови (А) и его содержание в семенниках (Б) у самцов инбредных линий PT и CBA/Lac при стимуляции ХГ в период стабильной социальной иерархии. +p<0.05 – достоверность различий между группами. Количество животных в группе варьировало от 14 до 40. |
Поскольку не было обнаружено достоверных межранговых различий по гормональным показателям у самцов обеих линий, то целесообразно было сравнить гормональный потенциал семенников у самцов в социально структурированной группе (без разделения по рангу) с таковым у адекватного контроля (длительное содержание с самкой), т.е. выяснить, как условия группового содержания влияют на гормональную реакцию семенников на введение ХГ.
Показано достоверное влияние генотипа (F1, 132 = 96.54, p<0.001) и группового содержания (F2, 132 = 305.87, p<0.001) на стимулированный ХГ уровень тестостерона в крови. Наблюдалось достоверное взаимодействие главных факторов (F1, 132 = 49.02, p<0.001). В условиях стабильной социальной иерархии стимулированный ХГ уровень тестостерона в крови достоверно снижался у самцов обеих линий по сравнению с контролем (рис. 8А). Показано достоверное влияние генотипа (F1, 131 = 68.44, p<0.001) и группового содержания (F2, 131 = 9.37, p<0.001) на стимулированное ХГ содержание тестостерона в семенниках. В условиях стабильной социальной иерархии стимулированное ХГ содержание тестостерона в семенниках снижалось, однако достоверные отличия от контроля (p<0.05) по этому показателю мы наблюдали только у линии PT (рис. 8Б). Следовательно, содержание животных в социально структурированной группе приводит к снижению гормонального потенциала семенников у самцов мышей обеих инбредных линий, более выраженному у линии РТ.
Обнаруженное снижение гормонального потенциала семенников при групповом содержании животных может быть объяснено с позиций социального стресса, который испытывают самцы на начальной стадии формирования социальной иерархии. У самцов лабораторных мышей в экспериментальной модели социальной иерархии в первые часы после формирования группы наблюдалось резкое повышение уровня кортикостероидов и снижение уровня тестостерона в крови (Осадчук, 1990).
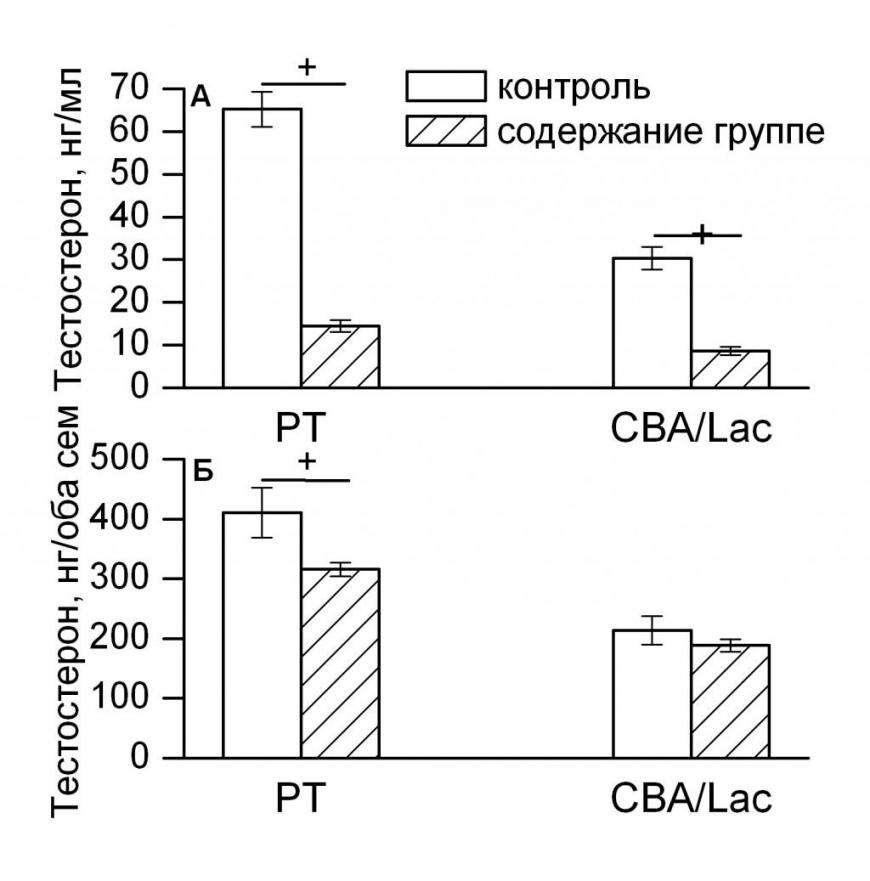 | Рис. 8. Уровень тестостерона в крови (А) и его содержание в семенниках (Б) при стимуляции ХГ у самцов инбредных линий PT и CBA/Lac в социально-структурированной группе. + – достоверность различий между группами (p<0.05); количество животных в группе варьировало от 15 до 54. Примечания: В качестве контроля взяты стимулированные ХГ гормональные показатели, полученные в эксперименте по длительному содержанию самцов с самкой, т.е. в отсутствии доминантно-субординантных отношений. |
С другой стороны, известно, что в стрессовых ситуациях повышенный уровень кортикостероидов может снижать реактивность семенников к ЛГ (Rivier, Rivest, 1991; Tamashiro et al., 2005), т.е. может приводить к ослаблению реакции семенников и на действие экзогенного ХГ. Можно предположить, что в нашей экспериментальной модели социальной иерархии у самцов мышей может снизиться функциональная активность и/или количество рецепторов к ЛГ/ХГ на клетках Лейдига, что в свою очередь вызовет уменьшение гормональной реакции семенников на стимуляцию ХГ. Такое предположение может быть предметом дальнейшего исследования.
Интересно, что в социально структурированной группе у самцов линии CBA/Lac содержание тестостерона в семенниках сохраняется на уровне контрольных значений. Можно предположить, что у самцов этого генотипа в семенниках в ответ на стрессовое воздействие «запускается» механизм активации фермента 11-гидростероиддегидрогеназа (11ГСД). В клетках Лейдига 11ГСД превращает кортикостерон в 11-дегидрокортикостерон, который, в отличие от кортикостерона, не способен связываться с внутриклеточными рецепторами глюкокортикоидов и подавлять продукцию тестостерона (Leckie et al., 1998; Tamashiro et al., 2005). Если активность или количество фермента 11-ГСД у самцов линии CBA/Lac выше, чем у самцов линии PT, они способны лучше противостоять негативным эффектам социального стресса на тестикулярную функцию. Следует отметить, что это предположение также нуждается в экспериментальной проверке.
Измерение массы тела и семенников у самцов PT и CBA/Lac позволило установить, что групповое содержание животных снижало массу тела (F1, 213 = 14.43, p<0.001, рис. 9А). Как в контроле, так и после содержания в группе масса тела у мышей линии CBA/Lac была больше, чем у PT (F1, 213 = 48.21, p<0.001).
Однако, при установлении социальной иерархии социальный статус влиял на массу тела (F1, 213 = 7.17, p<0.05). Доминантные самцы весили больше, чем субординантные (рис. 9Б), однако достоверные различия по этому показателю между доминантами и субординантами наблюдались только у линии PT (p<0.05). Содержание в социально структурированной группе не повлияло на массу семенников у самцов обеих линий, не было обнаружено и межранговых различий (рис. 9В). Масса семенников была больше у самцов линии PT по сравнению с CBA/Lac (F2, 220 = 76.62, p<0.001).
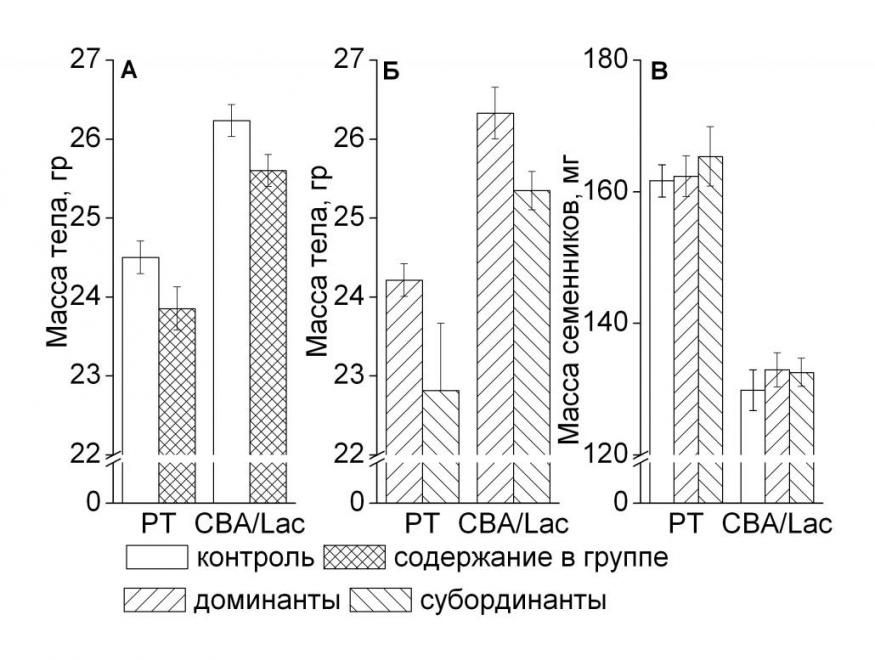 | Рис. 9. Масса тела (А, Б) и семенников (В) у самцов инбредных линий PT и CBA/Lac в период стабильной социальной иерархии. +p<0.05 – достоверность различий между группами. Количество животных в группе варьировало от 28 до 84. Примечания: в качестве контроля взяты гормональные данные, полученные в эксперименте по длительному содержанию самцов с самкой, т.е. в отсутствии доминантно–субординантных отношений. |
Итак, в настоящей работе проведено комплексное исследование роли генотипа и социальных взаимодействий в регуляции гормональной функции семенников. В качестве показателей гормональной активности семенников рассматривали не только базальный уровень тестостерона в крови и его содержание в семенниках, но и гормональный потенциал семенников, который оценивали с помощью стимуляции тестикулярного стероидогенеза хорионическим гонадотропином. Основные результаты работы состояли в том, что уровень гормональной активности семенников и, в большей степени, их гормональный потенциал определяется генотипом животного, а социальные взаимодействия могут значительно модифицировать гормональный потенциал семенников в зависимости от генотипа животного. Таким образом, уровень функциональной активности семенников и, видимо, гипоталамо-гипофизарно-семенникового комплекса формируется при тесном взаимодействии генотипа и социальных факторов.
ВЫВОДЫ
- У самцов мышей 8 инбредных линий при стимуляции тестикулярного стероидогенеза хорионическим гонадотропином in vivo наблюдаются генотипические различия в реакции на данный препарат и происходит усиление фенотипического проявления наследственной изменчивости гормональной функции семенников.
- Дозозависимый эффект и временная динамика гормонального ответа на введение ХГ in vivo определяются генотипом. У самцов линии CBA/Lac максимальная гормональная реакция семенников наблюдается при введении меньшей дозы ХГ и через более короткий промежуток времени по сравнению с PT. В исследованном диапазоне доз самцы линии РТ характеризуются более выраженной гормональной реакцией на стимуляцию ХГ по сравнению с СВА/Lac.
- Под влиянием длительного содержания с самками реакция семенников на действие ХГ усиливается только у самцов линии РТ, но не СВА/Lac, в то время как базальный уровень тестостерона в крови и его содержание в семенниках не меняется у самцов обеих линий.
- В условиях стабильной социальной иерархии наблюдается повышение базального уровня тестостерона в крови и его содержания в семенниках у доминантных самцов мышей инбредных линий PT и CBA/Lac по сравнению субординантами. В тех же условиях происходит снижение стимулированных ХГ уровня тестостерона в крови и его содержания в семенниках у самцов обеих линий вне зависимости от социального ранга, более выраженное у самцов линии PT.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
По «Перечню лицензированных ВАК РФ журналов»
- (Зарубина) Е. А. Гормональная реакция семенников на хорионический гонадотропин у мышей инбредных линий СВА/Lac и РТ: эффект дозы и времени после введения препарата / Е. А. Дубовенко, Л. В. Дубовенко Осадчук // Бюл. экспер. биол. мед. – 2010. – Т. 150. – № 8. – C. 194–198.
- Дубовенко (Зарубина) Е. А. Межлинейные различия в реактивности семенников к действию хорионического гонадотропин: эффекты присутствия самки / Е. А. Дубовенко, Л. В. Осадчук // Рос. физиол. журн. им. Сеченова. – 2010. – Т. 96. – № 10. – C. 1024–1029.
- Зарубина (Дубовенко) Е. А. Феногенетический анализ реактивности семенников к действию хорионического гонадотропина у мышей инбредных линий / Е. А. Дубовенко, Л. В. Осадчук // Генетика. – 2011. – Т. 47. – № 2. – C. 249–254.
Публикации в других изданиях:
- Дубовенко (Зарубина) Е. А. Генотипические различия в реактивности семенников к действию хорионического гонадотропина у самцов лабораторных мышей / Е. А. Дубовенко, Л. В. Осадчук // VI Сибирский физиологический съезд. Тезисы докладов. – Барнаул: Принтэкспресс, 2008. – Т. 1. – C. 219.
- Дубовенко (Зарубина) Е. А. Реактивность семенников к действию хорионического гонадотропина у самцов лабораторных мышей: роль генотипа / Е. А. Дубовенко, Л. В. Осадчук // Мат. XLVII междунар. науч. студ. конф. «Студент и научно-технический прогресс». Новосиб. гос. ун-т. Новосибирск, 2009. – C. 13.
- Дубовенко (Зарубина) Е. А. Влияние генотипа и социальной иерархии на тестикулярный стероидогенез у самцов лабораторных мышей / Е. А. Дубовенко, Л. В. Осадчук // Тез. докл. V съезд Вавиловского общества генетиков и селекционеров. Москва, 2009. – С. 79.
- Dubovenko (Zarubina) E. A. Influence of a female exposition to the male on the testosterone testicular response to hCG in inbred mice strains / E. A. Dubovenko, L. V. Osadchuk // Abs. 12-th Rodens et spatium. The Int. conf. on rodents biol. Turkey, 2010. – P. 110
- Дубовенко (Зарубина) Е. А. Феногенетический анализ реактивности семенников к действию хорионического гонадотропина у мышей инбредных линий / Е. А. Дубовенко, Л. В. Осадчук // Тез. докл. XXI Съезд физ. общ. им. И. П. Павлова. Калуга: «Бэст-принт», 2010. – C. 193.

