Внутриклеточные механизмы регуляции биосинтеза вазопрессина.
На правах рукописи
ЧЕРНИГОВСКАЯ Елена Валерьевна
Внутриклеточные механизмы регуляции биосинтеза вазопрессина.
03.03.01 – Физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Санкт-Петербург
2010
Работа выполнена в лаборатории сравнительной сомнологии и нейроэндокринологии Учреждения Российской академии наук Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Официальные оппоненты: доктор биологических наук, профессор
Неворотин Алексей Иосифович
доктор биологических наук,
Ордян Наталья Эдуардовна
доктор биологических наук,
Пастухов Юрий Федотович
Ведущее научное учреждение: Учреждение Российской академии наук Институт цитологии и генетики Сибирского отделения РАН
Защита диссертации состоится «9» марта 2011 года в 11 часов на заседании диссертационного совета (Д 002.127.01) при Учреждении Российской академии наук Институте эволюционной физиологии и биохимии им. И.М. Сеченова РАН по адресу: 194223, г. Санкт-Петербург, пр. М. Тореза, 44
С диссертацией можно ознакомиться в библиотеке Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (194223, г. Санкт-Петербург, пр. Тореза, 44).
Автореферат разослан «______» _____________ 2010 г.
Ученый секретарь диссертационного совета,
доктор биологических наук, профессор М.Н. Маслова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Вазопрессинергические нейросекреторные нейроны гипоталамуса являются ключевым интегративным звеном центральной регуляции многих важнейших функций организма, таких как поддержание водно-солевого баланса, артериального давления, регуляция стрессорных реакций и многих других. Экспрессия вазопрессина определяется двумя взаимосвязанными процессами - синтезом белка и скоростью его выведения в общий кровоток в задней доле гипофиза. Регуляция функциональной активности нейросекреторных вазопрессинергических клеток гипоталамуса складывается из анализа сигнала, приходящего на рецепторы нейронов, и зависит от внутриклеточных механизмов, посредством которых этот сигнал передается в ядро клетки, где происходит транскрипция вазопрессина. На следующем этапе происходит синтез белка, его процессинг в ходе формирования секреторных гранул и их транспорт по аксонам в нейрогемальные отделы, где происходит выведение вазопрессина в кровь [Burbach, et al., 2001]. Очевидно, что все вышеперечисленные процессы зависят от множества факторов, которые включаются в регуляцию секреции вазопрессина на разных этапах. Эти факторы можно условно разделить на основные и модулирующие. Исследование регуляции вазопрессинергических нейронов осуществляется уже на протяжении многих лет. Однако сложность процессов, обеспечивающих функционирование нейронов в условиях поддержания водно-солевого баланса объясняет тот факт, что в настоящее время остаются неясными многие вопросы регуляции биосинтеза вазопрессина.
Один их них – характер влияния различных нейротрансмиттеров и нейромодуляторов, в том числе норадреналина и дофамина на уровень синтеза и скорость выведения вазопрессина в норме и при нарушении осмотического равновесия. Данные литературы по этому вопросу крайне противоречивы [Boudaba, et al., 2003; Kim, et al., 1989; Randle, et al., 1986], что возможно связано, во-первых, с широкой представленностью различных типов рецепторов катехоламинов в вазопрессинергических нейронах [Khanna, et al., 1993; Takano, et al., 1989], а, во-вторых, с возможностью участия различных внутриклеточных механизмов в передаче сигналов от рецепторов и вкладом в этот процесс различных модулирующих влияний. Одним из таких модуляторов является NO. Показано участие NO в регуляции вазопрессинергических нейронов, но и в этом случае данные противоречивы [Liu, et al., 1998; Lutz-Bucher and Koch, 1994]. Кроме того, было высказано предположение о возможности взаимодействия катехоламинов и NO в регуляции функциональной активности вазопрессинергических нейронов, но характер этих взаимоотношений на сегодняшний день не установлен [Vacher et al. 2003].
Развитию гипоталамуса в ходе раннего онтогенеза посвящено множество исследований. Известен источник и приблизительные сроки возникновения нейронов гипоталамуса [Altman and Bayer, 1978, 1986], но при этом нет данных, касающихся особенностей возникновения в ходе онтогенеза вазопрессинергических нейронов супраоптического и паравентрикулярного ядер. Крайне важно изучение эмбрионального и постнатального периодов развития вазопрессинергической системы гипоталамуса, в том числе исследование роли апоптоза в формированиии вазопрессинергических нейросекреторных центров гипоталамуса. Время установления дефинитивных связей, особенности нейротрансмиттерной регуляции вазопрессинергической системы, анализ функциональной активности вазопрессинергических нейронов в ходе онтогенеза, анализ различных морфогенетических влияний, в том числе и со стороны катехоламинергической системы, являются чрезвычайно важными вопросами, решению которых посвящена настоящая работа.
Известно, что к развитию апоптоза приводят как внешние, рецепторные сигналы, так и внутриклеточные нарушения, связанные с повреждением ДНК. Апоптоз является конечным этапом многих нейродегенеративных заболеваний, в том числе болезни Паркинсона. Представляется интересным выяснение роли катехоламинов в индукции апоптоза в гипоталамусе, получающем мощную катехоламинергическую иннервацию. С другой стороны, известно участие NO как в инициации апоптоза [Brune, et al., 1998], так и в его подавлении [Kim, et al., 1997]. Исследование взаимодействия и характера влияния катехоламинов и NO на индукцию апоптоза вазопрессинергических нейронов и сопоставление этих данных с результатами анализа влияния этих веществ на функцию нейронов необходимо для выяснения роли катехоламинов и NO в регуляции жизнеспособности и физиологического статуса нейронов гипоталамуса.
В последние годы появились данные, указывающие на возможность участия антиапоптозного белка Bcl-2 и проапоптозного белка р53 в регуляции физиологических функций нейронов, не связанных с гибелью клеток [Nishimura, et al., 2004]. В связи с этим представляется важным исследование возможности, характера и механизмов влияния белков апоптоза на функциональную активность нейронов гипоталамуса. Можно предположить, что белки апоптоза скорее всего оказывают модулирующее действие на другие внутриклеточные каскады передачи сигнала. Одним из таких путей, возможно, является ERK1/2 модуль МАРК сигнального каскада, взаимодействие которого с изучаемыми белками апоптоза было выявлено при исследовании механизмов регуляции программированной клеточной гибели [Singh, et al., 2007; Wang, et al., 1996]. Роль ERK1/2 модуля МАРК сигнального каскада в регуляции функциональной активности вазопрессинергических нейронов гипоталамуса в настоящее время предполагается, но не установлена.
Таким образом, исследование взаимоотношений между поступающими к клеткам различными сигналами, как активирующими, так и тормозными, и внутриклеточными посредниками, участвующими в непосредственной передаче информации в ядро клетки с последующим изменением активности синтеза вазопрессина, являются важной проблемой, малоизученной в настоящее время.
Цель работы: исследование механимов внутриклеточной регуляции функциональной активности и жизнеспособности вазопрессинергических нейронов в ходе раннего онтогенеза и у взрослых животных.
Задачи
- Оценить характер и механизмы взаимодействия катехоламинов и NO в регуляции функционального состояния и жизнеспособности вазопрессинергических нейронов гипоталамуса.
- Изучить влияние различных воздействий (денервация, нарушение катехоламинергической иннервации, стресс, водная депривация и их сочетанное действие) на развитие апоптоза вазопрессинергических нейронов гипоталамуса.
- Установить сроки окончания пролиферации и выхода в дифференцировку вазопрессин- и окситоцинергических нейронов гипоталамуса.
- Исследовать экспрессию белков апоптоза вазопрессинергическими нейронами на ранних стадиях постнатального онтогенеза, а также показать морфогенетическое влияние катехоламинов и NO на формирование вазопрессинергических нейросекреторных отделов гипоталамуса.
- Доказать существование неапоптозных функций белков апоптоза в вазопрессин- и дофаминергических нейронах и изучить механизмы влияния антиапоптозного белка Bcl-2 и проапоптозного белка р53 на функциональное состояние вазопрессинергических нейронов гипоталамуса.
- Доказать возможность и механизмы участия членов ERK1/2 модуля МАРК сигнального каскада в регуляции синтеза и выведения вазопрессина нейронами гипоталамуса. Изучить возможность участия транспортного белка кинезина в регуляции антероградного транспорта вазопрессинергических гранул по аксонам и показать роль киназ ERK1/2 сигнального каскада в регуляции экспрессии кинезина.
Научная новизна
Впервые доказано, что катехоламины - дофамин и норадреналин оказывают ингибирующее действие на экспрессию вазопрессина. Любое значительное изменение уровня катехоламинов в мозге приводит к усилению экспрессии nNOS в вазопрессинергических нейронах. Ингибирующее действие катехоламинов на синтез и выведение вазопрессина опосредуется действием NO. Как снижение катехоламинергической иннервации, так и ее увеличение приводит к усилению экспрессии про- и антиапоптозных белков в вазопрессинергических нейронах гипоталамуса. Уменьшение плотности катехоламинергической иннервации является более сильным повреждающим фактором для изучаемых нейронов и приводит к их гибели. Экспрессия белков апоптоза при нарушении катехоламинергического баланса в мозге является NO-зависимой. Особенно выраженное активирующее влияние NO оказывает на экспрессию антиапоптозного белка Bcl-2.
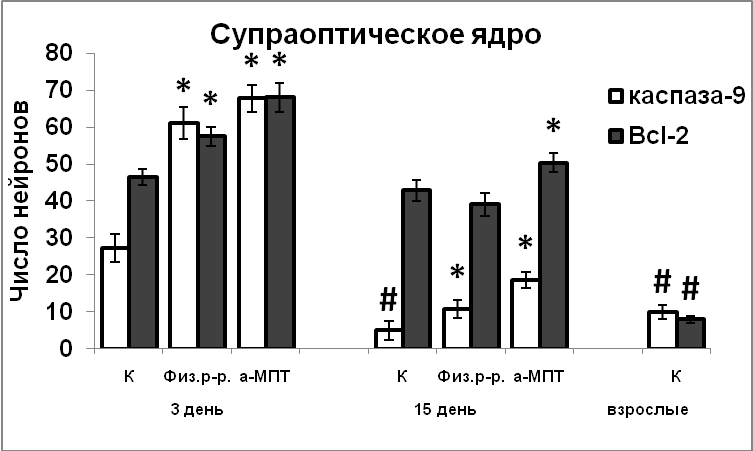
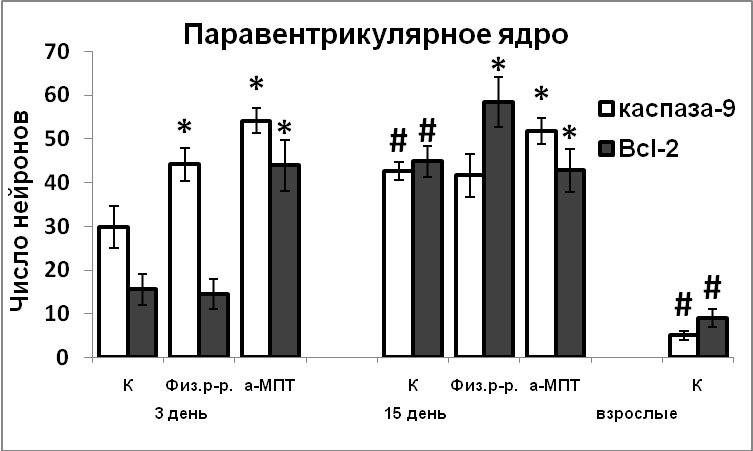
Установлено, что вазопрессинергические нейроны супраоптического ядра заканчивают деление на 14 день эмбриогенеза, на сутки раньше, чем вазопрессинергические нейроны паравентрикулярного ядра. Апоптоз постмитотических нейронов, вызванный повышенным уровнем экспрессии проапоптозного белка каспаза-9, также завершается раньше в супраоптическом ядре, чем в паравентрикулярном. Выживаемость вазопрессинергических нейронов в раннем постнатальном онтогенезе зависит от антиапоптозного действия Bcl-2. Катехоламины, взаимодействуя с NO, играют важную роль в морфогенезе гипоталамических нейронов, влияя на экспрессию белков апоптоза.
Показано, что функциональные нагрузки (стресс и дегидратация) не вызывают гибели вазопрессинергических нейронов, несмотря на активацию экспрессии в нейронах проапоптозных белков. Белки апоптоза оказывают модулирующее влияние на функциональную активность вазопрессин- и дофаминергических нейронов мозга. Выявлены возможные пути внутриклеточной сигнализации, которые передают сигнал от белков апоптоза на аппарат биосинтеза вазопрессина. Показано, что Bcl-2 стимулирует экспрессию вазопрессина, и это влияние опосредовано транскрипционным фактором CREB. Проапоптозный белок р53 усиливает интенсивность транспорта вазопрессинергических нейросекреторных гранул по аксонам и их выведение в системный кровоток, и это влияние, по-видимому, опосредовано ERK1/2 сигнальным каскадом.
ERK1/2 каскад участвует в регуляции биосинтеза вазопрессина за счет активации транскрипционных факторов Elk1 и CREB. Показана зависимость экспрессии кинезина от активности ERK1/2 киназы и установлено участие кинезина в реализации антероградного транспорта вазопрессина.
Полученные данные свидетельствуют о возможности одних и тех же внутриклеточных сигнальных посредников принимать участие в регуляции функционального состояния нейронов и обеспечении их жизнеспособности.
Положения, выносимые на защиту.
1. Взаимодействие катехоламинов и NO играет важную роль в регуляции функциональной активности и жизнеспособности вазопрессинергических нейронов. Катехоламины и NO оказывают ингибирующее действие на синтез и секрецию вазопрессина, причем NO опосредует тормозное действие катехоламинов на экспрессию вазопрессина. Снижение уровня катехоламинов является сильным повреждающим фактором и вызывает массовую гибель вазопрессинергических нейронов путем апоптоза. Активация вазопрессинергических нейронов предохраняет нейроны от апоптоза, вызванного нарушением катехоламинергической иннервации.
2. Вазопрессинергические нейроны супраоптического ядра заканчивают пролиферацию, выход в дифференцировку и апоптотическую гибель раньше, чем нейроны паравентрикулярного ядра. NO опосредует морфогенетическое действие катехоламинов на развитие вазопрессинергических нейронов, как на формирование клеточного состава гипоталамических нейросекреторных центров, так и на функциональную активность развивающихся нейронов.
3. Сигнальные белки апоптоза обладают неапоптозными функциями в центральной нервной системе и оказывают модулирующее влияние на функциональное состояние вазопрессинергических и дофаминергических нейронов. Антиапоптозный белок Bcl-2 вызывает усиление синтеза вазопрессина за счет активации транскрипционного фактора CREB. Проапоптозный белок р53 активирует антероградный транспорт вазопрессина, взаимодействуя с ERK1/2 киназой.
4. ERK1/2 каскад участвует в регуляции синтеза вазопрессина путем активации транскрипционных факторов Elk1 и CREB, и в регуляции секреции вазопрессина участвуя в активации экспрессии кинезина.
Теоретическая и практическая значимость
Исследование имеет фундаментальное значение для понимания механизмов регуляции биосинтеза вазопрессина на уровне восприятия клеткой рецепторного сигнала от различных нейротрансмиттеров и передачи информации внутриклеточными посредниками в ядро клетки с последующим изменением активности синтеза вазопрессина. Полученные результаты, касающиеся роли дофамина, норадреналина и их взаимодействия с NO, указывают на ингибиторне действие катехоламинов и NO на секрецию вазопрессина, что может иметь важное значение при нарушении осмотического баланса для предотвращения истощения вазопрессинергической системы гипоталамуса. Полученные результаты важны для понимания механизмов регуляции водно-солевого обмена у млекопитающих, что имеет большое значение для разработки методических подходов лечения различного рода нарушений, в том числе приводящих к серьезным заболеваниям сердечно-сосудистой системы.
Существенно изменены традиционные представления о строго ограниченных функциях белков апоптоза, связанных с регуляцией клеточной гибели. Исследование имеет фундаментальное значение для понимания роли сигнальных белков апоптоза Bcl-2 и p53 в модуляции функциональной активности нейронов, что открывает новые перспективы в изучении взаимозависимости функциональной активности нейронов и их жизнеспособности. Исследование воздействий, приводящих к усилению экспрессии белков апоптоза в вазопрессинергических нейронах, которые в ряде случаев инициируют гибель нейронов, имеет важное значение для понимания причин возникновения нейродегенеративных заболеваний. Понимание механизмов взаимодействия различных белков апоптоза с внутриклеточными посредниками лежит в основе разработки новых подходов к лечению онкологических заболеваний, а также ряда нейродегенеративных заболеваний, патогенез которых связан с нарушением баланса про- и антиапоптозных белков. В настоящее время блокаторы белков апоптоза Bcl-2 и p53 используются при лечении онкологических заболеваний периферических органов, в связи с чем необходимо учитывать возможность влияния этих фармакологических агентов на центральную нервную систему. Полученные в работе данные могут быть использованы в курсах лекций для студентов биологических и медицинских факультетов университетов и медицинских институтов.
Апробация работы
Результаты исследования доложены и обсуждены на V Всероссийской конференции “Нейроэндокринология-2000” (С.-Петербург, 2000), на XVIII съезде физиологического общества имени И.П. Павлова (Казань, 2001), на Второй научной конференции с международным участием “Эндокринная регуляция физиологических функций в норме и патологии” (Новосибирск, 2002), на совещании “Monoaminergic and peptidergic neurons: Functional interactions in neuroendocrine regulations” (Париж, 2002), на международном симпозиуме “Neuron differentiation and plasticity – regulation by intercellular signals” (Москва, 2003), на Всероссийской конференции с международным участием “Нейроэндокринология-2003” (С.-Петербург, 2003), на 1 Съезде физиологов СНГ (Дагомыс, 2005), на Всероссийской конференции с международным участием “Нейроэндокринология-2005” (С.-Петербург, 2005), на XIII международном совещании по эволюционной физиологии (Санкт-Петербург, 2006), на 6-th ICN (Питтсбург, США 2006), на XX съезде физиологического общества имени И.П. Павлова (Москва, 2007), на Всероссийском симпозиуме с международным участием «Гормональные механизмы адаптации» ( Санкт-Петербург, 2007), на Международной конференции «Apoptosis World 2008. From mechanisms to applications» (Люксембург, 2008), на Конференции с международным участием “Нейрохимические механизмы формирования адаптивных и патологических состояний мозга” (С.-Петербург, 2008), на 4th Conference on Advances in Molecular Mechanisms of Neurological Disorders (Лейпциг, Германия, 2009), на Всероссийской конференции с международным участием “Нейроэндокринология-2010” (С.-Петербург, 2010).
Финансовая поддержка работы. Работа выполнена при финансовой поддержке Российской академии наук, Российского фонда фундаментальных исследований №№ 98-04-49921, 01-04-48825, 05-04-48099, 08-04-00028.
Личный вклад автора. Результаты работы получены лично автором, под его руководством и при его непосредственном участии в планировании и проведении экспериментов. Имена соавторов указаны в соответствующих публикациях.
Публикации. По теме диссертации опубликовано 35 работы, 17 из которых – статьи в рецензируемых журналах, 18 - тезисы докладов.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов исследования, обсуждения результатов, выводов и списка литературы, включающего 20 отечественных и 485 зарубежных источников. Работа изложена на 322 страницах машинописного текста, иллюстрирована 5 таблицами и 90 рисунками.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные модели
Модели in vitro.
В экспериментах использовали половозрелых самцов крыс линии Вистар массой 120 – 140 г. В каждой экспериментальной группе было по 5 – 10 животных. Исследования in vitro проводились на переживающих срезах гипоталамуса. Животных декапитировали, быстро извлекали мозг и в стерильных условиях из гипоталамической области иссекали срезы толщиной 400-500 мкм. Во всех экспериментах срезы инкубировали в СО2 инкубаторе в среде DMEM содержащей 20% инактивированной сыворотки крови лошади и антибиотики (пенициллин в дозе 50 мкг/мл среды и стрептомицин – 100 мкг/мл) при температуре 370С, концентрации СО2 5% и влажности 95%.
Инкубация переживающих срезов гипоталамуса в среде с добавлением норадреналина и дофамина.
После прединкубации срезы на 30 минут помещали в питательную среду, содержащую дофамин в концентрации 100 нМ или норадреналин в концентрации 10 нМ, а затем переносили на 2.5 часа в среду без добавления катехоламинов, вторую часть срезов инкубировали в среде содержащей дофамин или норадреналин в течение 3 часов. Контролем служили срезы гипоталамуса, инкубированные в течение 4-х часов в чистой среде.
Инкубация переживающих срезов гипоталамуса в средах, содержащих блокаторы Bcl-2 (HA14-1), p53 (Pifithrin-а) или ERK1/2 каскада (UO126).
Эксперименты проведены для изучения прямого влияния инактивации антиапоптозного белка Bcl-2, проапоптозного белка p53 и MEK1/2 киназы на функциональную активность вазопрессинергических нейронов гипоталамуса. Контролем служили срезы, инкубированные в среде, содержащей растворитель блокаторов - DMSO в концентрации 0,5% итогового объема.
Ингибитор Bcl-2, так называемая small-molecule, – НА14-1 (2-амино-6-бромо-a-циано-3-(этоксикарбонилl)-4H-1-бензопиран-4-уксусной кислоты этиловый эфир) с молекулярным весом 409 является органическим соединением способным конкурировать с ВН3 доменом белка Ваk за связывание с гидрофобной поверхностью Bcl-2 [Wang, et al., 2000]. Фронтальные срезы, содержащие супраоптическое и паравентрикулярное ядра, инкубировали в среде, содержащей 30мкМ блокатора, в течение 5 часов.
Ингибитор р53 - органическое соединение 1-(4-метилфенил)-2-(4,5,6,7-тетрагидро-2-имино-3(2H)-бензотиазолил) этанон гидробромид, названная Pifithrin-а (рКа=9,1), подавляет р53-зависимую активацию транскрипции, на стадии после его транслокации в ядро [Murphy, et al., 2004]. Горизонтальные срезы гипоталамуса, содержащие супраоптическое и паравентрикулярное ядра, срединное возвышение и гипофиз инкубировали в среде, содержащей блокатор в дозе 10 мкМ в течение 5 часов.
Блокатор UO126 является органическим соединением, которое является селективным ингибитором активности MEK1/2 киназы ERK1/2 сигнального каскада [Duncia, et al., 1998]. Фронтальные срезы гипоталамуса, содержащие супраоптическое и паравентрикулярное ядра, инкубировали в среде, содержащей 25 мкМ UO126 в течение 5 часов.
Во всех сериях экспериментов по окончании инкубации часть срезов фиксировали 4% формальдегидом для дальнейшего морфологического исследования, а другую часть гомогенизировали в буфере, содержащем блокаторы пептидаз и фосфатаз, для последующего биохимического анализа с помощью Вестерн блоттинга.
Модели in vivo.
Блокада синтеза катехоламинов на фоне активации вазопрессинергической системы гипоталамуса у крыс и мышей дикого типа и нокаутов по гену nNOS. В экспериментах использовали половозрелых самцов крыс линии Вистар массой 170 – 200 г и половозрелых мышей дикого типа линии C57BL/6 и мышей-нокаутов по гену nNOS. Животных содержали в стандартных условиях вивария при естественном освещении. Опыты начинались в 12 – 13 часов дня. В каждой экспериментальной группе было по 5 животных (опыты на мышах проведены в Бостоне, США).
1-я группа - интактные мыши и крысы. 2-я группа (крысы) - ежедневно в течение 3-х дней в утренние часы вводили внутрибрюшинно физиологический раствор в количестве 0,25 мл/100г веса животного в качестве контроля к экспериментальной группе, а кроме того, в качестве стрессорного воздействия. 3-я группа (крысы и мыши обеих линий) - водная депривация в течение 5 суток. 4-я группа - внутрибрюшинное введение блокатора синтеза тирозингидроксилазы, ключевого скорость лимитирующего фермента синтеза катехоламинов, -метил-п-тирозин (а-МПТ) в течение 3-х последних дней водной депривации (первая инъекция - 200 мг/кг веса животного, последующие - по 100 мг/кг веса). 5-я группа - внутрибрюшинное введение а-МПТ в течение 3-х дней мышам дикого типа и мышам-нокаутам по той же схеме, что и животным 4-ой группы.
Анализ сроков окончания пролиферации вазопрессинергических нейронов гипоталамуса
Для выяснения сроков возникновения вазопрессин и окситоцинергических нейронов супраоптического и паравентрикулярного ядер гипоталамуса самкам крыс линии Вистар на 13, 14, 15, 16 или 17 дни беременности вводили внутрибрюшинно раствор Н3-тимидина, затем через два часа - бром дезоксиуридин (Brdu). Родившиеся крысята были декапитированы на 40 день постнатальной жизни, то есть по достижении ими половозрелости.
Блокада синтеза катехоламинов в ходе эмбрионального развития крысят.
Для изучения характера влияния катехоламинов и NO в регуляции формирования вазопрессинергической системы гипоталамуса самкам ежедневно с 13-го по 20-й дни беременности делали внутрибрюшинные инъекции -МПТ. Первую инъекцию (13-й день беременности) делали из расчета 200 мг/кг веса животного, далее по 100 мг/кг. Другой группе крыс с 13-го по 20-й дни беременности делали инъекции физиологического раствора в том же объеме, эти животные служили контролем к группе крыс инъецированных а-МПТ, кроме того, мы рассматривали их как модель пренатального стрессирования крысят. Третью группу составляли интактные животные. Родившихся крысят разделили на две группы. Первую группу декапитировали на 3-й день, а вторую – на 15-й день жизни.
Изучение влияния сигнальных белков апоптоза на функциональную активность вазопрессинергических нейронов.
Трансгенные животные. Для выяснения возможности и механизмов влияния сигнальных белков апоптоза на функциональное состояние вазопрессинергических нейронов гипоталамуса были исследованы мыши-нокауты по сигнальным белкам апоптоза – р53, р21 и Bcl-2 и трансгенные мыши по гену cRaf киназы, а также контрольные мыши тех же линий, от которых были получены мыши-нокауты. Животные были получены в Институте радиационной биологии и клеточных исследований Университета г.Вюрзбурга, Германия.
Внутригипоталамическое введение блокаторов Bcl-2 или р53. Всем животным за 7-8 дней до проведения эксперимента при помощи стереотаксического аппарата были вживлены проводящие канюли в область гипоталамуса над III желудочком по координатам AP=-1,40 мм, L=0,8 мм относительно брегмы, в соответствии со стереотаксическим атласом [Paxinos and Watson, 1998]. Крысам контрольной группы через канюли вводили растворитель блокаторов - DMSO. Крысам второй группы вводили НА14-1 - блокатор антиапоптозного белка Bcl-2 (0,5 мг/кг в 2 мкл физиологического раствора, содержащего 0,5% DMSO). Животные третьей группы были подвергнуты введению Pifithrin-a - блокатора проапоптозного белка р53 (0,25 мг/кг в 2 мкл физиологического раствора, содержащего 0,5% DMSO). Инъекции делали дважды: на восьмой и девятый дни после вживления канюль. Уровень диуреза были оценен в метаболических камерах через 2 часа после каждого введения блокаторов. Крысы были декапитированы через 6 часов после последнего введения блокаторов.
Внутрибрюшинное введение блокатора p53 Pifithrin-а. Pifithrin-a вводили крысам внутрибрюшинно в концентрации 2 мг/кг. Животным контрольной группы вводили растворитель блокатора DMSO на физиологическом растворе в концентрации 0,5%. Животных декапитировали через 5 часов после введения растворов.
Обработка материала
После декапитации или инкубации (в зависимости от экспериментов) срезы гипоталамуса фиксировали 4% формальдегидом разведенным в PBS в течение суток. Фиксация проводилась при 4-х градусах Цельсия. Затем материал на сутки помешался в 15% раствор сахарозы. Материал замораживали при температуре -450С в изопентане, охлажденном на сухом льду или жидком азоте до искомой температуры. На криостате изготавливались серии чередующихся срезов, сделанных во фронтальной плоскости, толщиной 8мкм. В других случаях материал фиксировали 4% формальдегидом разведенным в PBS в течение недели и далее по стандартной схеме заливали в парафин. Затем также изготавливали серии чередующихся парафиновых срезов.
Иммуногистохимический метод
Иммуногистохимический метод, с использованием немеченых антител и иммунопероксидазной реакции проводили по стандартной методике. Срезы после предварительной обработки инкубировали с первичными антителами против: вазопрессина (Abcam) – 1:200, nNOS (Transduction Lab.) – 1:250, каспазы-9 (Santa Kruz Biotechnology Inc.) 1:200, Bcl-2 (Santa Kruz Biotechnology Inc.) - 1:200, p53 (Cell Signalling) – 1:100, фосфо-CREB(Ser133) (Chemicon) - 1:100, кинезина (Abcam) – 1:250, фосфо-ERK1/2(Thr202/Tyr204) (Cell Signalling) – 1:120, фосфо-Elk1(Ser383) (Cell Signalling) - 1:30, фосфо-MEK1/2(Ser217/221) (1:100) (Cell Signaling), фосфо-p90RSK(Ser380)(Cell Signalling) – 1:30 и фосфо-cRaf (Ser338) (Cell Signaling) – 1:100).
В случае двойной иммуногистохимической реакции на вазопрессин и р53 после проявления реакции на р53 с помощью диаминобензидина срезы обрабатывали сильно закисленным PBS (рН=5.0). Затем проводили вторую иммуногистохимическую реакцию с антителами к вазопрессину по стандартной схеме. В этом случае пероксидазу выявляли набором реактивов SK-4700. Затем срезы обезвоживали и заключали в канадский бальзам.
Для анализа сроков выхода в дифференцировку нейронов супраоптического и паравентрикулярного ядер гипоталамуса мы последовательно выявляли Brdu и вазопрессин иммуногистохимическим методом на срезах. Для этого сначала использовали моноклональные антитела к Brdu (Sigma-Aldrich Co) -1:100, затем срезы инкубировали с вторичными моноклональными биотинилированными антителами (1:100) и с авидин-биотиновым комплексом 1:200 (Vectastain, Vector Labs). Визуализация реакции проводилась с помощью SK-4700. Затем на эти же срезы наносили первичные поликлональные кроличьи антитела к вазопрессину (Research Diagnostic Inc.) - 1:200 или окситоцину (Research Diagnostic Inc.)- 1-200, затем их инкубировали с антителами к IgG кролика в течение 1 часа, после чего проводилась инкубация с ПАП комплексом. В данном случае визуализация пероксидазы производилась диаминобензидином. Н3 тимидиновую метку проявляли с помощью фотоэмульсии (Kodak, IBI, New Нaven, CT, USA). После проявления метки срезы докрашивали тимидиновым синим.
Конфокальная микроскопия
Для изучения распределения исследуемых белков апоптоза и участников ERK1/2 сигнального каскада в гипоталамо-гипофизарной нейросекреторной системе срезы гипоталамуса обрабатывали иммуногистохимически с применением первичных поликлональных антител против кролика к вазопрессину, который выявляли с помощью вторичных антител, конъюгированных с Alexa Fluor 568 (Invitrogen). P53, фосфо-ERK1/2(Thr202/Tyr204), фосфо-Elk1(Ser383) и фосфо-CREB(Ser133) выявляли на тех же срезах с помощью первичных мышиных моноклональных антител и вторичных антител, конъюгированных с Alexa Fluor 488 (Invitrogen). Анализ препаратов проводили на конфокальном микроскопе (Leica).
Вестерн блоттинг
Для приготовления проб из гипоталамуса иссекали супраоптические ядра и заднюю долю гипофиза. Белки в пробах разделяли с помощью электрофореза в полиакриламидном геле по Лэммли (SDS-PAGE). Далее белковые фракции переносили на нитроцеллюлозную мембрану (Amersham Biosciences, Freiburg, Germany). Использовали те же первичные антитела, что и при иммуногистохимическом анализе. Для визуализации результатов использовали ECL plus–систему (Amersham Biosciences). Денситометрический анализ проводили с помощью программы PhotoM. Уровень экспрессии специфических белков был скорректирован по сигналу GAPDH, выявляемый для определения уровня общего количества белка в пробах.
Метод гибридизации in situ
Метод гибридизации in situ использовали для выявления мРНК вазопрессина. Меченая дигоксигенином мРНК вазопрессина была синтезирована in vitro транскрипционной реакцией с использованием линеализированной ДНК плазмиды (1 мкг), содержащей мРНК вазопрессина, с помощью коммерческого набора, содержащего дигоксигенин-меченые нуклеотиды согласно инструкции производителя (Boehringer Mannheim, Germany). Плазмида, содержащая мРНК вазопрессина, была любезно предоставлена М.В. Глазовой. Гибридизацию проводили согласно принятой методике [Campbell-Thompson, et al., 1995]. Срезы ацетилировали в растворе ангидрида уксусной кислоты (0,25%), содержащем 0,1М триэтаноламин, дегидратировали в этиловом спирте и инкубировали в течение 12 часов при температуре 500С в гибридизационном растворе, содержащем меченную дигоксигенином рибопробу к мРНК вазопрессина. Затем срезы промывали в смеси хлорида и цитрата натрия (SSC) и формамида. Для визуализации мРНК вазопрессина, меченного дигоксигенином, срезы инкубировали с антителами к дигоксигенину (разведение 250х на блокирующем растворе). Затем на срезы наносили раствор, содержащий NBT (nitro blue tetrazolium chloride) и BCIP (5-bromo-4-chloro-3-indolyl phosphate) и оставляли инкубироваться в темноте во влажных камерах при комнатной температуре до проявления реакции. Для остановки реакции срезы промывали в буфере (100 мМ TRIS-HCl, 1 мМ EDTA, рН=9,5) в течение 15 минут и, после дополнительной промывке в воде, заключали в мовиол.
Морфофункциональный анализ материала
Количественная оценка содержания исследуемых веществ в нейросекреторных клетках и волокнах срединного возвышения и задней доли гипофиза производилась на основании измерения оптической плотности иммунореактивного вещества в телах нейронов или в волокнах на микрофотографиях с помощью компьютерного цифрового анализатора телевизионного изображения [Smolen, 1990; Агроскин and Папаян, 1977] и программного обеспечения PhotoM (Черниговский, http://t_lambda.chat.ru). Данные выражены в условных единицах оптической плотности на мкм2. Кроме оценки содержания в нейронах иммунореактивного вещества, в некоторых случаях проводился подсчет количества нейронов, давших интенсивную иммуногистохимическую реакцию на выявляемые белки.
Статистический анализ результатов
Все полученные данные обрабатывались статистически по t-критерию Стьюдента с помощью коммерческой программы Microsoft Excel 2003. При оценке достоверности отличий между группами n = количеству срезов на группу. Данные представлены в виде среднего арифметического по каждой группе животных ± доверительный интервал для среднего значения. Достоверными считались отличия при уровне значимости p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние катехоламинов и NO на функциональное состояние и жизнеспособность вазопрессинергических нейронов
Возможность участия катехоламинов в регуляции функционального состояния гипоталамических вазопрессинергических нейронов подтверждается данными о наличии синаптических контактов между катехоламин- и нонапептидергическими нейронами в пределах гипоталамуса [Michaloudi, et al., 1997; Shioda and Nakai, 1996]. В экспериментах in vitro, позволяющих исключить все афферентные влияния и определить характер прямого воздействия катехоламинов на вазопрессинергические клетки гипоталамуса, было показано, что норадреналин и дофамин не влияют на синтез вазопрессина, но подавляют выведение вазопрессина из тел нейронов в аксоны (Рис.1).
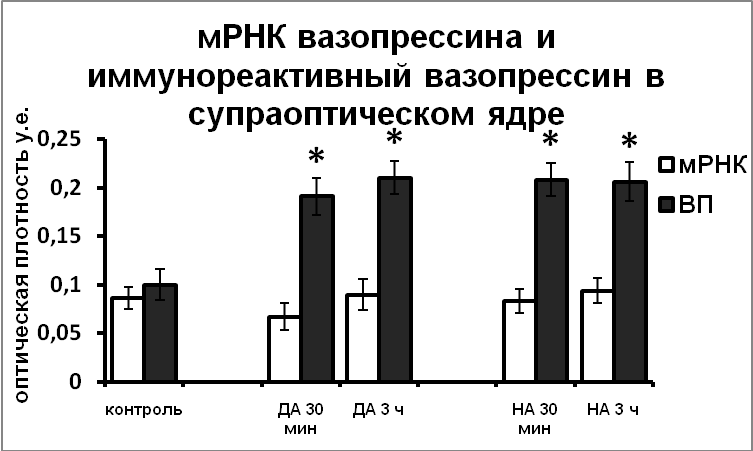 | 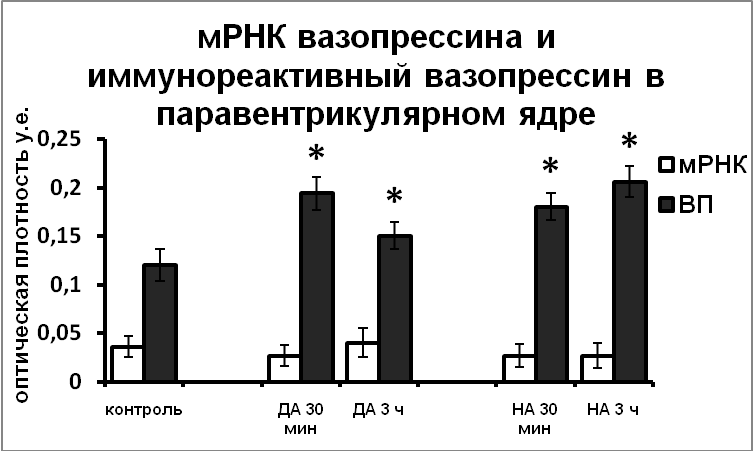 |
Рис. 1. Содержание мРНК вазопрессина и вазопрессин-иммунореактивного вещества в нейронах супраоптического и паравентрикулярного ядер срезов гипоталамуса, инкубированных в чистой среде (контроль), в среде, содержащей норадреналин (НА) и дофамин (ДА).
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2. *-достоверность отличия от контроля при p<0,05.
Увеличение уровня дофамина и норадреналина также приводит к усилению экспрессии nNOS в нейронах (Рис.2). Мы показали, что нарушение иннервации, в том числе катехоламинергической, является мощным стимулом для усиления экспрессии nNOS в вазопрессинергических нейронах (Рис.2). Полученные данные указывают на зависимость экспрессии nNOS от катехоламинергической иннервации и на возможное участие NO в передаче сигнала от катехоламинергических рецепторов на механизмы секреции вазопрессина.
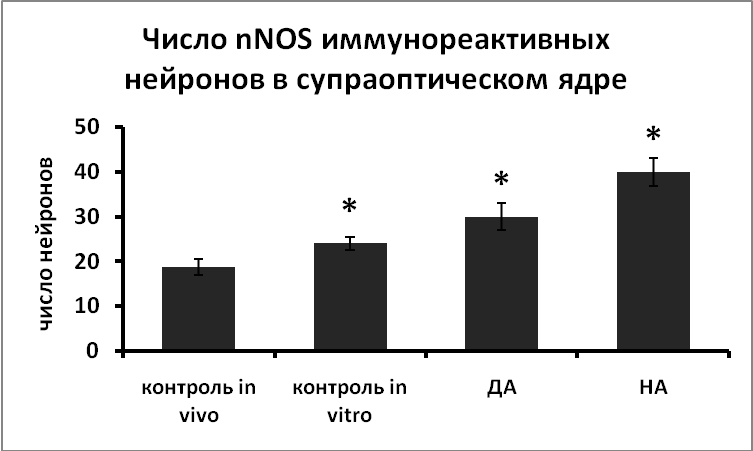 |  |
Рис. 2. Число nNOS иммунореактивных нейронов супраоптического и паравентрикулярного ядер срезов гипоталамуса, зафиксированных непосредственно после декапитации животных (контроль in vivo), инкубированных в «чистой» среде (контроль in vitro), в среде, содержащей норадреналин (НА) или дофамин (ДА) в течение 3-х часов.
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2. *-достоверность отличия от контроля при p<0,05.
Для того чтобы оценить характер взаимодействия катехоламинов и NO в регуляции функционального состояния нейронов супраоптического и паравентрикулярного ядер в условиях активации вазопрессинергической системы гипоталамуса в результате водной депривации, мы провели эксперименты in vivo на крысах, мышах-нокаутах по гену nNOS и мышах дикого типа. Уровень синтеза вазопрессина в нейронах супраоптического и паравентрикулярного ядер не отличался у интактных мышей дикого типа и мышей-нокаутов по гену nNOS (рис. 3). При этом содержание вазопрессин-иммунореактивного вещества в нейронах было достоверно меньшим у нокаутов по сравнению с мышами дикого типа (рис. 3), что свидетельствует о более интенсивном выведении вазопрессина из тел нейронов супраоптического и паравентрикулярного ядер в отсутствие nNOS.
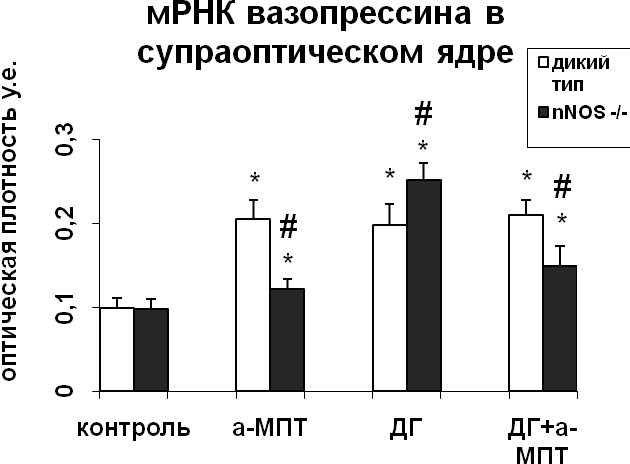 | 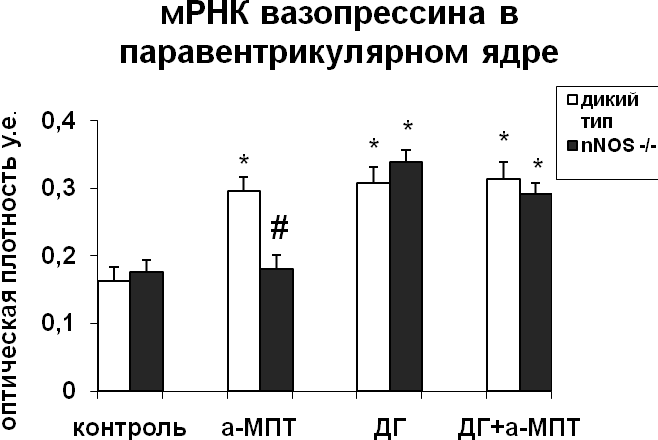 |
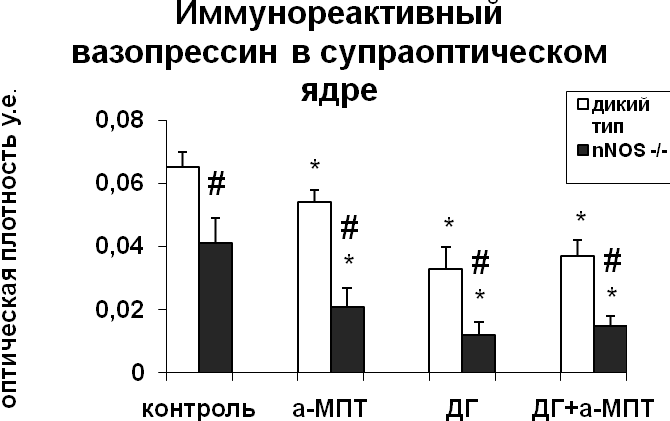 | 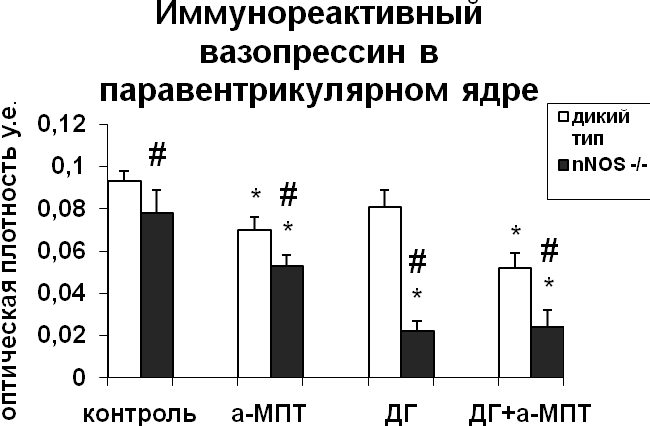 |
Рис. 3. Содержание мРНК вазопрессина и вазопрессин-иммунореактивного вещества в нейронах супраоптического и паравентрикулярного ядер гипоталамуса мышей, подвергнутых введению блокатора синтеза катехоламинов а-МПТ (a-MPT), дегидратации (ДГ), и введению блокатора синтеза катехоламинов а-МПТ на фоне дегидратации (ДГ+а-МПТ).
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2. *-достоверность отличия от контроля при p<0,05. #- достоверность различий между мышами дикого типа и мышами-нокаутами.
Внутрибрюшинное введение физиологического раствора крысам, являющееся адекватным стрессорным воздействием для нейронов паравентрикулярного ядра, вызвало активацию синтеза вазопрессина в нейронах этого ядра, а также усиление его выведения, что сопровождалось увеличением экспрессии nNOS (Рис.4).
Водная депривация, приводящая к дегидратации, вызвала усиление синтеза вазопрессина в нейронах супраоптического ядра и паравентрикулярного ядер крыс (Рис.4) и мышей обеих линий (Рис.3), и значительное увеличение содержания nNOS в вазопрессинергических нейронах у крыс (Рис.4), что подтверждает предположение о непосредственном участии NO в регуляции секреции вазопрессина в условиях активации системы. При этом у мышей-нокаутов по гену nNOS увеличение содержания мРНК вазопрессина и усиление выведения вазопрессина из тел нейронов были значительно более выражены, чем у мышей дикого типа и крыс. Таким образом, инактивация гена nNOS приводит к усилению синтеза и выведения вазопрессина. Очевидно, что NO отвечает за торможение секреции вазопрессина не только в норме, но и при активации вазопрессинергической системы, вызванной стрессом или дегидратацией. В этом случае, вероятно, NO модулирует баланс между активными киназами и фосфатазами, изменяя уровень фосфорилирования нейрофиламентов и регулируя, таким образом, подвижность элементов цитоскелета [Rothe, et al., 2002].
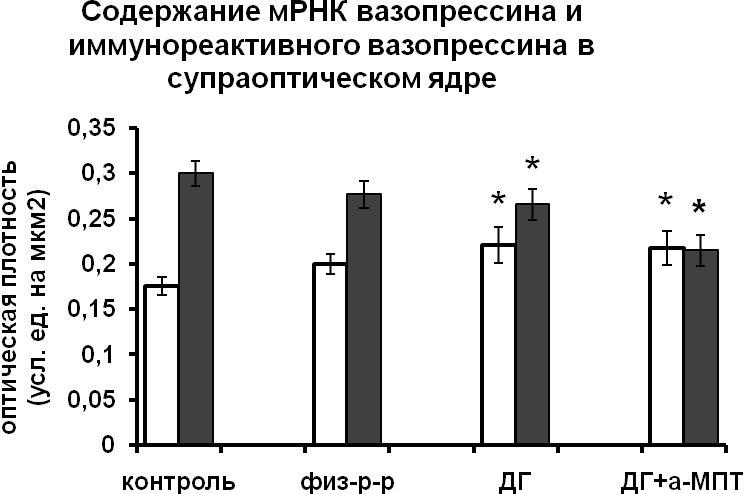 | 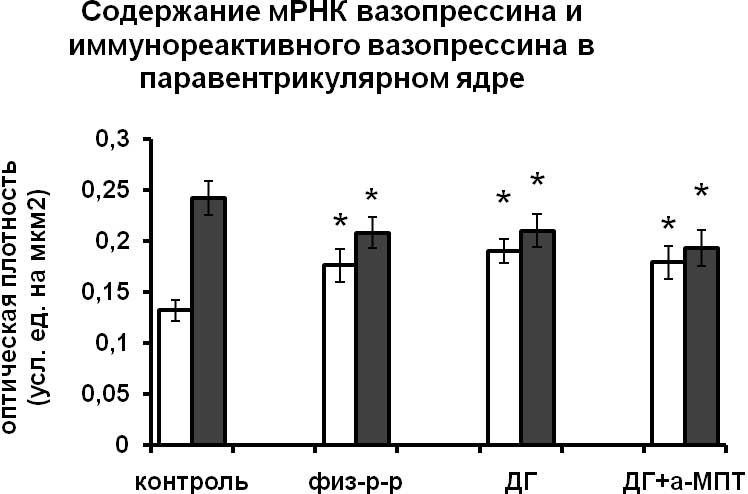 |
Рис. 4. Содержание мРНК вазопрессина (белые столбики) и вазопрессин-иммунореактивного вещества (серые столбики) в нейронах супраоптического и паравентрикулярного ядер гипоталамуса крыс, подвергнутых введению физиологического раствора, дегидратации (ДГ), и введению блокатора синтеза катехоламинов а-МПТ на фоне дегидратации.
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2. *-достоверность отличия от контроля при p<0,05.
При введении блокатора синтеза катехоламинов a-МПТ на фоне дегидратации уровень мРНК вазопрессина в нейронах супраоптического ядра крыс и мышей дикого типа не отличался от уровня мРНК вазопрессина дегидратированных животных (Рис.3,4). У мышей-нокаутов по гену nNOS при введении а-МПТ на фоне дегидратации отмечалось снижение мРНК вазопрессина по сравнению с дегидратированными животными (рис. 3). Полученные данные подтверждают NO-зависимый механизм катехоламинергической регуляции синтеза вазопрессина в условиях дегидратации. Воздействие а-МПТ на дегидратированных мышей-нокаутов по гену nNOS не привело к изменению содержания в нейронах супраоптического и паравентрикулярного ядер вазопрессин-иммунореактивного вещества по сравнению с дегидратированными животными, что при сниженном уровне мРНК вазопрессина свидетельствует о торможении его выведения из тел нейронов. Эти данные указывают на активацию выведения вазопрессина нейронами супраоптического ядра при недостатке катехоламинергической иннервации. Из этого можно сделать вывод, что в норме при осмотической стимуляции катехоламины могут подавлять секрецию вазопрессина.
Внутрибрюшинное введение а-МПТ недегидратированным мышам вызвало сильное повышение уровня мРНК вазопрессина в нейронах супраоптического и паравентрикулярного ядер у мышей дикого типа, что указывает на тормозное действие катехоламинов на синтез вазопрессина гипоталамическими нейронами (рис. 3) и на существование прямой зависимости экспрессии nNOS от интенсивности катехоламинергического сигнала. У мышей-нокаутов а-МПТ не оказал влияния на интенсивность синтеза вазопрессина нейронами супраоптического и паравентрикулярного ядер (рис. 3). Полученные данные свидетельствуют об NO-зависимом механизме регуляции катехоламинами синтеза вазопрессина. Применение а-МПТ у мышей дикого типа и у мышей-нокаутов снизило содержание вазопрессин-иммунореактивного вещества в нейронах супраоптического и паравентрикулярного ядер по сравнению с контролем, что указывает на активацию выведения вазопрессина в условиях низкого уровня катехоламинов в мозге (рис. 3). При этом снижение содержания вазопрессин-иммунореактивного вещества было значительно большим у мышей-нокаутов по сравнению с мышами дикого типа.
В экспериментах in vivo и in vitro установлено, что катехоламины, дофамин и норадреналин оказывают ингибирующее действие на экспрессию вазопрессина, вызывая торможение выведения вазопрессина из тел нейронов супраоптического и паравентрикулярного ядер. NO опосредует ингибирующее влияние катехоламинов на активность синтеза вазопрессина и его выведение из тел нейронов супраоптического и паравентрикулярного ядер.
Существуют многочисленные работы, демонстрирующие, что повышенные концентрации катехоламинов являются токсическими и вызывают апоптоз [Colucci, et al., 2000; Hoyt, et al., 1997; Noh, et al., 1999]. И напротив, ряд данных, свидетельствует в пользу того, что катехоламины могут защищать клетки мозга от повреждений, вызываемых различными окислителями и свободными радикалами [Noh and Gwag, 1997; Noh, Kim, Kang, Kim, Oh and Gwag, 1999]. NO также принимает участие в регуляции программированной клеточной гибели, можно предположить, что инициирование катехоламинами процесса апоптоза опосредуется NO. При этом роль NO, как и роль катехоламинов, в регуляции апоптоза трудно определить однозначно, так как NO может оказывать противоположные эффекты на процесс программированной клеточной гибели в зависимости от его концентрации и типа клеток [Canals, et al., 2001].
Мы показали, что денервация гипоталамуса в эксперименте in vitro привела к значительному усилению экспрессии nNOS в нейросекреторных клетках, при этом число нейронов, экспрессирующих каспазу-9 увеличивалось, что свидетельствует об индукции апоптоза. Увеличивалась и экспрессия антиапоптозного белка Вcl-2, что указывает на активацию защитных механизмов в этих клетках (Рис.5).
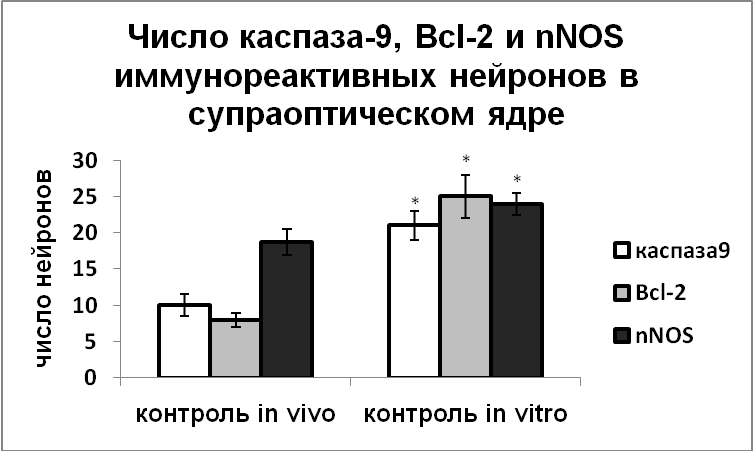 | 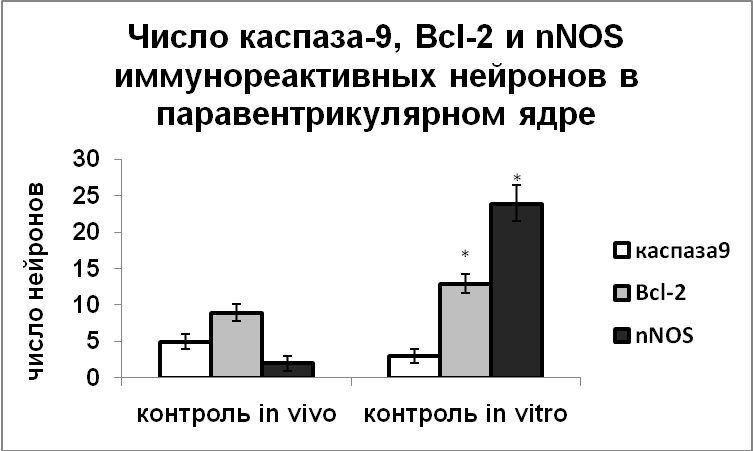 |
Рис. 5. Число каспаза-9, Bcl-2 и nNOS иммунореактивных нейронов супраоптического и паравентрикулярного ядер крыс, зафиксированных непосредственно после декапитации (контроль in vivo) и нейронов супраоптического и паравентрикулярного ядер срезов гипоталамуса, инкубированных в чистой среде (контроль in vitro).
По оси ординат: число нейронов на срез ядра с высокой оптической плотностью. *-достоверность отличия от контроля при p<0,05.
Снижение плотности катехоламинергической иннервации в результате введения а-МПТ мышам-нокаутам по гену nNOS и мышам дикого типа привело к значительной гибели нейронов – до 30% клеток погибало путем апоптоза (Рис.6). Важно отметить, что в случае, если нарушение катехоламинергической иннервации происходило на фоне активации вазопрессинергических нейронов, вызванной дегидратацией, гибели нейронов не происходило у крыс и мышей дикого типа, несмотря на повышенную экспрессию проапоптозных белков – каспазы-9, р53 и антиапоптозного белка Bcl-2 (Рис.6,7). Возможно, при дегидратации, вызывающей значительное усиление функциональной активности вазопрессинергических нейронов, все ресурсы клетки направлены на синтез и выведение вазопрессина, необходимого для поддержания осмотического равновесия организма, и в этом случае нарушение катехоламинергической иннервации активированных вазопрессинергических нейронов не является столь сильным повреждающим фактором. Важно отметить, что у крыс усиление экспрессии белков апоптоза при введении а-МПТ на фоне дегидратации коррелировало с повышенным уровнем nNOS (Рис.7).
 |
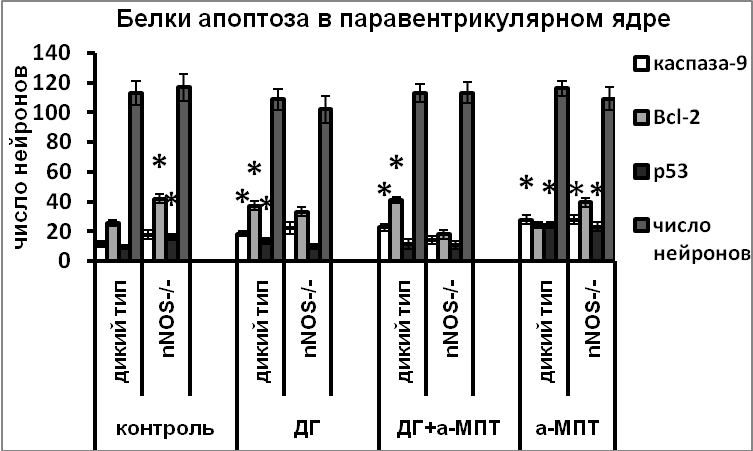 |
Рис. 6. Число каспаза-9, Bcl-2 и nNOS иммунореактивных нейронов супраоптического и паравентрикулярного ядер мышей дикого типа и мышей-нокаутов по гену nNOS и общее число вазопрессинергических нейронов на срез ядра. Интактные животные - контроль, дегидратированные мыши (ДГ), мыши подвергнутые инъекциям а-МПТ, и мыши, подвергнутые инъекциям а-МПТ на фоне дегидратации (ДГ+а-МПТ).
По оси ординат: число нейронов на срез ядра с высокой оптической плотностью. *-достоверность отличия от контроля при p<0,05.
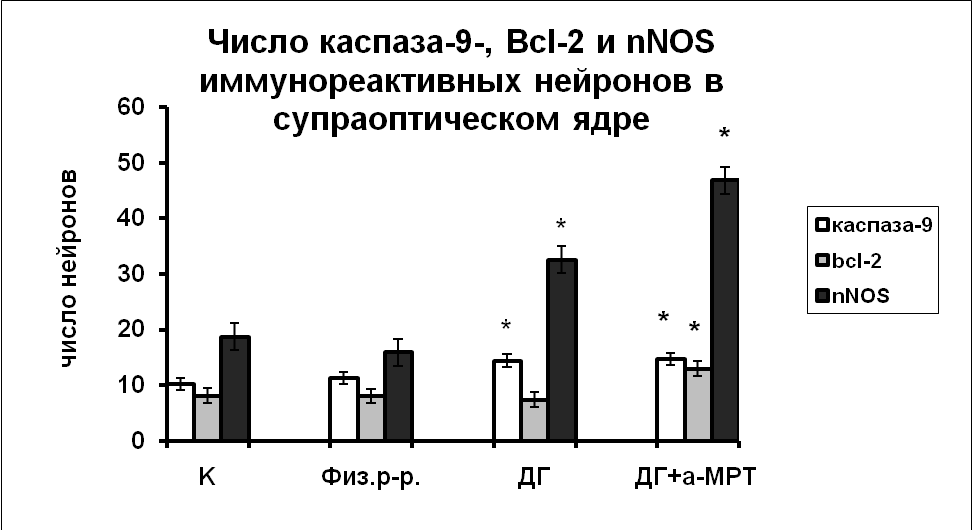 | 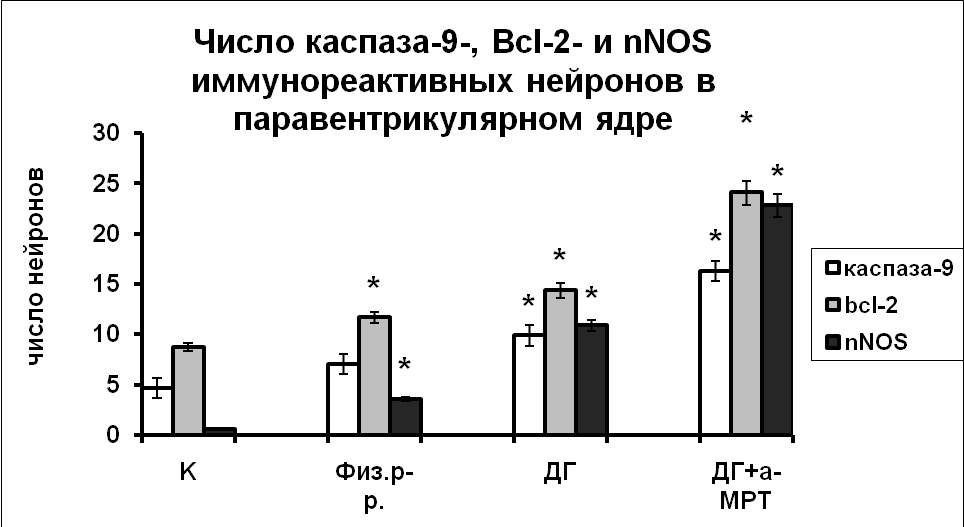 |
Рис. 7. Число каспаза-9, Bcl-2 и nNOS иммунореактивных нейронов супраоптического и паравентрикулярного ядер гипоталамуса крыс, интактные животные (К), крысы, подвергнутые инъекциям физиологического раствора, дегидратированные крысы (ДГ) и крысы, подвергнутые инъекциям а-МПТ на фоне дегидратации (ДГ+а-МПТ).
По оси ординат: число нейронов на срез ядра с высокой оптической плотностью. *-достоверность отличия от контроля при p<0,05.
Необходимо отметить, что у мышей-нокаутов по гену nNOS в отличие от животных дикого типа не происходит активации экспрессии Bcl-2 нейронами супраоптического и паравентрикулярного ядер в ответ на снижение катехоламинергической иннервации (Рис.6). Вероятно, основным звеном механизма регуляции программированной клеточной гибели катехоламинами, на которое в первую очередь оказывает влияние NO, является именно антиапоптозный белок Bcl-2.
В ответ на дегидратацию в супраоптическом и паравентрикулярном ядрах, а на стресс – только в паравентрикулярном ядре у крыс и мышей дикого типа, наблюдалось усиление экспрессии nNOS и всех изученных белков апоптоза (Рис.6,7). У мышей-нокаутов эти воздействия не приводили к увеличению содержания в нейронах белков апоптоза, что указывает на ключевую роль NO в регуляции их экспрессии в условиях функционального напряжения вазопрессинергических нейронов. Важно отметить, что под действием стресса или дегидратации, несмотря на активацию экспрессии всех изученных белков апоптоза в вазопрессинергических нейронах гипоталамуса, гибели клеток не наблюдалось. Эти данные позволяют предположить другие функции белков апоптоза не связанные с регуляцией клеточной гибели и указывают на возможность участия белков апоптоза в регуляции функциональной активности нейронов.
Таким образом, показано, что снижение содержания катехоламинов в мозге является сильным повреждающим фактором, вызывающим апоптотическую гибель вазопрессинергических нейронов.
С другой стороны, известно, что в высоких концентрациях катехоламины могут становиться токсичными и вызывать гибель [Hoyt, Reynolds and Hastings, 1997; Luo, et al., 1998; Offen, et al., 1996; Zilkha-Falb, et al., 1997; Ziv, et al., 1994].
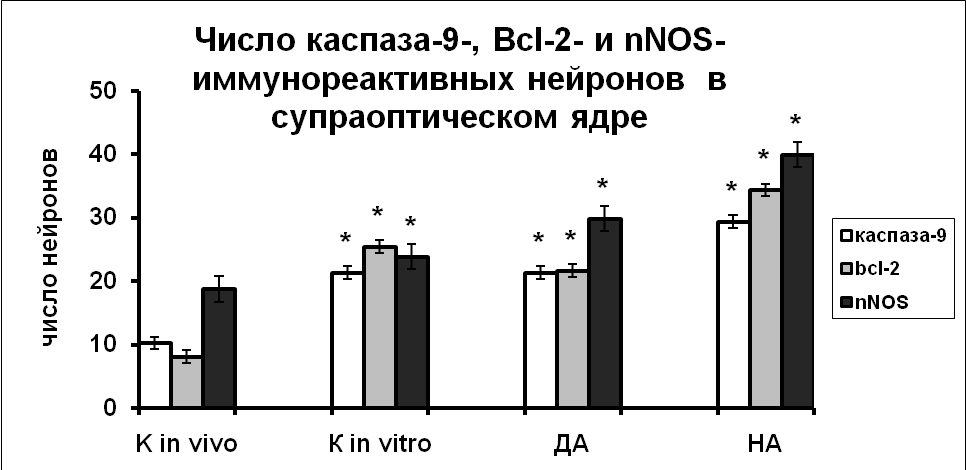 | 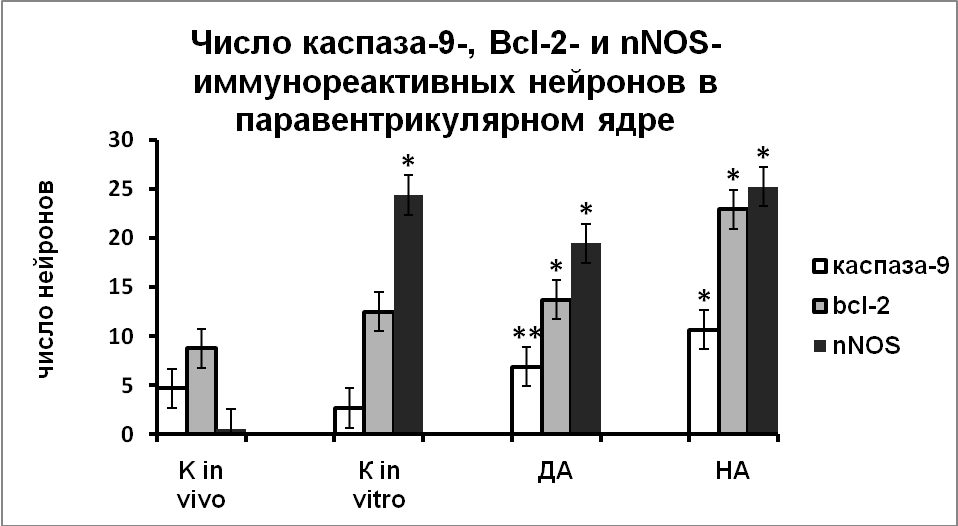 |
Рис. 8. Число каспаза-9, Bcl-2 и nNOS иммунореактивных нейронов супраоптического и паравентрикулярного ядер зафиксированных непосредственно после декапитации животных (к in vivo), в нейронах супраоптического и паравентрикулярного ядер срезов гипоталамуса, инкубированных в «чистой» среде (к in vitro), в среде с добавлением дофамина (ДА) или норадреналина (НА) в течение 3-х часов.
По оси ординат: число нейронов на срез ядра с высокой оптической плотностью. *-достоверность отличия от контроля при p<0,05.
Добавление в инкубационную среду дофамина не приводило к активации экспрессии каспазы-9 и Вcl-2 по сравнению со срезами гипоталамуса, инкубированными в чистой среде, но по сравнению с интактным контролем экспрессия nNOS и синтез белков апоптоза были достоверно выше (Рис.8).
Под влиянием норадреналина наблюдалась повышенная экспрессия nNOS и высокое содержание каспазы-9 и Bcl-2 в вазопрессинергических нейронах гипоталамуса (Рис. 8). Показанная корреляция позволяет предположить, что норадреналин вызывает увеличение внутриклеточного содержания NO, в результате чего происходит активация митохондриального пути апоптоза.
Таким образом, мы показали, что любое значительное изменение уровня катехоламинов в мозге приводит к усилению экспрессии nNOS в вазопрессинергических нейронах, что сопровождается усилением экспрессии в нейронах белков, индуцирующих и подавляющих апоптоз. Особенно выраженным является влияние NO на антиапоптозный белок Bcl-2. Показано, что снижение катехоламинергической иннервации является более сильным повреждающим фактором для изучаемых нейронов и приводит к их гибели. Важно отметить, что в том случае, если вазопрессинергические нейроны находятся в состоянии функционального напряжения, нарушение катехоламинергической иннервации не приводит к клеточной гибели, несмотря на повышенную экспрессию белков апоптоза. Полученные данные указывают на возможность белков апоптоза принимать участие в регуляции функционального состояния нейронов и обеспечивать их жизнеспособность.
Формирование вазопрессинергических нейронов в ходе пренатального и постнатального развития
Известно, что нейроны супраоптического ядра у крыс образуются с 13-го по 14-й день внутриутробного развития, а выход в дифференцировку нейронов паравентрикулярного происходит в основном на 14-й – 15-й день эмбрионального развития [Altman and Bayer, 1978; Anderson, 1978; Ifft, 1972].
Эти данные были получены без учета эргичности нейронов супраоптического и паравентрикулярного ядер. Мы показали, что вазопрессинергические нейроны супраоптического ядра заканчивают деление и выходят в дифференцировку на 14 день эмбриогенеза, на сутки раньше, чем нейроны паравентрикулярного ядра (Рис.9).
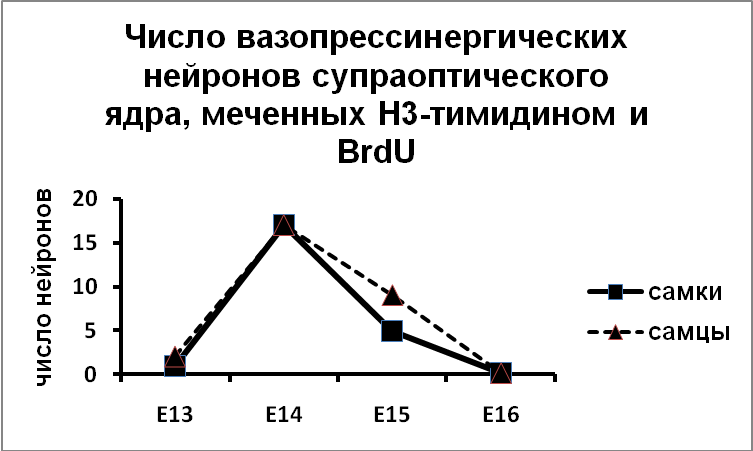 | Б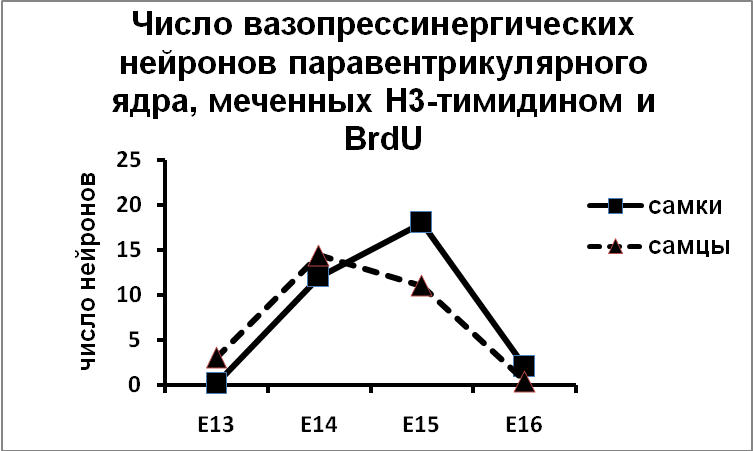 |
Рис. 9. Супраоптическое и парвентрикулярное ядра крыс, подвергнутых введению Н3-тимидина и бром-дезокси-уридина.
По оси ординат: число вазопрессинергических нейронов на срез ядра, содержащих Н3-тимидин и бром-дезокси-уридин.
По оси абсцисс: день введения Н3-тимидина и бром-дезокси-уридина.
В ходе постнатального развития экспрессия белков апоптоза каспазы-9 и Bcl-2 в нейронах гипоталамуса превышает таковую у взрослых животных. Это свидетельствует, что и на постнатальном этапе развития продолжается гибель нейронов путем апоптоза (Рис.10). Гибель постмитотических нейронов, а, следовательно, и формирование клеточного состава раньше начинается и, вместе с тем, раньше завершается в супраоптическом ядре, по сравнению с паравентрикулярным ядром. Наблюдаемая высокая корреляция между содержанием nNOS, каспазы-9 и Bcl-2 в нейронах гипоталамуса у интактных крысят позволяет предположить участие NO в реализации апоптоза в ходе раннего постнатального развития. Усиление экспрессии nNOS в результате нарушения катехоламинергической иннервации в эмбриогенезе является возможной причиной усиления экспрессии в них сигнальных белков апоптоза, и соответственно более позднего завершения формирования супраоптического и паравентрикулярного ядер.
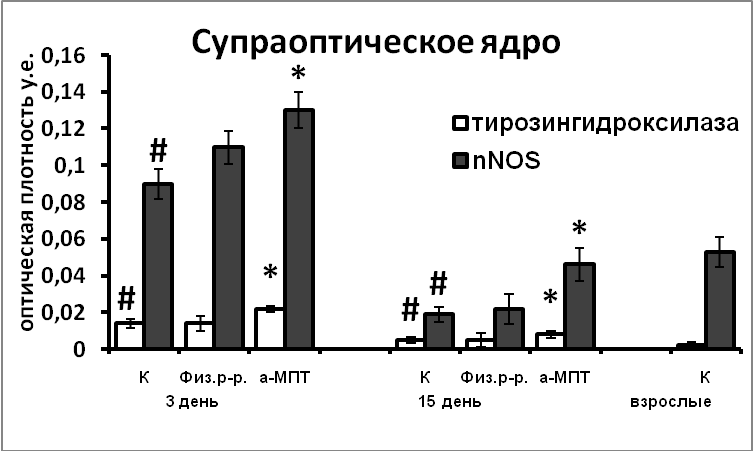 | 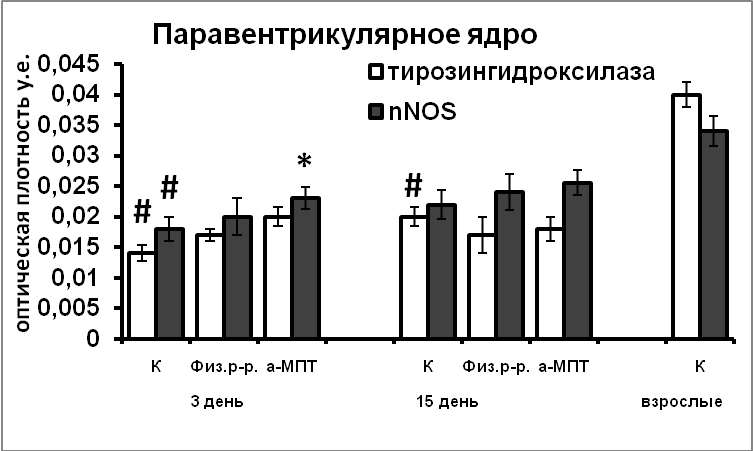 |
 |  |
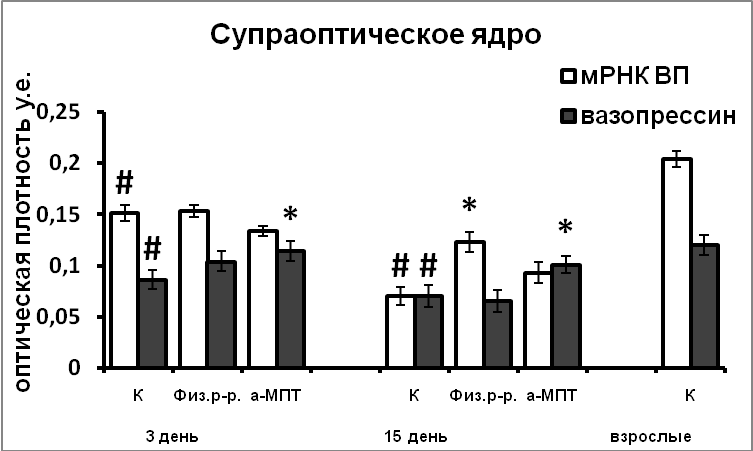 |  |
Рис. 10. Иммунореактивные тирозингидроксилаза, nNOS, каспаза-9, Bcl-2, содержание мРНК вазопрессина и вазопрессин-иммунореактивного вещества в нейронах супраоптического и паравентрикулярного ядер крысят, интактные животные (К), крысы, подвергнутые инъекциям физиологического раствора и крысы, подвергнутые инъекциям а-МПТ (а-МПТ).
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2 или число нейронов на срез ядра с высокой оптической плотностью.
*-достоверность отличия от контроля при p<0,05.
Снижение уровня катехоламинов в мозге во время последней трети эмбриогенеза привело к длительно сохраняющимся нарушениям в функциональном состоянии вазопрессинергических нейронов (Рис.10). Возможно, эти нарушения связаны с увеличением экспрессии nNOS в вазопрессинергических нейронах происходящем под воздействием компенсаторного увеличения содержания тирозингидроксилазы в супраоптическом и паравентрикулярном ядрах.
Таким образом, показано морфогенетическое влияние катехоламинов на развитие вазопрессинергической системы гипоталамуса, опосредованное действием NO. Усиление экспрессии nNOS в результате нарушения катехоламинергической иннервации в эмбриогенезе является возможной причиной повышенной экспрессии в них сигнальных белков апоптоза, и, соответственно, более позднего завершения формирования супраоптического и паравентрикулярного ядер. Уже на ранних стадиях онтогенетического развития характер влияния NO на функцию вазопрессинергических нейронов не отличается от такового у взрослых животных.
Исследование неапоптозных функции белков апоптоза в нейронах гипоталамуса
Базальная экспрессия p53 и Bcl-2 наблюдается в различных областях мозга, в том числе и в гипоталамусе [Chernigovskaya, et al., 2005; Nishimura, Makino, Tanaka, Kaneda and Hashimoto, 2004; Tendler, et al., 1999]. В экспериментах с длительной водной депривацией было показано увеличение содержания антиапоптозного белка Bcl-2 и проапоптозных белков p53 и каспаза-9 в вазопрессинергических нейронах гипоталамуса (Рис.11). Усиление экспрессии p53 наблюдалось и при иммобилизационном стрессе [Chernigovskaya, Taranukhin, Glazova, Yamova and Fedorov, 2005; Nishimura, Makino, Tanaka, Kaneda and Hashimoto, 2004]. Активация про- и антиапоптозных белков не сопровождалась клеточной гибелью и, следовательно, сигнальные белки апоптоза в нервной системе обладают функциями, не связанными непосредственно с регуляцией апоптоза. Очевидно, можно говорить о существовании модулирующей нейрональную активность функции белков апоптоза. Представляется маловероятным, что белки апоптоза могут непосредственно влиять на экспрессию нейрогормонов или нейротрансмиттеров. Поэтому наши исследования были направлены на выявление возможных путей внутриклеточной сигнализации, которые могут передавать сигнал от белков апоптоза на аппарат биосинтеза нейрогормонов и нейротрансмиттеров, в частности, вазопрессина.
Мы показали, что при дегидратации происходит увеличение активности транскрипционного фактора CREB в нейронах супраоптического ядра (Рис. 11), сопровождавшееся усилением синтеза вазопрессина, что подтверждает данные литературы [Pardy, et al., 1992] о вовлеченности CREB в регуляцию экспрессии вазопрессина.
Дегидратация вызвала активацию MEK1/2 киназы ERK1/2-сигнального пути, а также фосфо-Elk1 - транскрипционного фактора, являющегося одной из наиболее известных мишеней ERK1/2-сигнального пути, в телах нейронов супраоптического ядра (Рис. 11). Увеличение транскрипции и трансляции вазопрессина нейронами супраоптического ядра при дегидратации позволяет рассматривать возможность участия ERK1/2 сигнального пути в регуляции биосинтеза вазопрессина. Мы показали, что ERK1/2 содержится в вазопрессинергических волокнах задней доли гипофиза и его количество в волокнах задней доли гипофиза превышает таковое в нейронах супраоптического ядра, что дает нам возможность предположить участие ERK1/2 киназы в реализации транспорта и выведения вазопрессина (Рис.11). Накопление в терминальных отделах аксонов нейронов гипоталамуса активных киназ ERK1/2 каскада при активации транспорта и выведения вазопрессина, в совокупности с данными литературы об участии ERK1/2 пути в регуляции активности нейрофиламентов [Julien and Mushynski, 1998; Veeranna, et al., 1998; Veeranna, et al., 2000], указывает на возможность участия киназ ERK1/2 каскада в регуляции секреции вазопрессина. Однако обе гипотезы требовали подтверждения.
Выявление корреляций между активностью вазопрессинергических нейронов, уровнем экспрессии в них белков апоптоза и участников ERK1/2 каскада явилось предпосылкой для дальнейшего исследования механизмов регуляции функционального состояния вазопрессинергических нейронов белками апоптоза.
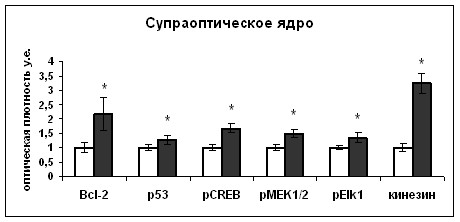 | 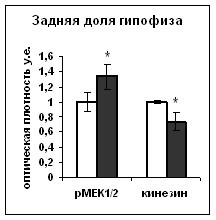 |
Рис. 11. Содержание Bcl-2, p53, фосфо-CREB (pCREB), фосфо-MEK1/2 (pMEK1/2), фосфо-Elk1 (pElk1) и кинезина в нейронах супраоптического ядра и волокнах задней доли гипофиза интактных (белые столбики) и дегидратированных крыс (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
В нейронах супраоптического и паравентрикулярного ядер гипоталамуса мышей, нокаутных по гену p53, наблюдалось значительное снижение уровня мРНК вазопрессина. Количество иммунореактивного вазопрессина в клетках гипоталамических нейросекреторных центров также было меньше у нокаутных мышей, чем у мышей дикого типа, что указывает на возможность активирующего влияния проапоптозного белка р53 на экспрессию вазопрессина. Мы наблюдали также снижение уровня экспрессии тирозингидроксилазы во всех изученных дофаминергических ядрах мышей-нокаутов по проапоптозному белку р53 (Рис.12).
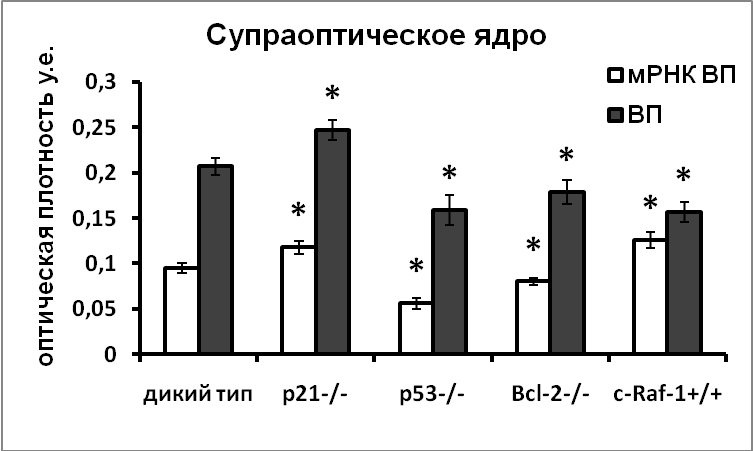 | 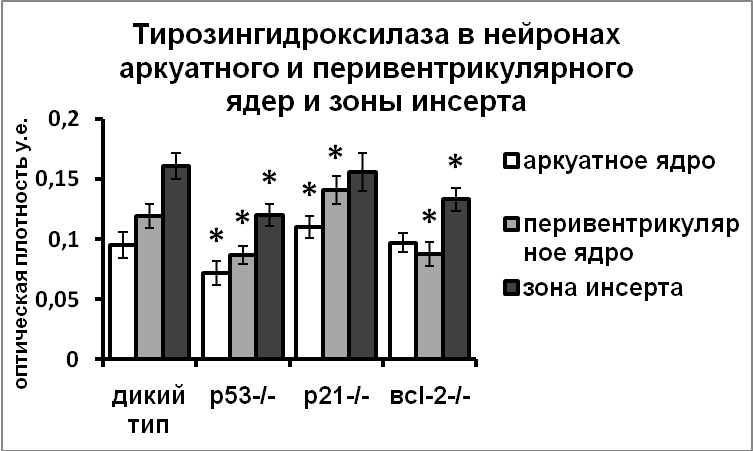 |
Рис. 12. Содержание мРНК вазопрессина и иммунореактивного вазопрессина в супраоптическом ядре и тирозингидроксилазы в аркуатном ядре, перивентрикулярном ядре и в зоне инсерта мышей дикого типа, и мышей-нокаутов по гену p21, р53, bcl-2 и cRaf
По оси ординат: оптическая плотность, выраженная в условных единицах на мкм2. *-достоверность отличия от контроля при p<0,05.
Известно, что при генотоксическом стрессе взаимодействие белков р53 и р21 приводит к остановке клеточного деления [Harper, et al., 1993; Waldman, et al., 1995]. В наших экспериментах у мышей-нокаутов по гену р21 показано повышение экспрессии вазопрессина в нейронах супраоптического и паравентрикулярного ядер и тирозингидроксилазы в нейронах аркуатного и перивентрикулярного ядер (Рис.12).
Возможно, что изменения в активности вазопрессинергических и дофаминергических нейросекреторных клеток мышей нокаутов возникают вследствие адаптивных изменений, возникших из-за неполноценности развития и функционирования органов–мишеней, регулируемых этими нейронами.
Одним из наиболее часто применяемых методов исследования функций белков апоптоза является использование их фармакологических блокаторов, что позволяет избежать влияния компенсаторных изменений, возможно, возникающих в результате генетической инактивации гена, и показать непосредственную зависимость нейрональной активности от присутствия в нейронах активного белка.
Для выяснения роли p53 в регуляции биосинтеза вазопрессина нейронами супраоптического ядра гипоталамуса мы провели эксперимент in vivo с внутрибрюшинным введением блокатора p53 - Pifithrin-а (Рис.13,14).
Очевидно, что системное введение Pifithrin-а вызывает изменение активности p53 не только в нервной системе, но и в периферических тканях. Чтобы оценить непосредственное влияние инактивации p53 на вазопрессинергические нейроны, мы провели эксперимент in vivo с внутригипоталамическим введением Pifithrin-а (Рис.15,16). Для того чтобы выявить влияние инактивации p53 на секреторную активность нейронов супраоптического ядра и исключить воздействия проекций других отделов ЦНС и периферических органов на активность исследуемых гипоталамических центров, мы провели эксперимент in vitro, в котором срезы гипоталамуса инкубировали в среде, содержащей Pifithrin-а (Рис.17).
Независимо от способа введения блокатора р53 мы показали, что инактивация p53 приводит к повышению содержания вазопрессина в телах нейронов супраоптического ядра, при неизменяющемся уровне синтеза мРНК вазопрессина (Рис. 13,14,15), и к увеличению уровня диуреза (Рис. 16), что указывает на торможение выведения вазопрессина из тел гипоталамических клеток. Отсутствие изменений в активности синтеза вазопрессина коррелировало с неизменяющейся активностью транскрипционного фактора CREB, что косвенно указывает на его ключевую роль в регуляции транксрипции вазопрессина. При этом инактивация p53 привела к снижению содержания фосфо-MEK1/2 киназы и фосфо- ERK1/2 киназ в телах нейронов супраоптического ядра и их волокнах, входящих в состав задней доли гипофиза (Рис. 17), что сопровождалось торможением выведения вазопрессина. На основании полученных данных можно заключить, что снижение содержания активной формы ERК1/2 киназы, наблюдаемое нами в супраоптическом ядре и в задней доле гипофиза при подавлении активности p53, может приводить к уменьшению активности ответственных за транспорт в аксонах белков. Таким образом, ERK1/2 каскад опосредует влияние p53 на аксональный транспорт гранул вазопрессина.
А | Б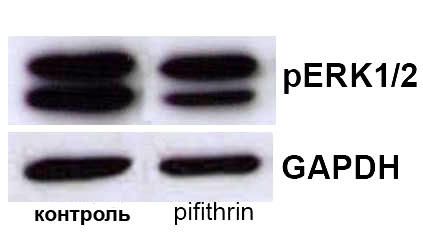 |
Рис. 13. Вестерн Блотт анализ содержания фосфо-ERK1/2 киназы (pERK1/2) в супраоптическом ядре (А) и задней доли гопофиза (Б) крыс подвергнутых внутрибрюшинному введению растворителя блокатора (контроль) и блокатора p53 Pifithrin-а (Pifithrin). В качестве контроля количества белка в пробах использовали GAPDH.
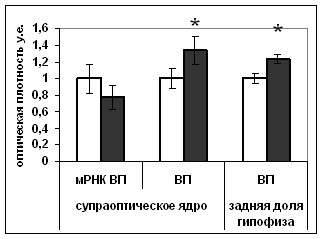 | 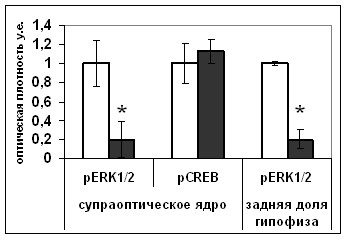 |
Рис. 14. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), фосфо-ERK1/2 (pERK1/2), фосфо-CREB (pCREB) в нейронах супраоптического ядра и задней доли гипофиза крыс, подвергнутых внутрибрюшинному введению растворителя блокатора (белые столбики) и блокатора p53 Pifithrin-а (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
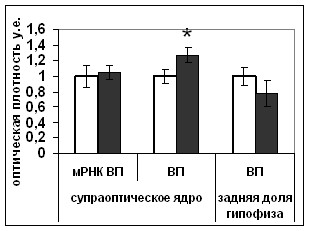 | 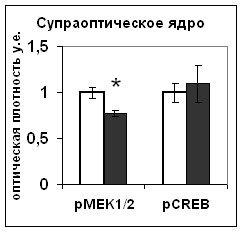 |
Рис. 15. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), фосфо-ERK1/2 (pERK1/2), фосфо-CREB (pCREB) в нейронах супраоптического ядра и задней доле гипофиза крыс, подвергнутых внутригипоталамическому введению растворителя блокатора (белые столбики) и блокатора p53 Pifithrin-а (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
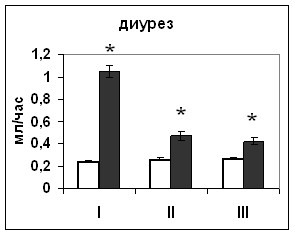 | Рис. 16. Уровень диуреза крыс, подвергнутых внутригипоталамическому введению растворителя блокатора (белые столбики) и Pifithrin-а (серые столбики). По оси абсцисс: I – измерение через 2 часа после первого введения, II –за 2 часа перед вторым введением, III – через 2 часа после второго введения. По оси ординат: усредненный объем мочи крыс, выраженный в мл/час/на животное *-достоверность отличия от контроля при p<0,05. |
 | 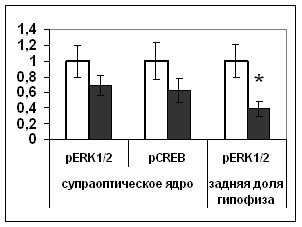 |
Рис. 17. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), фосфо-CREB (pCREB), фосфо-ERK1/2 (pERK1/2) в нейронах супраоптического ядра и волокнах задней доли гипофиза гипоталамических срезов, инкубировавшихся в среде, содержащей растворитель блокатора (белые столбики) и блокатор p53 Pifithrin-а (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
У мышей-нокаутов по гену bcl-2 наблюдалось значительное уменьшение уровня синтеза вазопрессина. Также наши данные показали снижение активности и «классических» дофаминергических нейронов (Рис.12), что позволило предположить участие белка Bcl-2 в регуляции функции гипоталамических нейронов различной эргичности. Для изучения характера прямого влияния антиапоптозного белка Bcl-2 на функциональную активность нейронов мы провели эксперименты in vivo и in vitro с введением фармакологического блокатора Bcl-2 HA14-1.
Мы показали увеличение содержания Bcl-2 после внутригипоталамического введения HA14-1 (Рис. 18). Возможно, усиление экспрессии Bcl-2, показанное в этом эксперименте, связано с компенсаторным увеличением синтеза Bcl-2 через 36 часов после первого введения блокатора и 8 часов после второго. В этом случае введение HA14-1 вызвало усиление секреторной активности вазопрессинергических нейронов супраоптического ядра как на уровне синтеза (увеличение количества мРНК вазопрессина в телах нейронов), так и на уровне выведения (снижение содержания вазопрессина в задней доле гипофиза (Рис.18) и значительное уменьшение уровня диуреза) (Рис.19).
По данным литературы, одной из мишеней Bcl-2 является транскрипционный фактор CREB [Jiao, et al., 2005]. Мы показали увеличение содержания фосфо-CREB в нейронах супраоптического ядра в ответ на внутригипоталамическое введение блокатора HA14-1 (Рис 5Б). Очевидно, активация CREB, в свою очередь, вызвала увеличение активности биосинтеза вазопрессина нейронами супраоптического ядра. Непосредственный механизм активации CREB антиапоптозным белком Bcl-2 в данных экспериментах пока не ясен. С одной стороны, активация CREB напрямую зависит от уровня кальция в цитоплазме [Dolmetsch, et al., 2001], который регулируется, в том числе, и белком Bcl-2 [Foyouzi-Youssefi, et al., 2000]. С другой стороны, CREB является одной из мишеней ERK1/2 каскада [Wang, et al., 2003].
Действительно, внутригипоталамическое введение блокатора HA14-1 вызвало увеличение содержания фосфо-MEK1/2 киназы и фосфо-Elk1 в нейронах супраоптического ядра (Рис.18), что свидетельствует об активации ERK1/2 каскада [Pearson, et al., 2001].
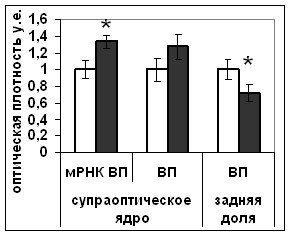 | 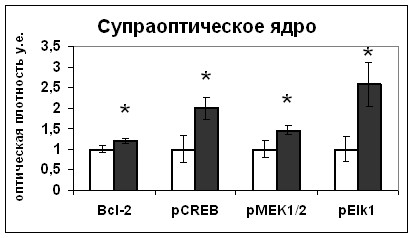 |
Рис. 18. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), Bcl-2, фосфо-CREB (pCREB), фосфо-MEK1/2 (pMEK1/2) и фосфо-Elk1(pElk1) в нейронах супраоптического ядра и в задней доле гипофиза крыс, подвергнутых внутригипоталамическому введению растворителя блокатора (белые столбики) и HA14-1(серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
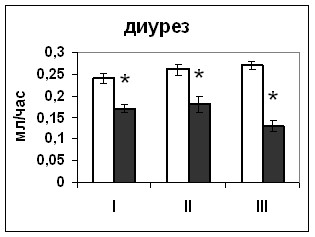 | Рис. 19. Уровень диуреза крыс, подвергнутых внутригипоталамическому введению растворителя блокатора (белые столбики) и HA14-1(серые столбики). По оси абсцисс: I – измерение через 2 часа после первого введения, II –за 2 часа перед вторым введением, III – через 2 часа после второго введения. По оси ординат: усредненный объем мочи крыс, выраженный в мл/час/на животное *-достоверность отличия от контроля при p<0,05. |
Таким образом, увеличение Bcl-2 в нейронах супраоптического ядра сопровождалось активацией ERK1/2 сигнального каскада и транскрипционных факторов Elk1 и CREB, что приводило к повышению экспрессии вазопрессина. Полученные данные свидетельствуют о возможности модулирующего действия Bcl-2 на ERK1/2 каскад.
В эксперименте in vitro мы показали, что 5-часовая инкубация срезов с блокатором HA14-1 вызывает значительное снижение содержания Bcl-2 в нейронах супраоптического ядра (Рис. 20). При этом наблюдалось уменьшение активности CREB в нейронах супраоптического ядра (Рис.20), что очевидно является причиной снижения уровня синтеза вазопрессина, наблюдаемого в этом эксперименте.
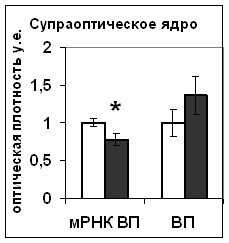 | 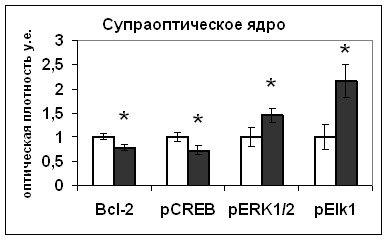 |
Рис. 20. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), Bcl-2, фосфо-CREB (pCREB), фосфо-ERK1/2 (pERK1/2) и фосфо-Elk1 (pElk1) в нейронах гипоталамических срезов, инкубировавшихся в среде, содержащей растворитель блокатора (белые столбики) и блокатор Bcl-2 HA14-1 (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
Мы показали значительное увеличение содержания как фосфо-ERK1/2 киназы, так и фосфо-Elk1, в нейронах супраоптического ядра после 5-часовой инкубации с HA14-1 (Рис.20). В связи с тем, что в эксперименте in vitro уровень синтеза вазопрессина нейронами супраоптического ядра снижался, повышение активности ERK1/2 киназы свидетельствует о вовлечения этого каскада в другие процессы в нейронах супраоптического ядра, не связанные с модуляцией синтеза вазопрессина в условиях недостатка антиапоптозного белка Bcl-2.
Таким образом, на основании полученных в экспериментах in vivo и in vitro данных можно заключить, что антиапоптозный белок Bcl-2 участвует в регуляции активности синтеза вазопрессина нейронами супраоптического ядра, вызывая активацию транскрипционного фактора CREB. При этом влияние Bcl-2 на биосинтез вазопрессина нейронами супраоптического ядра, скорее всего, не зависит от его действия на активность ERK1/2 сигнального каскада.
Анализ активности вазопрессинергических и дофаминергических нейронов показал, что белки апоптоза вовлечены в регуляцию функциональной активности не только вазопрессинергических нейросекреторных клеток гипоталамуса, но и дофаминергических нейронов мозга. Таким образом, можно говорить, что белки апоптоза влияют на функциональную активность не только нейросекреторных клеток, но и модулируют активность «классических» нейронов мозга.
Обобщая представленный материал, следует отметить, что традиционные представления о строго ограниченных функциях белков апоптоза, связанных с регуляцией клеточной гибели, существенно изменены новыми сведениями о способности проапоптозного белка р53 и антиапоптозного белка Bcl-2 модулировать функциональную активность нейронов. Выявлены механизмы этого регуляторного влияния (Рис.21).
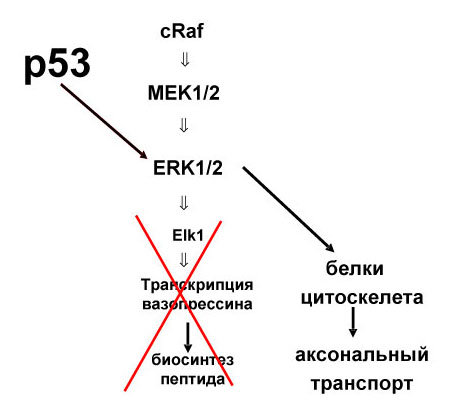 | 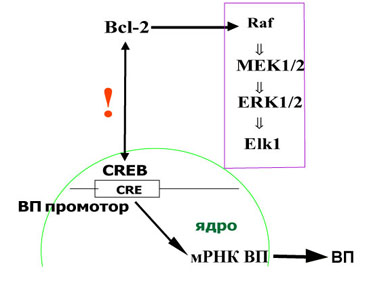 |
Рис. 21. Схема регуляции биосинтеза вазопрессина проапоптозным белком р53 и антиапоптозным белком Bcl-2.
Участие ERK1/2 сигнального каскада в регуляции функциональной активности нейронов гипоталамуса
Изменение активности белков апоптоза и, соответственно, активности нейронов сопровождается изменением в состоянии участников ERK1/2 сигнального каскада, что заставило нас в следующей серии экспериментов исследовать характер влияния ERK1/2 сигнального каскада на функциональное состояние вазопрессинергических нейронов гипоталамуса.
При анализе трансгенных мышей с повышенной экспрессией одной из киназ ERK1/2 сигнального каскада – cRaf киназы, было показано достоверное усиление синтеза вазопрессина в нейронах гипоталамуса и выведения его из тел нейронов (Рис.12). В экспериментах in vitro с использованием блокатора MEK1/2 - киназы UO126 было показано значительное падение активности вазопрессинергических нейронов, выражающееся в уменьшении синтеза вазопрессина, что сопровождалось снижением активности транскрипционного фактора CREB (Рис.22). Можно заключить, что ERK1/2 каскад участвует в регуляции биосинтеза вазопрессина, и что влияние ERK1/2 каскада на биосинтез вазопрессина может быть опосредовано транскрипционным фактором CREB.
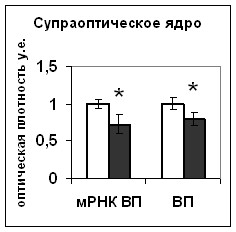 | 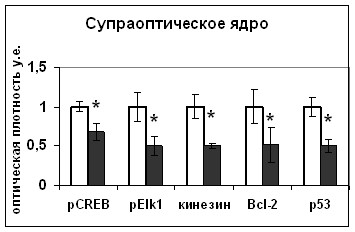 |
Рис. 22. Содержание мРНК вазопрессина (мРНК ВП), вазопрессина (ВП), фосфо-CREB (pCREB), фосфо-Elk1 (pElk1), кинезина, Bcl-2 и р53 в нейронах гипоталамических срезов, инкубировавшихся в среде, содержащей растворитель блокатора (белые столбики) и блокатор ERK1/2 каскада UO126 (серые столбики).
По оси ординат: относительная оптическая плотность, выраженная в условных единицах. *-достоверность отличия от контроля при p<0,05.
Мы показали, что усиление транспорта и выведения вазопрессина при дегидратации сопровождается накоплением в терминалях нейронов гипоталамуса активных киназ ERK1/2 каскада, что в совокупности с данными литературы об участии ERK1/2 пути в регуляции активности нейрофиламентов указывает на возможность участия киназ ERK1/2 каскада в регуляции транспорта и выведения вазопрессина (Рис.22). Возможной мишенью действия киназ ERK1/2 каскада в регуляции антероградного транспорта вазопрессина является кинезин, поскольку было показано, что ERK1/2 каскад вовлечен в регуляцию активности одного из белков семейства кинезин – MS-KIF18A [Luboshits and Benayahu, 2007]. Большинство авторов сходятся во мнении, что антероградный транспорт нейросекреторных гранул по микротрубочкам осуществляют белки семейства кинезинов [Gainer and Chin, 1998; Park, et al., 2009; Senda and Yu, 1999], однако экспериментальных данных об участии кинезина в транспорте нейросекреторных гранул очень мало. Анализ распределения кинезина в вазопрессинергических клетках супраоптического ядра показал, что при дегидратации наблюдается увеличение содержания кинезина в супраоптическом ядре (Рис. 11), тогда как в задней доле гипофиза кинезина становится меньше (Рис. 11). Таким образом, по-видимому, при дегидратации происходит усиление экспрессии кинезина, равно как и вазопрессина, он транспортирует гранулы с вазопрессином в нейрогемальные отделы, где вазопрессин выбрасывается в кровь, а кинезин, возможно, подвергается протеасомной деградации.
Инактивация ERK1/2 каскада привела к снижению содержания кинезина в нейронах супраоптического ядра (Рис. 22). Зависимость экспрессии кинезина от активности ERK1/2 киназы подтверждает наше предположение о возможности участия ERK1/2 каскада в регуляции антероградного транспорта вазопрессина за счет воздействия на траспортный белок кинезин.
Таким образом, показано, что ERK1/2 каскад участвует в регуляции биосинтеза вазопрессина, и его влияние опосредовано транскрипционными факторами Elk1 и CREB. Показана зависимость экспрессии транспортного белка кинезина от активности ERK1/2 киназы и подтверждено участие кинезина в реализации антероградного транспорта нейросекреторных вазопрессинергических гранул.
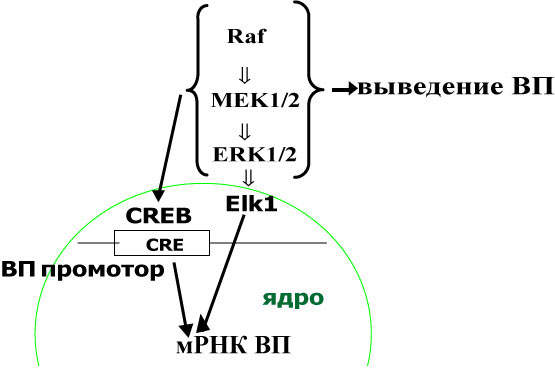 | Рис. 23. Схема влияния ERK1/2 каскада на биосинтез вазопрессина. |
Заключение
Регуляция биосинтеза вазопрессина нейросекреторными нейронами гипоталамуса до сих пор остается актуальным предметом исследования. В представленной работе рассмотрены внутриклеточные механизмы, ранее не изучавшиеся в связи с регуляцией секреции вазопрессина, но функции которых были показаны при изучении апоптоза и клеточного цикла. Установлено, что сигнальные белки апоптоза, р53 и Bcl-2, включаются во внутриклеточные пути передачи сигнала от рецепторов клетки на аппарат биосинтеза вазопрессина и играют модулирующую роль в регуляции функциональной активности вазопрессинергических нейронов. Bcl-2 стимулирует экспрессию вазопрессина нейронами супраоптического ядра, усиливая активацию транскрипционного фактора CREB. р53 вызывает активцию транспорта вазопрессинергических нейросекреторных гранул по аксонам и их выведение в системный кровоток, и его действие опосредовано киназами ERK1/2 сигнального каскада. Показано активирующее влияние ERK1/2 сигнального каскада на секрецию вазопрессина и установлена его роль в передаче сигнала от белков апоптоза на аппарат биосинтеза и выведения вазопрессина. Выявлена модулирующая роль NO в регуляции функциональной активности вазопрессинергических нейронов катехоламинами и в регуляции экспрессии белков апоптоза этими нейронами при различных воздействиях. У взрослых животных изменение плотности катехоламинергической иннервации и содержания в клетках нейромодулятора NO, а также специфические функциональные воздействия, такие как стресс и дегидратация приводят не только к изменению функционального состояния вазопрессинергических нейронов, но и вызывают усиление экспрессии белков апоптоза. При этом, за исключением патологических воздействий, таких как снижение катехоламинергической иннервации, активация экспрессии белков апоптоза не вызывает гибели нейронов, но приводит к изменению функциональной активности клеток. В ходе постнатального онтогенеза повышенная экспрессия белков апоптоза вызывает гибель части нейронов и обеспечивает формирование клеточного состава гипоталамических нейросекреторных ядер, таким образом, в онтогенезе белки апоптоза выполняют традиционно приписываемую им роль регуляторов апоптоза. В целом проведенное исследование указывает на существование тесной взаимосвязи между функциональным статусом и жизнеспособностью нейронов, которая обеспечивается взаимодействием единых внутриклеточных сигнальных путей (Рис. 24).
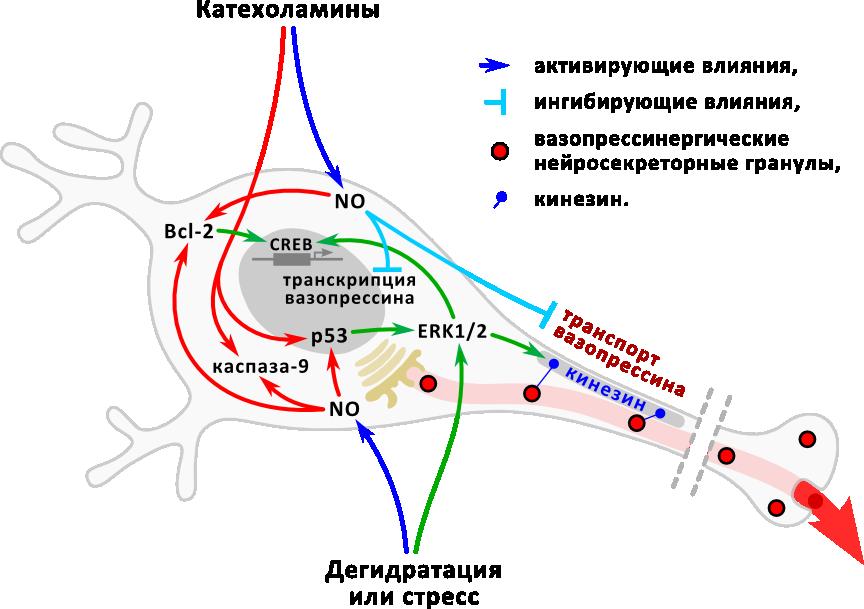 |
| Рис. 24. Взаимодействие внутриклеточных сигнальных посредников в регуляции функционального состояния нейронов и их жизнеспособности. |
СПИСОК СОКРАЩЕНИЙ
Bcl-2 –B-cell lymphoma 2
CRE - cAMP response element
CREB - cAMP response element binding protein
Elk1 - (Ets)-like transcription factor-1
ERK – Extracelular regulated kinase
MAPK – Mitogen-activated protein kinase caskade
P53 - protein 53 or tumor protein 53
nNOS – нейрональная NO-синтаза
ВЫВОДЫ
- Вазопрессинергические нейроны супраоптического ядра крыс заканчивают пролиферацию и выходят в дифференцировку на 14 день эмбриогенеза, на сутки раньше, чем нейроны паравентрикулярного ядра. Апоптотическая гибель вазопрессинергических нейронов в ходе постнатального онтогенеза также завершается раньше в супраоптическом ядре, чем в паравентрикулярном.
- Морфогенетическое влияние катехоламинов на развитие вазопрессинергической системы гипоталамуса опосредуется NO. Нарушение катехоламинергической иннервации в ходе эмбриогенеза приводит к более позднему завершению апоптоза вазопрессинергических нейронов супраоптического и паравентрикулярного ядер гипоталамуса.
- Совокупность данных, полученных в экспериментах in vivo и in vitro с использованием норадреналина, дофамина и блокатора синтеза катехоламинов, свидетельствует об ингибирующем действии катехоламинов на синтез и, особенно, на выведение вазопрессина. Ингибирующее действие катехоламинов на синтез и выведение вазопрессина опосредуется NO.
- Как снижение, так и повышение уровня катехоламинов в мозге приводит к усилению экспрессии белков апоптоза и nNOS в вазопрессинергических нейронах гипоталамуса. Основной мишенью NO в регуляции апоптоза является антиапоптозный белок Bcl-2. Снижение уровня катехоламинов приводит к апоптозу вазопрессинергических нейронов. Активация вазопрессинергических нейронов вследствие водной депривации предохраняет нейроны от апоптоза, вызваного нарушением катехоламинергической иннервации.
- Физиологические воздействия, стресс и водная депривация, вызывающие активацию вазопрессинергических нейронов взрослых животных, не приводят к гибели нейронов, несмотря на увеличение экспрессии сигнальных белков апоптоза.
- Белки апоптоза оказывают модулирующее влияние на функциональную активность вазопрессин- и дофаминергических нейронов. Bcl-2 усиливает синтез вазопрессина нейронами гипоталамуса, влияя на активность транскрипционного фактора CREB. Р53 оказывает активирующее действие на аксональный транспорт вазопрессина за счет взаимодействия с киназами ERK1/2 сигнального каскада.
- ERK1/2 сигнальный каскад оказывает активирующее влияние на экспрессию вазопрессина нейронами гипоталамуса, как на уровне синтеза вазопрессина, активируя транскрипционные факторы Elk1 и CREB, так и на уровне его выведения, участвуя в регуляции экспрессии транспортного белка кинезина.
- Совокупность полученных данных свидетельствует о возможности одних и тех же внутриклеточных сигнальных посредников принимать участие в регуляции функционального состояния нейронов и обеспечивать их жизнеспособность.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Черниговская Е.В., Данилова О.А., Четверухин В.К. Характеристика гормонального профиля центральных звеньев регуляции адренокортикальной функции в постнатальном онтогенезе крысят. // Ж Эвол. Биохим. Физиол. - 1991. - Т.27. - N 4. - С. 467-471.
- Данилова О.А., Черниговская Е.В., Четверухин В.К. Гормональные показатели реактивности центральных звеньев гипоталамо-гипофизарно-адренокортикальной системы крыс в ходе постнатального онтогенеза. // Ж Эвол. Биохим. Физиол. - 1991. - Т.27. - N 3. - С. 308-313.
- Beltramo M, Calas A, Chernigovskaya E, Borisova N, Polenova O, Tillet Y, Thibault J, Ugrumov M. Postnatal development of the suprachiasmatic nucleus in the rat. Morpho-functional characteristics and time course of tyrosine hydroxylase immunopositive fibers. // Neuroscience. - 1994. - V63. - N2. - Р.603-610.
- Beltramo M, Calas A, Chernigovskaya E, Thibault J, Ugrumov M. Long-lasting effect of catecholamine deficiency on differentiating vasopressin and oxytocin neurons in the rat supraoptic nucleus. // Neuroscience. - 1997. - V.79. - N 2. - P. 555-561.
- Черниговская Е.В., Глазова М.В., ЯмоваЛ.А., Евтеева С.Е., Красновская И.А. Роль катехоламинов в регуляции функционального состояния вазопрессинергических клеток гипоталамуса крыс. // Ж Эвол. Биохим. Физиол. - 2001. - Т.37. - N2. - С.144-149.
- Ямова Л.А., Глазова М.В., Евтеева С.Е., Черниговская Е.В. Роль различных типов адренорецепторов в регуляции функциональной активности вазопрессинергических нейросекреторных клеток гипоталамуса крыс. // Ж Эвол. Биохим. Физиол. - 2002. - Т.38. - N4. - С.383-387.
- Таранухин А.Г., Глазова М.В., Евтеева С.Е., Ямова Л.А., Черниговская Е.В. Участие катехоламинов и оксида азота в регуляции апоптоза в нонапептидергических нейронах гипоталамуса крыс. // Ж. Эвол. Биохим. Физиол. - 2002. - Т. 38. - С. 615-619.
- Четверухин В.К., Черниговская Е.В., Данилова О.А. Половая дифференцировка параметров клеточного цикла в вентрикулярной зоне развивающегося преоптического ядра эмбрионов крыс. // Докл. Биол. Наук. - 2002. - Т.385. - с. 319-322.
- Ямова Л.А., Глазова М.В., Евтеева С.Е., Черниговская Е.В. Влияние блокады синтеза катехоламинов на функциональное состояние вазопрессинергических нейронов гипоталамуса дегидратированных крыс. // Ж. Эвол. Биохим. Физиол. - 2003. - Т.39. - N3. - С.292-296.
- Таранухин А.Г., Черниговская Е.В., Глазова М.В., Евтеева С.Е., Ямова Л.А., Оганесян Г.А. Регуляция катехоламинами апоптоза нонапептидергических нейронов гипоталамуса крыс в опытах in vitro. // Ж. эвол. биохим. и физиол. - 2003. - Т. 39. - С. 593-598.
- Chernigovskaya EV, Taranukhin AG, Glazova MV, Yamova LA, Fedorov LM. Apoptotic signaling proteins: possible participation in the regulation of vasopressin and catecholamines biosynthesis in the hypothalamus. // Histochem Cell Biol. - 2005. - V.124. - N6. - Р.523-533.
- Черниговская Е.В., Таранухин А.Г., Ямова Л.А., Комиссаров А.Б., Глазова М.В. Участие нейрональной NO-синтазы в регуляции вазопрессинергических нейронов гипоталамуса крысят на ранних стадиях постнатального онтогенеза. // Ж. эвол. биохим. и физиол. - 2006. - Т. 42. - N 1. – C. 80-87.
- Таранухин А.Г., Ямова Л.А Черниговская Е.В. Участие NO в регуляции апоптоза нонапептидергических нейронов неонатальных крысят при нарушении катехоламинергической иннервации // Ж. эвол. биохим. и физиол. - 2006. - Т. 42. - N 2. - C.174-180.
- Yamova L, Atochin D, Glazova M, Chernigovskaya E, Huang P. Role of neuronal nitric oxide in the regulation of vasopressin expression and release in response to inhibition of catecholamine synthesis and dehydration. // Neurosci Lett. - 2007. - V. 426. - N3. - P.160-165.
- Никитина Л.С., Глазова М.В., Дорофеева Н.А., Черниговская Е.В. Влияние белков апоптоза на функцию вазопрессин-и дофаминергических нейронов гипоталамуса // Ж. эвол. биохим. и физиол. – 2008. - Т.44. - N.3. – C. 311-7.
- Chernigovskaya E., Nikitina L., Dorofeeva N., Glazova M. Effects of selective Bcl-2 inhibitor HA14-1 treatments on functional activity of magnocellular vasopressinergic neurons of rat hypothalamus. // Neurosci Lett. – 2008. – V.437. – N.1. – P.59-64.
- Chernigovskaya E, Atochin D, Yamova L, Huang P, Glazova M. Immunohistochemical expression of Bcl-2, p53 and caspase-9 in hypothalamus magnocellular centers of nNOS knockout mice following water deprivation. Biotech Histochem. 2010. Jul 22. [Epub ahead of print] PMID: 20662604
Всего опубликовано 46 статей в рецензируемых журналах.
Тезисы докладов
- Глазова М.В., Евтеева С.Е., Ямова Л.А., Черниговская Е.В. Изучение физиологической роли катехоламинов мозга в регуляции функций вазопрессинергических нейронов гипоталамуса. // V Всероссийская конференция «Нейроэндокринология-2000». - Санкт-Петербург. - 2000. - С.40.
- Ямова Л., Аточин Д., Глазова М., Черниговская Е. Участие катехоламинов и NO в регуляции функций вазопрессинергических нейронов супраоптического и паравентрикулярного ядер гипоталамуса. // Всероссийская конференция с международным участием “Нейроэндокринология-2003”. - Санкт-Петербург. - 2003. - С.164-165.
- Yamova L., Atochin D., Chernigovskaya E. The examination of functional state of vasopressinergic neurons and signal apoptotic proteins expression in nNOS-knockout mice. // Abstracts of International Symposium “Neuron differentiation and plasticity – regulation by intercellular signals”. - Moscow, Russia. - 2003. - p. 73.
- Chernigovskaya E., Taranukhin A., Yamova L., Fedorov L. Signalling apoptotic proteins: possible participation in the regulation of vasopressin and catecholamine biosynthesis in the hypothalamus. // Abstracts. International symposium “Neuron differentiation and plasticity – regulation by intercellular signals”. - Moscow, Russia. - 2003. - P. 43.
- Taranukhin A., Yamova L., Chernigovskaya E. Prenatal blockade of catecholamines synthesis influences on apoptotic signal proteins expression in rat nonapeptidergic neurons on 3-d and 15-th postnatal days. // Abstracts. International symposium “Neuron differentiation and plasticity – regulation by intercellular signals”. - Moscow, Russia. - 2003. - P. 58-59.
- Четверухин В.К., Черниговская Е.В. Половые различия в сроках возникновения вазопрессин- (ВП) и окситоцинергических нейронов гипоталамуса крыс // XIX съезд Физиологического общества им. И.П. Павлова. - Екатеринбург. 2004. - Рос. физиол. журн. - Т. 90. – C. 191-192.
- Черниговская Е.В., Никитина Л.С., Дорофеева Н.А., Романова И.В., Аристакесян Е.А. Участие сигнальных белков апоптоза в регуляции функциональной активности нейронов мозга крыс. // Научные труды 1 Съезда физиологов СНГ. – Дагомыс. – 2005. – Т.2. - С.53.
- Никитина Л.С., Дорофеева Н.А., Глазова М.В., Романова И.В., Черниговская Е.В. Участие белков апоптоза в регуляции активности нейронов мозга. // Тезисы 5 международной конференции по функциональной нейроморфологии «Колосовские чтения-2006». - Санкт-Петербург. - 2006.- С. 66.
- Черниговская Е.В., Никитина Л.С., Дорофеева Н.А., Глазова М.В., Романова И.В. Механизмы регуляции белками апоптоза вазопрессинергических и катехоламинергических нейронов мозга крыс. // Свободные радикалы, антиоксиданты и старение. – Астрахань. – 2006. - C.38-39.
- Chernigovskaya EV, Nikitina LS, Dorofeeva NA, Glazova MV, Romanova I.V. Participation of apoptotic proteins in regulation of neuronal activity in rat brain. // Abs. 6-th ICN. - Fron. in Neuroendocrinol. - V.27. – N.1. - P.148.
- Никитина Л.С., Дорофеева Н.А., Глазова М.В., Черниговская Е.В. Регуляция белками апоптоза вазопрессинергических нейронов гипоталамуса // XX съезд физиологического общества имени И.П. Павлова. - Москва. – 2007. - С.67.
- Черниговская Е.В., Никитина Л.С., Дорофеева Н.А., Глазова М.В. Взаимодействие белков апоптоза Bcl-2 и p53 и ERK1/2 модуля MAPK сигнального каскада в регуляции активности вазопрессинергических нейронов супраоптического ядра // тезисы Всероссийский симпозиум с международным участием "Гормональные механизмы адаптации". - Санкт-Петербург. – 2007. - C.90-91.
- Nikitina L., Glazova M., Dorofeeva N., Chernigovskaya E. Inhibition of Bcl-2 and p53 alter the functional activity of hypothalamic magnocellular neurons and affect the MAPK/ERK pathway. // Abstr. of conf. Apoptosis World 2008. From mechanisms to applications. - 2008. - Luxembourg. - P. 413.
- Никитина Л.С., Глазова М.В., Дорофеева Н.А., Губарева Е.А. Кириллова О.Д., Черниговская Е.В. Внутриклеточные механизмы регуляции активности вазопрессинергических нейронов гипоталамуса в условиях водной депривации. // Нейрохимические механизмы формирования адаптивных и патологических состояний мозга: Конференция с международным участием. Тезисы докладов. - 2008. - С.-Петербург. - C.101.
- Губарева Е.А., Никитина Л.С., Дорофеева Н.А., Кириллова О.Д. Глазова М.В., Черниговская Е.В. Влияние Bcl-2 на активность ERK-модуля МАРК каскада в нейронах супраоптического ядра гипоталамуса крыс. // Нейрохимические механизмы формирования адаптивных и патологических состояний мозга: Конференция с международным участием. Тезисы докладов. - 2008. - С.-Петербург. - C.36-37.
- Дорофеева Н.А., Никитина Л.С., Глазова М.В., Кириллова О.Д., Черниговская Е.В. Механизмы взаимодействия Bcl-2 и членов ERK1/2 модуля МАРК сигнального каскада в регуляции секреции вазопрессина. // Нейрохимические механизмы формирования адаптивных и патологических состояний мозга: Конференция с международным участием. Тезисы докладов. - 2008. - С.-Петербург. - C.43-44.
- Nikitina L., Dorofeeva N., Glazova M., Kirllova O. Chernigovskaya E. Bcl-2 modulates hypothalamic vasopressinergic neurons activity // Abstracts of 4th ESN Conference on Advances in Molecular Mechansims of Neurological Disorders. - J. Neurochem. – 2009. – P. 91-92.
- Dorofeeva N., Nikitina L., Glazova M., Chernigovskaya E. Involvement of p53 and ERK1/2 in the regulation of vasopressin secretion // Abstracts of 4th ESN Conference on Advances in Molecular Mechansims of Neurological Disorders. - J. Neurochem.-110 (Suppl. 1) – 2009. – P. 93.

