Патогенетическое обоснование комплексного лечения острого панкреатита
На правах рукописи
ДЁМИН Дмитрий Борисович
ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ КОМПЛЕКСНОГО
ЛЕЧЕНИЯ ОСТРОГО ПАНКРЕАТИТА
| 14.01.17 Хирургия 03.03.04 Гистология, цитология, клеточная биология |
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
ОРЕНБУРГ – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию »
| Научные консультанты: Доктор медицинских наук, профессор Заслуженный деятель науки РФ, доктор биологических наук, профессор Официальные оппоненты: Член-корреспондент РАМН, доктор медицинских наук, профессор, заведующий кафедрой общей хирургии МГМСУ Доктор медицинских наук, профессор кафедры общей хирургии ОрГМА Доктор медицинских наук, профессор, заведующий кафедрой гистологии и эмбриологии СамГМУ | Тарасенко Валерий Семенович Стадников Александр Абрамович Кубышкин Валерий Алексеевич Абрамзон Олег Михайлович Ямщиков Николай Васильевич |
Ведущее учреждение: НИИ скорой помощи им. И.И.Джанелидзе
(г. Санкт-Петербург)
Защита состоится «______»_______________200 г. в ______часов на заседании диссертационного совета Д 208.066.02 при Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 460000, г. Оренбург, ул. Советская, д.6. Зал заседаний ученого совета.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию »
Автореферат разослан «______»_____________________2010 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Р.И.Сайфутдинов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы.
Острый панкреатит (ОП) остается серьезной проблемой экстренной брюшной хирургии вследствие роста заболеваемости, увеличения числа его деструктивных форм с высокой летальностью (Пугаев А.В., Ачкасов Е.Е., 2007). Поиски эффективных методов лечения ОП вызваны отсутствием заметных успехов в данном направлении, дискуссионными вопросами хирургической тактики, высоким числом инфекционных осложнений и актуальностью проблемы вторичного иммунодефицита (Ярема И.В., 2003; Багненко С.Ф., Гольцов В.Р., 2008).
Известна патогенетическая роль прогрессирующих микроциркуляторных нарушений с ишемическим симптомокомплексом, активации свободно-радикальных процессов и цитокинового каскада в развитии ОП. Установлено, что гемодинамические нарушения появляются на ранних стадиях ОП, что обусловлено значительным повышением вязкости крови и глубокими изменениями на уровне микроциркуляторного русла (Ярема И.В., 2003), что приводит к прогрессирующей гипоксии тканей с запуском каскада окислительного стресса (Roth E., 2004; Weber H. et all., 2007). Активация липопероксидации при ОП ведёт к истощению факторов антиоксидантной защиты, прежде всего, аскорбиновой кислоты, одного из ключевых неферментнных антиоксидантов плазмы крови (Sweiry J.H., 1996). Тяжёлый ОП сопровождается многократным снижением уровня аскорбиновой кислоты в крови (Scott P. et all, 1993; Bonham M.J. et all, 1999; Roth E. et all, 2004). Tsai K. et all. (1998) полагают, что имеется чёткая зависимость тяжести ОП от степени истощения антиоксидантных факторов, прежде всего, аскорбиновой кислоты. Известна патогенетическая роль активации и разбалансировки цитокиновой сети в развитии острых хирургических заболеваний органов брюшной полости, в том числе, ОП (Салиенко С.В. с соавт., 2006, Козлов В.К., 2006, Жидовинов А.А. с соавт., 2007), однако вопросы коррекции данного процесса остаются открытыми.
В настоящее время недостаточно изучен вопрос о методах воздействия на патофизиологические процессы при ОП, особенно на его ранних сроках до формирования некроза, и влиянии их на дальнейшее его течение и развитие осложнений. Это обусловливает необходимость поиска новых способов патогенетического лечения данного заболевания (Толстой А.Д. с соавт., 2003; Багненко С.Ф., Гольцов В.Р., 2008). Известно, что от объёма некроза зависит вероятность его инфицирования. Соответственно, мероприятия, направленные на профилактику превращения очагов ишемии в некроз на ранних сроках течения ОП должны являться одним из краеугольных камней лечебной тактики. Это обусловливает, наряду с общепринятыми схемами лечения, необходимость применения препаратов, обладающих противоишемическими и антиоксидантными свойствами. Кроме того, учитывая, что ведущие продуценты цитокинов – гиперактивироанные макрофаги, для инактивации «цитокинового пожара» при ОП актуально применение средств, регулирующих их гиперэргическую реакцию с обратимым подавлением чрезмерной секреторной функции макрофагов.
Все вышеизложенное явилось предметом нашего исследования по обоснованию рационального метода лечения больных острым панкреатитом на основе воздействия на ведущие патогенетические звенья.
Цель и задачи исследования
Цель работы – разработать новые подходы к повышению эффективности лечения острого панкреатита за счёт патогенетически обоснованного применения комплекса лечебных мероприятий.
Для достижения этой цели решались следующие задачи:
1. В условиях экспериментального острого панкреатита (ЭОП) определить эффективность применения перфторана, больших доз аскорбиновой кислоты и их комбинации путём изучения морфофункциональных и биохимических изменений в тканях поджелудочной железы, печени и сыворотке крови.
2. Изучить эффективность применения перфторана, высоких доз аскорбиновой кислоты и их комбинации в лечении больных острым панкреатитом.
3. Оценить влияние перфторана, высоких доз аскорбиновой кислоты и их комбинации на иммунологическую динамику у больных острым панкреатитом.
4. Изучить роль противоишемической и массивной антиоксидантной терапии в профилактике инфицирования панкреонекроза.
5. Обосновать предпочтительность малоинвазивной хирургии в качестве стартового метода как фактора профилактики экзогенного инфицирования панкреатического некроза.
6. Сопоставить результаты лечения больных острым панкреатитом с исходными клинико-лабораторными показателями и разработана эффективная схема комплексного лечения данного заболевания.
7. Разработать новые способы диагностики и прогнозирования исхода острого панкреатита.
Научная новизна. Впервые изучена ультраструктурная реорганизация клеток паренхимы и стромы поджелудочной железы (ПЖ) и печени при ЭОП в условиях применения перфторана, высоких доз аскорбиновой кислоты и их комбинации.
С использованием комплексного методического подхода (световая и электронная микроскопия, морфометрия, иммуноцитохимическая идентификация апоптозных клеток) доказано оптимизирующее влияние перфторана и аскорбиновой кислоты, а особенно их комбинации на репаративные гистогенезы, васкулогенез, восстановление микроциркуляции в ПЖ и печени при ЭОП.
Впервые при ЭОП комплексно исследована динамика биохимических маркеров в сыворотке крови, тканях ПЖ и печени, отражающих выраженность ишемического процесса (молочная кислота), липопероксидации (диеновые конъюгаты (ДК), малоновый диальдегид (МДА)) и истощения уровня аскорбиновой кислоты и её изменения под воздействием перфторана, высоких доз аскорбиновой кислоты и их комбинации.
Впервые применены перфторан, высокие дозы аскорбиновой кислоты и их комбинация в комплексном лечении ОП и оценена их лечебная эффективность, в том числе, в профилактике инфицирования панкреонекроза.
Впервые в комплексе изучена динамика уровней молочной кислоты, аскорбиновой кислоты, некоторых продуктов липопероксидации (ДК, МДА), некоторых Th1-цитокинов (интерферон гамма (ИФН), фактор некроза опухоли альфа (ФНО)) и Th2-цитокинов (интерлейкин 4 (Ил-4), интерлейкин 10 (Ил-10)) в сыворотке крови у больных ОП при применении различных схем лечения и проведены клинико-лабораторные параллели.
Впервые показана роль соотношения Th1-/Th2-цитокинов в прогнозировании исхода ОП.
Разработаны способы прогнозирования исхода острого деструктивного панкреатита (патенты РФ на изобретение № 2153676 от 20.07.2000 г. и № 2338195 от 10.11.2008 г.).
Разработан способ диагностики гнойно-некротических осложнений при панкреонекрозе (патент РФ на изобретение № 2199121 от 20.02.2003 г.).
Разработан способ диагностики формы острого панкреатита (патент РФ на изобретение № 2339042 от 20.11.2008 г.).
Научно-практическое значение. Полученные новые экспериментальные и клинические данные по некоторым аспектам патогенеза ОП позволили разработать более рациональный комплекс его лечения, начиная с ранних сроков заболевания, что позволяет существенно изменить дальнейшее течение патологического процесса.
Показано, что уровни молочной кислоты и аскорбиновой кислоты в сыворотке крови являются ранними диагностическими и прогностическими предикторами ОП, отражают тяжесть процесса и эффективность проводимого лечения.
Использование перфторана, высоких дозы аскорбиновой кислоты, а особенно их комбинация в комплексном лечении ОП, начиная с ранних сроков заболевания, приводит к значительному уменьшению выраженности ведущих патогенетических звеньев деструкции панкреатической ткани и позволяет в ряде случаев добиться обрыва процесса и проведения его по асептическому пути.
Показана иммуномодулирующая роль перфторана при лечении ОП.
Показано, что малоинвазивные методы хирургического лечения наиболее эффективны при ограниченнных формах панкреонекроза.
Основные положения диссертации, выносимые на защиту.
1. Нарушение микроциркуляции с последующим развитием ишемических процессов с активацией анаэробного гликолиза и липопероксидации является важнейшим звеном патогенеза острого панкреатита, определяющим объём формирующегося некроза, течение и исход заболевания.
2. Выраженность истощения уровня аскорбиновой кислоты и интенсивность цитокиновой разбалансировки являются предикторами исхода данного заболевания.
3. Назначение комбинации перфторана с высокими дозами аскорбиновой кислоты является патогенетически обоснованной схемой в комплексном лечении острого панкреатита, позволяющей улучшить результаты лечения.
4. Эффективность проводимого комплексного лечения на ранних сроках заболевания позволяет говорить о «терапевтическом окне» при остром панкреатите, то есть на ранних сроках поражение панкреатической ткани обратимо.
5. Полученные результаты лечения больных острым панкреатитом обосновывают применение малоинвазивной хирургии в качестве стартового метода при необходимости хирургического лечения стерильного панкреонекроза.
Внедрение. Результаты диссертационной работы внедрены в учебный процесс на кафедрах госпитальной хирургии; хирургии факультета последипломной подготовки специалистов; гистологии, цитологии и эмбриологии Оренбургской государственной медицинской академии, а также используются в НИР лаборатории нейроэндокринной регуляции взаимодействия про- и эукариот Оренбургского филиала ЮУНЦ РАМН. Метод предложенного лечения внедрен в работу хирургических отделений Муниципальной городской клинической больницы №1 скорой медицинской помощи г. Оренбурга.
Апробация работы и публикации. Основные положения диссертации доложены и обсуждены на: V, VI межобластных научно-практических конференциях врачей Приволжско-Уральского военного округа (Оренбург, 2004, 2005); областной научно-практической конференции хирургов, посвященной 100-летию со дня рождения проф. Вилесова С.П. (Оренбург, 2005); VIII, IX Всероссийских научно-практических конференциях врачей Приволжско-Уральского военного округа (Оренбург, 2007, 2008); межобластной научно-практической конференции хирургов «Актуальные вопросы хирургии» (Бугуруслан, 2008); международной научно-практической конференции хирургов и урологов «Высокие технологии в медицине» (Нижний – Новгород, 2008); I съезде Российского общества хирургов-гастроэнтерологов «Актуальные вопросы хирургической гастроэнтерологии» (Геленджик, 2008); Всероссийской научной конференции «Нейробиологические аспекты морфогенеза и регенерации» (Оренбург 2008); XI, XIV, XV, XVI международных конгрессах хирургов – гепатологов России и стран СНГ (Омск, 2004; Санкт-Петербург, 2007; Казань, 2008; Екатеринбург, 2009); Всероссийской научной конференции «Клиническая анатомия и экспериментальная хирургия в XXI веке» (Оренбург, 2009); межрегиональной научно-практической конференции «Актуальные вопросы хирургии. Проблемы и пути решения» » (Оренбург 2009); VII Всероссийской конференции иммунологов «Актуальные вопросы фундаментальной и клинической иммунологии» с международным участием (Архангельск, 2009);
Диссертация апробирована на заседании проблемной комиссии по хирургии Оренбургской государственной медицинской академии. Получены четыре патента РФ на изобретение. По материалам диссертации опубликованы 46 печатных работ, в т.ч., 13 статей в ВАК-рецензируемых журналах, издано пособие для врачей («Применение перфторана в комплексном лечении острого панкреатита», 2009), получены 4 патента на изобретение.
Экспериментальные морфологические исследования по теме диссертации выполнены на кафедре гистологии, цитологии и эмбриологии (зав. кафедрой – проф. А.А.Стадников), иммунологические исследования – в проблемной лаборатории по изучению механизмов естественного иммунитета (зав. – проф. А.И.Смолягин), биохимические исследования – на кафедре биологической химии (зав. – проф. А.А.Никоноров) Оренбургской государственной медицинской академии. Клинический раздел работы выполнен на кафедре госпитальной хирургии ОрГМА (зав. кафедрой – проф. В.С.Тарасенко) и в хирургических отделениях на базе 1-й муниципальной больницы скорой медицинской помощи г. Оренбурга (главный врач – Заслуженный врач РФ А.К. Щетинин).
Объем и структура диссертации. Диссертация изложена на 283 страницах машинописного текста и состоит из введения, обзора литературы, материалов и методов, результатов собственных исследований, их обсуждения, выводов, практических рекомендаций и указателя литературы, включающего 409 источников, в том числе 239 работ на русском и 170 на иностранных языках. Работа иллюстрирована 61 рисунками, в том числе, 26 черно-белыми и цветными микрофотографиями гистологических препаратов и электронограмм и 57 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Экспериментальные исследования выполнены на 225 половозрелых морских свинках-самцах массой 550-720 гр. в 5 сериях опытов. Выбор морских свинок для моделирования ЭОП был принципиальным, так как эти животные, также как и человек, неспособны, в отличие от остальных млекопитающих, к эндогенному синтезу аскорбиновой кислоты, поэтому нуждаются в её постоянном приёме извне. Моделирование ЭОП осуществляли по методике Mallet Guy P. et all. (1971). В асептических условиях морским свинкам под эфирным наркозом производили верхнесрединную лапаротомию и выделяли ПЖ с введением в ткань железы 0,5-1,0 мл стерильной гетерожелчи с каплей аутокрови и дополнительной ее травматизацией браншами пинцета. В брюшную полость животного для дальнейшего введения препарата (в зависимости от серии) ставили тонкий эпидуральный катетер с ушиванием брюшной стенки. Экспериментальные животные разделены на пять групп по 45 свинок. В каждой группе выделены подгруппы по 15 животных: А – острый панкреатит без инфицирования; В – острый панкреатит с инфицированием E. Coli (в дозе 3 106 микробных клеток); С – острый панкреатит с инфицированием S. Aureus штамм P – 450 (в дозе 3 106 микробных клеток).
В серии животные не получали какого – либо лечения. Во серии вводили 0,9% раствор хлорида натрия в разовой дозе 6 мл/кг через 2 часа от начала опыта и затем ежедневно. В III серии свинки получали 5% раствор аскорбиновой кислоты в дозе 300 мг/кг через 2 часа от начала эксперимента и затем ежедневно. В IV серии животные получали перфторан в разовой дозе 6 мл/кг через 2 часа от начала эксперимента и затем ежедневно. В V серии животные получали комбинацию перфторана и аскорбиновой кислоты в вышеназванных дозировках. Сроки наблюдения животных – 5 суток. Животные выводились из опыта путем ингаляции летальной дозы эфира с последующей декапитацией и забором для гистологического изучения ПЖ и печени, а для биохимического исследования – проб крови, фрагментов ПЖ и печени. При выполнении исследований соблюдались «Правила проведения работ с использованием экспериментальных животных» согласно приказу МЗ СССР № 755 от 12.08.1977 г.
Клиническая часть работы базируется на обследовании 186 больных с подтверждённым ОП. Контролем служили данные биохимических и иммунологических исследований крови от 20 здоровых доноров. Исследования выполнены с информированного согласия пациентов и соответствуют этическим нормам Хельсинкской декларации (2000 г.). Ведущими критериями отбора больных были срок до 24 часов от начала заболевания и тяжесть ОП по шкале Glasgow-Imrie (1984) не менее 2 баллов. Из исследования были исключены больные с посттравматическим ОП и пациенты, которым была сразу выполнена лапаротомия при отёчном панкреатите или в ферментативную фазу панкреонекроза.
Все обследованные больные разделены на 4 группы. В I группе (45 человек) проводилось комплексное лечение по общепринятой методике (инфузионная терапия в объеме 40 мл/кг, блокаторы панкреатической и желудочной секреции, спазмолитики, антибиотики, антиоксиданты (аскорбиновая кислота 500 мг/сут. внутривенно)). Пациентам II группы (44 человека) при поступлении и далее ежедневно в течение всего периода лечения дополнительно вводили внутривенно капельно 5% раствор аскорбиновой кислоты в суточной дозе 2000 мг (1000 мг 2 раза в сутки). Пациентам III группы (48 человек) при поступлении дополнительно вводился внутривенно капельно перфторан в разовой дозе 6 мл/кг. Пациентам IV группы (49 человек) доплнительно вводили комбинацию перфторана и аскорбиновой кислоты в тех же дозировках.
Необходимость дозы перфторана 6 мл/кг обусловлена тем, что она достаточна для получения микроциркуляторного эффекта (Иваницкий Г.Р. с соавт, 2004; Клигуненко Е.Н. с соавт., 2004). Препарат вводился однократно, так как он в организме не метаболизируется и постепенно выводится в неизменённом виде (Богданова Л.А. с соавт., 2004). Выбор указанной дозы аскорбиновой кислоты осуществлен на основании прототипных исследований при других заболеваниях (Теселкин Ю.О., 1998; Айнабекова Б.А., 2001; Yamada T. et all., 2001; Brody S. et all., 2002).
Показанием к лапароскопии была перитонеальная симптоматика. Все эндохирургические вмешательства выполнялись в течение трёх суток с момента госпитализации. Объём операции – ревизия, дренирование сальниковой сумки и брюшной полости, по показаниям – холецистостомия. Открытые операции (лапаротомия, оментобурсостомия, ретроперитонеостомия) выполнялись при инфицировании панкреатического некроза с признаками массивного поражения. Пункционно-дренирующие вмешательства под контролем УЗИ при парапанкреатических жидкостных скоплениях, в том числе инфицированных, проводились в срок от 10 суток от начала заболевания. После выполненных вмешательств все больные получали многокомпонентную терапию согласно современным принципам лечения ОП, включая применение проточного лаважа сальниковой сумки, методов экстракорпоральной детоксикации, озонирования, электрохимического окисления и фотомодификации крови.
Методики морфологических исследований.
Изучение биоптатов ПЖ и печени у животных осуществляли через 24, 72 и 120 часов от начала эксперимента на световом и электронномикроскопическом уровнях. Для светооптических и иммуноцитохимических исследований полученный материал фиксировали в 10% водном растворе нейтрального формалина, спирт-формоле или жидкости Буэна. Обезвоживание и уплотнение материала производили в этаноле возрастающей крепости и заливали в смесь парафина с воском (1:1). Гистосрезы толщиной 5-6 мкм окрашивали гематоксилином Майера и эозином. Ферменты, маркеры митохондрий и лизосом определяли в свежезамороженных криостатных срезах органов в соответствии с методиками Nachlas M. (1960), Gomory G. (1963).
Дифференцировку углеводных соединений в тканях ПЖ проводили в соответствии с рекомендациями Пирса Э. (1962). Гликоген и нейтральные полисахариды выявляли перийодат-ШИФФ-реакцией по Мак-Манусу. С целью дифференциального анализа гликогена и нейтральных гликопротеидов гистологические срезы обрабатывали амилазой слюны при +37 оС в течение 1 часа. Гликозаминогликаны определяли в срезах толуидиновым синим (при рН 2,7; 4,0; 7,3) и альциановым синим (при рН 1,0; 2,7) с проведением соответствующих контролей с гиалуронидазами по Хейлу (Пирс Э., 1962).
Нуклеиновые кислоты выявляли метиленовым зеленым и пиронином Ж по Браше (Пирс Э., 1962). Контрольные срезы инкубировали в растворе рибонуклеазы – 1 мг/см3 при +37 оС в течение 2 часов. Суммарный белок определяли по Даниэли (Пирс Э., 1962). Морфологические исследования соотношений жизнеспособных и некротизированых зон ПЖ проводили с использованием окулярных морфометрических приспособлений (Автандилов Г. Г.,1990). Выявление ДНК проводилось по методу Фёльгена-Розенбека. Выявление микроорганизмов в исследуемых тканях проводилось окраской по Граму.
Для идентификации клеток с признаками апоптоза применяли иммуноцитохимические реакции на определение экспрессии проапоптотического белка р53 и на выявление интернуклеосомальной фрагментации ДНК. Кусочки ПЖ фиксировали в 10% нейтральном формалине, обезвоживали и заливали в парафин. Исследование проводили на серийных срезах толщиной 5-6 мкм. Срезы инкубировали с моноклональными антителами к р53 (фирма «Дако», Дания) в рабочем разведении 1:50. Для выявления иммунного окрашивания использовали стрептавидин-биотиновый пероксидазный метод (ДакоLSAB-kit, Дания) с докрашиванием ядер водным раствором гематоксилина. С целью определения внутриядерной фрагментации ДНК использовали набор реактивов «Apoptag Plus in Situ Apoptosis Detection Kit» (фирма «Intergen» Канада), докрашивание ядер производили 0,5% раствором метиленового зелёного на 0,1М ацетатном буфере. При постановке Apoptag-теста ядерный хроматин клеток, вступивших в апоптоз, приобретал коричневое окрашивание. Подсчитывали процент окрашенных клеток на 1000 клеток в случайно выбранных полях зрения.
Для электронномикроскопического исследования материал последовательно фиксировали в 2,5% охлаждённом растворе (+ 4оС) глютарового альдегида и четырехокиси осмия по Millonig G. (1961). Обезвоживание проводили в ацетоне нарастающей концентрации с последующей заливкой кусочков в смолу ЭПОН-812. После изготовления полутонких объектов (1 мкм), ультратонкие срезы готовили на ультратоме LКB-5 (Bromma, Sweden). В дальнейшем срезы подвергали двойному контрастированию: в 2% водном растворе уранила ацетата при +37 оС в течение 2 часов и цитрате свинца (Reynolds Е., 1963). Изучение объектов и фотографирование их осуществляли с помощью электронного микроскопа ЭВМ 100 АК при увеличениях 7000-48000.
Методики биохимических исследований.
Полученные при забое животных биоптаты отмывали холодным (+4 С) 0,9% раствором хлорида натрия и замораживали в жидком азоте, пробы крови центрифугировали с замораживанием полученной сыворотки. Хранение вышеназванных материалов производили в морозильной камере (-18С). Нормальные биохимические показатели получены путём забоя в аналогичных условиях 5 интактных морских свинок. В полученном материале изучали содержание одного из первичных продуктов – ДК и одного из конечных продуктов липопероксидации – МДА, концентрацию аскорбиновой кислоты (аскорбата) и молочной кислоты (лактата).
Определение концентрации ДК проводили по методике Стальной И.Д. (1977). Концентрацию МДА определяли набором реактивов для определения ТБК-активных продуктов «ТБК–АГАТ». Все манипуляции проводили в холодовой комнате при t +1+3оС. Определение концентрации аскорбиновой кислоты проводили колориметрическим методом с реактивом Folin (коммерческий) (Jagota S.K., Dani H.M., 1982). Определение концентрации молочной кислоты проводили энзиматическим колориметрическим методом с использованием стандартного набора реагентов Ольвекс Диагностикум.
У пациентов определение концентрации ДК, МДА, аскорбата и лактата проводили по вышеописанным методикам, лейкоцитарный индекса интоксикации (ЛИИ) определяли по Кальф-Калифу Я.Я. (1941). Указанные исследования выполняли при поступлении больных до начала лечения, а также на 3, 5, 7, 10 и 15 сутки наблюдения.
Для определения сывороточных иммуноглобулинов использовали метод радиальной иммунодиффузии по Mancini G. (Бем Э., 1979). Исследование уровней ФНО, ИФН, Ил-4 и Ил-10 в сыворотке крови больных проведено методом ИФА с использованием наборов фирмы «Цитокин» (Санкт-Петербург). Иммунологические исследования проводили при поступлении больных до начала лечения, а также на 5, 10 и 15 сутки наблюдения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Экспериментальные исследования
Морфологические исследования (I серия) показали, что через 24 часа от начала эксперимента возникали локальные некротические изменения паренхимы и стромы ПЖ на фоне выраженного геморрагического отека. Через 72 часа наблюдались фатальная дискомплексация волокон и аморфного матрикса соединительной ткани, существенные ультраструктурные изменения эндотелиоцитов, клеток фибробластического дифферона и сосудов микроциркуляторного русла (МЦР), демаскировка липидов цитомембран с формированием гигантских липосом, разрушение мембранных компартментов с образованием крупных ламеллярных телец и аутофагосом. При инфицировании (IA, IB серии), особенно E. coli, усиление процессов альтерации нарастает более стремительно.
Значительные изменения происходят в системе МЦР. Паралитическое расширение сосудов, повышенная проницаемость их стенок приводят к быстро нарастающему отеку с экстравазацией компонентов крови с 1 суток с усугублением к 5 дню. Это подтвердили и электронно-микроскопические данные (выраженный отек и истончение эндотелия, формирование в нем фенестр, образование широких межклеточных щелей вследствие разрушений межмембранных контактов, разрыхления и повреждения целостности базальной мембраны).
Начиная с 3-х суток, в участках панкреонекроза происходит мозаичное и гетерохронное развитие и дифференцировка соединительнотканного регенерата. Данные световой и электронной микроскопии показали, что процессы регенерации паренхимы и стромы ПЖ лимитированы в условиях инфицирования, особенно при контаминации E. coli. При дополнительном введении 0,9% раствора NaCl (II серия) как в асептических условиях (IIA), так и в условиях инфицирования (IIB, IIC серии) не выявлено выраженной разницы в динамике морфофункциональных изменений в панкреатической ткани.
При применении перфторана (IV серия) получены существенные отличия в виде менее выраженных нарушений микроциркуляции, снижения выраженности некробиотических и некротических изменений паренхиматозных и стромальных структур органа. Отмечена выраженная положительная динамика в развитии репаративных гистогенезов как в асептических условиях (IVA серия), так и при инфицировании (IVB, IVC серии) за счет усиления процессов васкулогенеза, пролиферации эндотелиоцитов, фибробластов, макрофагов, более раннего отграничения очагов некроза малодифференцированной соединительной тканью. Выявлено достоверное увеличение объёма ядер ацинозных клеток и ядерно-цитоплазматических отношений (за счёт возрастания двуядерных клеток), что свидетельствует о создании условий для реализации ими репаративных возможностей (таблица 1).
На 3-5 сутки уменьшалось количество тромбированных и сладжированных сосудов МЦР с усилением регенераторных потенций эндотелиоцитов, фибробластов и периваскулярных клеток, у которых установлена сохранность митохондрий и мембранных компонентов клеток. Отмечены явления митотического деления ацинозных клеток и клеток выводных протоков, формирующих трубчатые структуры. С 3 суток возрастало (против контроля в 2,6-3 раза) (таблица 2) число ДНК-синтезирующих клеток и экспрессирующих синтез антиапоптотического белка BCL-2.
Таблица 1
Изменение морфометрических характеристик в эксперименте
| Параметры | контроль (ЭОП без лечения) р1 | ЭОП с введением 0,9% раствора NaCl р2 | ЭОП с введением перфторана р3 | ЭОП с введением аскорбиновой кислоты р4 | ЭОП с введением перфторана и аскорбиновой кислоты р5 |
| Цитоплазма ацинарных клеток (мкм) | 10,62± 0,16 | 11,41 ± 0,23 р1-р2<0,01 | 12,44 ± 0,31 р1-р3<0,01 р2-р3<0,01 | 13,12 ± 0,16 р1-р4<0,01 р2-р4<0,01 р3-р4>0,05 | 14,22 ± 0,14 р1-р5<0,01 р2-р5<0,01 р3-р5<0,01 р4-р5<0,01 |
| Ядра ацинарных клеток (мкм) | 5,71 ± 1,01 | 7,11 ± 0,58 р1-р2>0,05 | 8,93 ± 0,02 р1-р3<0,01 р2-р3<0,01 | 7,98 ± 0,01 р1-р4<0,05 р2-р4>0,05 р3-р4<0,01 | 9,14 ± 0,08 р1-р5<0,01 р2-р5<0,01 р3-р5<0,05 р4-р5<0,01 |
| Отношение двуядерных ацинарных клеток к одноядерным клеткам | 0,06 ± 0,01 | 0,07 ± 0,01 р1-р2>0,05 | 0,12 ± 0,01 р1-р3<0,01 р2-р3<0,01 | 0,13 ± 0,01 р1-р4<0,05 р2-р4<0,01 р3-р4>0,05 | 0,16 ± 0,02 р1-р5<0,01 р2-р5<0,01 р3-р5>0,05 р4-р5>0,05 |
| Диаметр гемокапилляров (мкм) | 8,74 ± 0,10 | 9,11 ± 0,31 р1-р2>0,05 | 8,14 ± 0,14 р1-р3<0,01 р2-р3<0,01 | 8,77 ± 0,18 р1-р4>0,05 р2-р4>0,05 р3-р4<0,01 | 10,13 ± 0,11 р1, р2, р3, р4-р5<0,01 |
Примечание: р1-р2, р1-р3 и т.д. – критерий достоверности различий в сравниваемых группах.
Таблица 2
Количество bcl – 2 позитивных ацинарных клеток в условиях экспериментального острого панкреатита на стадии 3 суток (в %)
| Контроль (ЭОП без лечения) р1 | ЭОП с введением 0,9% раствора NaCl р2 | ЭОП с введением перфторана р3 | ЭОП с введением аскорбиновой кислоты р4 | ЭОП с введением перфторана и аскорбиновой кислоты р5 |
| 1,1±0,01 | 1,92±0,066 р1-р2<0,01 | 2,61±0,11 р1-р3<0,01 р2-р3<0,01 | 2,58±0,12 р1-р4<0,01 р2-р4<0,01 р3-р4>0,05 | 3,11±0,14 р1, р2, р3, р4-р5<0,01 |
Примечание: р1-р2, р1-р3 и т.д. – критерий достоверности различий в сравниваемых группах.
Следует отметить, что введение высоких доз аскорбиновой кислоты (IIIA, IIIB, IIIC серии) обеспечивало сходный характер морфологических процессов в поджелудочной железе с сериями экспериментов с использованием перфторана. Однако, совместное применение перфторана и высоких доз аскорбиновой кислоты (VA серия) вызывало потенцирующий эффект на купирование микроциркуляторных нарушений, деструктивных процессов и развитие репаративных гистогенезов паренхимы и стромы пораженного органа, в том числе, и в условиях инфицирования (VB, VC серии) (таблица 1).
Морфологическая картина в печени (IA, IIA серии) выявила деструктивные изменения эндотелиоцитов, повышение проницаемости гемокапилляров с очагами кровоизлияния в периваскулярное пространство. Имелись признаки нарушения лимфооттока в виде расширения просвета лимфатических сосудов, особенно капилляров. С 1 суток определялось выраженное полнокровие и отёк ткани печени, расширение перисинусоидных пространств, слущивание клеток Купфера. В условиях инфицирования (IB, IC, IIB, IIC серии), особенно E.coli, процессы альтерации ткани печени усиливались. Определялись гепатоциты с пикнотически изменёнными ядрами и выраженными процессами деструкции в цитоплазме в виде вакуолей, имевших тенденцию к слиянию, липидных капель, разрушающихся митохондрий, расширенных канальцев эндоплазматической сети и цистерн комплекса Гольджи, аутофагосом. При развитии жировой дистрофии в гепатоцитах определялся жир, имевший мелко- и крупнокапельный вид. Некоторые печеночные клетки погибали, жировые капли сливались и образовывали жировые кисты, вокруг которых возникала клеточная реакция с начальными признаками разрастания соединительной ткани (5 сутки). То есть, в печени наблюдалась картина острого гепатита, причём степень морфологических изменений зависела от интенсивности патологического процесса в ПЖ.
При применении перфторана (IV серия) отмечены менее выраженные нарушения микрогемо- и лимфоциркуляции, что проявлялось уменьшением экстравазации плазмы и форменных элементов крови в периваскулярное пространство. Улучшение кровоснабжения печёночной дольки приводило к стабилизации патологических изменений в виде возрастания количества двуядерных гепатоцитоов наряду с уменьшением числа деструктивно изменённых клеток.
При электронно-микроскопическом исследовании отмечался процесс восстановления структуры мембран гепатоцитов и межклеточных контактов. В ядрах увеличивались эухроматиновые зоны. В цитоплазме уменьшался просвет канальцев эндоплазматической сети и цистерн пластинчатого комплекса, размеры и количество вакуолей и липидных капель, аутофагосом, увеличивалось количество рибосом и митохондрий, где определялись мембраны, крипты и матрикс, что свойственно для энергированных форм. В гепатоцитах активизировались метаболитические процессы (в том числе синтетические), что проявлялось в усилении гистохимических реакций на выявление рибонуклеопротеидов, гликогена, суммарного белка. Отмечено усиление регенераторных процессов в эндотелиоцитах и звёздчатых клетках. Положительное действие перфторана проявлялось также в активизации перемещения лимфоцитов, макрофагов в повреждённые зоны органа и активизации клеток фибробластического ряда.
Для оценки влияния высоких доз аскорбиновой кислоты (III серия), перфторана (IV серия) и их комбинации (V серия) на репаративные процессы в печени животных проведены цитологический анализ и кариометрия гепатоцитов. Результаты исследования (таблица 3) показали, что применение данных схем приводит к уменьшению деструктивных процессов и возрастанию количества двуядерных гепатоцитов, что свидетельствует о реализации органом своих компенсаторных возможностей и оптимизации регенерации печеночных клеток. Параллельно нарастает число крупноядерных гепатоцитов, что свидетельствует об активизации синтетических процессов.
Таблица 3
Цитологические изменения гепатоцитов (5 сутки эксперимента)
| ЭОП р1 | ЭОП + аскорбиновая кислота р2 | ЭОП + перфторан р3 | ЭОП + аскорбиновая кислота и перфторан р4 | |
| Содержание двуядерных гепатоцитов (в % к исходному) | 25,5±1,8 | 35,2±2,1 р1-р2<0,01 | 39,4±1,9 р1-р3<0,01 р2-р3>0,05 | 41,6±2,1 р1-р4<0,01 р2-р4<0,05 р3-р4>0,05 |
| Размеры ядер гепатоцитов (в % к исходному) | 81,6±4,1 | 83,1±3,8 р1-р2>0,05 | 88,4±3,4 р1-р3>0,05 р2-р3>0,05 | 96,9±1,1 р1-р4<0,01 р2-р4<0,01 р3-р4<0,05 |
Примечание: р1-р2, р1-р3 и т.д. – критерий достоверности различий в сравниваемых группах.
Биохимические исследования. Изучение динамики ДК в сыворотке крови (рис. 1) показало достоверное превышение нормы во всех группах почти на всех сроках. Через 24 часа норма превышена в 1,41-4,64 раза, через 72 часа – 2,02-2,92 раза с превалированием 1 и 2 групп (р<0,02). Через 120 часов максимальное превышение нормы отмечено в 1 группе – в 6,87 раз (р<0,01), во 2 группе – в 4,19 раз (р<0,01), в 3 группе - в 4,5 раза, в 4 группе – в 4,66 раз (р<0,01). В этот срок минимальный рост отмечен в 5 группе – 2,76 раза. Показатели 2-5 групп значительно ниже, чем в 1 группе (р<0,01), причём во 2-4 группах они примерно одинаковы. В 5 группе уровень ДК ниже значения 1 группы в 2,5 раза (р<0,01) и значений 2-4 групп в 1,5 раза (р<0,01).
Рисунок 1 Рисунок 2

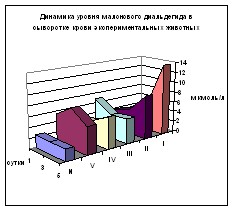
В динамике МДА (рис. 2) во всех случаях имелось превышение нормы (р<0,01), в т.ч., через 24 часа – в 1,5-3 раза, через 72 часа – в 1,87-3,27 раза. Однако через 120 часов в 1 группе отмечается дальнейший рост по отношению к норме в 5,86 раз, во 2 группе – в 3,62 раза, в 3 и 4 группах рост менее значителен по отношению к 72 часам наблюдения – в 2,1-2,6 раз, а в 5 группе отмечается снижение содержания МДА. Выявлены значительно меньшие уровни изучаемого метаболита в 3-5 группах по сравнению с 1 и 2 сериями животных.
Изучение динамики ДК в ткани ПЖ выявило сходную картину (рис. 3). В 1 группе имеет место 9-кратное превышение нормы через 24 часа, прогрессирующее к 120 часам до 12-кратного роста. Применение 0,9% раствора NaCl (2 группа) существенно не изменило изучаемую картину – сохраняется превышение нормы в 7,7-8,4-9 раз, однако разница с 1 группой достоверна на всех сроках наблюдения. В 3 группе уровень ДК, оставаясь в 3,2-5,4 раза выше нормы, является значительно более низким по сравнению с 1 и 2 группами.
Рисунок 3 Рисунок 4
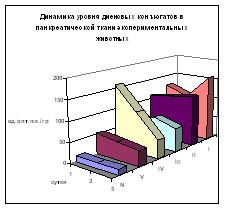
Однако в 4 группе через 24 часа содержание данного метаболита самое высокое (в 12,4 раза выше нормы) с последующим снижением к 120 часам, когда его концентрация значительно ниже, чем в предыдущих группах. В 5 группе «всплеск» изначально невысок аналогично 3 группе с последующим снижением к 5 суткам, когда содержание ДК минимально с превышением нормы в 2,7 раз, что существенно ниже по сравнению с предыдущими группами, особенно первыми двумя, где норма превышена соответственно в 11 и 9 раз. В 3 и 4 группах к 5 суткам данное превышение составляет 4,2 и 3,3 раза.
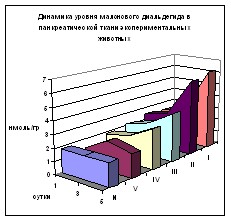
Аналогичная динамика выявлена в показателях МДА в панкреатической ткани животных (рис. 4). Комбинация перфторана с аскорбиновой кислотой минимизирует продукцию данного метаболита, начиная с 1 суток, где его уровень достоверно ниже значений всех предыдущих групп. Имеет место рост к 3 суткам, сопоставимый с остальными сериями животных, однако к 5 суткам отмечается снижение содержания МДА до нормы со значительной достоверной разницей по отношению к остальным группам морских свинок. Изучение содержания ДК и МДА в тканях печени выявило сходную с сывороткой крови и панкреатической тканью динамику.
Изучение динамики содержания аскорбиновой кислоты в сыворотке крови (рис. 5) выявило, что ее уровень в 1 и 2 группах прогрессивно снижался с апофеозом на 5 сутки, где в 1 группе снижение составило 4,34 раза, во 2 группе 5,27 раз по отношению к норме. В 3 серии, несмотря на ежедневное введение массивных доз аскорбиновой кислоты, её концентрация остаётся на всех сроках ниже нормы, но выше, чем соответствующие показатели в предыдущих группах, особенно на 5 сутки, где имеет место превышение более чем в 4 раза. В 4 группе снижение по суткам составило соответственно 1,4, 1,23, 1,6 раз к норме. При этом через 72 часа уровень аскорбата в данной серии был выше соответственно в 1,7-2,4 раза по сравнению с предыдущими группами. На 5 день его содержание уменьшилось на 20%, оставаясь в 3 раза выше по отношению к первым двум группам и почти в 1,5 раза ниже, чем в группе животных, получавших аскорбиновую кислоту. В 5 серии отмечается изначальная депрессия уровня аскорбата в 2 раза ниже нормы с последующим ростом на всех сроках с достоверным превышением значений 1 и 2 групп на 3 и 5 сутки. По сравнению с 3 и 4 группами разница недостоверна, однако, в отличие от этих серий, имеется возрастающий тренд.
Уровень аскорбата в ткани ПЖ (рис. 6) в 1 и 2 группах прогрессивно снижается, становясь минимальным через 120 часов (в 4,2 и 3,5 раз ниже нормы соответственно). В 3 группе содержание аскорбиновой кислоты через 72 часа почти в 5 раз, а через 120 часов почти в 6 раз выше соответствующих значений показателей в 1 и 2 группах.
Рисунок 5 Рисунок 6


Снижение концентрации данного показателя в 4 группе незначительно по отношению к норме. Через 72 и 120 часов в данной группе уровень этого вещества в 2-3 раза выше соответствующих показателей в первых двух группах, однако, и значительно ниже, чем в группе, получавшей аскорбиновую кислоту. В 5 группе на всех сроках имеет место превышение нормы со значительным превалированием над сериями животных, не получавших аскорбат. Обращает на себя внимание тот факт, что в 3 и 5 группах морских свинок, которым выполнялись инъекции аскорбиновой кислоты, практически во все сроки исследования уровень аскорбата в гомогенатах ПЖ превышает норму.
Изучение динамики уровня данного антиоксиданта в ткани печени (рис. 7) выявляет похожую с ПЖ картину. В 1 и 2 группах имеет место снижение концентрации аскорбиновой кислоты через 24 часа на 20%, через 72 часа – в 2 раза, а через 120 часов – в 3 раза ниже нормы. В 3 группе, наоборот, отмечается прогрессирующий рост уровня аскорбата на всех сроках, и его содержание выше нормы с превышением на 3 сутки значений первых двух групп в 2 раза, а на 5 день – в 5 раз. В 4 группе уровень данного вещества находится практически на одном уровне, значительно превышая показатели 1 и 2 групп и оставаясь значительно ниже, чем в 3 группе. В 5 группе превышение нормы на 40% через 24 часа сменяется двухкратной депрессией на 3 сутки с последующим ростом до 90% от нормального содержания аскорбата на 5 день.
При изучении динамики молочной кислоты установлено, что ее содержание в сыворотке крови во всех случаях достоверно превышает норму (рис. 8), составляя уже через 24 часа рост в 2-2,8 раз (р<0,01). В 1 и 2 группах его уровень прогрессивно возрастает к 120 часам, превышая норму соответственно в 5,9 и 7,7 раз.
Рисунок 7 Рисунок 8


В 3 группе повышение содержания лактата выражено более значительно в 1 и 3 сутки, чем в 1 и 2 группах, однако к 5 суткам он почти в 2 раза ниже, чем в этих сериях (р<0,01). В 4 группе динамика иная – максимальный уровень через 3 суток (в 4,8 раз выше нормы) со снижением к 5 суткам (в 3,7 раз выше нормы). При этом в данной группе через 5 суток уровень лактата ниже, чем в 1 и 2 группах соответственно в 1,6 раз (р<0,02) и 2,1 раз (р<0,01) и практически равен 3 серии. В 5 группе животных картина аналогична.
Повышение уровня молочной кислоты в ткани ПЖ происходит во всех группах (рис. 9), однако в 1 и 2 сериях его концентрация возрастает через 72 часа более чем в 2 раза (р<0,05), через 120 часов – в 3 раза (р<0,01) и 2,5 раза (р<0,01) соответственно. В 3 группе содержание лактата повышается (через 24 и 120 часов недостоверно) по отношению к норме, являясь более низким (через 120 часов р<0,01), чем в предыдущих группах. В 4 группе через 24 часа содержание лактата соответствует норме, через 72 и 120 часов оно увеличивается в 1,6 раз выше нормального уровня (р<0,05), но остаётся более низким, чем соответствующие показатели в 1 и 2 группах через 72 часа в 1,4 раза (р>0,05) и 120 часов в 1,6-1,9 раз (р<0,05). По сравнению с 3 группой показатели в 4 серии ниже через 24 и 72 часа (р<0,05) и одинаковы через 120 часов. В 5 группе динамика уровня молочной кислоты идентична 4 группе со слабыми колебаниями в течение срока наблюдения.
Рисунок 9 Рисунок 10


В печёночной ткани морских свинок (рис. 10) изменения содержания молочной кислоты схожи с аналогичной динамикой в панкреатической ткани. В 1 и 2 группах животных имеет место прогрессирующий рост концентрации лактата с превышением нормы в 1,5-3,9 раз. Введение аскорбиновой кислоты (3 группа) приводит к уменьшению выраженности анаэробного гликолиза, особенно 5 сутки, когда разница с 1 и 2 группами составляет 2 раза. Обращает на себя внимание тот факт, что в 3 серии отмечается прогрессирующее снижение концентрации лактата. В 4 группе животных уровень лактата, оставаясь достоверно выше нормы, имеет более низкие значения с предыдущими группами через 24 и 72 часа. Через 120 часов он достоверно ниже (почти в 2 раза), чем в первых двух группах, но на 20% выше 3 группы. Комбинированное применение перфторана и аскорбиновой кислоты (5 группа) приводит к самому низкому «всплеску» анаэробного гликолиза в ткани печени. В первые трое суток содержание молочной кислоты повышается всего на 20% выше нормы, а на 5 день – на 66%, являясь достоверно более низким по сравнению с 1 и 2 группами и сопоставимым с 3 и 4 группами. Следует отметить, что, несмотря на повышение уровня лактата во всех сериях экспериментальных животных, при применении изучаемых методов лечения (перфторан, аскорбиновая кислота и их комбинация) отмечается значительно менее выраженная активация анаэробного гликолиза.
Проведенный корреляционный анализ в 70% случаев выявил прямую связь (в основном r=0,5-0,9) между одноименными процессами в изучаемых биологических субстратах, что подтверждает закономерность их течения. Во всех субстратах в большинстве случаев выявлена прямая связь динамики продуктов липопероксидации между собой и с молочной кислотой (в основном r=0,7-0,9), а также обратная связь этих метаболитов с содержанием аскорбиновой кислоты (в основном r= r=-0,7 – -0,9).
Клинические исследования.
Все пациенты, включенные в исследование, поступили в клинику в срок до 24 часов от начала заболевания с тяжестью заболевания по шкале Glasgow-Imrie (1984) не менее 2 баллов, что соответствует, как минимум, среднетяжёлому ОП. Отбор пациентов с досуточным сроком заболевания имел принципиальное значение в связи с тем, что согласно современным представлениям, при ОП некроз формируется не ранее, чем через 24 часа от начала первых клинических проявлений. Тяжесть панкреатита не менее 2 баллов также была принципиальной, так как давала «гарантию», что мы имеем дело с истинным ОП, а не с другим заболеванием под его маской (острый гастрит, дуоденит и т.д.). Рассматриваемые группы сопоставимы по поло-возрастному составу, формам заболевания, степени тяжести процесса, а также примененным методам базисной интенсивной терапии (таб. 4).
Таблица 4
Основные статистические показатели в изучаемых группах
| Группы Критерии | I группа (n=45) | II группа (n=44) | III группа (n=48) | IV группа (n=49) |
| Возраст | 48,4±3,7 | 48,9±3,2 | 51,2±2,4 | 48,7±2,5 |
| Пол Мужчины Женщины | 25 (55,6%) 20 (44,4%) | 24 (54,5%) 20 (45,5%) | 28 (58,3%) 20 (41,7%) | 24 (49%) 25 (51%) |
| Тяжесть по шкале Glasgow-Imrie, в т.ч. | 2,8±0,2 | 2,9±0,2 | 2,8±0,1 | 2,8±0,1 |
| тяжёлый ОП | 22 (48,9%) | 23 (52,3%) | 25 (52,1%) | 26 (55,1%) |
| Тяжесть по SAPS2 с прогнозом летальности | 39,7±2,5 (23%) | 40,0±3,7 (25%) | 38,9±1,9 (23%) | 39,4±2,1 (23%) |
При поступлении во всех группах индекс SAPS II был идентичным, что подтверждает сопоставимость групп, а прогнозируемая летальность составляла 23-25%, что свидетельствует о выраженной тяжести патологии у пациентов.
Процент формирования панкреонекроза во всех группах высок (таб. 5), при этом в 1 группе он максимален, в группах 2-4 он значимо ниже, особенно в 3 группе пациентов.
Таблица 5
Течение и исходы острого панкреатита у обследованных больных
| Группы Критерии | I группа (n=45) | II группа (n=44) | III группа (n=48) | IV группа (n=49) |
| Проведены консервативно, в т.ч.: | 5 (11,1%) | 5 (11,4%) | 11 (22,9%) | 10 (20,4%) |
| феномен обрыва | - | 2 (4,5%) | 4 (8,3%) | 6 (12,2%) |
| Абортивное течение (отёчный панкреатит) | 8 (17,8%) | 10 (22,7%) | 18 (37,5%) | 17 (34,7%) |
| Развитие панкреонкроза | 37 (82,2%) | 34 (77,3%) | 30 (62,5%) | 32 (65,3%) |
| Инфицирование некроза | 25 (55,6 %) | 10 (22,7%) | 9 (18,8%) | 8 (16,3%) |
| Летальность | 13 (28,9%) | 7 (15,9%) | 7 (14,6%) | 7 (14,3%) |
При рассмотрении процента инфицирования некроза мы видим более показательную картину: в 1 группе оно возникло в 55,6% случаев, во 2 группе этот показатель ниже в 2,45 раз, в 3 группе – в 2,96 раз, а в 4 группе – в 3,4 раза. Количество пациентов, проведенных консервативно, в том числе, с феноменом обрыва и с отёчным ОП (отсутствием признаков панкреонекроза) в исходе заболевания распределилось в обратной последовательности.
Большинство пациентов всех групп было подвергнуто оперативным вмешательствам (таб. 6), однако в 3 и 4 группах процент оперированных значительно ниже. При этом в 1 группе 55,6% больных перенесли открытые вмешательства вследствие прогрессирования патологии и инфицирования с минимальным процентом малоинвазивных вмешательств в качестве окончательного метода хирургической инвазии.Во 2-4 группах картина обратная: значительно меньшее количество открытых операций с преобладанием малоинвазивных технологий с лучшими результатами в 4 группе больных.
Таблица 6
Структура оперативных вмешательств у обследованных больных
| Группы Критерии | I группа (n=45) | II группа (n=44) | III группа (n=48) | IV группа (n=49) |
| Оперировано, в т.ч: | 40 (88,9%) | 39 (88,6%) | 37 (77,1%) | 39 (79,6%) |
| Лапароскопия | 12 (26,7%) | 27 (61,4%) | 23 (47,9%) | 24 (49%) |
| пункционные вмешательства | 3 (6,7%) | 2 (4,5%) | 5 (10,4%) | 7 (14,3%) |
| Малоинвазивные операции как окончательный метод | 15 (22,2%) | 29 (65,9%) | 28 (58,3%) | 31 (63,3%) |
| открытые операции | 25 (55,6%) | 10 (22,7%) | 9 (18,8%) | 8 (16,3%) |
Из находившихся под наблюдением 186 пациентов летальный исход у 34 больных (18,3%) (таб. 7). В 1 группе летальность составила 28,9%, в остальных группах она ниже в 1,82-1,98-2 раза с минимальным показателем в 4 группе.
Таблица 7
Структура летальности у больных острым панкреатитом
| I группа n=45 | II группа n=44 | III группа n=48 | IV группа n=49 | |
| «Ранняя» смерть | 3 (6,7%) | 2 (4,5%) | 4 (8,3%) | 4 (8,2%) |
| «Поздняя» смерть | 10 (22,2%) | 5 (11,4%) | 3 (6,3%) | 3 (6,1%) |
| Итого | 13 (28,9%) | 7 (15,9%) | 7 (14,6%) | 7 (14,3%) |
«Ранняя» смерть – летальный исход в первые 10 суток от начала заболевания, составила 13 случаев (38,2%) от всех летальных исходов. Причина смерти – панкреатогенная токсемия с прогрессирующей полиорганной недостаточностью на фоне тотального панкреонекроза (верифицированного присекционном исследовании), резистентная ко всем способам интенсивного лечения. Пациенты изначально поступали с клиникой тяжёлого ОП. «Поздняя» смерть – летальный исход в стадию секвестрации (после 10 суток от начала заболевания) составила 21 случай (61,8%). Причина смерти в 20 случаях – «поздняя» токсемия, то есть инфицированный панкреонекроз с абдоминальным сепсисом, в 1 случае – массивная тромбоэмболия легочной артерии у пациентки 74 лет с инфицированным панкреонекрозом в стадии реконвалесценции.
Изучение динамики оксидантных процессов у пациентов выявило выраженную их активацию. При поступлении во всех группах уровень ДК (рис. 11) превышает норму в 8-13 раз (р<0,01 к норме). Далее в 1 группе отмечается рост концентрации этого вещества с превышением нормы в 10-23 раза с максимальным содержанием на 7 сутки. Во 2 группе картина обратная – постепенное снижение, начиная с 3 суток, по отношению к 1 группе с возрастающей разницей значений в 2-3 раза, однако норма превышена в 4-11 раз. В 3 группе динамика аналогична 2 группе, однако уровень ДК на всех сроках, за исключением 15 дня наблюдения, достоверно ниже значений как 1 (в 3-5 раз), так и 2 (в 1,5-2 раза) групп. В 4 группе при изначально более высоком содержании ДК отмечается максимально быстрая депрессия его уровня к 3 суткам с последующим снижением на всех сроках наблюдения. По отношению к 1 группе на всех сроках разница достоверна и составляет 2-6 раз. Ко 2 группе отношение аналогично (кроме 10 суток) с разницей в 1,5-2 раза. По отношению к 3 группе результаты, начиная с 5 суток, также ниже примерно на 20-30%, но недостоверно, за исключением 15 суток, где разница составляет 1,3 раза (р<0,05).
Рисунок 11 Рисунок 12

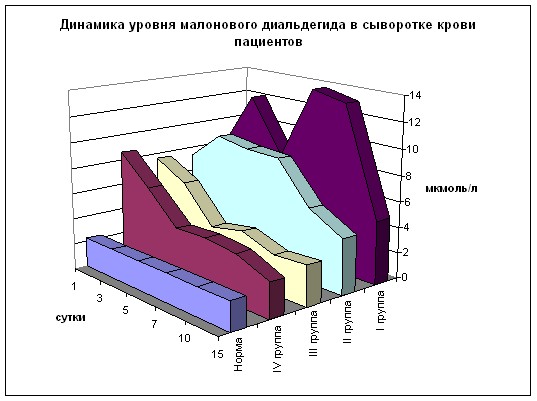
Содержание МДА (рис. 12) при поступлении во всех группах почти не различается и превышает норму в 3,2-3,8 раз (р<0,01). На протяжении всех сроков наблюдения во всех группах отмечается достоверное превышение нормы как ДК, так и МДА. Это подтверждает общеизвестный факт активации свободно-радикального окисления при ОП.
Начиная с 3 суток, как и в предыдущем случае, проявляются «ножницы» в виде роста уровня данного метаболита с превышением нормальных значений в 3,5-6 раз в 1 группе и постепенного снижения содержания МДА в остальных группах. Во 2 группе, несмотря на имеющееся практически на всех сроках достоверное снижение по сравнению с 1 группой, значения, начиная с 3-х суток, в течение всего исследования были в 1,5-2 раза выше соответствующих показателей в 3 и 4 группах. В 3 и 4 группах содержание МДА в течение всего периода наблюдения было практически одинаковым. В отличие от 1 и 2 групп, где тренд показателей имел вид перевёрнутой параболы, в 3 и 4 группах имело место прогрессирующее снижение уровня данного метаболита. По сравнению с 1 группой пациентов в 3 и 4 группах разница значений составляла 2-3 раза.
Общеизвестно, что молочная кислота – маркер кислородной недостаточности, и ее накопление в сыворотке крови убедительно свидетельствует о недостаточной оксигенации тканей и органов (Waxman К. et all., 1982; Kruse J.A. et all., 1987). Содержание лактата (рис. 13) при поступлении во всех группах превышает норму в 2,4-2,9 раза (р<0,01 к норме). Это свидетельствует о дефиците кислорода в тканях, отражающем нарушения микроциркуляции. В 1 группе больных на всех сроках наблюдения отмечается достоверное превышение нормы в 1,5-2,4 раза. Обращает на себя внимание, что, несмотря на общую тенденцию к снижению, с 3 по 15 сутки содержание молочной кислоты меняется незначительно, практически представляя плато.
Рисунок 13
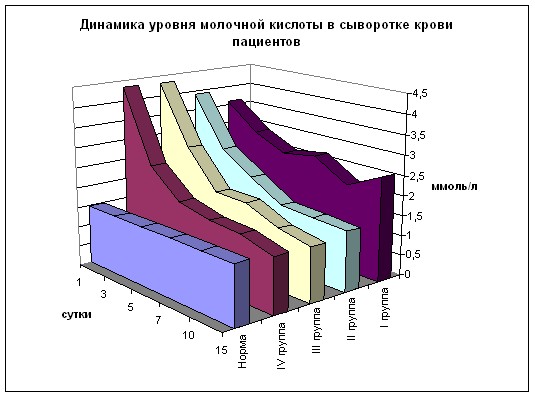
Динамика уровня молочной кислоты во 2-4 группах практически идентична с прогрессирующей депрессией лактата на всех сроках, причём достоверное превышение нормы во 2 группе имеет место до 5 суток включительно, в 3 – до 7 суток, а в 4 группе – только при поступлении пациентов. При этом с 5-7 суток значения становятся достоверно более низкими по сравнению с 1 группой больных. На 10 день превышение нормы составляет 3-6%, а на 15 сутки в 3 и 4 группах содержание молочной кислоты на 7 % и 6% ниже нормы.
Изучение уровня молочной кислоты при поступлении у пациентов с различной тяжестью ОП позволило выявить у них существенные различия в содержании данного метаболита. Произведено ретроспективное сопоставление уровня лактата у 80 больных с верифицированной формой ОП при оперативном вмешательстве и (или) секционном исследовании. Отёчный панкреатит выявлен у 20 пациентов (I группа), очаговый панкреонекроз - у 27 человек (II группа), субтотальный и тотальный - у 25 больных (III группа). 8 пациентов погибли в течение суток с момента госпитализации на фоне фульминантного течения заболевания (IV группа), диагноз верифицирован во время секции – тотальный панкреонекроз с массивным ретроперитонеонекрозом. Анализ результатов свидетельствует о достоверном прогрессирующем повышении уровня молочной кислоты (рис. 14) в сыворотке крови от отёчного панкреатита до тотального панкреонекроза с фульминантным течением. При отёчном панкреатите норма превышена в 1,32 раза (р<0,05), при очаговом панкреонекрозе – в 2,1 раза (р<0,01), при субтотальном – в 3,1 раза (р<0,01). Фульминантный тотальный панкреонекроз сопровождается повышением уровня лактата в 13 раз выше нормы (р<0,01). Выявлена сильная прямая связь между изменением уровня лактата в группах и показателями шкал Glasgow (r=0,94) и SAPS II (r=0,99).
На основании полученных данных нами предложен способ диагностики формы ОП, отличающийся тем, что при поступлении в стационар у больного определяют уровень лактата, и при показателях его до 1,96±0,19 ммоль/л диагностируют отёчный панкреатит, до 3,17±0,25 ммоль/л диагностируют развитие очагового, до 4,59±0,46 ммоль/л – тотально-субтотального панкреонекроза, выше этого показателя – тотального панкреонекроза с фульминантным течением (Патент РФ на изобретение № 2339042 от 20.11.2008 г. «Способ диагностики формы острого панкреатита»).
Рисунок 14

I группа - отёчный панкреатит
II группа - очаговый панкреонекроз
III группа - тотально-субтотальный панкреонекроз
IV группа - тотальный панкреонекроз с фульминантным течением
Изучение уровня аскорбиновой кислоты при ОП представляет значительный интерес. Это обусловлено биологической ролью данного антиоксиданта, играющего важную роль в регуляции процессов свободно-радикального окисления как напрямую, так и опосредованно за счёт воздействия на ряд других антиоксидантов. Концентрация аскорбата (рис. 15) при поступлении практически одинакова во всех группах и более чем в 2 раза ниже нормы (р<0,01), что свидетельствует об истощении содержания данного антиоксиданта у больных с ОП. Следует отметить, что в 1-3 группах на всех сроках снижение было достоверно по отношению к норме, в том числе и во 2 группе больных, получавших высокие дозы аскорбиновой кислоты, в то время как в 4 группе снижение достоверно ниже нормального значения только на 1 и 3 сутки. На 3 сутки в 1 группе, несмотря на парентеральное введение аскорбиновой кислоты (500 мг/сут.), её содержание снижается в 3,4 раза по отношению к норме (р<0,01) и остаётся примерно на одном уровне до 10 суток (незначительное повышение) с последующим ещё большим снижением на 15 сутки, когда дефицит становится практически пятикратным. Во 2 группе начиная с 3 суток содержание аскорбиновой кислоты достоверно (р<0,01) превышает в 2-2,5 раза соответствующие показатели I группы, оставаясь, однако, на 30-40% ниже нормы (р<0,01, р<0,05).
В 3 группе динамика уровня данного вещества идентична 2 группе: на 3 сутки содержание аскорбата остаётся ниже нормы в 1,23 раза (р<0,05), однако оно превышает соответствующий показатель в I группе в 2,76 раз (р<0,01), на 5-10 сутки отмечается снижение до 62% от нормы с дальнейшим ростом на 15 сутки. На 10 и 15 день наблюдения уровни аскорбиновой кислоты во 2 и 3 группах одинаковы. В 4 группе больных при изначально одинаковом с остальными группами уровне аскорбата отмечается прогрессивный рост его содержания. Достоверность депрессии по отношению к норме имеет место только на 1 и 3 сутки. Уровень данного вещества, начиная с 3 суток достоверно выше значений 1 группы в 3-4 раза (р<0,01) на всех сроках. Начиная с 5 суток, имеют место более высокие значения 4 группы и по отношению к 2 и 3 группам, причём в половине случаев разница достоверна. Это свидетельствует о кумулятивном эффекте совместного применения перфторана и высоких доз аскорбиновой кислоты. Следует отметить, что с 3 суток содержание аскорбата во 2-4 группах больных на всех сроках достоверно (р<0,01) выше соответствующих значений 1 группы.
Рисунок 15

При сопоставлении содержания аскорбиновой кислоты в сыворотке крови при поступлении пациентов с различными исходами ОП выявлена существенная разница в концентрации данного вещества, что заставило нас предположить прогностическую роль уровня данного антиоксиданта. С этой целью проведено сопоставление содержания аскорбиновой кислоты при поступлении до начала лечения у 73 больных ОП, которые ретроспективно разделены на две сопоставимые по основным параметрам группы: I группа - выжившие (45 пациентов), II группа – пациенты с летальным исходом (28 больных). Все пациенты получали одинаковое лечение. Анализ результатов (рис. 16) свидетельствует о достоверном снижении уровня аскорбиновой кислоты в сыворотке крови в обеих группах по сравнению с нормой в I группе в 3,6 раз, а во II группе в 7,6 раз и разнице в 2 раза между группами (p<0,01).
У 18 пациентов концентрации аскорбата имели промежуточные значения, 8 из них выжили, перенеся тяжелые формы инфицированного панкреонекроза, 10 больных погибли. Выявлена сильная прямая связь между изменением уровня аскорбата в группах и показателями шкал Glasgow (r=0,92) и SAPS II (r=0,91). В связи с этим нами предложен способ прогнозирования исхода ОП путём биохимических исследований, отличающийся тем, что при поступлении в стационар у больного определяют уровень аскорбата в сыворотке крови, и при показателях его выше 0,94±0,09 ммоль/л оценивают прогноз как благоприятный, ниже 0,45±0,06 ммоль/л – как неблагоприятный, при промежуточных показателях прогноз сомнителен (Патент РФ на изобретение № 2338195 от 10.11.2008 г. «Способ прогнозирования исхода острого панкреатита»).
Рисунок 16

I группа – выжившие пациенты,
II группа – пациенты с летальным исходом.
Рисунок 17 Рисунок 18

Для мониторинга динамики иммунного статуса при лечении пациентов в каждой группе методом случайной выборки (в 1 и 2 группах по 14 пациентов, в 3 и 4 группах – по 16 пациентов) определяли содержание некоторых Th1-цитокинов (ФНО, ИНФ) и Th2-цитокинов (Ил-4, Ил-10), а также иммуноглобулинов M, A, G.
Уровень ИФН при поступлении (рис. 17) во всех группах практически одинаково превышает норму более, чем в 3,5 раза (р<0,01). На 5 сутки в 1 группе происходит дальнейший рост (6,25 раз, р<0,01), а в остальных группах - снижение в 2,5-3 раза по отношению к 1 группе, но показатели остаются в 2-2,6 раз выше нормы (р<0,05). На 10-15 сутки в 1 группе отмечается снижение, во 2-4 группах постепенное увеличение уровня данного цитокина, причём к 15 суткам его содержание во всех группах становится практически одинаковым, превышая норму в 2,8-3,2 раза (р<0,01). Обращает на себя внимание практически идентичная динамика содержания данного цитокина в 3 и 4 группах.
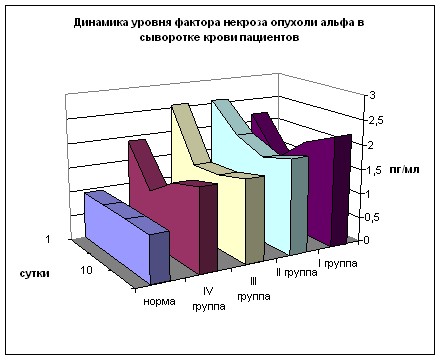
Уровень ФНО в сыворотке крови (рис. 18) при поступлении достоверно выше нормы во всех группах в 2-2,7 раз (между группами р>0,05). К 5 суткам его содержание снижается во всех группах, в 1 и 2 группах показатели выше нормы в 1,46 и 2,1 раза (р<0,05), а в 3 и 4 – в 1,57 и 1,15 раз (р>0,05). В дальнейшем во всех группах уровень данного цитокина растёт, особенно в 1 и 2 группах, где на 15 сутки он в 2-2,4 раза превышает норму (р<0,01), а в 3 и 4 группах – в 1,7 раз (р>0,05), разница между группами недостоверна. При изучении уровня ФНО ни в одной группе не получено значительного всплеска его содержания. Сходным для всех групп моментом является параболический тип тренда с минимальным уровнем на 5 сутки с последующим ростом вплоть до 15 дня.
Анализ содержания Ил-4 (рис. 19) выявил, что при поступлении во всех группах имеется 54-68-кратное превышение нормы (р<0,01) и значительность этого превышения (не менее, чем в 10 раз) сохраняется в течение всего времени наблюдения. На 5 сутки в 1 и 2 группах отмечается дальнейший рост (262 и 172 раза по отношению к норме), а в 3 и 4 группах – многократное снижение уровня Ил-4, что соответственно в 10 и почти в 20 раз ниже, чем в 1 и 2 группах (р<0,01). На 10 сутки в первых двух группах также отмечается значительное снижение содержания данного цитокина, превышающее, однако, в 4-5,5 раз (р<0,01) показатели 3 и 4 групп, которые с 5 по 15 сутки остаются практически без динамики. В 1 группе на 15 сутки продолжается рост, а во 2 группе уровень Ил-4 значительно снижается, приближаясь к показателям 3 и 4 групп. Показательно выраженное превышение нормы во всех группах при поступлении пациентов и схожесть динамики Ил-4 в 1-2 и 3-4 группах. Многократно более низкое содержание Ил-4 в группах больных, получавших перфторан, свидетельствует о подавлении гиперпродукции этого цитокина.
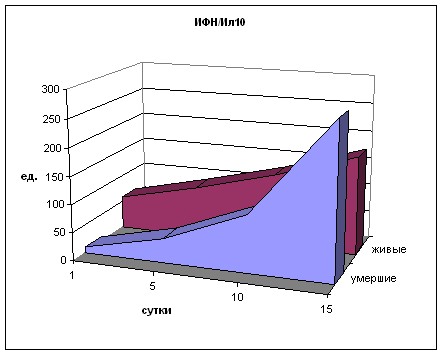
При изучении динамики уровня Ил-10 получены схожие с Ил-4 результаты (рис. 20). При поступлении отмечается превышение нормы во всех группах более, чем в 3 раза (р<0,05). На 5 сутки в 1 и 2 группах рост продолжается (р<0,01) с превышением значений 3 и 4 групп в 5-7 раз (р<0,01), которые снижены и составляют 60% и 86% от нормы (р>0,05). В дальнейшем в 3 и 4 группах уровни Ил-10 незначительно варьируют, оставаясь ниже показателя нормы.
Рисунок 19 Рисунок 20 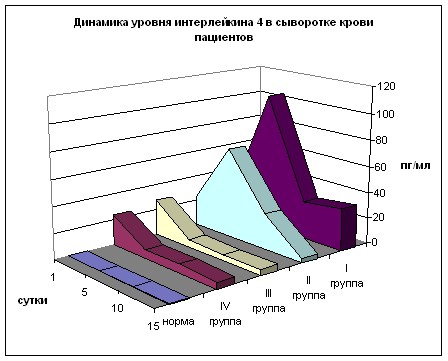
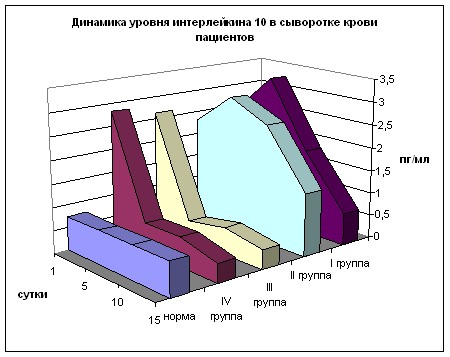
В 1 и 2 группах на 10 и 15 сутки содержание данного цитокина уменьшается, однако оно в 2-4 раза выше значений 3 и 4 групп. Несмотря на менее выраженный всплеск при поступлении, имеют место «ножницы» в виде дальнейшего роста содержания этого цитокина в первых двух группах к 5 суткам с последующим снижением и угнетения гиперпродукции Ил-10 в 3 и 4 группах.
Уровень IgM (рис. 21) при поступлении был практически одинаков во всех группах и слабо изменялся на протяжении всего периода наблюдения, за исключением 5 суток в первой группе, где он составлял 64,6% от нормы (р<0,01), а также 5 и 10 суток во II группе, где имело место превышение нормы в 1,2 раза (р<0,05).
Рисунок 21 Рисунок 22

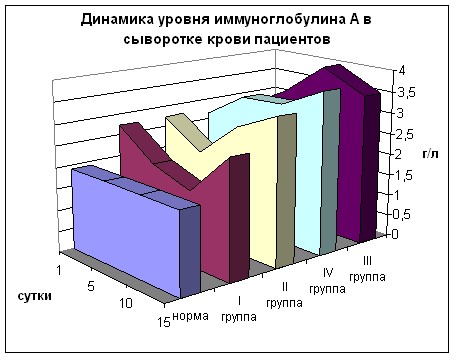
В динамике содержания IgA (рис. 22) наблюдались более выраженные изменения. При поступлении во всех группах отмечено достоверное повышение уровня данного иммуноглобулина почти в 1,5 раза с последующим снижением на 5 и 10 сутки в I группе и ростом в остальных группах.
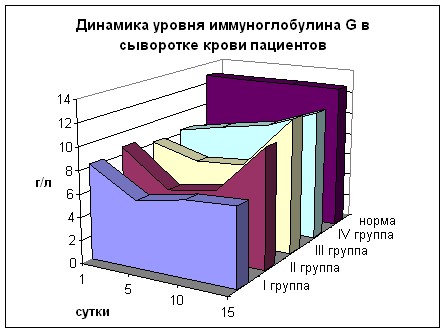
Изменения содержания IgG были наиболее яркими (рис. 23). Отмечалась изначальная депрессия его количества во всех группах (63,75% - 68%, р<0,01), усугублявшаяся на 5 сутки во всех группах, кроме IV, где на всех сроках имел место рост. Начиная с 10 суток, отмечается нарастание уровня IgG во всех группах, наиболее выраженное в группах III и IV. Однако с 1 по 10 сутки показатели во всех группах значительно ниже нормы, но в III группе они достоверно выше I группы, а в IV выше I-II групп (р<0,05). К 15 дню в III и IV группах уровень IgG почти достигает нормы (92% и 90%), во II группе составляет 82%, а в I – 53% (р<0,01 ко всем группам и к норме).
Рисунок 23 Рисунок 24

Исходя из полученных результатов, можно заключить, что при поступлении уровни изучаемых сывороточных иммуноглобулинов и цитокинов во всех группах практически одинаковы, что свидетельствует о сопоставимости исследуемых групп. Значительное повышение уровня цитокинов обоих оппозитных пулов говорит о наличии «цитокиновой бури», свидетельствующей о разбалансировке цитокиновой сети в частности и иммунной системы в целом, что согласуется с данными других исследователей (Салиенко С.В. с соавт., 2006; Козлов В.К., 2006; Жидовинов А.А. с соавт., 2007). В 1 и 2 группах явления «цитокинового пожара» усиливаются на 5 сутки с постепенным затуханием к 15 дню. В 3 и 4 группах, получавших дополнительно перфторан, с 5 суток имеется снижение обоих пулов, особенно Th2.
Согласно современным данным Th1-цитокины – важнейшие индукторы иммунного ответа, обусловливающие примат активации клеточного иммунитета, гемопоэза и репаративных процессов. Их недостаток в совокупности с высоким уровнем Th2-цитокинов является признаком иммуносупрессии и анергии иммунного ответа (Козлов В.К., 2006; Пичугина Л.В., Пинегин Б.В., 2008). Ряд авторов в данной связи называют «ведущий» Th2-цитокин Ил-10 «интерлейкином смерти». Известно, что именно дисбаланс цитокинов оппозитных пулов, а не уровень гиперцитокинемии отдельно взятого медиатора является критерием дизрегуляции иммунной системы (Козлов В.К., 2006), для оценки которой важное значение имеет соотношение Th1/Th2, прежде всего ИФН/Ил-10, ведущих цитокинов в своих группах (Кузнецов В.П. с соавт., 2001; Железникова Г.Ф., 2008). Высокие цифры данного индекса и его нарастание говорят о положительной иммунологической динамике в виде восстановления приоритета клеточных реакций защиты. При поступлении этот индекс (рис. 24) примерно одинаков во всех группах, причём в 3 и 4 группах показатели ниже, чем в 1 и 2. Начиная с 5 суток, в течение всего времени наблюдения отмечаются значительно более высокие значения с отчётливой возрастающей динамикой в 3-4 группах, получавших перфторан, а в 1 и 2 группах значения этого индекса ниже в 3-6 раз с более слабой положительной динамикой.
Таким образом, ОП характеризуется значительным снижением содержания IgG и нарушением цитокиновой регуляции, сопровождающимся многократным увеличением уровня как про-, так и противовоспалительных цитокинов, что является одним из критериев иммунодефицита и гнойно-септических осложнений. Дополнительное применение аскорбиновой кислоты способствует повышению уровней IgA и IgG и снижению содержания Th1-цитокинов, но не оказывает значительного влияния на Th2-пул, что говорит о недостаточном иммуномодулирующем эффекте аскорбиновой кислоты в течение представленных сроков наблюдения. Это подтверждается и отсутствием разницы в динамике изучаемых показателей в III и IV группах. Перфторан и его комбинация с аскорбиновой кислотой значительно повышают содержание IgA и IgG и достоверно уменьшает уровень как Th1-, так и Th2-цитокинов, что свидетельствует о подавлении чрезмерной цитокинпродуцирующей функции макрофагов. При этом соотношение ИФН/Ил-10 в 3-6 раз выше по отношению к I и II группам и имеет явную возрастающую динамику. Это характеризует перфторан как препарат, обладающий положительными иммуномодулирующими свойствами при лечении ОП.
Среди обследованных больных ретроспективно выделены 34 пациента с тяжёлым ОП с развившимся впоследствии распространённым панкреонекрозом, потребовавшим хирургического вмешательства, которые в зависимости от исхода ретроспективно были разделены на выживших (I группа) – 20 больных и с летальным исходом (II группа) – 14 больных.
В обеих группах содержание ИФН (рис. 25) превышает на всех сроках норму в 2,5-4 раза (р<0,01), однако при поступлении его уровень в I группе выше, чем во II в 1,58 раз (р<0,05). В дальнейшем разница между группами незначительна.
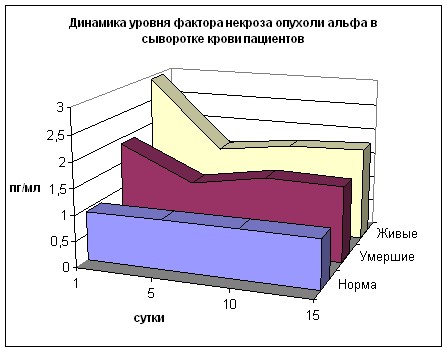
Уровень ФНО достоверно выше нормы (рис. 26) в обеих группах на всех сроках наблюдения, за исключением 5 суток у II группы. При этом в 1 сутки в I группе отмечается превышение соответствующего уровня данного цитокина во II гр. в 1,55 раза (р<0,01) и данная тенденция сохраняется на всех сроках с разницей между группами в 18-26% (р>0,05).
Рисунок 25 Рисунок 26

В динамике содержания Ил-4 (рис. 27) отмечается многократное (в десятки и сотни раз) превышение нормы в обеих группах, максимальное в 1 сутки со снижением к 15 дню.
Рисунок 27 Рисунок 28
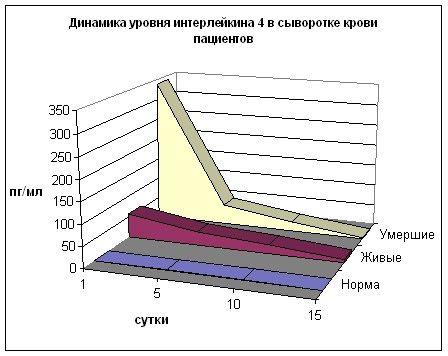

При поступлении во II группе уровень Ил-4 в 6 раз выше, чем в I гр. (р<0,01), на 5 сутки разница составляет 50% (р>0,05), на 10 день – 4% (р>0,05) с превалированием значений II группы. Количество Ил-10 (рис. 28) на всех сроках в обеих группах превышает норму и максимально выражено в 1 и 5 сутки (в I группе соответственно в 7 и 2,9 раз, во II – в 27 и 6 раз, р<0,01) с последующим снижением к 15 дню наблюдения, когда превышение нормы незначительно.
В то же время, имеют место более высокие значения Ил-10 во II группе на 1 и 5 сутки соответственно в 3,85 и 2 раза (р<0,05) по отношению к I группе, на 10 и 15 сутки уровни данного цитокина превалируют в I группе на 5% и 43% (р>0,05).Известно, что тяжёлая дисфункция иммунной системы при хирургической патологии является не просто ранним признаком развивающейся полиорганной недостаточности с последующим присоединением гнойно-септических осложнений, а во многом обеспечивает её возникновение и прогрессирование, то есть является одним из ведущих патогенетических звеньев (Козлов В.К., 2006). В обеих группах отмечается значительное повышение уровня цитокинов обоих оппозитных пулов. Однако при поступлении у больных I группы (исход – выздоровление) отмечаются более высокие уровни Th1 пула с более низкими значениями Th2-цитокинов по сравнению со II группой (летальный исход). Это имеет важное значение в связи с тем, что все пациенты поступили до суток от появления симптоматики ОП, а некроз формируется не ранее, чем через 24 часа от начала заболевания, то есть выявленный при поступлении пациентов цитокиновый дисбаланс предшествовал формированию некроза.
Расчёт соотношения ИФН/Ил-10 в изучаемых группах (рис. 29) показал, что при поступлении данный индекс ниже нормы в I группе в 1,77 раз, а во II – почти в 11 раз с сохранением этой тенденции на 5 сутки (1,13 и 2,42 раза соответственно).
Рисунок 29 Рисунок 30

Сопоставление значения ИФН/Ил-10 между группами выявило, что в I группе при поступлении имеется 6-кратное, а на 5 сутки более чем 2-кратное превышение данного показателя II группы. У выживших пациентов при поступлении (до сформировавшегося панкреонекроза) имеет место достоверное преобладание пула Th1-цитокинов над Th2 пулом, в то время как в группе больных с последующим летальным исходом картина обратная, что может являться критерием прогноза течения и исхода ОП.
Изучена динамика ЛИИ в обследованных группах для сопоставления этого общеизвестного маркера эндогенной интоксикации с изучаемыми биохимическими и иммунологическими показателями (рис. 30). При поступлении во всех группах уровень данного показателя превышает норму в 4,4-6,36 раз (р<0,01 к норме). Далее в I группе отмечается прогрессирующий рост ЛИИ с превышением нормы в 7-11 раз с максимальным содержанием на 7 сутки. Во II-III группах картина обратная – постепенное снижение, начиная с 3 суток, по отношению к I группе с возрастающей разницей значений в 2-3 раза, однако норма превышена в 5-2,5 раза. В IV группе на 3 сутки отмечается рост данного индекса с последующим снижением, более выраженным, чем во II-III группах (с достоверной разницей на 7 и 10 сутки).
Корреляционный анализ выявил прямую связь в динамике продуктов липопероксидации между собой и с динамикой лактата практически во всех случаях (в основном r=0,7-0,9). Соотношение продуктов свободнорадикального окисления и аскорбата обратное (в основном r=-0,3–-0,5), что обусловлено в естественных условиях реципрокностью системы оксидант-антиоксидант с прогрессией окислительных процессов и истощением уровня аскорбата. Связь между динамикой аскорбата и лактата также обратная (в основном r=-0,3–-0,5), что логично и объясняется усилением потребления антиоксиданта в очаге ишемии. Между динамикой цитокинов, в том числе оппозитных пулов, в большинстве случаев отмечается прямая значительная и сильная связь. Это обусловлено, по нашему мнению, разбалансировкой цитокиновой сети. Связь между сывороточными иммуноглобулинами в основном сильная прямая. Сопоставление динамики иммуноглобулинов с Th1-цитокинами выявляет в основном прямую связь, а с Th2-цитокинами – обратную, что соответствует современным представлениям об иммуносупрессивных свойствах последних. Связь между ЛИИ и цитокинами обоих пулов в большинстве случаев значительная прямая, а между ЛИИ и иммуноглобулинами – значительная обратная. Динамика уровня продуктов липопероксидации и ЛИИ выраженная прямая, что объясняется весомым вкладом окислительного стресса в общий «котёл» эндотоксикоза. Обратная связь динамики аскорбата с ЛИИ во всех группах обусловлена прогрессирующим истощением антиоксидантной защиты по мере нарастания явлений эндотоксикоза. Связь между динамикой лактата и ЛИИ во всех группах выраженная прямая, что также вполне логично. Выявлено, что связь между динамикой продуктов перекисного окисления липидов и цитокинами обоих пулов в большинстве случаев прямая, что объясняется важной ролью активированных моноцитов и нейтрофилов в генерации «дыхательного взрыва». Однако с другой стороны можно предположить участие оксидативных процессов в стимуляции цитокиногенеза. В таком случае неконтролируемая взаимоактивация обоих процессов приводит к формированию порочного круга с развитием цитокинового и окислительного «пожаров». Аналогичная ситуация выявлена при сопоставлении трендов изучаемых цитокинов и молочной кислоты. А взаимоотношение аскорбата и изучаемых цитокинов, имеющее обратную зависимость, по нашему мнению, свидетельствует в пользу данного предположения. Связь между динамикой метаболитов пероксидации и иммуноглобулинов в большинстве случаев обратная, что объясняется иммуносупрессивным действием оксидативных процессов (по крайней мере, на гуморальное звено), связь между лактатом и иммуноглобулинами аналогична. Соответственно динамика уровня аскорбиновой кислоты и иммуноглобулинов синхронна, что свидетельствует об иммуномодулирующем эффекте аскорбата.
Из 186 больных всех групп, включенных в исследование, подвергнуто оперативным вмешательствам 155 человек. Из них 22 пациентам были изначально выполнены открытые вмешательства в связи прогрессирующим течением стерильного некротического панкреатита либо в связи с инфицированием некроза. Объём операции – лапаротомия, в ряде случаев люмботомия, дренирование сальниковой сумки, брюшной полости, забрюшинного постранства.
У 133 больных в качестве стартового метода хирургической агрессии применены малоинвазивные вмешательства (таблица 8). Из них у 112 человек произведены лапароскопические операции (санация, дренирование сальниковой сумки и брюшной полости), у 21 пациента дренированы парапанкреатические жидкостные скопления под ультразвуковым контролем. Эти пациенты разделены на 3 группы (таблицы 8 и 9): с выявленным при лапароскопии отёчным панкреатитом у 21 пациента (I группа), с панкреонекрозом у 91 человека (II группа). Больные II группы были дополнительно разделены на подгруппы IIА (выжившие и перенесшие только лапароскопию), IIБ (выжившие и перенесшие лапароскопию и открытые вмешательства), IIС (пациенты, перенесшие оперативные вмешательства, с последующим летальным исходом). Пациенты, перенесшие пункционные вмешательства, составили III группу.
В I группе тяжесть заболевания составила 1,86±0,08, тяжёлых ОП не было. Индекс SAPS II составил 31,5±2,23 (прогноз летальности – 12%). Прогрессирования процесса и осложнений не было, все больные выздоровели. Средний койко-день составил 16,0±1,22.
Таблица 8
Сравнительная характеристика групп больных острым панкреатитом, перенесших малоинвазивные вмешательства
| I группа | II группа | III группа | ||
| Количество больных | 21 | 91 | 21 | |
| Пол | Муж. | 13 | 48 | 12 |
| Жен. | 8 | 43 | 9 | |
| Возраст | 54,9±4,2 | 49,3±1,9 | 56,3±3,4 | |
| Этиология | ЖКБ | 9 | 45 | 11 |
| Алкоголь | 11 | 46 | 10 | |
| SAPS II и прогноз летальности | 31,5±2,23 (12%) | 39,2±1,1 (23%) | 32,2±1,6 (13%) | |
| Индекс Glasgow-Imrie | 1,86±0,08 | 2,67±0,07 | 2,2±0,05 | |
| Больные с тяжёлым ОП | 0 | 50 (54,95%) | 5 (23,8%) | |
| Длительность лечения | 16,0±1,22 | 28,7±2,7 (выжившие) | 12,2±2,3 | |
| Открытые операции | 0 | 19 (20,88%) | 4 (19%) | |
| Летальный исход | 0 | 11 (12,1%) | 0 | |
Мнение ряда авторов, что отёчный панкреатит есть, как минимум, мелкоочаговый панкреонекроз (Савельев В.С. с соавт., 1983; Пермяков Н.К., 1985), на опыте наших наблюдений в ряде случаев подтвердилось. У всех пациентов I группы выявили при лапароскопии только признаки отёчного панкреатита, в том числе у 12 диагностировано наличие распространённого серозного выпота. Послеоперационное течение у всех пациентов было гладким с полным выздоровлением. Однако 4 пациента в последующем были госпитализированы в сроки от 2 месяцев до года после лапароскопии с постнекротическими кистами ПЖ, которые были санированы пункционно под ультразвуковым контролем. То есть, отсутствие в момент лапароскопии бляшек стеатонекрозов и (или) геморрагического выпота ещё не говорит об отсутствии панкреонекроза. Вероятно, наличие серозного выпота есть признак мелкоочагового панкреонекроза с абортивным течением.
Во II группе тяжесть ОП составила 2,67±0,07, в том числе у 50 больных (54,9%) – тяжёлый панкреатит. Средний индекс SAPS II – 39,2±1,1 (прогнозируемая летальность – 23%). При лапароскопии во всех случаях были выявлены бляшки стеатонекрозов, либо выпот с геморрагическим компонентом, либо их комбинация. При оментобурсоскопии визуализировалась инфильтрированная багровая с бляшками стеатонекрозов передняя поверхность поджелудочной железы на всём протяжении, что создавало впечатление об её тотальном поражении. У 70 пациентов (76,2%, IIА гр.) лапароскопия явилась окончательным методом хирургического лечения. Исходно индекс Glasgow-Imrie – 2,54±0,07; SAPS II – 34,93±1,23 с прогнозируемой летальностью 17%; количество больных с тяжёлым ОП – 30 (42,8%). Все пациенты выздоровели, что говорит о сомнительности наличия у них тотального панкреонекроза, визуализированного лапароскопически.
Таблица 9
Сравнительная характеристика подгрупп больных некротическим панкреатитом, перенесших лапароскопические вмешательства
| IIА группа р1 | IIБ группа р2 | IIС группа р3 | |
| Количество больных и % от всех больных ОДП | 70 (76,2%) | 10 (10,99%) | 11 (12,09%) |
| Возраст | 48,5±2,25 | 44,8±3,88 р1-р2>0,05 | 55,3±4,79 р1-р3>0,05 р2-р3>0,05 |
| Индекс SAPS II и прогнозируемая летальность | 34,93±1,23 (17%) | 37,1±2,59 (20%) р1-р2>0,05 | 43,67±4,19 (31%) р1-р3<0,05 р2-р3>0,05 |
| Индекс Glasgow | 2,54±0,07 | 3,0±0,14 р1-р2<0,05 | 3,33±0,15 р1-р3<0,01 р2-р3>0,05 |
| Количество больных с тяжёлым ОП | 30 (42,8%) | 9 (90%) | 11 (100%) |
| Длительность лечения | 21,7±1,35 | 71,8±9,26 р1-р2<0,01 | – |
Открытые операции выполнены у 19 больных (20,88%), у всех при поступлении был диагностирован тяжёлый ОП. Срок вмешательства – 5-23 суток с момента лапароскопии. При лапаротомии у всех пациентов выявлено тотальное поражение ПЖ с массивным ретроперитонеонекрозом с признаками инфицирования. По-видимому, в изучаемой группе больных это и были пациенты с истинным тотальным панкреонекрозом. Из них 10 пациентов (10,99%) выжили, составив IIБ группу, 9 больных погибли и вошли в IIС группу.
Во IIБ группе при поступлении индекс Glasgow-Imrie составил 3,0±0,14; SAPS II – 37,1±2,59 с прогнозируемой летальностью 20%; количество больных с тяжёлым ОП – 9 (90%).
Летальный исход у 11 (12,1%) пациентов (IIС группа) с исходным индексом Glasgow-Imrie - 3,33±0,15, SAPS II – 43,7±4,19 с прогнозируемой летальностью 31% и тяжёлым ОП у всех больных. Из них 2 пациента (2,2%) погибли в ферментативную фазу от прогрессирующей панкреатогенной токсемии, а 9 пациентов (9,9%) умерли в фазу гнойных осложнений, перенеся открытые операции. Причина смерти у 1 больного (1,1%) – массивная тромбоэмболия легочной артерии, у 8 (8,8%) – абдоминальный сепсис с полиорганной недостаточностью. Секционное исследование во всех 11 случаях подтвердило диагноз тотального поражения ПЖ.
Обращает на себя внимание существенная разница в тяжести ОП, проценте больных с тяжёлым панкреатитом и индексе SAPS2 с прогнозом летальности во IIA-C группах. Так, во IIА группе все эти показатели значительно ниже по сравнению с пациентами IIB-C групп. Во IIA группе вероятность летального исхода составляет 17%, во IIB – 20%, а в IIC группе – 31% и индекс тяжести состояния в этой группе на 25% выше, чем во IIA группе пациентов (р<0,05). Различие в исходном индексе тяжести ОП достоверно, и наблюдается максимальное значение его в группе пациентов с последующим летальным исходом. Существенным является количество пациентов с тяжёлым панкреатитом в этих подгруппах: если в IIA подгруппе их меньше половины, то в IIB подгруппе их 90%, а в IIC – 100%. То есть пациенты, у которых в последующем развились инфицированные формы панкреонекроза, а тем более, неблагоприятные исходы, поступали с изначально клинически более тяжёлыми формами ОП. При этом разница в возрасте между подгруппами пациентов была недостоверной.
Средний койко-день у выживших составил 28,7±2,7, в том числе, у пациентов без лапаротомии - 21,7±1,35, у перенесших лапаротомию – 71,8±9,26. Общая летальность (все больные перенесшие лапароскопические вмешательства) составила 9,8%, летальность среди больных с панкреонекрозом (II группа) – 12,1%, летальность среди больных с тяжёлым ОП – 22%.
Известно, что инфицирование панкреатического некроза является решающим фактором, определяющим дальнейшее течение деструктивного панкреатита. Даже при наличии распространённого некроза летальность низка до тех пор, пока некроз остаётся стерильным (Bradley E.L., Allen K., 1991). В данном ракурсе положительным эффектом лапароскопии является значительно меньшее количество развившегося в последующем инфицированного панкреонекроза, что, исходя из необходимости проведения деструктивного панкреатита по асептическому пути, резко повышает шансы больного на выздоровление. Лапаротомия в ферментативную фазу открывает «ворота смерти» и приводит практически в 100% случаев к экзогенному инфицированию панкреатического некроза, значительно ухудшая прогноз для пациента, даже при ограниченных формах некротического панкреатита.
Обращает на себя внимание, что из 91 больного панкреонекрозом у 32 пациентов не проводилась оментобурсоскопия и дренирование сальниковой сумки по техническим причинам (невозможность данной манипуляции в ночное время, спаечный процесс, инфильтрат). Мы не выявили никакой разницы в послеоперационном течении у пациентов ни по осложнениям, ни по летальности. Учитывая данный момент, а также тот факт, что оментобурсоскопия не даёт полноценного представления об объёме панкреатического некроза, можно сделать заключение, что при наличии косвенных признаков панкреонекроза осмотр сальниковой сумки и её дренирование не должны являться обязательным компонентом лапароскопического вмешательства при ОП, а ведущее значение имеет санация и дренирование брюшной полости для удаления токсичного выпота.
У 21 пациента, получавших консервативное лечение, в связи с выявлением при ультрасонографии парапанкреатических жидкостных скоплений (признак переносимого панкреонекроза), не купирующихся консервативными мероприятиями, выполнено их пункционное дренирование под ультразвуковым контролем, в том числе у четверых больных (19,1%) – с признаками инфицирования. У 17 пациентов (80,9%) пункционное вмешательство явилось окончательным методом лечения с полной санацией полостных образований. У одного больного (4,8%) в момент пункции возникло подтекание содержимого кисты в свободную брюшную полость, выполнено её лапароскопическое дренирование с последующей облитерацией жидкостного образования. У двух пациентов (9,5%) в связи с наличием в полости кисты секвестра, поддерживающего, несмотря на проводимое лечение, гнойный процесс, выполнено открытое оперативное вмешательство. Двум пациентам (9,5%) в связи с выявлением сообщения полости кисты с протоковой системой поджелудочной железы в последующем выполнены цистодигестивные соустья (в одном случае произведена эндоскопическая цистогастростомия, в другом - наложен цистоеюноанастомоз). Летальных исходов в данной группе не было.
Обобщая результаты хирургического лечения, можно сделать заключение, что летальность у всех пациентов с панкреонекрозом (112 человек), включивших в себя вторую (91 человек) и третью (21 человек) группы наблюдения, составила 9,8%, что не может не внушать оптимизма и свидетельствует о бесспорной эффективности малоинвазивной хирургии у данных больных. Однако «ложкой дёгтя» остаётся тотальный панкреонекроз, который, как известно, составляет 5% всего ОП и 10-20% от всех форм деструктивного панкреатита (Багненко С.Ф., Гольцов В.Р., 2008). Результаты лечения больных с данным объёмом поражения наименее утешительны (Яицкий Н.А. с соавт., 2003), что подтверждают и наши данные. К сожалению, следует констатировать, что малоинвазивные технологии при этой форме панкреонекроза в большинстве случаев малоэффективны как окончательный способ хирургического лечения и могут являться лишь первым этапом сложного лечебного процесса. Однако для ограниченных форм панкреонекроза малоинвазивная хирургия – метод выбора, и этому хирургическому направлению принадлежит одна из ведущих ролей в снижении летальности в общей популяции больных с деструктивным панкреатитом. Следует подчеркнуть, что открытые операции, несомненно, имеют право на жизнь при наличии строгих показаний (массивный инфекционный процесс, неэффективность проводимого комплексного лечения), но в качестве стартового метода хирургической агрессии по умолчанию должна быть применена малоинвазивная хирургия.
Подводя итог выполненной работе, можно заключить следующее. Экспериментальный острый панкреатит у морских свинок характеризуется нарастающим ишемическим поражением панкреатической ткани, что морфологически подтверждается прогрессирующими микроциркуляторными нарушениями и деструкцией клеточных и стромальных элементов. Повышение уровня лактата с развитием ацидоза в панкреатической ткани может являться одним из факторов активации протеолитических ферментов поджелудочной железы. Прогрессирующая гипоксия приводит к активации свободнорадикальных процессов как на локальном, так и на системном уровнях, вследствие чего возникает массивное потребление аскорбиновой кислоты, что сопровождается выраженным снижением её уровня в сыворотке крови и панкреатической ткани. Применение высоких доз аскорбиновой кислоты позволяет снизить проявления ишемического поражения ткани поджелудочной железы и выраженность свободнорадикальных процессов при экспериментальном остром панкреатите, что говорит об эффективности данного метода лечения. Применение перфторана позволяет значительно снизить проявления ишемического поражения ткани поджелудочной железы и выраженность свободнорадикальных процессов, что свидетельствует о противоишемическом эффекте данного кровезаменителя в лечении экспериментального острого панкреатита. Комбинация перфторана и высоких доз аскорбиновой кислоты обладает кумулирующим эффектом. В целом данные морфологических и биохимических исследований, проведенных в эксперименте с использованием высоких доз аскорбиновой кислоты, перфторана и их комбинации, обосновывают целесообразность включения данной схемы в комплекс лечебных мероприятий при остром панкреатите.
Результаты выполненных клинических исследований свидетельствуют, что острый панкреатит характеризуется активацией анаэробного гликолиза, что отражает нарастание ишемических процессов. Прогрессирующая гипоксия приводит к развитию синдрома липидной пероксидации, вследствие чего возникает массивное потребление аскорбиновой кислоты, что сопровождается выраженным снижением её уровня в сыворотке крови. Развивается выраженный иммунный дисбаланс. Применение высоких доз аскорбиновой кислоты (2000 мг в сутки) позволяет снизить проявления С-витаминного дефицита, ишемических процессов и выраженность оксидантного взрыва при остром панкреатите. Иммуномодулирующий эффект выражен недостаточно. Применение перфторана, а особенно его комбинации с аскорбиновой кислотой, позволяет значительно снизить проявления ишемического поражения ткани поджелудочной железы и выраженность свободнорадикальных процессов, что свидетельствует о противоишемическом эффекте данного кровезаменителя в лечении острого панкреатита. Кроме того, перфторан обладает эффективным иммуномодулирующим действием. Применение высоких доз аскорбиновой кислоты, перфторана, а особенно их комбинации на досуточном сроке острого панкреатита сопровождается уменьшением вероятности развития панкреонекроза и значительным снижением вероятности его инфицирования.
Малоинвазивные технологии значительно улучшают результаты лечения больных деструктивным панкреатитом, однако данное улучшение достигается за счёт успеха при ограниченных формах панкреонекроза. При тотальном панкреонекрозе результаты малоутешительны, что говорит о сохраняющейся актуальности проблемы и требует продолжения поиска новых путей её решения.
Выводы.
1. Первые 24 часа течения острого панкреатита (до формирования панкреонекроза) являются важнейшей стадией заболевания, «терапевтическим окном», когда патологические изменения могут быть обратимы. Комплексная, своевременно начатая терапия позволяет улучшить результаты лечения острого панкреатита путём достижения в ряде случаев локализации процесса и проведения его по асептическому пути.
2. Острый панкреатит характеризуется значительной активацией анаэробного гликолиза вследствие нарушения микроциркуляторных процессов, что сопровождается прогрессирующей генерацией молочной кислоты. Развивающийся лактат-ацидоз может являться одним из факторов интрапанкреатической активации протеолитических ферментов поджелудочной железы. Уровень молочной кислоты в сыворотке крови является маркером тяжести острого панкреатита.
3. Острый панкреатит характеризуется прогрессирующим дефицитом неферментного антиоксиданта – аскорбиновой кислоты, вследствие массивного ее потребления в связи с выраженной активацией процессов липопероксидации. Снижение уровня аскорбиновой кислоты коррелирует с тяжестью патологического процесса и является прогностическим фактором исхода острого панкреатита.
4. У больных острым панкреатитом развивается цитокиновый дисбаланс с массивной генерацией обоих пулов цитокинов с преобладанием противовоспалительного звена, что является одним из критериев иммунодефицита и гнойно-септических осложнений. Интенсивность разбалансировки цитокиновой сети является предиктором течения и исхода острого панкреатита.
5. Применение высоких доз аскорбиновой кислоты (2000 мг в сутки) снижает проявления аскорбатного дефицита, ишемических процессов и выраженность оксидантного взрыва при остром панкреатите.
6. Включение перфторана в комплексную терапию на досуточном сроке острого панкреатита позволяет значительно снизить проявления ишемического поражения ткани поджелудочной железы и выраженность свободнорадикальных процессов, что свидетельствует о противоишемическом и антиоксидантном эффектах этого кровезаменителя в лечении данного заболевания.
7. Перфторан обладает эффективным иммуномодулирующим действием при лечении острого панкреатита за счет купирования явлений цитокинового дисбаланса.
8. Применение высоких доз аскорбиновой кислоты, перфторана, а особенно их комбинации в комплексном лечении на досуточном сроке острого панкреатита сопровождается уменьшением вероятности развития панкреонекроза и значительным снижением вероятности его инфицирования.
9. Малоинвазивная хирургия – метод выбора при необходимости хирургического лечения стерильного панкреонекроза. Малоинвазивные технологии значительно улучшают результаты лечения больных деструктивным панкреатитом, однако данное улучшение достигается за счёт успеха при ограниченных формах панкреонекроза.
Практические рекомендации.
1. Лечебная тактика у больных с острым панкреатитом должна исходить из того, что на досуточном сроке заболевания (до сформировавшегося некроза) патологические изменения обратимы. Ведущее значение в судьбе пациента имеет не только объём поражения, но и время и полноценность начатого комплексного лечения, которое должно проводиться с акцентом на ведущие патогенетические звенья (гипоксия, активация липопероксидации, цитокиновый дисбаланс) данного заболевания.
2. У больных острым панкреатитом с учетом развивающихся патофизиологических процессов необходимо включение в базисную схему лечения перфторана и высоких доз аскорбиновой кислоты с целью эффективного воздействия на вышеуказанные звенья патогенеза.
3. В оценке тяжести состояния больных острым панкреатитом следует принимать во внимание интенсивность анаэробного гликолиза.. Определение уровня молочной кислоты в сыворотке крови больных при их поступлении является диагностическим маркером формы острого панкреатита.
4. У больных острым панкреатитом необходимо учитывать наличие прогрессирующего дефицита аскорбиновой кислоты вследствие ее массивного потребления в результате активации оксидативных процессов. Исследование содержания аскорбиновой кислоты в сыворотке крови больных позволяет прогнозировать исход заболевания.
5. Уровень малонового диальдегида в интраоперационных биоптатах поджелудочной железы у оперированных больных является предиктором исхода заболевания. Определение содержания малонового диальдегида в сыворотке крови позволяет диагностировать развитие инфицированного панкреонекроза.
6. Следует учитывать, что у больных острым панкреатитом развивается разбалансировка цитокиновой сети, отражающая формирование иммунологического дефицита. Соотношение ИФН/Ил-10 в сыворотке крови – прогностический критерий исхода заболевания.
7. При возникновении показаний к хирургическому вмешательству при панкреонекрозе стартовым методом выбора должны быть малоинвазивные способы хирургической агрессии (эндовидеохирургия, навигационная УЗИ-контролируемая хирургия), что позволяет добиться успеха в большинстве случаев при ограниченных формах деструктивного панкреатита. При неэффективности малоинвазивных технологий показаны открытые оперативные вмешательства.
Список работ, опубликованных по теме диссертации.
- Тарасенко В.С., Дёмин Д.Б., Волков Д.В. Прогнозирование исхода деструктивного панкреатита // Актуальные вопросы военной и практической медицины. (Сборник трудов I научно-практической конференции врачей Приволжского военного округа). Оренбург, 2000. – С. 65-68;
- Фадеев С.Б., Тарасенко В.С., Дёмин Д.Б., Волков Д.В., Стрельцов Ю.П., Белоклоков С.В., Шеина Е.А. Микробиологические особенности в течение деструктивного панкреатита // Актуальные вопросы военной и практической медицины. (Сборник трудов II научно-практической конференции врачей Приволжско-Уральского военного округа). Оренбург, 2001. – С. 92-96;
- Дёмин Д.Б., Тарасенко В.С., Волков Д.В. Роль липопероксидации в патогенезе гепатопривного синдрома при панкреонекрозе // Актуальные проблемы хирургического лечения онкопатологии. (Тезисы докладов II межобластной конференции хирургов). Бугуруслан, 2001. – С. 124- 129;
- Дёмин Д.Б., Волков Д.В. Роль липопероксидации в патогенезе панкреонекроза // Региональная научно-практическая конференция молодых ученых. Оренбург, 2002. – С. 83-89;
- Дёмин Д.Б., Тарасенко В.С., Перепелицин В.Л., Волков Д.В., Стрельцов Ю.П., Фадеев С.Б., Белоклоков С.В. Малоинвазивная хирургия деструктивного панкреатита // Актуальные вопросы военной и практической медицины. (Сборник трудов III научно-практической конференции врачей Приволжско-Уральского военного округа). Оренбург, 2002. – С. 172-174;
- Тарасенко В.С., Дёмин Д.Б., Волков Д.В., Перепелицин В.Л., Золотухин С.В., Стальмаков С.Ю. Лечебная тактика у больных острым деструктивным панкреатитом // Материалы III межобластной конференции хирургов «Современная тактика и новые технологии в экстренной и плановой хирургии», Бугуруслан, 2002. – С. 137 – 141;
- Дёмин Д.Б., Тарасенко В.С., Волков Д.В., Твердохлиб В.П., Соломатова Т.В. Прогностическое значение содержания продуктов липопероксидации в тканях при панкреонекрозе // Вестник хирургии имени И.И.Грекова, 2003. – Т. 162. – № 5. – С. 47 – 50;
- Дёмин Д.Б., Иванова Т.Е., Корнилов С.А., Фадеев С.Б. Анализ результатов оперативного лечения больных острым панкреатитом // Актуальные вопросы экстренной и восстановительной хирургии (Материалы конференции хирургов, посвящённой 100-летию со дня рождения проф. С.П.Вилесова). Оренбург, 2005. – С. 33 – 34;
- Тарасенко В.С., Дёмин Д.Б., Волков Д.В., Фадеев С.Б. Диагностика гнойных осложнений панкреонекроза // Неотложная и специализированная хирургическая помощь. Первый конгресс московских хирургов. Тезисы докладов. Москва, 19-21 мая 2005 г.- М.: ГЕОС, 2005.- С. 114-115;
- Дёмин Д.Б., Тарасенко В.С., Волков Д.В., Корнилов С.А. О совершенствовании лечения больных острым деструктивным панкреатитом // Актуальные вопросы военной и практической медицины. (Сборник трудов VI межрегиональной научно-практической конференции врачей Приволжско-Уральского военного округа). Оренбург, 2005. – С. 325 – 328;
- Дёмин Д.Б., Тарасенко В.С., Фадеев С.Б., Волков Д.В. Диагностические критерии гнойных осложнений деструктивного панкреатита // Труды международного хирургического конгресса «Новые технологии в хирургии». Ростов-на-Дону, 2005. – С. 62-63;
- Дёмин Д.Б., Тарасенко В.С., Фадеев С.Б., Волков Д.В. Эндохирургическое лечение панкреонекроза // Труды международного хирургического конгресса «Новые технологии в хирургии». Ростов-на-Дону, 2005. – С. 198-199;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Применение высоких доз аскорбиновой кислоты при остром панкреатите // Актуальные вопросы военной и практической медицины. (Сборник трудов VII Всероссийской научно-практической конференции врачей Приволжско-Уральского военного округа). Оренбург, 2006. – Том 2, С. 480 – 484;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. С-витаминный статус у больных острым панкреатитом // Анналы хирургической гепатологии. 2007, том 12, №3. - С. 182 – 183;
- Тарасенко В.С., Дёмин Д.Б., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Малоинвазивные технологии в лечении панкреонекроза // Анналы хирургической гепатологии. 2007, том 12, №3. - С. 231;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Современные аспекты диагностики тяжести деструктивного процесса и лечебной тактики при остром панкреатите // Информационный архив. 2007, том 1, №1. – С. 61-62;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В. С-витаминный статус – прогностический фактор исхода острого панкреатита // Материалы VII межобластной научно-практической конференции хирургов «Актуальные вопросы хирургии», Бугуруслан, 2007. – С. 96 – 99;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Современные аспекты лечения острого панкреатита // Материалы VII межобластной научно-практической конференции «Актуальные вопросы хирургии», Бугуруслан, 2007. – С. 105 – 107;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Современные подходы к диагностике и лечению острого деструктивного панкреатита // Хирург. 2008, № 2. – С.19 – 21;
- Тарасенко В.С., Дёмин Д.Б., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Острый деструктивный панкреатит: прогноз и лечение // Материалы II международной научно-практической конференции хирургов и урологов «Высокие технологии в медицине» Медицинский альманах. 2008, май. Спецвыпуск. С. 103 – 104;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. С-витаминный дефицит при остром деструктивном панкреатите – прогностический фактор исхода заболевания // Хирург. 2008, № 5. – С.12 – 14;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Басов Ф.В., Щетинин Н.А. Некоторые аспекты малоинвазивной хирургии панкреонекроза // Первая международная конференция по торако-абдоминальной хирургии. (Сборник тезисов). Москва, 2008. – С. 93;
- Басов Ф.В., Дёмин Д.Б., Тарасенко В.С., Валов С.Д., Щетинин Н.А. Влияние перфторана на течение экспериментального острого панкреатита // Анналы хирургической гепатологии. 2008, том 13, №3. - С. 39 – 40;
- Дёмин Д.Б., Тарасенко В.С., Басов Ф.В., Щетинин Н.А., Корнилов С.А. Применение перфторана при лечении острого панкреатита // Анналы хирургической гепатологии. 2008, том 13, №3. - С. 48 – 49;
- Тарасенко В.С., Дёмин Д.Б., Басов Ф.В., Щетинин Н.А., Корнилов С.А. Современные подходы к лечению панкреонекроза // Анналы хирургической гепатологии. 2008, том 13, №3. - С. 264 – 265;
- Басов Ф.В., Дёмин Д.Б., Валов С.Д. Изучение влияния перфторана на репаративную регенерацию поджелудочной железы в условиях экспериментального острого панкреатита // Морфология. 2008, том 134, №5. - С. 55. (Материалы Всероссийской научной конференции «Нейробиологические аспекты морфогенеза и регенерации»);
- Дёмин Д.Б., Тарасенко В.С., Басов Ф.В., Щетинин Н.А., Корнилов С.А. Влияние перфторана на течение острого панкреатита // Информационный архив. 2007, том 2, № 4. – С. 25-27;
- Дёмин Д.Б., Тарасенко В.С., Никоноров А.А., Щетинин Н.А., Афонина С.Н., Павлова М.М., Басов Ф.В. Влияние перфторана на процессы липопероксидации, тканевой гипоксии и С-витаминный статус при экспериментальном остром панкреатите // Вестник хирургической гастроэнтерологии. 2008, № 2. – С. 67-71;
- Дёмин Д.Б., Тарасенко В.С., Никоноров А.А., Щетинин Н.А., Афонина С.Н., Павлова М.М., Басов Ф.В. Влияние высоких доз аскорбиновой кислоты на течение экспериментального острого панкреатита // Хирург. 2009, №5. – С.4 – 10;
- Фадеев С.Б., Тарасенко В.С., Кретинин С.В., Дёмин Д.Б., Волков Д.В., Бобылев А.А. Количественная оценка тяжести состояния экспериментальных животных // Актуальные вопросы хирургии: проблемы и пути решения. Сборник научно-практических работ, посвящённый 90-летию отделенческой больницы на ст. Оренбург. Оренбург, 2009. – С. 216-218;
- Дёмин Д.Б., Тарасенко В.С., Басов Ф.В., Щетинин Н.А., Корнилов С.А. Некоторые патогенетические принципы лечения острого панкреатита // Актуальные вопросы хирургии: проблемы и пути решения. Сборник научно-практических работ, посвящённый 90-летию отделенческой больницы на ст. Оренбург. Оренбург, 2009. – С. 18-21;
- Дёмин Д.Б., Тарасенко В.С., Михеева С.И., Иликаева А.А. Пункционно-дренирующие вмешательства под ультразвуковым контролем в лечении панкреонекроза // Актуальные вопросы хирургии: проблемы и пути решения. Сборник научно-практических работ, посвящённый 90-летию отделенческой больницы на ст. Оренбург. Оренбург, 2009. – С. 150-152;
- Басов Ф.В., Дёмин Д.Б., Валов С.Д., Тарасенко В.С., Щетинин Н.А., Корнилов С.А., Бобылев А.А. Особенности морфологических изменений печени в условиях экспериментального острого панкреатита // Актуальные вопросы хирургии: проблемы и пути решения. Сборник научно-практических работ, посвящённый 90-летию отделенческой больницы на ст. Оренбург. Оренбург, 2009. – С. 196-197;
- Demin D.B. C-Vitamin Status in the Patients With Acute Pancreatitis // HPB. 2009, V. 11. - Suppl. 2. – P. 30. (Abstracts of the Eigths Congress of the European Hepato-Pancreato-Biliary Association. 18-20 Juine 2009. Athens, Greece);
- Demin D.B. Minimal invasive surgery of acute pancreatitis // HPB. 2009, V. 11. - Suppl. 2. – P. 90. (Abstracts of the Eigths Congress of the European Hepato-Pancreato-Biliary Association. 18-20 Juine 2009. Athens, Greece);
- Дёмин Д.Б., Смолягин А.И., Попова Е.В., Тарасенко В.С. Некоторые иммунологические предикторы исхода панкреонекроза // Вестник Уральской медицинской академической науки (Тематический выпуск по аллергологии и иммунологии). 2009. № 2/1 (24). – С. 99 – 100;
- Дёмин Д.Б., Смолягин А.И., Попова Е.В., Тарасенко В.С. Иммуномодулирующий эффект перфторана при лечении острого панкреатита // Вестник Уральской медицинской академической науки (Тематический выпуск по аллергологии и иммунологии). 2009. № 2/1 (24). – С. 205 – 207;
- Дёмин Д.Б., Тарасенко В.С., Щетинин Н.А., Корнилов С.А., Басов Ф.В. Актуальные проблемы малоинвазивной хирургии острого панкреатита // Морфологические ведомости. 2009. № 3. – С. 180-181;
- Дёмин Д.Б., Стадников А.А., Валов С.Д., Басов Ф.В., Тарасенко В.С., Щетинин Н.А., Корнилов С.А. Гистологическая характеристика морфологических изменений печени в условиях экспериментального острого панкреатита при использовании перфторана // Морфологические ведомости. 2009. № 3. – С. 279-281;
- Дёмин Д.Б., Тарасенко В.С., Смолягин А.И. Цитокиновый статус как предиктор исхода панкреонекроза // Тезисы докладов XVI международной конференции хирургов-гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии». 2009. – С. 68;
- Дёмин Д.Б., Тарасенко В.С., Корнилов С.А., Щетинин Н.А. Уровень молочной кислоты в сыворотке крови – маркер объема панкреатического некроза при остром панкреатите // Московский хирургический журнал, 2009. № 3 (7). – С. 54-57;
- Дёмин Д.Б., Смолягин А.И., Попова Е.В., Тарасенко В.С., Щетинин Н.А. Влияние перфторана, высоких доз аскорбиновой кислоты и их комбинации на цитокиновый профиль и уровень сывороточных иммуноглобулинов при остром панкреатите // Цитокины и воспаление. 2009, Т. 8, № 3. – С. 59-63;
- Дёмин Д.Б., Тарасенко В.С., Щетинин Н.А., Корнилов С.А., Басов Ф.В. Влияние высоких доз аскорбиновой кислоты на течение острого панкреатита // Вестник хирургической гастроэнтерологии. 2009, № 3. – С. 54-62.
- Дёмин Д.Б., Тарасенко В.С., Никоноров А.А., Щетинин Н.А., Афонина С.Н., Павлова М.М., Басов Ф.В. Применение перфторана в комплексном лечении острого панкреатита // Вестник хирургии имени И.И.Грекова. 2009. Т. 168, №4. – С. 97 – 100;
- Дёмин Д.Б., Тарасенко В.С., Щетинин Н.А., Корнилов С.А. Малоинвазивная хирургия панкреонекроза – успехи и проблемы // Вестник хирургии имени И.И.Грекова, 2009, Т. 168, №5. – С. 55-58;
- Дёмин Д.Б., Тарасенко В.С., Стадников А.А., Смолягин А.И., Басов Ф.В. Применение перфторана в комплексном лечении острого панкреатита. Пособие для врачей. – Оренбург: ГОУ ВПО ОрГМА, 2009. – 48 с.
Изобретения по теме диссертации.
1. Тарасенко В.С., Дёмин Д.Б., Волков Д.В., Твердохлиб В.П., Соломатова Т.В. Способ прогнозирования исхода деструктивного панкреатита // Патент РФ на изобретение № 2153676 от 20.07.2000 г.;
2. Тарасенко В.С., Дёмин Д.Б., Волков Д.В. Способ диагностики гнойно-некротических осложнений при панкреонекрозе // Патент РФ на изобретение № 2199121 от 20.02.2003 г.;
3. Дёмин Д.Б., Тарасенко В.С., Щетинин Н.А., Никоноров А.А., Афонина С.Н., Павлова М.М., Корнилов С.А., Басов Ф.В. Способ прогнозирования исхода деструктивного панкреатита // Патент РФ на изобретение № 2338195 от 10.11.2008 г.;
4. Дёмин Д.Б., Тарасенко В.С., Щетинин Н.А., Никоноров А.А., Афонина С.Н., Павлова М.М., Корнилов С.А., Басов Ф.В. Способ диагностики формы острого панкреатита // Патент РФ на изобретение № 2339042 от 20.11.2008 г.

