Технология получения компонентов тест-системы для диагностики классической чумы свиней
УДК 619:616.9-002-07 На правах рукописи
ЕСЕНЕЕВА САЛТАНАТ СОВЕТОВНА
Технология получения компонентов тест-системы для диагностики классической чумы свиней
16.00.03 – ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология
Автореферат
диссертации на соискание ученой степени
кандидата ветеринарных наук
Республика Казахстан
Астана, 2010
Работа выполнена в Научно-исследовательском институте биотехнологии АО «Казахский агротехнический университет им. С.Сейфуллина» и кафедре Ветеринарной санитарии.
| Научный руководитель: | доктор ветеринарных наук Абдрахманов С.К. |
| Официальные оппоненты: | доктор ветеринарных наук, профессор Никитин Е.Б. |
| кандидат ветеринарных наук Бакирова Г.А. | |
| Ведущая организация | Казахский национальный аграрный университет |
Защита состоится 26 мая 2010 г. в 1000 часов на заседании диссерта-ционного совета ОД 18.08.03 при Казахском агротехническом университете им. С.Сейфуллина по адресу: 010011, г. Астана, пр. Победы, 62 тел.: 8 (7172) 31-75-64, факс: 8 (7172) 31-75-68, www.agun.kz
С диссертацией можно ознакомиться в библиотеке АО «Казахский агротехнический университет им. С.Сейфуллина».
Автореферат разослан «__» апреля 2010 г.
Ученый секретарь
диссертационного совета,
доктор ветеринарных наук, профессор Абдрахманов Т.Ж.
ВВЕДЕНИЕ
Актуальность проблемы. Одной из наиболее опасных инфекционных болезней является классическая чума свиней (КЧС). В настоящее время данная инфекция зарегистрирована в 32 странах мира, в том числе 12 европейских, 12 азиатских и 8 американских.
Практический опыт показывает, что защита хозяйств и страны от заноса возбудителя, а тем более ликвидация возникшей эпизоотии чрезвычайно трудна и требует больших затрат. Эта болезнь за последние годы в европейских странах нанесла ущерб в 4 млрд. долларов США [Вишняков И.Ф., 1991; Коломыцев А.А., 1995].
В последние годы 2005-2008 гг. поголовье свиней в Республике Казахстан достигло 1 509,3 – 1 927,5 тыс. голов, что свидетельствует о динамичном развитии данной отрасли животноводства. Однако ряд инфекционных болезней значительно сдерживает развитие.
Эпизоотическая сситуация по классической чуме свиней в Республике Казахстан характеризуется спорадическими случаями проявления. Последние вспышки данной инфекции зарегистрированы в 2001 г. в Костанайской области и в 2004 г. в Алматинской области, ущерб от которых составил около 10 млн. тенге [Абдрахманов С.К., 2008].
Для серодиагностики классической чумы свиней разработаны и применяются различные методы, такие как иммунодиффузия в агаровом геле, иммунофлюоресценция, реакция связывания комплемента, пассивная гемагглютинация, иммуноэлектрофорез. [Куриннов В.В., 2005].
В диагностике КЧС в республике используются биопроба на восприимчивых животных, иммуноферментный анализ, а также тест-система зарубежного производства.
Одним из наиболее динамично развивающихся методов диагностики вирусных и бактериальных инфекции в ветеринарии и медицине является иммуноферментный анализ [Булашев А.К., 1995; Бакирова Г.А., 2001; Дюсенова Г.Т., 2005; Куйбагаров М.А., 2006].
Значительный прогресс в области вирусологии, инфекционной патологии и иммунологии за последнюю четверть века достигнут во многом благодаря гибридомной технологии.
Применение гибридом и моноклональных антител (МКА) в биологических, вирусологических и медицинских исследованиях изменило наши представления о структуре вирусов и антител, функциях отдельных компонентов вириона (антигенов) в развитии иммунных реакций, роли различных типов антител в нейтрализации вирусов и т.д. Кроме того, имея в распоряжении штамм гибридных культивируемых клеток-продуцентов МКА можно стандартизировать процесс производства диагностикумов. Все это позволяет успешно применять МКА для повышения специфичности и чувствительности иммунологических методов диагностики инфекционных заболеваний.
В соответствии с эпизоотологической важностью и затруднениями в диагностике КЧС возникла потребность в разработке новых диагностикумов отечественного производства, которые позволили бы провести эффективный мониторинг болезни среди домашних и диких свиней.
Цели и задачи исследования. Целью работы является технология получения компонентов тест-системы для диагностики классической чумы свиней. В соответствии с целью были поставлены следующие задачи:
- Получение и очистка антигена вируса КЧС;
- Отработка условий получения специфической сыворотки против КЧС;
- Получение гибридом, стабильно продуцирующих моноклональные антитела;
- Определение диагностической ценности «Сэндвич» варианта иммуно-ферментного анализа, при детекции антител в сыворотке крови свиней с применением моноклональных антител к вирусу КЧС;
- Оценка экономической эффективности разработки.
Научная новизна. Впервые разработан и предложен способ получения антигена вируса классической чумы свиней для серологических реакций.
Отработана схема очистки и концентрирования антигена вируса классической чумы свиней, что подтверждено заключением РГКП «Национальный институт интеллектуальной собственности» о выдаче инновационного патента на изобретение №62950 от 15.01.2010 г., Бюл. №1, которая позволяет получать высокоочищенные антигены, обладающие специфическими свойствами.
Отработана схема получения высокоактивных вирусспецифических сывороток с использованием штамма «КТ», пригодных для постановки серологических реакций.
Впервые создан штамм гибридных культивируемых клеток – Mus. musculus L - продуцент моноклональных антител к вирусу классической чумы свиней с авторским названием 3Е9-КТ, на что подана заявка РГКП «Национальный институт интеллектуальной собственности» о выдаче инновационного патента на изобретение.
Установлена возможность использования моноклональных антител (гибридомы 3Е9-КТ) в «сэндвич» варианте иммуноферментного анализа для обнаружения антител вируса классической чумы свиней.
Основные положения, выносимые на защиту
- Получение антигена и схема очистки вируса классической чумы свиней;
- Отработка схемы гипериммунизации животных для получения специфической сыворотки против классической чумы свиней;
- Получение и характеристика моноклональных антител, созданных путем слияния миеломных линий Х 63. Ag.8.6.5.3. с лимфоцитами мышей BALB/c иммунизированных антигенами вируса классической чумы свиней;
- Определение диагностической ценности «Сэндвич» варианта иммуноферментного анализа при детекции антител в сыворотке крови свиней с применением моноклональных антител;
- Экономическая оценка эффективности разработки.
Практическая значимость работы. Предложен к использованию при разработке и совершенствовании методов идентификации вируса классической чумы свиней, штамм гибридных культивируемых клеток с авторским названием «3Е9-КТ» депонированный в Коллекции микроорганизмов ДГП «Научно-исследовательский институт проблем биологической безопасности НЦБ РК КН МОН РК под регистрационным номером М-11-09/Д от 21.07.2009г.
Разработаны «Методические указания по лабораторной диагностике классической чумы свиней при введении международной торговли». Утверждены директором Департамента развития животноводства и ветеринарной безопасности МСХ РК 16.01. 2008 г., Астана.
Результаты научных исследований внедрены в учебный процесс АО «Казахский агротехнический университет им. С. Сейфулина» и РГКП «Костанайский государственный университет им. А. Байтурсынова» при подготовке кадров по специальностям 051201- Ветеринарная медицина, 051202- Ветеринарная санитария.
Апробация работы. Материалы диссертации доложены и обсуждены на:
Заседаниях Ученых советов Казахского агротехнического университета им. С. Сейфуллина с 2006-2009 гг.; Международной научно-практической конференции, посвященной 50-летию основания АО КазГАТУ им. С.Сейфуллина (г. Астана, 2007); Республиканской научно-теоретической конференции «Сейфуллинское чтения-3» посвященной 50-летию основания КазГАТУ им. С.Сейфуллина (г. Астана,2007); Международной научно-практической конференции «Состояние и перспективы диагностики инфекционных болезней животных» (Астана, 2008); Международной научно-практической конференции, посвященной 50-летию Научно-исследовательского института проблем биологической безопасности НЦБ МОН РК Биотехнология в Казахстане: проблемы и перспективы инновационного развития (г. Алматы 2008).
Публикации. По теме диссертации опубликовано 9 научных работ.
Объем и структура диссертации. Диссертация изложена на 120 страницах и состоит из введения, основной части, заключения, списка использованной литературы и приложений. Список использованных источников содержит 227 наименований работ. Материалы иллюстрированы 12 таблицами, 9 рисунками.
1ОСНОВНАЯ ЧАСТЬ
1.1 Материалы и методы исследования
Животные. При выполнении работ были использованы следующие виды и возрастные группы животных: 55 мышей беспородных и 25 мышей линии BALB/c 6-8 недельного возраста; кролики с живой массой 2,5-3,0 кг, породы шиншилла – 24 голов; cвиньи крупной белой породы, 2-6 мес. возраста-8 голов.
В работе использован вакцинный штамм вируса классической чумы свиней Pestis suum “КТ”. Штамм культивируется на кроликах, инкубационный период 2-3 суток. Титр вируса 4,25 lg ИД50/см. Штамм депонирован за регистрационным номером П25-99/Д от 26.09.1999 г., в коллекции микроорганизмов НИИПББ НЦБ РК.
Набор ИФА «Сеditest CSFV Ag», для выявления антигена вируса классической чумы свиней и набор ИФА «Сеditest CSFV Ab», для выявления антител к вирусу классической чумы свиней (производство Нидерланды).
В качестве гетерологичных антигенов использовали антигены вируса диареи КРС, штамм «Орегон», болезни Ауески штамм «УБ-95», гриппа птиц Н5 N1, лейкоза КРС.
Получение вируссодержащего материала проводили инфицированием лапинизированным штаммом КТ кроликов массой 2,5- 3 кг с ежедневным измерением температуры тела. Сбор вируссодержащего материала (кровь, брыжеечные лимфоузлы и селезенку) проводили в период проявления температурной реакции (24-72 ч.).
Полученный вирусcодержащий материал гомогенизировали в STE-буфере. В вируссодержащую жидкость после осветления добавляли ПЭГ 6000 до конечной концентрации 6%. Через 12-16 ч. центрифугировали при 5000 об/мин 30 мин, в дальнейшем использовали осадок, которую подвергали центрифугированию при 35000 об/мин в течение 2 час, осадок ресуспендировали в STE -буфере и наслаивали на 20-40-60% сахарозу с последующим центрифугированием при 25000 об/мин в течение 4 час.
Гибридомная техника. Гибридомы получали путем слияния лимфоцитов мышей линии BALB/c, стимулированных белковым антигеном вируса классической чумы свиней с клетками миеломной линии клеток Х63 – Ag 8.653. В качестве сливающего агента использовали 45% раствор полиэтиленгликоля (ПЭГ-4000). Клонирование гибридных клеток проводили методом лимитирующих разведений J. Coding et. al. Антитела из полученной асцитной жидкости выделяли методом высаливания насыщенным раствором сульфата аммония.
Активность и специфичность моноклональных антител определяли в непрямом ИФА. Электрофорез белковых антигенов проводили в 10% полиакриламидном геле в присутствии додецилсульфата натрия по методу J. Laemmli et al. Электрофоретический перенос антигенов из геля на нитроцеллюлозную мембрану осуществляли с помощью прибора для иммуноблотинга по Н. Towbin et al.
Константу связывания моноклональных антител устанавливали по методу J. Beatty, (1987). Определение классов и подклассов продуцируемых моноклональных антител проводили в реакции двойной иммунодиффузии по по методу O. Ouchterlony.
2 Результаты исследований
2.1 Получение и характеристика антигена вируса КЧС
Штамм вируса классической чумы свиней Pestis suum «КТ» (Карагандинский, термостабильный) выделен из местного слабопатогенного эпизоотического изолята от больных свиней в Карагандинской области в 1988 году. Штамм аттенуирован на кроликах посредством длительных пассажей. Штамм вируса отнесен к семейству Flaviviridae, род Pestivirus, РНК-геномный.
Для получения органно-тканевого вируссодержащего материала штамма вируса классической чумы свиней Pestis suum «КТ», клинически здоровых кроликов породы шиншилла, живой массой 2,5-3 кг, заражали внутривенно штаммом Pestis suum «КТ» вируса КЧС в объеме 1 см.
Через каждые 12 часов, начиная с 24 часа, проводили термометрию животных. Животных с повышенной температурой отделяли для получения вирусного материала. Пик температурной реакции соответствует наибольшему накоплению вируса в организме животных. Сбор вируссодержащего материала проводили с 36 часа до 72 часов после заражения кроликов. Полученный вирусный материал обладал сравнительно высокой активностью, которую определяли титрованием в организме кроликов, и составил 3,75-4,5 ± 0,07 lg ИД 50/см.
Вируссодержащий материал очищали тремя способами очистки:
1. Вируссодержащий материал гомогенизировали в STE-буфере (0,1М трисНСl, рН 7.4, 0,1М NаСl и 10-4 ЭДТА), осветление гомогената проводили на рефрижераторной центрифуге при 2000 об/мин 30 минут. В дальнейшем в вируссодержащую жидкость после осветления добавляли полиэтиленгликоль 6000 до конечной концентрации 6%. Перемешивали до полного растворения, затем суспензию оставляли на ночь при 4° С. На следующий день центрифугировали при 5000 об/мин 30 мин. Для дальнейших экспериментов использовали осадок. Полученный очищенный вирус использовали в качестве фракции № 1.
2. Вируссодержащий материал ресуспендировали в STE-буфере (0,1М трис-НСl, рН 7.4, 0,1М NаСl и 10-4 ЭДТА) и наслаивали на 20-60% сахарозу. Центрифугировали при 25000 об/мин в течение 3-4 часов. 20-60% раствор готовили на специальном растворе (200 мМ глицин, 50 мМ трис-НСl, 100мМ NaCl, 1 мМ ЭДТА, рН доводят до 7,5 с помощью НСl). В пробирку на дно вносили 60% сахарозу до 1/10 объема пробирки, затем осторожно по стенке наслаивали 3/10 объема 20% раствор сахарозы. Остальной объем пробирки заполняли вируссодержащим материалом и центрифугировали при 100000 g 35-40 тыс. об/мин в течение 3 часов. После центрифугирования вирус локализовался в интерфазе между 20-60%-ным содержанием сахарозы. Полученный очищенный вирус использовали в качестве фракции № 2.
В основу предложенной нами схемы очистки положена комбинация методов.
3. Вируссодержащий материал гомогенизировали в STE-буфере (0,1М трис-НСl, рН 7.4, 0,1М NaCl и 10-4 ЭДТА), осветление гомогената осуществляли на рефрижераторной центрифуге при 2000 об/мин 30 минут. В дальнейшем в вируссодержащую жидкость добавляли ПЭГ- 6000 до конечной концентрации 6%. Перемешивали до полного растворения, затем суспензию оставляли на ночь при 4о С. На следующий день центрифугировали при 5000 об/мин 30 мин. Для дальнейших экспериментов использовали осадок. Полученный осадок подвергали центрифугированию при 35000 об/мин в течение 2 час. Полученный ультрацентрифугированием осадок ресуспендировали в STE - буфере и наслаивали на 20-60% сахарозу. Центрифугировали при 25000 об/мин в течение 4 час. После центрифугирования вирус локализовался в интерфазе между 20-60%-ным содержанием сахарозы. Полученный очищенный вирус использовали в качестве фракции № 3.
Очищенный вирус КЧС является необходимым компонентом для иммунизации с целью получения моноклональных антител, поэтому одним из наиболее точных методов оценки степени очистки вируса является обнаружение его при электронно-микроскопическом исследовании.
Для выявления вируса методом негативного контрастирования, материал обрабатывали по стандартным электронно-микроскопическим методам.
При электронно-микроскопическом исследовании во всех фракциях было обнаружено, что вирион вируса имеет характерную для данного семейства форму. Частицы вируса состоят из внутренней серцевины и наружной оболочки, размер вириона составляет 40-60 нм.
При определении чистоты вирусных фракции выявилось, что фракция №1 по степени чистоты составила 20%, фракция №2 40-60%. Фракция №3, которая включала комбинацию методов, показала степень чистоты до 90-98%.
Таким образом, электронно-микроскопическое исследование является достоверным высокочувствительным методом определяющий степень очистки вируса чумы свиней, в результате при комбинированном методе чистота вирусного материала составила 90-98%.
Для обнаружения антигена вируса КЧС применяются несколько методов исследований таких, как прямой анализ флюоресцирующих антител (Ressang, 1973), прямой иммунопероксидазный анализ (Wensvoort et al, 1986) или иммуноферментный анализ. Набор является дополнительным, ценным диагностическим средством повышения диагностической уверенности в конечном определении инфекции, вызванной вирусом КЧС.
В дальнейшей работе с целью определения антигенной активности, белковые фракции были подвергнуты иммуноферментному анализу с применением коммерческого набора ИФА «Сеditest CSFV - Ag» для выявления антигена вируса классической чумы свиней в цельной крови, плазме или экземплярах ткани фирмы Cedi- Diagnostics B. V. Серийный номер 7610047. Действие тест-набора основано на принципе сэндвич анализа. Окрашивание хромогена /субстрата в синий цвет указывает на то, что образцы являются положительным на вирус КЧС. Отсутствие цвета или минимальное окрашивание при отрицательном результате образца на вирус КЧС.
Значение средней оптической плотности приведены в таблице 1.
По данным таблицы видно, что вирус КЧС выявлен во всех исследованных пробах и их оптическая плотность составилa в фракции №1 – 1,260± 0,05, фракции №2 – 1,340± 1,30 и фракции №3 – 1,590±1,61. Испытанные пробы антигенов показали положительные результаты в ИФА, что говорит об активности данного материала.
Уровень взаимодействия специфичных антител с антигеном был аналогичен уровню реакции с контрольным положительным антигеном.
Таблица 1- Результаты оценки оптической плотности антигенов в ИФА
М ±m
| № п/п | Исследуемые пробы | Средняя оптическая плотность в ИФА | % очистки |
| 1 | фракция №1 | 1,260± 0,05 | 20 |
| 2 | фракция №2 | 1,340± 1,30 | 60 |
| 3 | фракция №3 | 1,590± 1,61 | 98 |
| 4 | Положительный контроль | 1,380± 1,38 | - |
| 5 | Слабоположительный контроль | 0,700± 0,81 | - |
| 6 | Отрицательный контроль | 0,070± 0,07 | - |
В дальнейших исследованиях полученные белковые фракции в электрофорезе с 10 %-ном полиакриламидном геле в присутствии додецилсульфата натрия (ДСН) по методу J. Laemmli et al (рисунок 1).
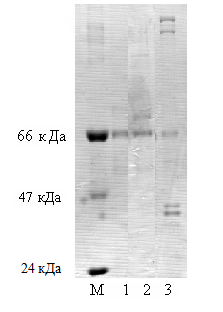
М-молекулярный маркер
1,2, 3 - образцы очищенного антигена
Рисунок 1 – Электрофорез белкового антигена вируса классической чумы свиней
Проведенный нами электрофорез очищенного препарата вируса КЧС в 10% полиакриламидном геле, во всех трех образцах показали наличие белковых фракций с молекулярной массой 66 кДа, в образце №3 были обнаружены наличие 5 белков с молекулярными массами приблизительно 41 кДа, 44 кДа, 66 кДа, 108 кДа, 116 кДа.
Полученные результаты показывают, что электрофоретический анализ содержит структурные белки характерные вирусу КЧС.
Таким образом, отработаны оптимальные условия получения и очистки вируссодержащего материала позволяющего провести 90-95% очистку и концентрирование вируса классической чумы свиней.
2.2 Получение специфической сыворотки против классической чумы свиней
С целью получения высокоактивных специфических сывороток против КЧС использовали органо-тканевые материалы вакцинного лапанизированного штамма КТ (дефибринированная кровь, селезенка, лимфоузлы кроликов). Нативные вируссодержащие суспензии, после осветления низкоскоростным центрифугированием, использовали для гипериммунизации свиней и кроликов.
Подсвинкам антиген вводили в возрастающих дозах (50, 100 см) внутримышечно, через 14 суток 50 см внутривенно. Через две недели после последней инъекции животных обескровливали для получения сыворотки крови.
Кроликам за неделю до начала цикла гипериммунизации подколенные лимфатические узлы сенсибилизировали неполным адъювантом Фрейнда в дозе 1 см 3 на каждого кролика. Гипериммунизация включала 5 введений антигена с недельным интервалом в область подколенных лимфатических узлов. Антиген вводили в возрастающей дозе (1; 1,5; 2; 2,5; 3 мг) на одного кролика в комплексе с равным объемом полного адъюванта Фрейда. Титры антител в полученных сыворотках определяли в ИФА.
Результаты исследований показали что, специфические сыворотки, полученные при гипериммунизации свиней, обладали высокой активностью, титр антител составил 1:6400. Полученный из этой сыворотки гамма-глобулин имел активность в этой же реакции 1:12800. Иммунизация кроликов оказалось малоэффективным, титры антител в сыворотках крови в ИФА не превышали 1:800.
Таким образом, в результате проведенных исследовании установлено, что полученные специфические сыворотки по схеме гипериммунизации свиней являются оптимальным, где титры антител в 8 раз выше, чем в сыворотках крови полученные при иммунизации кроликов.
2.3 Получение и характеристика моноклональных антител к антигену вируса классической чумы свиней
Для получения иммунных спленоцитов мыши линии BALB/с 8-недельного возраста были разбиты на три группы и иммунизированы внутрибрюшинно антигенами вируса КЧС в дозе 100 мкг/мл. Первая группа мышей была иммунизирована фракцией №1, вторая фракцией №2 и третья №3 соответственно. Оптимальной оказалась двухнедельная схема иммунизации мышей.
По истечении трех дней после последней иммунизации в сыворотке крови мышей с помощью ИФА определяли титры антител против антигена, использованного для иммунизации. Результаты исследований показали, что все антигены, вполне пригодны для стимулирования иммунной системы организма подопытных животных. Титры специфических антител в сыворотке крови мышей, иммунизированных белковыми антигенами разных фракции, в ИФА достигали 1:3200 - 1:12800, что указывает на активную индукцию клонов В-лимфоцитов продуцирующих антитела заданной специфичности. Наибольший титр был отмечен при применении антигена №3 (таблица 2).
Таблица 2 – Исследование сывороток крови иммунизированных мышей линии BALB/c в непрямом варианте ИФА
| Группы мышей | Антиген использованный для иммунизации | Титры специфических антител к исходному антигену |
| I | № 1 | 1:3200 |
| II | № 2 | 1:6400 |
| III | № 3 | 1:12800 |
Селезенки, которые были использованы в качестве источника иммунных лимфоцитов, взяты у животных с наивысшими титрами.
Слияние иммунных В-лимфоцитов и миеломных клеток стало основным этапом получения гибридом - продуцентов моноклональных антител. Источником лимфоцитов послужила селезенка от иммунной мыши с титром специфических антител - 1:12800. Соотношение клеток миеломной линий X63 Ag 8.653 и спленоцитов при проведении гибридизации составило 1:20.
Тестирование гибридом на продукцию антител начинали проводить с того момента, когда наблюдалось незначительное пожелтение ростовой среды и клетки гибридом занимали более 30% поверхности лунок (таблица 3).
Таблица 3- Динамика образования гибридных клеток
| Количество суток после гибридизации | Количество образовавшихся клонов | % клонообразования |
| 12 | 45 | 11,7 |
| 17 | 78 | 20,3 |
| 27 | 119 | 30,9 |
Как видно из таблицы 3, в результате гибридизации лимфоцитов, стимулированных антигеном вируса КЧС с миеломной линии, в 119 из 384 засеянных лунок отмечен рост клонов гибридных клеток, что составило 30,9 % клонообразования. Также следует отметить, что увеличение числа гибридом возрастает по мере увеличения продолжительности культивирования и имеет положительную коррелятивную связь.
В целях оценки стабильности антительной продуктивности гибридомы были подвергнуты пятикратному тестированию, в течение которых исследовали их культуральную жидкость в ИФА на наличие специфических антител против белкового антигена вируса КЧС. При этом было выявлено, что из полученных клонов к вирусу КЧС восемь сохранили положительную активность (таблица 4).
Таблица 4- Результаты скрининга гибридных клеток
| Оптическая плотность | Название гибридомы | |||||||
| 1С11 | 1G9 | 1C5 | 2B2 | 2G6 | 3Е9 | 3B8 | 4D6 | |
| 1 тестиро-вание | 2,206 | 0,569 | 0,352 | 1,297 | 0,589 | 1,238 | 0,365 | 0,439 |
| 2 тестиро-вание | 2,851 | 0,851 | 0,616 | 1,348 | 0,659 | 1,376 | 1,344 | 1,407 |
| 3 тестиро-вание | 1,212 | 1,260 | 1,160 | 1,920 | 0,836 | 1,860 | 1,747 | 1,587 |
| 4 тестиро-вание | 1,916 | 1,736 | 2,201 | 2,261 | 0,839 | 2,044 | 1,806 | 2,638 |
| 5 тестиро-вание | 2,365 | 1,749 | 2,67 | 2,384 | 1,728 | 2,219 | 2,611 | 2,656 |
| Среднее значение | 2,110± 0,34 | 1,230± 1,51 | 1,400± 1,94 | 1,840± 2,10 | 0,930± 1,11 | 1,750± 1,96 | 1,570± 1,94 | 1,740± 2,23 |
В результате проведенных нами исследовании отобраны 8 штаммом гибридных клеток, стабильно продуцирующие моноклональные антитела с оптической плотностью при тестировании в ИФА в среднем от 0,930± 1,11 до 2,110± 0,34.
Титры МКА штаммов гибридом в культуральной жидкости составляли от 1:200 до 1:6400. Среди них штаммы гибридных клеток 3Е9, 3В8 стабильно продуцирующие моноклональные антитела были подвергнуты клонированию методом лимитирующих разведений, а остальные гибридомы для длительного сохранения ценных клеточных линии, подвергнуты криоконсервации.
В результате клонирования получены 3 штамма стабильно продуцирующие МКА специфичные антигену вируса КЧС.
В ходе дальнейших исследований были изучены морфологические и культуральные свойства гибридом в условиях in vitro.
Исследования по изучению морфологических и культуральных свойств показали, что гибридомы штаммов 3Е9 и 2В8 хорошо растут в ростовой среде, представляющей собой RPMI-1640 с 10% сывороткой плода коровы, 2х10-3 М L-глютамина, 1х10-3 М пирувата натрия при температуре 37,5°С в атмосфере с 5% СО2.
Для наработки препаративного количества МКА клетки гибридомы 3Е9F2 ресуспендировали в неполной ростовой среде и вводили 2х106 клеток внутрибрюшинно мышам линии BALB/c, которым за 7-10 дней до этого был инъецирован пристан – 2, 6, 10, 14 тетраметипентадекан (Sigma, США) в дозе 0,5 мл на голову.
После образования асцитной опухоли через 12-14 дней мышь убивали методом цервикальной дислокацией и отбирали из брюшной полости асцитную жидкость. Полученные таким образом 2 серии асцитной жидкости были тестированы в ИФА (таблица 5).
Таблица 5 – Результаты тестирования МКА гибридомы 3Е9F2 в ИФА
| Разведение асцитной жидкости | Серия асцитной жидкости | Отрицательный контроль | |
| №1 | №2 | ||
| 1:100 | 1,227 | 1,831 | 0,155 |
| 1:200 | 1,112 | 1,741 | 0,139 |
| 1:400 | 1,095 | 1,677 | 0,119 |
| 1:800 | 1,037 | 1,610 | 0,103 |
| 1:1600 | 0,928 | 1,542 | 0,077 |
| 1:3200 | 0,874 | 1,488 | 0,073 |
| 1:6400 | 0,641 | 1,208 | 0,063 |
| 1:12800 | 0,467 | 0, 923 | 0,058 |
| 1:25600 | 0,294 | 0,714 | 0,057 |
| 1:51200 | 0,105 | 0,467 | 0,042 |
| 1:102400 | 0,046 | 0,215 | 0,036 |
По данным таблицы 5 видно, что титры 1, 2 серии асцитной жидкости в ИФА составил 1:25600 и 1:102400 соответственно.
Для того чтобы оценить перспективы и диапазон использования полученных гибридом, была проведена первоначальная оценка МКА.
Определение изотипа, синтезируемых гибридомой 3Е9F2 МКА, показало, что они принадлежат к иммуноглобулинам класса G, к подклассу G1.
Показатель константы связывания моноклональных антител гибридомы 3Е9F2 составил 2,1х10-8М, что свидетельствует о высокой степени совпадения конфигураций активного центра антитела и антигенной детерминанты.
В дальнейших исследованиях нами проводилось определение специфичности полученных моноклональных антител.
Известно, что вирус диареи по антигенным свойствам сходен с вирусом классической чумы свиней и относятся к одному роду Pestivirus, в связи с этим, специфичность определяли по отношению к вирусу диареи КРС, коммерческого антигена вируса КЧС, а также к вирусам болезни Ауески штамм УБ-95, лейкоза КРС, гриппа птиц H5N1.
Анализ проводили на 96-луночных полистироловых планшетах, лунки которых сенсибилизировали антигенами различных вирусов в концентрации 0,010 мг/мл. Титры моноклональных антител определяли в культуральной и асцитной жидкости (таблица 6).
Таким образом, результаты опыта свидетельствуют о специфичности МКА гибридомы 3Е9F2 к антигенам вируса КЧС. Полученные МКА могут использоваться для конструирования диагностических препаратов для индикации и дифференциации вируса КЧС.
Таблица 6 – Изучение специфичности и активности МКА штамма гибридомы
3Е9F2 в непрямом варианте ИФА
| № | Виды антигенов | Титры МКА | |
| Культуральная жидкость | Асцитная жидкость | ||
| 1 | Вирус классической чумы свиней, шт. «КТ» (очищенный препарат вируса) | 1:32 | 1:12800 |
| 2 | Вирус классической чумы свиней (коммерческий) | 1:16 | 1:6400 |
| 3 | Вирус диареи КРС шт. Орегон | 1:2 | 1:100 |
| 4 | Вирус болезни Ауески шт. «УБ-95» | РО | РО |
| 5 | Вирус гриппа птиц Н5N1 | РО | РО |
| 6 | Вирус лейкоза КРС | РО | РО |
| 7 | Контроль | РО | РО |
| Примечание - РО – реакция отрицательная. | |||
Идентификация вирусных белков, с которыми взаимодействовали МКА полученные на белковый антиген вируса КЧС, а также специфичность связывания антител с антигеном, была проведена методом иммуноблотинга после SDS-электрофореза в 10% полиакриламидном геле по методу J. Laemmli et al. с последующим электропереносом белков на нитроцеллюлозную мембрану по методу Н. Towbin et al (рисунок 2).
МКА полученные на белковый антиген вируса КЧС, давали специфическую полосу окрашивания в области 41,5 кДа, что свидетельствует расчетной молекулярной массе балка Е2 вируса КЧС.
Таким образом, электрофорезом в денатурирующих условиях и иммуноблотингом установлено, что моноклональные антитела изученного клона связываются с антигенными детерминантами, расположенными на белке Е2 вируса КЧС.
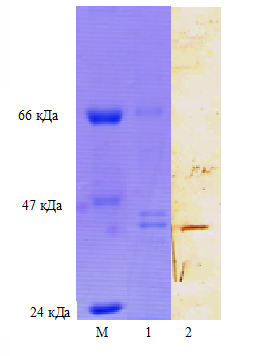
М-молекулярный маркер
1- результат электрофореза
2- результат иммуноблотинга
Рисунок 2- Результат иммуноблотинга
Анализируя положительные результаты взаимодействия МКА с белковым антигеном в ИФА, а также данные иммуноблотинга, можно сделать предположение о том, что антигенные детерминанты, к которым направлены антитела, полученные к антигену, являются линейными.
2.4 Отработка оптимальных условий постановки «Сэндвич» варианта иммуноферментного анализа на основе моноклональных антител.
В последние годы в диагностике инфекционных болезней животных широкое распространение получил иммуноферментный анализ (ИФА).
При создании иммуноферментной системы на основе МКА нами отработаны параметры постановки «сэндвич» варианта ИФА.
Особенностью предлагаемого метода является создание сложного иммунного комплекса, построенного по принципу «сэндвича», который образован двумя антителами и антигеном между ними. Специфичность данного метода значительно выше, так как идентификация молекулы определяемого вещества происходит только при условии узнавания одновременно двух антигенных детерминант.
Отработку оптимальных условий постановки «сэндвич» варианта проводили поэтапно. На первом этапе отрабатывали оптимальные условия сенсибилизации твердой фазы моноклональными антителами. Моноклональные антитела перед сенсибилизацией предварительно разводили в 0,1 М бикарбонатном буфере рН 9,6 до концентрации 1 мкг/мл, 2 мкг/мл, 5 мкг/мл, 10 мкг/мл и вносили по 0,1 мл в лунки полистироловых планшет. Сенсибилизацию планшет проводили в течение 30 мин, 1 часа и 2 часов при температуре +37 °С или оставляли на ночь (16 часов ) в холодильнике при температуре +4 °С.
В результате при концентрации моноклональных антител 10 мкг/мл происходила полная инактивация активных центров полистиролового носителя. Процесс связывания моноклональных антител с носителем завершался в течение 1 часа при +37 °С. Следует отметить, что сенсибилизация на холоде (+4 °С) в течение 16 часов также оказалась вполне пригодной для этой цели.
После сенсибилизации планшетов МКА проводилась забивка активных центров твердой фазы 1% раствором БСА. В процессе постановки ИФА установлено, что 1% концентрация БСА является наиболее оптимальной.
На втором этапе отрабатывали оптимальные условия взаимодействия МКА с антигеном вируса классической чумы свиней.
При подборе оптимальной концентрации антиген вносили по 10,0 мкг/мл; 20,0 мкг/мл; 30,0 мкг/мл в лунку. В ходе работы установлено, что оптимальной является концентрация антигена 10 мкг/мл.
Дальнейшее увеличение концентрации антигена приводило к превышению фонового сигнала и нерациональному расходованию препаратов.
В дальнейших исследованиях разведение 1:400, 1:800 испытуемых сывороток на ЗФР-Т. Во все лунки планшета кроме лунок первого ряда вносят по 100 мкл раствора ЗФР-Т.
Результаты оценки связывания антивидового пероксидазного конъюгата с комплексом Ат-Аг-Ат показали, что равновесие между системами достигается в течение 1 часа инкубирования при температуре +37 °С. Инкубирование более 1 часа сопровождалось незначительным увеличением величин оптической плотности.
Каждый этап ИФА ставили в пяти повторах. Приемлемыми считали такие условия, при которых титр позитивной сыворотки достигал 1:800.
Положительная реакция характеризуется окрашиванием раствора субстрата в желто-коричневый цвет. Реакцию останавливали добавлением в лунки планшет раствора 2М серной кислоты. Результаты ИФА учитывали с помощью спектрофотометра с вертикальным потоком света при длине волны 492 нм.
2.5 Определение диагностической ценности предлагаемого сэндвич варианта ИФА для индикации антител в сыворотке крови свиней
Следующим этапом нашей работы было тестирование проб сывороток свиней. Для сравнения все сыворотки были исследованы в твердофазном варианте иммуноферментной тест-системы «Сеditest CSFV – Ab» разработанной компанией ID-Lelystad (Нидерланды).
Диагностическую ценность «сэндвич» варианта ИФА с использованием моноклональных антител определяли исследованием 46 проб сывороток крови свиней.
Для этого было исследовано 36 проб сывороток полученные из хозяйств Акмолинской области, 8 проб из хозяйств Карагандинской области и 2 положительные сыворотки полученные от гипериммунизированных животных.
Исследуемые сыворотки крови свиней проводили в 2 разведениях 1:400, 1:800 на забуферном физиологическом растворе с твином.
Одновременно с испытуемыми сыворотками в лунках первого ряда ставят следующие контроли:
- в качестве положительного контроля использовали специфическую сыворотку в тех же разведениях, что и с испытуемыми (две лунки);
- в качестве отрицательного контроля сыворотку от не вакцинированной свиньи в тех же разведениях, что и с испытуемыми (две лунки);
- контроль конъюгата (две лунки);
- контроль раствора субстратной смеси (две лунки).
Реакцию учитывали, если среднее значение оптической плотности (ОП) в лунках с контрольной негативной сывороткой (К–) и контролей конъюгата и субстрата в два и более раза ниже ОП в лунках с контрольной позитивной сывороткой (К+) или при наличии в лунках с К+ темно-коричневого окрашивания продукта реакции, а в лунках с К–, контролями конъюгата и субстрата окрашивание отсутствует или светло-желтое.
По данным результатов исследований было установлено что, в 36 пробах из Павлодарской, и 8 пробах из Карагандинской области, исследованных предложенным нами «сэндвич» варианте иммуноферментного анализа и при использовании тест- системы коммерческого производства вирус КЧС не был выявлен. В тоже время пробы, полученные при гипериммунизации дали положительные реакций.
Исходя из этого, можно заключить, что предлагаемый сэндвич вариант ИФА не уступает по специфичности коммерческим аналогам.
Выполнение исследования не отличается сложностью (занимает от 3-х до 4-х часов), а результаты даже при отсутствии спектрофотометра, вполне могут учитываться визуально.
ВЫВОДЫ
- Разработана технология получения органно-тканевого специфического антигена вируса КЧС из вакцинного штамма «КТ», включающая культивирование штамма на кроликах, породы шиншилла, с массой 2,5- 3,0 кг с биологической активностью полученного вируссодержащего материла 3,74-4,5±0,07 lg ИД 50/см и очистку от клеточного детрита ультрацентрифугиро-ванием при 35000 об/мин в течение 2 часов и 25000 об/ мин в течение 4 часов после наслаивания на 20-40-60% сахарозу. Электрофоретический анализ очищенных антигенов показал наличие белков с молекулярными массами: 116кДа, 66 кДа, 41 кДа и 44 кДа.
- Отработана схема получения вирусспецифической сыворотки на свиньях включающей двукратное подкожное и внутривенное введение антигена в нарастающих дозах с интервалом 7 суток, при этом активность гипериммунизированной сыворотки в ИФА составила 1:6400.
- Получено 8 клонов гибридом, стабильно продуцирующих моноклональные антитела, специфичные к антигенным детерминантам структурного полипептида Е2 вируса КЧС.
- Моноклональные антитела клона 3Е9F2 имеют активность от 1:25600 до 1:102400 в непрямом ИФА и реагируют с антигенами вируса КЧС, а также в титрах 1:100 с вирусом диареи КРС.
- На основе использования моноклональных антител предложены технологические основы создания тест - системы для диагностики вируса КЧС методом «сэндвич» варианта иммуноферментного анализа. Диагностическая ценность и специфичность подтверждена серологическими исследованиями.
- Предварительные расчеты по оценке экономической эффективности внедрения данной тест-системы показывают ее эффективность по сравнению с аналогами в 2 раза.
ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
- Предлагается штамм гибридных культивируемых клеток Mus. musculus (авторское название 3Е9-КТ), депонированный в коллекции микроорганизмов ДГП «Научно-исследовательский институт проблем биологической безопасности НЦБ РК (регистрационный № М-11-09/Д), в качестве источника продуцента антител против антигена вируса КЧС, который в отличие от коммерческой поликлональной сыворотки обладает более высокой активностью и специфичностью;
- «Методические указания по диагностике классической чумы свиней, при ведении международной торговли», утвержденные директором Департамента развития животноводства и ветеринарной безопасности МСХ РК 16.01.2008 г.;
- Результаты научных исследований внедрены в учебный процесс АО «Казахский агротехнический университет им. С. Сейфулина» и РГКП «Костанайский государственный университет им. А. Байтурсынова» при подготовке кадров по специальностям 051201- Ветеринарная медицина, 051202- Ветеринарная санитария.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
1 Есенеева С.С., Абдрахманов C.К., Абдураимов Е.О. Очистка и концентрирование вируса классической чумы свиней шт. «КТ» //Тезисы докладов республиканской научно-теоритической конференции «Сейфуллинское чтения-3» посвященной 50-летию основания КазГАТУ им. С.Сейфуллина. – Астана, 2007. - С.116.
2 Есенеева С.С, Абдрахманов С.К., Куйбагаров М.А. Получение моноклональных антител к белковому антигену вируса классической чумы свиней //Материалы международной конференции «Состояние и перспективы диагностики инфекционных болезней животных». – Астана, 2008. - С.198-207.
3 Есенеева С.С, Абдрахманов С.К. Моноклональные антитела к антигену вируса классической чумы свиней //Международная научно-практическая конференция, посвященная 50-летию Научно-исследовательского института проблем биологической безопасности НЦБ МОН РК «Биотехнология в Казахстане: Проблемы и перспективы инновационного развития». - Алматы, 2008. - С.454.
4 Есенеева С.С, Абдрахманов С.К., Асауова Ж.С., Мамадалиев С.М. Эпизоотический мониторинг и профилактика классической чумы свиней //Сборник научных трудов «Теория и практика борьбы с болезнями животных в Казахстане». КазНИВИ. - Алматы, 2008. - С.8-15.
5 Абдрахманов С.К., Мамадалиев С.М., Есенеева С.С., Асауова Ж.С., Методические указания по лабораторной диагностике классической чумы свиней при введении международной торговли. - Утв. департаментом развития животноводства и ветеринарной безопасности МСХ РК 14.03.2008 г. - Астана, 2008. - 8 с.
6 Есенеева С.С., Абдрахманов С.К., Куйбагаров М.А. Характеристика моноклональных антител полученных к вирусу классической чумы свиней //Вестник науки Казахского агротехнического университета им. С.Сейфуллина. -Астана, 2009. - №3 (54). - С.79-85.
7 Есенеева С.С. Получение антигена вируса классической чумы свиней //Вестник науки Казахского агротехнического университета им. С.Сейфуллина. - Астана, 2009. - №3 (54). - С.57-62.
8 Есенеева С.С., Абдрахманов С.К. Получение специфической сыворотки против классической чумы свиней //Вестник Семипалатинского государственного университета им. Шакарима. - Семей, 2009. - С.135-137.
9 Инновационный патент РК №62950. Способ получения антигена вируса классической чумы свиней /Абдрахманов С.К., Есенеева С.С., Асауова Ж.С.; опубл. 15.01.2010, Бюл. №1.- 3 с.
ЕСЕНЕЕВА САЛТАНАТ СОВЕТЫЗЫ
Шошаларды классикалы обасын диагностикалау шін тест-жйе компоненттерін алу технологиясы
Ветеринария ылымдарыны кандидаты дрежесін іздену диссертациясы
16.00.03 – мал дрігерлік микробиология, вирусология, эпизоотология, микология микотоксикологиямен бірге жне иммунология.
ТЙІН
Зерттеу нысаны: Жмысты орындау барысында Pestis suum “КТ” вакциналы штамыны р трлі схема бойынша алынан белокты антигендері, зертханалы а тышандар мен 7-8 апталы жастаы BALB/c тышандары, «Шиншила» тымы ояндары жне 6-8 айлы шошалар пайдаланды.
Жмысты масаты. Шошаларды классикалы обасын диагностикалау шін тест-жйе компоненттерін алу технологиясы.
Зерттеу дістері. Жмыс барысында шошаларды классикалы обасы вирусыны лапинизирленген «КТ» вакциналы штаммын сау ояндарды кк тамырына егіп жтыру арылы органды-лпалы вирусы бар материалын алу шін пайдаланылды. Антиген зірлеу шін вирусы бар материалды тазарту жне концентрациялау жобасызыы олданылды, бл тсіл кезінде материал ультрацентрифугерленді, 6000 полиэтиленглюкольмен тндырылып, 20-60 пайыз сахароза абаты арылы градиентті центрифугирленді.
Зерттеуге алынан лгілерді электрофорезі J. Laemmli et al. /1970/. Будандастыруа Х63 – Ag 8.653 миелома жасушалары мен шошаларды классикалы обасы вирусы антигенімен иммунделген BALB/c тышандарыны спленоциттері пайдаланылды. Х63 – Ag 8.653 миелома жасушалары мен иммунды спленоциттерін будандастыру жмыстары V.Oi, L. Herzenberg (1980) дісі бойынша іске асырылды. Гибридті жасушалар сінділерін клондау J. Coding et. al. дісімен лимитті сйылту арылы орындалды. Алынан моноклоналды антиденелерді класы мен класс тармаын O. Ouchterlony (1958) тсілі бойынша иммунды диффузиялы реакциясымен анытады.
Зерттеу нтижелері: «КТ» вакциналы штаммынан шоша классикалы обасы органды-лпалы вирус антигенін алу технологиясы растырылды, салмаы 2,5-3,0 кг шиншила тымы ояндарына штаммды скінділеу егетіні арылы, белсенділігі 4,5±0,07 lg ИД 50/см вирусы бар материал алу, оны 35000 ай/мин 2 саат бойы жне 25000 ай/мин 4 саат бойы 20- 40% сахароза абаттан стаан со ультрацентрифугациялап жасушалы детриттен тазарту. Тазартылан антигендерді электрофорездік талдауы молекулалы салмаы 116кД, 66 кД, 41 кДа, 44 кД ауыздары бар екенін крсетті.
Шошалара арасына 7 тулік салып жоарылайтын млшерде антигенді екі мрте тері астына жне кк тамырына егіп вируса зіндік сипаты бар сарысу алу сызбансасы растырылды.
Шоша классикалы обасы Е2 вирусыны рылымды полипептидті антигендік детерминанттарына телімді, траты трде моноклонды антиденелер ндіретін 8 гибридома клондары алынды.
Асцидті сйыты тріндегі 3Е9F2 клоныны моноклонды антиденелері тура емес ИФТ 1:25600 ден 1:102400 дейінгі белсенділікке ие жне классикалы шоша обасы вирусы антигендерімен, сонымен атар 1:100 титрде ірі ара мал диареясы вирусымен реакцияа тседі.
Моноклонды антиденелерін пайдалану негізінде «сэндвич» дісімен иммуноферменттік талдау нсамасында шоша классикалы обасы вирусын диагностикалау шін тест-жйесін руды технологиялы негізі жасалынды. Оны диагностикалы ндылыы мен телімділігі серологиялы зерттеулер арылы длелденді.
Аталан тест-жйесін экономикалы тиімділігін баамдау бойынша алдын ала ткізілген есептеулер оны осыан дейінгі дістерге араанда 2-есе тиімді екендігін крсетеді.
олдану аумаы. Ветеринария саласы.
ESENEEVA SALTANAT SOVETOVNA
Development component of test system for diagnostic of>
The dissertation on competition of a scientific degree of the candidate
of veterinary sciences
16.00.03- veterinary microbiology, virology, epizootology, mycology with mycotoxicology and immunology
Summary
The research objects. Vaccinal lapinizirzed Shtamm of>
Rabbits with 2,5-3,0 kg weight, chinchilla breeds, large white breed pigs of 2-6 months age.
The aim of the work: The technology of components reception of test system for the>
Research methods
Vaccinal lapinizirzed Stamm «КТ» of>
For gamma globuline fractions allocation from animals specific serum kon spirit method was used.
Electrophoresis on vertical electrophoresis apparatus was conducted on J. Laemmli method (Hoefer Scientific, the USA).
Antigene electroforetical carryiage from gel on a nitrocellulose membrane (Schleicher and Schuller, Germany) was carried out by the means of immunobloting device on Н. Towbin.
Myelomic cages lines Х63 – Ag 8.653 frozen in a special plastic ampoules with screwed up covers were used for hybridization (Nunc, Denmark).
Myeloma cages hybridization and splenozide immunes was made on L. Herzenberg method. Hybrid cultivated cages Cloning was made by limiting cultivation method on J. Coding.
Antibodies concentration in ascid liquids was defined by М.Bradford method. An indirect immunoferment analysis variant was used for testing.
Monoclonal antibodies constant linking was defermined on J. Beatty method. Monoclonal antibodies>
The research results
- The technology of>
- The scheme of virusspecific serum reception on pigs including double hypodermic and intravenous introduction of an antigene in increasing doses with an interval of 7 days is fulfilled.
3. 8 clones by a hybrid were received monoclonal antigene stably produced, specific to antigene determinants of>
4. Technological basis of test creation of>
Scope. Veterinary science
| Сдано в набор 20.04.2010 г. | Подписано в печать 20.04.2010 г. | |
| Формат 60х84 1\16 | Заказ № 8302 | |
| Усл.печ.л. 1,5 | Тираж 100 экз. |
© Издательство АО Казахского агротехнического университета им. С.Сейфуллина
010011, г. Астана, пр. Победы, 62а.

