Клиническое значение генетических и количественных показателей клеток опухоли при раке яичников - онкология
На правах рукописи
Паниченко Игорь Валерианович
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ И КОЛИЧЕСТВЕННЫХ ПОКАЗАТЕЛЕЙ
КЛЕТОК ОПУХОЛИ ПРИ РАКЕ ЯИЧНИКОВ
- - онкология
Автореферат диссертации
на соискание учёной степени
доктора медицинских наук
Москва-2006г.
Работа выполнена в ГУ Российский онкологический научный центр им Н.Н. Блохина РАМН
Научные консультанты:
доктор медицинских наук, профессор К.И. Жорданиа
доктор медицинских наук, профессор В.Н. Богатырёв
Официальные оппоненты:
доктор медицинских наук, профессор К.П. Лактионов
доктор медицинских наук О.В. Чулкова
доктор медицинских наук, профессор Н.А. Шапиро
Ведущая организация:
ФГУ «Российский Научный центр рентгенорадиологии» Росздрава.
Защита диссертации состоится «12 » апреля 2007 г. в 10 часов на заседании специализированного совета (Д.001.17.01) в ГУ Российский онкологический научный центр им. Н.Н. Блохина РАМН.
(115478, Москва, Каширское шоссе, 24). Тел. (495) 324 15 30.
С диссертацией можно ознакомиться в библиотеке ГУ РОНЦ им. Н.Н. Блохина РАМН
Автореферат разослан « 16 » января 2007 г.
Учёный секретарь Диссертационного Совета
доктор медицинских наук Ю.В. Шишкин
Актуальность темы
В структуре заболеваемости злокачественными новообразованиями у женщин в России в 2004 году рак яичников (РЯ) занимал 7 место (4,9%), под наблюдением находилось 72,5 тыс. больных. При этом годовая летальность составила 7400 больных (5,7% больных злокачественными новообразованиями), занимая пятое место по смертности среди всех злокачественных новообразований у женщин (Аксель Е.М., 2006). Бессимптомное течение заболевания на начальных этапах приводит к тому, что в 75-80% наблюдений рак яичников диагностируется в III-IV стадии болезни, когда отдалённые результаты лечения малоутешительны (Heintz A.P.M., 2001;Ozols R.F., 2005). В первую очередь именно неудовлетворительные отдалённые результаты лечения, сложность диагностики на ранних стадиях заболевания диктуют интерес исследователей к данной проблеме. С другой стороны, до настоящего времени нет цельного и научно обоснованного представления о патогенезе опухолей яичников, знание которого значительно приблизило бы нас и к решению проблемы ранней диагностики, и к возможности проведения патогенетической терапии.
Эффективность проводимого лечения во многом зависит от адекватной оценки клинических и морфологических параметров, имеющих прогностическое значение. Нельзя не отметить чрезвычайно важную роль адекватного интраоперационного стадирования, которое на практике проводится далеко не всегда. Вместе с тем, используемые в настоящее время традиционные клинико-морфологические факторы не позволяют реально оценить злокачественный потенциал конкретной опухоли. Известно, что даже в пределах одной стадии заболевания и морфологической формы опухоли прогноз может существенно варьировать. Появившиеся в последнее время методики позволяют объективно определять биологические параметры опухолей различной локализации. Какие из них наиболее предпочтительны для применения в широкой клинической практике? На основании каких из них можно прогнозировать эффект химиотерапии и, в зависимости от этого, своевременно корригировать план лечения? Как выделить группу больных с наиболее злокачественным и агрессивным течением заболевания?
В этой связи не случайными кажутся исследования, которые стали возможны благодаря внедрению метода лазерной ДНК-проточной цитофлуорометрии. Определяемое с его помощью содержание ДНК в клетках опухоли, её плоидность, соотношение клеток в различных фазах клеточного цикла, исключают субъективизм исследования и позволяют выявить особенности пролиферации и аномальное содержание ДНК в ядрах клеток (Винокуров В.Л., 2004; Randall M., 2005). В последнее время появились данные о применении метода лазерной ДНК-проточной цитофлуорометрии при раке молочной железы, почки, желудка, эндометрия и шейки матки, толстой кишки, во многих исследованиях подчёркивается прогностическая значимость данных показателей (Нечушкина В.М., 2002; Малиев Ф.М., 2005; Богатырёв В.Н., 2005; Хайленко В.А., 2005; Abou-Rebyeh H., 2001; Klorin G., 2003).
В настоящее время морфологическая диагностика некоторых форм пограничных опухолей яичников и их дифференциальная диагностика со злокачественными новообразованиями яичников вызывает затруднение, что влияет на выработку правильной лечебной тактики (Карселадзе А.И., 2000; Козаченко В.П., 2005; Rao G.G. et al., 2005). Вместе с тем по данным Ozols R.F. et al. (2005), пограничные опухоли составляют 12-15% всех новообразований яичников. Это определяет необходимость изучить достаточное количество материала для объективной характеристики клеток пограничных и злокачественных опухолей яичников с целью последующего использования банка количественных параметров в дифференциальной диагностике.
Определение геномных нарушений, детерминирующих развитие опухоли, степень её злокачественности, метастатический потенциал и скорость прогрессии, является приоритетной областью молекулярно-генетических исследований в современной онкологии. В настоящее время известно несколько классов генов, нарушения в которых приводят к злокачественной трансформации клетки. Решающая роль в этом процессе отводится протоонкогенам и генам-супрессорам (антионкогенам), являющимся нормальными клеточными генами с ключевыми функциями регуляции клеточного роста и дифференцировки. В норме некоторые протоонкогены стимулируют процессы, связанные с клеточным делением, а гены-супрессоры отвечают за его подавление. Суммарным эффектом активации онкогенов и инактивации генов-супрессоров является возрастающая пролиферативная активность клеток и нарушение их дифференцировки. Одним из возможных механизмов инактивации гена-супрессора является утрата хромосомного локуса (делеции). Считается, что делеции участков хромосом отражают инактивацию расположенных в них супрессорных генов, причём последние могут оставаться неидентифицированными (Хансон К.П., Имянитов Е.Н., 2000). Для определения делеций, изучения известных и выявления потенциальных генов-супрессоров опухолевого роста, в последние годы широко используется метод определения потери гетерозиготности (Loss of heterozigosity) с использованием микросателлитных маркеров для амплификации локусов, содержащих микросателлитные аллели. Определение делеций в хромосомных локусах опухоли может идентифицировать гены-супрессоры, участвующие в процессе канцерогенеза при раке яичников. Исследования делеций некоторых локусов при злокачественных опухолях яичников демонстрируют значительную вариабельность результатов, что диктует необходимость собственных исследований. Другим аспектом исследования является клиническая оценка найденных нарушений.
Одним из основных компонентов в регуляции системы апоптоза (программируемой гибели клетки) и клеточного цикла является ген-супрессор опухолевого роста р53. Однако, в результате приобретённых мутаций, продуцируется уже мутантная форма белка р53, которая не выполняет возложенных на неё функций и процесс деления опухолевых клеток приобретает неуправляемый характер (Райхлин Н.Т., 2006; Cloven N., 2004). Важно подчеркнуть, что мутации р53 могут быть как инициальным событием (синдром Ли-Фраумени) или детерминировать начальные этапы канцерогенеза, так и возникать уже в ходе роста опухоли, обеспечивая приобретение новых агрессивных свойств (Копнин Б.П., 2000). Наличие мутантного р53 определяется во многих злокачественных новообразованиях: при опухолях толстой кишки (60%), желудка (60%), молочной железы (20%), лёгких (70%) (Райхлин Н.Т., 2006; Soussi T., 2000). В злокачественных эпителиальных опухолях яичников экспрессия р53 достигает 80% при III-IV стадиях (Pieretti M. et al, 2002; Terada K. et al, 2004).
Появление производных платины и таксанов в арсенале лекарственных средств, используемых в химиотерапии больных раком яичников, позволило значительно улучшить непосредственные и отдалённые результаты лечения. Вместе с тем, около 20-25% опухолей являются платинорезистентными и требуют применения других схем лечения. Однако выделить заранее группу больных с такими опухолями в настоящее время практически невозможно. Вместе с тем имеются данные о том, что экспрессия р53 в опухолевой ткани может служить маркером резистентности рака яичников к адъювантной терапии препаратами платины, а также фактором прогноза выживаемости больных (Gadducci A. et al, 2002; Vasey P.A., 2003; Siddik Z.H., 2003). Таким образом, исследование роли мутантной формы р53 в опухоли является приоритетным при оценке клеточного апоптоза у больных раком яичником.
На основании вышеизложенного можно заключить, что комплексное исследование генетических и количественных параметров клеток опухоли, сопоставление их с клинико-морфологическими данными, изучение их прогностической значимости, является своевременным и актуальным.
Целью настоящего исследования явилось изучение клинико-морфологических особенностей эпителиальных новообразований яичников, количественных показателей клеток опухоли (плоидность, распределение их по фазам митотического цикла, наличие делеций в некоторых хромосомных локусах, экспрессия р53 мутантного типа) необходимых для оптимизации методов диагностики, лечения и прогнозирования течения рака яичников.
Для достижения указанной цели было необходимо решить следующие задачи:
- Определить плоидность, распределение клеток опухолей яичников по фазам клеточного цикла, индекс пролиферации злокачественных новообразований.
- Установить роль показателей лазерной ДНК-проточной цитофлуорометрии в дифференциальной диагностике доброкачественных, пограничных и злокачественных эпителиальных опухолей яичников.
- Оценить эффективность проводимой химиотерапии с учётом показателей плоидности, числа опухолевых клеток в различных фазах клеточного цикла, а также определить прогностическое значение данных лазерной ДНК-проточной цитофлуорометрии для больных раком яичников.
- Исследовать, с использованием микросателлитных маркеров, потерю гетерозиготности и микросателлитную нестабильность в зонах локализации некоторых известных и предполагаемых генов-супрессоров, ассоциированных с развитием и прогрессированием рака яичников (хромосомные локусы: 1p32-36, 7q31, 11p15, 17q12-21, 18q21-23). Сопоставить результаты молекулярно-генетического анализа с традиционными клиническими и морфологическими показателями злокачественных, пограничных и доброкачественных опухолей яичников; оценить прогностическое значение найденных изменений.
- Определить экспрессию молекулярно-биологического маркёра апоптоза р53 мутантного типа в злокачественных и пограничных опухолях яичников, сопоставить прогностическую значимость изученных показателей с традиционными клинико-морфологическими параметрами.
- Установить влияние экспрессии р53 мутантного типа на результаты химиотерапии и отдалённые результаты лечения больных раком яичников.
- Путём многофакторного анализа выявить наиболее значимые с прогностической точки зрения параметры, позволяющие индивидуально прогнозировать течение опухолевого процесса и планировать лечебные мероприятия у больных раком яичников.
НАУЧНАЯ НОВИЗНА
Впервые в нашей стране на большом клиническом материале выполнено комплексное изучение количественных параметров клеток опухоли у больных злокачественными и пограничными опухолями яичников. Изучение плоидности и индекса пролиферации опухолей (с использованием метода лазерной ДНК-проточной цитофлуорометрии), сопоставление полученных результатов с клинико-морфологическими параметрами позволило установить преобладание анеуплоидных новообразований у больных раком яичников и более агрессивное их течение по сравнению с диплоидными опухолями. Полный эффект проводимой химиотерапии производными платины достоверно чаще достигался в группе пациентов с диплоидными опухолями. Вместе с тем, эффективность химиотерапии у больных с анеуплоидным раком яичников выше при использовании комбинаций производных платины и таксанов. Среди больных пограничными опухолями яичников, у которых диагностирован рецидив заболевания, среднее количество опухолевых клеток, находящихся в синтетической фазе клеточного цикла, в 2 раза больше по сравнению с аналогичным показателем у больных, находящихся в ремиссии. Исследование уровня делеций в хромосомных локусах с использованием микросателлитных маркёров показало, что в локусах 11р15, 17q12-21 локализованы гены-супрессоры, участвующие в процессе канцерогенеза и прогрессии опухолей у больных серозным и муцинозным раком яичников. Уровень экспрессии р53-mut в опухолевых клетках коррелирует со стадией заболевания, индексом ДНК и степенью дифференцировки опухолей у больных раком яичников. В группе больных с р53-негативными опухолями полный эффект химиотерапии по схемам, включающим производные платины, отмечался достоверно чаще по сравнению с группой пациентов с р53-позитивными новообразованиями. Показатели общей и безрецидивной выживаемости больных раком яичников с наличием р53-mut в опухоли достоверно ниже по сравнению с аналогичными показателями у пациентов с р53-негативными новообразованиями.
Практическая значимость
Полученные данные позволили рекомендовать определение количественных показателей клеток опухоли с использованием метода лазерной ДНК-проточной цитофлуорометрии в качестве дополнительного метода для проведения дифференциальной диагностики между пограничными и злокачественными эпителиальными опухолями яичников в затруднительных случаях, а также выделить группу больных с пограничными опухолями яичников с высоким риском развития рецидива заболевания, требующих тщательного мониторинга. Анеуплоидный тип опухоли у больных III-IV стадии заболевания диктует необходимость проведения химиотерапии комбинациями, включающими производные Pt и таксаны. На основании всего комплекса полученных клинических и лабораторных данных разработана математическая модель, позволяющая индивидуально прогнозировать риск прогрессирования заболевания у больных раком яичников.
Внедрение в практику
Основные положения и результаты диссертационного исследования внедрены в практику обследования и лечения больных в ГУ РОНЦ им. Н.Н. Блохина РАМН.
Апробация работы. Диссертационная работа апробирована на совместной конференции с участием гинекологического отделения, хирургического отделения опухолей женской репродуктивной системы, отделения амбулаторных методов диагностики и лечения, отделения химиотерапии и комбинированного лечения злокачественных опухолей, отделения химиотерапии, отделения клинической фармакологии и химиотерапии, хирургического отделения диагностики опухолей, лаборатории клинической цитологии, патолого-анатомического отделения НИИ клинической онкологии и лаборатории регуляции клеточных и вирусных онкогенов НИИ канцерогенеза ГУ РОНЦ им. Н.Н. Блохина РАМН. Основные положения диссертации представлены на: IV съезде онкологов и радиологов стран СНГ (Баку, 2006 г.); VI Всероссийском съезде онкологов (Ростов-на-Дону, 2005 г.); XIV Европейском съезде онкогинекологов (Турция, Стамбул, 2005 г.); XXX Европейском конгрессе цитологов (Чехия, Прага, 2004 г.), III съезде онкологов стран СНГ, (Беларусь, Минск, 2004 г.); VI Всероссийской онкологической конференции (Москва, 2002 г.); V Всероссийском съезде клинических цитологов (Москва, 2003 г.).
Публикации. По материалам диссертации опубликованы 32 научные работы в отечественной и зарубежной печати.
Объём и структура диссертации. Работа изложена на 250 страницах машинописного текста, состоит из введения, обзора литературы, описания клинического материала и методов исследования, 5 глав собственных результатов исследований, заключения, выводов и указателя литературы. Диссертация содержит 97 таблиц и 39 рисунков. Список литературы представлен 51 отечественным и 209 иностранными источниками.
Основные положения, выносимые на защиту:
- Среди традиционных клинико-морфологических факторов прогноза при раке яичников наибольшее значение имеют стадия заболевания, размер остаточной опухоли после хирургического лечения, морфологический вариант опухоли и степень её дифференцировки, а также возраст больного.
- Определение плоидности и индекса пролиферации опухолей методом лазерной ДНК-проточной цитофлуорометрии позволяет выделить группу больных раком яичников с неблагоприятным прогнозом течения заболевания.
- Лазерная ДНК-проточная цитофлуорометрия может служить дополнительным методом в дифференциальной диагностике пограничных и злокачественных опухолей яичников.
- Эффективность химиотерапии при анеуплоидном раке яичников выше при использовании схем, включающих производные платины и таксаны.
- В локусах 11р15, 17q12-21 локализованы гены-супрессоры, участвующие в процессе канцерогенеза и прогрессии опухолей у больных серозным раком яичников.
- р53-статус опухоли позволяет прогнозировать эффективность химиотерапии производными платины у больных раком яичников.
- Количественные показатели клеток опухоли, позволяют объективно прогнозировать течение заболевания у больных РЯ.
- Математическая модель индивидуального прогнозирования течения заболевания у больных РЯ.
Общая клиническая характеристика больных и методы исследования
Диссертационная работа выполнена на базе гинекологического отделения (зав. отделением проф. В.В. Кузнецов); исследование количественных показателей клеток опухолей методом лазерной ДНК-проточной цитофлуорометрии и определение экспрессии р53 проводилось в лаборатории клинической цитологии (зав. проф. В.Н. Богатырёв) НИИ КО ГУ РОНЦ им. Н.Н. Блохина РАМН. Определение потери гетерозиготности хромосомных локусов в опухолях яичников проводилось в лаборатории регуляции клеточных и вирусных онкогенов (зав. к.м.н. И.Б. Зборовская) НИИ канцерогенеза ГУ РОНЦ им. Н.Н. Блохина РАМН.
Материалом для диссертационного исследования послужили данные о 351 больной раком яичников, 88 больных пограничными опухолями яичников и 18 больных с доброкачественными новообразованиями яичников, лечившихся в НИИ КО ГУ РОНЦ им. Н.Н. Блохина РАМН в 1988-2003 гг. В исследование вошли больные с морфологически (гистологически и цитологически) верифицированным диагнозом рака яичников и пограничных опухолей яичников. Все гистологические микропрепараты были пересмотрены в соответствии с принятой для данной локализации опухоли Международной гистологической классификацией (ВОЗ, 2003).
Статистический анализ выполняли с помощью стандартного пакета «Statistica» (версия 5,0, «Statsoft Inc.», США). Анализ кумулятивной выживаемости больных по методу Каплана–Мейера и сравнение достоверности различий проводили с помощью программы «Survival», предоставленной отделом статистики Онкологического центра М.Д. Андерсона (США). Достоверными считались различия с вероятностью не менее 95% (р<0,05). Определение коэффициентов веса и информативности изучаемых признаков производилось по формуле Шеннона с помощью программы «АСТА», разработанной в лаборатории медицинской кибернетики ГУ РОНЦ им. Н.Н. Блохина РАМН. Статистический анализ данных включал построение решающих правил по методу Байеса с использованием различных наборов признаков.
Диагностика рака яичников проводилась путём комплексного обследования больных, которое включало в себя: бимануальное ректовагинальное исследование, ультразвуковую томографию органов брюшной полости и забрюшинного пространства, определение уровня опухолево-ассоциирован-ного маркёра СА-125 в сыворотке крови, рентгенологическое исследование органов грудной клетки, толстой кишки, цитологическое и гистологическое исследование материала, при необходимости компьютерную томографию. Обследование и лечение, а также оценка результатов проводились в соответствии с принятыми методиками и программами, согласно стандартам ВОЗ.
Оценка прогностической значимости традиционных клинико-морфологических параметров выполнена у 351 больной РЯ. При этом I стадия заболевания диагностирована у 75 (21,4%) больных, II стадия – у 51 (14,5%) больной, III – у 175 (49,9%) и IV – у 50 (14,2%) пациенток.
Средний возраст больных составил 53,8±0,64 года (от 25 до 77 лет), пограничными опухолями яичников (ПОЯ) – 42,4±1,7 года (от 16 до 80 лет), доброкачественными опухолями яичников (ДОЯ) – 53,5±1,3 года. (от 26 до 68 лет).
На I этапе лечения всем больным РЯ выполняли хирургическое вмешательство различного объёма. Чаще всего, в 325 (92,5%) случаях, выполняли экстирпацию матки с придатками или надвлагалищную ампутацию матки с придатками и удаление большого сальника. Выполнение операции меньшего объёма, как правило, было связано с техническими трудностями при вовлечении полых органов в опухолевый конгломерат. Удаление придатков матки с обеих сторон и резекция большого сальника выполнена у 8 (2,2%) больных, односторонняя аднексэктомия и резекция большого сальника – у 10 (2,8%), только надвлагалищная ампутация матки с придатками – у 2 (0,6%) и эксплоративная лапаротомия – у 6 (1,7%) больных.
При морфологическом исследовании удалённых опухолей (n=351) оказалось, что серозная аденокарцинома присутствует в 236 (67,2%) наблюдениях, эндометриоидная – в 59 (16,8%), муцинозная – в 35 (9,9%) и светлоклеточная – в 21 (5,9%) наблюдении. Низкодифференцированные новообразования найдены у 137 (39,8%) больных, умереннодифференцированные – у 118 (33,6%) и высокодифференцированные – у 96 (27,3%) больных.
На втором этапе лечения химиотерапию проводили 348 больным. Схемы химиотерапии, используемые в лечении, были разделены на три группы. Самой многочисленной была группа больных, которым проводилось лечение по схемам, включающим производные платины – 260 (74%), вторую группу составили больные, которым проводилось лечение по схемам, включающим производные платины и таксаны – 46 (13,1%). Третьей группе больных (исторический контроль) проводилось лечение по схемам, не включающим производные платины – 42 (11,9%).
Количественные параметры клеток опухоли методом лазерной ДНК-проточной цитофлуорометрии определяли у 309 больных РЯ, 88 больных ПОЯ и 18 больных с ДОЯ. Материалом для исследования служил биоптат ткани, полученный при хирургическом вмешательстве. Исследования ДНК в клеточной популяции производили на лазерном проточном цитофлуорометре EPIСS-XL (Coulter, США), укомплектованном воздухоохлаждаемым аргоновым лазером с длинной волны возбуждения 488 nm. В каждом образце осуществляли сбор и анализ не менее 10000 клеток. В качестве диплоидного стандарта (контроля) использовали лимфоциты периферической крови доноров. Флуоресценцию измеряли от каждой клетки, сигналы преобразовывались и записывались в виде гистограмм на экране дисплея. Полученные данные анализировали современными специализированными компьютерными программами: «System IITM» (Version 3.0, Coulter, США), «MultiCycle» (Phoenix Flow Systems, США), используемыми для анализа плоидности и распределения клеток исследуемых образцов по фазам клеточного цикла.
Определение потери гетерозиготности (делеций) хромосомных локусов в опухолях яичников было выполнено у 80 больных. Для проведения молекулярно-генетического анализа использовали от одного до восьми образцов ДНК, полученных из различных участков опухоли каждой пациентки. В работе был применен метод выделения ДНК из парафиновых срезов, который позволяет отделить опухолевую ткань от фенотипически нормальных структур яичника и исследовать генетические изменения в участках опухоли, различных по степени дифференцировки или морфологии клеток. Генетическую нестабильность (потерю гетерозиготности) исследовали в зонах локализации некоторых известных и предполагаемых генов-супрессоров на пяти хромосомных локусах (1р32-36, 7q31.1-3, 11p15, 17q12-21, 18q21-23) с использованием 19 микросателлитных маркеров. Микросателлитные (СА)n повторы амплифицировали в ходе полимеразной цепной реакции (ПЦР) с использованием праймеров – уникальных последовательностей, фланкирующих (СА)n повторы. Продукты ПЦР разделяли в 6% денатурирующем полиакриламидном геле, переносили на нейлоновую мембрану и гибридизовали с радиоактивно-меченым зондом, представляющим собой одноцепочный олигонуклеотид (СА)12. После отмывки блоты экспонировали с рентгеновской пленкой.
Делецию определяли по отсутствию или снижению более чем на 50% интенсивности авторадиографического сигнала, соответствующего одному из аллелей в опухолевой ДНК по отношению к данному аллелю в ДНК из нормальной ткани. Потерю гетерозиготности по каждому из использованных маркёров учитывали при наличии делеции хотя бы в одном из исследованных участков опухоли.
Оценку экспрессии мутантного р53 в опухолях яичников осуществляли иммуноцитохимически (метод определения экспрессии молекулярно-биологических маркёров на цитологических препаратах). Для выявления внутриклеточного белка р53 использовали мышиные моноклональные антитела (МКА) DO-7 («DAKO», Дания), распознающие эпитоп, локализованный на N-конце белка между 19 и 26 аминокислотой. Для визуализации иммунологической реакции применяли систему LSAB-Detection System (Dako Corp, Дания) согласно инструкции.
Результаты исследования
В ходе проведённого исследования мы оценили значение традиционных клинико-морфологических факторов прогноза у больных раком яичников. Вне всякого сомнения, что стадия заболевания является тем основополагающим фактором, на основании которого вырабатывается план как диагностических, так и лечебных мероприятий. Однако этот показатель обладает ещё и прогностической значимостью. В нашем исследовании показатель общей 5-летней выживаемости составил у больных с I стадией 73,5±6,9%, со II – 54,4±9,8%, c III – 24,3±3,8% и с IV – 13,7±3,2%, (p<0,05). Показатели пятилетней безрецидивной выживаемости составили соответственно 71,7±7,1%, 52,3±9,7%, 20,0±4,0% и 7,6±4,1%, (p<0,05).
При оценке прогностической значимости возраста на отдалённые результаты лечения были получены следующие данные. При I стадии заболевания, когда в большинстве случаев имеется возможность выполнить радикальное хирургическое вмешательство независимо от возраста пациента, прогностическая значимость этого фактора не так велика, как при распространённых стадиях болезни. В нашем исследовании не выявлено достоверных различий в общей и безрецидивной выживаемости больных РЯ I и II стадией заболевания во всех возрастных группах пациентов. В тоже время, при III-IV стадиях болезни хирургу для выполнения оптимальной циторедуктивной операции приходится выполнять комбинированные или расширенные хирургические вмешательства, и именно в таких случаях выраженная экстрагенитальная патология у пациентов пожилого и старческого возраста может служить противопоказанием для выполнения запланированного объёма вмешательства. С другой стороны, наличие остаточных опухолевых образований больших размеров диктует проведение большего числа курсов химиотерапии по сравнению с таковым при I и II стадиях болезни, когда, как правило, макроскопически опухолевые образования в брюшной полости не определяются. Всё вышеперечисленное может стать частичным объяснением того факта, что в нашем исследовании были получены достоверные различия в выживаемости больных молодого (до 45 лет) и пожилого возрастов (от 60 лет и старше) при III стадии РЯ. Показатели общей выживаемости в данных группах составили соответственно 43,7±10,1% и 14,1±5,5%, (р<0,05). Аналогичные результаты были получены и для больных с IV стадией болезни. Показатель общей 5-летней выживаемости в группе больных до 60 лет составил 21,8±6,1%, в то время как в группе пациентов от 60 лет и старше – только 5,5±3,2%, (р<0,05). Таким образом, возраст является прогностическим фактором при распространённых стадиях болезни.
При оценке размера остаточной опухоли выяснилось, что всем больным с I стадией заболевания удалось выполнить условно радикальную операцию (без остаточной опухоли). Однако при более поздних стадиях количество субоптимальных и неоптимальных хирургических вмешательств резко увеличивается. Например, при III стадии оптимальное циторедуктивное вмешательство выполнено у 9,1% пациенток, субоптимальная циторедуктивная операция – у 25,1%, неоптимальная циторедуктивная операция – у 65,7%. Полученные результаты убедительно демонстрируют, что количество неоптимальных циторедуктивных вмешательств достоверно увеличивается при распространённых стадиях заболевания (табл. 1), что зачастую требует проведения неоадъювантной химиотерапии.
Таблица 1
Радикальность выполненных хирургических вмешательств
у больных РЯ с учётом стадии заболевания
| Стадия | Размер остаточной опухоли | ||
| нет | < 2 см | > 2 см | |
| I (n=75) | 75 (100%) | - | - |
| II (n=51) | 33 (64,7%) | 15 (29,4%) | 3 (5,9%) |
| III (n=175) | 16 (9,1%)* | 44 (25,1%) | 115 (65,7%)* |
| IV (n=50) | 2 (4,0%)* | 18 (30%) | 30 (60%)* |
n – число наблюдений; * – различия статистически достоверны при сравнении с аналогичными показателями у больных I и II стадиями, (p<0,05).
Прогностическая значимость размера остаточной опухоли проиллюстрирована на примере больных с III стадией заболевания. К пяти годам наблюдения медиана общей выживаемости в группе больных без остаточной опухоли в брюшной полости (n=16) составила 46,5±5,3 мес., что превышает аналогичные показатели в группах больных с остаточной опухолью до 2 см (n=44) и более 2 см (n=115) – 38,2±1,4 мес. и 29,9±1,3 мес., (р<0,05). Медианы безрецидивной выживаемости составили соответственно 38,8±2,1 мес., 21,7±3,7 мес. и 15,6±0,7 мес., (р<0,05). Таким образом, размер остаточной опухоли имеет важное прогностическое значение – показатели выживаемости значительно выше у больных без визуальных проявлений опухоли после хирургического вмешательства.
Морфологическая структура опухоли также является важным прогностическим фактором. Среди больных с I стадией наибольшая 5-летняя выживаемость отмечена у пациентов с муцинозными аденокарциномами (n=18) – 90,5±6,6%, в группе больных с эндометриоидными опухолями (n=19) этот показатель составил 88,2±6,1%, а в группе пациентов с серозными аденокарциномами (n=33) – 62,1±7,4%, (р<0,05). Следует отметить, что все пациенты со светлоклеточными аденокарциномами (n=5) умерли от прогрессирования основного заболевания к четырём годам наблюдения. Аналогичные данные получены и при оценке безрецидивной выживаемости. Таким образом, на основании полученных результатов можно говорить об относительно благоприятном течении заболевания у больных РЯ с эндометриоидным или муцинозным вариантом опухоли по сравнению с серозным или светлоклеточным типом.
Степень дифференцировки опухоли также является важным прогностическим фактором. Выживаемость больных с низкодифференцированными аденокарциномами была достоверно ниже по сравнению с аналогичным показателем у больных с высокодифференцированными новообразованиями при всех стадиях, кроме IV. Например, при I стадии заболевания 5-летняя выживаемость больных с высокодифференцированными опухолями составила 84,1±4,5%, с низкодифференцированными – 68,2±8,5%, (p<0,05).
На II этапе лечения всем больным РЯ проводили адъювантную или индукционную химиотерапию. Мы сознательно включили в наше исследование группу больных, которым проводилось лечение по схемам, не включающим препараты Pt, в качестве исторического контроля. Следует подчеркнуть, что полный эффект от проводимого лечения при III-IV стадии заболевания достоверно чаще наблюдался в группе больных, которым проводилось лечение по схемам, включающим производные Pt и таксаны (табл. 2).
Вместе с тем, прогрессирование заболевания достоверно чаще отмечалось в группе больных, которым проводили лечение по схемам, не включающим производные платины. Отдалённые результаты лечения больных РЯ III стадии заболевания с учётом схемы лечения представлены в табл. 3.
Таблица 2
Эффективность проводимого лечения у больных РЯ III стадии
с учётом схемы химиотерапии
| Схема | Эффект химиотерапии | |||
| полный | частичный | стабилизация | прогрессирование | |
| Pt + таксаны (n=32) | 24 (75%)* | 5 (15,7%) | - | 3 (9,4%)* |
| С Pt (n=130) | 74 (56,9%) | 15 (11,5%) | 6 (4,6%) | 35 (26,9%) |
| Без Pt (n=13) | 3 (23,1%) | 2 (15,4%) | 1 (7,6%) | 7 (53,8%) |
| Всего (n=175) | 101 (57,7%) | 2 (3,9%) | 2 (3,9%) | 7 (13,7%) |
n – число наблюдений; * - различия статистически достоверны по сравнению с аналогичными показателями в остальных группах, р<0,05.
Таблица 3
Выживаемость больных РЯ III стадии с учётом
схемы химиотерапии I линии
| Схема | Выживаемость | |||
| общая | безрецидивная | |||
| 5-летняя, % | медиана, мес. | 5-летняя, % | медиана, мес. | |
| Pt + таксаны (n=32) | 35,8±10,1 | 36,9±4,2 | 31,6±8,4 | 21,6±2,7 |
| С Pt (n=130) | 25±4,2 | 34,7±2,9 | 22,3±4,2 | 17,9±1,1 |
| Без Pt (n=13) | - | 18,9±3,7 * | - | 11,3±2,3 * |
n – число наблюдений; * - различия статистически достоверны по сравнению с аналогичными показателями во всех остальных группах, р<0,05
В заключение этого раздела следует отметить, что успех лечения больных раком яичников во многом зависит от клинических, макро- и микро-морфологических характеристик опухоли, однако учёт только этих факторов не позволяет индивидуально подойти к каждому больному в выборе тактики лечения. Существенные вариации прогноза в рамках одного и того же гистологического вида, степени дифференцировки, неоднозначная трактовка различными авторами полученных данных делают необходимым поиск более адекватных объективных критериев.
На 2-м этапе исследования проведено определение плоидности и анализ клеточного цикла у 415 больных различными новообразованиями яичников методом лазерной ДНК-проточной цитофлуорометрии. При этом обнаружено, что количество анеуплоидных опухолей при РЯ достоверно больше, чем при ПОЯ и ДОЯ (рис. 1).
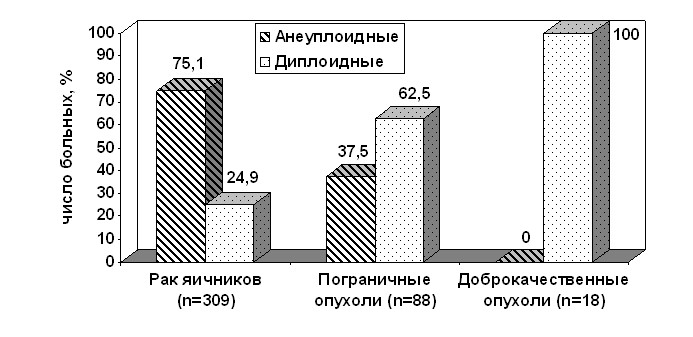
Рис.1. Соотношение диплоидных и анеуплоидных опухолей у больных
с новообразованиями яичников
Из 232 больных РЯ с анеуплоидными новообразованиями у 53 (22,8%) в опухолях отмечена анеуплоидия с потерей хромосом (ИДНК<1.0), у 146 (62,7%) – анеуплоидия в пределах митотического цикла (ИДНК=1.1-1.9), у 8 (3,4%) – тетраплоидные опухоли (ИДНК=2,0), у 7 (3,0%) – гиперанеуплоидные опухоли (ИДНК>2,1), у 18 (7,7%) – многоклоновые опухоли. У больных ПОЯ чаще всего имела место анеуплоидия в пределах митотического цикла – 63,6%, в отличие от злокачественных опухолей тетраплоидные и гиперанеуплоидные новообразования не определялись вовсе.
Проведённый сравнительный анализ количества опухолевых клеток в различных фазах клеточного цикла в новообразованиях яичников показал, что имеются достоверные различия практически по всем изученным параметрам, включая индекс пролиферации опухоли, между злокачественными, пограничными и доброкачественными новообразованиями, что является логичным подтверждением злокачественного потенциала РЯ (табл. 4).
Характеризуя клеточный цикл пограничных опухолей, можно отметить, что среднее количество клеток по всем фазам цикла достоверно отличается в сравнении с аналогичными показателями в злокачественных опухолях. Меньшее количество клеток опухолей, находящихся в синтетической фазе клеточного цикла, а также меньший индекс пролиферации только лишний раз подтверждают правильное название ПОЯ, которое в англоязычной литературе звучит как «low malignant potential tumors», что можно перевести как опухоли с низкой степенью злокачественности. Вместе с тем даже эта группа ПОЯ неоднородна по своему клеточному составу. Проведённый анализ распределения клеточного цикла показал, что при сравнении аналогичных показателей в диплоидных и анеуплоидных опухолях имеются достоверные различия (табл. 5).
Таблица 4
Распределение клеток злокачественных, пограничных и доброкачественных опухолей яичников по фазам клеточного цикла
| Вид опухоли | Фазы клеточного цикла | Индекс пролиферации (S+G2+M) (%) | ||
| G0/1 (%) | S (%) | G2+M (%) | ||
| Рак яичников (n=309) | 81,2±0,4* | 9,7±0,2* | 9,2±0,3* | 18,9±0,4* |
| Пограничные опухоли (n=88) | 87,7±0,8 | 6,1±0,3 | 6,3±0,6 | 12,4±0,8 |
| Доброкачественные опухоли (n=18) | 88,9±2,5 | 6,0±1,6 | 5,1±2,5 | 11,1±2,5 |
n – количество наблюдений; * - различия статистически достоверны по сравнению с группой пограничных и доброкачественных опухолей, p<0,05.
Таблица 5
Распределение клеточного цикла опухолей у больных ПОЯ
с учётом плоидности
| Плоидность опухолей | Фазы клеточного цикла | Индекс | ||
| G0/1 (%) | S (%) | G2+M (%) | пролиферации (S+G2+M) (%) | |
| Анеуплоидные (n=32) | 83,9±1,9* | 7,6±0,7* | 8,5±1,4 | 16,1±0,8* |
| Диплоидные (n=56) | 89,8±0,7 | 5,2±0,3 | 5,0±0,4 | 10,2±0,6 |
n – количество наблюдений; * - различия статистически достоверны по сравнению с группой больных с диплоидными опухолями, p<0,05.
Учитывая, что дифференциальная диагностика злокачественных и пограничных опухолей яичников достаточно сложна, мы сравнили полученные данные распределения клеточного цикла отдельно при анеуплоидных и диплоидных новообразованиях (табл. 6).
Таблица 6
Распределение клеточного цикла опухоли
у больных РЯ и ПОЯ с учётом плоидности
| Тип опухоли | Фазы клеточного цикла | Индекс пролиферации S+G2+M) (%) | ||
| G0/1 (%) | S (%) | G2+M (%) | ||
| Диплоидный РЯ (n=77) | 85,8±0,6* | 7,8±0,4* | 6,4±0,3 | 14,2±0,6* |
| Диплоидные ПОЯ (n=56) | 89,8±0,6 | 5,2±0,3 | 5,0±0,4 | 10,2±0,5 |
| Анеуплоидный РЯ (n=232) | 79,6±0,5* | 10,4±0,3* | 10,0±0,4 | 20,4±0,5* |
| Анеуплоидные ПОЯ (n=32) | 83,9±0,6 | 7,6±0,7 | 8,5±1,4 | 16,1±1,5 |
n – количество наблюдений; * - различия статистически достоверны при сравнении с аналогичными показателями, р<0,05.
Как видно из приведённых данных, диплоидные опухоли при РЯ и ПОЯ достоверно отличаются между собой по содержанию клеток в фазе покоя и синтетической фазе клеточного цикла, и, что особенно важно для клинициста, индекс пролиферации достоверно больше при РЯ (14,2±0,6% и 10,2±0,5%, соответственно). Аналогичные результаты получены и при сравнении анеуплоидных опухолей между собой – пролиферативная активность при анеуплоидном раке в среднем составила 20,4±0,5%, при анеуплоидных ПОЯ – 16,1±1,5%, (р<0,05). Исходя из этого, определение плоидности опухоли и количества клеток в различных фазах клеточного цикла может быть использовано в качестве дополнительного критерия для дифференциальной диагностики ПОЯ и РЯ, что имеет большое значение для выработки оптимальной лечебной тактики и определения прогноза заболевания.
Проведённый в последующем анализ не выявил достоверной связи плоидности и распределения клеточного цикла опухолей у больных ПОЯ с традиционными клинико-морфологическими показателями (возраст, стадия заболевания и размер остаточной опухоли).
Анализ отдалённых результатов лечения больных ПОЯ продемонстрировал, что у больных с анеуплоидными опухолями (n=32) рецидивы заболевания отмечались несколько чаще, нежели у больных с диплоидными новообразованиями (n=56) – 12,2% и 3,7%, соответственно, (р>0,05). У больных с анеуплоидными новообразованиями, у которых впоследствии диагностированы рецидивы заболевания, имело место большее количество клеток в синтетической фазе клеточного цикла по сравнению с аналогичным показателем у больных в ремиссии, (12,2±1,2% и 6,1±0,7% соответственно, р<0,05). Полученные результаты позволяют выделить группу больных ПОЯ с неблагоприятным прогнозом, нуждающихся в тщательном мониторинге.
Сравнительный анализ количественных параметров клеток злокачественных опухолей яичников в зависимости от традиционных клинико-морфологических факторов позволил выявить следующие закономерности. Не получено достоверных различий в плоидности и количестве клеток в различных фазах клеточного цикла опухолей в зависимости от возраста больных. Закономерным является вопрос: имеется ли зависимость между стадией заболевания и плоидностью опухоли у больных РЯ? Полученные результаты позволяют сделать следующее заключение – с увеличением стадии количество диплоидных новообразований уменьшается (табл. 7).
Таблица 7
Распределение больных раком яичников по стадиям заболевания
с учётом плоидности опухоли
| Плоидность | Стадия | |||
| I (n=50) | II (n=34) | III (n=175) | IV (n=50) | |
| Анеуплоидные | 29 (58,0%) | 22 (64,7%) | 137 (78,3%)** | 44 (88,0%)* |
| Диплоидные | 21 (42,0%) | 12 (35,3%) | 38 (21,7%)** | 6 (12,0%)* |
n – количество наблюдений; * - различия статистически достоверны при сравнении IV с I и II стадиями, р<0,05; **- различия статистически достоверны при сравнении III и I стадий, p<0,05.
Исследование было продолжено в группах больных с ранними (n=84) и распространёнными стадиями (n=225). Отмечена чёткая корреляция: количество анеуплоидных опухолей достоверно больше при III-IV стадиях болезни – 181 (80,4%), чем при I-II – 51 (60,7%), (p=0,0001). В свою очередь количество диплоидных новообразований отмечалось больше при I-II стадиях – 33 (39,3%), чем при III-IV – 44 (19,6%), (р=0,001). Количество клеток в синтетической фазе клеточного цикла опухоли при I стадии РЯ (n=50) составило 7,0±0,6%, при IV (n=50) – 10,3±0,5%, (р<0,05). Индекс пролиферации опухолей при I стадии РЯ составил 15,4±1,1%, при IV – 19,7±1,0%, (р<0,05).
Анализ плоидности опухоли с учётом морфологического варианта злокачественных новообразований показал, что диплоидные опухоли чаще встречаются среди муцинозных аденокарцином (39,3%) и реже всего – среди светлоклеточных опухолей (5,2%), (р<0,05). Индекс пролиферации муцинозных опухолей (n=28) составил 14,3±0,9%, что достоверно меньше, чем у больных с остальными морфологическими вариантами опухолей. При этом наибольший индекс пролиферации отмечен у больных со светлоклеточными опухолями (n=19) – 19,1±2,0%.
Анализ количественных параметров клеток опухолей у больных РЯ с учётом степени дифференцировки новообразований показал, что среди низкодифференцированных аденокарцином (n=131) количество анеуплоидных опухолей (84,0%) достоверно больше, чем среди высокодифференцированных опухолей (n=76) – 63,2%, (р<0,05). Индекс пролиферации низкодифференцированных диплоидных аденокарцином (n=28) равен 16,4±1,3%, что превышает аналогичный показатель в высокодифференцированных диплоидных опухолях (n=21) – 10,8±1,1%, (р<0,05).
Нами проведено сопоставление полученных при помощи лазерной ДНК-проточной цитофлуорометрии показателей с результатами лечения больных РЯ. В группе больных, которым на II этапе лечения проводили химиотерапиию по схемам, включавшим производные платины (n=225), у 170 пациенток диагностированы анеуплоидные опухоли, а у 55 – диплоидные. В группе больных с анеуплоидными новообразованиями полный эффект от проводимого лечения достигнут в 97 (57,0%) случаях, а в группе больных с диплоидными опухолями – у 46 (83,6%) пациенток (р<0,05). Вместе с тем прогрессирование основного заболевания на фоне лечения достоверно чаще отмечалось у больных с анеуплоидными опухолями – 25,9%, (табл. 8).
Таблица 8
Эффективность химиотерапии производными Pt у больных РЯ
с учётом плоидности опухолей
| Тип опухоли | Эффект лечения | |||
| полный | частичный | стабилизация | прогресси-рование | |
| Анеуплоидный (n=170) | 97 (57%)* | 17 (10%) | 12 (7,1%) | 44 (25,9%)* |
| Диплоидный (n=55) | 46 (83,6%) | 5 (8,8%) | - | 4 (7,3%) |
n – количество наблюдений; * – различия статистически достоверны по сравнению с аналогичными показателями в группе больных с анеуплоидными опухолями, p=0,001.
При оценке общего (сумма полного и частичного) эффекта химиотерапии выявлено, что в группе больных с диплоидными опухолями данный показатель составил 92,4%, а в группе с анеуплоидными новообразованиями – 67% (p<0,05). Таким образом, общий эффект химиотерапии с включением производных платины связан с показателем плоидности опухоли.
Так как группа больных РЯ с анеуплоидными опухолями являлась самой многочисленной в нашем исследовании (75,1%), можно было оценить эффективность различных схем химиотерапии (табл. 9).
Таблица 9
Эффективность схем химиотерапии в группе больных РЯ III-IV стадии
с анеуплоидными опухолями
| Схема лечения | Эффект лечения | |||
| полный | частичный | стабилизация | прогрессирование | |
| Pt + таксаны (n=18) | 13 (72,2%)* | 5 (27,8%) | - | - |
| С Pt (n=72) | 31 (43,1%) | 10 (13,9%) | - | 27 (37,5%) |
| Без Pt (n=6) | 1 (16,7%) | - | 1 (16,7%) | 4 (66,7%) |
n –число наблюдений; * - различия достоверны по сравнению с аналогичными показателями в остальных группах больных, (р<0,05).
Из представленных данных видно, что полный эффект от проводимого лечения достоверно чаще отмечен в группе больных, которым проводилось лечение по схемам, включавшим производные платины и таксаны – 72,5%. Аналогичный показатель в группе больных, получавших лечение по схемам, включающим производные платины, но без таксанов, составил 43,1%, а в группе пациентов, получавших лечение без производных платины – только 16,7%. Кроме того оказалось, что средняя продолжительность безрецидивного периода в первой группе больных равнялась 15,6±3,6 мес., что значительно превышает аналогичные показатели в остальных группах (8,7±1,2 мес. и 6,6±3,5 мес.), (р<0,05). На основании полученных результатов мы считаем, что для больных РЯ III-IV стадии и анеуплоидными опухолями целесообразно проведение химиотерапии по схемам, включающим производные платины и таксаны.
При оценке отдалённых результатов лечения больных РЯ с учётом плоидности опухоли получены достоверные различия выживаемости в пределах каждой клинической стадии (табл. 10).
Таблица 10
Общая 5-летняя выживаемость больных РЯ в зависимости от
плоидности опухоли и стадии заболевания
| Рак яичников | Стадия | |||
| I (n=50) | II (n=34) | III (n=175) | IV (n=50) | |
| Анеуплоидный (n=232) | 54,7±10,2%* | 33,1±11,9%* | 20,5±4,1%* | 12,8±5,8%* |
| Диплоидный (n=77) | 100% | 88,9±10,4% | 42,1±11,8% | 24,3±5,2% |
n – количество наблюдений; * – различия статистически достоверны по сравнению с аналогичными показателями в группе больных с диплоидными опухолями, p<0,05.
Аналогичная зависимость отмечалась и при анализе безрецидивной выживаемости. Таким образом, наличие диплоидного набора хромосом в опухоли является благоприятным прогностическим фактором для больных РЯ.
Для изучения влияния количества опухолевых клеток в синтетической фазе клеточного цикла на отдалённые результаты лечения проведён анализ в группе диплоидных и анеуплоидных опухолей. Все пациенты с диплоидными новообразованиями (n=77) были разделены на две подгруппы: в I подгруппу вошли больные, у которых количество опухолевых клеток, находящихся в S-фазе было меньше или равно 10% (n=16), во II – пациенты, у которых этот показатель превышал 10% (n=61). Показатели общей 5-летней выживаемости составили соответственно 76,1±6,7% и 24,3±10,2% больных (p<0,05). Медиана выживаемости в I подгруппе не была достигнута к 5 годам наблюдения, в то время как во II подгруппе она составила 32,3±4,2 мес. (p<0,05). При оценке безрецидивной 5-летней выживаемости подтвердилась такая же закономерность: в I подгруппе без признаков прогрессирования болезни были живы 75,2±5,8% больных, во II – 22,1±11,3% (p<0,05). Медиана безрецидивной выживаемости в I подгруппе достигнута не была, во II она составила 16,1±6,7 мес. (p<0,05), (рис. 2).

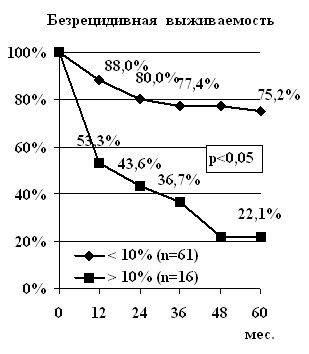
Рис. 2. Выживаемость больных РЯ с учётом количества клеток
в синтетической фазе клеточного цикла диплоидных опухолей
С учётом полученных достоверных различий, как в общей, так и в безрецидивной выживаемости, был проведён детальный анализ больных с III стадией заболевания. Первую подгруппу составили больные, у которых количество диплоидных опухолевых клеток в S-фазе было меньше или равно 10% (n=28), вторую – у которых этот показатель превышал 10% (n=10). Общая 5-летняя выживаемость в первой подгруппе составила 51,8±13,7% больных, во второй – к этому сроку все пациенты умерли от прогрессирования основного заболевания (p<0,05). При этом медиана выживаемости составила соответственно 85,2±1,9 мес. и 33,4±2,2 мес. (p<0,05). Безрецидивная выживаемость в первой подгруппе равнялась 50,8±13,6%, в то время как во второй подгруппе уже к окончанию четвёртого года наблюдения у всех больных отмечено прогрессирование болезни (p<0,05). При этом медиана безрецидивной выживаемости составила соответственно 80,6±1,5 мес. и 15,6±4,3 мес. (p<0,05). Данная зависимость подтвердилась и при анализе выживаемости больных с анеуплоидными опухолями. Таким образом, количество клеток в синтетической фазе клеточного цикла опухоли является важным прогностическим показателем: показатели общей и безрецидивной выживаемости больных РЯ выше в тех случаях, когда количество клеток в S-фазе не превышает 10%.
Анализ отдалённых результатов лечения больных РЯ с учётом количества клеток в премитотической и митотической фазах клеточного цикла не выявил достоверных различий выживаемости в зависимости от плоидности опухоли. Следовательно, данные показатели не имеют прогностического значения для больных РЯ.
На следующем этапе исследования изучено прогностическое значение индекса пролиферации опухоли для больных РЯ. Для этого все пациенты с анеуплоидным раком яичников были разделены на две подгруппы: в первую вошли больные, у которых индекс пролиферации опухолей был меньше или равен 16% (n=75), во вторую – те пациенты, у которых данный показатель превышал 16% (n=157). В первой подгруппе к 5 годам были живы 30,9±4,2% пациентов, что достоверно больше аналогичного показателя во второй подгруппе – 20,4±3,2%, (р<0,05). Достоверно отличались и медианы выживаемости – соответственно 42,1±2,9 мес. и 30,5±1,2 мес. (р<0,05). Безрецидивная 5-летняя выживаемость составила 28,2±5,1% и 14,5±3,7% пациентов соответственно (р<0,05). Достоверно отличались и медианы безрецидивной выживаемости – 12,4±0,8 мес. и 4,7±1,3 мес. (рис. 3). Для больных III стадии заболевания получены аналогичные различия (табл. 11).

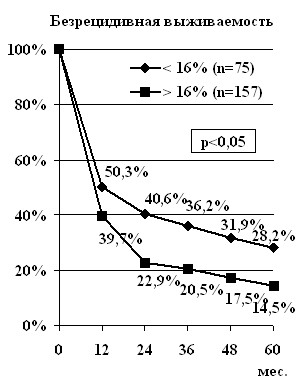
Рис. 3. Выживаемость больных РЯ с учётом индекса пролиферации анеуплоидных опухолей
Таблица 11
Показатели выживаемости больных РЯ III стадии в зависимости от индекса пролиферации анеуплоидных опухолей
| Количество клеток | 5-летняя выживаемость, % | |
| общая | безрецидивная | |
| 16% (n=41) | 26,9±4,2* | 26,5±8,2* |
| >16% (n=96) | 16,0±3,3 | 9,4±4,1 |
n – количество наблюдений; * – различия статистически достоверны при сравнении с аналогичными показателями, p<0,05.
Таким образом, индекс пролиферации опухоли, превышающий 16%, является неблагоприятным прогностическим фактором для больных РЯ.
Метод лазерной ДНК проточной цитофлуорометрии позволяет установить количественные изменения кариотипа опухоли, в тоже время определение микроделеций (потери гетерозиготности) в хромосомных локусах методом полимеразной цепной реакции с использованием микросателлитных маркёров может помочь определить места локализации генов-супрессоров, участвующих в процессе канцерогенеза. Ни в одном из исследуемых локусов частота делеций в доброкачественных новообразованиях не превышала фоновую (35%). В пограничных опухолях частота делеций возрастает. В тоже время частота делеций в локусах 11р15 и 17q12-21 (зона локализации гена BRCA1) достоверно возрастает в злокачественных новообразованиях по сравнению с пограничными (примерно в 2 раза) (рис. 4).
 Рис. 4. Частота делеций в исследуемых локусах эпителиальных
Рис. 4. Частота делеций в исследуемых локусах эпителиальных
опухолей яичников
Полученные данные свидетельствуют о том, что гены-супрессоры, картированные в данных локусах, вероятнее всего, влияют на трансформацию доброкачественных и пограничных новообразований в злокачественные.
Во всех исследованных локусах, кроме 18q21-23, частота делеций в опухолях больных с распространёнными стадиями превышало таковую при ранних формах заболевания. Наибольшее количество потери гетерозиготности (90%) отмечено при III-IV стадиях РЯ в локусе 17q12-21 (рис. 5).
 Рис. 5. Частота делеций в исследованных локусах с учётом
Рис. 5. Частота делеций в исследованных локусах с учётом
стадии заболевания
Результаты молекулярно-генетического исследования каждого морфологического варианта опухолей яичников в исследованных локусах показали достоверные различия в частоте потери гетерозиготности только в локусе 17q12-21. В серозных доброкачественных опухолях яичников не было отмечено ни одного случая потери микросателлитных аллелей. Потерю гетерозиготности демонстрировали 25% пограничных серозных опухолей и 90% серозных аденокарцином яичников. Большое количество делеций в локусе 17q12-21 свидетельствует о том, что ген BRCA1 вовлечён в канцерогенез не только наследственных, но и спорадических форм РЯ.
При анализе общей и безрецидивной выживаемости больных РЯ III-IV стадии оказалось, что имеются достоверные различия между группами пациентов в опухоли которых определялись делеции в локусе 17q12-21 и без таковых (рис. 6). В целом, полученные данные о различии в частоте потери гетерозиготности в злокачественных новообразованиях яичников позволяют более полно охарактеризовать отдельные морфологические типы опухолей с молекулярно-генетической точки зрения, определить локусы, содержащие гены-супрессоры, участвующие в канцерогенезе РЯ, с клинической точки зрения – выделить группу пациентов с неблагоприятным прогнозом.
Общая выживаемость Безрецидивная выживаемость
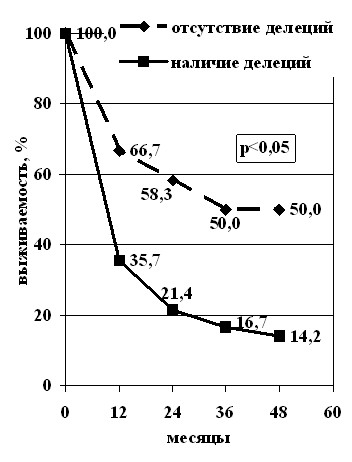

Рис. 6. Выживаемость больных РЯ III-IV стадии
в зависимости от наличия делеций в локусе 17q12-21
Определение экспрессии мутантной формы белка р53 в опухоли выполнено у 94 больных РЯ, из них в 73,4% случаев отмечалась положительная иммуноцитохимическая реакция (рис. 7). Изучение экспрессии р53-mut в опухолевых клетках у больных с пограничными новообразованиями яичников (n=26) показало, что только у 1 (3,8%) больной отмечалась позитивная иммуноцитохимическая реакция, при этом определялся низкий уровень экспрессии.
При анализе экспрессии р53-mut в злокачественных опухолях с учётом стадии заболевания оказалось, что у пациентов с I стадией р53-позитивные опухоли определялись достоверно реже, чем при других стадиях (рис. 8). Таким образом, с увеличением стадии заболевания экспрессия р53-mut в опухоли увеличивается.
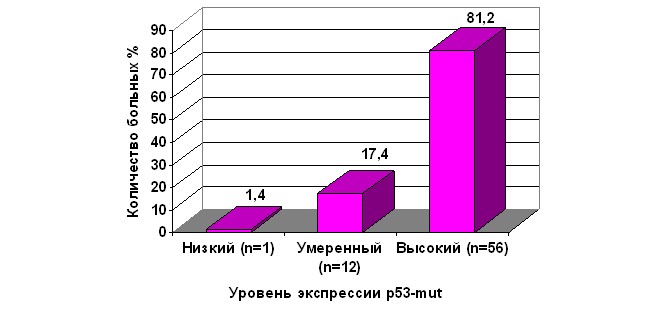
Рис. 7. Распределение больных РЯ с учётом уровня экспрессии р53-mut

Рис. 8. Экспрессия р53-mut в опухолях больных раком яичников с учётом стадии заболевания
Вместе с тем, не выявлено корреляции между экспрессией р53-mut и возрастом больных, а также размером остаточной опухоли после хирургического лечения.
Исследование экспрессии р53-mut в различных морфологических вариантах злокачественных эпителиальных опухолей яичников позволило выявить следующие закономерности. Во всех светлоклеточных аденокарциномах (100%) отмечалась экспрессия р53-mut, для серозных аденокарцином данный показатель составил 78,4%, для муцинозных – только в 50%, реже всего экспрессия р53 отмечалась в эндометриоидных опухолях – в 33,3% случаев. Достоверно отличалось и среднее количество клеток опухоли, экспрессирующих р53-mut (табл. 12).
Таблица 12
Экспрессия р53-mut в различных морфологических вариантах РЯ
| Морфологический вариант РЯ | Число р53-позитивных случаев | Среднее количество клеток, экспрессирующих р53-mut |
| Светлоклеточный (n=4) | 4 (100%)* | 70±2,8%** |
| Серозный (n=74) | 58 (78,4%)* | 50,1±3,4% |
| Муцинозный (n=4) | 2 (50%) | 27±15% |
| Эндометриоидный (n=12) | 4 (33,3%) | 19,9±9,1% |
* – различия статистически достоверны по сравнению с аналогичными показателями в группах больных с эндометриоидными и муцинозными опухолями, р<0,05; ** – различия достоверны по сравнению с аналогичными показателями в группах больных с серозными, эндометриоидными и муцинозными опухолями, р<0,05.
Таким образом, р53-позитивные опухоли чаще встречаются при серозном и светлоклеточном раке яичников.
При анализе экспрессии р53 с учётом степени дифференцировки опухолей получены следующие результаты. Среди низкодифференцированных новообразований (n=40) количество р53-позитивных опухолей более чем в два раза больше, чем среди высокодифференцированных аденокарцином (n=21), умереннодифференцированные опухоли (n=33) занимают по данному показателю как бы промежуточное положение (табл. 13). При этом и среднее количество клеток, экспрессирующих р53, достоверно отличалось в указанных группах.
Таблица 13
Экспрессия р53-mut у больных раком яичников с учётом
степени дифференцировки опухоли
| Степень дифференцировки | Число р53-позитивных случаев | Среднее количество клеток, экспрессирующих р53-mut |
| Низкая (n=40) | 37 (92,5%) | 56,2±3,2% |
| Умеренная (n=33) | 21 (63,6%) | 47,2±6,3% |
| Высокая (n=21) | 10 (47,6%)* | 28,0±7,2%* |
* – различия статистически достоверны при сравнении с аналогичными показателями в группах больных с умеренно- и низкодифференцированными опухолями, р<0,05.
Таким образом, проведённый сравнительный анализ экспрессии р53-mut с учётом наиболее важных клинико-морфологических факторов у больных РЯ позволил сделать следующее заключение. Во-первых, экспрессия мутантного р53 напрямую зависит от стадии заболевания. При III-IV стадиях экспрессия р53 достоверно выше по сравнению с I-II стадиями, помимо этого при распространённых стадиях чаще определяется высокий уровень экспрессии данного белка в опухолевых клетках. Во-вторых, уровень экспрессии р53 не связан с возрастом пациентов и размером остаточной опухоли после хирургического вмешательства. В-третьих, повышенный уровень экспрессии р53 коррелирует со светлоклеточным морфологическим вариантом опухоли, а также с низкой степенью дифференцировки аденокарцином.
С нашей точки зрения представлялось целесообразным изучить экспрессию р53-mut в зависимости от количественных показателей клеток опухолей, отражающих течение заболевания. У больных РЯ с диплоидными новообразованиями р53-позитивные случаи отмечались достоверно реже, чем у пациентов с анеуплоидными опухолями (33,4% и 85,7% соответственно), (р<0,05). Кроме того и среднее количество опухолевых клеток, экспрессирующих р53-mut, достоверно меньше в диплоидных опухолях (16,9±5,6% и 56,9±2,9%), (р<0,05). Достоверные различия получены и при сравнении уровней экспрессии в описываемых группах (табл. 14).
Таблица 14
Распределение больных раком яичников по уровню экспрессии р53-mut
с учётом индекса ДНК опухоли
| Вид опухоли | Уровень экспрессии р53-mut | |||
| p53(-) | низкий (+) | умеренный (++) | высокий (+++) | |
| Диплоидные (n=24) | 16 (66,6%)* | 1 (4,2%) | - | 7 (29,2%)* |
| Анеуплоидные (n=70) | 16 (14,3%) | - | 12 (17,1%) | 48 (68,6%) |
* - различия статистически достоверны при сравнении с аналогичными показателями в группе больных с анеуплоидными опухолями, р<0,05.
Как видно из представленных данных, р53-негативные опухоли достоверно чаще определялись в опухолях больных с диплоидными новообразованиями, в тоже время среди анеуплоидных аденокарцином достоверно чаще определялся высокий уровень экспрессии р53 (p<0,05).
Другим важным в прогностическом плане критерием для больных РЯ является индекс пролиферации опухоли. Разделив всех больных на две группы: 1-я – пациенты, у которых индекс пролиферации был менее или равен 16% (n=51), 2-я – у которых данный показатель превышал 16% (n=43), мы получили, что в 1-й группе пациентов р53-mut-позитивные случаи отмечались достоверно реже по сравнению со 2-й группой (48,8% и 90,6% соответственно), (p<0,05). Достоверно отличалось и среднее количество опухолевых клеток, экспрессирующих р53-mut: в I группе этот показатель составил 33,3±5,3%, во II – 57,1±3,2% (p<0,05), (табл. 15).
Таблица 15
Экспрессия р53-mut в опухолевых клетках у больных РЯ
с учётом индекса пролиферации опухоли
| Индекс пролиферации | Число р53-позитивных случаев | Среднее количество клеток, экспрессирующих р53-mut |
| < 16% (n=41) | 21 (51,2%)* | 33,3±5,3%* |
| > 16% (n=53) | 48 (90,6%) | 57,1±3,2% |
* – различия статистически достоверны по сравнению с аналогичными показателями, р<0,001.
Оценка эффекта химиотерапии I линии комбинациями с включением производных платины у больных РЯ показала, что в группе больных, опухоли которых экспрессировали р53-mut, полный эффект от проводимого лечения был достигнут только в 56,8% наблюдений, в то время как в группе больных, где опухоли не экспрессировали р53-mut полный эффект был достигнут в 91,7% случаев, (р<0,05). В тоже время прогрессирование болезни на фоне проводимого лечения отмечалось в 31,4% и 8,3% случаях больных I и II групп соответственно (р<0,05), (табл. 16).
Таблица 16
Эффективность химиотерапии I линии в группе больных РЯ,
получавших комбинации с производными Pt
| Экспрессия р53-mut | Эффект лечения | |||
| полный | частичный | стабилизация | прогрессиро-вание | |
| р53 (+) (n=51) | 29 (56,8%)* | 4 (7,8%) | 2 (3,9%) | 16 (31,4%)* |
| р53 (-) (n=24) | 22 (91,7%) | - | - | 2 (8,3%) |
* - различия статистически достоверны по сравнению с аналогичными показателями в группе больных с р53-негативными опухолями, p<0,05.
Таким образом, эффект проводимой химиотерапии у больных РЯ коррелирует с р53-статусом опухоли.
После оценки непосредственного эффекта 1-й линии химиотерапии, были проанализированы отдалённые результаты лечения данной группы больных. Среди пациентов с р53-негативными опухолями прогрессирование заболевания в дальнейшем отмечалось только у 3 (12,5%) больных, соответственно у 21 (87,5%) женщины сохранялась ремиссия заболевания. В тоже время среди больных с р53-позитивными опухолями прогрессирование заболевания диагностировано у 49 (96,1%) пациенток, в ремиссии находились только 2 (3,9%) больные. Полученные результаты свидетельствуют о том, что наличие мутантного р53 в опухоли у больных раком яичников является неблагоприятным прогностическим фактором и служит основанием тщательного мониторинга данного контингента больных.
Общая 5-летняя выживаемость пациенток с р53-позитивным РЯ ранних стадий (n=26) составила 17,8±6,4%, в то время как для больных с р53-негативными опухолями этот показатель составил 65,4±12,1% (p<0,05), (рис. 9).

Рис. 9. Общая выживаемость больных РЯ I-II стадии
в зависимости от р53-статуса опухоли
Столь же достоверные различия получены и при анализе выживаемости больных III-IV стадий заболевания. Общая 5-летняя выживаемость больных в группе с р53-mut(+) опухолями составила 8,5±6,3%, при этом медиана выживаемости в данной группе равна 34,5±2,9 мес. В тоже время в группе с р53-mut (-) опухолями показатель выживаемости составил 50,9±18,6%, а медиана не была достигнута вовсе. Полученные результаты свидетельствуют о том, что наличие мутантного р53 в опухоли у больных РЯ является одним из неблагоприятных прогностических факторов и служит веским основанием тщательного мониторинга данного контингента больных.
Индивидуальный прогноз течения заболевания у больных раком яичников должен осуществляться путём анализа комплекса клинических, морфологических и лабораторных данных. Последние позволяют охарактеризовать биологические особенности опухоли даже в пределах одной клинической стадии заболевания.
Проведённый однофакторный анализ позволил выделить те показатели, которые отражают течение заболевания. Многофакторный анализ по Шеннону позволяет выделить наиболее значимые из них, оценивая степень информативности каждого признака.
В ходе проведённого исследования была проведена оценка комплекса прогностических факторов у 309 больных РЯ на предмет прогрессирования заболевания. Для каждой пациентки в общей сложности определялись значения следующих признаков: стадия заболевания, возраст больной, морфологический вариант опухоли, её степень дифференцировки, размер остаточной опухоли после хирургического лечения, плоидность опухоли, ИДНК, количество анеуплоидных клеток в опухоли, число клеток опухоли в G0/1-, S-фазах клеточного цикла, индекс пролиферации, наличие делеций в локусах 11р15 и 17q12-21 и наличие экспрессии р53-mut в опухолевых клетках.
В ходе исследования определено, что наиболее значимыми для прогнозирования прогрессирования заболевания у больных РЯ являются следующие факторы (в порядке убывания): стадия заболевания, плоидность опухоли, ИДНК, индекс пролиферации опухоли, размер остаточной опухоли после операции, экспрессия р53-mut, число клеток опухоли в S-фазе клеточного цикла, число анеуплоидных клеток в опухоли, степень дифференцировки опухоли, число клеток в G0/1 фазе клеточного цикла, морфологический вариант новообразования и возраст больной (рис. 10). Точность данного анализа составила 86,4%, специфичность – 87%, чувствительность – 86,3%.
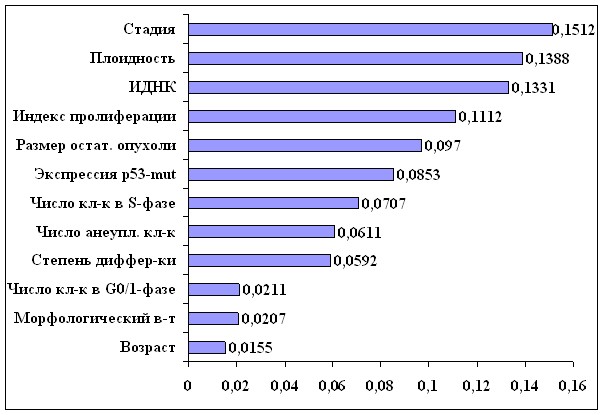
Рис. 10. Информативность признаков при прогнозе рецидива заболевания больных раком яичников (309 пациентов)
На следующем этапе были вычислены коэффициенты для всех градаций перечисленных выше признаков (табл. 17). При положительной сумме баллов с вероятностью 86,3% у больной наступит прогрессирование заболевания, что диктует проведение более агрессивных схем химиотерапии I линии. При отрицательном значении с вероятностью 87% исход течения заболевания у больной благоприятен. Если сумма коэффициентов находится в пределах диапазона от -50 до +50, то данная больная попадает в группу риска и нуждается в тщательном мониторинге.
Таблица 17
Коэффициенты веса наиболее информативных признаков при прогнозе рецидивов рака яичников
| № | Признак | Название градации | Коэффициент решающего правила |
| 1. | Стадия заболевания | I | - 200 |
| II | - 41 | ||
| III | 72 | ||
| IV | 160 | ||
| 2. | Плоидность опухоли | Анеуплоидные | 93 |
| Диплоидные | - 165 | ||
| 3. | ИДНК | < 1,0 | 107 |
| 1,1-1,9 | 86 | ||
| 2,0 | - 163 | ||
| > 2,0 | 46 | ||
| Многоклоновые | 17 | ||
| 4. | Индекс пролиферации опухоли | 16% | - 88 |
| > 16% | 108 | ||
| 5. | Размер остаточной опухоли | Нет ост. опухоли | - 82 |
| < 2 cм | 74 | ||
| > 2 см | 184 | ||
| 6. | Уровень экспрессии р53-mut | Отрицательный (-) | - 270 |
| Низкий (+) | - 136 | ||
| Умеренный (++) | 161 | ||
| Высокий (+++) | 238 | ||
| 7. | Число клеток опухоли в S-фазе | 10% | - 68 |
| > 10% | 131 | ||
| 8. | Число анеуплоидных клеток в опухоли | < 35% | - 89 |
| 35-70% | 71 | ||
| > 70% | 90 | ||
| 9. | Степень дифференцировки опухоли | Низкая | 157 |
| Умеренная | - 34 | ||
| Высокая | - 108 | ||
| 10. | Число опухолевых клеток в G0/1 фазе | 80% | 90 |
| > 80% | -124 | ||
| 11. | Морфологический вариант опухоли | Серозный | 43 |
| Светлоклеточный | 64 | ||
| Эндометриоидный | - 56 | ||
| Муцинозный | - 97 | ||
| 12. | Возраст больной | Молодой (до 45 лет) | - 90 |
| Средний (45-59 лет) | 19 | ||
| Пожилой (от 60 лет) | 53 |
Мы надеемся, что результаты данной работы способствуют разрешению ряда вопросов, связанных как с патогенезом, так и с клиническим течением рака яичников, а в дальнейшем будут способствовать повышению адекватности лечения и улучшению отдалённых результатов. Полученные данные, дальнейшее накопление клинического опыта, кооперированные исследования различных клиник способствуют достижению этой цели.
ВЫВОДЫ
- Полученные результаты подтверждают прогностическую значимость ряда известных клинических параметров:
- пятилетняя выживаемость больных при I стадии заболевания составила 73,5±6,9%, при II – 54,4±9,8%, при III – 24,3±3,8% и при IV – 13,7±3,2%, (p<0,05);
- размер остаточной опухоли имеет важное прогностическое значение у больных с распространёнными стадиями заболевания. При III стадии заболевания 5-летняя выживаемость больных оперированных без остаточной опухоли составила 41,4±10,2%, что превышает аналогичный показатель у больных с остаточной опухолью более 2 см – 20,1±7,9%, (р<0,05);
- возраст больных имеет прогностическую значимость при распространённых стадиях заболевания: при III стадии заболевания 5-летняя выживаемость больных молодого возраста (до 45 лет) составила 43,7±5,5%, в то время как аналогичный показатель у больных пожилого возраста (> 60 лет) равен 14,1±5,5%, (р<0,05).
- ИДНК злокачественных опухолей яичников коррелирует со стадией заболевания: диплоидные опухоли чаще встречаются у больных I-II стадии болезни (39,3%), чем у пациентов III-IV стадии (19,6%), (р<0,05). Количество анеуплоидных клеток не зависит от степени распространённости опухолевого процесса.
- Из изученных морфологических вариантов рака яичников чаще всего анеуплоидные опухоли определялись в светлоклеточных (94,8%) и серозных аденокарциномах (76,6%), реже в эндометриоидных (68,8%) и муцинозных (60,7%) новообразованиях. В свою очередь диплоидные опухоли чаще всего встречались среди муцинозных аденокарцином (39,3%), реже всего – среди светлоклеточных новообразований (5,2%).
- Диплоидные пограничные и злокачественные эпителиальные опухоли яичников достоверно различимы между собой по количеству клеток в синтетической фазе клеточного цикла (соответственно 5,2±0,3% и 7,8±0,4%, р<0,05); анеуплоидные пограничные и злокачественные эпителиальные опухоли яичников достоверно различимы между собой по количеству клеток в синтетической фазе клеточного цикла (соответственно 7,6±0,7% и 10,4±0,3%, р<0,05). Полученные данные могут служить дополнительным объективным критерием при проведении дифференциальной диагностики между пограничными опухолями яичников и раком яичников в затруднительных случаях.
- У больных с анеуплоидными новообразованиями полный эффект химиотерапии с включением производных платины достигнут в 57,0%, в то время как у больных с диплоидными опухолями – в 83,6% наблюдений, (р<0,05). Прогрессирование основного заболевания на фоне проводимого лечения отмечено только у 7,3% больных с диплоидными опухолями, а у больных с анеуплоидными новообразованиями – в 25,9%, (p<0,05).
- Плоидность опухоли при раке яичников является важным прогностическим показателем. Пятилетняя выживаемость больных с распространённым раком яичников и диплоидными опухолями составила 42,1%, с анеуплоидными – 20,5%, (p<0,05).
- Потеря генетического материала в локусе 17q12-21 (зона локализации гена BRCAI) ассоциирована с развитием злокачественных эпителиальных серозных опухолей яичников. В процессе прогрессирования заболевания степень повреждения данного участка хромосомы 17 достоверно увеличивается.
- При III-IV стадиях заболевания отмечается общее усиление генетической нестабильности, что выражается в увеличении количества делеций во всех исследованных локусах, кроме 18q21-23.
- Общая и безрецидивная 5-летняя выживаемость больных раком яичников с делециями в локусе 17q12-21 более чем в два раза ниже по сравнению с аналогичными показателями у пациентов, в опухолях которых данные делеции не определялись (р<0,05), что свидетельствует о нахождении в данных локусах генов-супрессоров опухолевого роста.
- Экспрессия р53-mut коррелирует со стадией заболевания, степенью дифференцировки и ИДНК злокачественных опухолей яичников. Среднее количество опухолевых клеток, экспрессирующих р53, достоверно увеличивается при распространённых стадиях болезни (при I-II стадиях этот показатель составил 29,1±8,2%, при III-IV – 59,7±3,6%, р<0,05). Среди опухолей с низкой степенью дифференцировки экспрессия р53-mut составила 56,2±3,2%, среди высоко дифференцированных аденокарцином – 28,0±7,2%, (р<0,05). Среди диплоидных опухолей экспрессия р53-mut составила 16,9±5,6%, в то время как в анеуплоидных новообразованиях – 56,9±2,9% (р<0,05).
- Определение р53-mut в опухоли у больных РЯ имеет клиническое значение. В группе больных с р53-негативными опухолями полный эффект химиотерапии с производным платины отмечался достоверно чаще по сравнению с группой пациентов с р53-позитивными новообразованиями (91,7% и 56,8%, соответственно), (р<0,05).
- Определение экспрессии p53-mut в опухоли при раке яичников имеет важное прогностическое значение. Пятилетняя выживаемость в группе больных с III-IV стадией заболевания и р53(-) новообразованиями составила 50,9±18,6%, что достоверно выше по сравнению с выживаемостью в группе больных с р53(+) опухолями, где этот показатель составил 8,5±6,3%, (p<0.05).
- При многофакторном анализе информативности изученных признаков выявлено, что наиболее важны в прогностическом плане (в порядке убывания): 1) стадия заболевания; 2) плоидность опухоли; 3) ИДНК; 4) индекс пролиферации опухоли; 5) размер остаточной опухоли после хирургического лечения; 6) экспрессия р53-mut; 7) число клеток опухоли в S-фазе клеточного цикла; 8) число анеуплоидных клеток в опухоли; 9) степень дифференцировки опухоли, число клеток в G0/1 фазе клеточного цикла; 10) морфологический вариант новообразования; 11) возраст больной. Точность анализа составила 86,4%, специфичность – 87%, чувствительность – 86,3%.
Список работ, опубликованных по теме диссертации
- Микросателлитная нестабильность 17q хромосомы при раке яичников. // Материалы IV съезда онкологов и радиологов стран СНГ. Азербайджан, Баку, 2006 г., т.2, с.47-48 (соавторы: И.Б. Зборовская, В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа, И.А. Ельчева).
- Количественные параметры клеток опухолей у больных раком яичников I стадии // Материалы IV съезда онкологов и радиологов стран СНГ. Баку, 2006 г., т.2, с.63 (соавторы: В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа).
- Рецидивы у больных раком яичников I стадии // В кн.: «Современные технологии в диагностике и лечении гинекологических заболеваний». Изд-во «Пантори», Москва, 2005, с. 312-313. (соавторы: З.Э. Тамаева, И.В. Поддубная, К.И. Жорданиа, Т.И. Захарова, Р.Р. Кидралиев).
- Микроделеции в хромосомных локусах опухолей яичников: сопоставление с клинико-морфологическими факторами прогноза // Российский онкологический журнал, 2006, №2, с. 26-30 (соавторы: И.Б. Зборовская, В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа, О.А. Анурова, И.А. Ельчева, Е.В. Коржевская).
- Клиническое значение определения делеций в различных хромосомных локусах у больных раком яичников. // Материалы IV съезда онкологов и радиологов стран СНГ. Азербайджан, Баку, 2006 год, т.1, с. 273-276 (соавторы: И.Б. Зборовская, В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа, О.А. Анурова, И.А. Ельчева, О.В. Балукова).
- Клинико-морфологические факторы прогноза у больных раком яичников // Акушерство и гинекология, 2004, №6, с. 28-31 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Возможность использования лазерной ДНК-проточной цитофлуорометрии у больных раком яичников. // Материалы Первого международного конгресса по репродуктивной медицине, Москва, 8-12 июня 2006 г., с.42-44 (соавторы: В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа, Г.В. Титова).
- Отдаленные результаты лечения больных раком яичников ранних стадий. // Материалы VI Всероссийского съезда онкологов, 2005, Ростов-на-Дону, с. 435-436 (соавторы: З.Э. Тамаева, К.И. Жорданиа, В.Н. Богатырёв, Н.Б. Перване).
- Лизофосфатидиловая кислота и рак яичников. // Проблемы репродукции, 2006, №2, с. 71-74 (соавторы: Р.Р. Кидралиев, Л.В. Адамян, К.И. Жорданиа, В.М. Говорун, Н.Е. Кушлинский, А.С. Кидралиева).
- Зависимость возникновения рецидива рака яичников ранних стадий от прогностических факторов. // Современная онкология, 2005, т.2, №7, с. 76-78 (соавторы: З.Э. Тамаева, К.И. Жорданиа, Т.В. Харитонова, И.Б. Поддубная).
- Клиническое значение ДНК-проточноцитофлуорометрических показателей клеток опухоли у больных с пограничными новообразованиями яичников. // Новости клинической цитологии России, 2004, т.8, №1-2, с. 2-4 (соавторы: В.Н. Богатырёв, К.И. Жорданиа).
- Клиническое значение показателей ДНК-проточной цитофлуорометрии при раке яичников. // Вестник Российского онкологического научного центра РАМН, 2007, т.18, №1, с. 40-44 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.В. Кузнецов, О.А. Анурова).
- Loss of heterozigosity (LOH) in epithelial ovarian tumors. // Int J Gynecol Cancer, V.15, Suppl. 2, p. 171. Материалы XIV Европейского съезда онкогинекологов, 2005, 25-29 сентября, Турция, Стамбул (соавторы: И.Б. Зборовская, В.Н. Богатырёв, В.В. Кузнецов, К.И. Жорданиа, О.А. Анурова, И.А. Ельчева, Е.В. Коржевская).
- A phase II study of carboplatin and doxorubicin as the first-line treatment of ovarian cancer. // Annals of Oncology, 2004, V.15, Suppl. 3, p. 130. Материалы XXIX конгресса ESMO, Вена, Австрия (соавторы: С.А. Тюляндин, Л.В. Чития, А.В. Трякин, М.Б. Стенина).
- Using DNA flow cytometry in patients with ovarian tumors. // Annals of Oncology, 2004, V.15, Suppl. 3, p. 131. Материалы XXIX конгресса ESMO, Вена, Австрия (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Borderline ovarian tumors (DNA flow cytometry). // Cytopathology, 2004, V15, p. 24. Материалы XXX Европейского конгресса цитологов, Греция, 12-15 окт. 2004.
- Quantitative tumor cells parameters as prognostic factors in ovarian neoplasms patients. // Мат-лы XXIX Европейского конгресса цитологов, 5-8 окт., 2003, Прага, Чехия, с. 133-135 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Using DNA flow cytometry parameters in prognosis of patients with ovarian neoplasms. // Материалы XV Международного конгресса цитологов, Чили, 11-15 апр. 2004, с. 58 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, А.В. Самсонова).
- Количественные параметры клеток опухоли у больных раком яичников. // Материалы III конгресса онкологов закавказских государств, 22-24 сент, 2004., с. 187-188 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, А.В. Самсонова).
- Биологические параметры клеток опухоли у больных с различными новообразованиями яичников. // В кн.: «Современные технологии в диагностике и лечении гинекологических заболеваний». Изд-во «Пантори», Москва, 2004, с. 237-238 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Клинико-морфологические факторы прогноза у больных раком яичников с учётом количественных параметров клеток опухоли. // Материалы III съезда онкологов и радиологов СНГ, 25-28 мая 2004, Минск, с. 316 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Потеря гетерозиготности в различных хромосомных локусах у больных раком яичников и её клиническое значение. // Мат-лы конференции: «Современные методы лечения онкологических больных: достижения и неудачи», Барнаул, Россия, 2006 г., с. 221 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко, В.В. Баринов).
- ДНК-проточноцитофлуорометрические параметры как факторы прогноза у больных раком яичников (обзор литературы). // Новости клинической цитологии России, 1999, т.3, №2, с. 49-52 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко, А.И. Карселадзе, М.А. Шабанов, Н.Е. Кушлинский, Д.А.Шарыпова).
- ДНК-проточноцитофлуорометрические параметры как факторы прогноза у больных раком яичников (собственные данные). // Новости клинической цитологии России, 1999, т.3, №1, с. 29-32 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко, А.И. Карселадзе, М.А. Шабанов, Н.Е. Кушлинский, Д.А.Шарыпова).
- Use DNA flow cytometry in diagnosis and prognosis of serous borderline ovarian tumors and high grade ovarian tumors. // Europe Journal of cancer, 1997, V.33, p. S124 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, М.А. Шабанов).
- Цитометрическое определение содержания ДНК в клетках опухолей яичников и его роль в прогнозе заболевания. // Материалы V Всероссийского съезда клинических цитологов, Москва, 2003, с.67-68 (соавторы: В.Н. Богатырёв, К.И. Жорданиа).
- Биологические факторы прогноза у больных раком яичников. // Сибирский онкологический журнал, 2003, №1, с. 18-20 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, И.А. Масляева, М.Д. Ахмедова).
- Злокачественные эпителиальные опухоли яичников. // Проблемы клинической онкологии, 2003, №4, с. 90-92 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, М.Д. Ахмедова, В.В. Баринов).
- Количественные параметры клеток опухоли как факторы прогноза у больных раком яичников. // В сб.: «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва, 2003, с. 178-180 (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко).
- Количественные параметры клеток у больных с пограничными опухолями яичников. // Современная онкология, 2003, т.5, №2, с. 68-70 (соавторы: В.Н. Богатырёв, И.А. Масляева, К.И. Жорданиа).
- Данные ДНК-проточной цитометрии и прогноз гранулёзоклеточных опухолей яичников взрослого и ювенильного типов. // Материалы V Всероссийского съезда клинических цитологов, Москва, 2003, с. 56-57 (соавторы: Н.С. Кержковская, В.Н. Богатырёв, К.И. Жорданиа).
- Опыт применения клинических и биологических факторов прогноза у больных раком яичников. // Практикующий врач, 2002, №2, с. 35-38. Материалы VI Российской онкологической конференции, Москва, 2002, 26-28 ноября (соавторы: В.Н. Богатырёв, К.И. Жорданиа, В.П. Козаченко, С.А. Тюляндин).

