К 7-м суткам послеоперационного периода в группе № 1 состояние крыс улучшалось, при этом регистрировалось достоверное снижение балла оценки тяжести неврологического дефицита (PКЗ=0,013), однако степень восстановления утраченных функций составляла, по сравнению с первыми сутками наблюдения, всего 9 ± 1 %. Из 8-и животных к этому сроку только две особи имели ОТНН менее 20 баллов, т.е. перешли в категорию умеренного неврологического дефицита. Положительная динамика проявлялась у них в виде разрешения правосторонней гемиплегии до глубокого гемипареза. В то же время оставшиеся животные сохраняли признаки тяжелых неврологических расстройств.
Несмотря на реоперацию, направленную на удаление полихлорвинилового катетера, к 7-м суткам животные второй группы характеризовались схожими изменениями в виде уменьшения очаговой неврологической симптоматики и также достоверным (PКЗ=0,013), но весьма умеренным по выраженности (на 9 ± 1 %) самостоятельным восстановлением утраченных функций. Снижение балла ОТНН ниже 20 в этой группе отмечалось только у одного животного.
Следует отметить, что у животных обеих групп к концу 1-й недели была зарегистрирована потеря массы тела и обеднение волосяного покрова.
К концу второй недели отмечалось дальнейшее улучшение состояния подопытных крыс. Положительная неврологическая динамика у животных 1-й группы серии S2 проявлялась частичным восстановлением движения и чувствительности в конечностях на гомолатеральной стороне (у 6 из 8 животных) и повышением активности животных по сравнению с предшествующим периодом. Тем не менее, 3-м животным по-прежнему требовался дополнительный уход в виде вспомогательного кормления. Во второй группе животные были несколько менее активными, положительная неврологическая динамика отмечалась у 4-х из 8-и животных и проявлялась восстановлением силы в конечностях и объема движений на гомолатеральной стороне и регрессом чувствительных нарушений на контралатеральной стороне. Все это приводило к умеренному снижению балла ОТНН. Характерно, что восстановление неврологического статуса во второй группе было менее выраженным. И хотя различия между баллом ОТНН в 1-й и 2-й группах серии S2 на 14-е сутки были недостоверны, они проявлялись в виде достаточно выраженной тенденции (PU=0,066).
К 21-м суткам наблюдалось дальнейшее снижение балла ОТНН до
15,70 ± 0,30 в 1-й группе и 16,50 ± 0,20 баллов во 2-й группе. К этому сроку неврологические выпадения в обеих группах стабилизировались, особой положительной динамики не было отмечено: у животных складывался определенный стереотип в движениях, приеме пищи, воды. При этом двигательные нарушения на контралатеральной стороне по-прежнему были более выражены. Неврологические моторные нарушения у животных проявлялись отсутствием способности двигаться прямолинейно – периодически имело место движение с поворотом в паретичную сторону. При поднятии животного за хвост отсутствовали сгибания передних и задних конечностей.
У животных 2-й группы отмечались более выраженные нарушения двигательной активности. Если в 1-й группе двигательная активность на гомолатеральной стороне у 4-х животных составляла 2 балла, у 4-х – 3 балла, а на контрлатеральной стороне – 4 балла, то во второй группе двигательные расстройства на гомолатеральной стороне у большинства животных (6 из 8-и) соответствовали 3-м баллам, а на контралатеральной стороне – 5-и баллам.
В целом, состояние животных обеих групп в соответствии с бальной оценкой по ОТНН к 21-у дню характеризовалось как умеренное повреждение.
Таким образом, моделирование нарушения венозного кровотока у крыс в виде коагуляции верхнего сагиттального синуса в средней трети и корковых вен в левой теменно-височной области индуцирует выраженное повреждение головного мозга, которое проявляется в виде тяжелого общего состояния животных и очагового неврологического дефицита, характеризуется низким уровнем естественного восстановления.
Наличие степени неврологических выпадений и их динамика при самопроизвольном восстановлении утраченных функций и их статистическая обработка убедительно свидетельствует о том, что присутствие хлорвинилового катетера под мягкими тканями головы крысы не оказывает негативного влияния на степень и темп восстановления неврологического дефицита.
3.1.2. Характеристика морфологических изменений головного мозга при моделировании нарушения венозного кровотока
Для изучения характера и верификации морфологических повреждений, возникающих у экспериментальных животных при моделировании нарушений венозного кровотока, и их дальнейшей трансформации были проведены МРТ и гистологические исследования головного мозга животных.
3.1.2.1. МРТ-исследования головного мозга крыс
Для проведения МРТ головного мозга крыс были отобраны 3 животных серии S4, которые обследовались до и после моделирования нарушения венозного кровотока. Томографическое обследование животных проводилось до операции, на 2-е, 8-е, 14-е и 23-и сутки после хирургического вмешательства. Всего у этих животных было последовательно проведено 11 МРТ-исследований.
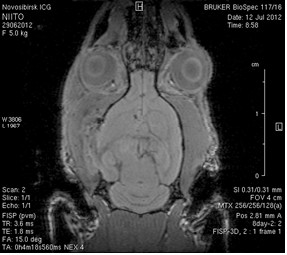
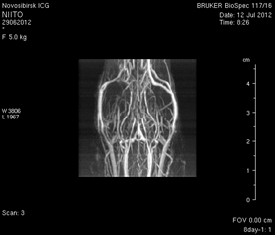
Исследование головного мозга 2-х животных до моделирования нарушения венозного кровотока (рисунок 3) показало, что на МР-томограммах, полученных при помощи импульсных последовательностей FISP и RARE в аксиальных и коронарных плоскостях, структуры мозга симметричны, форма и размеры их не изменены. Патологических изменений интенсивности сигнала в веществе мозга не выявлено. На МР-томограммах, полученных при помощи импульсной последовательности TOF (рисунок 3 а3, б3) и на реконструированных объемных церебральных МР-ангиограммах (рисунок 3 а4, а5) визуализируется кровоток по всем экстра- и интракраниальным артериям, синусам твердой мозговой оболочки и венам.
а1  б1
б1 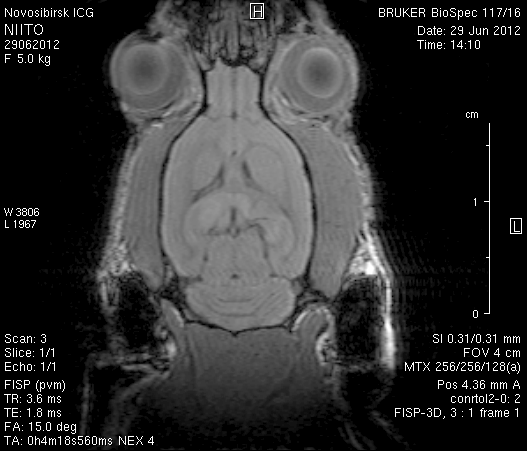
а2 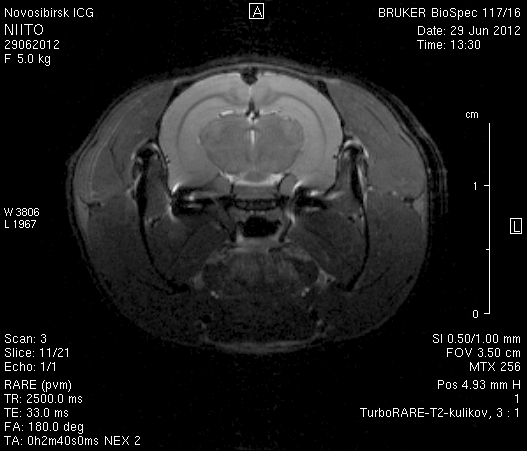 б2
б2 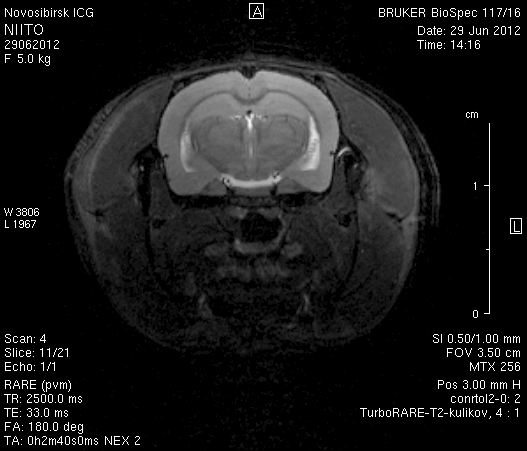
а3 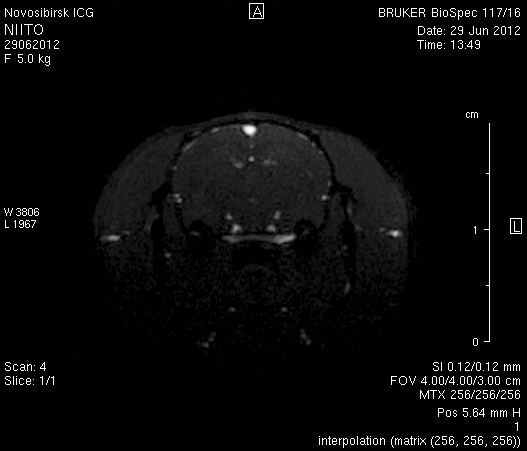 б3
б3 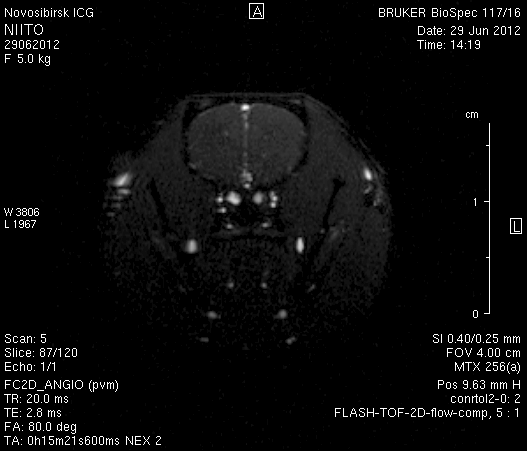
а4 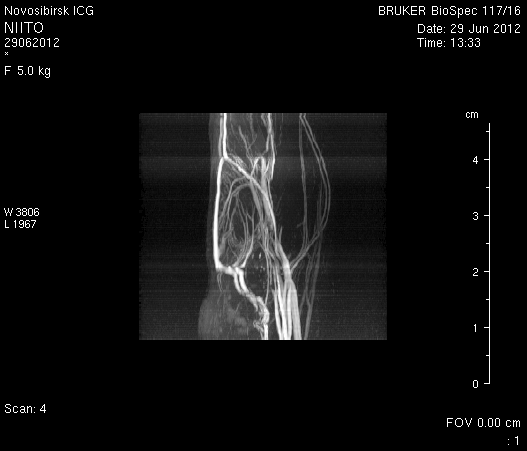
а5 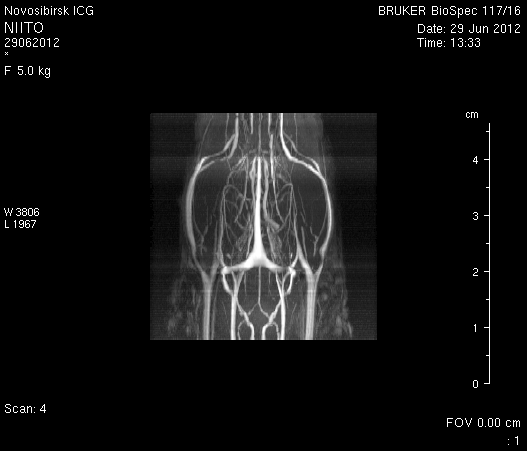
Рисунок 3 – МРТ головного мозга интактных крыс: а – животное № 1; б – животное №2. а1, а2, б1, б2 – МРТ томограммы, полученные в FISP и RARE режимах; а3, а4, а5 –изображения, полученные при помощи импульсной последовательности TOF и реконструированные объемные церебральные МР-ангиограммы.
На 2-е сутки после моделирования нарушений венозного кровотока головного мозга по нашей оригинальной методике на изображениях в аксиальных и коронарных плоскостях в области верхнего сагиттального синуса и над левым полушарием мозга визуализировался гемостатический материал (рисунок 4). Видно, что мозговое вещество левого полушария пролабирует через трепанационное отверстие в среднем на 6–7 мм. Срединные структуры смещены влево на 2–3 мм. В пролабирующем в трепанационное отверстие и прилежащем к коагулированным участкам синуса веществе мозга выражены признаки отека. Объем зоны отека варьирует от 0,1 до 1,6 см3 и в среднем составляет 0,9 см3 (рисунок 4 а1, б1, в1).
а1 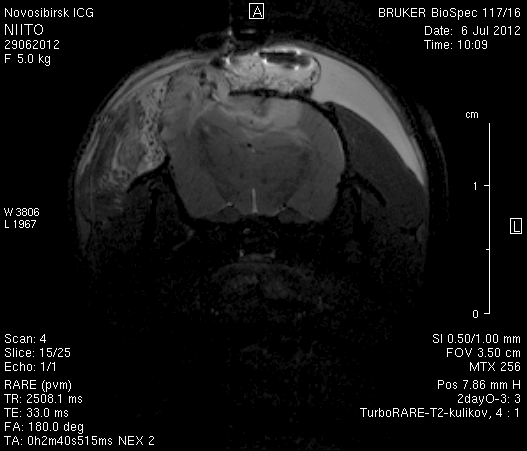 а2
а2 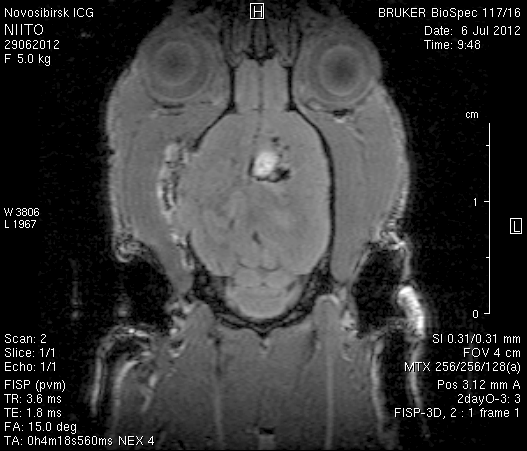
б1 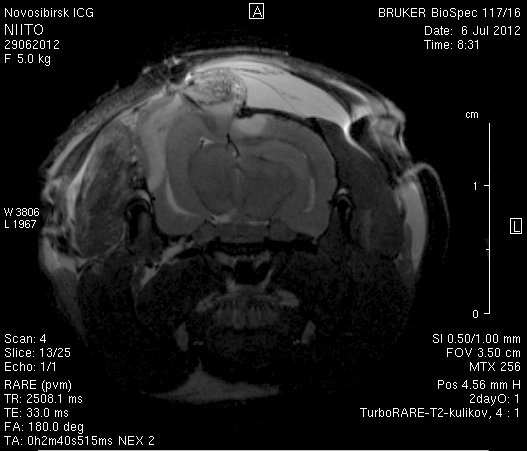 б2
б2 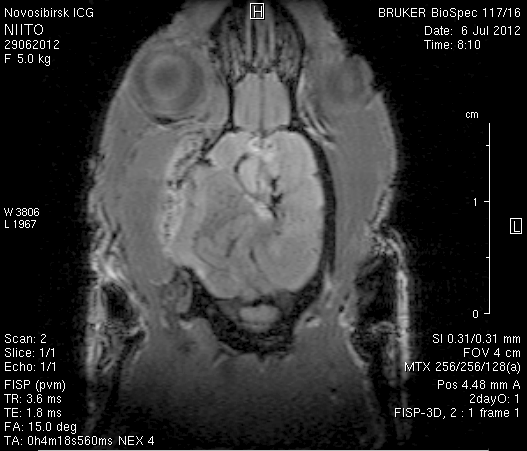
в1 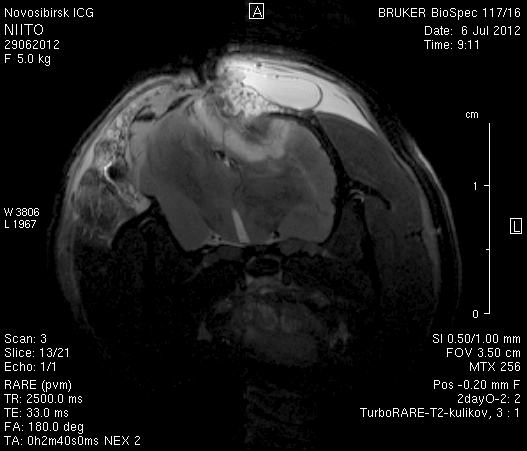
Рисунок 4 – МРТ головного мозга на 2-е сутки после хирургического вмешательства. Изображения получены в режимах RARE и FISP: а – животное № 1; б – животное № 2;
в – животное № 3.
На МР-томограммах, полученных при помощи импульсной последовательности TOF, и на реконструированных объемных церебральных МР-ангиограммах кровоток по синусам твердой мозговой оболочки и венам отчетливо не визуализируется (рисунок 5 а1, б1, в1) Кровоток по экстра- и интракраниальным артериям сохранен, выражены признаки их полнокровия (рисунок 5 а2, б2, в2).
а1 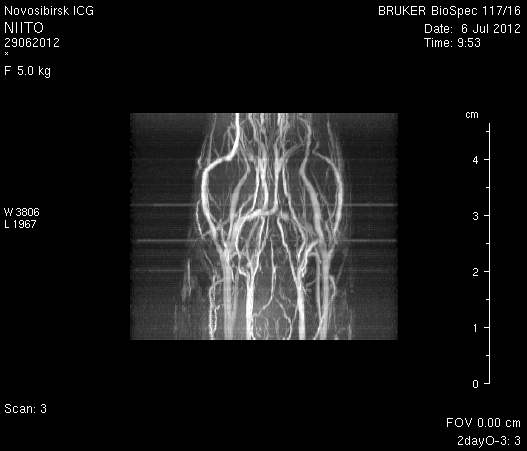 а2
а2 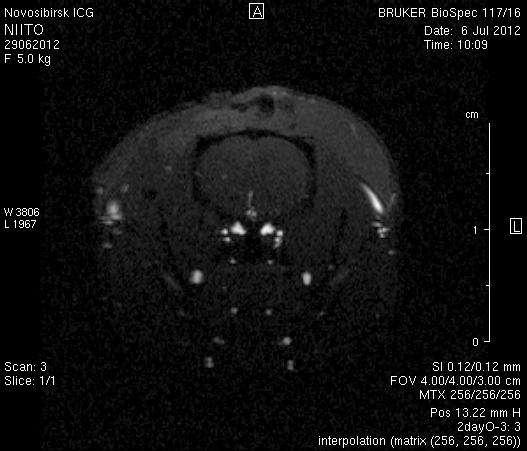
б1 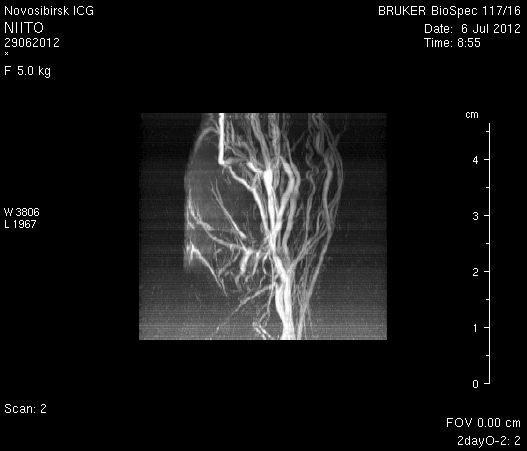 б2
б2 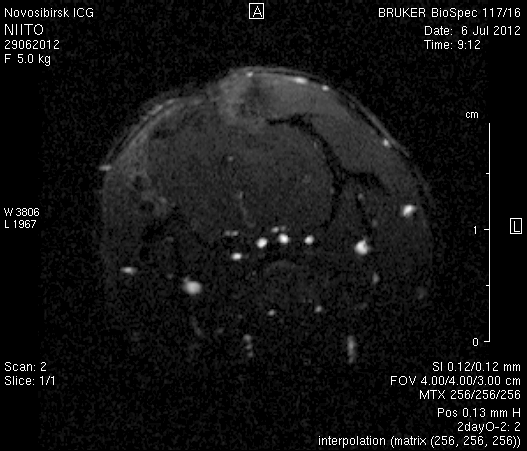
в1 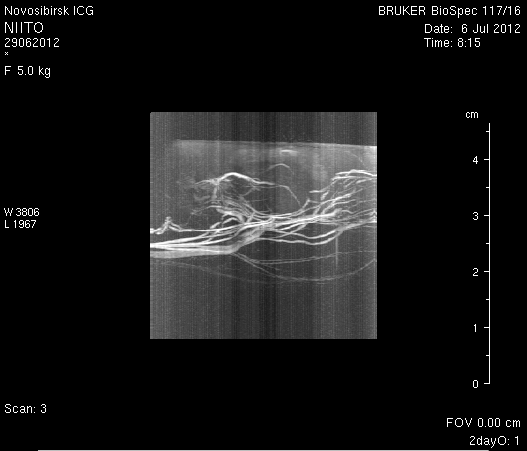 в2
в2 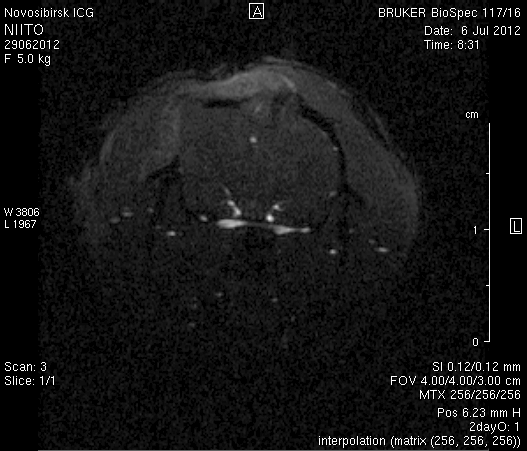
Рисунок 5 – Церебральная МР-ангиография головного мозга на 2-е сутки после хирургического вмешательства: а – животное № 1; б – животное № 2; в – животное № 3.
На 8-е сутки послеоперационного периода исследования удалось выполнить не у всех 3, а лишь у 2 животных, так как одно погибло из-за тяжелого состояния на 5-е сутки эксперимента.
У животного № 1 в области верхнего сагиттального синуса и над левым полушарием мозга визуализировался гемостатический материал. Мозговое вещество левого полушария пролабировало через трепанационное отверстие, но в несколько меньшей степени – в среднем на 3,5–4,5 мм. Срединные структуры не были смещены. В пролабирующем в трепанационное отверстие и прилежащем к коагулированным участкам синуса веществе мозга признаков отека не наблюдалось (рисунок 6 а1, а2). У животного № 2 отек вещества мозга, прилежащего к участкам синуса, сохранялся (рисунок 6 б1, б2). Кровоток по синусам твердой мозговой оболочки и венам отчетливо не визуализировался. Кровоток по экстра- и интракраниальным артериям сохранился, были отчетливо выражены признаки их полнокровия (рисунок 7). По сравнению с результатами церебральной МР-ангиографии на 8-е сутки незначительно уменьшилось количество визуализированных вен среднего и малого калибра.
а1 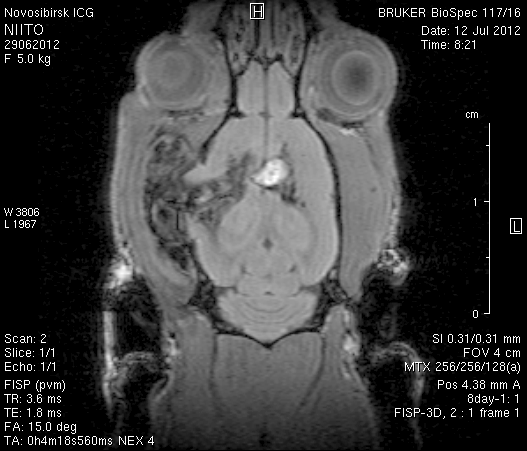 а2
а2 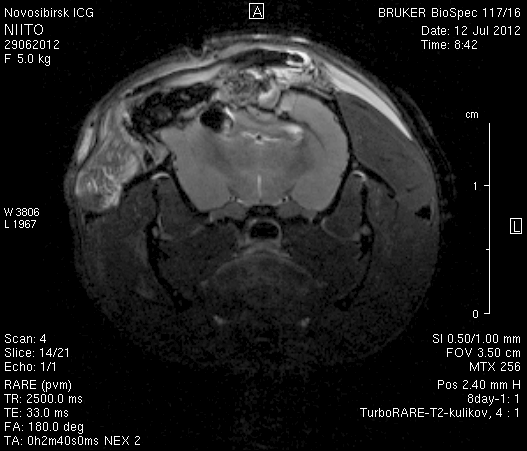
б1
 б2
б2 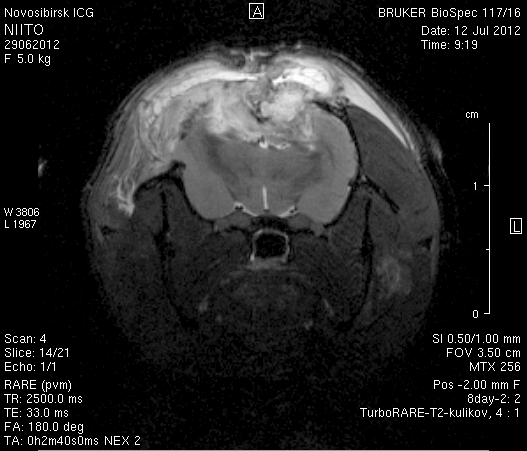
Рисунок 6 – МРТ головного мозга на 8-е сутки после хирургического вмешательства. Изображения, полученные в режимах FISP и RARE: а – животное № 1; б – животное № 2.
На 14-е сутки послеоперационного периода в области верхнего сагиттального синуса визуализировался гемостатический материал (рисунок 8). Сохранялось пролабирование мозгового вещества левого полушария – в среднем на 3,4–4,5 мм. Срединные структуры не были смещены (рисунок 8 а2, б2).
а1
 б1
б1 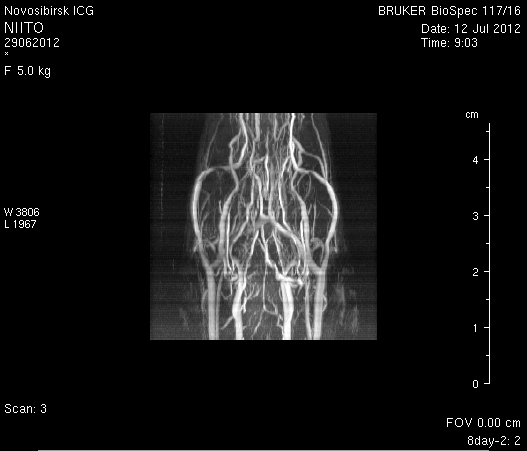
а2 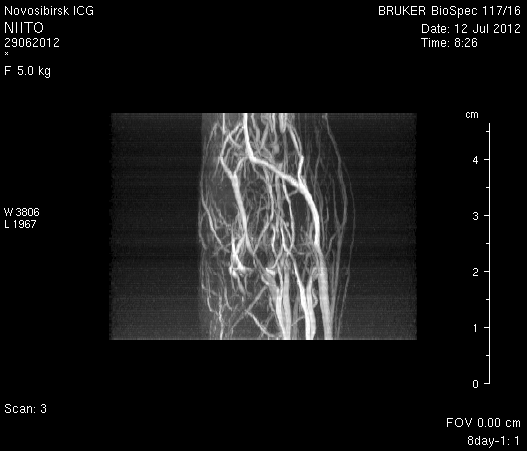 б2
б2 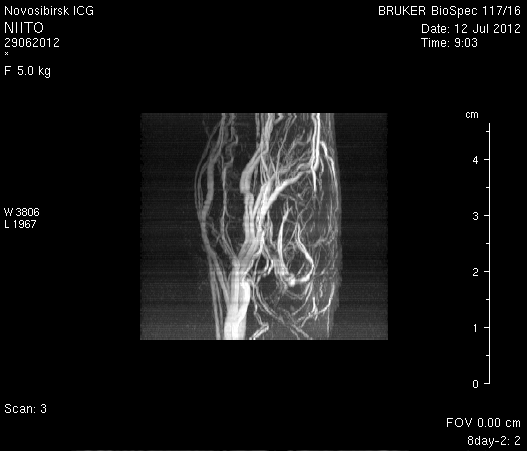
а3 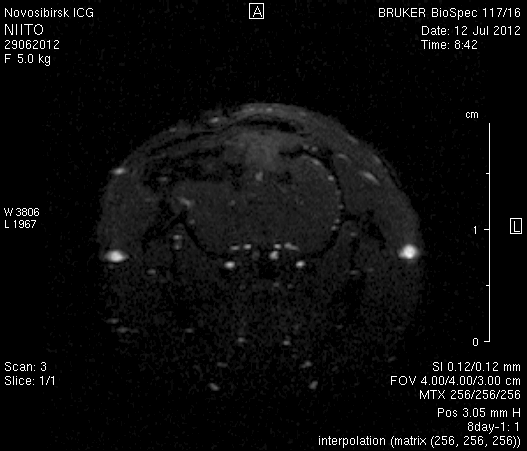 б3
б3 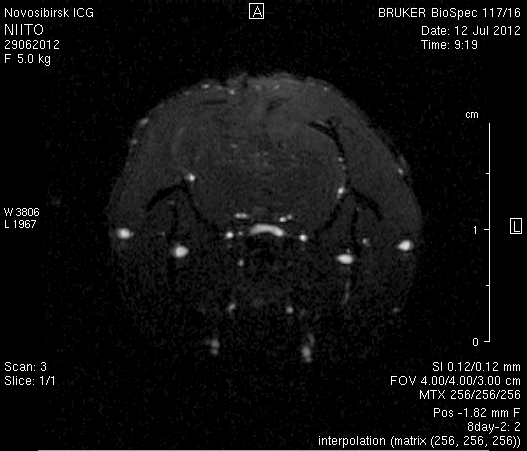
Рисунок 7 – Церебральная МР-ангиография головного мозга на 8-е сутки после хирургического вмешательства. а – животное № 1, б – животное № 2.
а1 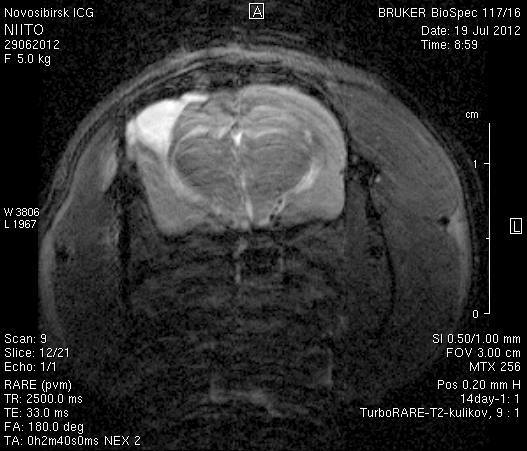 а2
а2 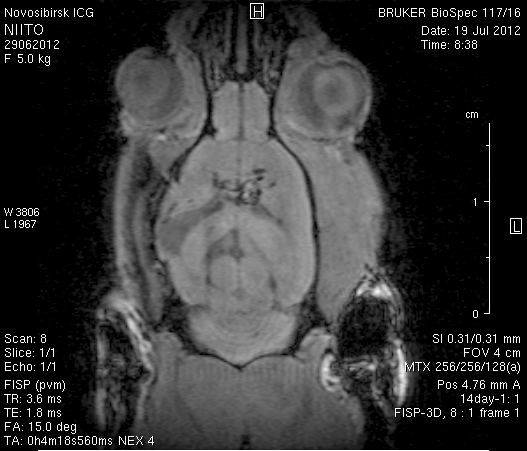
б1 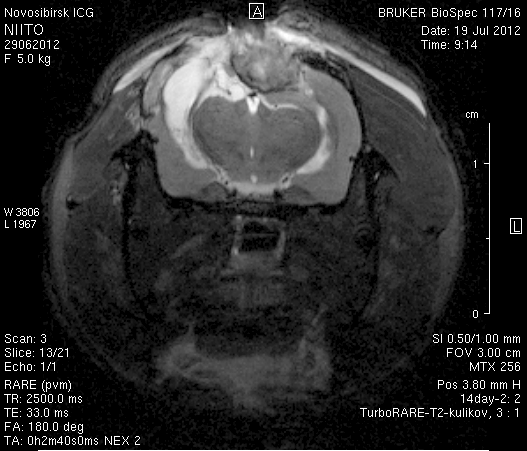 б2
б2 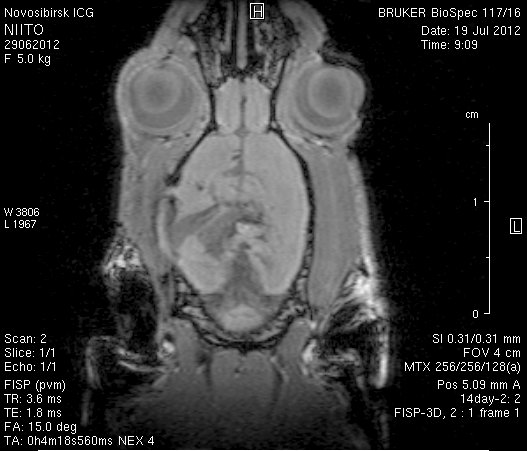
Рисунок 8 – МРТ головного мозга на 14-е сутки после хирургического вмешательства. Изображения полученны в режимах FISP и RARE. а – животное № 1, б – животное № 2.
В веществе мозга, пролабирующем в трепанационное отверстие, и в расположенных рядом с ним участках, определялась неправильной формы полость, заполненная жидкостью с сигналом, идентичным сигналу ликвора (рисунок 8 а1, б1). Размеры кистозной полости варьировали от 0,1 до 1,0 см3, составляя в среднем 0,6 см3.
При церебральной МР-ангиорграфии (рисунок 9) кровоток по экстра- и интракраниальным артериям был сохранен. По сравнению с результатами МР-ангиографии на 14-е сутки появился участок отсутствия кровотока по одной из крупных вен левого полушария мозга (рисунок 9 а1).
а1 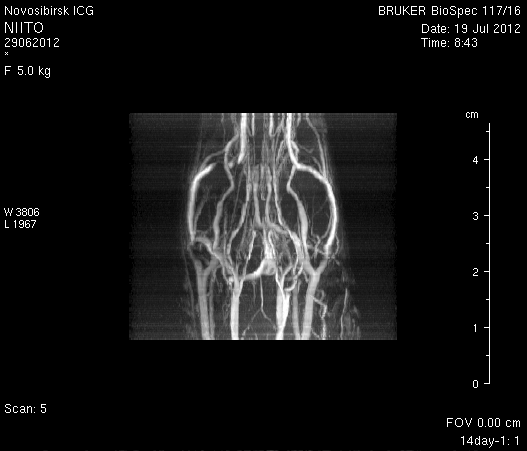 а2
а2 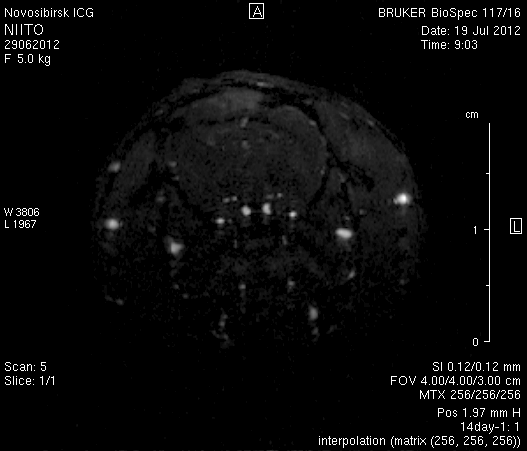
б1 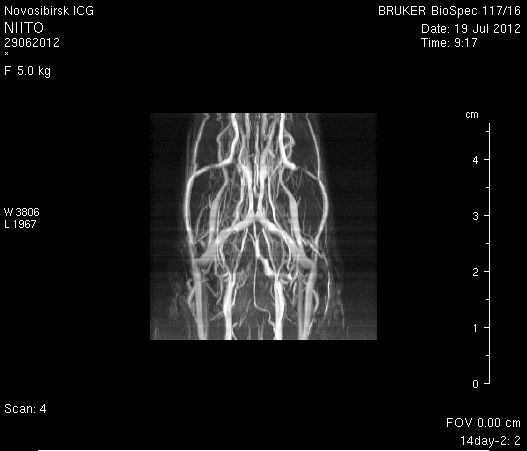 б2
б2 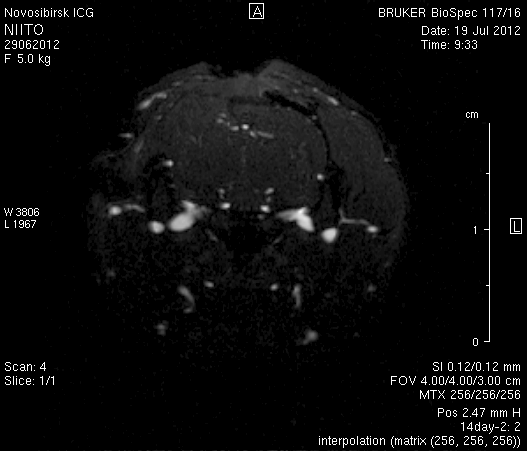
Рисунок 9 – Церабральная МР-ангиография головного мозга на 14-е сутки: а – животное № 1; б – животное № 2.
На 23-и сутки после хирургического вмешательства (рисунок 10) в области верхнего сагиттального синуса визуализировался гемостатический материал. Мозговое вещество левого полушария пролабировало через трепанационное отверстие на 3–4мм (рисунок 10 а1, б1). Срединные структуры не были смещены (рисунок 10 а2, б2). В веществе мозга, пролабирующем в трепанационное отверстие, и в расположенных рядом с ним участках определялась неправильной формы полость, заполненная жидкостью с сигналом, идентичным сигналу ликвора (рисунок 10 а1, а2, б1, б2). По сравнению с результатами МРТ на 14-е сутки размеры полости увеличились в среднем до 1,0 см3. У животного № 1 определялись признаки сообщения полости с левым желудочком.
а1 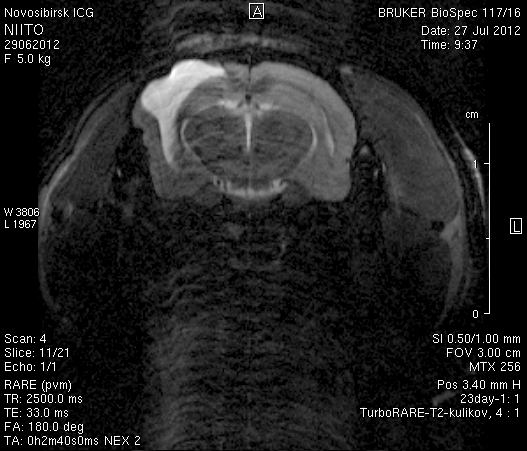 а2
а2 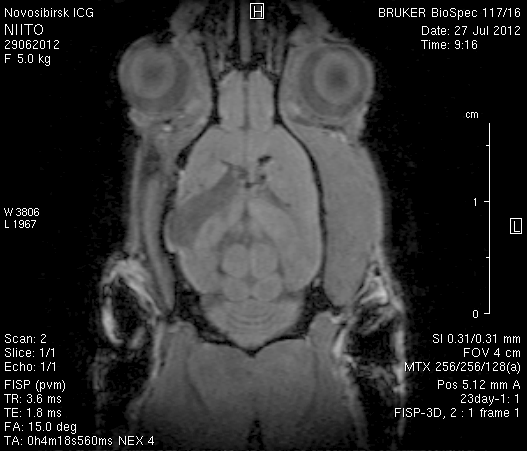
б1 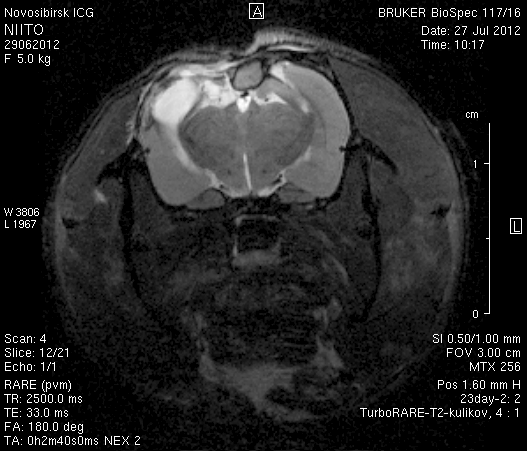 б2
б2 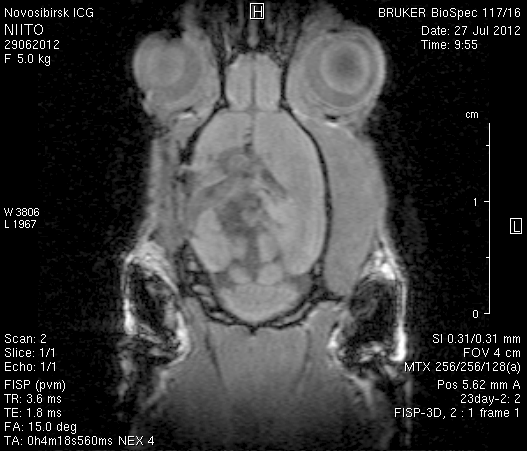
Рисунок 10 – МРТ головного мозга на 23-е сутки после хирургического вмешательства. Изображения, полученные в режимах FISP и RARE. а – животное № 1, б – животное № 2.
При ангиографии на 23-и сутки (рисунок 11) кровоток по синусам твердой мозговой оболочки и венам отчетливо не визуализировался. Кровоток по экстра- и интракраниальным артериям сохранялся. По сравнению с результатами МР-ангиографии на 14-е сутки увеличилось количество участков крупных вен левого полушария мозга, кровоток по которым не визуализировался (рисунок 11 а1). У крысы 2 (рисунок 11 б1) по сравнению с предыдущим исследованием определялось значительное уменьшение количества мелких вен.
Таким образом, по данным МРТ исследования головного мозга экспериментальных животных установлено, что моделирование нарушений венозного кровотока путем облитерации с помощью биполярной коагуляции верхнего сагиттального синуса и последующей коагуляцией венозных корковых сосудов в левой теменно-височной области приводит к выключению кровотока по синусам твердой мозговой оболочки и венам головного мозга, сохраняющемуся до 23-х суток. При этом кровоток по экстра- и интракраниальным артериям не изменяется.
а1 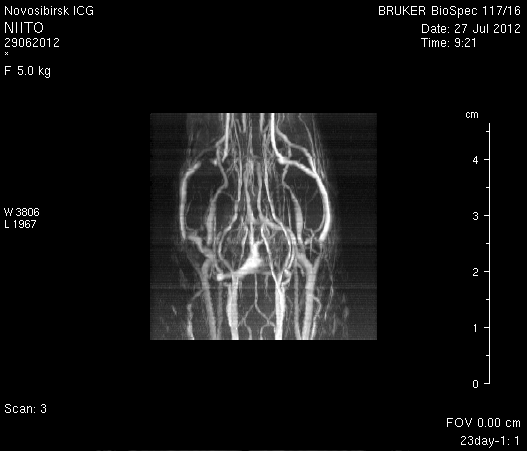 б1
б1 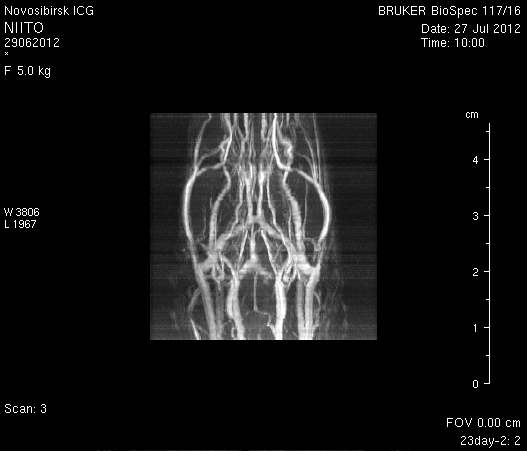
а2 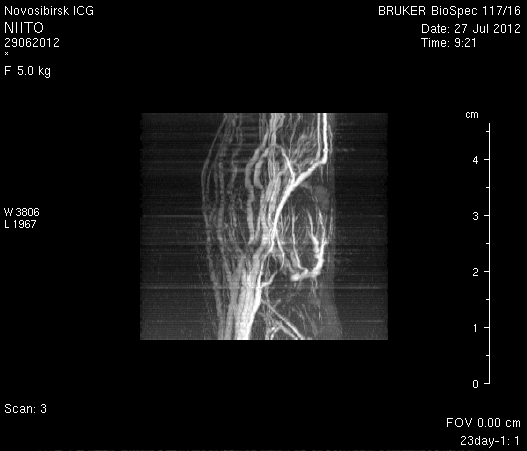 б2
б2 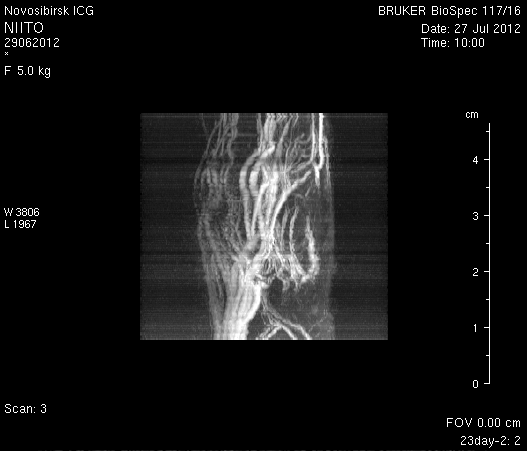
а3 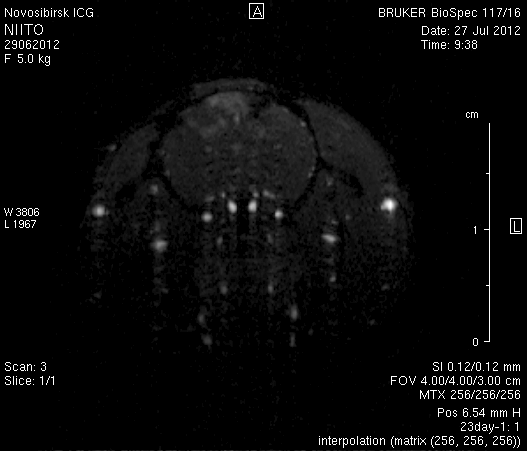 б3
б3 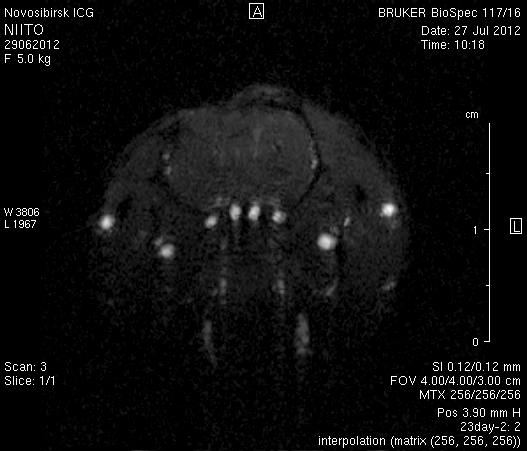
Рисунок 11 – Церебральная МР-ангиография головного мозга на 23-и сутки после хирургического вмешательства. а – животное № 1, б – животное № 2.
Это сопровождается развитием выраженного отека головного мозга в области хирургического вмешательства, прилежащего к коагулированным участкам синуса и пролабирующего в трепанационное отверстие, с последующим (спустя две недели с момента травмы) формированием интрацеребральной ликворной кисты в зоне очага повреждения мозга на фоне сохраняющегося его отека.
3.1.2.2. Гистологическое исследование головного мозга при экспериментальном нарушении венозного кровотока
При создании экспериментальной модели острого нарушения венозного кровотока головного мозга оценивалась степень выраженности морфологических изменений, позволяющих оценить характерологические особенности повреждения ткани мозга (инфаркта) на разных стадиях его развития (1-е, 7-е,
14-е, 21-е сутки).
Моделирование повреждения венозного кровотока у всех исследуемых экспериментальных животных приводило к развитию достаточно однотипных повреждений ткани мозга (в силу единого патогенетического фактора), которые классифицировались как участки полного или неполного некроза. При этом морфологические особенности повреждения мозговой ткани в различных участках позволяли идентифицировать все три формы инфаркта, включая белый, красный или смешанный.
Анализ структурно-клеточных показателей в поврежденной нервной ткани животных контрольной группы продемонстрировал, что нарушение гемодинамики при используемой модели приводило к развитию прогрессирующих дистрофических и некробиотических изменений в поврежденной ткани мозга с образованием очага омертвения, характеризующегося определенным набором морфологических изменений в виде зональности его строения и стадийности изменений в динамике.
Патологические изменения головного мозга на 1-е сутки.
Макроскопически: у всех животных после выполнения коагуляции ВСС с последующей коагуляцией корковых вен в левой теменно- височной области определялся очаг венозного стаза, который характеризовался отеком левой теменно-височной области (размерами 1,0х1,0 см) и пролабированием мозгового вещества в трепанационного отверстие.
Микроскопически: визуализировался очаг, центр которого представлял зону полного разрушения ткани с формированием дезинтеграции и морфологическими изменениями клеток нейронов и глии. Очаг повреждения был представлен выраженной перифокальной лимфоидно-лейкоцитарной инфильтрацией (рисунок 12 а). Тяжелые структурные изменения в микроциркуляторном русле проявлялись в виде деформации капилляров, набухания эндотелия, расширения его базальных слоев, приводящих к повышенной сосудистой проницаемости, диапедезными кровоизлияниями в веществе мозга и перифокальной зоне (рисунок 12 б).
а 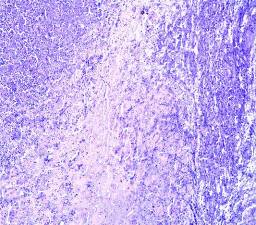 б
б 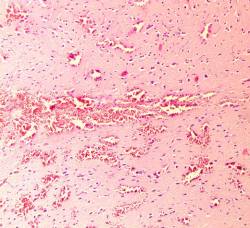
Рисунок 12 – Контрольная группа. 1-е сутки: а – очаг повреждения мозговой ткани с выраженной перифокальной лимфоидно-лейкоцитарной инфильтрацией. Увеличение 200; б – множественные диапедезные кровоизлияния в перифокальной зоне очага повреждения. Увеличение 100. Окраска гематоксилином и эозином.
В перифокальной зоне наблюдался выраженный перифокальный отек и дистрофические изменения нейронов по ишемическому типу, клетки тени, пикноморфные и гиперхромные нейроны (рисунок 13).
Таким образом, некротическая стадия инфаркта мозга – это стадия аутолиза с характерными, типичными признаками некроза.
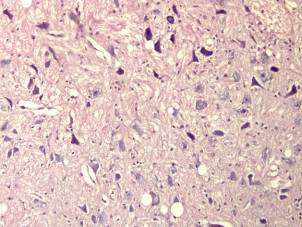
Рисунок 13 – Выраженный отек, тяжелые дегенеративно-дистрофические изменения нейронов по ишемическому типу (в перифокальной зоне очага повреждения). Окраска гематоксилином и эозином. Увеличение 300.
Патологические изменения головного мозга на 7-е сутки исследования.
Макроскопически: у животных в месте нанесения повреждения головного мозга мозговая ткань характеризовалась дряблой консистенцией в очаге некроза, вещество мозга было набухшим, бледным, границы инфаркта визуализировались нечетко и плохо контурировались, дефект ткани составлял около 0,9х1,0см. Сохранялось умеренное пролабирование мозгового вещества.
Микроскопически: в пограничной и перифокальной зонах очага повреждения наблюдалась пролиферация глиальных клеток на границе с инфарктом. В зоне повреждения выявлено большое количество гемосидерофагов, зернистые шары (рисунок 14).
Выявлены скопления гиперплазированных глиальных клеток в пограничной и перифокальной зонах. В демаркационной зоне на границе с инфарктом увеличено число и плотность клеток глии (рисунок 15).
Процессы альтерации в этом периоде преобладали над репаративными изменениями. Гипоксическое состояние приводило к дезинтеграции, отеку и набуханию нервной ткани.
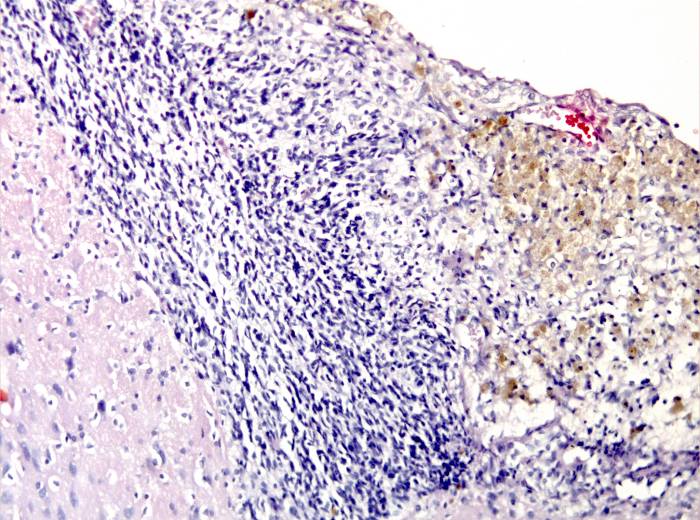
Рисунок 14 – Пролиферация клеток глии. Лейкоцитарная инфильтрация в перифокальной зоне очага повреждения. Гемосидерофаги в центральной зоне. Окраска гематоксилином и эозином. Увеличение 200.
а 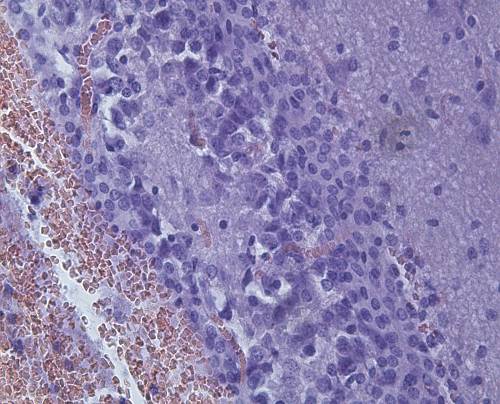 б
б 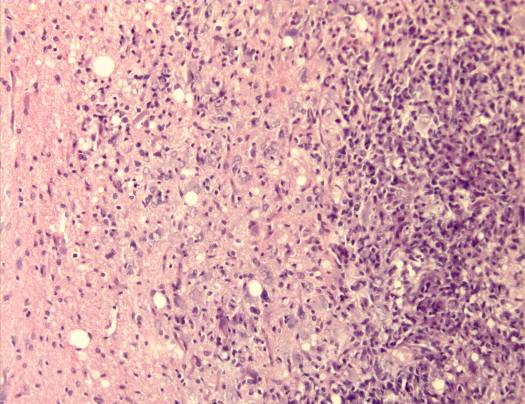
Рисунок 15 – Очаги повреждения: а – гиперплазированные глиальные клетки в перифокальной и пограничной зонах; б – клетки глии в демаркационной зоне. Окраска гематоксилином и эозином. Увеличение 200.
Патологические изменения головного мозга на 14-е сутки исследования.
Макроскопически: на 14-е сутки наблюдалось формирование ликворной кисты размерами 0,4х0,9х1,0 см, были визуализированы единичные очаги некроза по периферии очага повреждения, размеры дефекта ткани составляли около 0,9х1,0 см.
Микроскопически: в очаге повреждения ткани головного мозга наблюдалось нарастание репаративных изменений, дальнейшая резорбция некроза и активация макрофагальной функции (рисунок 16).
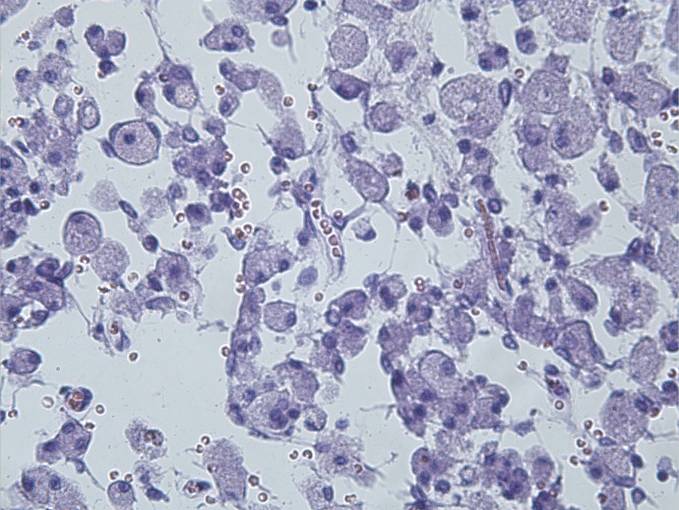 .
.
Рисунок 16 – Макрофогальная резорбция некротизированной нервной ткани. Окраска гематоксилином и эозином. Увеличение 200.
В дальнейшем имели место пролиферация кровеносных сосудов и формирование петель из новообразованных сосудов, которые особенно отчетливо выявлялись к 14-м суткам (рисунок 17).
а 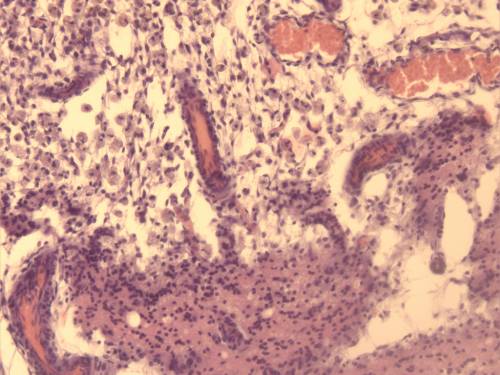 б
б 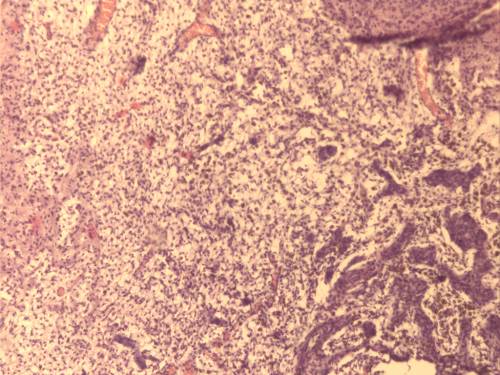
Рисунок 17 – Контрольная группа. 14-е сутки: а – врастание сосудистых петель в очаг повреждения. б – петли новообразованных сосудов пограничной зоны, врастающих в очаг повреждения. Окраска гематоксилином и эозином. Увеличение 200.
На этом фоне в зоне повреждения происходили начальные процессы кистозной дегенерации ткани мозга (рисунок 18).
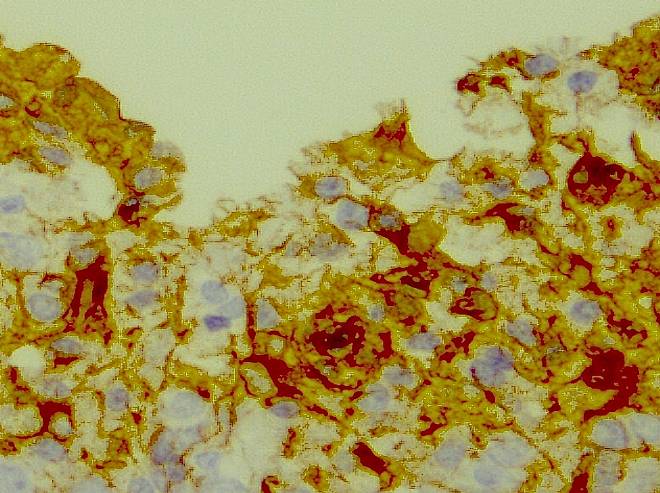
Рисунок 18 – Образование мелких кистовидных полостей в веществе мозга. Иммуногистохимическая реакция. Увеличение 300.
Патологические изменения головного мозга на 21-е сутки исследования.
Макроскопически: участков некроза не обнаружено, признаков воспаления не выявлено, кистозная полость (размерами 0,7х0,8х1,0 см) содержала ксантохромный ликвор. Сохранился дефект ткани размерами около 0,9х0,9 см.
Микроскопически: на 21-е сутки зона некроза была замещена рубцовой тканью cо значительной кистозной дегенерацией мозговой ткани (рисунок 19).
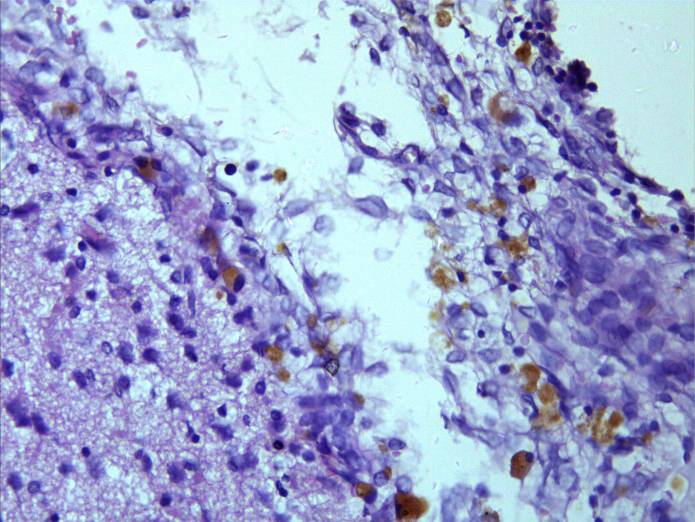
Рисунок 19 – Формирование кист разных размеров в зоне очага повреждения Окраска гематксилином и эозином. Увеличение 300.
На 21-е сутки отмечаено уменьшение интенсивности отека вещества мозга. В незначительном количестве были выявлены клетки, измененные по ишемическому типу, геморрагический компонент минимального уровня был представлен геморрагиями из мелких артерий, вен и капилляров, как диапедезными, так и в результате разрывов их стенок. Определялся гиломезензхимальный рубец с формирование кист разного размера (рисунок 20).
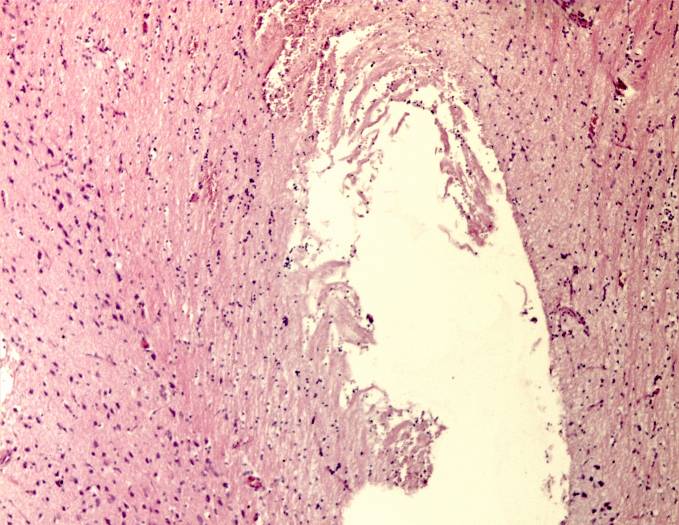
Рисунок 20 – Формирование глиомезенхимальной рубца в зоне очага повреждения. Окраска гематоксилином и эозином. Увеличение 200.
Таким образом, экспериментальное повреждение головного мозга путем искусственного нарушения венозного кровотока характеризуется развитием зоны некроза с последующей резорбцией некротических масс, формированием, начиная с 14-х суток с момента повреждения, глиального рубца и кистозной дегенерацией этой зоны. Характерной особенностью данной модели является развитие отека и выраженные нарушения микрогемоциркуляции с развитием тромбозов, стаза в сосудах и кровоизлияниями разной степени выраженности, что свидетельствует о сложности патогенеза инфаркта в модели очаговых повреждений головного мозга, вызванного нарушением венозного кровотока.
Суммируя полученные результаты, можно констатировать, что мы экспериментально разработали модель ишемического поражения головного мозга у крыс венозного характера путем последовательной коагуляции верхнего сагиттального синуса и корковых вен в левой теменной области, отвечающую условиям цели и задач нашей работы. Об этом, в первую очередь, свидетельствуют клинические проявления в виде возникновения выраженных очаговых неврологических расстройств на фоне тяжелой общемозговой симптоматики с низким уровнем спонтанного восстановления вплоть до 21-х суток.
Во-вторых, получены данные нейровизуализации (МРТ) и гистологические результаты, подтверждающие выключение венозного кровотока в головном мозге и формирование в нем очага повреждения в виде инфаркта с развитием зоны некроза, сопровождающееся выраженным отеком головного мозга в области хирургического вмешательства с последующей резорбцией некротических масс (спустя две недели с момента травмы) и формированием в зоне очага повреждения мозга глиального рубца и выраженной кистозной дегенерации.
На основе полученных экспериментальных данных нами получен патент РФ «Способ моделирования ишемического поражения головного мозга». Патент № 2 432 619 РФ, авторы Ступак В.В., Васильев И.А., Самохин А.Г.
Поэтому созданная модель, сочетающая коагуляцию ВСС с последующей коагуляцией корковых вен головного мозга у крыс в левой теменно-височной области, будет использована в дальнейшей нашей работе.
3.2. Влияние МСК на восстановление неврологических выпадений крыс при экспериментальном очаговом повреждении головного мозга, вызванном нарушением венозного кровотока
Согласно данным литературы трансплантация МСК улучшает восстановление функции головного мозга и умеренно-выраженного неврологического дефицита при экспериментальной окклюзии средней мозговой артерии [13, 14, 63].
Однако возможности клеточной терапии при искусственном ПГМ вследствие нарушения венозного кровотока, выполненного по разработанной нами оригинальной модели, имеющем характер выраженных общемозговых и неврологических расстройств, ранее не оценивались. Поэтому настоящий раздел работы посвящен оценке влияния МСК на восстановление возникающих неврологических выпадений в рамках разработанной нами оригинальной модели формирования нарушения венозного кровотока головного мозга у крыс.
Для этого были проведены исследования на 24-х крысах групп № 3, 4, 5 и 6 серии S2, направленные на изучение сравнения эффективности действия МСК на сформированный очаг венозного нарушения церебрального кровообращения при различных путях доставки клеток и в зависимости от сроков их использования. При исследовании изучалась динамика восстановления неврологических выпадений у животных после местной и внутривенной трансплантации МСК костного мозга на первые и седьмые сутки после моделирования венозных повреждений головного мозга.
Через сутки после хирургического вмешательства у всех животных данных исследовательских групп наблюдалась выраженная однотипная неврологическая симптоматика, которая проявлялась грубым тетрапарезом и повышением тонуса мышц хвоста. Выраженность двигательных расстройств на контрлатеральной стороне была выше и у части животных достигала уровня гемиплегии. Наряду с очаговыми выпадениями у животных имелась выраженная общемозговая симптоматика в виде вялости, сонливости, неспособности к самостоятельному приему пищи. Тяжесть неврологических нарушений у животных групп № 3 и № 4 серии S2, которым внутривенно вводили МСК, на 1-е и 7-е сутки послеоперационного периода была равна соответственно 21,50 ± 0,40
и 22,30 ± 0,60 баллов (рисунок 21). Таким образом, после формирования в головном мозге очага нарушения венозного кровообращения животные данных групп были сопоставимы между собой и с группами контроля № 1 и № 2 серии S2 по тяжести неврологических выпадений и общему состоянию.
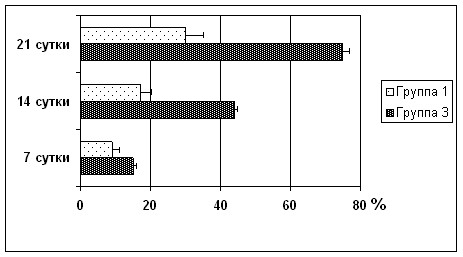
Рисунок 21 – Относительные показатели уменьшения выраженности неврологического дефицита у экспериментальных животных между группами № 1 и № 3 серии S2.
Однако в дальнейшем регресс моторных нарушений в группах с использованием трансплантации клеток был более выраженным по сравнению с первой группой контроля серии S2. Об этом свидетельствовал тот факт, что средний балл ОТНН у животных 3-й группы с внутривенным введением МСК через 1 сутки с момента травмы, на 7-е, 14-е и 21-е сутки был достоверно ниже, чем у животных первой контрольной группы: (18,30 ± 0,50 vs 20,20 ± 0,40, PU=0,001); 12,00 ± 0,70 vs 18,40 ± 0,40, PU=0,002 и 5,50 ± 1,70 vs 15,70 ± 0,30, PU=0,002, соответственно.
Эти различия также ярко проявлялись и при сравнении относительных показателей уменьшения неврологического дефицита в группах исследования по сравнению с контролем. Темп снижения относительного числа случаев неврологического дефицита у животных 3-й группы в 1,5–2,5 раза превышал те же величины контрольной группы (рисунок 21). Так, в 3-й группе исследования относительные показатели неврологического дефицита у животных к 7-м суткам уменьшились на 15,0 ± 2,0 % против 9,0 ± 1,0 % в группе контроля, PU =0,027, к 14-м суткам – на 44,0 ± 3,2 % против 17,0 ± 1,0 % в группе контроля, PU=0,002, а к исходу 3-й недели эти данные снизилась на 75,0 ± 5,0 % против 30,0 ± 2,0 %; PU=0,002. При этом состояние животных к последнему сроку наблюдения в группе 3 соответствовало легким неврологическим повреждениям.
В группе № 4, где МСК вводились крысам в хвостовую вену на 7-е сутки после операции, существенное снижение балла ОТНН по сравнению с контролем регистрировалось на 14-е (13,30 ± 1,20 vs 18,40 ± 0,40; PU=0,003) и 21-е сутки
(9,10 ± 0,90 vs 15,60 ± 0,30; PU=0,002). Однако сумма баллов ОТНН в группе № 4 на 21-е сутки была почти в 2 раза выше, чем в группе № 3 (9,10 ± 0,86 против
5,50 ± 1,10; PU=0,033). То есть регресс неврологического дефицита к концу третьей недели послеоперационного периода у животных 3-й группы был более выраженным, чем в группе 4 (рисунок 22).
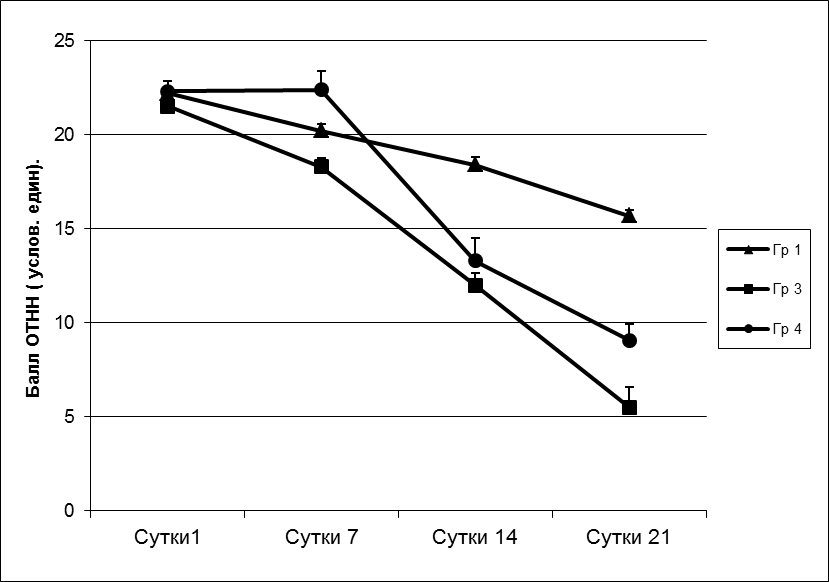
Рисунок. 22 – Влияние внутривенного введения МСК на выраженность неврологических нарушений у животных при экспериментальном очаговом повреждении головного мозга, вызванном нарушением венозного кровообращения. * – PU<0,05 – различия по сравнению с контролем достоверны, # – PU<0,05 – различия между группами достоверны.
Более заметное восстановление животных 3-й группы, по сравнению с группой 4 проявлялось также и в том, что крысы, которым МСК вводили внутривенно на 1-е сутки, быстрее (уже через 2–3 суток после операции) восстанавливали способность к самостоятельному приему пищи.
Анализ неврологического статуса в группах исследования № 5 и № 6 серии S2 с местным введением МСК через полихлорвиниловый катетер в зону очага поражения показал, что на 1-е сутки послеоперационного периода средние значения суммы баллов ОТНН в группе исследования и контроля № 2 той же серии не различались (рисунок 23). В тоже время через 14 суток и на 21-е сутки неврологический дефицит в группах с локальным введением МСК был менее выраженным и состовлял на 14 сутки в группе №5 14,50 ± 1,57 и в группе №6 14,40 ± 1,64 vs 19,40 ± 0,40 в группе контроля. Соответственно на 21-е сутки уровень неврологического дефицита в группе №5 и №6 состовлял 7,20±1,32 и 9,9±0,97 vs 16,50 ± 0,20 в контрольной группе.
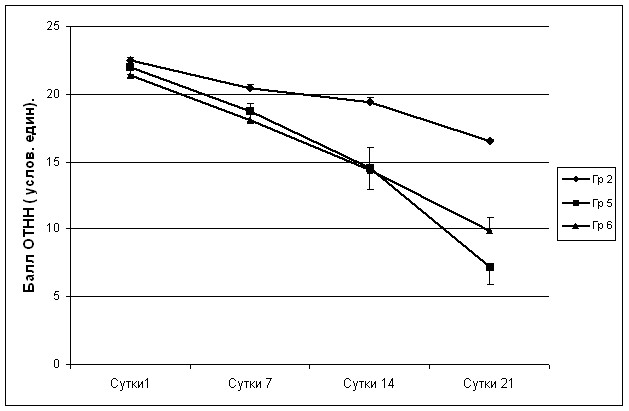
Рисунок 23 – Влияние местного введения МСК на выраженность неврологических нарушений в модели очагового повреждения головного мозга, венозного характера.
* – PU<0,05 – различия по сравнению с контролем достоверны, различия между группами не достоверны.
Дальнейший анализ влияния сроков локального введения МСК на интенсивность неврологического восстановления выявил, что показатели ОТНН в группе животных № 6 на 7-е и 14-е сутки были схожими с таковыми у крыс группы № 5. Однако уменьшение относительного числа случаев неврологических расстройств к 21-м суткам у животных группы № 6 было менее выраженным – 54,0 ± 3,9 % против 68,0 ± 6,0 % у животных 5-й группы; PU=0,04. Как и в группах с внутривенным введением МСК, восстановление к самостоятельному приему пищи у животных 5-й группы с ранним местным введением МСК в очаг поражения регистрировалось раньше, чем у животных группы № 6, где клеточная терапия начиналась лишь на 7-е сутки с момента травмы.
Сравнение результатов локального и системного способов трансплантации клеток показало, что достоверных различий в динамике восстановления неврологического статуса нами зарегистрировано не было (таблица 7). Хотя животные с внутривенным введением МСК (на 1-е сутки) характеризовались тенденцией к более выраженному восстановлению неврологических выпадений на 21-е сутки – по сравнению с группой животных, которым МСК (на 1-е сутки) вводили местно.
Таблица 7 – Балльные оценки тяжести неврологических нарушений у экспериментальных животных серии S2
| Группы | Кол-во животных | Вид хирургических манипуляций | 1-е сутки | 7-е сутки | 14-е сутки | 21-е сутки |
| 3 | 6 | трепанация + моделирование ПГМ с введением МСК на 1-е сутки в/в | 21,50 ± 0,38 | 18,30 ± 0,48 | 12,00 ± 0,65 | 5,50 ± 1,08* |
| 4 | 6 | трепанация + моделирование ПГМ с введением МСК на 7-е сутки в/в | 22,30 ± 0,56 | 22,40 ± 0,99 | 13,30 ± 1,19 | 9,07 ± 0,87 |
| 5 | 6 | трепанация + моделирование ПГМ + установка катетера с введением МСК на 1-е сутки местно | 22,00 ± 0,54 | 18,70 ± 0,89 | 14,50 ± 1,57 | 7,20 ± 1,32 |
| 6 | 6 | трепанация + моделирование ПГМ + установка катетера с введением МСК на 7-е сутки местно | 21,40 ± 0,85 | 18,10 ± 1,25 | 14,40 ± 1,64 | 9,90 ± 0,97 |
| Итого | 24 | |||||
| Примечание: * PU <0,05 – различия между группами № 3 и № 4 достоверны. | ||||||
Полученные нами данные впервые продемонстрировали способность МСК корригировать неврологические нарушения у крыс с грубым неврологическим дефицитом в модели очагового поражения головного мозга, индуцированного нарушением венозного кровотока, характеризующегося низким уровнем спонтанного восстановления. У животных, получивших клеточную терапию, степень неврологического дефицита, по сравнению с группой контроля, снижалась от исходного уровня к окончанию эксперимента более чем в 3 раза – на 54,0–75,0 %. К 21-у дню наблюдения состояние экспериментальных животных после клеточной трансплантации соответствовало уровню легких неврологических расстройств, которые проявлялись сохранением высокого тонуса в мышцах хвоста, отсутствием сгибания конечностей при поднятии животного за хвост. У животных контрольной группы к окончанию эксперимента степень неврологических выпадений снижалось лишь на 14,0–17,0 % и их состояние соответствовало умеренному уровню неврологических расстройств.
Анализ эффективности клеточной терапии в зависимости от сроков введения МСК показал, что эффект клеток, вводимых на первые сутки послеоперационного периода, был статистически значимо выше, чем при введении клеток на 7-е сутки. На примере крыс групп № 3 и № 5 это проявлялось более выраженным снижением тяжести состояния по шкале ОТНН, включая быстрое восстановление животных к самостоятельному приему жидкой пищи и регресс неврологической симптоматики в виде нарастания силы и объема движений в конечностях.
Сравнение двух способов введения клеток не выявило преимуществ местного введения МСК в очаг поражения. Более того, животные с этим путем введения клеток характеризовались тенденцией к менее эффективному восстановлению утраченных функций мозга, по сравнению с группой животных с внутривенным введением. Можно полагать, что само по себе местное введение МСК через установленный катетер является повреждающим воздействием на головной мозг в виде возникающего дополнительного гидродинамического давления при иньекции клеточной суспензии. Кроме этого, неблагоприятные последствия, как нам представляется, могут быть обусловлены и премедикацией животных, проведением в дальнейшем реоперации в виде разведения краев кожной раны, выделением проксимального конца катетера с последующим его удалением и повторным ушиванием раны после введения клеток.
Высокие показатели клинического эффекта, наблюдаемого при внутривенном введении МСК, позволяют предполагать, что в указанные сроки МСК быстрее мигрируют в зону повреждения и для их введения не требуется дополнительной локальной имплантации клеток.
В итоге, экспериментальными исследованиями на крысах с очаговым повреждением головного мозга венозного характера установлено, что для коррекции возникающего неврологического дефицита наиболее технически простым и эффективным является раннее внутривенное введение МСК – на 1-е сутки с момента повреждающего воздействия. Данный путь внутривенной доставки клеток, по сравнению с местным введением, представляется нам более предпочтительным.
3.3. Влияние МСК на электрофизиологическую активность головного мозга в модели очагового нарушения венозного кровообращения
С целью объективизации функционального состояния головного мозга у
22-х оперированных животных, входящих в серию S3 регистрировались корковые ССВП. Серия состояла из 3-х групп: 1) контрольная группа № 1 из 6-и животных, которым проводилась только резекционная трепанация черепа с сохранением целостности твердой мозговой оболочки; 2) группа № 2, где 8-и животным по нашей методике формировали только очаговое нарушение венозного кровообращения головного мозга и исследовали динамику спонтанного восстановления неврологического дефицита; 3) группа № 3, в которой у 8-и крыс после моделирования нарушения церебрального венозного кровообращения по оригинальной методике, на 1-е сутки с момента постановки эксперимента вводили внутривенно МСК.
Регистрация ССВП осуществлялась до проведения ПГМ, через 1-е, 7-е, 14-е и 21-е сутки с момента проведения операции.
Электрофизиологическое обследование интактных животных показало (рисунок 24 а), что наиболее высокоамплитудными (в диапазоне от 9 до 18 мкВ) компонентами регистрируемых ССВП были негативные отклонения с латентностью максимума во временном диапазоне 8,5–11,0 мс. При этом межполушарные различия амплитуд и показателей латентности ССВП в 82 % случаев (18 из 22) не превышали 10 %.
Электрофизиологическое обследование животных группы хирургического контроля № 1 серии S3 после выполнения резекционной трепанации черепа не выявило выраженных изменений показателей ССВП (рисунок 24 б, в).
а 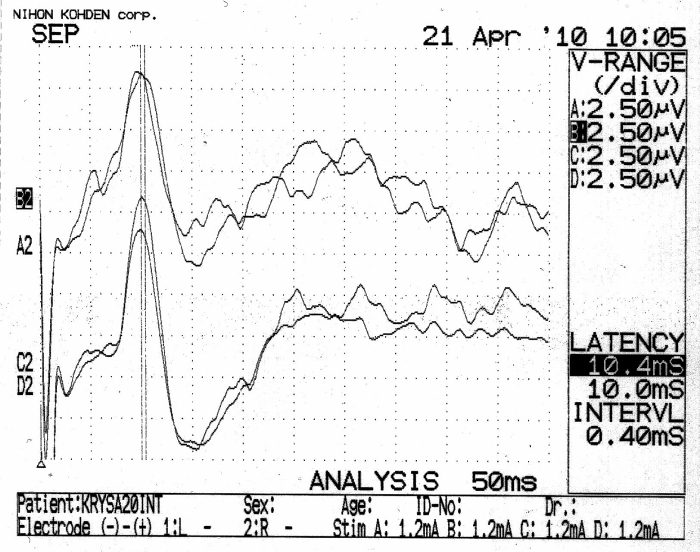 б
б 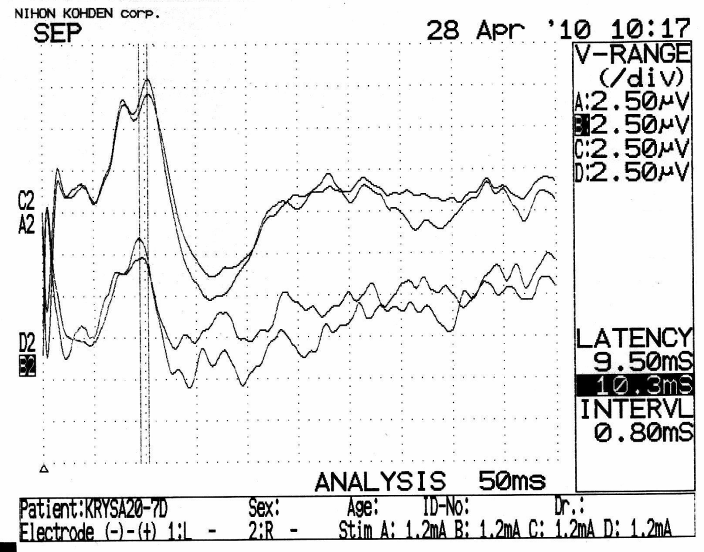
в
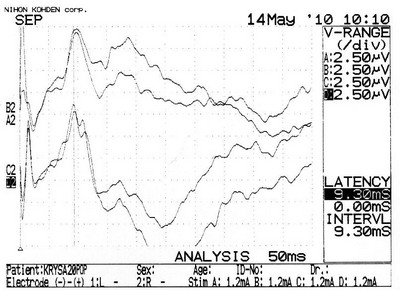

Рисунок 24 – Пример регистрации ССВП у животного № 3 1-ой группы серии S3:
а – ССВП до оперативного вмешательства; б – через 7 суток; в – через 21 сутки после трепанации. Верхние кривые ССВП в оперированном полушарии, нижние – в контрлатеральном полушарии.
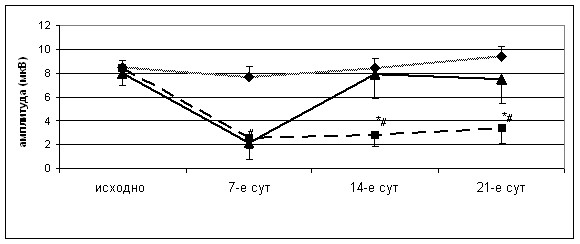
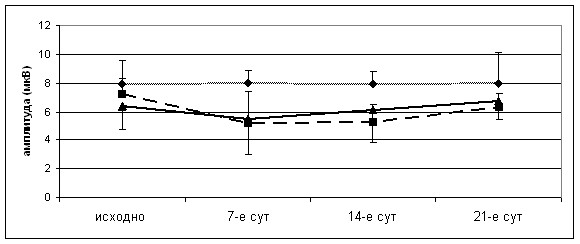
Анализ средних значений амплитуды и латентности потенциалов у животных этой группы показал (рисунок 25), что на 7-е сутки после операции снижение амплитуды ССВП на стороне повреждения является незначительным. При этом задержка ССВП также не отличалась от исходного уровня, составляя 10,20 ± 0,19 мс (до операции 10,10 ± 0,35 мс; p>0,05). К исходу 21-х суток исследуемые показатели ССВП у животных 1-й группы полностью соответствовали исходным значениям (рисунок 24).
а
б
1 группа, 2 группа 3 группа.
Рисунок 25 – Динамика амплитуды ССВП животных серии S3 на поврежденной (а) и интактной (б) сторонах. 1-я группа – резекционная трепанация, 2-я – очаговое повреждение без введения клеток, 3-я – трансплантация МСК. * PU <0,05 – различия между 2-й и 3-й группами, # PU <0,05, – различия между 1-й и 2-й группами достоверны
(U – критерий Манна-Уитни).
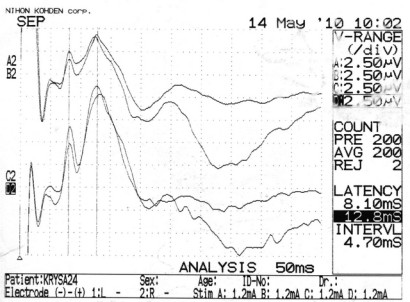
Моделирование очагового повреждения животным группы № 2 сопровождалось у них выраженной неврологической и общемозговой симптоматикой. У большинства особей этой группы (6 из 8-и) при обследовании на 7-е и 14-е сутки регистрировалось статистически значимое снижение амплитуды ССВП на оперированной стороне (в 3–4 раза), которое сохранялось в течение трех недель наблюдения. При этом среднее значение амплитуды ССВП составляло к 21-м суткам 3,40 ± 1,33 мкВ (p<0,05; рисунок 25, 26).
а
 б
б

в
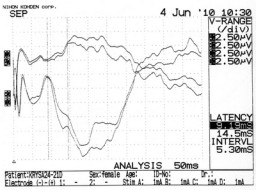

Рисунок 26 – ССВП у животного № 1 2-й группы серии S2: а – ССВП до оперативного вмешательства; б – через 14 суток и в – через 21 сутки после формирования очагового повреждения мозга.
Снижение амплитуды ССВП на поврежденной стороне регистрировалось на 7-е, 14-е и 21-е сутки у всех 8-и животных. Лишь у двух крыс этой группы наблюдалось незначительное спонтанное восстановление амплитуды ССВП
к 21-м суткам.
Кроме того, у 5-и из 8-и животных на 14-е сутки отмечалось снижение ССВП в интактном полушарии (рисунок 25 б), что обусловило тенденцию к снижению средних значений амплитуды ССВП на 14-е (с 7,20 ± 1,19 до 5,30 ± 2,22 мкВ; p>0,05) и 21-е (6,30 ± 0,96 мкВ; p>0,05) сутки. Моделирование очагового повреждения приводило также к увеличению задержки ССВП с 9,20 ± 0,99 мс до 11,00 ± 1,14 мс, p>0,05 (различия не достоверны).
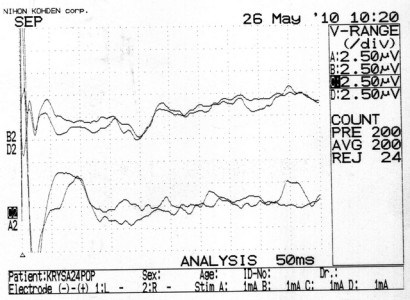
Подобно второй, у животных 3-й группы на 7-е сутки после операции выявлялось выраженное снижение амплитуды ССВП (с 8,00 ± 0,97 до 2,20 ± 1,42 мкВ; p<0,05) и незначительное увеличение задержки основных компонентов ССВП (с 11,20 ± 1,42 до 12,60 ± 1,37 мс; p>0,05) (рисунок 25 а). Однако введение МСК в первые сутки после операции приводило к значимому увеличению амплитуды ССВП к 14-м суткам у большинства особей (6 из 8-и) (рисунок 25 а). К этому сроку среднее значение амплитуды практически не отличалось от исходного показателя (7,90 ± 2,00 мкВ по сравнению с 8,00 ± 0,97 мкВ до операции). В итоге к 21-м суткам у всех животных амплитуды ССВП полностью восстанавливались.
На рисунке 27 представлены ССВП одного из животных третьей группы при наблюдении в динамике на протяжении 21-х суток.
Суммируя полученные данные, можно заключить, что отсутствие выраженных изменений ССВП у животных 1-й группы серии S3 подтверждает сохранность функциональной активности головного мозга при выполнении трепанации.
Формирование локального поражения головного мозга вследствие нарушения венозного кровотока ассоциируется с выраженными изменениями регистрируемых потенциалов в течение всего срока (21 сутки) наблюдения. Наибольшая выраженность изменений ССВП на стороне поражения и незначительность этих изменений на интактной стороне являются дополнительными аргументами в пользу очагового характера моделируемого повреждения. Тем не менее, наличие изменений ССВП в контралатеральном полушарии у 5-и из 8-и животных может отражать тяжесть процесса, обусловливающего у ряда животных вовлечение в патологический процесс интактного полушария.
а 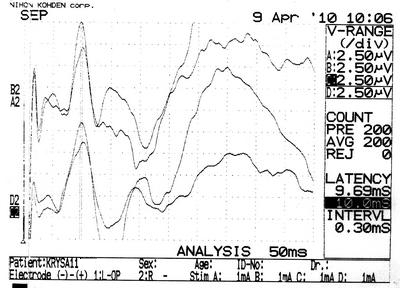 б
б 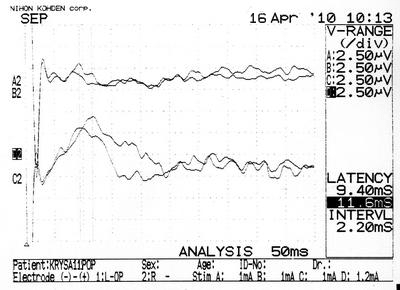
в 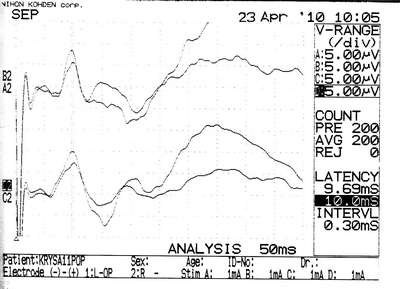 г
г 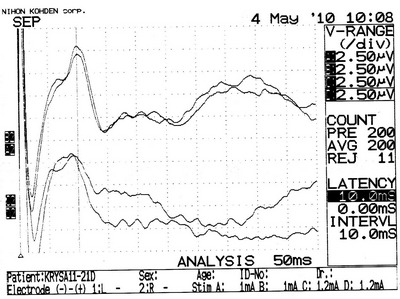
Рисунок 27 – ССВП у животного № 6, 3-й группы серии S3: а – до оперативного вмешательства; б – через 7 суток; в – через 14 суток и г – через 21 сутки после формирования нарушения венозного кровообращения.
Наконец, улучшение показателей ССВП на фоне трансплантации МСК свидетельствует о позитивном эффекте МСК на восстановление функциональной активности головного мозга в виде значительного увеличения амплитуды ССВП к 14-м суткам эксперимента у большинства животных, с полным восстановлением амплитуд к 21-м суткам.
Полученные в данном исследовании результаты свидетельствуют о том, что моделирование локального повреждения головного мозга, обусловленного нарушением венозного кровотока, ассоциируется с изменением электрофизиологической активности головного мозга у экспериментальных животных. Динамика ССВП при самопроизвольном восстановлении и на фоне трансплантации МСК существенно различалась, что свидетельствует, с одной стороны, о невысокой скорости естественного восстановления функционального состояния коры головного мозга в данной модели, а с другой стороны – об эффективности клеточной терапии в коррекции функциональной активности головного мозга при очаговых поражениях. Вышесказанное убеждает в перспективности использования ССВП с целью оценки эффективности клеточной терапии.
3.4. Влияние МСК на характер морфологических изменений в модели очагового повреждения головного мозга, индуцированного нарушением венозного кровотока
Для оценки возможного уровня позитивности механизма МСК на восстановление неврологического дефицита при модельных нарушениях венозного кровотока проведен сравнительный анализ морфологических изменений поврежденного головного мозга в случаях с самопроизвольным его восстановлением (контроль) и с восстановлением, обусловленным трансплантацией МСК.
Согласно данным литературы, механизмы действия трансплантируемых МСК связывают в первую очередь с их паракринными эффектами, направленными на стимуляцию ангио- и нейрогенеза, предупреждение гибели нервных клеток и подавление воспаления [224]. Поэтому морфологические исследования были нацелены на анализ показателей, прямо или косвенно характеризующих эти процессы. В частности, оценивалась объемная плотность формирующихся кровеносных капилляров – как характеристика ангиогенеза, соотношение площади среза кровеносных капилляров к площади среза вен – как косвенный признак деструктивного отека и проницаемости сосудов. При исследовании цитоархитектоники производили подсчет волокнистых астроцитов, фибробластов и макрофагов (характеризующих воспалительный и репаративный процессы).
Изменения головного мозга на 7-е сутки исследования.
Макроскопически: отмечается незначительное пролабирование мозгового вещества в трепанационный дефект.
Микроскопически: в очаге повреждения наблюдается макрофагальная реакция с элиминацией продуктов распада, пролиферация фибробластов, формирование рыхлой соединительной ткани, увеличение астроцитарной глии, внедрение сосудов из демаркационной зоны (рисунок 28).
а 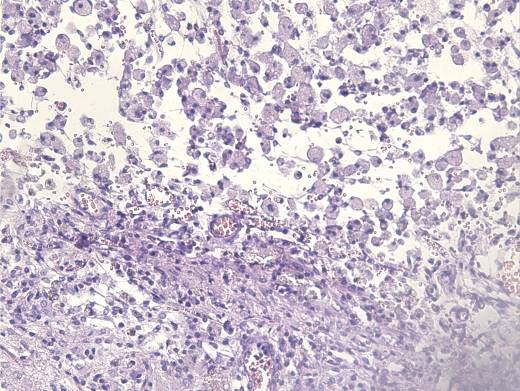 б
б 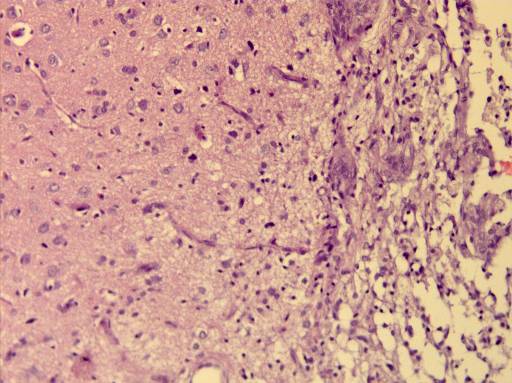
Рисунок 28 – Макрофагальная реакция и начало организации зоны повреждения:
а – элиминация продуктов распада макрофагами; б – формирования рыхлой соединительной ткани с пролиферацией сосудов. Окрашено гематоксилин-эозином. Увеличение 200.
Объемная плотность кровеносных капилляров в площади среза в группе с внутривенным введением МСК на 1-е сутки с момента поражения мозга составляла 24,50 ± 2,70 и достоверно превышала таковую у крыс контрольной группы № 1 серии S2 (16,30 ± 1,40). Объемная плотность кровеносных капилляров в группе с местным введением клеток в очаг поражения мозга на 1-е сутки составляла 19,50 ± 0,30 и также превышала соответствующий показатель в группе контроля. При этом анализируемый показатель в группе с внутривенным введением МСК был достоверно выше (p<0,05), чем при локальном введении клеток в эти же сроки.
Отношение площади среза кровеносных капилляров к площади среза вен (индекс К/В) в группе контроля № 1 серии S2 составило 0,72 ± 0,19, тогда как в группе № 3 с внутривенным введением МСК на 1-е сутки данный показатель был в практически в 2, 5 раза выше и составлял 1,78 ± 0,67 (p<0,05). В то же время введение МСК в зону повреждения головного мозга у животных группы № 5 серии S2 не приводило к возрастанию индекса К/В: данный показатель оставался на уровне контрольной группы – 0,66 ± 0,19.
Абсолютное и относительное количества клеточных элементов демаркационной зоны (на границе с инфарктом) при разных способах введения МСК представлены в таблице 8. Анализ цитоархитектоники этого периода выявил следующие различия.
Таблица 8 – Абсолютное и относительное содержание клеток на границе с инфарктом на 7-е сутки (М ± m), N (%).
| Исследуемый параметр | Контрольная группа | В/в введение МСК (1-е сут, гр. 3) | Локальное введение МСК (1-е сут, гр. 5) |
| Волокнистые астроциты | 12,80 ± 2,29 (21,50 ± 2,90) | 21,70 ± 3,78 (32,60 ± 1,90*) | 10,10 ± 1,22 (18,60 ± 0,10) |
| Фибробласты | 5,00 ± 2,20 (10,14 ± 4,88) | 12,50 ± 3,12 (17,44 ± 1,23*) | 7,12 ± 1,59 (12,33 ± 3,65) |
| Макрофаги | 7,56 ± 3,42 (14,60 ± 2,56) | 8,61 ± 1,52 (15,05 ± 2,59) | 10,84 ± 2,84 (19,70 ± 3,44) |
| Примечание: (N) – численная плотность клеток на 105 мкм2 площади среза зоны; * – отличие величин значений по сравнению с контрольной группой достоверно | |||
Группа животных № 3 серии S2 с внутривенным введением МСК на 1-е сутки характеризовалась достоверно большим содержанием волокнистых астроцитов и фибробластов. Группа № 5 той же серии с местным введением МСК на 1-е сутки не отличалась от контрольной группы по содержанию других клеточных популяций.
Таким образом, внутривенное введение МСК на 1-е сутки повышало интенсивность ангиогенеза, снижало выраженность отека, способствовало более активному формированию рубца и оказывало цитопротективный эффект на 7-е сутки. Аналогичные эффекты при локальном введении МСК на 1-е сутки проявлялись с меньшей степенью выраженности, либо не регистрировались вообще, что могло быть обусловлено по нашему мнению повреждающим действием катетера.
Изменения головного мозга на 14-е сутки исследования.
Макроскопически: на 14-е сутки в области поврежденного головного мозга сформировалась кистозная полость размерами (0,4х0,7х0,9) см, заполненная ликвором, участки некроза не определялись.
Микроскопически: на 14-е сутки в зоне повреждения наблюдалось формирование кистозной полости, ограниченной нежным глиомезенхимальным пролифератом (рисунок 29).
а 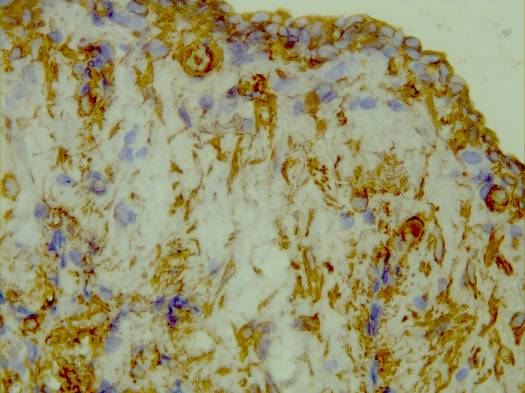 б
б 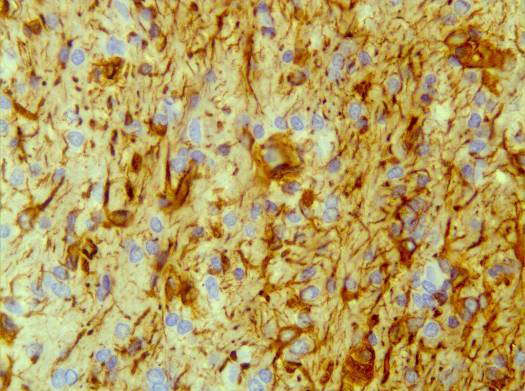
Рисунок 29 – Организация очага повреждения группа № 3 серии S2: а – формирующаяся стенка дна кистозной полости, отграничивающаяся нежной глиомезенхимальной капсулой; б – глиомезенхимальная капсула на границе с очагом повреждения. Иммуногистохимическая реакция. Увеличение 200.
Патологические изменения головного мозга в контрольной группе характеризовались дальнейшей резорбцией некроза и нарастанием репаративных изменений с пролиферацией глиальных элементов, разрастанием фибробластов, интенсивной продукцией аргирофильной волокнистости и нарастанием численной плотности волокнистых астроцитов. Объемная плотность капилляров в зоне среза в этой группе составила 16,90 ± 1,50. В то же время аналогичный показатель в 3-й группе был достоверно выше – 21,60 ± 0,90 (p<0,05). У животных с внутривенным и местным введением МСК на 7-е сутки (группы № 4 и № 6) этот показатель составлял 19,40 ± 1,70 и 17,60 ± 1,90 соответственно; в группе № 5 (с введением МСК в зону повреждения на 1-е сутки) плотность кровеносных капилляров была равной 16,90 ± 2,30 (рисунок 30).
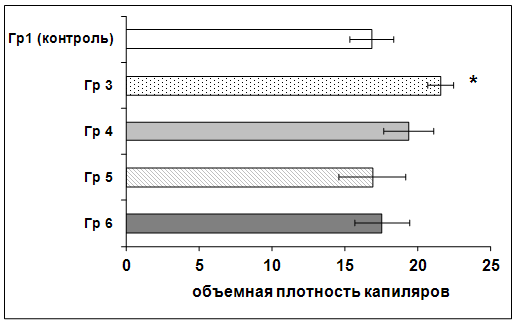
Рисунок 30 – Интенсивность ангиогенеза в группах с трансплантацией МСК и у животных контрольной группы на 14-е сутки. Представлены средние значения и ошибка среднего показателя объемной плотности кровеносных сосудов. * – P<0,05 – различие между группами достоверно.
Отношение площади среза капилляров к площади среза вен в контрольной группе составило 0,76 ± 0,04. В группах № 3 и № 4 индекс К/В был выше (1,20 ± 0,05 и 1,20 ± 0,10). В группах № 5 и № 6 данный показатель составлял соответственно 0,78 ± 0,04 и 0,67 ± 0,03, незначительно отличаясь от уровня в контрольной группе (p<0,05).
Числовые значения клеточных субпопуляций в области принекротической зоны инфаркта представлены в таблице 9.
Таблица 9 – Абсолютное и относительное содержание различных клеток на границе с инфарктом на 14-е сутки (М ± m), N (%)
| Исследуемый параметр | Контрольная группа | В/в ведение МСК (1-е сут, гр. 3) | Местное введение МСК (1-е сут, гр. 5) | В/в введение МСК (7-е сут, гр. 4) | Местное ввдение МСК (7-е сут, гр. 6) |
| Волокнистые астроциты | 14,23 ± 1,18 (23,30 ± 3,55) | 24,22 ± 2,19 (38,30 ± 0,64*) | 12,60 ± 2,31 (21,45 ± 1,44) | 20,70 ± 2,72 (31,74 ± 0,85*) | 14,90 ± 2,85 (24,12 ± 3,42) |
| Фибробласты | 10,23 ± 2,67 (16,35 ± 2,34) | 16,50 ± 2,55 (25,28 ± 2,89) | 11,42 ± 2,49 (17,22 ± 0,26*) | 13,50 ± 1,36 (21,30 ± 0,87*) | 10,84 ± 0,99 (16,47 ± 2,56) |
| Макрофаги | 8,36 ± 2,90 (13,22 ± 1,46) | 4,61 ± 1,47 (9,27 ± 1,83) | 9,93 ± 2,44 (16,83 ± 1,29) | 6,33 ± 0,87 (11,42 ± 3,12) | 8,94 ± 1,49 (13,79 ± 2,38) |
| Примечание: (N) – численная плотность клеток на 105 мкм2 площади среза зоны; * – отличие величин значений между группами достоверно | |||||
Как видно, внутривенное введение МСК как на 1-е, так и на 7-е сутки ассоциировалось с большим относительным содержанием в периинфарктной зоне волокнистых астроцитов и фибробластов. При локальном введении МСК эти эффекты были минимальны.
Изменения головного мозга на 21-е сутки исследования.
Макроскопически: кровоизлияний в полость и признаков воспаления выявлено не было. Умеренно пролабирующая кистозная полость размерами (0,3х0,7х0,8) см прозрачная, имеется четкая граница между зонами интактного и поврежденного головного мозга.
Микроскопически: в зоне повреждения сформировался компактный глиомезодермальный рубец с небольшим количеством кист (рисунок 31).
а 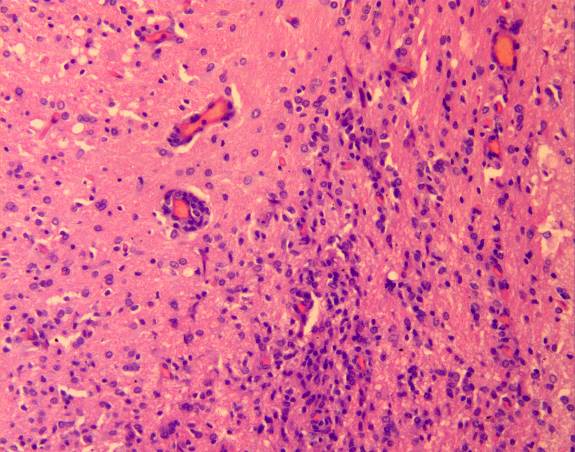 б
б 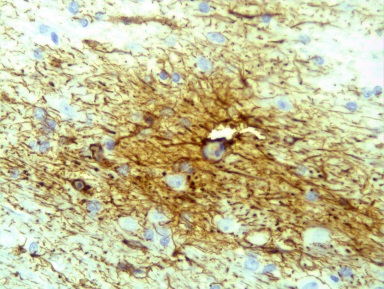
Рисунок. 31 – Морфологические изменения зоны повреждения на 21-е сутки:
а – глиомезодермальный рубец компактного типа. Окраска гематоксилином и эозином. Увеличение 200; б – образование рубца на месте очага повреждения. Иммуногистохимическая реакция. Увеличение 200.
На этой стадии исследования было отмечено уменьшение плотности капиллярных сосудов как в контрольной группе ( 14,96 ± 2,54), так и группах с трансплантацией МСК. Так, данный показатель в 3-й, 4-й, 5-й и 6-й группах составил соответственно 11,40 ± 2,10; 13,90 ± 1,20; 16,80 ± 2,50 и 14,20 ± 3,30. Напротив, индекс соотношения площади среза капилляров к площади среза вен в контрольной группе по сравнению с предшествующим периодом несколько возрос, что свидетельствует о дальнейшем уменьшении отека. При этом существенных различий в индексе К/В между контрольной группой и группами с трансплантацией МСК не наблюдалось. Так, индекс К/В в группе № 3 составлял 0,98 ± 0,20, в группе № 4 – 1,10 ± 1,10, в группе № 5 – 1,30 ± 1,10 и в группе № 6 – 1,20 ± 0,80.
Данные, характеризующие клеточный состав в зоне организации, представлены в таблице 10.
Таблица 10 – Клеточный состав зоны организации на 21-е сутки (М ± m), N (%)
| Исследуемый параметр | Контрольная группа | В/в ведение МСК (1-е сут, гр. 3) | Местное введение МСК (1-е сут, гр. 5) | В/в введение МСК (7-е сут, гр. 4) | Местное ввдение МСК (7-е сут, гр. 6) |
| Волокнистые астроциты | 25,11 ± 0,35 (34,50 ± 2,13) | 35,11 ± 1,69 (41,25 ± 1,24*) | 22,33 ± 1,57 (29,14 ± 1,56) | 29,43 ± 1,97 (38,90 ± 0,66) | 24,93 ± 3,18 (33,85 ± 3,09) |
| Фибробласты | 19,22 ± 1,38 (29,43 ± 2,84) | 28,50 ± 1,25 (35,19 ± 1,30) | 17,92 ± 2,56 (26,38 ± 3,43) | 23,50 ± 1,36 (32,84 ± 1,19) | 18,02 ± 1,25 (27,43 ± 1,38) |
| Макрофаги | 4,22 ± 1,82 (9,02 ± 1,67) | 1,21 ± 1,74* (2,89 ± 0,96)* | 5,86 ± 1,66 (10,56 ± 2,23) | 2,11 ± 1,97* (4,32 ± 2,27)* | 4,19 ± 2,68 (8,11 ± 1,67) |
| Примечание: (N) – численная плотность клеток на 105 мкм2 площади среза зоны; * – отличие величин значений между группами достоверно | |||||

