Глиомезодермальный рубец состоял из волокнистых астроцитов (рисунок 32) и фибробластов. Количество макрофагов снижено.
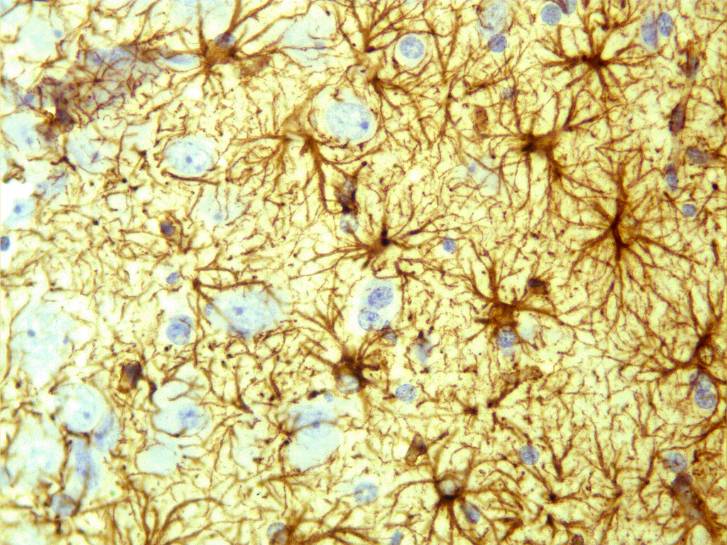
Рисунок 32 – Группа №3, серии S2. Пролиферация астроглии в перифокальной зоне очага. Иммуногистохимическая реакция. Увеличение 200.
Введение МСК на 1-е сутки приводит к более эффективному очищению очага повреждения и формированию компактного глиомезенхимального рубца с менее выраженной кистозной дегенерацией к 21-м суткам. Зона повреждения замещена глиомезенхимальными структурами.
При местном введении МСК подобных различий не было выявлено. Таким образом, исследование цитоархитектоники головного мозга у животных с внутривенной трансплантацией МСК свидетельствует о меньшей интенсивности воспалительного процесса и более эффективной репарации к 21-м суткам.
Полученные результаты позволяют утверждать, что моделирование повреждений головного мозга путем коагуляции верхнего сагиттального синуса в средней трети и последующая коагуляция венозных корковых сосудов приводят к развитию инфаркта по смешанному типу с резорбцией некротической ткани и формированию глиального рубца с выраженной кистозной дегенерацией. Причиной развития некроза в разработанной модели является нарушение мозгового кровотока, которое морфологически проявляется выраженными нарушения микрогемоциркуляции с тромбозом, стазами в сосудах и кровоизлияниями разной степени выраженности.
Отслеживание динамики изменений в процессе исследований показало, что введение МСК в остром периоде первой некротической стадии улучшает в последующем состояние микроциркуляции, о чем свидетельствовала большая плотность кровеносных капилляров к 7-м суткам у исследуемых животных по сравнению с группой контроля. Причем внутривенное введение МСК приводило к возрастанию данного показателя в 1,5 раза, тогда как непосредственное введение клеток в зону поражения через катетер – только в 1,2 раза. На 14-е сутки объемная плотность кровеносных сосудов в группе с внутривенным (на 1-е сутки) введением МСК также превышала данный показатель в контрольной группе.
Другой характерной особенностью патологических изменений при транспланатации МСК были более высокие показатели отношения площади среза кровеносных капилляров к площади среза вен на 7-е сутки (группа № 3), по сравнению с контрольной группой, что указывало на уменьшение деструктивного отека и сосудистой проницаемости на фоне внутривенного введения МСК.
Начиная с 7-х суток помимо резорбции некротических масс, отмечалось нарастание репаративных процессов с пролиферацией глиальных элементов и фибробластов. Сравнение количественных параметров клеточных элементов мозга, участвующих в процессе организации зоны повреждения, показало, что эффект трансплантации МСК, особенно при внутривенном режиме введения, характеризовался на 7-е и 14-е сутки нарастанием клеточной массы, прежде всего волокнистых астроцитов, и фибробластов, непосредственно участвующих в формировании рубцовой ткани. Количество этих клеток особенно интенсивно нарастало и преобладало в группе № 3, достигая максимума на 21-й день исследования и превышая соответствующий показатель для клеток астроцитарного ряда в контроле в 1,6 раза. Схожие закономерности наблюдались и у животных с внутривенным введением МСК на 7-е сутки. Отсутствие подобных закономерностей при введении МСК в зону повреждения объясняется, по-видимому, непосредственным травмирующим воздействием катетера, что, скорее всего, и являлось причиной активации процессов альтерации, поддержания воспаления и менее эффективной репарации, в частности замедления организации тканевых структур.
Введение МСК в первые сутки, возможно, решает проблему ограничения очага поражения и размеров принекротической зоны в сторону ее уменьшения (через подавление воспалительного процесса), что ускоряет процесс резорбции некротических масс, улучшает метаболические, и репаративные процессы тканей мозга, а так же дает основание для благоприятного прогноза. Кроме того, введение МСК на 1-е сутки позволяет добиться более раннего и эффективного усиления ангиогенеза. В свою очередь, введение МСК в подостром периоде (на
7-е сутки) оказывает стимулирующий эффект на процесс организации поврежденной нервной ткани, снижает выраженность дистрофических изменений и возможно, ограничивает воспалительный ответ на этапе организации поврежденной ткани.
ЗАКЛЮЧЕНИЕ
Цереброваскулярная патология вследствие нарушения венозного кровотока представляет серьезную проблему в связи со сложностью диагностики, недостаточной изученностью патогенеза и отсутствием эффективных методов лечения. При хирургическом удалении ПСМ, особенно локализованных в средней трети ВСС, нарушения венозного кровотока, которые приводят к развитию венозного инфаркта и сопровождаются выраженным неврологическим дефицитом, регистрируются приблизительно в 50 % случаев. Причем половина этих пациентов так и не восстанавливается полностью даже после реабилитационной терапии [15].
Поэтому разработка новых методов лечения цереброваскулярных расстройств продолжает оставаться насущной проблемой, и сегодня большие надежды возлагаются на клеточную терапию. Действительно, многочисленные экспериментальные исследования показали способность различных типов стволовых клеток улучшать неврологический статус в модели ишемического инсульта [85, 90, 113, 123, 235]. Однако вопрос о терапевтической эффективности клеточной терапии при нарушениях венозного кровотока остается открытым в силу отсутствия адекватных экспериментальных моделей данной патологии.
С этой точки зрения разработка новой модели повреждения головного мозга вследствие нарушения венозного кровотока является важным результатом настоящей работы и имеет несомненное научно-практическое значение.
Суть разработанного нами нового способа заключается в последовательной коагуляции и пересечении ВСС с последующей коагуляцией корковых вен в левой теменно-височной области. Данное хирургическое вмешательство приводит к выключению венозного кровотока в головном мозге и формированию в нем очага повреждения, что подтверждается данными МР-томограмм, полученных при помощи импульсных последовательностей FISP и RARE в аксиальных и коронарных плоскостях и на реконструированных объемных церебральных МР-ангиограммах. Разработанный способ (что подтверждено МРТ-изображениями) обеспечивает выключение кровотока по синусам твердой мозговой оболочки и венам головного мозга, сохраняющееся до 23-х суток. При этом кровоток по экстра- и интракраниальным артериям сохраняется. Это сопровождается развитием в области хирургического вмешательства выраженного отека головного мозга, прилежащего к коагулированным участкам синуса и пролабирующего в трепанационное отверстие, с последующим (спустя две недели с момента травмы) формированием интрацеребральной ликворной кисты в зоне очага повреждения мозга на фоне сохраняющегося его отека.
По данным гистологичекого исследования данный тип моделирования нарушения венозного церебрального кровотока приводит к развитию инфаркта головного мозга с формированием зоны некроза с последующей резорбцией некротических масс, формированием начиная с 14-х суток с момента повреждения глиального рубца и кистозной дегенерацией этой зоны. Характерной особенностью данной модели является развитие отека и выраженных нарушений микрогемоциркуляции с развитием тромбозов, стаза в сосудах и кровоизлияний разной степени выраженности.
Формирование очагового повреждения мозга клинически проявляется возникновением выраженных неврологических расстройств: на фоне тяжелой общемозговой симптоматики возникают грубые очаговые расстройства в виде параплегий на гетеролатеральной стороне от повреждения и грубых парезов на гомолатеральной стороне. Неврологические выпадения в разработанной модели носят характер тяжелого неврологического дефицита и характеризуется низким уровнем спонтанного восстановления вплоть до 21-х суток с момента повреждения мозга в отличие от большинства моделей окклюзии среднемозговой артерии.
Согласно данным литературы основным подходом при экспериментальном моделировании нарушений венозного кровотока является окклюзия ВСС, индуцированная путем лигирования венозного синуса, введения тромбогенного материала, эмболизации или индукции тромбоза с помощью FeCl3 или фотохимической обработки [86, 111, 129, 194]. Однако эти подходы имеют ряд недостатков, что обусловлено гибелью животных вследствие разрушения структуры синуса, низкой воспроизводимостью модели, серьезными осложнениями в результате повреждения ткани мозга и сосудов, высокой скоростью перфузии эмболов (в случае эмболизации) и большими материальными и временными затратами [159, 201], что ограничивает возможность использования данных моделей. Проблемой является также частичная реканализация тромбированного синуса.
С этой точки зрения разработанная нами модель очагового повреждения головного мозга имеет ряд преимуществ (тяжесть неврологического дефицита, низкий уровень самопроизвольного восстановления), что в наибольшей степени приближает его симптоматику к патогенезу осложнений, наблюдаемых при удалении ПСМ.
Вторым важным результатом, полученным в настоящем исследовании, являются данные о безопасности и терапевтической эффективности МСК в коррекции неврологических нарушений в рамках разработанной модели. Проведенные нами исследования, по сути, впервые позволили охарактеризовать влияние различных способов трансплантации МСК на восстановление неврологического дефицита, обусловленного нарушением венозного кровотока в головном мозге. Согласно полученным данным, внутривенное и местное введение МСК в остром (на 1-е сутки) и подостром (на 7-е сутки) периодах является безопасным, не вызывает каких-либо серьезных осложнений или побочных реакций и приводит к более эффективному восстановлению неврологических функций у экспериментальных животных по сравнению с животными контрольных групп. Как показали наши исследования, более выраженное неврологическое восстановление на фоне трансплантации МСК обусловлено регрессом двигательных и чувствительных нарушений и максимально проявляется при внутривенном введение клеток на 1-е сутки после формирования модели.
Позитивный эффект клеточной терапии на основе МСК наиболее хорошо исследован в модели ишемического инсульта и проявляется усилением двигательной активности, улучшением поведенческих реакций и когнитивных функций животных [89, 226, 228]. Исследования на модели ишемического инсульта также показали, что восстановление неврологического дефицита наблюдается как при интрацеребральном/внутрижелудочковом, так и при внутрисосудистом введении клеток [165, 227, 234], причем в ряде исследований эффективность при внутривенном введении клеток превышает таковую при интрацеребральной их имплантации [167]. Кроме того, было показано, что клиническое и морфологическое улучшение выявляются как при введении клеток в ранние сроки (на 1–2-е сутки после окклюзии среднемозговой артерии), соответствующие острому периоду, так и в более поздние сроки, соответствующие подострому – через 1 неделю и отдаленному (через 1 месяц после повреждения мозга) периодам [141, 163, 230]. Эти данные во многом согласуются с полученными нами результатами. При этом нами впервые показана способность МСК купировать грубый стойкий неврологический дефицит, обусловленный нарушением венозного кровотока.
Объективизацией позитивного эффекта МСК в разработанной модели являются данные нейрофизиологического обследования. Так, если животные контрольных групп характеризовались выраженным снижением амплитуды ССВП на протяжении всего послеоперационного периода (что свидетельствовало о стойком нарушении функциональной активности головного мозга), то у животных с трансплантацией МСК отмечалась положительная динамика в виде частичного восстановления амплитуды ССВП уже на 14-е сутки и полного восстановление – на 21-е сутки.
Следует отметить, что клинический эффект МСК проявлялся достаточно быстро. Так, улучшение неврологического восстановления в группах животных с введением МСК на 1-е сутки послеоперационного периода наблюдалось уже на 7–14-е сутки, и, следовательно, не могло быть связано с «заместительным» эффектом вследствие дифференцировки МСК в нервные клетки. То есть эффект МСК был, скорее всего, обусловлен паракринными эффектами вводимых клеток. Действительно, рядом авторов в модели ишемического инсульта было показано, что быстро развивающийся эффект клеточной терапии может наблюдаться даже в отсутствии интеграции вводимых клеток в зоне повреждения и обусловлен анти-апоптотическим действием МСК, что проявляется уменьшением размера зоны инфаркта [230], активацией ангио-, нейро- и синаптогенеза, ремоделированием (уменьшением рубцовой ткани) [90, 106, 114, 141, 163, 165], а также подавлением воспалительного ответа [97]. Это объясняется способностью МСК продуцировать широкий набора факторов, обладающих нейропротективным эффектом, а также стимулирующих ангио- и нейрогенез [100, 238]. Кроме того, МСК, обладая противовоспалительной, иммуномодулирующей и антифибротической активностями, способны подавлять воспаление (в том числе за счет восстановления ГЭБ) и обеспечивать ремоделирование внеклеточного матрикса [95, 207, 224].
Исследование морфологических изменений головного мозга животных в разработанной модели продемонстрировало, что животные с внутривенным введением МСК отличались от контрольных животных более высокими показателями плотности кровеносных капилляров, отношения площади капилляров к площади вен. Полученные в целом данные свидетельствуют об эффективности МСК в коррекции неврологического дефицита, индуцированного нарушением церебрального венозного кровотока, и обосновывают перспективность дальнейшего развития клеточных технологий в лечении цереброваскулярной патологии.
ВЫВОДЫ
1. Разработана новая эксперементальная модель очагового повреждения головного мозга крыс путем коагуляции верхнего сагиттального синуса с последующей коагуляцией корковых вен в левой теменно-височной области, ведущей к нарушению венозного кровообращения, что проявляется в остром периоде нарушением кровообращения венозного характера в виде тяжелого неврологического дефицита с доминированием очаговых расстройств, сочетающихся с общемозговой симптоматикой, и характеризуется низким уровнем спонтанного восстановления.
2. Повреждение головного мозга в разработанной модели характеризуется по данным МРТ формированием зоны отека с последующим образованием интрацеребральной кистозной полости, а по данным гистологического исследования – формированием зоны некроза на фоне нарушений микроциркуяции (развитие тромбозов, стаза и кровоизлияний) с последующей резорбцией некротических масс и формированием глиального рубца с выраженной кистозной дегенерацией.
3. Трансплантация МСК в количестве 2х106 клеток на одно животное, как при внутривенном, так и местном их введении, приводит к достоверному снижению тяжести неврологического дефицита, при этом наиболее выраженный эффект МСК регистрируется при использовании внутривенного введения клеток на 1-е сутки после формирования очага нарушения венозного кровотока.
4. В отличие от контрольных животных, состояние которых характеризуется выраженным снижением амплитуды ССВП на протяжении всего послеоперационного периода, животные с трансплантацией МСК отличаются положительной динамикой ССВП на 14-е сутки и полным восстановлением электрофизиологической активности к 21-м суткам. Это подтверждает низкую эффективность спонтанного восстановления функции головного мозга в рамках разработанной модели и свидетельствует об эффективности клеточной терапии.
5. Морфологические изменения головного мозга у животных с внутривенной трансплантацией МСК по сравнению с контрольной группой характеризуются более выраженной активацией ангиогенеза, меньшей выраженности отека, быстрой санацией участков мозга с формированием глиомезедермального рубца.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Разработанная экспериментально модель тяжелого очагового поражения головного мозга венозного характера является основой изучения патогенеза венозных нарушений головного мозга и позволяет исследовать эффективность различных фармакологических и клеточных технологий восстановления утраченных функций мозга при данной патологии.
Отсутствие осложнений и положительный эффект МСК на морфо-функциональное восстановление головного мозга у экспериментальных животных в оригинальной модели ишемического поражения головного мозга является основанием для дальнейших экспериментальных исследований и клинической апробации МСК в нейрохирургической практике.
Исследования ССВП и МРТ головного мозга, наряду с клиническими данными, являются объективными методами, подтверждающими эффективность морфо-функционального восстановления очаговых повреждений головного мозга, и могут быть использованы для мониторирования эффектов клеточной терапии.
СПИСОК СОКРАЩЕНИЙ
ВСС Верхний сагиттальный синус
ГИШ Глобальная ишемия мозга
ГСК Гемопоэтические стволовые клетки
ГЭБ Гематоэнцефалический барьер
ИГМ Ишемия головного мозга
К/В Капилляры к площади среза вен
МРТ Магнитно-резонансная томография
МСК Мезенхимальные стромальные клетки
ОТНН Оценка тяжести неврологических нарушений
ПГМ Поражение головного мозга
ПСМ Парасагиттальная менингиома
СК Стволовые клетки
СМА Средняя мозговая артерия
ССВП Сомато-сенсорные вызванные потенциалы
ЦНС Центральная нервная система
ЭП Эндотелиальные предшественники
PU критерий Манна-Уитни для независимых выборок
PКЗ критерий знаков для зависимых выборок
S1, S2, S3, S4 Серия 1, Серия 2, Серия 3, Серия 4
vs Versus – против
СПИСОК ЛИТЕРАТУРЫ
- Акопян, Ж. А. Функциональная активность эндотелиальных, мезенхимальных и циркулирующих прогениторных клеток при повышенной концентрации глюкозы in vitro и гипергликемии у больных сахарным диабетом : автореф. дис. … канд. мед. наук : 03.01.04 : 03.03.04 / Ж. А. Акопян. – Москва, 2012. – 25 с.
- Арутюнов, А. И. Строение и функция стабилизирующих конструкций мозговых артерий в свете патогенеза спазма артерий после разрыва аневризм (второе сообщение) / А. И. Арутюнов, М. А. Барон, Н. А. Майорова // Вопр. нейрохирургии. – 1973. – № 3. – С. 3–10.
- Бабенков, Н. В. Нарушения венозного кровообращения мозга: патогенез, клиника, течение, диагностика (обзор литературы) / Н. В. Бабенков // Журн. невропатологии и психиатрии им. С. С. Корсакова. – 1984. – Т. 84, № 2. – С. 281–288.
- Багметов, М. Н. Церебропротекторное действие композиций фенибута и фенотропила и их солей в условиях экспериментальной ишемии головного мозга : автореф. дис. … канд. мед. наук: 14.00.25 / М. Н. Багметов. – Волгоград, 2006. – 25 с.
- Балязин, В. А. Итоги хирургического лечения внутричерепных менингитом за 40 лет / В. А. Балязин, Э. С. Темиров // Вопр. нейрохирургии. – 1999. – № 4. – С. 20–25.
- Бердичевский, М. Я. Венозная дисциркуляторная патология головного мозга / М. Я. Бердичевский. – Москва : Медицина, 1989. – 224 с.
- Беставишвили, Ф. И. Неврологическая симптоматика при парасагиттальных менингиомах в связи с нарушением венозного кровообращения / Ф. И. Беставишвили // Журн. неврологии и психиатрии. – 1995. – Т. 95, № 6. – С. 10–15.
- Бестаев, Ф. И. Нарушение венозного кровотока при парасагиттальных менингиомах во время операции : автореф. дис. … канд. мед. наук: 14.00.28. / Ф. И. Бестаев. – Москва, 1989. – 23 с.
- Большаков, О. П. О значении пульсовых колебаний внутренней сонной артерии для венозного кровотока в пазухах твердой мозговой оболочки / О. П. Большаков // Механизмы нейро-гуморальной регуляции вегетативных функций. – Ленинград : Наука, Ленингр. отд-ние, 1970. – С. 12–17.
- Большой сальник: анатомия, физиология, патология, хирургия, исторический очерк : руководство : пер. с англ. / Р. Аусфилд [и др.] ; под ред. Д. Либерманн-Меффет, Х. Уайта. – Москва : Медицина, 1989. – 335 с.
- Вальдман, В. А. Заболевания венозной сосудистой системы / В. А. Вальдман. – Ленинград : Медицина, Ленингр. отд-ние, 1967. – 142 с.
- Верещагин, Н. В. К морфологии и патогенезу патологической извитости и перегибов внутренних сонных и позвоночных артерий / Н. В. Верещагин, А. Н. Колтовер // Арх. патологии. – 1966. – № 12. – С. 11–16.
- Влияние сроков трансплантации мезенхимных стволовых клеток на репарацию сердечной мышцы крыс после инфаркта / П. В. Кругляков [и др.] // Цитология. – 2005. – Т. 47, № 5. – С. 404–416.
- Возможности применения клеточной терапии при лечении ишемического инсульта в эксперименте / И. Б. Соколова [и др.] // Клеточная трансплантология и тканевая инженерия. – 2007. – Т. 11, № 4. – С. 54–62.
- Габибов, Г. А. Парасагиттальные менингиомы и их хирургическое лечение / Г. А. Габибов. – Москва : Медицина, 1975. – 231 с.
- Габибов, Г. А. Принципы хирургии парасагиттальных менингиом: современное состояние проблемы / Г. А. Габибов, А. В. Козлов // Вопр. нейрохирургии. – 1994. – № 1. – С. 3–7.
- Глебов, М. В. Тромбозы церебральных венозных синусов / М. В. Глебов [и др.] // Анналы клинич. и эксперим. неврологии. – 2011. – Т. 5, № 1. – С. 4–10.
- Гнездицкий, В.В. Вызванные потенциалы мозга в клинической практике / В.В. Гнездицкий. – Таганрог: Издательство ТРТУ, 1997. – 252 с.
- Гусев, Е. И. Ишемия головного мозга / Е. И. Гусев, В. И. Скворцова. – Москва : Медицина, 2001. – 327 с.
- Диагностика и хирургическое лечение парасагиттальных менингиом : метод. рекомендации / сост.: Г. С. Тиглиев [и др.]. – Ленинград : Изд-во ЛНХИ им. А. Л. Поленова, 1989. – 13 с.
- Диагностика и этапное лечение дистонических венозных энцефалопатий : метод. рекомендации / сост.: М. Я. Бердичевский [и др.] ; Кубан. мед. ин-т им. Красной Армии, Соч. науч.-исслед. ин-т курортологии и физиотерапии. – Краснодар, 1981. – 22 с.
- Иванов, А. Ю. Нарушения венозного оттока от головного мозга у больных сосудистой и нейроонкологической патологией : автореф. дис. … д-ра мед. наук : 14.01.18: 14.03.03 / А. Ю. Иванов. – Санкт-Петербург, 2011. – 38 с.
- Исмагилов, М. Ф. Ишемический мозговой инсульт: терминология, эпидемиология, принципы диагностики, патогенетические подтипы, терапия острого периода заболевания / М. Ф. Исмагилов // Неврол. вестн. – 2005. – Т. 37, вып. 1/2. – С. 67–76.
- К вопросу клинико-неврологической характеристики инсультов / Л. М. Тибекина [и др.] // Вестн. Санкт-Петерб. ун-та. Сер. 11, Медицина. – 2009. – № 3. – С. 174–179.
- Камалова, Г. М. Диагностика менингиом полушарий большого мозга на догоспитальном этапе / Г. М. Камалова // Журн. неврологии и психиатрии. – 1997. – Т. 97, № 12. – С. 51–53.
- Канарейкин, К. Ф. Нарушения венозного кровообращения / К. Ф. Канарейкин // Сосудистые заболевания нервной системы. – Москва : Медицина, 1975. – С. 437–449.
- Клосовский, Б. Н. Циркуляция крови в мозгу / Б. Н. Клоссовский. – Москва : Медгиз, 1951. – 372 с.
- Козлов, А. В. Результаты хирургического лечения внутричерепных менингиом (продолженный рост и прогнозирование) : автореф. дис. … канд. мед. наук: 14.00.28 / А. В. Козлов. – Москва, 1988. – 24 с.
- Коновалов, А. Н. Клиника и микрохирургическое лечение менингиом блюменбахова ската / А. Н. Коновалов, У. Б. Махмудов // Вопр. нейрохирургии. – 1986. – № 1. – С. 3–13.
- Космарская, Е. Н. К вопросу о коллатериальном кровообращении в мозгу / Е. Н. Космарская // Журн. невропатологии и психиатрии. – 1953. – Т. 53, № 9. – С. 702–707.
- Кулеша, Г. Б. К вопросу о нарушениях венозного кровообращения в мозгу / Г. Б. Кулеша // Материалы научных работ по невропатологии и психиатрии. – Краснодар, 1966. – С. 79–80.
- Литвиненко, Д. В. Венозное кровообращение головного мозга при травматических дефектах черепа : автореф. дис. … канд. мед. наук: 14.00.28 / Д. В. Литвиненко. – Санкт-Петербург, 2006. – 21 с.
- Микрохирургическая реваскуляризация очагов ишемии головного мозга аутотрансплантатом большого сальника / Г. С. Тиглиев [и др.] // Вопр. нейрохирургии. – 1994, № 3. – С. 34–35.
- Минакина, Л. Н. Нейропротекторный эффект циклопентиладенозина при глобальной ишемии головного мозга у мышей / Л.Н. Минакина // Фундаментальные исследования. – 2008. –№9. – С60–61.
- Минакина, Л. Н. Моделирование глобальной ишемии головного мозга / Л. Н. Минакина // Успехи соврем. естествознания. – 2008. – № 12. – С. 53–54.
- Моделирование церебральной ишемии посредством коагуляции средней мозговой артерии у крыс / А. И. Трофименко [и др.] // Фундам. исследования. – 2012. – № 2. – С. 215–218.
- Можаев, С. В. Хирургия менингиом верхнего сагиттального синуса (реконструктивные и реваскуляризирующие операции) : дис. … д-ра мед. наук : 14.00.28 / С. В. Можаев. – Санкт-Петербург, 1993. – 340 с.
- Москаленко, Ю. Е. О роли внутричерепных вен в механизме регуляции мозгового кровотока / Ю. Е. Москаленко, Г. Б. Вайнштейн // Труды Международного симпозиума по регуляции емкостных сосудов. – Москва : Медицина, 1977. – С. 120–129.
- Москаленко, Ю.Е. Внутричерепная гемодинамика. Биофизические аспекты / Ю. Е. Москаленко, Г. Б. Вайнштейн, И. Т. Демченко. – Ленинград : Наука, Ленингр. отд-ние, 1975. – 202 с.
- Нарушение венозного оттока из головы при непроходимости верхней полой вены / А. А. Вишневский [и др.] // Венозная патология головного и спинного мозга : (тез. докл. к всерос. науч.-практ. конф.). – Краснодар, 1979. – С. 176–178.
- Нарушения интракраниального венозного кровообращения при менингиомах парасагиттальной локации / Г. Г. Музлаев [и др.] // Материалы III съезда нейрохирургов России. – Санкт-Петербург, 2002. – С. 146–147.
- Неймарк, Е. З. К дифференциальной диагностике венозных инсультов / Е. З. Неймарк // Дифференцированное применение психотропных средств в психиатрии и неврологии. Диагностика, клиника и лечение инсультов : материалы Респ. конф. психиатров и невропатологов, июнь, 1971 г. – Львов, 1971. – С. 357–360.
- Неймарк, Е. З. Тромбозы внутричерепных синусов и вен / Е. З. Неймарк. – Москва : Медицина, 1975. – 184 с.
- Некоторые итоги и перспективы хирургического лечения околоселлярных менингиом с применением микрохирургической техники / А. Н. Коновалов [и др.] // Опухоли головного мозга. – Москва, 1975. – С. 130–136.
- Неодимовый лазер в хирургии церебральных менингиом / В. В. Ступак, С. Г. Струц, М. А.Садовой, А. П. Майоров. – Новосибирск : Наука, 2013. – 267 с.
- Нестеров, Л. Н. Регионарно-церебральные и системные нарушения гемодинамики при опухолях головного мозга / Л. Н. Нестеров, Ю. И. Кравцов, А. Н. Богданов // Вопр. нейрохирургии. – 1978. – № 2. – С. 19–24.
- Никифоров, Б. М. Опухоли головного мозга / Б. М. Никифоров, Д. Е. Мацко. – Санкт-Петербург [и др.] : Питер, 2003. – 311 с. – (Краткое руководство).
- Паносян, А. Г. Диагностика и лечение менингиом фалькс– тенториального угла : автореф. дис. … канд. мед. наук : 14.00.28 / А. Г. Паносян. – Москва, 1987. – 23 с.
- Петрова, О. А. Комплексная реабилитация больных в раннем восстановительном периоде ишемического мозгового инсульта в амбулаторно-поликлинических условиях : дис.... канд. мед. наук : 14.00.13 / О. А. Петрова. – Екатеринбург, 2005. – 187 с.
- Покалев, Г. М. Нейроциркуляторные дистонии / Г. М. Покалев, В. Д. Трошин. – Горький : Волго-Вят. кн. изд-во, 1977. – 319 с.
- Регуляция мозгового кровообращения : тр. IV Тбил. симп. по мозговому кровообращению, 19–21 апр. 1978 г. / общ. ред. Г.И. Мчедлишвили. – Тбилиси : Мецниереба, 1980. – 158 с.
- Рыжий, А. В. Нарушения церебрального венозного кровообращения при опухолях головного мозга супра- субтенториальной локализации : дис. … канд. мед. наук. : 14.00.28 / А. В. Рыжий. – Санкт-Петербург, 2004. – 143 с.
- Рясина, Т. В. Последствия выключения стриарных вен (экспериментально–морфологическое исследование) / Т. В. Рясина // Арх. патологии. – 1970. – № 3. – С. 57–61.
- Самойленкова, Н. С. Защитный эффект прекондиционирования при фокальной ишемии мозга: роль АТФ-зависимых калиевых каналов : автореф. дис. … канд. биол. наук / Н. С. Самойленкова ; Моск. гос. ун-т. – Москва, 2008. – 25 с.
- Саратиков, А. С. Экспериментальная и клиническая фармакология мозгового кровообращения / А. С. Саратиков, В. В. Белопасов, М. Б. Плотников. – Томск : Изд-во Том. ун-та, 1979. – 248 с.
- Саркисов, Д. С. Микроскопическая техника : руководство для врачей и лаборантов / Д. С. Саркисов, Ю. Л. Перов. – Москва : Медицина, 1996. – 544 с.
- Семенов, С. Е. Ультразвуковые критерии гемодинамической значимости обструкции брахиоцефальных вен / С. Е. Семенов [и др.] // Клинич. физиология кровообращения. – 2009. – № 3. – С. 42–50.
- Семченко В. В. Гистологическая техника / В. В. Семченко, С. А. Барашкова, В. Н. Артемьев. – Омск : Омская мед. акад., 2003. –152 с.
- Современные принципы хирургического лечения менингиом околоселлярной локализации / А.Н. Коновалов [и др.] // Современные проблемы. – Ленинград, 1977. – С. 5–6.
- Сосудистые нарушения в раннем послеоперационном периоде у больных интракраниальными менингиомами / Ю. С. Боровкова [и др.] // Поленовские чтения : всерос. науч.-практ. конф., 11–13 апр. 2005 г. : материалы конф. – Санкт-Петербург, 2005. – С. 272–273.
- Стулин, И. Д. Энцефалопатия пробуждения – синдром преходящей венозной дисгемии у флебопатов / И. Д. Стулин [и др. ]. // Клинич. физиология кровообращения. – 2009. – № 3. – С. 33–36.
- Таубер, А. С. Хирургия головного мозга: клинические лекции / А. С. Таубер. – Санкт-Петербург : Паровая скоропечатня И. А. Богельман, 1898. – 440 с.
- Терапия экспериментального инфаркта миокарда у крыс с помощью трансплантации сингенных мезенхимных стволовых клеток / П. В. Кругляков [и др.] // Цитология. – 2004. – Т. 46, № 12. – С. 1043–1054.
- Тиглиев Г.С. О принципах хирургии экстрацеребральных опухолей / Г. С. Тиглиев // Хирургия внутричерепных экстрацеребральных опухолей. – Санкт-Петербург, 1997. – С. 10–22.
- Тиглиев, Г. С. Основные принципы и техническое обеспечение микрохирургических операций / Г. С. Тиглиев // Хирургия внемозговых опухолей. – Ленинград, 1981. – С. 14–17.
- Тиглиев, Г. С. Особенности хирургическго лечения базальных менингиом с супра-субтенториальным распространением / Г. С. Тиглиев, М. Ф. Чернов // Вопр. нейрохирургии. – 1998. – № 1. – С. 3–7.
- Тиглиев, Г. С. Внутричерепные менингиомы / Г. С. Тиглиев, А. Н. Кондратьев, В. Е. Олюшин. – Санкт-Петербург, 2001. – 555 с.
- Тимиргаз, В. В. Результаты хирургического лечения парасагиттальных менингиом : автореф. дис. … канд. мед наук: 14.00.28 / В. В. Тимиргаз. – Москва, 1994. – 20 с.
- Фадеева, Т. Н. Электрофизиологический контроль в хирургии внутричерепных экстрацеребральных опухолей : автореф. дис. … канд. мед. наук: 14.00.28, 14.00.17 / Т. Н. Фадеева. – Санкт-Петербург, 1997. – 22 с.
- Федоров, В. Н. Некоторые механизмы ишемического повреждения головного мозга в острейшем периоде церебрального инсульта и их коррекция нейропротекторами : дис.... канд. мед. наук: 14.01.11 / В. Н. Федоров. – Москва, 2012. – 140 с.
- Хирургическое лечение ишемических инсультов / С. В. Можаев, В. Н. Вавилов, И. Э. Белоусова, А. М. Пономарев // I съезд нейрохирургов Российской Федерации : тез. докл. – Екатеринбург, 1995. – С. 261–262.
- Хирургическое лечение менингиом верхнего сагиттального синуса (тактика и техника операций) / Г. С. Тиглиев [и др.] // Вопр. нейрохирургии. – 1994. – № 3. – С. 19–21.
- Хирургическое лечение менингиом области бугорка турецкого седла / А. Н. Коновалов [и др.] // Опухоли хиазмально-селлярной. – Москва, 1976. – С. 10–17.
- Хирургия внутричерепных экстрацеребральных опухолей : [сб. науч. тр.] / Рос. науч.-исслед. нейрохирург. ин-т им. А. Л. Поленова ; под ред. Г. С. Тиглиева, В.Е Олюшина. – Санкт-Петербург, 1997. – 277 с.
- Хирургия опухолей основания черепа / А. Н. Коновалов [и др.] ; под ред. А. Н. Коновалова; Ин-т нейрохирургии им. Н. Н. Бурденко Рос. акад. мед. наук. – Москва : НИИ нейрохирургии, 2004. – 371 с.
- Хирургия основания черепа / А. Н. Коновалов [и др.] // Вопр. нейрохирургии. – 1998. – № 4. – С. 3–9.
- Холоденко, М. И. Расстройства венозного кровообращения в мозгу / М. И. Холоденко. – Москва : Медгиз, 1963. – 228 с.
- Чернов, С. В. Микрохирургия парасагиттальных менингиом головного мозга с использованием хирургического лазера : дис. … канд. мед. наук: 14.00.28 / С. В. Чернов. – Новосибирск, 2008. – 161 с.
- Шахнович, А. Р. Неинвазивная оценка венозного кровообращения мозга, ликвородинамики и краниовертебральных объемных соотношений при гидроцефалии / А. Р. Шахнович, В. А. Шахнович // Клинич. физиология кровообращения. – 2009. – № 3. – С. 5–15.
- Шебзухова, Л. М. Начальные неврологические признаки и их динамика в течении менингиом верхнего сагиттального синуса / Л. М. Шебзухова, В. П.Берснев, Л. Н. Маслова // Практ. неврология и нейрореабилитация. – 2007. – № 1. – С. 34–38.
- Шефер, Д. Г. Вопросы клиники и патогенеза тромбоза позвоночных и основной артерии / Д. Г. Шефер, З. С. Манелис, Н. А. Чуприянова // Журн. невропатологии и психиатрии. – 1962. – Т. 62, № 11. – С. 1647–1654.
- Шмидт, Е. В. Новое в понимании механизма нарушений мозгового кровообращения / Е. В. Шмидт // Клинич. медицина. – 1960. – № 6. – С. 12–18.
- Шмидт, Е. В. Актуальные вопросы в области сосудистой патологии мозга // Вестн. Акад. мед. наук СССР. – 1970. – № 5. – С. 5–11.
- Экспериментальный геморрагический инсульт: исследование нейропептидов (МИФ, селанк) при внутрибрюшинном введении / В. И. Скворцова [и др.] // Журн. неврологии и психиатрии. – 2009. – Т. 109, № 12, вып. 2 : Инсульт. – С. 62– 66.
- Ярыгин, К. Н. Нейрогенез в центральной нервной системе и перспективы регенеративной неврологии / К. Н. Ярыгин, В. Н. Ярыгин // Журн. неврологии и психиатрии. – 2012. – № 1. – С. 4–13.
- A new animal model of cerebral venous infarction: ligation of the posterior part of the superior sagittal sinus in the cat / B. Schaller [et al.] // Swiss Med. Wkly. – 2003. – Vol. 133. – № 29/30. – P. 412–418.
- A new model of reversible sinus sagittalis superior thrombosis in the rat: magnetic resonance imaging changes / C. Rttger [et al.] // Neurosurgery. – 2005. – Vol. 57, № 3. – P. 573–580.
- A new model of reversible superior sagittal sinus thrombosis in rats / J. Wang [et al.] // Brain Research. – Vol. 1181. – P. 118–124.
- Adipose-derived mesenchymal stem cells markedly attenuate brain infarct size and improve neurological function in rats / S. Leu [et al.] // J. Transl. Med. – 2010. – Vol. 8. – Art. 63. – P. 1–16.
- Administration of CD34+ cells after stroke enhances neurogenesis via angiogenesis in a mouse model / A. Taguchi [et al.] // J. Clin. Invest. – 2004. – Vol. 114, № 3. – P. 330–338.
- Adrenomedullin enhances therapeutic potency of mesenchymal stem cells after experimental stroke in rats / K. Hanabusa [et al.] // Stroke. – 2005. – Vol. 36, № 4. – P. 853–858.
- Adult bone marrow stromal cells in the embryonic brain: engraftment, migration, differentiation, and long-term survival / G. Muoz-Elias [et al.] // J. Neurosci. – 2004. – Vol. 24, № 19. – P. 4585–4595.
- Adult rat and human bone marrow stromal cells differentiate into neurons / D. Woodbury [et al.] // J. Neurosci. Res. – 2000. – Vol. 61, № 4. – P. 364–370.
- Al-Mefty’s Meningiomas / ed. by F. DeMonte, M. W. McDermott, O. Al-Mefty. – 2nd ed. – New York : Thieme Medical, 2011. – 432 p.
- An anti-inflammatory effect of murine fetal liver cells in BALB/c mouse contact hypersensitivity model / G. Biziuleviciene [et al.] // Int. Immunopharmacol. – 2007. – Vol. 7, № 6. – P. 744–749.
- Anderson, D. J. Can stem cells cross lineage boundaries? / D. J. Anderson, F. H. Gage, I. L. Weissman // Nat. Med. – 2001. – Vol. 7, № 4. – P. 393–395.
- Anti-inflammatory effects of human cord blood cells in a rat model of stroke / M. Vendrame [et al.] // Stem Cells Dev. – 2005. – Vol. 14, № 5. – P. 595 – 604.
- Aqueductal cerebrospinal fluid pulsatility in healthy individuals is affected by impaired cerebral venous outflow / C. B. Beggs [et al.] // J. Magn. Reson. Imaging. – 2013, Nov. 8. – Doi: 10.1002/jmri.24468.
- Baker, A. B. Cerebrovascular disease. Etiologic factors in cerebral infarction / A. B. Baker, E. Dahl, B. Sandler // Neurology. – 1963. – Vol. 13, № 6. – P. 445–454.
- Baraniak, P.R. Stem cell paracrine actions and tissue regeneration / P. R. Baraniak, T. C. McDevitt // Regen. Med. – 2010. – Vol. 5, № 1. – P. 121–143.
- Bederson, J.B. Resection and replacement of the superior sagittal sinus for treatment of a parasagittal meningioma: Technical case report / J.B. Bederson, M.B. Eisenberg // Neurosurgery. – 1995. – Vol. 37, № 5. – P. 1015–1018.
- Bieback, K. Translating research into clinical scale manufacturing of mesenchymal stromal cells [Electronic resource] / K. Bieback, S. Kinzebach, M. Karagianni // Stem Cells Intern. – 2010. – Vol. 2010. – Art. ID 193519. – P. 1–11. – Mode of access: http://dx.doi.org/10.4061/2010/193519.
- Black, P. Meningiomas / P. Black // Neuro-oncology: the essentials / ed. by M. Bernstein, M. S. Berger. – New. York.: Thieme Med. Publ., 2000. – P. 384–389.
- Black, P. M. Parasagittal and falx meningiomas // Meningiomas: a comprehensive text / eds: M. N. Pamir, P. M. Black, R. Fahlbusch. Philadelphia : Saunders Elsevier, 2010. – P. 349–355.
- Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets / V. Sordi [et al.] // Blood. – 2005. – Vol. 106, № 2. – P. 419–427.
- Bone marrow stromal cells upregulate expression of bone morphogenetic proteins 2 and 4, gap junction protein connexin-43 and synaptophysin after stroke in rats / C. Zhang [et al.] // Neuroscience. – 2006. –Vol. 141, № 2. – P. 687–695.
- Bonnal, J. Surgery of the superior sagittal sinus in parasagittal meningiomas / J. Bonnal, J. Brotchi // J. Neurosurg. – 1978. – Vol. 48, № 6. – P. 935–945.
- Boudin, G. Le ramollisement cerebral hemorragiqual'originearterielle / G. Boudin, Y. Barbizet, Cl. Labram // Presse Med. – 1962. – Vol. 70. – P. 1253–1256.
- Brotchi, J. Meningiomas invading the superior sagittal sinus: surgical experience in 108 cases (comment) / J. Brotchi // Neurosurgery. – 2004. – Vol. 55, № 6. – P. 1273.
- Cech, D. A. Giant intracranial and extracranial meningioma: case report and review of the literature / D. A. Cech, M. E. Leavens, D. L. Larson // Neurosurgery. – 1982. – Vol. 11, № 5. – P. 694–697.
- Cerebral venous sinus thrombosis: developing an experimental model / A. K. Srivastava [et al.] // J. Neurosci. Methods. – 2007. – Vol. 161, № 2. – P. 220–222.
- Chan, R.C. Morbidity, mortality and quality of life following surgery for intracranial meningiomas: a retrospective study in 257 cases / R. C. Chan, G. B. Thompson // J. Neurosurg. –1984. – Vol. 60, № 1. – P. 52–60.
- Changes in host blood factors and brain glia accompanying the functional recovery after systemic administration of bone marrow stem cells in ischemic stroke rats / M. Yang [et al.] // Cell Transplant. – 2010. – Vol. 19, № 9. – P. 1073–1084.
- Cord blood rescues stroke–induced changes in splenocyte phenotype and function / M. Vendrame [et al.] // Exp. Neurol. – 2006. – Vol. 199, № 1. – P. 191–200.
- Corday, E. Cerebral vascular insufficiency; an explanation of some types of localized cerebral encephalopathy / E. Corday, S.F. Rothenberg, T.J. Putman // AMA Arch. Neurol. Psychiatry. – 1953. – Vol. 69, № 5. P. 551–570.
- Cushing, H. The meningiomas (dural endotheliomas): their source, and favored seats of origin / H. Cushing // Brain. – 1922. – Vol. 45, № 2. – P. 282–316.
- Davson, H. A note on the distribution of sodium between plasma and aqueous humor, with special reference to the monkey / H. Davson., C. P. Luck // Am. J. Ophthalmol. – 1956. – Vol. 41, № 5. – P. 809–812.
- Denny-Brown, D. The treatment of recurrent cerebrovascular symptoms and the question of «vasospasm» / D. Denny-Brown // Med. Clin. North. Am. – 1951. – Vol. 35, № 5. – P. 1457–1474.
- Die Fortentwicklung der Neurorehabilitation auf verhaltensneurowissenschaftlicher Grundlage / T. Elbert [et al.] // Der Nervenarzt. – 2003. – Vol. 74, № 4. – P. 334–342.
- Differentiation of transplanted bone marrow cells in the adult mouse brain / K. Nakano, M. Migita, H. Mochizuki, T. Shimada // Transplantation. – 2001. – Vol. 71, № 12. – P. 1735–1740.
- Disturbance in venous outflow from the cerebral circulation intensifies the release of blood-Brain barrier injury biomarkers in patients undergoing cardiac surgery / E. Kotlinska-Hasiec [et al.] // J. Cardiothorac. Vasc. Anesth. – 2013. – Doi:pii: S1053–0770(13)00283–8. 10.1053/j.jvca.2013.05.008.
- Doepp, F. Incompetence of internal jugular valve in patients with primary exertional headache: a risk factor? / F. Doepp, J. M. Valdueza, S. J. Schreiber // Cephalalgia. – 2008. – Vol. 28, № 2. – P. 182–185.
- Doeppner, T. R. Mesenchymal stem cells in the treatment of ischemic stroke: progress and possibilities / T. R. Doeppner, D. M. Hermann // Stem Cells a. Cloning: Advances a. Applications. – 2010. – Vol. 3. – P. 157–163.
- Donaghy, R. M. P. Surgical management of lesions of the dural venous sinuses / R. M. P. Donaghy // Operative neurosurgical techniques. Indications, methods and results. – 2nd еd. – Orlando, 1988. – P. 863–874.
- Down-regulation of neurocan expression in reactive astrocytes promotes asxonal regeneration and facilitates the neurorestorative effects of bone marrow stromal cells in the ischemic rat brain / L. H. Shen [et al.] // Glia. – 2008. – Vol. 56, № 16. – P. 1747–1754.
- Eecken, H. M. The anatomy and functional significance of the meningeal arterial anastomoses of the human brain / H.M. Eecken, R. D. Adams // J. Neuropathol. Exp. Neurol. – 1953. – Vol. 12, № 2. – P. 132–157.
- Effect of mesenchymal stem cell transplantation on cognitive functions in rats with ischemic stroke / I. B. Sokolova [et al.] // Bull. Exp. Biol. Med. – 2006. – Vol. 142, № 4. – P. 511–514.
- Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy / A. T. Askari [et al.] // Lancet. – 2003. – Vol. 362, № 9385. – P. 697–703.
- Effects of injecting urokinase via carotid artery in treatment of cerebral venous sinus thrombosis: an experiment with rabbit models / X. Y. Cao [et al.] // Zhonghua Yi Xue Za Zhi. – 2006. – Vol. 86, № 11. – P. 745–748.
- Eglitis, M. A. Hematopoietic cells differentiate into both microglia and macroglia in the brains of adult mice / M. A. Eglitis, E. Mezey // Proc. Natl. Acad. Sci. USA. – 1997. – Vol. 94, № 8. – P. 4080–4085.
- Encephalo-omental synangiosis in primates following cerebral infarction / E. J. Dev [et al.] // Indian J. Med. Res. – 1984. – Vol. 79. – P. 432–438.
- Epidemiology of intracranial meningioma / E. B. Claus [et al.] // Neurosurgery. – 2005. – Vol. 57, № 6. – P. 1088–1094.
- Establishing a new rat model of central venous sinus thrombosis and analyzing its pathophysiological and apoptotic changes / H. Yang [et al.] // J. Neurosci. Methods. – Vol. 203, № 1. – P. 130–135.
- Evidence for stroke-induced neurogenesis in the human brain / K. Jin [et al.] // Proc. Natl. Acad. Sci. USA. – 2006. – Vol. 103, № 35. – P. 13198–13202.
- Experimental intracerebral hemorrhage: description of a double injection model in rats / W. Deinsberger [et al.] // Neurol. Res. – 1996. – Vol. 18, № 5. – P. 475–477.
- Experimental intracranial transplantation of autogenic omentum majus / M. G. Yaargil [et al.] // J. Neurosurg. – 1974. – Vol. 40, № 2. – P. 213–217.
- Factors affecting operative and excess long–term mortality in 935 patients with intracranial meningioma / M. Kallio, R. Sankila, T. akulinen, J. Jaaskelainen // Neurosurgery. – 1992. – Vol. 31, № 1. – P. 2–12.
- Fazio, C. Red softening of the brain / C. Fazio // J. Neuropath. Exp. Neurol. – 1949. – Vol. 8, № 1. – P. 43– 60.
- Ferguson, R. L. Preserving and restoring cerebral reserve / R. L. Ferguson // Br. J. Neurosurg. – 1997. – Vol. 11, № 5. – P. 463. 135).
- Friedenstein, A. J. Osteogenesis in transplants of bone marrow cells / A. J. Friedenstein, I. I. Piatetzky-Shapiro, K. V. Petrakova // J. Embryol. Exp. Morphol. – 1966. – Vol. 16, № 3. – P. 381–390.
- Gliosis and brain remodeling after treatment of stroke in rats with marrow stromal cells / Y. Li [et al.] // Glia. – 2005. – Vol. 49, № 3. – P. 407–417.
- Goldsmith, H. S. Salvage of end stage ischemic extremities by intact omentum / H. S. Goldsmith // Surgery. – 1980. – Vol. 88, № 5. – P. 732–736.
- Griffiths, M. Innate immunity and protective neuroinflammation: new emphasis on the role of neuroimmune regulatory proteins / M. Griffiths, J. W. Neal, P. Gasque // Int. Rev. Neurobiol. – 2007. – Vol. 82. – P. 29–55.
- Griffiths, M. R. The regulation of the CNS innate immune response is vital for the restoration of tissue homeostasis (repair) after acute brain injury: a brief review [Electronic resource] / M. R. Griffiths, P. Gasque, J. W. Neal // Int. J. Inflam. – 2010. – Vol. 2010. – Art. ID 151097. – P. 1–18. – Mode of access: http://dx.doi.org/10.4061/2010/151097.
- Guo, X. B. Endovascular Treatment of Chronic, Recurrent Headache Secondary to Chronic Cerebral Venous Sinus Thrombosis) / X. B. Guo, L. J. Song, S.Guan // J. Stroke Cerebrovasc. Dis. – 2013. – Doi:pii: S1052–3057(13)00122–5. 10.1016/j.jstrokecerebrovasdis.2013.04.005.
- Handley, T.P. Collet-sicard syndrome from thrombosis of the sigmoid-jugular complex: a case report and review of the literature / T. P. Handley, M. S. Miah, S. Majumdar S. S. Hussain // Int J. Otolaryngol. – 2010. – Vol. 2010. – Art. ID 203587. – P. 1–5.
- Hemmer, R. On the therapy of cerebral circulation disorders / R. Нemmer // Med. Welt. – 1960. – Vol. 10, № 37. – P. 1908–1911.
- Hepatocyte growth factor–mediated attraction of mesenchymal stem cells for apoptotic neuronal and cardiomyocytic cells / S. Vogel [et al.] // Cell. Mol. Life Sci. – 2010. – Vol. 67, № 2. – P. 295–303.
- Herold, S. Studies on cerebral blood flow and oxygen metabolism in patients with established cerebral infarcts undergoing omental transposition / S. Herold, R. S. Frackowiak, G. Neil-Dwyer // Stroke. – 1987. – Vol. 18, № 1. – P. 46–51. 131)
- Hicks, A. Challenges and possibilities of intravascular cell therapy in stroke / A. Hicks, J. Jolkkonen // Acta Neurobiol. Exp. (Wars). – 2009. – Vol. 69, № 1. – P. 1–11.
- Huge meningiomas: a review of 93 cases / M. Tuna [et al.] // Skull Base Surgery. – 1999. – Vol. 9, № 3. – P. 227–238.
- Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors / M. Honczarenko [et al.] // Stem Cells. – 2006. – Vol. 24, № 4. – P. 1030–1041.
- Human marrow stromal cell therapy for stroke in rat: neurotrophins and functional recovery / Y. Li [et al.] // Neurology. – 2002. – Vol. 59, № 4. – P. 514–523.
- Human mesenchymal stem cell transplantation protects against cerebral ischemic injury and upregulates interleukin-10 expression in macacafascicularis / J. Li [et al.] // Brain Research. – 2010. – Vol. 1334. – P. 65–72.
- Human mesenchymal stem sell subpopulations express a variety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis / L. Crigler [et al.] // Experimental Neurology. – 2006. – Vol. 198, № 1. – P. 54–64.
- Human neuroblasts migrate to the olfactory bulb via a lateral ventricular extension / M. A. Curtis [et al.] // Science. – 2007. – Vol. 315, № 5816. – P. 1243–1249.
- Human progenitor cells from bone marrow or adipose tissue produce VEGF, HGF, and IGF-I in response to TNF by a p38 MAPK–dependent mechanism / M. Wang [et al.] // Amer. J. Physiol-Reg. – 2006. – Vol. 291, № 4. – P. R880–R884.
- Immunosuppression by mesenchymal stem cells: mechanisms and clinical applications / S. Ghannam [et al.] // Stem Cell Res. Ther. – 2010. – Vol. 1, № 1. – P. 2–8.
- Impact of anatomical difference of the cerebral venous system on microcirculation in a gerbil superior sagittal sinus occlusion model / K. Ueda [et al.] // Acta Neurochir. (Wien). – 2000. – Vol. 142, № 1. – P. 75–82.
- Increasing tPA activity in astrocytes induced by multipotent mesenchymal stromal cells facilitate neurite outgrowth after stroke in the mouse / H. Xin [et al.] // PloS One. – 2010. – Vol. 5, № 2. – P. e9027.
- Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury / J. F. Ji, B. He, S. Dheen, S. Tay // Stem Cells. – 2004. – Vol. 22, № 3. – P. 415– 427.
- Intraarterial administration of marrow stromal cells in a rat model of traumatic brain injury / D. Lu [et al.] // J. Neurotrauma. – 2001. – Vol. 18, № 8. – P. 813–819.
- Intracarotid transplantation of bone marrow stromal cells increases axon–myelin remodeling after stroke / L. H. Shen [et al.] // Neuroscience. – 2006. – Vol. 137. – P. 393–399.
- Intrastriatal transplantation of bone marrow nonhematopoietic cells improves functional recovery after stroke in adult mice / Y. Li [et al.] // J. Cereb. Blood Flow Metab. – 2000. – Vol. 20, № 9. – P. 1311 – 1319.
- Intravenous administration of human bone marrow stromal cells induces angiogenesis in the ischemic boundary zone after stroke in rats / J. Chen [et al.] // Circ. Res. – 2003. – Vol. 92, № 6. – P. 692–699.
- Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferation after stroke in female rat / J. Chen [et al.] // J. Neurosci. Res. – 2003. – Vol. 73, № 6. – P. 778–786.
- Intravenous versus intrastriatal cord blood administration in a rodent model of stroke / A. E. Willing [et al.] // J. Neurosci. Res. – 2003. – Vol. 73, № 3. – P. 296–307.
- Intravenous versus intrastriatal cord blood administration in a rodent model of stroke / A. E. Willing [et al.] // J. Neurosci. Res. – 2003. – Vol. 73, № 3. – P. 296–307.
- Intravenously administered bone marrow cells migrate to damaged brain tissue and improve neural function in ischemic rats / J. Wu [et al.] // Cell Transplant. – 2008. – Vol. 16, № 10. – P. 993–1005.
- Ionescu, M. Cerebral hemodynamic disorders in patients with chronic decompensated respiratory insufficiency. Physiopathogenetic onsiderations. / M. Ionescu // Rev. Ig. Bacteriol. Virusol. Parazitol. Epidemiol. Pneumoftiziol. – 1978. – Vol. 27, № 4. – P. 247–250.
- Isolation of human mesenchymal stem cells: bone marrow versus umbilical cord blood / K. Mareschi [et al.] // Haematologica. – 2001. – Volo. 86, № 10. – P. 1099–1100.
- Isolation of putative progenitor endothelial cells for angiogenesis / T. Asahara [et al.] // Science. – 1997. – Vol. 275, № 5302. – P. 964 – 967.
- Iwai, Y. Gamma knife radiosurgery for the treatment of cavernous sinus meningiomas / Y. Iwai, K. Yamanaka, T. Ishiguro // Neurosurgery. – 2003. – Vol. 52, № 3. – P. 517–522.
- Jaaskelainen, J. Seemingly complete removal of histologically benign intracranial meningioma: Late recurrence rate and factors predicting recurrence in 657 patients. A multivariate analysis / J. Jaaskelainen // Surg. Neurol. – 1986. – Vol. 26, № 5. – P. 461–469.
- Karp, J. M. Mesenchymal stem cell homing: the devil is in the details / J. M. Karp, G. S. Leng Teo // Cell. Stem Cell. – 2009. – № 4. – P. 206–216.
- Kernie, S.G. Forebrain Neurogenesis after focal ischemic and traumatic brain injury / S.G. Kernie, J.M. Parent // Neurobiology of Disease. – 2010. – Vol. 37, № 2. – P. 267–274.
- Kondziolka, D. Judicious resection and/or radiosurgery for parasagittal meningiomas: Outcomes from a multicenter review / D. Kondziolka, J. C. Flickinger, B. Perez // Neurosurgery. – 1998. – Vol. 43, № 3. – P. 405–413.
- Lee, J.H. Meningiomas. Diagnosis, treatment and outcome / J.H. Lee. – London : Springer, 2008. – 639 p.
- Leu, H. J. Morphological alterations of non-varicose and varicose veins. (A morphological contribution to the discussion on pathogenesis of varicose veins) / H. J. Leu, M. Vogt, H. Pfrunder // Basic Res. Cardiol. – 1979. – Vol. 74, № 4. – P. 435–444.
- Maxwell, R. E. Parasagittal and falx meningioma / R. E. Maxwell, S. N. Chou // Operative neurosurgical techniques: indications, methods, and results. – 2nd ed. – Orlando, 1988. – P. 563–570.
- Meningiomas and their surgical management / ed. H. H. Schmidek. – Philadelphia : Saunders, 1991. – 557 p.
- Meningiomas invading the superior sagittal sinus: Surgical experience in 108 cases / F. DiMeco [et al.] // Neurosurgery. – 2004. – Vol. 55, № 6. – P. 1263–1274.
- Meningiomas: a comprehensive text / ed. by M. N. Pamir, P.M. Black, R. Fahlbusch. – Philadelphia : Saunders ; Elsevier, 2010. – 773 p.
- Merrem, G. Parasagittal meningiomas. Fedor Krause memorial lecture / G. Merrem // Acta Neurochir. (Wien). – 1970. – Bd. 23, № 2. – S. 203–216.
- Mesenchymal stem cells display coordinated rolling and adhesion behavior on endothelial cells / B. Ruster [et al.] // Blood. – 2006. – Vol. 108, № 12. – P. 3938–3944.
- Mesenchymal stem cells promote proliferation of endogenous neural stem cells and survival of newborn cells in a rat stroke model / S. W. Yoo [et al.] // Exp. Mol. Med. – 2008. – Vol. 40, № 4. – P. 387–397.
- Mesenchymal stem cells support migration, extracellular matrix invasion, proliferation, and survival of endothelial cells in vitro / I. A. Potapova [et al.] // Stem Cells. – 2007. – Vol. 25, № 7. – P. 1761–1768.
- Mesenchymal stem cells transplantation could be beneficial for treatment of experimental ischemic stroke in rats / N. Pavlichenko [et al.] // Brain Research. – 2008. – Vol. 1233. – P. 203–213.
- Mesenchymal stem cells: biological properties and clinical applications / I. Garca–Gmez [et al.] // Expert Opin. Biol. Ther. – 2010. – Vol. 10, № 10. – P. 1453–1468.
- Meyer, A. Neuropathological aspects of anoxia / A. Meyer // Proc. R. Soc. Med. – 1956. – Vol. 49, № 9. – P. 619–622.
- Meyer, J. The cerebral collateral circulation. I. Factors influencing collateral blood flow / J. Meyer, D. Denny-Brown // Neurology. – 1957. – Vol. 7, № 7. – P. 447–458.
- Micheau, P. The greater omentum. Its role in reconstructive plastic surgery / P. Micheau //Ann. Chir. Plast. Esthet. – 1995. – Vol. 40, № 2. – P. 192–207.
- Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement / M. Dominici [et al.] // Cytotherapy. – 2006. – Vol. 8, № 4. – P. 315–317.
- Molecular MRI of cerebral venous sinus thrombosis using a new fibrin – specific MR contrast agent / C. P. Stracke [et al.] // Stroke. – Vol. 38, № 5. – P. 1476–1481.
- Moossy, J. Cerebral infarction and intracranial arterial thrombosis. Necropsy studies and clinical implications / J. Moossy // Arch. Neurol. – 1966. – Vol. 14, № 2. – P. 119–123.
- Mller-Bhl U. Jugularvenenthrombose. Portsystem nicht optimal plaziert / U. Mller-Bhl // MMW Fortschr. Med. – 2010. – Bd. 152, № 14. – S. 5.
- Multilineage differentiation activity by cells isolated from umbilical cord blood: expression of bone, fat, and neural markers / H. Goodwin [et al.] // Вiol. Blood Marrow Transplant. – 2001. – Vol. 7, № 11. – P. 581–588.
- Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146. perivascular cells and fibroblasts / D. T. Covas [et al.] // Exp Hematol. – 2008. – Vol. 36. – P. 642–654.
- Multipotential human adipose-derived stromal stem cells exhibit a perivascular phenotype in vitro and in vivo / A. C. Zannettino [et al.] // J Cell Physiol. – 2008. – Vol. 214. – P. 413–421.
- Multipotential mesenchymal stem cells are mobilized into peripheral blood by hypoxia / G. Y. Rochefort [et al.] // Stem Cells. – 2006. – Vol. 24, № 10. – P. 2202–2208.
- Nakase, H. Alterations of regional cerebral blood flow and oxygen saturation in a rat sinus-vein thrombosis model / H. Nakase, A. Heimann, O. Kempski // Stroke. – Vol. 27, № 4. – P. 720–727.
- Neurogenesis in the adult human hippocampus / P. S. Eriksson [et al.] // Nat. Med. – 1998. – Vol. 4, № 11. – P. 1313 – 1317.
- Occlusion of the pig superior sagittal sinus, bridging and cortical veins: multistep evolution of sinus-vein thrombosis / G. Fries [et. al.] // J. Neurosurg. – 1992. – Vol. 77, № 1. – P. 127–133.
- Olivecrona, H. Die parasagittalen meningeome / H. Olivecrona. – Leipzig : Georg Thieme, 1934. – 144 S.
- Omental transposition or transplantation to the brain and superficial temporal artery-middle cerebral-artery anastomosis in preventing experimental cerebral-schemia / G. B. Azzena [et al.] // Acta Neurochirurgica. – 1983. – Vol. 68, № 1/2. – P. 63–83.
- Optimization of a therapeutic protocol for intravenous injection of human mesenchymal stem cells after cerebral ischemia in adult rats / Y. Omori [et al.] // Brain Res. – 2008. – Vol. 1236. – P. 30–38.
- Parr, A. M. Bone marrow-derived mesenchymal stromal cells for the repair of central nervous system injury / A. M. Parr, C. H. Tator, A. Keating // Bone Marrow Transplantation. – 2007. – Vol. 40, № 7. – P. 609–619.
- Parr, A. M. Bone marrow-derived mesenchymal stromal cells for the repair of central nervous system injury / A. M. Parr, C. H. Tator, A. Keating // Bone Marrow Transplantation. – 2007. – Vol. 40, № 7. – P. 609–619.
- Phinney, D. G. Concise review: mesenchymal stem/multipotent stromal cells: the state of transdifferentiation and modes of tissue repair-current views / D. G. Phinney, D.J. Prockop // Stem Cells. – 2007. – Vol. 25, № 11. – P. 2896–2902.
- Potential roles of bone marrow stem cells in stroke therapy / R. Mendez-Otero [et al.] // Regen. Med. – 2007. – Vol. 2, № 4. – P. 417–423.
- Progenitor cells as remote “bioreactors”: neuroprotection via modulation of the systemic inflammatory response / P. A. Walker [et al.] // World J. Stem Cells. – 2011. – Vol. 3, № 2. – P. 9–18.
- Prognosis of cerebral vein and dural sinus thrombosis: results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT) / J. M. Ferro [et al.] // Stroke. – 2004. – Vol. 35, № 3. – P. 664–670.
- Radiological and histological changes following cerebral venous sinus thrombosis in a rat model / A. K. Srivastava [et al.] // Neurosci. Res. – 2009. – Vol. 65, № 4. – P. 343–346.
- Reconstitution of marrow-derived extracellular matrix ex vivo: a robust culture system for expanding large-scale highly functional human mesenchymal stem cells / Y. Lai [et al.] // Stem Cells Dev. – 2010. – Vol. 19, № 7. – P. 1095–1107.
- Relationship between Trendelenburg tilt and internal jugular vein diameter / S. Clenaghan [et al.]. // Emerg. Med. J. – 2005. – Vol. 22, № 12. – P. 867– 868.
- Reorganization of motor cortex after controlled cortical impact in rats and implications for functional recovery / M. Nishibe [et al.] // J. of Neurotrauma. – 2010. – Vol. 27, № 12. – P. 2221–2232.
- Sakatani, K. Somatosensory evoked potentials in rat cerebral cjrtex before and after middle cerebral artery occlusion /K. Sakatani, H. Iizuka, W. Young. // Stroke – 1990. – Vol. 21 – P. 124–132.
- Schinkthe, T. In vitro secreting profile of human mesenchymal stem cells / T. Schinkthe, W. Bloch, A. Schmidt // Stem Cells Dev. – 2008. – Vol. 17, № 1. – P. 199–206.
- Shimada, Y. Experimental study on effects of omental transposition in cats with spinal cord injury / Y. Shimada // No To Shinkei. – 1995. – Vol. 47, № 9. – P. 863–873.
- Sindou, M.P. Resection and replacement of the superior sagittal sinus for treatment of a parasagittal meningioma : technical case report (comment) / M. P. Sindou // Neurosurgery. – 1995. – Vol. 37, № 5. – P. 1019.
- Standing up to the challenge of standing: a siphon does not support cerebral blood flow in humans / E. A. Dawson [et al.] // Am. J. Physiol. Regul. Integr. Comp. Physiol. – 2004. – Vol. 287, № 4. – P. R911–914.
- Stem Cell Therapies as an Emerging Paradigm in Stroke (STEPS): bridging basic and clinical science for cellular and neurogenic factor therapy in treating stroke // Stroke. – 2009. – Vol. 40, № 2. – P. 510–515.
- Stippler, M. Skull base meningiomas: is there a place for microsurgery? / M. Stippler, D. Kondziolka // Acta Neurochirurgica. – 2006. – Vol. 148, № 1. – P. 1–3.
- Tate, C. C. Mesenchymal Stromal Cells to Treat Brain Injury [Electronic resource] / C. C. Tate, C. С. Case // Advanced Topics in Neurological Disorders. – 2012. – Chap. 3. – Mode of access: http://cdn.intechopen.com/pdfs/32478/InTech-Mesenchymal_stromal_cells_to_treat_brain_injury.pdf.
- The neuroprotective action of dizocilpine (MK-801) in the rat middle cerebral artery occlusion model of focal ischaemia / R. Gill [et al.] // Br. J. Pharmacol. – 1991. – № 103. – P. 2030–2036.
- Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke / L. H. Shen [et al.] // J. Cereb. Blood Flow Metab. – 2007. – Vol. 27, № 1. – P. 6–13.
- Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats // J. L. Chen [et al.] // J. Neurol. Sci. – 2001. – Vol. 189, № 1/2. – P. 49–57.
- Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats / J. Chen [et al.] // Stroke. – 2001. – Vol. 32, № 4. – P. 1005–1011.
- Therapeutic effect of mesenchymal stem cells in rats with intracerebral hemorrhage: reduced apoptosis and enhanced neuroprotection / S. P. Wang [et al.] // Molecular Medicine Reports. – 2012. – Vol. 6, № 4. – P. 848–854.
- Timing of cord blood treatment after experimental stroke determines therapeutic efficacy / J. D. Newcomb [et al.] // Cell Transplant. – 2006. – Vol. 15, № 3. – P. 213–223.
- Towbin, A. The syndrome of latent cerebral venous thrombosis: its frequency and relation to age and congestive heart failure / A. Towbin // Stroke. – 1973. – Vol. 4, № 3. – P. 419–430.
- Transplantation of Flk-1+ human bone marrow-derived mesenchymal stem cells promotes behavioral recovery and anti-inflammatory and angiogenesis effects in an intracerebral hemorrhage rat model / X. J. Bao [et al.] // Int. J. Mol. Med. – 2013. – Vol. 31, № 5. – P. 1087–1096.
- Transplantation of human bone marrow-derived mesenchymal stem cells promotes behavioral recovery and endogenous neurogenesis after cerebral ischemia in rats / X. Bao [et al.] // Brain Research. – 2011. – Vol. 1367. – P. 103–113.
- Treatment of stroke in rat with intracarotid administration of marrow stromal cells / Y. Li [et al.] // Neurology. – 2001. – Vol. 56, № 12. – P. 1666–1672.
- Treatment with bone marrow mononuclear cells induces functional recovery and decreases neurodegeneration after sensorimotor cortical ischemia in rats / A. Giraidi-Guimaraes [et al.] // Brain Research. – 2009. –Vol. 1266. – P. 108–120.
- Ultrasonic echo pulsations in range. A study of rise times and delay times / C. O. Jenkins [et al.] // Acta Neurochir. (Wien). – 1971. – Vol. 24, № 1. – P. 1–10.
- Wu, A. V. Fibrinolytic response of vein wall after venous grafting /A. V. Wu, A. O. Mansfield, J. A Mannick // Surg. Forum. – 1979. – Vol. 30. – P. 202–204.
- Xiong Y. Angiogenesis, neurogenesis and brain recovery of function following injury / Y. Xiong, A. Mahmood, M. Chopp // Curr. Opin. Investig. Drugs. – 2010. – Vol. 11, № 3. – P. 298–308.
- Yasargil, M. G. Microsurgery applied to neurosurgery. – Stuttgart : Georg Thieme ; New York : Acad. Press, 1969. – 230 p.
- Yonekawa, Y. Experimental intracranial transplantation of the omentum majus in dogs. A tentative new treatment for hydrocephalus and cerebral ischemia / Y. Yonekawa // Nihon Geka Hokan. – 1978. – Vol. 47. – P. 3–17.
- Zulch, K.-J. Neuropathology of cerebral infarction / K.-J. Zulch, P. Kleihues // Stroke : Thule International Symposia. – Stockholm : Nordiska Bokhandelns, 1967. – P. 57–75.

